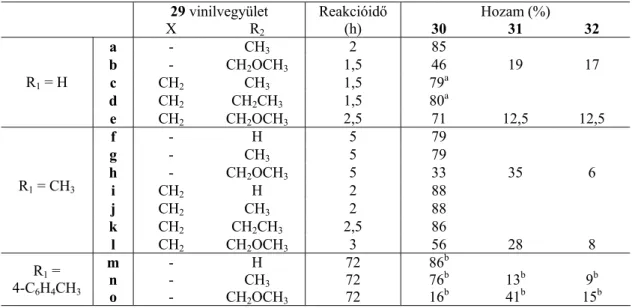
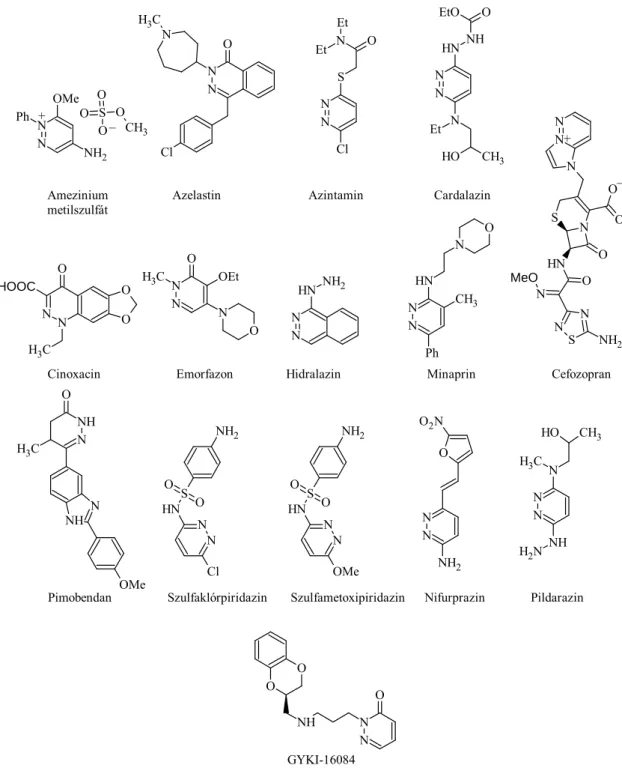
Részt vettem új gyűrűrendszerek létrehozásában a 2. típusú terc-amino-effektus felhasználásával (orto-vinil-terc-anilinek és rokon rendszerek termikus izomerizációja), valamint a reakció kinetikájának vizsgálatában. Az ilyen rendszerek előállításának egyik leghatékonyabb szintetikus módja a 2-es típusú terc-amino-hatás. Vizsgáltuk az izomerizációs reakció mechanizmusát is: a -4, -5 és -6 pozícióban lévő szubsztituensek hatásait; aciklusos vagy ciklusos elektronszívó csoportok a vinilcsoportoknál; amino-szubsztituenseket tanulmányozták.
A piridazingyűrű 6-os helyzetében lévő arilcsoport növeli a gyűrűzárási reakció sebességét. Bemutatom továbbá a terc-amino hatás alkalmazását különböző policiklusos gyűrűrendszerek kialakítására, a gyűrűzáródás kinetikáját vizsgáló irodalmi eredményekre fókuszálva. Míg az N-alkil- vagy N-fenil-származékok előállítása egy lépésben megvalósítható közvetlen gyűrűszintézissel, lehetőség van a piridazinongyűrű 2-es helyzetében lévő nitrogénatom utólagos alkilezésére is (1.2. reakcióvázlat). A reakciók régóta ismertek, és jól kidolgozott módszerek állnak rendelkezésre megfelelő vegyületek előállítására.
A terc-amino effektus
A két elektronszívó csoport nélkülözhetetlen jelenlétét igazolta, hogy a csak egy észtercsoportot tartalmazó (22) származék ciklizálása egyáltalán nem valósítható meg (1.8. reakcióvázlat). Két cianocsoportot tartalmazó pirrolo- és pirido[1,2-a]kinolinok analógjait is előállították, amelyekben cianocsoport helyett hetaril- vagy arilszulfonilcsoport van jelen (1.12. reakcióvázlat).23. A piridazinszármazékok további vizsgálata során intézetünkben felismerték, hogy a reakció spirociklusos vegyületek előállítására is alkalmas (1.14. reakcióvázlat).26.
Ugyancsak intézetünkben írták le először a terc-amino-hatást olyan vegyületek között, ahol a tercier nitrogénatomot tartalmazó gyűrű a vinilcsoportot hordozó gyűrűhöz kapcsolódik (1.15. reakcióvázlat). Ez utóbbi reakció szintetikus jelentőségét az is adja, hogy az 1,3-dioxángyűrű savas hasításával β-aminosav-származékok (68) állíthatók elő (1.15. reakcióvázlat). A piridazin gyűrű helyettesítése pirimidin gyűrűvel további új spirociklusokhoz vezetett (1.16. ábra).26a. i): 1,3-dimetil-barbitursav vagy Meldrum-sav, toluol, piperidin, AcOH, 25 oC;.
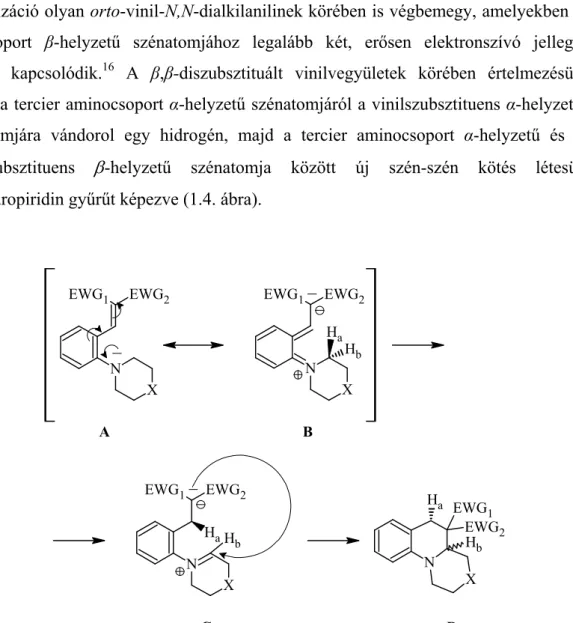
Piridazino[4,5-b]indol és benzo[b]furo[2,3-d]piridazin gyűrűrendszerek
Korábban a legelterjedtebb szintézismódszer során a 2- és 3-helyzetben megfelelően funkcionalizált indol- és benzo[b]furán-származékokból (87,89) kiindulva a 88-at a piridazingyűrű ezt követő kondenzációs reakcióban történő megépítésével állítottuk elő. hidrazinnal vagy a hidrazin szubsztituált származékaival.és 90 triciklus (1.18. reakciódiagram).37.
EREDMÉNYEK
A terc-amino effektus 2. típusának alkalmazása
A 60a ciklikus malonsav származékot aktív metilén komponensként használva szobahőmérsékleten csak a dimetilamino- és pirrolidinocsoportot tartalmazó 111a-d vinilvegyületeket tudtuk izolálni. Saját korábbi eredményeinkkel összhangban (1.2.2. fejezet) azt találtuk, hogy a gyűrűben a vinilcsoport terminális szénatomját tartalmazó 111-es származékok ciklizálása enyhébb körülmények között és gyorsabban megy végbe, mint a két cianocsoportot tartalmazó 109-es származékoké. . Ezenkívül a morfolino- és piperidinocsoportokat tartalmazó 108d és 108e aldehidek reakciója 1,3-dimetil-barbitursavval a kondenzációs reakció enyhe körülményei ellenére közvetlenül a spirociklusos piridazino[4,5-c]kinolizin 114a és 114b piridazinosavhoz vezet. rövid idő alatt [4', 5':5,6]pirido[2,1-c][1,4]oxazin gyűrűrendszert eredményezett (2.5. ábra).
119 A vinilvegyületeket és a zárt gyűrűs terméket egyaránt tartalmazó keverékeket a vinilvegyületek izolálása nélkül etanolban forraltuk a reakció teljessé tétele érdekében (2.6. és 2.7. reakcióvázlat). A piridazino[4,5-c]-5-azaantracén 120 gyűrűrendszer jelenléte kizárható, mivel a gyűrűrendszer 11b anulált hidrogénatomja szingulett jelet ad az 1H NMR spektrumban. Az eddigi tapasztalatokkal összhangban a gyűrűs vinil-szubsztituenst tartalmazó 124 vegyület ciklizálása könnyebben megvalósítható, bár a 125 triciklusos vegyület előállítása erősebb körülményeket (155 oC, N,N-dimetil-formamid) és hosszabb reakcióidőt igényel a fenilhez képest. 111a származék (2.9 reakcióséma).
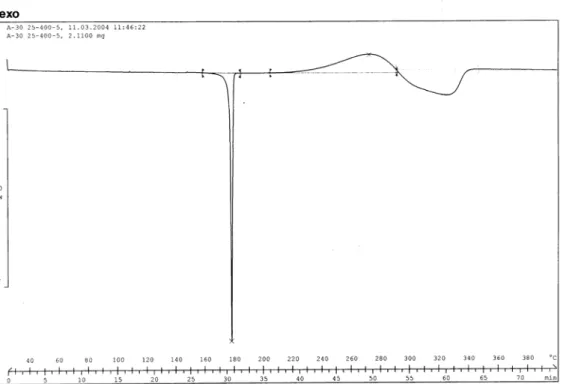
Sem a 122-es vegyületet N,N-dimetil-formamidban néhány napig (72 órán át) forraltuk, sem pedig xilollal készített oldatban alumínium-klorid jelenlétében visszafolyató hűtő alatt forraltuk. DSC mérésekkel (differenciális pásztázó kalorimetria) korábban hasznos tapasztalatokat szereztünk a terc-amino-effektussal lejátszódó termikus gyűrűzárási reakciók megvalósíthatóságáról.30 A 122-es vegyület DSC-tesztjét is elvégeztük. Közvetlenül az exoterm csúcs után széles endoterm jel jelenik meg, ami a vegyület bomlását jelzi (292 és 340 oC között).
Az olvadékban történő melegítést vékonyréteg-kromatográfia és 1H-NMR-spektroszkópia követte, amelyek az anyag bomlását jelezték. A 122. vegyület szilárd fázisú mikrohullámú besugárzása (200 oC, 30 perc, alumínium-oxidon bepárolva) ugyanerre az eredményre vezetett (2.9. reakcióvázlat). Az aciklikusan aktív metilénreagenssel előállított orto-vinil-N,N-dialkilanilinek közül Reinhoudt és munkatársai részletesen tanulmányozták a terc-amino-hatással járó gyűrűzárási reakciókat (1.2.1. fejezet).
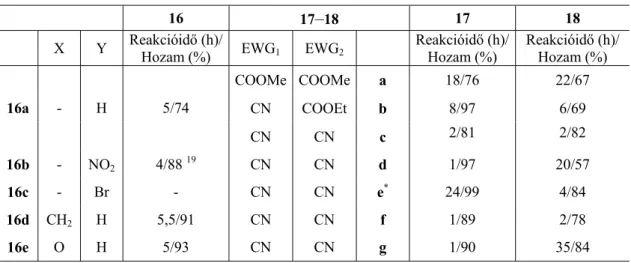
A 2-pirrolidinobenzaldehidet (16a) 1,3-dimetil-barbitursavval az általunk alkalmazott reakciókörülmények között (etanol, 25 oC) reagáltatva azt találtuk, hogy a reakció azonnal lezajlik, és elérkeztünk a 79a gyűrűzárt vegyülethez (reakcióvázlat) 2.11 ).

A gyűrűzárás kinetikájának vizsgálata
A különböző hőmérsékleteken (313K,323K,333K,343K,353K) meghatározott reakciósebesség-együtthatókat és a hőmérsékletek hányadosának logaritmusát a hőmérsékletek reciprokának függvényében ábrázoltuk, a termikus gyűrűzáródás aktiválási paramétereit pedig. az Eyring-egyenlet alapján kapott egyenesre vonatkozó egyenletből számítva. i) aciklusos és ciklusos vinil-szubsztituens; iv) a benzol- és piridazingyűrűk hatása a reakció kinetikájára. A benzolszármazékok esetében a 127-es malononitril-származék csak jóval magasabb hőmérsékleten (120 oC) zárta a gyűrűt a 129-es dimetil-barbitursav-származékhoz (50 oC) hasonló sebességgel. A 124-es dimetil-barbitursav-származék 100 oC-on néhány óra alatt alakult át a 125-ös gyűrűzárt spirovegyületté, míg az aciklusos dicianovinil-csoportot tartalmazó megfelelője jóval magasabb hőmérsékleten sem zárható le.
A 6-fenil-piridazinonok esetében a dimetil-barbitursav-származékok izomerizációja is könnyen ment: a piperidin és a morfolin származékok már szobahőmérsékleten, míg a 111d pirrolidin származék átalakulása magasabb hőmérsékleten ment végbe. Reinhoudt kutatócsoportja aciklusos vinil-szubsztituenst tartalmazó benzolszármazékok gyűrűzárási reakciójának vizsgálatakor korábban azt találta, hogy a pirrolidingyűrű piperidinre cserélése csökkenti a reakció sebességét. Így az átmeneti állapot kevésbé lesz stabil, mivel a nitrogénen képződött pozitív töltés kevésbé tud delokalizálódni.
A morfolingyűrűben lévő elektronszívó oxigénatom pedig még tovább csökkenti a delokalizációt, megnövelve az átmeneti állapot energiáját a piperidinhez képest, így a morfolinszármazék gyűrűzáródása a gyűrűs aminocsoportokat hordozó származékok közül a legkisebb sebességgel történik. Az aciklusos dimetil-amino-csoport esetében a szén-nitrogén kötés körüli szabadabb forgás miatt a nitrogén magányos elektronpárja és az aromás gyűrű π-elektron rendszere közötti kölcsönhatás még kevésbé hatékony. A pirrolidingyűrű hatását a hattagú gyűrűkkel összehasonlítva azt találtuk, hogy malononitril-származékok esetében a pirrolidingyűrűt tartalmazó 109f vegyület hasonló sebességgel ciklizál, mint a 109e morfolinszármazék, ahogyan a származékok esetében is történt. 6-os helyzetben hidrogént tartalmaz.
Bár a dimetil-amino-csoportot tartalmazó 111a vegyület lassabban zárja be a gyűrűt, mint a 111d pirrolidin-származék azonos hőmérsékleten, a két vegyület ciklizációs aktivációs entalpiája közel azonos, és a különbség abból adódik, hogy a 111a reakcióentrópia tag. inkább negatív. Az átmeneti állapot Gibbs-állapotfüggvénye szerint (ΔG# = ΔH# - TΔS#) a 111a vegyület gyűrűzárásának aktivációmentes entalpiája 80 oC-on: ΔG# = 26,1 kcal/mol, míg a 111d esetében ΔG# = 24,7 kcal/mol. A 111a és 124 vegyület 100 oC-on mért reakciósebességi együtthatói között 430-szoros különbség van (a fenilcsoporttal szubsztituált 111a javára), bár a két molekula csak egy szubsztituensben, a 6-os fenilcsoportban tér el egymástól.
A deuterált kloroformban felvett 1H-NMR-spektrumban két széles szingulett azonosítható vinil-hidrogén szignálként, míg a többi csoport szingulettjei kiszélesedtek.

Deuterált terc-amino származékok gyűrűzárása
Erre a következtetésre jutottunk a 111a (dimetil-pirimidindiil)vinil-származék deuterált vízben, mikrohullámú sütőben 100 oC-on 10 percen keresztül történő reakciójából is, amint azt a 112a gyűrűzárt termék szerkezetéből megállapítottuk, 1H NMR ill. tömegspektrometriás vizsgálatok azt mutatták, hogy a reakció során nem történt deuteráció az oldószer regisztrációjából. A 109c deuterált dinitril-származék n-butanolban történő forralása során még több napos forralás után sem történt átalakulás. Az, hogy [1,5]-szigmatróp átrendeződésről vagy hidridanion migrációról van-e szó, amelyen keresztül az ikerionos átmeneti állapot kialakul, nem lehet egyértelműen meghatározni.

A termikus átrendeződési reakció optimalizálása
Az eredmények megerősítik, hogy az olvadékban végzett mikrohullámú besugárzás és oldószermentes eljárások a terc-amino-közvetített gyűrűzárási reakciók szempontjából kedvezőbbek az oldószeres reakciókhoz képest. Szinte minden esetben a reakcióidő csökkenése és a hozamok jelentős javulását sikerült elérni az oldószerben végrehajtott reakciókhoz képest.48.

Piridazino[4,5-b]indol és benzo[b]furo[2,3-d]piridazin gyűrűrendszerek előállítása
Így orto-jód- vagy orto-brómfenollal végzett nukleofil szubsztitúciós reakcióban a 135 (orto-halofenoxi)piridazinon-származékok mérsékelt hozammal állíthatók elő (2.15. reakcióvázlat). A 135a és 135b (2-halofenoxi)piridazinon-származék szén-halogén kötése várhatóan reaktív lesz a Heck-reakcióban.49,50 Valójában a kívánt reakció mindkét esetben elfogadható hozammal megy végbe (2.16. reakcióvázlat). Feltételezhető, hogy a katalitikus ciklus első lépése, az aril-halogenid és a palládium közötti oxidatív addíció még ebben az esetben is gyorsabb a szén-jód kötést tartalmazó vegyületeknél, mint a szén-bróm kötést tartalmazó vegyületeknél. .
A 135b 2-bróm-fenoxi-származékból kiinduló gyűrűzárás 49%-os hozamát összehasonlítva a már említett 6-helyzetű fenilcsoport nélküli származék (R = H, X = Br) 99%. Előkísérleteink során azonban azt találtuk, hogy a 6-fenil-5-klór-2-metilpiridazin-3(2H)-on (2) nem lép reakcióba orto-bróm-anilinnal (137) a klasszikus nukleofil szubsztitúciós reakciók körülményei között. Ezért a Buchwald és Hartwig által kifejlesztett hatékonyabb katalitikus aminálási reakciót51 alkalmaztuk (2.17 reakcióséma), amellyel könnyen megvalósítható szén-nitrogén kötés kialakulása primer arilaminok, például anilinszármazékok és aromás klórvegyületek között.
Annak ellenére, hogy az aril-bromidoknak a Pd(BINAP) katalizátorhoz való oxidatív addíciós hajlandósága jóval nagyobb, mint az aril-kloridoké, nem tapasztaltunk olyan vegyület képződését, amely 2-bróm-anilin homokapcsolásával képződik a katalizátor mellett vagy helyett. a várt aminopiridazin. Ez azt bizonyítja, hogy a 2-klór-piridazinon szén-klór kötése reaktívabb, mint a 2-bróm-anilin szén-bróm kötése, ami nem is olyan meglepő, mivel a piridazinongyűrű 5-helyzetű C-Cl kötése egy nagyon reaktív elektron része. -hiányos hetaril-klorid rendszer. . A Buchwald-Hartwig reakció körülményei között az aktív szén-hidrogén kötést tartalmazó 3(2H)-piridazinon gyűrűn az intramolekuláris Heck-reakció is lezajlott (2.17. reakcióséma).8.
![2.3. ábra. A benzo[b]furo[2,3-d]piridazin vázhoz vezető, Heck-típusú reakciót alkalmazó szintézis retroszintetikus analízise](https://thumb-eu.123doks.com/thumbv2/9dokorg/19321116.0/66.892.146.746.565.681/piridazin-vázhoz-típusú-reakciót-alkalmazó-szintézis-retroszintetikus-analízise.webp)
KÍSÉRLETI RÉSZ
Módszerek
A koncentrációarányok meghatározásához az 58a, 58b, 61a, 61b, 122 és 124 vegyületek esetében a kiindulási vegyület vinilhidrogénjének jelét összehasonlítottuk a termékben előforduló 6-helyzetű hidrogén jelével. a 6. csoport hidrogénjei jele -fenil a 109a–f és 111a–d vegyületekben, aromás hidrogéneket használtak belső standardként a benzolszármazékokhoz (17c, 17g).
A vegyületek előállítása
A reagens hozzáadása után a reakcióelegy hőmérsékletét hagyjuk szobahőmérsékletre melegedni, majd 60 oC belső hőmérsékleten keverjük a kiindulási anyag elfogyásáig (VRK). A nyersterméket oszlopkromatográfiával tisztítottuk, eluálószerként diklór-metán és etil-acetát 1:1 arányú elegyét használtuk (a 126. vegyület esetében az eluens kloroform volt). A kapott reakcióelegyet olajfürdőn 120 oC-on argongáz bevezetése mellett a kiindulási anyag elfogyásáig keverjük (VRK, 27 óra).
Kaval N., Dajka-Halász B., Vo-Thanh G., Dehaen W., Van der Eycken J., Mátyus P., Loupy A., Van der Eycken E.: Efficient solvent-free microwave-assisted synthesis of pyrido -terc-amino-effektus felhasználásával kondenzálja a gyűrűrendszereket. Mátyus P., Éliás O., Tapolcsányi P., Bálint-Polonka Á., Dajka-Halász B.: Ortho-vinyl-terc-anilines and (di)aza-heterocyclic analogues gyűrűzárási reakciói a terc-amino-effektuson keresztül : közelmúltbeli fejlemények. Halászné Dajka B., Földi Á., Mátyus P.: Policiklusos piridazinok szintézise terc-amino-effektus és arilezési reakciók segítségével: a piridazin 6-fenil szubsztituensének szerepe - Kémiai Konferencia, Hajdúszoboszló, 2003.
Dajka-Halász B., Mátyus P.: Undersøgelse af tert.-aminoeffekten: syntese af polycykliske diaziner – XXIII Corso Avanzato i Chimica Farmaceutica e Seminario Nazionale per Dottorandi “E. Dajka-Halász B., Földi Á., Nagy V., Mátyus P.: Struktur - reaktionshastighedsforhold i omlejringsreaktion af ortho-vinyl-tert.-aminopyridazinoner. Éliás O., Halászné Dajka B., Balogh B., Harmat V., Boros S., Gergely A., Gy. Szász, Mátyus P.: Termisk isomeriseringsreaktion af 5-(tert-amino)-4-vinylpyridaziner indeholdende Hídfő nitrogenatom – Kemikonference, Hajdúszoboszló, 2005.
Keglevich Gy., Chuluunbaatar T., Dajka B., Dobó A., Szöllősy Á., Tőke L.: En ny reaktion af 1-(2,4,6-trialkylphenyl)phospholes med heteroatomisk karakter;. Keglevich Gy., Trecska M., Dajka B., Pete B., Dobó A., Tőke L.: Diels-Alder-reaktion af (2,4,6-trialkylphenyl)phospholer med N-phenylmaleimid. Chuluunbaatar T., Keglevich Gy., Dajka B., Szöllősy Á., Dobó A., Tőke L.: En ny reaktion af heteroaromatisk 1-(2,4,6-trialkylphenyl)-phospholes: aromatisk elektrofil substitution a under Friedel– Håndværker acyleringsbetingelser.
Keglevich Gy., Chuluunbaatar T., Dajka B., Ludányi K., Parlagh Gy., Kégl T., Tőke L.: Plaatsselectieve fosforylering van arylfosfolen door reactie met fosfortribromide. Keglevich Gy., Kégl T., Chuluunbaatar T., Dajka B., Mátyus P., Balogh B., Kollár L.: Hydroformylering van styreen in aanwezigheid van rhodium-2,4,6-trialkylfenyl-fosfol in situ katalytische systemen . Halászné Dajka B., Födi Á., Haider N., Barlocco D., Fadda A., Maccioni E., Knippel B., Magyar K., Mátyus P.: SSAO-remmers: enkele aspecten van de toepassing van medicamenteuze therapie; ontwerp van nieuwe werkzame stoffen – Farmacokinetiek en.