Polska Platforma Medyczna
Polish Platform of Medical Research https://ppm.edu.pl
Repozytorium Gdańskiego Uniwersytetu Medycznego Repository of Medical University of Gdańsk
https://ppm.gumed.edu.pl
Rodzaj dyplomu / Diploma type Rozprawa doktorska / PhD thesis
Autor / Author Jaskólska Marta Magdalena
Tytuł / Title
Ocena częstości występowania zajęcia obwodowego układu nerwowego u pacjentów z pierwotnym zespołem Sjögrena oraz jego związku z aktywnością choroby i wpływem na pogorszenie jakości życia / Assessment of the
prevalence of peripheral nervous system involvement in patients with primary Sjögren's syndrome and its relationship with disease activity and its impact on the deterioration of the quality of life
Rok powstania / Year of creation 2021
Promotor / Supervisor Zdrojewski Zbigniew Józef
Jednostka dyplomująca / Certifying unit Gdański Uniwersytet Medyczny / Medical University of Gdańsk Adres publikacji w Repozytorium URL /
Publication address in Repository https://ppm.gumed.edu.pl/info/phd/GUMdf30fd7142ed44dd97d4f7f040f5994a/
Data opublikowania w Repozytorium /
Deposited in Repository on 10 sty 2022
Rodzaj licencji / Type of licence Attribution-NonCommercial-NoDerivatives CC-BY-NC-ND
G D A Ń S K I U N I W E R S Y T E T M E D Y C Z N Y
Marta Jaskólska
Ocena częstości występowania zajęcia obwodowego układu nerwowego
u pacjentów z pierwotnym zespołem Sjögrena oraz jego związku z aktywnością choroby
i wpływem na pogorszenie jakości życia
Rozprawa na stopień doktora nauk medycznych
Katedra i Klinika Chorób Wewnętrznych, Chorób Tkanki Łącznej i Geriatrii Gdański Uniwersytet Medyczny
Promotor
Prof. dr hab. n. med. Zbigniew Zdrojewski
Składam serdeczne podziękowania
Panu Profesorowi Zbigniewowi Zdrojewskiemu, Promotorowi niniejszej pracy, za pomoc merytoryczną, cenne sugestie
i uwagi podczas powstawania poszczególnych publikacji oryginalnych i niniejszej rozprawy.
Rodzicom za wytyczenie celów i motywację.
Mężowi i Synom
za wsparcie na co dzień i umożliwienie ukończenia tej pracy.
Spis treści
I. Wprowadzenie ... 4
II. Cele pracy ... 5
III. Materiał i metody ... 5
IV. Wyniki ... 8
1. Rozpowszechnienie neuropatii obwodowych w pSS ... 9
2. Porównanie danych klinicznych i laboratoryjnych pacjentów z PNS+ i PNS- ... 10
3. Porównanie natężenia bólu, wywiadu i wyników SF-36 między pacjentami z PNS+ i PNS- ... 12
V. Dyskusja ... 13
VI. Wnioski ... 20
Wersja w języku angielskim ... 22
Piśmiennictwo / References ... 40
Spis tabel ... 52
Wykaz skrótów ... 53
I. Wprowadzenie
Zespół Sjögrena (ang. Sjögren’s syndrome, SS) to przewlekła choroba zapalna o podłożu autoimmunologicznym, która występuje głównie u kobiet w średnim wieku. Choroba ta charakteryzuje się obecnością nacieków limfocytarnych w obrębie gruczołów wydzielania zewnętrznego (głównie ślinowych i łzowych), co powoduje suchość oczu i suchość w jamie ustnej. SS może mieć charakter pierwotny (ang. primary Sjögren’s syndrome, pSS) – występuje wówczas jako niezależna choroba – lub wtórny (ang.
secondary Sjögren’s syndrome, sSS) – w przebiegu innych układowych chorób tkanki łącznej. Częstość występowania szacuje się na 0,1–1% populacji. Zajęcie innych narządów jest częste w pSS i odgrywa główną rolę w rokowaniu. W przebiegu SS objawy neurologiczne mogą dotyczyć zarówno obwodowego (ang. peripheral nervous system, PNS), jak i ośrodkowego układu nerwowego (ang. central nervous system, CNS).
Z dotychczasowych badań wynika, że zajęcie CNS może wystąpić u 6–48% chorych z SS, a PNS u 2–60% chorych. Objawy uszkodzenia ośrodkowego układu nerwowego mogą pojawiać się w następstwie ogniskowego lub rozlanego uszkodzenia CNS objawiającego się m.in. napadami padaczkowymi, zaburzeniami psychicznymi lub pogorszeniem funkcji poznawczych. Przebieg choroby oraz nasilenie objawów mogą mieć charakter łagodny i samoograniczający się lub postępujący, co prowadzi do powstania trwałych deficytów neurologicznych. W praktyce przypadki ciężkiego, rozlanego zajęcia CNS są rzadkie, natomiast dość często spotyka się uszkodzenia nerwów obwodowych.
Zidentyfikowano następujące podtypy neuropatii obwodowej w SS: trzy typy neuropatii czuciowych (czuciowa aksonalna, neuropatia drobnych włókien i ataksja czuciowa), aksonalna polineuropatia czuciowo-ruchowa, mononeuropatia, mononeuropatia mnoga, poliradikuloneuropatia demielinizacyjna, neuropatia czaszkowa i neuropatia autonomiczna. Przebieg kliniczny podtypów neuropatii obwodowej jest bardzo zróżnicowany, ale wszystkie z nich mogą prowadzić do znacznego bólu i pogorszenia jakości życia pacjentów z SS.
Etiologia tych zaburzeń jest złożona i nie do końca wyjaśniona. Najbardziej prawdopodobną przyczyną jest zapalenie naczyń występujące w obrębie układu nerwowego, ale możliwy jest również bezpośredni uszkadzający wpływ przeciwciał.
Warto pamiętać, że objawy neurologiczne mogą być pierwszym objawem choroby, ale mogą też pojawić się po pewnym czasie jej trwania. Świadomość szerokiego spektrum objawów neurologicznych towarzyszących SS jest ważna ze względu na możliwy wpływ
na pogorszenie jakości życia, potencjalne powikłania, ale także możliwość uzyskania znacznej poprawy po leczeniu immunosupresyjnym.
II. Cele pracy Cele pracy to:
1. Ocena częstości występowania i fenotypu zajęcia obwodowego układu nerwowego u pacjentów z pSS w ośrodku uniwersyteckim o najwyższym stopniu referencyjności.
2. Porównanie jakości życia związanej ze zdrowiem (ang. health-related quality of life, HR-QOL) u pacjentów z pSS z neuropatią obwodową i bez niej.
3. Analiza związku między powikłaniami neurologicznymi oraz różnymi komponentami HR-QOL z wykorzystaniem kwestionariusza SF-36.
III. Materiał i metody
Badanie przeprowadzono u 50 dorosłych pacjentów z rozpoznaniem pSS, którzy byli pod opieką Kliniki Chorób Wewnętrznych, Chorób Tkanki Łącznej i Geriatrii Gdańskiego Uniwersytetu Medycznego. Badaniem objęto 50 niewyselekcjonowanych osób, w tym 48 kobiet w wieku od 33 do 69 lat (średnia 53,6 ± 10,5 lat) i dwóch mężczyzn w wieku 42 i 67 lat. Średni wiek w chwili rozpoznania SS wynosił 50,4 ± 14 lat. Diagnozę pSS oparto na kryteriach American European Consensus Group z 2002 roku i kryteriach Sjögrens International Collaborative Clinical Alliance opublikowanych w 2012 roku. Kryteria wykluczenia to: rozpoznanie innej choroby tkanki łącznej, cukrzycy i innych stanów, które mogą powodować uszkodzenie nerwów, takie jak choroba zwyrodnieniowa dysku, nadużywanie alkoholu lub innych toksycznych substancji, poważna niewydolność narządów, niedobory witamin i inne choroby neurologiczne.
Ocena reumatologiczna obejmowała szczegółowy wywiad lekarski, badanie przedmiotowe, ocenę bólu, serologiczne badania krwi, ocenę aktywności choroby i wyników czynnościowych. Wszyscy pacjenci przeszli badanie neurologiczne, w tym badanie funkcji czuciowych i motorycznych, odruchów ścięgnistych, badanie nerwów czaszkowych i badanie przewodnictwa nerwowego (ang. nerve conduction study, NCS).
Badanie neurologiczne i NCS zostały wykonane i ocenione przez jednego certyfikowanego neurologa. Badania NCS zostały przeprowadzone zgodnie ze standardowymi metodami laboratoryjnymi według zaleceń protokołu Amerykańskiego Stowarzyszenia Medycyny Elektrodiagnostycznej (ang. American Association of
Electrodiagnostic Medicine, AAEM) przy użyciu aparatu Dantec Keypoint G4 firmy Medtronic. Badania wykonano z kontrolą temperatury skóry 32–34°C. U każdego pacjenta wykonano NCS dziewięciu nerwów obwodowych – strzałkowych, piszczelowych, łydkowych, pośrodkowych – obustronnie i łokciowego – jednostronnie.
W NCS włókien ruchowych przeanalizowano następujące parametry: prędkość przewodzenia, opóźnienie dystalne, amplitudę fali M, latencję fali F i częstotliwość.
W badaniu włókien czuciowych przeanalizowano prędkość przewodzenia i amplitudę potencjałów czuciowych. Dolne granice wartości normalnych [potencjał czynnościowy włókien czuciowych nerwu (ang. sensory nerve action potential, SNAP) i amplituda potencjałów ruchowych (ang. compound muscle action potential, CMAP)] określono dla 50 zdrowych osób w tym samym wieku.
Do klasyfikacji polineuropatii na aksonalne, demielinizacyjne lub mieszane wykorzystano wytyczne ESTEEM (European Standardized Telematic Tool to Evaluate Electrodiagnostic Methods). U wszystkich pacjentów wykonano rutynowe badania laboratoryjne i oznaczono następujące parametry:
• elektroforeza białek surowicy;
• immunofiksacja białek;
• składowe dopełniacza C3 i C4;
• krioglobuliny w surowicy mierzone po odwirowaniu i przechowywaniu w temperaturze 4°C przez co najmniej 72 godziny;
• czynnik reumatoidalny (ang. rheumatoid factor, RF) mierzony za pomocą nefelometrii;
• przeciwciała przeciwjądrowe (ang. antinuclear antibodies, ANA) badane metodą IF przy użyciu linii komórkowej Hep-2;
• przeciwciała anty-Ro/SS-A i anty-La/SS-B badane metodą ELISA lub wykrywane metodą Western blot;
• przeciwciała anty-Ro-52 wykrywane metodą Western blot;
• odczyn Biernackiego (ang. erythrocyte sedimentation rate, ESR);
• białko C-reaktywne (ang. C-reactive protein, CRP);
• β-2-mikroglobulina;
• witamina B12;
• fibrynogen;
• dehydrogenaza mleczanowa (LDH);
• kinaza kreatynowa (CK);
• morfologia krwi obwodowej.
Za normę przyjęto zakresy dla lokalnego laboratorium.
Aktywność SS oceniano przy użyciu skali ESSDAI (EULAR Sjögren's Syndrome Disease Activity Index). Powikłania narządowe rozpoznawano głównie na podstawie skali ESSDAI. Na potrzeby tego badania zajęcie innych narządów lub układów, nieuwzględnionych w skali ESSDAI, zdefiniowano w poniższy sposób. Zajęcie przewodu pokarmowego definiowano jako przewlekłe zanikowe zapalenie błony śluzowej żołądka, autoimmunologiczne zapalenie wątroby lub zespół złego wchłaniania po wykluczeniu towarzyszącej celiakii. Zajęcie układu sercowo-naczyniowego definiowano jako zapalenie osierdzia lub tętnicze nadciśnienie płucne. Zajęcie CNS zostało potwierdzone w badaniach obrazowych (tomografia komputerowa, rezonans magnetyczny, emisyjna tomografia komputerowa pojedynczych fotonów) lub w badaniu płynu mózgowo-rdzeniowego.
Do oceny nasilenia objawów, takich jak suchość, zmęczenie i ból, wykorzystano wskaźnik ESSPRI (EULAR Sjögren's Syndrome Patient Reported Index). Do oceny uszkodzeń spowodowanych przez chorobę użyto wskaźnika SSDDI (Sjögren's Syndrome Disease Damage Index). Do oceny niepełnosprawności spowodowanej neuropatią obwodową wykorzystano skalę ODSS (Overall Disability Sum Score). Skala ODSS składa się z listy pytań do przeprowadzenia wywiadu z pacjentem i koncentruje się na funkcji kończyn. Punktacja wynosi od 0 do 5 w kończynie górnej i od 0 do 7 w kończynie dolnej.
Wynik 0 oznacza brak ograniczeń, a najwyższe oceny (5 lub 7 w zależności od domeny) wskazują na niezdolność do wykonania celowego ruchu.
Dodatkowo poprosiliśmy pacjentów o ocenę bólu, którego doświadczyli w ciągu ostatnich dwóch tygodni za pomocą wizualnej skali analogowej (VAS) oraz częściowo ustrukturyzowanego wywiadu. W wywiadzie ból podzielono na następujące typy:
neuropatyczny, mięśniowy lub stawowy. Ból neuropatyczny scharakteryzowano jako drętwienie, uczucie mrowienia lub pieczenia. Ból mięśni scharakteryzowano jako ból lub sztywność mięśni kończyn i obręczy lub uczucie, że mięśnie zostały „przepracowane”.
Ból stawów (artralgia) charakteryzował się bólem lub sztywnością ograniczoną do stawów. Zastosowano własny kwestionariusz, który pozwolił uzyskać jedno proste i kompleksowe narzędzie do gromadzenia jakościowych i ilościowych informacji na temat bólu odczuwanego przez pacjenta. Ponieważ pacjenci wypełnili kwestionariusz
pod nadzorem doświadczonego specjalisty, wszystkie potencjalne problemy interpretacyjne zostały rozwiązane, zwłaszcza w zakresie różnicowania bólu neuropatycznego od mięśniowego.
Do oceny jakości życia związanej ze zdrowiem (HR-QOL) w obecnym badaniu wykorzystano kwestionariusz Optum SF-36v2. Jest to narzędzie składające się z 36 pytań do samooceny kilku dziedzin w ciągu ostatnich czterech tygodni. Ocenianych jest osiem domen: funkcjonowanie fizyczne (dziesięć pozycji), funkcjonowanie społeczne (dwie pozycje), ograniczenie w pełnieniu swoich funkcji z powodu zdrowia fizycznego (cztery pozycje), ograniczenie w pełnieniu swoich funkcji wynikające z problemów emocjonalnych (trzy pozycje), zdrowie psychiczne (pięć pozycji), witalność (cztery pozycje), ból (dwie pozycje) i ogólny stan zdrowia (pięć pozycji). W każdej domenie ocenia się zdrowie w skali od 0 do 100 punktów, gdzie 100 punktów wskazuje najlepsze możliwe funkcjonowanie. SF-36 to szeroko stosowana skala, która okazała się przydatna w badaniach populacji ogólnej i określonych populacji. Umożliwia porównanie obciążenia wynikającego z różnych chorób i ocenę korzyści wynikających z różnych terapii.
Obliczenia statystyczne przeprowadzono przy użyciu programu Statistica w wersji 13 (TIBCO Software Inc.). Zmienne ciągłe porównywano za pomocą nieparametrycznego testu U Manna-Whitneya po ocenie normalności rozkładu testem Shapiro-Wilka. Do porównania zmiennych kategorycznych użyto dokładnego testu Fishera. Wartość p równą 0,05 lub niższą uznawano za istotną.
Badanie uzyskało akceptację Niezależnej Komisji Bioetycznej Gdańskiego Uniwersytetu Medycznego (zgoda nr. NKEBN/345/2011), a wszyscy pacjenci wyrazili świadomą pisemną zgodę.
IV. Wyniki
40 pacjentów (80%) zgłaszało występowanie subiektywnych objawów wskazujących na zajęcie obwodowego układu nerwowego, takich jak parestezje lub ból o charakterze neuropatycznym.
Zajęcie CNS zostało potwierdzone u 12 pacjentów (24%) i miało następujące objawy kliniczne: zespół podobny do stwardnienia rozsianego, zapalenie naczyń mózgowych, zapalenie rdzenia kręgowego, zapalenie opon mózgowo-rdzeniowych oraz
zaburzenia poznawcze z nieprawidłowościami potwierdzonymi w badaniu tomografii emisyjnej pojedynczego fotonu (SPECT).
1. Rozpowszechnienie neuropatii obwodowych w pSS
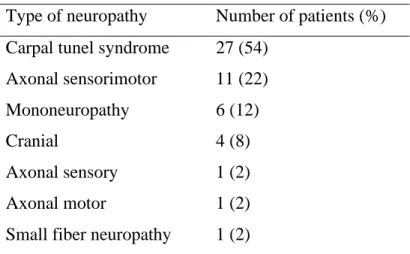
Kryteria rozpoznania neuropatii spełniło 36 chorych (72%). Rozkład podtypów neuropatii przedstawiono w tabeli 1.
Tabela 1. Zajęcie obwodowego układu nerwowego w pSS Rodzaj neuropatii Liczba pacjentów (%) Zespół cieśni nadgarstka 27 (54)
Aksonalna czuciowo-ruchowa 11 (22) Mononeuropatia
Czaszkowa
6 (12) 4 (8) Aksonalna czuciowa 1 (2) Aksonalna ruchowa 1 (2) Neuropatia drobnych włókien 1 (2) pSS – pierwotny zespół Sjögrena
Na potrzeby niniejszego badania do grupy z rozpoznanym zajęciem obwodowego układu nerwowego (dalej określana jako PNS+) włączono 23 z 50 (46%) pacjentów z neuropatiami innymi niż zespół cieśni nadgarstka (ang. carpal tunel syndrome, CTS) lub pacjentów z towarzyszącym CTS. U 13 z 50 (26%) pacjentów rozpoznano tylko CTS.
14 z 23 (61%) pacjentów z PNS+ miało dodatkowo CTS. Neuropatię drobnych włókien (ang. small fiber neuropathy, SFN) podejrzewano u 3 pacjentów, ale z uwagi na brak możliwości przeprowadzenia dodatkowych badań neurofizjologicznych nie udało się potwierdzić diagnozy. Wszyscy ci pacjenci zgłaszali występowanie bólu o charakterze neuropatycznym w kończynach dolnych i górnych. Ból na 6 punktów w skali VAS oceniło 2 pacjentów, a 1 na poziomie 7 punktów. U 1 pacjenta z prawidłowym wynikiem NCS rozpoznanie SFN ustalono na podstawie nieprawidłowych wyników analizy neurosensorycznej (ang. quantitative sensory testing, QST) wykonanych w innym laboratorium neurologicznym. U 8 z 23 (35%) pacjentów z PNS+ objawy neurologiczne poprzedzały rozpoznanie pSS. Najczęstszymi objawami klinicznymi były parestezje i ból neuropatyczny rozpoczynający się w dystalnych częściach kończyn, zaburzenia czucia o typie „rękawiczek i skarpetek” oraz zgłaszane przez pacjentów łagodne do umiarkowanego osłabienie mięśni. Początek objawów był zwykle przewlekły lub
podostry, a przebieg był przeważnie powoli postępujący. Badanie neurologiczne ujawniło deficyty czuciowe (powierzchowne lub głębokie), jak również zmniejszenie lub brak odruchów ścięgnistych w dotkniętych chorobą kończynach. Osłabienie mięśni było zwykle łagodne i miało charakter dystalny do proksymalnego. U 1 pacjenta ataktyczna neuropatia czuciowa doprowadziła do poważnej utraty propriocepcji i kinestezji, co skutkowało znaczną niepełnosprawnością.
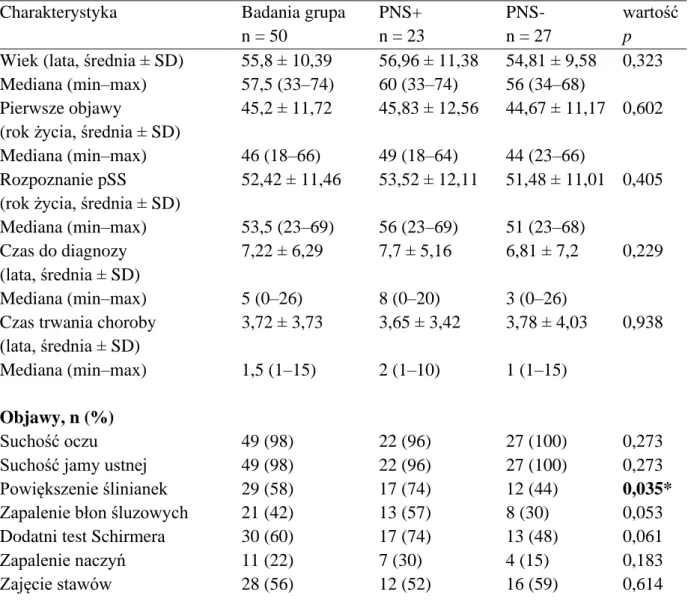
2. Porównanie danych klinicznych i laboratoryjnych pacjentów z PNS+ i PNS- Dane kliniczne porównano między pacjentami z zajęciem obwodowego układu nerwowego (PNS+, n = 23) i pozostałymi 27 pacjentami bez zajęcia obwodowego układu nerwowego (PNS-, n = 27). Tabela 2 przedstawia porównanie badanych grup pod względem danych klinicznych i laboratoryjnych.
Tabela 2. Charakterystyka kliniczna badanej grupy i porównanie grup PNS+ i PNS- Charakterystyka Badania grupa
n = 50
PNS+
n = 23
PNS- n = 27
wartość p Wiek (lata, średnia ± SD)
Mediana (min–max)
55,8 ± 10,39 57,5 (33–74)
56,96 ± 11,38 60 (33–74)
54,81 ± 9,58 56 (34–68)
0,323 Pierwsze objawy
(rok życia, średnia ± SD) Mediana (min–max)
45,2 ± 11,72 46 (18–66)
45,83 ± 12,56 49 (18–64)
44,67 ± 11,17 44 (23–66)
0,602
Rozpoznanie pSS
(rok życia, średnia ± SD) Mediana (min–max)
52,42 ± 11,46 53,5 (23–69)
53,52 ± 12,11 56 (23–69)
51,48 ± 11,01 51 (23–68)
0,405
Czas do diagnozy (lata, średnia ± SD) Mediana (min–max)
7,22 ± 6,29 5 (0–26)
7,7 ± 5,16 8 (0–20)
6,81 ± 7,2 3 (0–26)
0,229
Czas trwania choroby (lata, średnia ± SD) Mediana (min–max)
3,72 ± 3,73 1,5 (1–15)
3,65 ± 3,42 2 (1–10)
3,78 ± 4,03 1 (1–15)
0,938
Objawy, n (%)
Suchość oczu 49 (98) 22 (96) 27 (100) 0,273
Suchość jamy ustnej 49 (98) 22 (96) 27 (100) 0,273
Powiększenie ślinianek 29 (58) 17 (74) 12 (44) 0,035*
Zapalenie błon śluzowych 21 (42) 13 (57) 8 (30) 0,053
Dodatni test Schirmera 30 (60) 17 (74) 13 (48) 0,061
Zapalenie naczyń 11 (22) 7 (30) 4 (15) 0,183
Zajęcie stawów 28 (56) 12 (52) 16 (59) 0,614
Zajęcie przewodu pokarmowego
26 (52) 12 (52) 14 (52) 0,981
Zajęcie układu krążenia 5 (10) 2 (9) 3 (11) 0,776
Zajęcie układu oddechowego 25 (50) 15 (65) 10 (37) 0,047*
Zajęcie CNS 11 (22) 7 (30) 4 (15) 0,183
Zajęcie układu moczowego 25 (50) 12 (52) 13 (48) 0,776
Limfadenopatia 19 (38) 14 (61) 5 (19) 0,002*
Chłoniak 2 (4) 2 (9) 0 (0) 0,073
Obecność ANA 50 (100) 23 (100) 27 (100) –
Obecność anti-Ro/SS-A 35 (70) 16 (70) 19 (70) 0,979
Obecność anti-La/SS-B 23 (46) 10 (43) 13 (48) 0,648
Czynnik reumatoidalny 31 (62) 13 (57) 18 (67) 0,665
Krioglobuliny 10 (20) 3 (13) 7 (26) 0,668
Hipokomplementemia 8 (16) 6 (26) 2 (7) 0,045*
Hipergammaglobulinemia 28 (56) 13 (57) 15 (56) 0,429
ESR > 30 mm/h 18 (36) 6 (26) 12 (44) 0,178
CRP > 5 mg/l Leczenie, n (%)
10 (20) 4 (17) 6 (22) 0,670
Cyklofosfamid 4 (8) 4 (17) 0 (0) 0,01*
Sterydy 37 (74) 19 (83) 18 (67) 0,194
ESSDAI (punkty; średnia ± SD)
Mediana (min–max)
5,76 ± 5,78 4 (0–21)
7 ± 6,82 4 (0–21)
4,7 ± 4,58 3 (0–15)
0,245
ESSPRI (punkty; średnia ± SD)
Mediana (min–max)
5,12 ± 1,71 5,165 (1,33–8)
5,47 ± 1,66 6 (2,66–8)
4,82 ± 1,72 5 (1,33–7,33)
0,187
SSDDI (punkty; średnia ± SD) Mediana (min–max)
3,78 ± 2,41 4 (0–10)
4,65 ± 2,5 4 (1–10)
3,04 ± 2,1 3 (0–7)
0,055 ODSS (punkty; średnia ± SD)
Mediana (min–max)
1,14 ± 1,74 0 (0–7)
1,78 ± 2,21 1 (0–7)
0,59 ± 0,93 0 (0–4)
0,083
PNS+ – pacjenci z zajęciem obwodowego układu nerwowego, PNS- – pacjenci bez zajęcia obwodowego układu nerwowego, pSS – pierwotny zespół Sjögrena, CNS – ośrodkowy układ nerwowy, ANA – przeciwciała przeciwjądrowe, ESR – odczyn Biernackiego, CRP – białko C-reaktywne, ESSDAI – EULAR Sjögren’s Syndrome Disease Activity Index, ESSPRI – EULAR Sjögren’s Syndrome Patient Reported Index, SSDDI – Sjögren's Syndrome Disease Damage Index, ODSS – Overall Disability Sum Score;
* różnica istotna statystycznie; p ≤ 0,05)
Średni czas od wystąpienia objawów suchości do rozpoznania pSS wynosił 7,7 ± 5,16 lat i 6,81 ± 7,2 lat odpowiednio w grupach PNS+ i PNS- (p = 0,229). W grupie PNS+ częściej obserwowano powiększenie ślinianek (74% vs 44%; p < 0,05), limfadenopatię (61% vs
19%; p < 0,05) oraz zajęcie dróg oddechowych (65% vs 37%; p < 0,05). Chorzy ci byli również częściej leczeni cyklofosfamidem (p < 0,05). Biorąc pod uwagę wyniki badań laboratoryjnych, grupy różniły się jedynie częstością występowania hipokomplementemii (26% vs 7%; p < 0,05). Nie było istotnych różnic między grupami PNS+ i PNS- pod względem zajęcia innych narządów i wynikami skal ESSDAI, ESSPRI, SSDI i ODSS. W grupie PNS+ średni wynik ODSS określający stopień niepełnosprawności z powodu neuropatii obwodowej wyniósł 1,78 ± 2,21.
Zbadano również różnice między poszczególnymi podtypami neuropatii.
Stwierdzono, że pacjenci z neuropatią czuciowo-ruchową w porównaniu do pacjentów z innymi rodzajami neuropatii mieli dłuższy czas trwania choroby (5,82 ± 3,82 vs 1,67
± 1,07; p < 0,05), u większego odsetka stwierdzono obecność przeciwciał anty-SS-A (91% vs 50%; p < 0,05), hipokomplementemię (55% vs 0%; p < 0,05), hipergammaglobulinemię (82% vs 33%; p < 0,05) i podwyższone stężenie B-2- mikroglobuliny (91% vs 17%; p < 0,05). Chociaż częstość limfadenopatii była porównywalna między podgrupami, to u dwóch pacjentów z rozpoznanym chłoniakiem (4% badanej grupy) stwierdzono neuropatię czuciowo-ruchową.
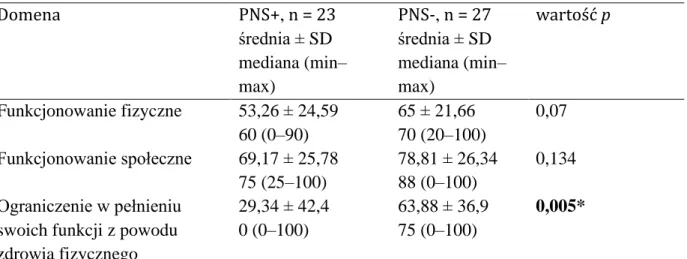
3. Porównanie natężenia bólu, wywiadu i wyników SF-36 między pacjentami z PNS+ i PNS-
Podsumowanie wyników uzyskanych za pomocą kwestionariusza SF-36 i wyników skali VAS oceniającej natężenie bólu pomiędzy pacjentami z pSS z zajęciem obwodowego układu nerwowego i bez niego przedstawiono w tabeli 3.
Tabela 3. Porównanie wyników SF-36 i VAS pomiędzy pacjentami z pSS z zajęciem obwodowego układu nerwowego i bez niego
Domena PNS+, n = 23
średnia ± SD mediana (min–
max)
PNS-, n = 27 średnia ± SD mediana (min–
max)
wartość p
Funkcjonowanie fizyczne 53,26 ± 24,59 60 (0–90)
65 ± 21,66 70 (20–100)
0,07 Funkcjonowanie społeczne 69,17 ± 25,78
75 (25–100)
78,81 ± 26,34 88 (0–100)
0,134 Ograniczenie w pełnieniu
swoich funkcji z powodu zdrowia fizycznego
29,34 ± 42,4 0 (0–100)
63,88 ± 36,9 75 (0–100)
0,005*
Ograniczenie w pełnieniu swoich funkcji z powodu problemów emocjonalnych
58,00 ± 44,08 67 (0–100)
85,25 ± 28,19 100 (0–100)
0,042*
Zdrowie psychiczne 63,65 ± 18,87 64 (20–96)
71,85 ± 16,54 72 (32–100)
0,129
Witalność 38,69 ± 15,96
40 (10–70)
49,62 ± 17,64 50 (20–75)
0,04*
Ból 43,69 ± 22,3
45 (10–75)
58,74 ± 26,37 55 (0–100)
0,038*
Ogólny stan zdrowia 23,04 ± 12,49 20 (5–50)
29,81 ± 12,12 30 (0–50)
0,044*
VAS bólu 2,87 ± 2,44
3 (0–7)
1,96 ± 2,47 0 (0–7)
0,229
SF-36 – kwestionariusz jakości życia, PNS+ – pacjenci z zajęciem obwodowego układu nerwowego, PNS- – pacjenci bez zajęcia obwodowego układu nerwowego, VAS – wizualna skala analogowa;
* różnica istotna statystycznie; p ≤ 0,05
Średnie natężenie bólu wg skali VAS w grupie PNS+ w porównaniu z PNS- wynosiło odpowiednio 2,87 ± 2,44 i 1,96 ± 2,47 (p = 0,229). Ocena lekarza ujawniła, że w obu podgrupach często występował ból o charakterze neuropatycznym. Ten rodzaj bólu dominował u 16 z 23 (70%) pacjentów z grupy PNS+, natomiast 11 z 27 (41%) pacjentów z grupy PNS- również cierpiało na ból neuropatyczny. W pięciu domenach kwestionariusza SF-36 pacjenci z grupy PNS+ uzyskali istotnie niższe wyniki niż w PNS-:
ograniczenie w pełnieniu swoich funkcji z powodu zdrowia fizycznego (29,34 ± 42,40 vs 63,88 ± 36,90), ograniczenie w pełnieniu swoich funkcji wynikające z problemów emocjonalnych (58 ± 44,08 vs 85,25 ± 28,19), witalność (38,69 ± 15,96 vs 49,62
± 17,64), ból (43,69 ± 22,30 vs 58,74 ± 26,37) i ogólny stan zdrowia (23,04 ± 12,49 vs 29,81 ± 12,12) (p ≤ 0,05).
V. Dyskusja
Rozprawa doktorska została oparta na trzech pracach opublikowanych w recenzowanych czasopismach naukowych:
1. Domżalska M., Wiglusz M., Chylińska M., Siemiński M., Czuszyńska Z., Zdrojewski Z., Zajęcie układu nerwowego w zespole Sjögrena, „Neurologia Praktyczna” 2015, nr 6, s.
6–15.
2. Jaskólska M., Chylińska M., Masiak A., Siemiński M., Ziętkiewicz M., Czuszyńska Z., Smoleńska Ż., Zdrojewski Z., Neuro-Sjögren: Uncommon or underestimated problem?,
„Brain and Behaviour” 2020 Aug, 10(8): 1267–1274; doi: 10.1002/brb3.1665.
3. Jaskólska M., Chylińska M., Masiak A., Nowicka-Sauer K., Siemiński M., Ziętkiewicz M., Czuszyńska Z., Zdrojewski Z., Peripheral neuropathy and health-related quality of life in patients with primary Sjögren's syndrome: a preliminary report, „Rheumatology International” 2020 Aug, 40(8): 1267–1274; doi: 10.1007/s00296-020-04543-2.
1. Praca poglądowa pod tytułem Zajęcie układu nerwowego w zespole Sjögrena opublikowana w czasopiśmie „Neurologia Praktyczna” stanowi podsumowanie aktualnej wiedzy na temat neurologicznych i psychiatrycznych objawów występujących w pSS, ich patofizjologii, diagnostyki i leczenia. Omówiono w niej objawy i zespoły kliniczne dotyczące zajęcia obwodowego i ośrodkowego układu nerwowego w przebiegu SS. Przytoczono i porównano prace innych autorów oceniające rozpowszechnienie powikłań neurologicznych w przebiegu SS. Przedstawiono i wyjaśniono potencjalne mechanizmy etiopatogenetyczne, które mogą być przyczyną obserwowanych objawów neurologicznych. Omówiono metody diagnostyczne oraz aktualny stan wiedzy na temat leczenia powikłań neurologicznych.
W posumowaniu zwrócono uwagę na szeroki zakres możliwych powikłań neurologicznych towarzyszących SS, potencjalnie poważny charakter powikłań oraz fakt, że w części przypadków dobre efekty przynosi leczenie immunosupresyjne. Celem było również zwrócenie uwagi i zainteresowanie lekarzy innych specjalności tą jednostką chorobową.
2. W artykule Neuro-Sjögren: Uncommon or underestimated problem? opublikowanym na łamach czasopisma „Brain and Behaviour” przedstawiono analizę częstości występowania i fenotypu zajęcia obwodowego układu nerwowego u pacjentów z pSS w szpitalu uniwersyteckim najwyższego stopnia referencyjności. O ile nam wiadomo, było to pierwsze takie badanie przeprowadzone w populacji polskiej.
Kryteria rozpoznania neuropatii spełniło 36 pacjentów (72%). Najczęstszą stwierdzaną neuropatią był zespół cieśni nadgarstka (54%) i aksonalna neuropatia czuciowo-ruchowa (22%). U 8 pacjentów (35%) rozpoznanie pSS poprzedzało objawy
neurologiczne. Fakt ten sugeruje, że są to pacjenci, którzy najpierw zgłoszą się do neurologa.
Pomimo postępu wiedzy o SS istnieje duża rozbieżność pomiędzy autorami w ocenie częstości występowania i symptomatologii zajęcia układu nerwowego w tej grupie chorych. Może to wynikać z zastosowanych kryteriów klasyfikacyjnych, różnych testów diagnostycznych, doboru grupy badanej oraz ukierunkowanego zainteresowania badaczy. Dodatkowo nie wszyscy autorzy klasyfikują zaburzenia psychiczne w przebiegu SS jako objaw zajęcia CNS. Niektóre badania obejmowały pacjentów z wtórnym zespołem Sjögrena, np. do tocznia rumieniowatego układowego, co utrudniało ocenę, która jednostka chorobowa jest przyczyną obserwowanych objawów neurologicznych. Ponadto należy wziąć pod uwagę choroby współistniejące, które mogą zwiększać ryzyko chorób naczyniowych mózgu (cukrzyca, nadciśnienie, hiperlipidemia), choroby tarczycy oraz objawy wtórne do zastosowanego leczenia (np.
glikokortykosteroidy, cytostatyki).
We wcześniejszych badaniach zajęcie obwodowego układu nerwowego obserwowano u 2–60% pacjentów z SS, a najczęstszym stwierdzanym zaburzeniem była neuropatia czuciowa. Dotychczasowe badania sugerują związek między neuropatiami obwodowymi a zapaleniem naczyń, zajęciem płuc i objawami ogólnymi, takimi jak gorączka i zmęczenie. W prezentowanym badaniu w grupie pacjentów PNS+ istotnie częściej stwierdzano powiększenie ślinianek, zajęcie dróg oddechowych, powiększenie węzłów chłonnych i hipokomplementemię oraz większy odsetek pacjentów leczonych cyklofosfamidem z powodu objawów pozagruczołowych w porównaniu z grupą PNS-.
W przeciwieństwie do innych autorów w prezentowanym materiale nie stwierdzono statystycznie istotnych różnic w immunologicznych markerach aktywacji limfocytów B lub proliferacji monoklonalnej między grupami PNS+ i PNS-. Przewlekła aktywacja limfocytów B charakteryzuje się podwyższonym poziomem gamma-globulin (głównie IgG) w surowicy, obecnością innych markerów serologicznych zwiększonej aktywności limfocytów B (ANA, przeciwciała anty-Ro/SS-A, przeciwciała anty-La/SS-B, RF ) i tworzeniem ektopowej tkanki limfatycznej o strukturach przypominających centra rozmnażania. Innym immunologicznym objawem pSS jest predyspozycja do rozwoju oligo- i monoklonalnej proliferacji limfocytów B charakteryzującej się obecnością mieszanej krioglobulinemii, gammapatii monoklonalnej i chłoniaków z komórek B.
W niniejszym badaniu tylko pacjenci z neuropatią czuciowo-ruchową mieli
podwyższone stężenie markerów aktywacji limfocytów B. W tej grupie stwierdzono również znacznie dłuższy czas trwania choroby w porównaniu z innymi podgrupami.
Neuropatie czuciowo-ruchowe były dotychczas wiązane z wyższą częstością występowania markerów przewlekłej aktywacji limfocytów B i proliferacji monoklonalnej limfocytów B, podczas gdy neuropatie czuciowe rzadziej powodowały przewlekłą aktywację limfocytów B, co sugeruje inny mechanizm przyczynowy.
Przypuszczamy, że neuropatie czuciowo-ruchowe są kolejnym krokiem w rozwoju neuropatii w pSS poprzedzonym neuropatiami czysto czuciowymi, a zatem wiążą się z większą częstością występowania przewlekłej aktywacji limfocytów B odpowiadającej dłuższemu czasowi trwania choroby.
W przedstawionym materiale klinicznym częstą neuropatią był zespół cieśni nadgarstka (CTS) (54%). Do tej pory ten typ neuropatii był rzadko obserwowany u pacjentów z pSS, chociaż jest to częsta neuropatia w populacji ogólnej, a jej częstość wzrasta wraz z wiekiem. Szacowane rozpowszechnienie CTS w populacji ogólnej wynosi od 1 do 5%, częściej chorują kobiety niż mężczyźni (stosunek kobiet do mężczyzn wynosi około 3:1). Binder i wsp. rozpoznali CTS u 6 ze 105 pacjentów włączonych do ich badania, 3 z nich miało SS wtórny do reumatoidalnego zapalenia stawów. W naszym badaniu występowanie CTS było związane z podgrupą pacjentów z zajęciem stawów.
Może to sugerować, że wystąpieniu CTS sprzyja stan zapalny i przerost błony maziowej stawu. Wyjaśnienie etiologii CTS w przebiegu pSS wymaga dalszych badań.
3. Kontynuację powyższej analizy w odniesieniu do HR-QOL można znaleźć w artykule Peripheral neuropathy and health-related quality of life in patients with primary Sjögren's syndrome: a preliminary report opublikowanym w czasopiśmie „Rheumatology International”. Celem pracy było porównanie HR-QOL u pacjentów z pSS z neuropatią obwodową i bez neuropatii. Do oceny HR-QOL wykorzystano kwestionariusz oceny jakości życia SF-36. Dodatkowej oceny bólu dokonano za pomocą wizualnej skali analogowej (VAS) oraz częściowo ustrukturyzowanego wywiadu.
Następujące domeny kwestionariusza SF-36 były istotnie gorzej oceniane przez pacjentów z zajęciem obwodowego układu nerwowego: ograniczenie w pełnieniu swoich funkcji z powodu zdrowia fizycznego, ograniczenie w pełnieniu swoich funkcji z powodu problemów emocjonalnych, witalność, ból i ogólny stan zdrowia (p ≤ 0,05).
W opublikowanym badaniu wykazano, że zajęcie PNS jest częste, ale pozostaje nierozpoznane u pacjentów z pSS i wiąże się z gorszą HR-QOL. W dotychczasowych doniesieniach stwierdzono, że HR-QOL jest upośledzona w pSS, ale jak dotąd wiązano to ze zmęczeniem, bólem, objawami suchości i stresem psychicznym.
Zmęczenie (wyrażone jako zmniejszona witalność w SF-36) i ból to najczęstsze objawy pozagruczołowe zgłaszane przez pacjentów cierpiących na choroby reumatologiczne. W badaniach populacyjnych rozpowszechnienie przewlekłego zmęczenia sięga około 20% wśród osób zdrowych i do 70% u pacjentów z chorobami autoimmunologicznymi. Patogeneza przewlekłego zmęczenia jest nadal nieznana.
Wpływ zmęczenia na jakość życia pacjentów ma istotne znaczenie. Zmęczenie jest związane z zaburzeniami nastroju, obniżoną motywacją, zaburzeniami snu, przewlekłym bólem, stanem zapalnym i zmiennymi psychospołecznymi, co sprawia, że jest to jeden z najbardziej kompleksowych problemów medycznych.
Dwie pozycje domeny dotyczącej odczuwanego bólu kwestionariusza SF-36 pozwalają ocenić częstotliwość bólu i jego wpływ na codzienne funkcjonowanie, ale nie rozróżniają rodzaju bólu i jego intensywności. Sugerujemy, że dodatkowa ocena natężenia bólu według skali VAS i użycie częściowo ustrukturyzowanego wywiadu w celu sklasyfikowania rodzaju bólu na neuropatyczny, mięśniowy lub stawowy jest niezbędna w tej grupie pacjentów. Nawet jeśli natężenie bólu znajduje się w przedziale od łagodnego do umiarkowanego, jak w badanej grupie, należy podkreślić, że rozważamy przewlekły ból towarzyszący pacjentowi każdego dnia. Nie należy też zakładać, że każdy ból odczuwany przez pacjenta z chorobą reumatyczną ma charakter stawowy. Według oceny klinicystów u wielu spośród badanych pacjentów dominował ból neuropatyczny. Warto wspomnieć, że w niniejszym badaniu zauważalna była różnica między oceną bólu w skali VAS a wskaźnikiem ESSPRI, chociaż korelacja między tymi dwoma wskaźnikami była istotna statystycznie (r = 0,53). Średni wynik natężenia bólu w skali VAS w grupie PNS+ w porównaniu z PNS- wyniósł odpowiednio 2,87 ± 2,44 i 1,96 ± 2,47, natomiast średni wynik natężenia bólu w skali ESSPRI w grupie PNS+
w porównaniu z PNS- wyniósł odpowiednio 4,35 ± 2,33 i 4,04 ± 2,65. Możliwe do uzyskania wyniki w obu skalach mieszczą się w przedziale od 0 do 10, dodatkowo w obu brano pod uwagę ten sam okres (dwa tygodnie przed oceną). Wcześniejsze badania wykazały, że wskaźnik ESSPRI istotnie koreluje z innymi skalami do oceny pacjentów, w tym z oceną bólu w skali VAS. Wskaźnik ESSPRI nie rozróżnia jednak rodzaju bólu,
a ocena wraz z innymi składowymi (zmęczenie i suchość) może powodować zawyżenie oceny bólu. Sugerujemy, aby w tej grupie chorych zastosować szerszą skalę oceny bólu, aby wyeliminować negatywny wpływ innych objawów na ocenę bólu i scharakteryzować rodzaj bólu celem dostosowania odpowiedniego leczenia.
Spośród chorób reumatycznych niepełnosprawność funkcjonalna najczęściej dotyka pacjentów z reumatoidalnym zapaleniem stawów (RZS) i twardziną układową (SSc). Pacjenci z SS są zwykle pomijani w tej kwestii, ponieważ ich choroba na ogół nie manifestuje się w widoczny sposób, czego przykładem są np. deformacje stawów w RZS czy przykurcze w SSc. Jednakże współistniejąca neuropatia może znacząco wpływać na funkcjonowanie pacjentów z pSS. Średni wynik ODSS określający stopień niepełnosprawności z powodu neuropatii obwodowej w naszym badaniu wyniósł 1,78
± 2,21 w grupie PNS+, co odzwierciedla gorsze codzienne funkcjonowanie i może wyjaśniać niskie wyniki uzyskane w domenie ograniczenia w pełnieniu swoich funkcji z powodu zdrowia fizycznego. U pacjentów PNS+ badanie neurologiczne najczęściej ujawniało ubytki czucia oraz łagodne do umiarkowanego osłabienie mięśni. Jednak u 1 pacjenta ataktyczna neuropatia czuciowa doprowadziła do znacznego stopnia niepełnosprawności spowodowanej ciężką utratą propriocepcji i kinestezji. Te dwa czynniki – ból neuropatyczny i niepełnosprawność spowodowana neuropatią mogą być dwoma ważnymi czynnikami wpływającymi na HR-QOL.
Gdy pojawiają się trudności w wykonaniu określonej czynności, wielu pacjentów dostosowuje się do sytuacji, wybierając alternatywne zajęcia. Zmniejszone oczekiwania spowodowane przewlekłą chorobą mogą ułatwić psychiczną adaptację. Może to być wyjaśnieniem, dlaczego punktacja uzyskana w trzech domenach: funkcjonowanie fizyczne, funkcjonowanie społeczne i zdrowie psychiczne nie różni się istotnie między podgrupami chorych PNS+ i PNS-.
Wyniki uzyskane za pomocą kwestionariusza SF-36 u pacjentów z pSS PNS+ są podobne do wyników uzyskanych wcześniej w grupie pacjentów chorych na RZS.
U pacjentów z RZS niskie wyniki uzyskane w domenie funkcjonowania fizycznego wynikały jednak głównie z zajęcia stawów. W porównaniu z pacjentami z toczniem rumieniowatym układowym (SLE), pacjenci z pSS PNS+ prezentują gorszą HR-QOL, uzyskali gorsze wyniki w zakresie domen: fizycznego funkcjonowania, zdrowia psychicznego, bólu i ogólnego stanu zdrowia. Pacjenci z pSS PNS+ mieli również tendencję do uzyskiwania niższych wyników w domenach fizycznego funkcjonowania,
ograniczenia w pełnieniu swoich funkcji z powodu zdrowia fizycznego, bólu, witalności i ogólnego stanu zdrowia w porównaniu z pacjentami z twardziną układową (SSc).
U pacjentów z SSc czas trwania choroby, zajęcie przewodu pokarmowego, zajęcie płuc było ujemnie skorelowane z domenami fizycznymi kwestionariusza SF-36, a stopień zajęcia skóry (mierzony za pomocą zmodyfikowanej skali Rodnana) był związany z gorszymi wynikami w domenach fizycznych i psychicznych.
Pacjenci z pSS na ogół mieli niższy poziom witalności niż pacjenci z RZS, SLE i SSc.
To ciekawe, ponieważ SS charakteryzuje się najlepszym rokowaniem dotyczącym oczekiwanej długości życia w porównaniu z wyżej wymienionymi chorobami. „Niska witalność” może wynikać z niespecyficznych objawów wielonarządowych, opóźnienia w rozpoznaniu, zaawansowania choroby w momencie diagnozy oraz niedostatecznego rozpoznania powikłań pozagruczołowych. Przyczyną może być również nierozpoznany charakter przewlekłego bólu, a zatem niewłaściwe jego leczenie.
Podsumowując, te wstępne wyniki sugerują duże niezaspokojone potrzeby zdrowotne. Pacjenci z SS to bardzo zróżnicowana grupa pacjentów z możliwym zajęciem każdego narządu i każdego układu w przebiegu choroby, dlatego istotna jest szeroka wiedza reumatologów i interdyscyplinarne podejście do tych pacjentów. U pacjentów z pSS współistniejące powikłania neurologiczne z takimi objawami, jak ból i niepełnosprawność fizyczna mogą być odpowiedzialne za obniżenie HR-QOL. Należy pamiętać, że pacjenci bardziej cenią sobie jakość życia niż wskaźniki aktywności choroby czy parametry laboratoryjne. Jest to pierwsze badanie, w którym podkreślono związek między zajęciem PNS a gorszą HR-QOL u pacjentów z pSS.
Nowością w tej grupie pacjentów jest również próba rozszerzenia oceny bólu o kategoryzację na mięśniowy, stawowy i neuropatyczny. Powyższe wnioski wskazują na kierunek przyszłych badań w tej grupie pacjentów, ukierunkowanych na szybkie wykrycie powikłań narządowych oraz odpowiednie ich leczenie. Ponadto wskazują na potrzebę zwrócenia większej uwagi na subiektywne objawy zgłaszane przez pacjentów i ich dokładną ocenę. Wydaje się, że potrzebne są dalsze badania nad patomechanizmem powstawania bólu i jego postrzeganiem w pSS. Konieczne wydaje się również opracowanie nowych skal do dokładnej oceny bólu i innych subiektywnych objawów zgłaszanych przez pacjentów. Należy podkreślić, że ból u pacjentów reumatologicznych jest problemem znacznie bardziej złożonym, niż się do tej pory wydawało.
Podsumowując, niniejsze badanie wykazało, że zajęcie PNS jest częste u pacjentów z pSS i skorelowane z gorszą HR-QOL. Przypuszczamy, że przyczyną obniżenia HR-QOL u pacjentów z pSS mogą być ból i niepełnosprawność ruchowa wynikające z powikłań neurologicznych. Aby uzyskać pełny obraz pacjentów z SS, niezbędne wydaje się kompleksowe podejście obejmujące całościową ocenę choroby z oceną wskaźników aktywności choroby i opinii pacjentów dotyczących zdrowia (ang.
patient-reported outcomes, PROs). Zastosowanie spersonalizowanej terapii łączącej leczenie immunosupresyjne, objawowe leczenie bólu, fizjoterapię i wsparcie psychologiczne może poprawić przestrzeganie zaleceń i wyniki leczenia oraz HR-QOL naszych pacjentów.
Niniejsze badanie ma pewne ograniczenia. Głównym jest mała liczba pacjentów z pSS poddana badaniu. Po drugie badanie zostało przeprowadzone w szpitalu uniwersyteckim, co mogło odgrywać rolę w doborze pacjentów. Dodatkowo nie mieliśmy możliwości przeprowadzenia dodatkowych badań neurofizjologicznych w przypadkach, w których podejrzewano neuropatię drobnych włókien. Główną zaletą jest to, że badanie ma charakter przekrojowy z dokładną oceną neurologiczno- reumatologiczną wykonywaną przez jednego dyplomowanego specjalistę. Wiele badań w tym temacie opierało się na ocenie retrospektywnej. Dodatkowo z badania wykluczono pacjentów z towarzyszącymi innymi chorobami tkanki łącznej, a także chorych na cukrzycę, chorobę zwyrodnieniową krążka międzykręgowego i inne schorzenia neurologiczne.
VI. Wnioski
1. Częstość występowania neuropatii obwodowych wśród pacjentów z pierwotnym zespołem Sjögrena w przedstawionym materiale jest wysoka i wynosi 72%.
Najczęściej stwierdzaną polineuropatią była polineuropatia czuciowo-ruchowa oraz zespół cieśni nadgarstka.
2. Objawy neurologiczne poprzedzały rozpoznanie choroby u 35% chorych. Obraz kliniczny i przebieg choroby jest odmienny u pacjentów z zajęciem obwodowego układu nerwowego i bez niego.
3. Pacjenci z zajęciem obwodowego układu nerwowego w przebiegu pierwotnego zespołu Sjögrena mają gorszą jakość życia w porównaniu z pacjentami bez zajęcia
obwodowego układu nerwowego, która wynika m.in. ze znacznego upośledzenia czynnościowego i dolegliwości bólowych.
4. Pacjenci z zajęciem obwodowego układu nerwowego uzyskali znacząco niższe wyniki w pięciu domenach kwestionariusza SF-36: ograniczenie w pełnieniu swoich funkcji z powodu zdrowia fizycznego, ograniczenie w pełnieniu swoich funkcji wynikające z problemów emocjonalnych, witalność, ból i ogólny stan zdrowia.
5. Ból towarzyszący tej grupie pacjentów miał nasilenie od łagodnego do umiarkowanego i u wielu pacjentów miał charakter neuropatyczny.
6. W celu ustalenia właściwego leczenia pacjenci z pierwotnym zespołem Sjögrena wymagają kompleksowej oceny aktywności choroby przy współpracy wielu specjalistów oraz uwzględnienia zgłaszanych przez nich objawów.
Podsumowując, zajęcie PNS u pacjentów z SS wydaje się częste, ale pozostaje niedoszacowane. Reumatolodzy powinni być bardziej świadomi ryzyka powikłań neurologicznych u pacjentów z pSS z uwagi na możliwość znacznej poprawy po zastosowaniu leczenia immunosupresyjnego. Natomiast neurolodzy powinni być świadomi możliwych autoimmunologicznych przyczyn neuropatii, ponieważ kliniczne objawy neuropatii mogą poprzedzać rozwój innych objawów chorób reumatycznych.
NCS to nieinwazyjna procedura, która powinna być stosowana w diagnostyce i obserwacji w tej grupie pacjentów. Potrzebne są wytyczne dotyczące diagnostyki i leczenia powikłań neurologicznych u pacjentów z pSS.
Wersja w języku angielskim
Title: Assessment of the prevalence of peripheral nervous system involvement in patients with primary Sjögren's syndrome and its relationship with disease activity and its impact on the deterioration of the quality of life.
Author: Marta Jaskólska, M.D.
Thesis supervisor: Prof. Zbigniew Zdrojewski, M.D. PhD
1. Introduction
Sjögren’s syndrome (SS) is a chronic inflammatory disease with an autoimmune background that mainly affects middle-aged women. It is characterized by the presence of lymphocytic infiltrates in the exocrine glands (mainly salivary and lacrimal), which causes dryness of the eyes (xerophthalmia) and mouth (xerostomia). Sjögren’s syndrome may be primary (pSS)—it occurs then as an independent disease or secondary (sSS)—in the course of other systemic connective tissue diseases. Its prevalence is estimated at 0.1–1% of the population. Systemic manifestations are common in pSS and play a major role in the prognosis. In the course of SS, neurological symptoms may affect both the peripheral (PNS) and central nervous system (CNS). The studies conducted so far have shown that involvement of CNS may occur in 6–48% of SS patients and PNS in 2–60% of patients.
Symptoms from CNS may appear as a consequence of the focal or diffuse brain damage and may be manifested by e.g. epileptic seizures, mental disorders or cognitive decline.
The course of the disease and the severity of symptoms can be mild and self-limiting or progressive, which leads to permanent neurological deficits. In practice, cases of severe, diffuse CNS involvement are rare, but quite common damage to peripheral nerves is found. The following subtypes of peripheral neuropathy in SS were identified: three types of sensory neuropathies (sensory axonal, small-fiber, and sensory ataxic), axonal sensorimotor polyneuropathy, mononeuropathy, multiple mononeuropathy, demyelinating polyradiculoneuropathy, cranial neuropathy, and autonomic neuropathy.
The clinical course of the subtypes of peripheral neuropathy vary widely, but all of them may lead to significant pain and deterioration of quality of life in patients with SS.
The etiology of neurological involvement is complex and not fully explained. The most likely cause is vasculitis occurring within the nervous system, but direct damaging effect of antibodies is also possible.
It is worth remembering that neurological symptoms may be the first manifestation, but may also develop later in the course of the disease.
Awareness of the wide range of neurological symptoms accompanying SS is important due to impact on the deterioration of quality of life, potential complications,
but also the possibility of significant improvement after immunosuppressive treatment.
2. Aims
The purpose of the study was:
1. Assessment of the prevalence and phenotype of peripheral nervous system involvement in patients with pSS in tertiary care university hospital in Poland.
2. Comparison of the health-related quality of life (HR-QOL) in pSS patients with and without peripheral neuropathy.
3. Assessment of the associations between neurological complications and various components of HR-QOL using the SF-36 Health Survey.
3. Material and methods
We studied a group of 50 adult patients with the diagnosis of pSS who were under the care of the Department of Internal Diseases, Connective Tissue Diseases and
Geriatrics of the Medical University of Gdańsk. Fifty unselected subjects were included in the study, of which 48 were females aged 33 to 69 (average 53.6 ± 10.5 years) and two were males aged 42 and 67. The mean age at diagnosis of SS was 50.4 ± 14 years.
Diagnosis of pSS was based on the 2002 American European Consensus Group criteria and Sjögren’s International Collaborative
Clinical Alliance criteria published in 2012. Exclusion criteria were: a diagnosis of other connective tissue disease, diabetes, and other conditions that may cause nerve damage, such as degenerative disc disease, alcohol or other toxic substance use, major organ failure, vitamin deficiencies, and other neurological conditions.
Rheumatological assessment consisted of a detailed medical history, physical examination, pain evaluation, serological blood tests, assessment of disease activity and functional outcomes. All patients underwent clinical neurological examination including conventional investigation of sensory and motor functions, tendon reflexes, cranial nerve investigation, and nerve conduction studies (NCS).
Neurological examination and NCS were performed and evaluated by one certified neurologist. The NCS examinations were conducted following our standard laboratory methods in accordance with the recommended protocol of the American Association of Electrodiagnostic Medicine (AAEM) using Medtronic's Dantec Keypoint G4. Recordings were performed with skin temperature control 32–34°C. NCS was performed on nine peripheral nerves in each patient—peroneal, tibial, sural, median—bilaterally, and ulnar—unilaterally. In motor NCS, the following parameters were analyzed: conduction velocity, distal latency, M-wave amplitude, F-wave latency, and frequency. In sensory NCS, conduction velocity and amplitude of sensory potentials were analyzed. The lower limits of normal values [sensory nerve and compound muscle action potential (SNAP and CMAP) amplitudes measured peak to peak] were determined from 50 age-matched healthy individuals.
For the classification of polyneuropathies into axonal, demyelinating, or mixed, we used the ESTEEM (European Standardized Telematic tool to Evaluate Electrodiagnostic Methods) guidelines.
Routine laboratory tests and following immunological parameters were recorded in all patients:
• serum protein electrophoresis;
• monoclonal gammapathy detected by immunofixation;
• C3 and C4 complement detected by nephelometry;
• serum cryoglobulins, measured after centrifugation and storage at 4°C for at least 72 hr;
• rheumatoid factor (RF) measured by nephelometry;
• antinuclear antibodies (ANA) tested by IF using HEp-2 cell substrate;
• antibodies to anti-Ro/SS-A and anti-La/SS-B assayed by ELISA method or detected by Western blot;
• anti-Ro-52 (detected by Western blot);
• erythrocyte sedimentation rate (ESR);
• c-reactive protein (CRP);
• β-2-microglobulin;
• vitamin B12; fibrinogen;
• lactate dehydrogenase (LDH);
• creatine kinase (CK);
• peripheral blood counts.
Normal ranges for local laboratory were taken into account.
SS activity was assessed using the EULAR Sjögren's Syndrome Disease Activity Index (ESSDAI).
Organ complications were mainly diagnosed based on the ESSDAI.
For the needs of this study, some organ or system involvement, not included in ESSDAI, was defined as follows. Gastrointestinal tract involvement was defined as chronic atrophic gastritis, autoimmune hepatitis, or malabsorption syndrome after exclusion of accompanying celiac disease. Cardiovascular system involvement was defined as pericarditis or pulmonary arterial hypertension. CNS involvement was confirmed in imaging studies (computed tomography, magnetic resonance imaging, single-photon emission computed tomography) or cerebrospinal fluid analysis.
We used EULAR Sjögren's Syndrome Patient Reported Index (ESSPRI) to assess the severity of patients' symptoms such as dryness, fatigue, and pain. To measure disease- related damage, we used Sjögren's Syndrome Disease Damage Index (SSDDI).
For the assessment of clinical disability due to peripheral neuropathy, the Overall Disability Sum Score (ODSS) scale was used. The ODSS scale consists of a checklist for interviewing the patient and focuses on limb functions. The score ranges from 0 to 5 in the upper limb and from 0 to 7 in the lower limb. A score of 0 indicates no limitations, and highest scores (5 or 7 depending on section) indicate inability to perform a purposeful movement.
We additionally asked patients to evaluate the pain that they have experienced in the previous 2 weeks with the Visual Analogue Scale (VAS). Based on a semistructured interview, the pain was categorized into the following types: neuropathic, muscular, or articular. Neuropathic pain was characterized as numbness, pins, and needles sensations or burning sensation. Muscular pain was described as aching or stiffness of the limb and girdle muscles or a feeling that muscles have been “overworked”. Articular pain (arthralgia) was characterized as pain or stiffness limited to joints. We have decided to use our own questionnaire focusing on pain to get one simple and comprehensive tool for gathering qualitative and quantitative information about patient’s pain. As the patients were filling in the questionnaire under supervision of experienced specialist, all potential interpretation problems were solved, especially in terms of differentiating neuropathic from muscular pain.
To assess the HR-QOL the Optum SF-36v2 Health Survey was used in the current study.
It is a 36 question instrument for self-evaluation of several domains during the prior 4 weeks. It assesses eight domains: physical functioning (ten items), social functioning (two items), role-physical (four items), role-emotional (three items), mental health (five items), vitality (four items), bodily pain (two items), and general health (five items).
Each domain evaluates health between 0 and 100 points, with 100 points
indicating the best possible functioning. The SF-36 is a global scale that has been useful in surveys of general and specific populations. It compares the relative burden resulting from various diseases and evaluates benefits resulting from different treatments.
Statistical operations were performed with Statistica version 13 (TIBCO Software Inc.).
Continuous variables were compared using nonparametric Mann–Whitney U test after assessing for normality with the Shapiro–Wilk test. Fisher's exact test was used to compare the categorical variables. p value 0.05 or lower was considered significant.
The study was approved by the Independent Bioethics Committee for Scientific Research of Medical University of Gdańsk (consent no. NKEBN/345/2011) and all patients gave their informed written consent.
4. Results
40 patients (80%) reported subjective symptoms indicative of peripheral nervous system involvement such as paresthesia or neuropathic pain.
CNS involvement was confirmed in 12 patients (24%), and the following clinical presentations were observed: multiple sclerosis-like syndrome, cerebral vasculitis, myelitis, meningoencephalitis, and cognitive impairment with abnormalities confirmed in the SPECT examination.
4.1 Prevalence of peripheral neuropathies in primary Sjögren's syndrome
36 patients (72%) met the criteria for the diagnosis of neuropathy. The distribution of subtypes of neuropathy is presented in Table 1.
Table 1. Peripheral nervous system involvement in pSS.
Type of neuropathy Number of patients (%) Carpal tunel syndrome 27 (54)
Axonal sensorimotor 11 (22) Mononeuropathy
Cranial
6 (12) 4 (8)
Axonal sensory 1 (2)
Axonal motor 1 (2)
Small fiber neuropathy 1 (2) pSS primary Sjögren syndrome
For the needs of the present study, we included 23 of 50 (46%) patients with neuropathies other than carpal tunnel syndrome (CTS) or patients with additional CTS into the group with peripheral nervous system involvement (further referred to as PNS+). 13 of 50 (26%) patients had only CTS, and 14 of 23 (61%) PNS+ patients had additional CTS. A pure small-fiber neuropathy was suspected in three patients, but we did not have the possibility to conduct additional neurophysiological testing. All of them reported neuropathic pain present in lower and upper extremities. Two rated the pain at the level of 6 points on the VAS and one at the level of 7. In one patient with normal NCS, the diagnosis of SFN was established based on abnormal clinical and quantitative sensory testing (QST) performed in another neurological laboratory. In 8 (35%) of 23 PNS+ patients, neurological symptoms preceded the diagnosis of pSS.
The most common clinical presentations were paresthesias and neuropathic pain beginning in distal parts of extremities, sensory deficits in a “glove-stocking”
distribution, and mild-to-moderate muscle weakness reported by patients. The onset was usually chronic or subacute, and the course was predominantly slowly progressive.
The neurological examination revealed sensory deficits (superficial or deep), as well as diminished or absent tendon reflexes in the affected limbs. Muscle weakness was usually mild with a distal-to-proximal pattern. In one patient, ataxic sensory neuropathy led to severe loss of proprioception and kinesthesia resulting in significant disability.
4.2 Comparison of clinical and laboratory data between primary Sjögren's syndrome patients with and without peripheral nervous system involvement
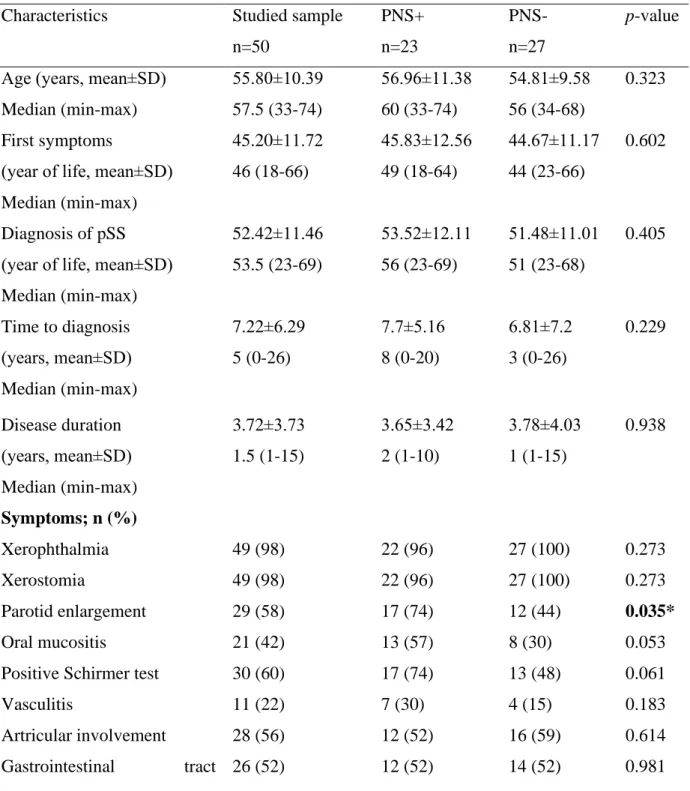
Clinical data were compared between patients with peripheral nervous system involvement (PNS+, n = 23) and the remaining 27 patients without peripheral nervous system involvement (PNS-, n=27). Table 2 summarizes the comparison of the groups and laboratory data.
Table 2. Clinical characteristics of studied sample and comparison between PNS+ and PNS- groups.
Characteristics Studied sample n=50
PNS+
n=23
PNS- n=27
p-value
Age (years, mean±SD) Median (min-max)
55.80±10.39 57.5 (33-74)
56.96±11.38 60 (33-74)
54.81±9.58 56 (34-68)
0.323
First symptoms
(year of life, mean±SD) Median (min-max)
45.20±11.72 46 (18-66)
45.83±12.56 49 (18-64)
44.67±11.17 44 (23-66)
0.602
Diagnosis of pSS (year of life, mean±SD) Median (min-max)
52.42±11.46 53.5 (23-69)
53.52±12.11 56 (23-69)
51.48±11.01 51 (23-68)
0.405
Time to diagnosis (years, mean±SD) Median (min-max)
7.22±6.29 5 (0-26)
7.7±5.16 8 (0-20)
6.81±7.2 3 (0-26)
0.229
Disease duration (years, mean±SD) Median (min-max)
3.72±3.73 1.5 (1-15)
3.65±3.42 2 (1-10)
3.78±4.03 1 (1-15)
0.938
Symptoms; n (%)
Xerophthalmia 49 (98) 22 (96) 27 (100) 0.273
Xerostomia 49 (98) 22 (96) 27 (100) 0.273
Parotid enlargement 29 (58) 17 (74) 12 (44) 0.035*
Oral mucositis 21 (42) 13 (57) 8 (30) 0.053
Positive Schirmer test 30 (60) 17 (74) 13 (48) 0.061
Vasculitis 11 (22) 7 (30) 4 (15) 0.183
Artricular involvement 28 (56) 12 (52) 16 (59) 0.614
Gastrointestinal tract 26 (52) 12 (52) 14 (52) 0.981
involvement
Cardiovascular system involvement
5 (10) 2 (9) 3 (11) 0.776
Respiratory tract involvement 25 (50) 15 (65) 10 (37) 0.047*
CNS involvement 11 (22) 7 (30) 4 (15) 0.183
Urinary tract involvement 25 (50) 12 (52) 13 (48) 0.776
Lymphadenopathy 19 (38) 14 (61) 5 (19) 0.002*
Lymphoma 2 (4) 2 (9) 0 (0) 0.073
Positive ANA 50 (100) 23 (100) 27 (100) -
Positive anti-Ro/SS-A 35 (70) 16 (70) 19 (70) 0.979
Positive anti-La/SS-B 23 (46) 10 (43) 13 (48) 0.648
Rheumatoid factor 31(62) 13 (57) 18 (67) 0.665
Cryoglobulins 10 (20) 3 (13) 7 (26) 0.668
Hypocomplementemia 8 (16) 6 (26) 2 (7) 0.045*
Hipergammaglobulinemia 28 (56) 13 (57) 15 (56) 0.429
ESR >30mm/h 18 (36) 6 (26) 12 (44) 0.178
CRP >5mg/l Treatment, n (%)
10 (20) 4 (17) 6 (22) 0.670
Cyclophosphamide 4 (8) 4 (17) 0 (0) 0.010*
Steroids 37 (74) 19 (83) 18 (67) 0.194
ESSDAI (points; mean±SD) Median (min-max)
5.76±5.78 4 (0-21)
7±6.82 4 (0-21)
4.7±4.58 3 (0-15)
0.245
ESSPRI (points; mean±SD) Median (min-max)
5.12±1.71 5.165 (1.33-8)
5.47±1.66 6 (2.66-8)
4.82±1.72 5 (1.33-7.33)
0.187
SSDDI (points; mean±SD) Median (min-max)
3.78±2.41 4 (0-10)
4.65±2.5 4 (1-10)
3.04±2.1 3 (0-7)
0.055
ODSS (points; mean±SD) Median (min-max)
1.14±1.74 0 (0-7)
1.78±2.21 1 (0-7)
0.59±0.93 0 (0-4)
0.083
PNS+ patients with peripheral neuropathy, PNS- patients without peripheral neuropathy, pSS primary Sjögren syndrome, CNS central nervous system, ANA antinuclear antibodies, ESR erythrocyte sedimentation rate, CRP C-reactive protein, ESSDAI EULAR Sjögren’s Syndrome Disease Activity Index, ESSPRI EULAR Sjögren’s Syndrome Patient Reported Index, SSDDI Sjögren's Syndrome Disease Damage Index, ODSS Overall Disability Sum Score;
* Statistically significant differences; p≤0.05)
The mean time between the onset of sicca symptoms and the diagnosis of pSS was 7,7 ± 5,16 years and 6,81 ± 7,2 years in the PNS+ and PNS− groups, respectively (p = 0.229).
We observed more often salivary gland enlargement (74% vs.44%; p < 0.05), lymphadenopathy (61% vs. 19%; p < 0.05), and respiratory tract involvement (65% vs.
37%; p < 0.05) in the PNS+ group. Those patients were also more often treated with cyclophosphamide (p < 0.05). Considering the laboratory results, the groups differed only in the incidence of hypocomplementemia (26% vs. 7%; p < 0.05). There were no significant differences between PNS+ and PNS− in terms of other organs involvement and results of ESSDAI, ESSPRI, SSDI, and ODSS. In PNS+ group, the mean ODSS score determining the severity of disability due to peripheral neuropathy was 1.78±2.21.
We also studied the differences between individual subtypes of neuropathy. We found that patients with sensorimotor neuropathy had longer disease duration (5,82 ± 3,82 versus 1,67 ± 1,07; p < 0.05), more of them had anti-SS-A antibodies (91% vs. 50%; p <
0.05), hypocomplementemia (55% vs. 0%; p < 0.05), hypergammaglobulinemia (82% vs.
33%; p < 0.05), and elevated levels of B-2-microglobulin (91% vs. 17%; p < 0.05).
Although lymphadenopathy was comparable between the subgroups, of the two patients with lymphoma (4% of our group), both had sensorimotor neuropathy.
4.3 Comparison of VAS-pain, the interview regarding type of pain and SF-36 between primary Sjögren's syndrome patients with and without peripheral nervous system involvement
The results of comparison of SF-36 domains and VAS scores between pSS patients with and without peripheral nervous system involvement are presented in Table 3.
Table 3. Comparison of SF-36 and VAS scores between pSS patients with and without peripheral nervous system involvement.
Domain PNS+, n=23
mean±SD
median (min-max)
PNS-, n=27 mean±SD
median (min-max)
p-value
Physical Functioning 53.26±24.59 60 (0-90)
65.00±21.66 70 (20-100)
0.070
Social Functioning 69.17±25.78 75 (25-100)
78.81±26.34 88 (0-100)
0.134
Role-Physical 29.34±42.40
0 (0-100)
63.88±36.90 75 (0-100)
0.005*
Role-Emotional 58.00±44.08
67 (0-100)
85.25±28.19 100 (0-100)
0.042*
Mental Health 63.65±18.87
64 (20-96)
71.85±16.54 72 (32-100)
0.129
Vitality 38.69±15.96
40 (10-70)
49.62±17.64 50 (20-75)
0.040*
Bodily Pain 43.69±22.30
45 (10-75)
58.74±26.37 55 (0-100)
0.038*
General Health 23.04±12.49 20 (5-50)
29.81±12.12 30 (0-50)
0.044*
VAS-pain 2.87±2.44
3 (0-7)
1.96±2.47 0 (0-7)
0.229
SF-36 Short Form Health Survey, PNS+ patients with peripheral neuropathy, PNS- patients without peripheral neuropathy; VAS – Visual Analogue Scale; results presented as mean±SD;
* Statistically significant differences; p≤0.05
The mean VAS-pain in PNS+ compared to PNS − patients was 2.87±2.44 and 1.96±2.47, respectively (p = 0.229). Clinician’s assessment revealed that neuropathic type of pain was often observed in both subgroups. This type of pain was predominant in PNS+
patients (16 of 23, 70%), while 11 of 27 PNS − patients (41%) suffered from neuropathic pain.
In five domains of the SF-36 PNS+ patients obtained significantly lower results than PNS− patients: role-physical (29.34±42.40 vs. 63.88±36.90), role-emotional (58.00±44.08 vs. 85.25±28.19), vitality (38.69±15.96 vs. 49.62±17.64), bodily pain (43.69±22.30 vs. 58.74±26.37), and general health (23.04±12.49 vs. 29.81±12.12) (p ≤ 0.05).
5. Discussion
The presented thesis is based on three original publications published in peer reviewed