Pode-se assim concluir que embora os genéricos e similares em relação à referência contenham o mesmo medicamento, na mesma dosagem e com a mesma forma farmacêutica, os diferentes excipientes presentes nas formulações interferiram diretamente nas diferenças existentes quanto à dissolução perfis e, consequentemente, podem interferir na biodisponibilidade e no efeito terapêutico da valsartana no tratamento da hipertensão arterial. Atualmente, existem diversos medicamentos no mercado brasileiro (referência, genéricos e similares) que contêm valsartana, um anti-hipertensivo da classe dos antagonistas da angiotensina II (ARA II). Dessa forma, pode-se concluir que embora os genéricos e similares apresentem o mesmo medicamento na mesma dosagem e na mesma forma farmacêutica, os diferentes excipientes presentes nas formulações interferiram diretamente nas diferenças nos perfis de dissolução e consequentemente podem interferir com biodisponibilidade de valsartan e efeito terapêutico no tratamento da hipertensão.
RPD: Desvio Padrão Relativo ED: Eficiência de Dissolução EMA: Agência Europeia de Medicamentos F2: Fator de Similaridade.
INTRODUÇÃO
Um dos critérios para a exclusão biológica de um fármaco é o Sistema de Classificação Biofarmacêutica (SCB), que agrupa os fármacos em quatro classes de acordo com suas características de solubilidade e permeabilidade, que são fatores importantes para a biodisponibilidade dos fármacos (AMIDON, 1995). Este trabalho identificou a valsartana como uma droga com baixa solubilidade e permeabilidade, o que pode inibir o processo de absorção.
OBJETIVOS
Geral
Específicos
REVISÃO DA LITERATURA
- Controle de qualidade físico-químico de formas farmacêuticas sólidas
- Equivalência Farmacêutica
- Bioequivalência/ Biodisponibilidade relativa
- Sistema de Classificação Biofarmacêutica (SCB) e bioisenção
- Dissolução
- Excipientes
- Valsartana no Tratamento da Hipertensão Arterial Sistêmica
- Classificação Biofarmacêutica da Valsartana
- Intercambiabilidade de Medicamentos
Equivalentes farmacêuticos são medicamentos que possuem o mesmo princípio ativo, na mesma quantidade, na forma farmacêutica, podendo diferir dependendo dos excipientes utilizados (BRASIL, 2010a; STORPIRTIS et al., 2004). Além disso, houve benefícios para o mercado, o número de empregos na indústria farmacêutica aumentou e a demanda por especialistas especializados na área de equivalência e bioequivalência farmacêutica também aumentou (ARAÚJO et al., 2010). Isso mostra que, além das técnicas de produção utilizadas, a dissolução pode ser influenciada por propriedades inerentes ao fármaco, como higroscopicidade, solubilidade, polimorfismo, tamanho de partícula, bem como pela presença de excipientes que podem favorecer ou dificultar o processo de dissolução (PEREIRA et al., 2005).
Assim, formas farmacêuticas sólidas para uso oral podem apresentar problemas quanto à biodisponibilidade e bioequivalência do fármaco (STORPITIS et al., 2004). Normalmente, são adicionados às formulações farmacêuticas para proteger, auxiliar ou melhorar a estabilidade da formulação, garantindo exatidão e precisão na dosagem; facilitar a administração do medicamento, melhorar as características organolépticas, permitindo assim melhor aceitação pelo usuário e adesão adequada à terapia (ANSEL et al., 2007). Dessa forma, os excipientes devem ser adicionados na quantidade certa para evitar que prejudique a liberação do fármaco e, além disso, evite a interação entre o ativo e o adjuvante e, menos ainda, cause um efeito adverso . reações em indivíduos (BANAKAR, 1992; PIFFERI et al., 1991; AMIDON; BERMEJO, 2003; ANSEL et al., 2007).
Tem sido relatado como um fármaco de baixa solubilidade e alta permeabilidade, ou seja, um fármaco de classe II e/ou de alta solubilidade e baixa permeabilidade, classe III (SAYDAM; TAKKA, 2007; KUMAR et al., 2012; KAZA et al. al., 2013; GOVINDASWAMY; UMASANKAR, 2014; CHOWDARY et al., 2014). Dessa forma, é de extrema importância a realização de estudos in vitro que reflitam o que ocorre in vivo, principalmente quando se deseja comparar a dissolução entre medicamentos genéricos e similares em relação ao de referência (AMIDON et al., 1995; SOUZA et al. al. ., 2007). A intercambialidade entre genérico-genérico, similar-similar ou mesmo genérico-similar não é possível, pois, além de não ter sido comprovada a bioequivalência/biodisponibilidade relativa entre eles, apenas o produto de referência é registrado na ANVISA para todos os in vivo e in vitro. testes que garantem a segurança e eficácia do medicamento em questão (MIDHA et al., 2005; KARALIS et al., 2013).
MATERIAIS E MÉTODOS
Material
- Substância química de referência (SQR) e medicamentos
- Reagentes e Solventes
- Equipamentos e materiais
Unidade de filtro de seringa Millex – poro de 0,45 µm, diâmetro de 13 mm – frasco de vidro âmbar Waters de 2,00 mL Millipore com tampa de Teflon e septos.
Métodos
- Avaliação de medicamentos contendo valsartana
- Avaliação dos excipientes utilizados nas FFSOLI contendo valsartana
- Caracterização dos medicamentos contendo valsartana
- Determinação de peso
- Desintegração
- Teor
- Perfil de dissolução dos medicamentos
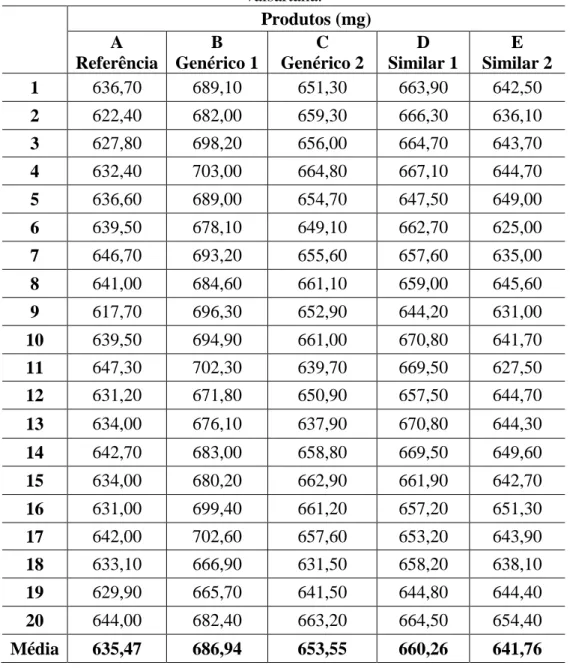
Os testes de caracterização de medicamentos foram realizados de acordo com a monografia individual do produto e os capítulos gerais da Farmacopéia Brasileira (USP, 2017; BRASIL, 2010b). Foram realizados testes para determinar o peso, conteúdo e desintegração de cada uma das drogas selecionadas. Seis comprimidos de cada um dos medicamentos genéricos, comparáveis e de referência analisados foram usados neste teste.
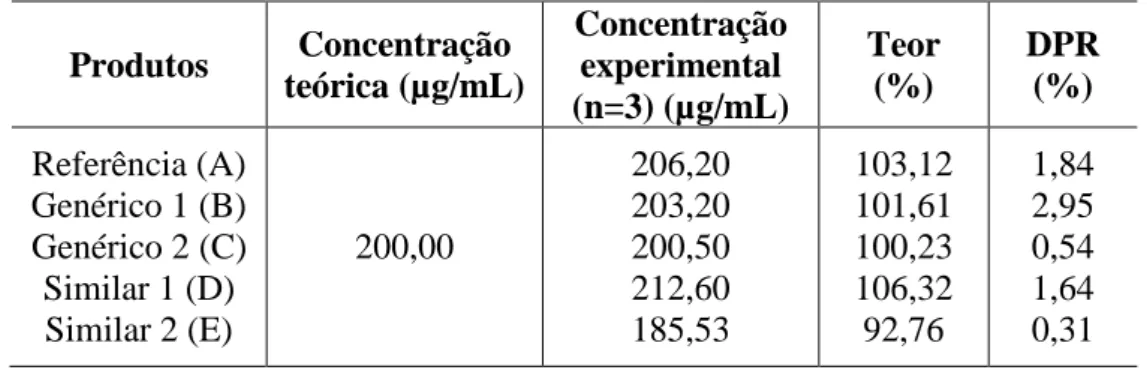
Cada comprimido foi colocado individualmente em um dos tubos do cesto de dissolução, em seguida o disco de acrílico foi colocado e o aparelho acionado. O teste de determinação do conteúdo de valsartan foi realizado em triplicata para cada um dos cinco produtos analisados. O perfil de dissolução da valsartana do FFSOLI foi avaliado conforme RDC nº 31 de 2010 da ANVISA, com 12 comprimidos de cada produto, em meio SESSE (pH=6,8).
Para determinação dos perfis de dissolução foram utilizadas as condições recomendadas pela legislação e a monografia individual do produto (BRASIL, 2010a; BRASIL; 2011a; USP, 2017). A partir disso, foram definidos os perfis de dissolução levando em consideração as alíquotas retiradas para análise e o cálculo do rendimento percentual do fármaco. Por fim, os perfis dos cinco fármacos analisados foram comparados pelo método da eficiência de dissolução (DE).
RESULTADOS E DISCUSSÃO
Análise dos excipientes presentes nas formulações dos medicamentos contendo
Crospovidona, povidona e croscarmelose sódica aceleram a desintegração da forma farmacêutica, bem como a dissolução do fármaco, fazendo com que o comprimido inche e se desintegre (PRISTA et al., 1995; SOARES; PETROVICK, 1999; AMIDON; BERMEJO, 2003; AULTON, 2005 ; ANSEL et al., 2007). Além disso, as formulações analisadas também contêm dióxido de silício, lubrificante, adsorvente, dessecante, agente de suspensão e agente de viscosidade, cuja principal utilização é reduzir o atrito interpartículas, impedir a adesão entre elas e facilitar a fluidez, além de aumentar a compatibilidade de misturas eutéticas e substâncias higroscópicas (PRISTA et al., 1995; USP, 2017). Entretanto, os lubrificantes lipofílicos podem interferir na dissolução do fármaco, pois são lipofílicos e demoram mais para se dissolver e afetam diretamente a biodisponibilidade do fármaco (STORPIRTIS et al., 1999; PRISTA et al., 1995; AMIDON BERMEJO, 2003).
O estearato de magnésio é um lubrificante, que possui propriedade hidrofóbica e pode retardar a dissolução de fármacos em formas farmacêuticas sólidas, sendo por isso utilizado em formulações com a menor concentração possível (ALLEN et al., 2003). Deve-se atentar para a quantidade adicionada, pois o excesso pode dificultar a desintegração do FFSOLI (AMIDON; BERMEJO, 2003; ROWE et al., 2006). A hipromelose é um polímero hidrofílico que resiste à desintegração e é utilizada para revestir o comprimido, possibilitando o controle da liberação do fármaco (ROWE et al., 2006); pois, após ser hidratado, incha e forma uma camada gelificante na superfície do comprimido que atua como uma barreira e assim controla a penetração de água e a velocidade de liberação do fármaco (PRISTA et al., 1995).
O lauril sulfato de sódio é um surfactante utilizado principalmente para facilitar a dissolução de fármacos (PRISTA et al., 1995). Portanto, a quantidade desses excipientes adicionados à formulação deve ser bem controlada, considerando que são adjuvantes críticos e, portanto, interferem na biodisponibilidade dos medicamentos (AMIDON et al., 1995; SILVA; VOLPATO, 2002; MARTINEZ; AMIDON, 2002; BRASIL, 2011b). O dióxido de titânio, além de corantes óxidos, sicovit e verniz são adicionados à formulação para auxiliar na identificação de FFSOLI e também para aumentar a adesão terapêutica, pois a medicação colorida facilita a identificação do medicamento pelo paciente. , o que é importante principalmente para indivíduos polimedicados e também contribui para que as crianças, induzidas pela cor, tomem a medicação quando necessário (ANSEL et al., 2007).
Caracterização dos medicamentos
- Determinação de peso
- Desintegração
- Teor
- Perfis de dissolução dos produtos contendo valsartana
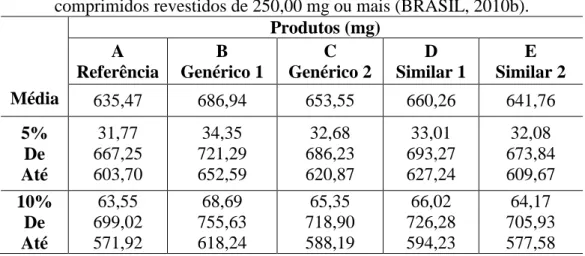
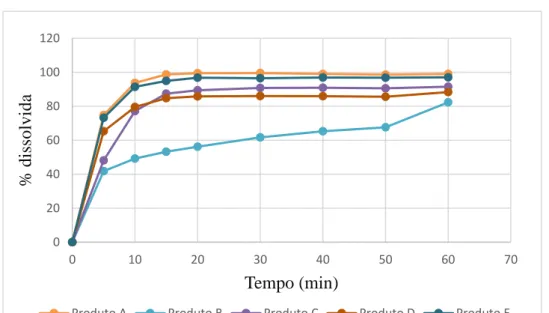
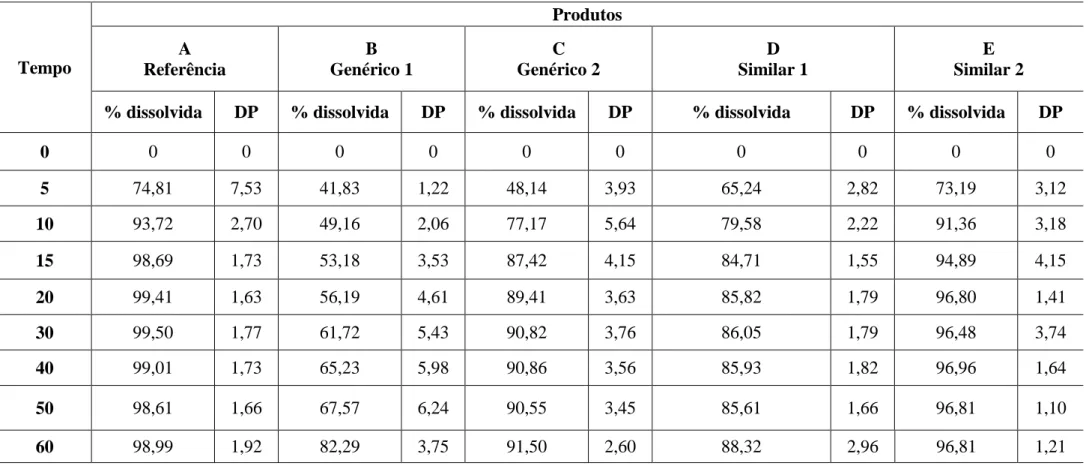
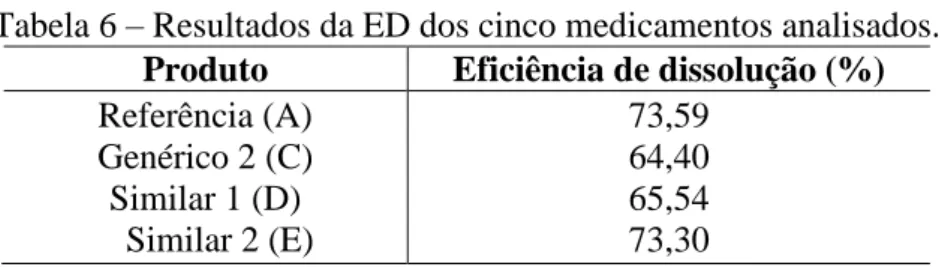
O gráfico dos perfis de dissolução dos cinco fármacos analisados bem como os resultados médios no meio SESSE (pH=6,8) é mostrado na Figura 1. De acordo com os perfis de dissolução obtidos (Figura 1) e os resultados médios (n) = 12) (Tabela 8), pode-se observar que os produtos A, C e E (referência, genérico 2 e similar 2, respectivamente) apresentaram dissolução muito rápida (≥ 85% em 15 minutos) da valsartana. Para a análise dos perfis de dissolução foi utilizada a eficiência de dissolução (DE), uma vez que o fator de similaridade (F2) para fármacos com liberação muito rápida (≥ 85% em 15 minutos), modelo geralmente utilizado (BRASIL, 2011a) ) perde sua capacidade discriminativa.
Isso pode ser observado na figura, a partir das diferenças entre as eficiências de dissolução que apresentaram valores mais próximos entre o produto E e A. A semelhança entre os perfis dos produtos A (referência) e E (semelhante 2), pode ter ocorrido devido à presença de lauril sulfato de sódio no produto E, que pode ter facilitado o processo de dissolução do fármaco. Assim, embora C e D apresentem em sua composição lactose monoidratada, que é um diluente que tende a facilitar a dissolução de fármacos pouco solúveis, como a valsartana, a velocidade de dissolução dos dois produtos ainda foi inferior à de E.
Além disso, vale ressaltar que o processo de dissolução do produto teste em relação ao produto referência deve ser o mais semelhante possível, visto que a dissolução do fármaco afeta diretamente sua biodisponibilidade, conforme mencionado anteriormente. Analisando os resultados obtidos neste trabalho de acordo com os perfis de dissolução, pode-se deduzir que a intercambialidade entre o produto E e a referência A pode ser considerada segura, pois se mostraram equivalentes com perfis de dissolução semelhantes. Quanto à possibilidade de intercambialidade entre medicamentos genérico-genérico, similar-similar e genérico-similar, nossos resultados mostram que o risco de inequivalência terapêutica pode ser ainda maior devido às diferenças existentes na comparação da eficiência de dissolução desses medicamentos.
CONCLUSÃO
6.360, de 23 de setembro de 1976, que dispõe sobre a vigilância sanitária, institui o medicamento genérico, dispõe sobre o uso de nomes genéricos em produtos farmacêuticos e dá outras providências. Fornece orientação sobre a exclusão e substituição de estudos de biodisponibilidade relativa/bioequivalência e outras disposições. Dispõe sobre a lista de medicamentos candidatos à bioexclusão com base no sistema de classificação biofarmacêutica (SCB) e dá outras providências.
Dispõe sobre as medidas a serem adotadas junto à Anvisa pelos titulares de registro de medicamentos para a. International guidelines for the bioequivalence of systemically available orally administered generic drugs: a study of similarities and differences. Waiver of in vivo bioavailability and bioequivalence studies for immediate-release solid oral dosage forms based on a biopharmaceutical classification system.
Agentes dissolventes de comprimidos de nimesulida: ação de surfactantes, Revista Brasileira de Ciências Farmacêuticas, v. Considerações biofarmacêuticas relevantes na fabricação de medicamentos genéricos: fatores que afetam a dissolução e absorção de medicamentos. Proposta de dispensa da bioequivalência in vivo para a lista modelo da OMS de medicamentos essenciais para formas farmacêuticas sólidas orais de liberação imediata.