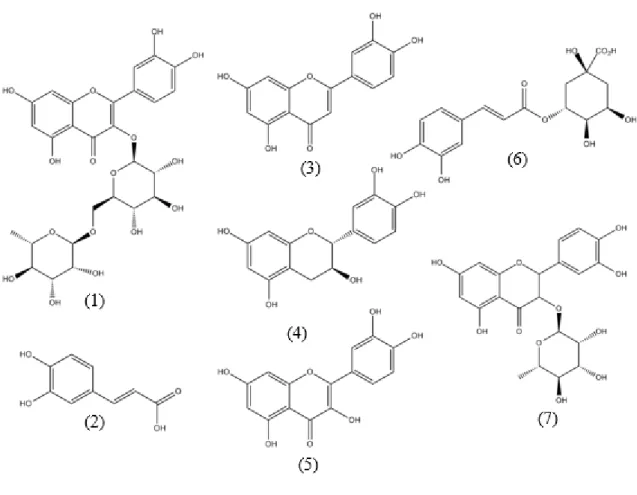
AVALIAÇÃO DA ATIVIDADE ANTIOXIDANTE, CONTEÚDO EM COMPOSTOS FENÓLICOS E INIBIÇÃO DA XANTIEN OXIDASE DO EXTRATO ETANÓLICO DOS FRUTOS DE. Avaliação da atividade antioxidante, teor de compostos fenólicos e inibição da xantina oxidase do extrato etanólico do fruto de Guazuma ulmifolia Lam. O EEM na concentração de 100 µg/ml apresentou, pelo método de sequestro do radical DPPH, atividade antioxidante (AA) inferior a 50% de descoloração branca.
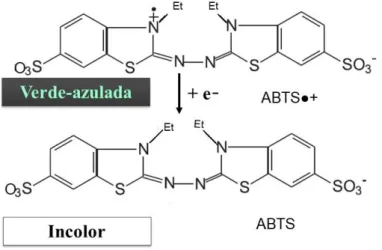
Os resultados obtidos mostraram que o EEM apresentou teor intermediário em compostos fenólicos e baixa atividade antioxidante com os métodos utilizados. ABTS•+: ácido 2,2'-azino-bis-(3-etilbenzotiazolina-6-sulfônico) na forma de radical (radical) HPLC/DAD: cromatografia líquida de alta eficiência acoplada a detector de arranjo de fotodiodos.
INTRODUÇÃO
OBJETIVOS
Objetivos específicos
REVISÃO DE LITERATURA 1 Características botânicas
- Características econômicas
- Características medicinais
- Características ecológicas
- Estudo farmacognóstico
- Estudo fitoquímico
- Atividade antioxidante
- Xantina oxidase
A casca do tronco é utilizada para extrair fibras utilizadas na confecção de cordas e tecidos (NUNES et al., 2005). Extratos de folhas e frutas são usados para fazer xampus, condicionadores, óleos aromáticos e perfumes. Os frutos são usados no Nordeste do Brasil para fazer o chamado "óleo-de-mutamba", usado para prevenir a queda de cabelo.
Os consumidores de chá dessas frutas substituem o chá-mate pelo chá de frutas secas da mutamba (GUARIM NETO, 1984), o motivo não é claro. Esta última propriedade se deve à presença de taninos antioxidantes, que atuam como protetores capilares e previnem a formação de radicais livres (NUNES et al., 2005, GALINA et al., 2005). É uma estrutura anfifílica, ou seja, há uma parte da estrutura com uma propriedade lipofílica (triterpeno ou esteroide) e outra hidrofílica (açúcares), (CASTEJON, 2011).
A sua natureza polifenólica permite-lhes neutralizar os radicais livres nocivos, como os radicais superóxido e hidroxilo. São produtos de reações endógenas, ou seja, do próprio organismo, ou são produzidos por fatores exógenos, ou seja, por fatores externos como o tabagismo, entre outros. Além disso, as proteínas, que também têm papel fundamental no organismo, são danificadas pelos radicais livres, levando ao desenvolvimento de doenças cardiovasculares, câncer e doenças do envelhecimento, que estão relacionadas à ocorrência de reações com os radicais livres no organismo.
No entanto, eles devem estar presentes em quantidades suficientes, ou seja, dentro do limite fisiológico, caso contrário, haverá efeitos prejudiciais nos tecidos se não houver antioxidantes disponíveis para neutralizar o excesso de radicais livres.
MATERIAIS e MÉTODOS
- Obtenção e preparo do material vegetal
- Preparo do extrato etanólico dos frutos secos e pulverizados
- Soluções
- Preparo da fase móvel CLAE/DAD
- Preparo da solução com EEM
- Solução de carbonato de sódio [ (Na 2 CO 3 ) 10% p/v ]
- Solução de DPPH 0,38mM
- Solução de persulfato de potássio 140mM
- Solução estoque de ABTS 7mM
- Preparo do radical ABTS •+
- Solução estoque de ácido gálico
- Solução estoque de quercetina a 200 µg/ml
- Caracterização por CLAE/DAD .1 Especificações do método
- Procedimento
- Avaliação do teor de compostos fenólicos no extrato
- Avaliação da atividade antioxidante
- Avaliação por captura de radical ABTS +
- Avaliação por captura de radical DPPH•
- Avaliação do potencial de inibição da xantina oxidase pelo extrato etanólico .1 - Preparo das soluções
1 g de carbonato foi adicionado a um balão volumétrico de 10 ml e uma pequena quantidade de água destilada foi adicionada para dissolver o carbonato, finalmente o volume foi completado com água destilada. Na primeira tentativa, a corrida cromatográfica foi iniciada com 100% de água acidificada e aos 83 minutos a concentração foi alterada para 100% de acetonitrila, voltando para 100% de água. Na segunda tentativa, a etapa cromatográfica iniciou com 98% de água acidificada e 2% de acetonitrila e aos 83 minutos a concentração foi alterada para 80% de água acidificada e 20% de acetonitrila, retornando para 100% de acetonitrila aos 85 minutos.
Na terceira tentativa, iniciou-se a corrida cromatográfica com 98% de água acidificada e 2% de acetonitrila e após 20 minutos a concentração foi alterada para 80% de água acidificada e 20% de acetonitrila, retornando para 100% de acetonitrila após 40 minutos. Na quarta tentativa, a corrida cromatográfica foi iniciada com 98% de água acidificada e 2% de acetonitrila e após 60 minutos a concentração foi alterada para 100% de acetonitrila. Na quinta tentativa a corrida cromatográfica iniciou com 98% de água acidificada e 2% de acetonitrila e após 10 minutos a concentração foi alterada para 80% de água acidificada e 20% de acetonitrila, após 30 minutos a concentração foi alterada para 40% de água acidificada e 60% acetonitrila, retornando a 100% de acetonitrila após 60 minutos.
No sexto experimento, iniciou-se o processo cromatográfico com 98% de água desnaturada e 2% de acetonitrila e após 15 minutos a concentração foi alterada para 90% de água desnaturada e 10% de acetonitrila, após 30 minutos a concentração para 60% de água desnaturada e 40% de acetonitrila após 45 minutos a concentração mudou para 40% de água acidificada e 60% de acetonitrila, retornando para 100% de acetonitrila após 60 minutos. No sétimo experimento, o processo cromatográfico foi iniciado com 100% de água acidificada e após 30 minutos a concentração foi alterada para 100% de acetonitrila. No nono experimento, que apresentou o melhor cromatograma, inicialmente era água 100% acidificada, após 35 minutos atingiu 100% de acetonitrila e após 5 minutos novamente 100%.
Foi feita outra tentativa (décima tentativa), iniciando a corrida cromatográfica com 90% de água acidificada e 10% de acetonitrila e após 5 minutos a concentração foi alterada para 80% de água acidificada e 20% de acetonitrila, após 10 minutos a concentração foi alterada para 70% água acidificada e 30% de acetonitrila, após 15 minutos a concentração foi alterada para 60% de água acidificada e 40% de acetonitrila, após 20 minutos a concentração foi alterada para 40% de água acidificada e 60% de acetonitrila, após 25 minutos a concentração foi alterada para 100% de acetonitrila, após 30 minutos a concentração foi reduzida para 90% de água acidificada e 10% de acetonitrila, até o final da corrida, que durou 33 minutos.

RESULTADOS
- Rendimento da extração etanólica
- Perfil cromatográfico (impressão digital) do extrato etanólico por CLAE-DAD
- Teor em compostos fenólicos
- Atividade antioxidante in vitro pela captura do radical DPPH •
- Avaliação in vitro da inibição da xantina oxidase
A Figura 12 mostra a coloração de diferentes concentrações de ácido gálico e a curva analítica obtida através das absorções de ácido gálico e suas respectivas concentrações é mostrada na figura 13. A partir desta curva foi possível obter a equação da reta, essencial para o cálculo de a concentração de compostos fenólicos no extrato etanólico. A partir da equação da reta (y=0,0116x+0,055), obtida a partir da curva analítica do ácido gálico, calculou-se o teor de compostos fenólicos presentes no MEE, substituindo o valor de y pela leitura média na equação e a reta obtida em três exemplares do EEM.
A Figura 14 mostra o gráfico elaborado no LAPLAMED, por Araújo (2016a), com o objetivo de obter a curva analítica do trolox para que, comparando a reta gerada a partir desta curva, seja possível determinar a concentração do equivalente ao trolox em mM de EEM. Com base na comparação da linha reta obtida a partir da curva analítica de trolox, o valor da concentração de trolox equivalente em mM foi calculado a partir de EEM, que foi de 0,7214 mM equivalentes de trolox. Para obtenção do EEM AA pelo método de eliminação de radicais DPPH∙, foram utilizados os Abs do branco e os Abs do controle EEM para aplicar a fórmula informada no item 4.6.2.
Mesmo visualmente (Figura 15), foi possível perceber que a solução de EEM na concentração de 100 µg/ml não foi capaz de descolorir a solução do radical DPPH∙. A Tabela 2 informa sobre os valores teóricos da concentração de quercetina capaz de prender o radical DPPH∙ em 50%, com base nos valores obtidos experimentalmente com três diferentes concentrações de quercetina. Com relação ao aprisionamento do radical DPPH∙ pelo EEM na concentração de 100 µg/ml, o percentual médio de descoloração das três amostras de EEM foi de 1,53%.
A partir dessas equações de reta foi possível obter a inclinação da reta para uso na equação apresentada no ponto 4.7.2.
DISCUSSÃO
A atividade antioxidante de muitos compostos fenólicos é essencialmente o resultado da facilidade com que um átomo de hidrogênio do grupo hidroxila (OH) de sua estrutura aromática é doado a um radical livre, bem como sua capacidade de suportar um não-elétron. pelo seu movimento em torno de todo o sistema eletrônico da molécula a (DUTHIE et al, 2003). No estudo de DURAISWANY et al (2018), foi detectada a presença de compostos fenólicos (27,2797 mg equivalente de ácido tânico/g peso seco de material vegetal) como fenol e tanino, mas flavonoides não foram detectados no extrato etanólico. frutos de G. Em estudo realizado por Vieira et al (2011), a atividade antioxidante in vitro contra o radical ABTS•+ foi de 3,690 mM com extrato hidroalcoólico de polpa de acerola, valor significativo.
Em um estudo realizado por Melo et al. (2008) foi observado que o efeito dos extratos de frutas testados nos ensaios de DPPH e β-caroteno/ácido linoleico foi diferente. Enquanto o extrato aquoso de acerola no ensaio DPPH apresentou maior capacidade de sequestrar o radical, no ensaio β-caroteno/ácido linoleico este extrato apresentou uma pequena porcentagem de inibição da oxidação, indicando que o DPPH interage melhor com compostos mais polares. Isso indica a existência de substâncias antioxidantes, o que torna necessária a mensuração da atividade antioxidante do EEM por meio do sistema β-caroteno/ácido linoleico, que consiste em avaliar a capacidade de determinada substância em prevenir a oxidação do β-caroteno e protegê-lo de radicais formados durante a peroxidação do ácido linoléico.
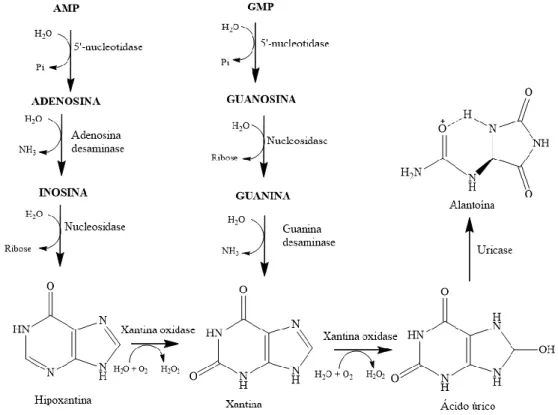
A xantina oxidase é uma enzima responsável pela conversão da hipoxantina em xantina (Figura 4) e desta em ácido úrico durante o metabolismo das purinas. Nesse processo de formação do ácido úrico, são produzidos o peróxido de hidrogênio e o radical superóxido, portanto essa via metabólica é considerada uma das principais fontes biológicas de espécies reativas de oxigênio. Assim, a inibição desse processo enzimático por compostos que exibem propriedades antioxidantes ou inibidoras da xantina oxidase pode ter aplicações terapêuticas (RAO et al, 2003 e DEW et al, 2005).
A inibição da xantina oxidase foi estudada no Laboratório de Plantas Medicinais da Faculdade de Farmácia da UFOP, onde existiam várias espécies e várias delas já apresentavam atividade sobre a xantina oxidase, dentre as quais podemos citar Lychnophora trichocarpha (DE SOUZA et al., 2012). ; Bernardes et al., 2019), Campomaniasia Velutina (Araújo, 2016b), Tabebuia Roseoalba (Ferraz-Filha et al, 2016), Lychnophora ericoides, Lychnophora Passerina, Lychorilha e Lychoriops) e Lychoriops) e outros.
CONCLUSÃO
Determinação da composição química, propriedades antioxidantes e antimicrobianas do óleo essencial de Guzuma ulmifolia American Journal of Essential Oils and Natural Products .1. As propriedades antidiabéticas de Guazuma ulmifolia Lam são mediadas pela estimulação da captação de glicose em adipócitos normais e diabéticos sem induzir adipogênese. Laboratório de Plantas Medicinais, Faculdade de Farmácia, Universidade Federal de Ouro Preto, Ouro Preto, Minas Gerais, Brasil; Departamento de Química, Instituto Federal de Minas Gerais-Campus Ouro Preto, Ouro Preto, Minas Gerais, Brasil.
Universidade Estadual Paulista Júlio de Mesquita Filho (UNESP) – Graduação em Ciências Farmacêuticas – Campus de. Ararraquara, PS; Universidade Estadual de Maringá - Departamento de Biologia e Pós-Graduação em Ciências Farmacêuticas, PR. Universidade Federal do Rio de Janeiro – Instituto de Química, Universidade Federal Rural do Rio de Janeiro – Departamento de Química, RJ, Brasil.
Instituto de Ciências Biológicas da Universidade Federal de Goiás Revista da Universidade do Vale do Rio Verde, Três Corações, v. Malvaceae) em floresta estacional decidual no norte de Minas Gerais Laboratório de Ecologia e Reprodução Vegetal - Departamento de Biologia Geral, Universidade Estadual de Montes Claros, MG, Brasil. Obtenção de extratos de plantas do cerrado. Programa de Pós-Graduação em Zootecnia da Faculdade de Medicina Veterinária e Zootecnia da Universidade Federal de Goiás. ENCYCLOPÉDIA BIOSFERA, Centro Científico Saber - Goiânia, v.13 n.23;.
Universidade Federal de Alagoas, Universidade Federal do Rio Grande do Sul e Universidade Estadual de Campinas.