36 Figura 9 - Análise do ciclo celular de células HEPG2 tratadas com nanocápsulas livres, nanoencapsuladas e vazias e benznidazol por 24 horas. 41 Figura 11 - Análise do ciclo celular de células H9c2 tratadas com licnofolide livre, nanoencapsulado, nanocápsulas vazias e benznidazol por 24 horas.
Doença de chagas e o Trypanozoma cruzi
Após a infecção e posterior período de incubação, inicia-se a fase aguda da CDh (PRATA, 2001). Na fase aguda, também podem aparecer os sinais iniciais de entrada do parasita, como edema palpebral (sinal de Romaña) e subcutâneo (chagoma de inoculação), que auxiliam muito na suspeita clínica de DCh (PRATA, 2001).
Epidemiologia
Quando sintomático, pode apresentar manifestações clínicas como: febre, edema, mialgia, hipertrofia linfonodal, hepatomegalia, esplenomegalia e sintomas neurológicos. Com o desenvolvimento da resposta imune do hospedeiro, as manifestações clínicas da fase aguda regridem e gradualmente se instala a fase crônica, onde a parasitemia é escassa e subpatente, mas persistente ao longo da vida.
Diagnóstico e prevenção
Segundo Cançado (1999), a taxa de cura é maior na fase aguda da doença, ao contrário da fase crônica, que tem uma soroconversão negativa lenta. Soma-se a tudo isso a falta de incentivo quanto à indicação do tratamento da DCh por parte da classe médica.
Produtos naturais
Nesse sentido, a DCh caracteriza-se como uma doença negligenciada do ponto de vista terapêutico, devido à falta de investimento em novas terapias por parte da indústria farmacêutica, decorrente das características socioeconômicas da população mais acometida e da evolução dos programas de controle para a doença DCh ocorrendo em países endêmicos (SCHOFIELD, 2006). Além disso, a ausência de marcadores de cura e progressão da doença, culminando na falta de incentivo da comunidade médica quanto à indicação de tratamento para DCh, também dificulta o desenvolvimento de ensaios clínicos de novos medicamentos, limitando suas pesquisas.
Novos tratamentos
Para realizar a evolução dos estudos in vitro para in vivo, Romanha et al. (2010) também outros critérios que tiveram que ser avaliados, como (IV) aspectos éticos quanto ao uso de animais em experimentos com vistas à utilização de um número reduzido deles; (V) limitação de infraestrutura; (VI) custos e tempo envolvidos para o laboratório; (VII) risco de infecção em humanos. Durante os estudos in vivo, os critérios a serem avaliados são: (I) determinação da toxicidade aguda em modelos murinos [dose máxima tolerada (MTD)]; (II) redução da parasitemia na fase aguda e critérios de corte para seleção de compostos; (III) marcadores parasitológicos na fase aguda (cepas parcialmente sensíveis e resistentes de T. .. cruzi) e critérios de corte para seleção.
Licnofolida
20 para analisar a fase crônica da infecção, sendo também uma forma de fornecer mais uma alternativa para pacientes resistentes ao BZ. Em estudos envolvendo quimioterapia Dch, Romanha et al. (2010) estabelecem alguns critérios a serem avaliados: para realizar todo o procedimento do estudo in vitro, deve-se (I) definir a linhagem celular a ser utilizada, bem como a cepa e a forma dos parasitos; (II) automatizar procedimentos; (III) determinar pontos importantes no estudo como IC50 (a concentração da substância que elimina 50% dos parasitas), índice de seletividade (SI) e comparar esses pontos com o medicamento padrão, BZ. A quimioterapia para doença de Chagas com essas drogas é difícil de seguir devido aos seus efeitos colaterais recorrentes e, além disso, são ativas apenas nas fases aguda e crônica recente da doença, onde a parasitemia é evidente, e não têm ação significativa contra as formas de não. tecido parasitário encontrado na fase crônica da doença (COURA e CASTRO, 2002, DIAS, 2015).
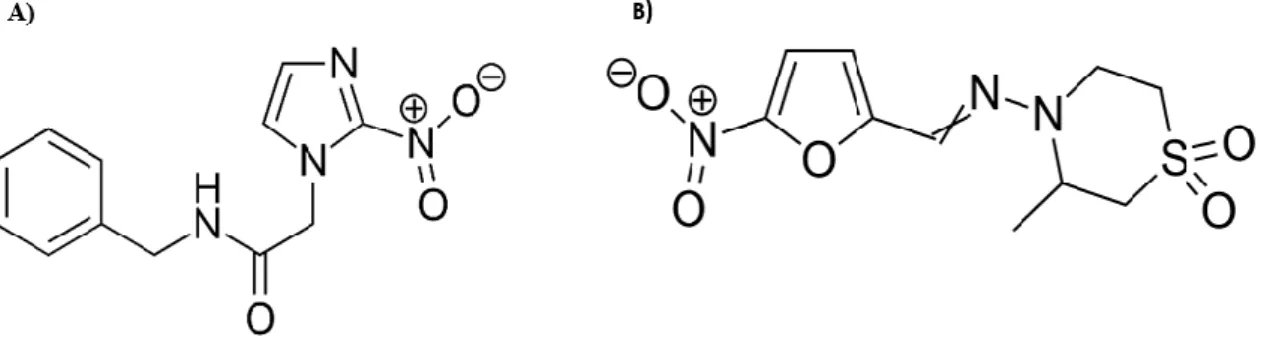
Esse insucesso da quimioterapia para doença de Chagas, aliado ao desinteresse das indústrias farmacêuticas e órgãos governamentais em combatê-la, indica a necessidade da busca de novas substâncias que sejam ativas contra o T. Sabendo disso, justifica-se este trabalho para avaliar a atividade tripanocida in vitro a produção do sesquiterpeno licnofolido lactona (LIC), isolado de Lychnophora trichocarpha e LIC já foi extensivamente estudada in vivo por nosso grupo de pesquisa, com resultados bastante promissores, alcançando até 100% de cura em camundongos na fase crônica da doença (BRANQUINHO et al 2014; MELLO et al., 2016). Este é um estudo preliminar onde a lactona será estudada in vitro e in vivo para validar sua ação anti-T.
Avaliar a toxicidade in vivo e in vitro a citotoxicidade e a atividade tripanocida do sesquiterpeno lactona licnofolida (livre e em nanocápsulas) contra as formas epimastigota e amastigota do Trypanosoma cruzi.
Substâncias e fármaco utilizados
Licnofolida e formulações nanoestruturadas
Solução Lic, Lic-NC e benznidazol
Benznidazol
Estudo da atividade citotóxica in vitro da Lic, Lic-NC, NC-BR e do benznidazol Células da linhagem H9c2 (American Type Culture Collection, ATCC: CRL 1446) e
- Cultivos de células H9c2 e HEPG2
- Preparo das placas com as células H9c2 e HEPG2
- Ensaio de citotoxicidade da Lic, Lic-NC e NC-BR em células H9c2 e HEPG2 utilizando o vermelho neutro
- Ensaio de toxicidade da lic, Lic-NC e NC-BR em células H9c2 e HEPG2 utilizando o ensaio de ciclo celular
- Ensaio de toxicidade Lic, Lic-NC e NC-BR em células H9c2 e HEPG2 utilizando o ensaio de apoptose necrose
- Índice de Seletividade
- Análises hematológicas e bioquímicas
Ensaio de citotoxicidade de Lic, Lic-NC e NC-BR em células H9c2 e HEPG2 usando vermelho neutro usando vermelho neutro. Ensaio de toxicidade de lic, Lic-NC e NC-BR em células H9c2 e HEPG2 usando um ensaio de ciclo celular usando um ensaio de ciclo celular. Ensaio de toxicidade de Lic, Lic-NC e NC-BR em células H9c2 e HEPG2 usando ensaio de apoptose necrose.
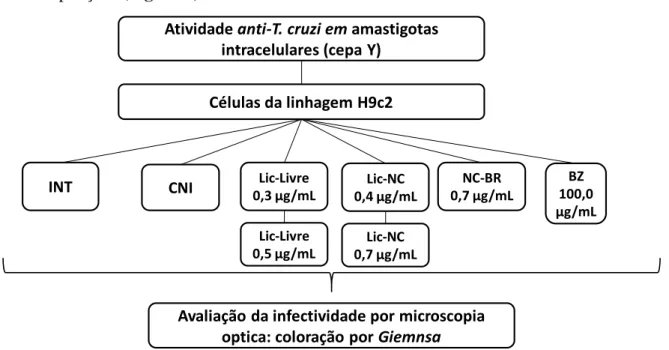
Em seguida, as células foram marcadas com iodeto de propídio e anexina V, conforme instruções do kit. Avaliação do efeito do tratamento com Lic, Lic-NC e NC-BR sobre amastigotas da linhagem T Y. As concentrações iniciais de LIC, LIC-NC e BZ foram definidas a partir de experimentos preliminares com Neutral Red.
Licnofolida livre; Lic-NC: Lycnofolide Nanoencapsulado; NC-BR: nanocápsula branca CNI: Controle não infectado (células não infectadas e não tratadas); BZ: Benznidazol (agente de referência);.
Resultados in vitro
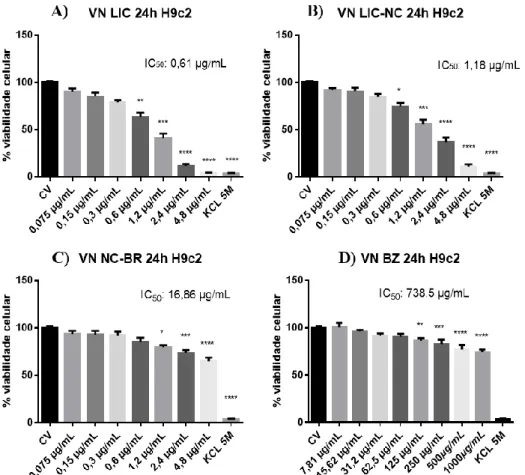
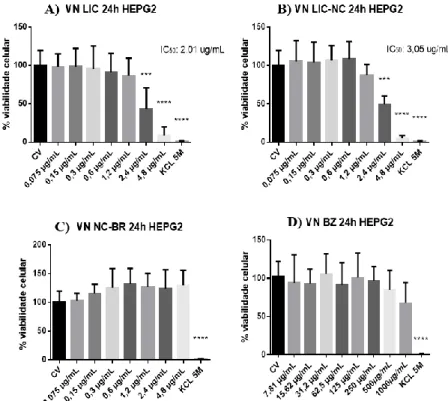
Ensaio de citotoxicidade da Lic, Lic-NC, NC-BR e BZ em células H9c2 e HEPG2 utilizando o vermelho neutro
IC = IC50: concentração do composto capaz de induzir a morte celular em 50%; CV - Células de controle de viabilidade. Ao observar o grupo de células controle tratadas com NC-BR, é possível observar um aumento no número de células em relação ao VC, mas não de forma significativa (Figura 8C). Além disso, não houve diferença significativa entre tratamento e CV no grupo de células tratadas com BZ (Figura 8D).
A partir da observação dos valores de viabilidade celular foi possível calcular com o auxílio do software CompuSym os valores das concentrações inibitórias de 50% (IC50), concentração onde 50% das células no teste das substâncias utilizadas para avaliação da atividade anti-T. Assim, para células H9c2, valores de IC50 de 0,61 µg/mL e 1,18 µg/mL foram observados nos tratamentos com Lic-free e Lic-NC, respectivamente. Nas células dos grupos controle tratados por 24 horas com NC-BR e BZ, não foi possível obter valores de IC50 (Figura 8).
As concentrações de Lic-free e Lic-NC foram assim definidas para avaliação de anti-T.
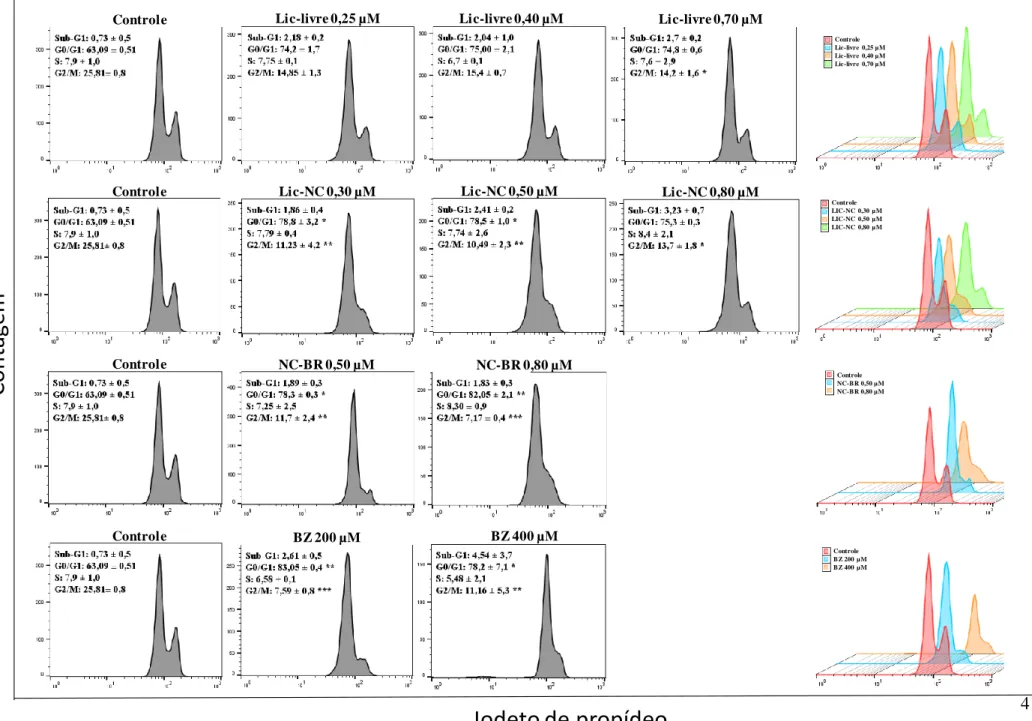
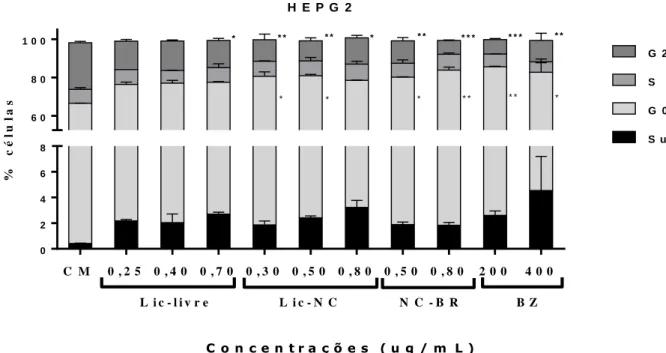
Ensaio de citotoxicidade Lic, Lic-NC, NC-BR e BZ em células HEPG2 e H9c2 usando ensaio de ciclo celular.
HEPG2
42 Em relação aos resultados obtidos com células cardíacas H9c2, observou-se aumento significativo do parâmetro Sub-G1 (diploide e baixa síntese de material genético com possível necrose celular) nos grupos tratados com 0,70 μg/mL sem Lic e LIC-NC. 0,80 µg/mL em comparação com o grupo controle CM. Também houve aumento significativo em todos os grupos nos tratamentos teste em relação ao parâmetro G0-G1, fase em que ocorre a multiplicação das organelas e o aumento do volume celular. Ao analisar a parte do ciclo celular dedicada à fase proliferativa G2-M, observa-se uma diminuição no número de todas as células nos grupos tratados em relação ao grupo controle CM (figura 11).
Não houve diferença significativa em relação ao parâmetro S do ciclo celular em nenhum dos tratamentos avaliados (figura 11).
Iodeto de propídeo
44 6.1.3 Ensaio de toxicidade de Lic, Lic-NC, NC-BR e BZ em células H9c2 e HEPG2 usando ensaio de apoptose necrose. Não foram observadas alterações significativas nas taxas de apoptose ou necrose em células HEPG2 após o tratamento com os compostos avaliados (Figuras 13 e 14). P1: Células em estado de necrose; Q2: Células em apoptose tardia; P3: Células em apoptose recente; P4: Células saudáveis.
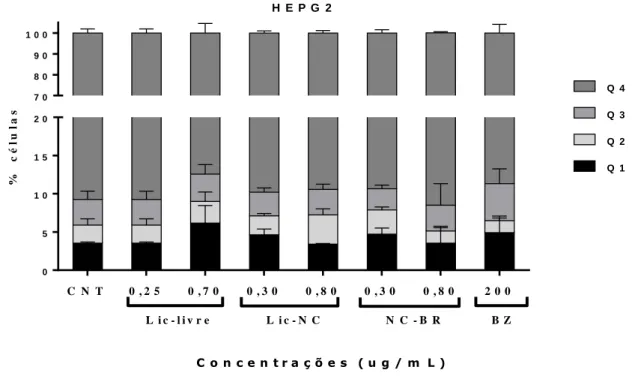
FITC
As formulações de NC-BR foram incapazes de inibir significativamente esta forma do parasita em comparação com o controle (Figura 17). Não foi possível calcular o IC50 das formulações de NC-BR, pois a atividade tripanocida não foi significativa, tornando os resultados inconclusivos. A avaliação da atividade de Lic-free, Lic-NC, NC-BR e BZ em células H9c2 infectadas com a cepa Y de T .
Nas células H9c2 infectadas isoladamente e incubadas com o meio de cultura (células infectadas e não tratadas - INT), houve um EI de 50% (dados não apresentados). De acordo com o gráfico de % de inibição de amastigotas pela concentração do composto testado (Figura 18), BZ teve a maior capacidade de inibir amastigotas, seguido por Lic-free 500 µg/ml e Lic-free 300 µg/ml. Os valores de % de inibição de amastigotas foram os mesmos para Lic-NC 400 µg/mL e Lic-NC 700 µg/mL.
Por fim, os valores de % de inibição de amastigotas foram próximos de zero e o índice de infectividade foi próximo de 100% para o NC-BR 700 µg/mL testado.
Inibição do
Um total de 1,0 x 104 células foram infectadas e então incubadas na presença de concentrações decrescentes de licnofolida livre, licnofolida nanoencapsulada e benznidazol por 24 h. INT: controle infectado não tratado; BZ: Benznidazol; LIC: Lycnofolida; IC50 = Concentração efetiva: a concentração da droga que reduz o número de parasitas em 50%; * indica diferença significativa em relação aos compostos administrados em relação ao grupo INT (controle infectado e não tratado) (p<0,05). A partir da observação dos valores de viabilidade celular, foi possível calcular, por meio do software CompuSym, os valores da concentração inibitória de 50% (IC50), concentração na qual ocorre a morte de 50% dos parasitas intracelulares teste. de substâncias analisadas, apresentadas na tabela 1.
Dados de EI: índice endocítico (%) e % de inibição de EI foram realizados em relação ao controle INT (controle infectado não tratado); EI: Índice Endocítico = % infecção x número de amastigotas por célula infectada;
Atividade dos tratamentos com formulações de Lic, Lic-NC e NC-BR em camundongos saudáveis
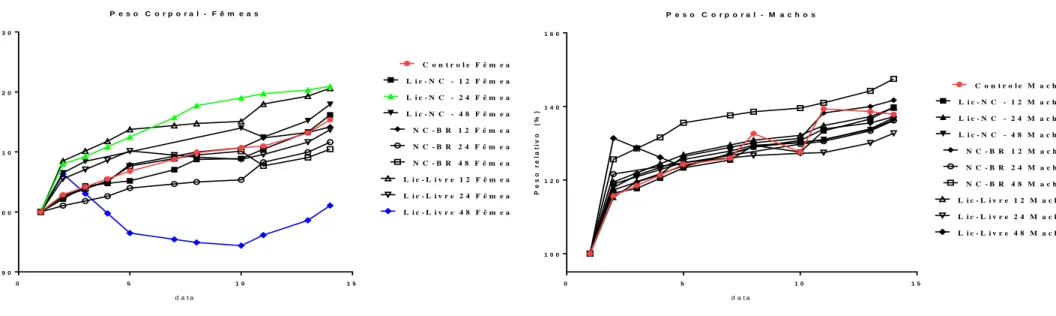
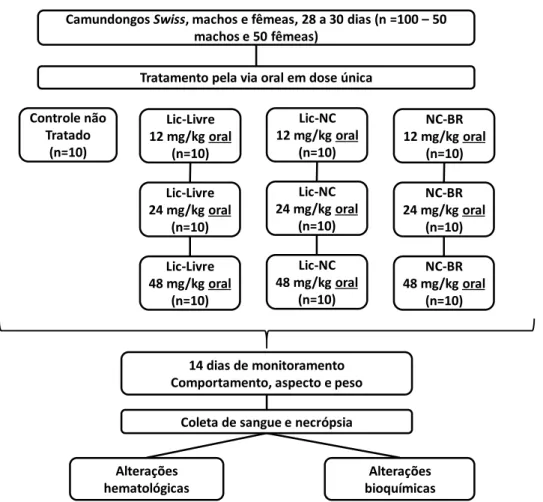
Para avaliar a atividade dos tratamentos com formulações Lic-free, Lic-NC e NC-BR em camundongos saudáveis, alguns aspectos de toxicidade aguda foram avaliados para analisar possíveis alterações comportamentais, aspectos físicos, peso, alterações bioquímicas e hematológicas. Não foram observados sinais de toxicidade ou alterações comportamentais após o tratamento com os compostos avaliados. No geral, não foram observados sinais de toxicidade após a administração das formulações e durante os 14 dias avaliados em comparação aos grupos controle.
Além disso, a perda de peso pode afetar o peso visceral (TEO et al., 2002) e é um parâmetro simples e sensível de toxicidade após exposição a tóxicos (THANABHORN et al., 2006). No geral, para os parâmetros de toxicidade aguda in vivo avaliados aqui, foi observada maior sensibilidade em camundongos fêmeas em comparação com machos tratados com licnofolide livre ou nanoencapsulado, com apenas o último resultando em uma redução significativa no peso corporal e na mortalidade associada. , em doses maiores. Autoimunidade na cardiopatia da doença de Chagas: significado biológico de um epítopo específico da miosina cardíaca com reação cruzada com o antígeno imunodominante do Trypanosoma cruzi.
Efficacy of Lychnopholide polymeric nanocapsules after oral and intravenous administration in murine experimental Chagas disease. The urgent need to develop new drugs and tools to treat Chagas disease. In vitro and in vivo experimental models for drug screening and development for Chagas disease.