Trabalho de conclusão de curso oferecido no Centro de Ciências Naturais da Universidade Federal de São Carlos, para obtenção do título de bacharel em engenharia ambiental. Agradeço também as grandes amizades que fiz durante os anos na Universidade Federal de São Carlos que levarei sempre em minha memória, um agradecimento especial a República Oscar Cavara e República Bee Rep pelas incríveis lembranças e aprendizados que levarei comigo para o resto da minha vida. Uma alternativa para esse tratamento é a inoculação de microalgas, pois as mesmas possuem potencial de remoção de nutrientes e poluentes para que não haja desequilíbrio ambiental grave no momento da remoção.
Com base neste ponto, este trabalho teve como objetivo utilizar TSE (Treated Sewage Effluent) como meio de cultura de microalgas, a fim de avaliar se é possível o desenvolvimento potencial de algas em águas residuárias. Como resultado, foi possível observar a adaptação das microalgas ao fluxo de FSB, bem como verificar que o processo de inoculação de algas para pós-tratamento é eficiente em termos de tempo de resposta do crescimento às condições de nutrientes pré-existentes e pH . No entanto, a qualidade do efluente não é desejável para lançamento em corpos hídricos, necessitando de pós-tratamento.
EMBRAPA - Empresa Brasileira de Pesquisa Agropecuária LANAPRE - Laboratório Nacional de Agricultura de Precisão PLANSAB - Plano Nacional de Saneamento Básico.
INTRODUÇÃO E JUSTIFICATIVA
De acordo com MARCELLO et al. 2015), geralmente é necessário ter tratamento terciário para águas residuais tratadas. Diante dessa necessidade, o presente trabalho se propõe a analisar, de forma preliminar, a eficiência da remoção de nutrientes utilizando microalgas para um pós-tratamento de efluente da fossa séptica do biodigestor, avaliando se o efluente após o tratamento está de acordo com as normas estabelecidas pelo CONAMA 430/11.
OBJETIVOS
OBJETIVO GERAL
OBJETIVOS ESPECÍFICOS
REVISÃO BIBLIOGRÁFICA
- Tratamento de Esgoto na Área Rural
- Fossa Séptica Biodigestora
- Microalgas
- Luz
- pH
- Temperatura
- Nutrientes
- Aeração
- Utilização de microalgas em águas residuárias
- Legislação para lançamento de efluentes
Alguns fatores são essenciais para o crescimento das microalgas, como luz, CO2, água, nutrientes, proteínas, açúcares e biomassa rica em lipídeos (CECCHIN, et al., 2018). Além disso, as microalgas são produtos nutricionalmente ricos em nutrientes, pois podem incorporá-los à sua biomassa e são utilizadas como suplementos em diversas áreas (GULDHE et al., 2017). Essa remoção de nutrientes pelas microalgas é diretamente dependente da intensidade luminosa e do fotoperíodo de exposição (SUTHERLAND et al., 2015; LI et al., 2019).
Alguns coeficientes determinam o crescimento e a composição bioquímica das microalgas, como luz, flutuação, intensidade e fotoperíodo, essas mudanças podem atrapalhar significativamente a composição dos lipídios (PANAHI et al., 2019). Os LEDs proporcionam um ambiente iluminado sem alterar a temperatura do experimento, mesmo com uso prolongado (HASAN et al., 2017). A utilização do pH ideal leva a um melhor desempenho de crescimento e acúmulo de carboidratos, correlacionado com a concentração de biomassa (HO et al., 2014).
No entanto, alguns estudos mostram que a produção de biomassa em pH alto, como 8,5 e 10, não demonstra inibição do crescimento de microalgas (VADLAMANI et al., 2017). A temperatura também pode afetar outros parâmetros, como a solubilidade do CO2 no ambiente e o valor do pH (BINNAL; BABU, 2017; XU et al., 2019). Além disso, a temperatura na faixa ótima de crescimento aumenta a tolerância ao alto brilho, evitando a fotoinibição (HUANG et al., 2019).
O fósforo também tem grande importância, pois é o elemento fundamental para a vida, que está presente no DNA, RNA, ATP, proteínas e lipídeos (SALAMA et al., 2017). No processo fotossintético, CO2 e energia luminosa são assimilados para formar biomassa e liberar oxigênio (SANTOS et al., 2021), além disso, também são utilizados nutrientes (polissacarídeos, proteínas, lipídeos e hidrocarbonetos). Desta forma, as microalgas colocadas em águas residuárias de esgoto tratadas podem desempenhar o papel de fonte secundária, devido à sua capacidade já comprovada de remover nutrientes (MOGES et al., 2020).
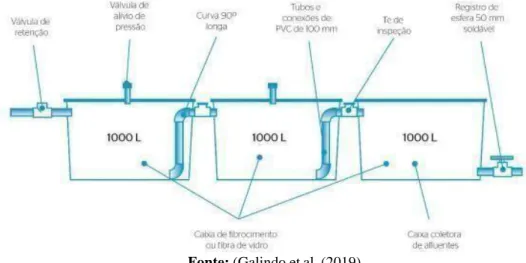
METODOLOGIA
- CARACTERIZAÇÃO DO LOCAL DA PESQUISA
- COLETA DE MICROALGA E EFLUENTE
- INOCULAÇÃO E CRESCIMENTO DAS ALGAS NO MEIO DECULTURA E NO
- Meio de cultivo com NH4OH, KH2PO4 e 100mL de alga
- Meio de cultivo com NaNO 3, KH 2 PO 4 e 100mL de alga
- Meio de cultivo com NaNO 3, KH 2 PO 4 e 250mL de alga
- Inserção de micronutrientes no meio de cultivo
- ANÁLISE E TRATAMENTO DOS DADOS
- ANÁLISE DOS RESÍDUOS SÓLIDOS
O efluente foi coletado no Laboratório Nacional de Referência em Agricultura de Precisão (LANAPRE), na latitude 47º51'10''W e latitude 21º57'13''S. INOCULAÇÃO E CRESCIMENTO DE ALGAS NO MEIO DE CULTIVO E NA SAÍDA DE ESGOTO TRATADO (TSE) CULTURA E NA SAÍDA DE ESGOTO TRATADO (TSE). A pesquisa foi realizada em uma sala com iluminação artificial, controle de temperatura e agitação (ambiente controlado) (Figura 3), na qual foi analisado o crescimento de microalgas para essas condições.
As metodologias consistiram em extrair quantidades de 50 ml e analisar pH, condutividade elétrica (CE), turbidez e espectroscopia UV-Vis. A pesquisa foi realizada em três fases, sendo a primeira fase utilizando meio de cultura e as duas últimas fases utilizando o efluente da fossa séptica. No primeiro meio de cultura, foi utilizada a solução de NH4OH (Hidróxido de Amônio) como fonte de nitrogênio e a solução de KH2PO4 (Fosfato de Potássio Monobásico) como fonte de fósforo.
Para o segundo meio de cultura, foi utilizada solução de NaNO3 (nitrato de sódio) como fonte de nitrogênio. 900 mL de efluente e 100 mL de microalgas foram adicionados a dois frascos Erlenmeyer, sendo que o pH foi ajustado para 6,5 em um frasco Erlenmeyer, enquanto o pH do efluente foi mantido no outro. A retirada de alíquotas de 50 ml foi repetida novamente para realização das análises de pH, turbidez e condutividade elétrica (CE) (Figura 8).
Para isso, os dados obtidos foram obtidos a partir da análise de pH utilizando um medidor de pH marca Simpla pHEC 140 previamente calibrado com soluções tampão 7 e 4. Para análise elementar de CHN, a composição média de C, H e N e relações H/C e C foram /N são realizados com um desvio padrão. Esta técnica foi realizada para identificar as principais funções químicas orgânicas na biomassa.Um espectrofotômetro de infravermelho Bruker, modelo Vertex 70, monitorado por um microcomputador com software Opus foi utilizado para análise de FTIR.
RESULTADOS E DISCUSSÕES
CARACTERÍSTICAS FÍSICO-QUÍMICAS GERAIS DO LÍQUIDOEM
- ETAPA I
- ETAPA II
- ETAPA III
Por outro lado, fatores físico-químicos como temperatura, iluminação, salinidade e disponibilidade de nutrientes podem influenciar, aumentar ou diminuir a geração de biomassa (FERNANDES et al., 2017). Outra hipótese de não crescimento foi o fato da microalga do tanque de piscicultura não ter se adaptado ao ambiente, pois segundo FERNANDES et al. 2017), um fator que pode inibir o crescimento das microalgas é a fase lag, onde nesta fase pode ocorrer uma espécie de inibição, pois uma cultura recém inoculada tende a se adaptar ao novo meio em que é colocada. Para a análise UV-Vis, a Figura 18 e a Figura 19 ilustram a diminuição da clorofila A ao longo do experimento.
Na Tabela 4, T0 foi considerado o início do experimento e T17 foi considerado o décimo sétimo dia do experimento. Analisando a Tabela 4, pode-se observar que em relação às características do efluente, houve diminuição do pH, diminuição do EC e leve aumento da turbidez. Esse resultado é compatível com os resultados de TAVARES et al., (2014), visto a presença dessa alta.
A resposta de crescimento microalgal aumentou com o aumento da agitação, que no início do experimento estava em 70 rpm e depois mudou para 96 rpm e novamente para 110 rpm, tendo um efeito positivo no desenvolvimento das algas. Segundo a literatura (CHEN; ZHAO; QI, 2015; SUPARMANIAM et al., 2019), no cultivo heterotrófico, as microalgas utilizam apenas compostos orgânicos como fonte de energia, e no modo mixotrófico, a fotossíntese é utilizada como fonte de energia, mas Te. Em comparação com os dados de LOPES, et al., 2017, o desenvolvimento de microalgas em pH alcalino também obteve maiores respostas de crescimento do que em pH neutro (7), consistente com os resultados obtidos.
Segundo dados de TRIPATHI et al. 2015) que avaliou a influência do pH em uma faixa de 7 e 10 e 18 horas de luz, a microalga obteve maior produtividade em pH 8, apresentando também melhor crescimento em meio alcalino. Analisando a CE, vale ressaltar que na amostra 125 mL pH 6,5 ela foi bem superior comparada com a amostra 125 mL pH EET. Isso porque, segundo dados de SUTHERLAND et al., (2015), com a adição de CO2 no cultivo de microalgas em efluentes em pH (8) e pH (6,5), foi observado um melhor rendimento de biomassa em pH ácido, entretanto, reduziu drasticamente sua eficiência na absorção de nutrientes do meio.

ANÁLISE DA BIOMASSA
- ANÁLISE POR MICROSCOPIA ÓPTICA
- ANÁLISE ELEMENTAR
- ANÁLISE FTIR
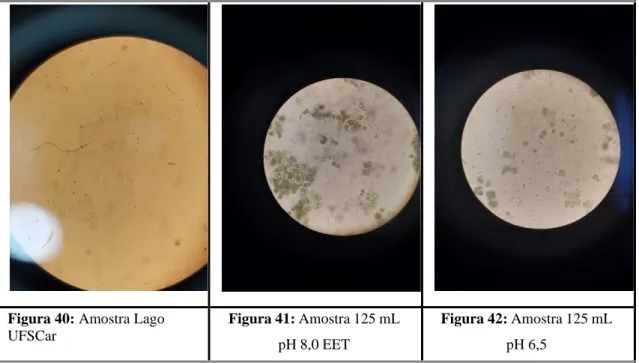
Fitoplâncton e representantes perifíticos de algas eucarióticas verdes (Chlorophyta) e diatomáceas (Heterokontophyta/Bacillariophyceae) e algas procarióticas, cianobactérias (Cyanophyta) foram observados. Em particular, foram observadas algas eucarióticas do gênero Scenedesmus (Clorophyta colonial), Chiamydomonas (Clorophyta unicelular com movimento de flagelos) e Navicula (Chrysophyta, diatomácea unicelular com movimento deslizante) e algas procarióticas Synechocystis (movimento unicelular, sem movimento). Para a amostra do lago da UFSCar, havia poucos espécimes de algas na amostra observada, como cianobactérias unicelulares e algas verdes (unicelulares e coloniais).
Ao analisar a microscopia da água do lago da UFSCar (Figura 40) com a microscopia da etapa III (Figura 41), notou-se que as mesmas observações feitas na etapa anterior (II) voltaram a ser vistas na etapa III, com pouco diferença entre as análises microscópicas. A única diferença encontrada entre os efluentes inoculados refere-se à presença de esporos fúngicos ao longo do inóculo. A amostra correspondente é de 125 ml pH 6,5 (Figura 42), com uma notável diminuição de células vivas e clorofila entre as amostras.
Ao final do processo, a biomassa gerada na etapa II foi levada para análise FTIR (Figuras 43 a 46). De maneira geral, pode-se observar que existe um padrão semelhante para as amostras analisadas, porém com intensidades diferentes. Na região de 2919 a 2852 cm-1, são encontrados trechos C-H simétricos e assimétricos, característicos de hidrocarbonetos e lipídios e seus derivados, que também são encontrados em todas as amostras.
A banda de 1744 cm-1 está relacionada ao trecho C=O presente em carbonilas (ésteres, cetonas, aldeídos e ácidos carboxílicos) que aparece em todas as amostras por apresentar o sinal de absorção mais intenso. Por fim, na região de 1200 a 1000 cm-1 é atribuída às ligações C-O-C, C-O e P=O e está relacionada a polissacarídeos e ácidos nucléicos, detectáveis em todas as amostras (BISPO, 2009). Nas proximidades da banda de 700 nm é evidente a presença de clorofila, observada em todas as amostras (TOLENTINO, 2008).
CONCLUSÕES
Uso da Técnica do Infravermelho por Transformada de Fourier (FTIR) para determinar as concentrações de carboidratos e lipídeos em Scenedesmus sp. Avaliação do crescimento da microalga Scenedesmus sp. em diferentes concentrações de NaCl Taxa de crescimento de microalgas. Cultivo heterotrófico de microalgas usando águas residuais de aquicultura: um conceito de biorrefinaria para produção de biomassa e remediação de nutrientes.
Tratamento de águas residuárias de melaço e produção de lipídeos em baixa temperatura por uma microalga mutante Scenedesmus sp. Impactos ambientais em unidades de conservação: Parque Nacional de Anavilhanas segundo especialistas envolvidos na visita. Avaliação do crescimento de microalgas na presença de material poroso à base de amido impregnado com óxido de zinco.
PINA, Luís Celso Cardoso de; LIRA, Evandro Bernardo de; COSTA, Maria Helena Juvito da; e outros Avaliação de um sistema de cultivo de microalgas com mistura de fotobiorreatores tubulares e de placas paralelas para a produção de biomassa de microalgas em meios de cultura alternativos. Dissertação (Mestrado) - Programa de Pós-Graduação - Ciências Ambientais da Universidade do Sul de Santa Catarina, Palhoça, 2019.
Comparison of photoautotrophic and mixotrophic cultivation of microalgae Messastrum gracile (Chlorophyceae) in alternative culture media.







