UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE POS GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
CARACTERIZAÇÃO DO PERFIL IMUNOLÓGICO EM MULHERES PORTADORAS DO PAPILOMAVÍRUS HUMANO
Daliana Caldas Pessoa da Silva
II UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE POS GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
CARACTERIZAÇÃO DO PERFIL IMUNOLÓGICO EM MULHERES PORTADORAS DO PAPILOMAVÍRUS HUMANO
Dissertação de mestrado apresentada ao programa de pós graduação em ciências da Saúde da Universidade Federal do Rio Grande do Norte
Para obtenção do título de grau mestre.
Orientador: Prof. Dr. Geraldo Barroso Cavalcanti Junior (UFRN) Co-orientadora: Profa. Dra. Ane Katerine Gonçalves (UFRN)
III UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE POS GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Coordenadora: Profa. Dra. Tércia Maria de Oliveira Maranhão
IV UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE POS GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
CARACTERIZAÇÃO DO PERFIL IMUNOLÓGICO EM MULHERES PORTADORAS DO PAPILOMAVÍRUS HUMANO
Banca Examinadora:
Presidente da Banca: Geraldo Barroso Cavalcanti Junior
Membros da Banca Examinadora:
Prof. Dr. Geraldo Barroso Cavalcanti Junior – UFRN Prof. Dr. Carlos Eduardo de Queiroz Lima – UFPE Profa. Dra. Valéria Soraya de Farias Sales - UFRN
V
“ Se pensar é o destino o ser humano, continuar
sonhando é o seu grande desafio. E isto, é
lógico, implica em trajetórias com riscos, em
vitórias, com muitas lutas, e não poucos
obstáculos pelo caminho. Apesar de tudo, seja
ousado. Liberte sua criatividade. E NUNCA DESISTA
DOS SEUS SONHOS, pois eles transformarão sua vida
em uma grande aventura”
VI
DEDICATÓRIA
Aos meus pais e avó, Dailor Bezerra Pessoa, Maria de Fátima Caldas Pessoa e Izabel Fernandes Caldas, grandiosos mestres, conselheiros e educadores, pelos fiéis exemplos de vida, amor, dedicação e perseverança. Agradeço de coração o carinho, incentivo e apoio constantes, que nunca mediram esforços para me fazer seguir em frente na busca de meus sonhos.
A minha filha, Isabelle Caldas Pessoa da Silva, que através de seu amor e carinho em todas as horas, me incentivou a prosseguir.
VII
AGRADECIMENTO
À Deus, pelo dom da vida e por sempre me iluminar e guiar meus caminhos.
Ao Prof. Geraldo Barroso Cavalcanti Junior, que através de sua amizade, confiança e orientação foi fundamental tanto no meu conhecimento científico profissional como pessoal. Obrigada eternamente, professor Geraldo!!!! Sempre levarei comigo seu exemplo de vida, ética, humildade e solidariedade.
À Prof. Janaina Crispim Freitas, pela amizade, atenção e assessoria científica constante. A sua presença foi extremamente importante ao meu amadurecimento científico. Gratidão eterna, querida professora, ao seu incentivo e apoio que nunca me faltaram desde o início do nosso encontro.
À Prof. Ana Katherine da Silveira Gonçalves, pela atenção, colaboração e auxílio científico.
Àos amigos Rosana Lucena de Sá Leitão, Roberto Chaves de Vasconcelos pela atenção e colaboração. Ainda por disponibilizar o laboratório de citometria de fluxo do Hemonort, para realização da imunofenotipagem das pacientes.
Ao colega José Queiroz Filho, não apenas pela colaboração científica, mas principalmente pelo valor da eterna amizade, companheirismo e apoio nas dificuldades e alegrias.
A amigo graduando Diego, pela amizade e excelente auxilio técnico.
VIII LISTA DE ABREVIATURAS
APCs: Células Apresentadoras de Antígenos
DCs: Células Dendríticas
HMC: Complexo de Histocompatibilidade
HPV: Papiloma vírus Humano
ISTs: Infecção Sexualmente Transmissíveis
LGG: Linfócitos Grandes Granulados
LIE: Linfócitos intra epiteliais
LSIL: Lesão Intraepitelial Cervical de Baixo Grau
NK: Natural Killer
NKT:
RPM: Rotação Por Minuto
TH: T. Helper
IX LISTA DE FIGURAS
FIGURA 01
Representação esquemática do genoma do HPV: E (Early do inglês) são genes precoces, L (Late do inglês) são genes tardios e URR (upstream Region Regulation) é a região reguladora da replicação viral.
03
FIGURA 02
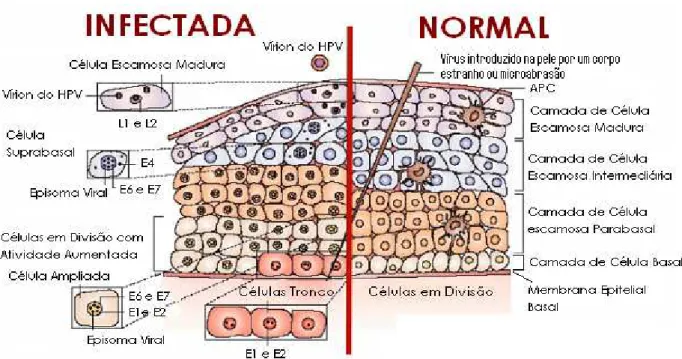
Replicação do HPV relacionada à diferenciação das células do epitélio escamoso estratificado da cérvice uterina mostrando um epitélio cervical normal e um infectado pelo vírus HPV
08
FIGURA 03 Células escamosas com características coilocíticas 13
FIGURA 04 Representação esquemática do perfil imunológico por cintometria de fluxo de uma paciente com lesão
induzida por HPV.
17
FIGURA 05 Representação esquemática do perfil imunológico por
cintometria de fluxo de uma paciente do grupo controle. 18
FIGURA 06 Distribuição da leucometria em mulheres HPV+ e HPV-. 31
FIGURA 07 Distribuição da contagem de linfócitos em mulheres
HPV+ e HPV-. 32
FIGURA 08 Distribuição da contagem de monócitos em mulheres
HPV+ e HPV- 33
FIGURA 09 Distribuição da contagem de granulócitos em mulheres
HPV+ e HPV-. 34
FIGURA 10 Distribuição dos valores de linfócitos TCD3+ em
mulheres HPV+ e HPV-. 35
FIGURA 11 Distribuição dos valores de linfócitos BCD19+ em
mulheres HPV+ e HPV-. 36
FIGURA 12 Distribuição dos valores de linfócitos TCD4+ em
mulheres HPV+ e HPV-. 37
FIGURA 13 Distribuição dos valores de linfócitos TCD8+ em
X FIGURA 14 Distribuição da relação CD4/CD8 em mulheres HPV+ e
HPV-. 39
FIGURA 15 Distribuição dos valores de células NK (CD16-56+) em
mulheres HPV+ e HPV-. 40
FIGURA 16 Distribuição dos valores de células NKT
XI LISTA DE TABELAS
TABELA 01 Valores de referência da sub-população linfocitária. 16
TABELA 02 Características gerais e parâmetros hematológicos
das mulheres pertencentes ao grupo controle. 23
TABELA 03 Características gerais e parâmetros hematológicos
das mulheres infectadas pelo HPV 24
TABELA 04 Porcentagem de pacientes portadoras de HPV de alto risco e de baixo risco oncongênico. 25
TABELA 05
Parâmetros clínicos e epidemiológicos de 30 pacientes com LSIL estratificada por idade, tipo de lesão, presença oncogênico de baixo grau (destaque em verde) e alto risco (destaque em vermelho) do HPV e perfil imunológico.
26
TABELA 06 Perfil imunológico das mulheres pertencentes ao
grupo controle 29
XII LISTA DE ANEXOS
XIII SUMÁRIO
LISTA DE ABREVIATURAS VIII
LISTA DE FIGURAS IX
LISTA DE TABELAS XI
LISTA DE ANEXOS XII
SUMÁRIO XIII
RESUMO XV
1 INTRODUÇÃO 1
1.1 CÂNCER DE COLO UTERINO 1
2 REVISÃO DA LITERATURA 3
2.1 BIOLOGIA E CARACTERIZAÇÃO DO HPV 3
2.2 TÉCNICAS DE DETECÇÃO DO HPV 4
2.3 O HPV E A INTERFERÊNCIA NO SISTEMA IMUNOLÓGICO DO
HOSPEDEIRO 5
3 OBJETIVOS 9
3.1 OBJETIVO GERAL 9
3.2 OBJETIVO ESPECÍFICO 9
4 CASUÍSTICA E METODOLOGIA 10
4.1 CARACTERIZAÇÃO DA PESQUISA 10
4.2 PARTICIPANTES 10
4.3 CRITÉRIO DE EXCLUSÃO 10
XIV
4.4.1 AMOSTRAS BIOLÓGICAS 11
4.5 PROCEDIMENTOS 11
4.5.1 METODOLOGIA DA CITOLOGIA ONCÓTICA
UTILIZANDO A COLORAÇÃO DE PAPANICOLAOU 12
4.5.2 METODOLOGIA DA CITOMETRIA DE FLUXO NO
ESTUDO DO PERFIL IMUNOLÓGICO 14
4.5.2.1 ANÁLISE HEMATOLÓGICA DE PACIENTES E
GRUPO CONTROLE 14
4.5.2.2 ANÁLISE DE CITOMETRIA DE FLUXO DE
PERFIL IMUNOLÓGICO 14
4.5.3 METODOLOGIA DA CAPTURA HÍBRIDA 19
4.6 ANÁLISE ESTATÍSTICA 19
5 RESULTADOS 21
5.1 CARACTERÍSTICAS GERAIS E PARÂMETROS
HEMATOLÓGICOS DA POPULAÇÃO INVESTIGADA. 21
5.2 DETECÇÃO DO PAPILOMAVÍRUS HUMANO EM AMOSTRAS DE
CITOLOGIA CERVICAL 25
5.3 INVESTIGAÇÃO DOS PARÂMETROS IMUNOLÓGICOS DA
POPULAÇÃO ANALISADA 27
6 DISCUSSÃO 42
7 CONCLUSÃO 46
8 REFERÊNCIAS BIBLIOGRÁFICAS 47
9 ABSTRACT 54
XV
Resumo
O câncer de colo uterino consiste em um problema de grande relevância social, visto que se trata da segunda malignidade ginecológica mais freqüente no mundo. O principal precursor do câncer da cérvice uterina consiste na infecção pelo Papiloma vírus humano (HPV). O HPV tem despertado grande interesse na comunidade científica, devido à relação estabelecida entre a sua epidemiologia e o câncer de cérvice uterina. Apesar do grande avanço na biologia do HPV, pouco se sabe acerca da resposta imunológica a este vírus. O Papilomavírus humano (HPV) é um DNA vírus epiteliotrófico, que está vinculado à carcinogênese do colo uterino por meio de evidências epidemiológicas e laboratoriais. As infecções pelo HPV ocorrem em mulheres em todo o mundo. Existe consenso na literatura quanto à associação do DNA – HPV com as neoplasias intra – epiteliais cervicais e o câncer cervical. Por este motivo é de grande importância a detecção precoce deste tipo de infecção para que seja efetuado um tratamento específico. Esse trabalho está caracterizando o perfil imunológico de pacientes portadoras de HPV através da quantificação linfocitária (TCD4, TCD8, células NKT e células NK), e correlacionou esse material à técnica de captura híbrida, para poder comprovar a infecção pelo HPV, esperando assim contribuir precocemente para o diagnóstico do câncer de colo uterino.
XVI
1.INTRODUÇÃO
1.1– CÂNCER DE COLO UTERINO
O câncer cervical é a segunda neoplasia mais prevalente entre mulheres no Brasil e no mundo(KODON K., 2009). Dados estimam que 231.000 mortes anualmente desta doença e cerca de 80% delas são oriundas dos países em desenvolvimento (BOSCH, FXAN, et al., 2008;BRASIL mds, 2008).
A infecção persistente pelo Papiloma vírus Humano (HPV), do tipo oncogênico desempenha papel preponderante no desenvolvimento do câncer do colo uterino, sendo esse vírus detectado em quase todas as lesões pré – malignas e neoplásicas cervicais. (REIMERS et al., 2009; WOLSCHICK et al, 2011).
Além da infecção pelo HPV, existem também outros fatores de risco envolvidos na carcinogênese cervical tais como: baixo nível sócio-econômico, início precoce da atividade sexual, multiplicidade de parceiros sexuais, tabagismo, higiene íntima inadequada, uso prolongado de contraceptivos orais, doenças sexualmente transmissíveis (DST) e imunossupressão (AU, 2004; BOARDMAN, COOPER et al., 2004; FRANCESCHI, 2005; TRIMBLE, GENKINGER et al, 2005; WANG et al.,2009).
A carcinogênese cervical é um processo que se desenvolve em múltiplas etapas (MUNOZ et al, 2003; MOSCICKI et al, 2006). A infecção persistente por um ou mais tipos de Papillomavírus humano (HPV) oncogênico e a transformação do epitélio infectado em neoplásico constituem em uma das etapas mais importantes desse processo (MOSCICKI etal, 2006).
XVII
A capacidade do indivíduo de eliminar a infecção pelo HPV seria determinada por fatores genéticos, possivelmente, atuando através de mecanismos imunológicos (GHADERI et al., 2002).
A resposta imune do hospedeiro é considerada hoje um fator determinante da carcinogênese cervical, portanto a elucidação do perfil imunológico desencadeada no organismo pelo HPV e relacionada ao tipo de resposta imune provocada pela células T e sub-populações T helper (CD3+ CD4+), supressor citotóxico (CD3+ CD8+) e células natural Killer (NK), pode contribuir para o monitoramento das pacientes com lesão intra epitelial cervical
XVIII
1.1.1.1.1.1 2. REVISÃO DA LITERATURA
2.1 – BIOLOGIA E CARACTERIZAÇÃO DO HPV
O Papilomavírus Humano (HPV) é um vírus de dupla fita circular de DNA (figura 01) com comprimento de 7900 Kilobases de forma icosaédrica, não envelopado, com 72 caspsômeros e pertence à família Papillomaviridae. O HPV é classificado conforme a espécie de hospedeiro natural e subclassificado em tipos de acordo com as seqüências de nucleotídeos de DNA (ICTV, 2003; BURT, 2003).
Após a integração dos HPVs de alto risco no genoma celular, esses passam a codificar as oncoproteínas E6 e E7 que promovem o processo maligno. A célula hospedeira possui genes supressores de tumores pRb e p53. O gene Rb é o principal regulador do ciclo celular e o gene (p53) é chamado de “guardião do genoma”, pois tem finalidade de supervisionar se todos os genes estão íntegros.
XIX
Os HPVs dos tipos 6 e 11 induzem a condilomas que afetam a pele anogenital e parte inferior da vagina, sendo detectado nas lesões intraepiteliais escamosa de baixo grau (LSIL) e são considerados de baixo risco porque estão envolvidas em lesões benignas. Os HPVs dos tipos 16, 18, 30, 31, 33, 34, 35, 45, 51, 52, 56, 58, 59, 66, 68 e 70 são fortemente associados com câncer intra – epitelial cervical, sendo considerados de alto risco e prevalecem em cânceres anogenitais (GOMPEL, 1997; PINHO et al.,2003; VARGAS et al.,2004).
2.2 – TÉCNICAS DE IDENTIFICAÇÃO DO HPV
Para determinação do câncer de colo de útero, o uso das técnicas atuais, como teste citopalógico, apesar de serem confiáveis, apresentam baixos índices de reprodutibilidade. Os testes moleculares, quando apresentam resultados positivos para tipos virais altamente oncogênicos, não determinam necessariamente o desenvolvimento de uma displasia, sendo necessários vários outros fatores concomitantes. Portanto, novas técnicas citológicas de análises prediletivas, confiáveis e reprodutíveis devem ser admitidas(MADKAN et al., 2007).
XX
A Detecção do DNA do HPV pela técnica de captura hibrida é importante, mas se torna imperativo discriminar o tipo de HPV presente em materiais clínicos provenientes das mucosas genitais, a fim de verificar se os tipos presentes são de alto ou baixo potencial para desenvolvimento de neoplasias cervicais (BERNARD et al., 1994; VILLA, 2000).
A determinação do tipo de HPV pode auxiliar também na condução de um tratamento mais apropriado para pacientes acometidas por essa infecção viral.
2.3 – O HPV E A INTERFERÊNCIA NO SISTEMA IMUNOLÓGICO DO HOSPEDEIRO
O sistema imunológico da mucosa vaginal é formado pelos tecidos linfóides que estão associados à superfícies da mucosa vaginal. Agregados de tecidos linfóides não encapsulados são encontrados particularmente na lâmina própria tecidual, e na lâmina submersa do trato geniturinário (ROITT, 2003).
A mucosa geniturinária contém células dendríticas para a internalização, processamento e transporte de antígenos para os linfonodos drenantes (ROITT, 2003).
XXI
Existem vários tipos de linfócitos, porém não se consegue fazer diferenciação entre eles pela microscopia óptica convencional. Sendo somente a sua diferenciação por métodos imunológicos tais como: imunohistoquímica e ou imunofluorescência, detectado por meio de anticorpos monoclonais os antígenos são capazes de caracterizar estas células
A maioria dos linfócitos circulantes são do tipo T, e uma menor quantidade do tipo B e “Natural Killer (NK)”. Os linfócitos T possuem receptores especializados em reconhecer antígenos ligados a MHC na superfície de outras células, que pode ser do tipo alfa/beta (TCR ) ou gama/delta (TCR ). Na circulação sangüínea, ocorre o predomínio de células T com TCR e na mucosa vaginal com TCR . Existe a hipótese de que os linfócitos T TCR desempenhem função primordial na proteção das superfícies das mucosas (FIDLER, 2003; ROITT, 2003).
Funcionalmente os linfócitos T são classificados em: linfócitos T auxiliares, T supressores citotóxicos. Os linfócitos T auxiliares também chamados T helper (Th), possuem receptor CD4 que reconhece a molécula do complexo principal de histocompatibilidade classe II, atuam no reconhecimento de macrófagos ativados e são importantes “sinalizadores” através da produção de interleucinas, que interagem com outros tipos celulares. De acordo com as citocinas produzidas desenvolve-se uma resposta predominantemente celular (tipo Th1). Com o direcionamento de mais células da resposta imune inata e linfócitos T para o local da infecção, ou uma resposta predominantemente humoral (tipo Th2), induzindo o recrutamento de linfócitos B e produção de imunoglobulinas (ROITT, 2003; ABBAS 2008).
Os linfócitos T citotóxicos possuem receptores CD8 e são capazes de reconhecer e tolerar as moléculas de MHC de classe I autologa presente na superfície de outras células nucleadas e conseqüentemente exercer a ação de citotoxidade contra moléculas quando associadas a partículas virais ou se as mesmas forem geneticamente de outra origem (ABBAS, 2008).
XXII
Lymphocyte”. Estes linfócitos se caracterizam por apresentarem em seu citoplasma um abundante conteúdo de grandes grânulos de tonalidade violeta (grânulos azurófilos), quando corados por corantes hematológicos ( ABBAS 2008). Esses linfócitos são classicamente denominados de “células assassinas naturais” ou Natural Killer (NK) sendo do ponto de vista imunofenotípico idenficados por técnicas de imunofenotipagem pela expressão do antígeno CD 56, expressando também altos níveis de controle (FC) receptor para fração das imunoglobulinas (CD 16) ou ainda as enzimas granzimas e perfurinas que estão presentes nos grânulos acima citados (ROITT, 2003).
Cerca de 60 a 65% dos linfócitos circulantes nos adultos sadios correspondem a linfócitos T total. Destes, cerca de 35 a 50% correspondem as células TCD4+ e 25 a 30% as células TCD8+. As células NK correspondem a uma contagem em torno de 10 a 15% e os linfócitos B em torno de 10 a 20%. (LANIER, 1997).
As células NK usualmente lisam células alvo que não expressam moléculas MHC de classe I, tais como, células tumorais ou aquelas infectadas por vírus. Dessa forma, moléculas MHC clássicas de classe I, quando expressas na superfície das células nucleadas podem exercer um mecanismo protetor da lise mediada por células NK nas células saudáveis (BONTROP, 2000).
A região MHC de classe II possui genes que codificam as moléculas clássicas de histocompatibilidade de classe II, expressas normalmente nas células apresentadoras de antígenos (APCs), ou seja, nos monócitos, macrófagos, células dendríticas, células de Langerhans e linfócitos B (SULLIVAN et al., 2006). Do ponto de vista funcional, essas moléculas estão envolvidas na apresentação de peptídeos de origem extracelular, tais como bactérias, para células TCD4+ (TABAYOYONG et al., 2007). A ativação dessas células libera citocinas que atuam em diversas reações imunes (KELLY et al., 1991; SLOAN CAMERON et al., 1995).
XXIII
(precoces) são expressas em níveis baixos e, sobretudo, no núcleo celular e a produção de proteínas do capsídeo viral, altamente imunogênicas, é limitada a camada mais diferenciada e liberada ao epitélio, onde os sinais pró-inflamatórios são diminuídos. O HPV apresenta um perfil insuficiente para ativar a resposta imune do hospedeiro, uma vez que não há fase do ciclo de vida do HPV na corrente sanguínea, e apenas quantidades mínimas de replicação do vírus são expostas ao sistema imune, o vírus se torna praticamente imperceptível para o sistema imune do hospedeiro (KANODIA et al., 2007; STANLEY, 2008). Embora a resposta imune a infecção ao HPV seja pouco entendida, postula-se que a resposta imune celular (Th1) é prioritária em relação à resposta imune humoral (Th2). Ainda, a resposta imune do tipo Th1 pode gerar resposta específica dos linfócitos T citotóxicos, contribuindo para eliminação da infecção e regressão das lesões infectadas pelos tipos de HPV de baixo risco (GONÇALVES, 2004).
XXIV
3.0 – OBJETIVOS
3.1 - Geral:
Avaliar o perfil imunológico de mulheres portadoras do Papiloma Vírus Humano (HPV) por meio do perfil leucocitário, contagem de monócitos, granulócitos além de linfócitos total e subpopulações: i) Linfócitos B (LB), ii)
Linfócitos T (LT) e subpopulações LT Helper e LT Supressor Citotóxico e, iv)
células natural killer (NK).
3.2 - Específicos:
• Avaliar o efeito citopatologico compatível com HPV nas mulheres em estudo através da citologia oncótica.
• Tipificar os HPVs (em alto ou baixo grau) pela técnica de captura híbrida em mulheres cuja citologia cervico-vaginal apresentaram alterações citopatológicas compatíveis com HPV.
XXV 4 – DELINEAMENTO DO ESTUDO
4.1 – Caracterização da pesquisa:
O presente estudo foi conduzido mediante a aprovação do comitê de ética da Universidade Federal do Rio Grande do Norte. Este trabalho foi realizado por um estudo prospectivo, realizando inicialmente teste de captura híbrida nas mulheres com histórico de lesão cérvico-vaginal recorrente e estudo de perfil imunológico neste grupo de pacientes e em mulheres sadias que serviram como grupo controle.
4.2 – Participantes:
Esse estudo foi realizado com um grupo de 30 pacientes na faixa etária dos 18 aos 59 anos, cuja citologia oncótica cérvico vaginal apresentou efeito citopático para HPV e foram não reagentes para o teste de HIV, HVC e HbsAg, provenientes do serviço de citologia do laboratório Potengi.
O grupo controle foi composto de 30 pacientes saudáveis não portadoras de lesão cervico vaginal e sem HPV.
4.3 – Critérios de exclusão:
- Tabagistas
- Pacientes fora do grupo etário escolhido; - Pacientes gestantes;
XXVI
- pacientes com qualquer tipo de doenças do sistema imunológico: imunodeficiências, doenças inflamatórias e auto-imunes.
4.4 – Material:
4.4.1- Amostras biológicas a- Sangue periférico:
Amostras de sangue periférico (10 mL) foram obtidas através de punção de venosa, foram, coletadas por sistema a vácuo vacutainer (BECTON – DICKINSON – VACUTAINER SST BD). Tubos contendo anticoagulante, para a realização dos seguintes exames; hemograma e quantificação da sub-população linfocitária por citometria de fluxo.
Paralelamente a esses exames, todas as pacientes foram submetidas à testes sorológicos para Fator Reumatóide, HIV, HTLV, HVC e HbsAg, sendo todas soronegativas.
b- Raspado cérvico-vaginal:
Raspado das paredes vaginais, ecto e endocervice foram colocados em lâminas de vidro previamente identificadas, fixadas em álcool 96% para posterior coloração e leitura, com a finalidade de identificar a presença de coilócitos e discariose que são efeitos citopático para o vírus HPV. Parte das células escamosas foram acondicionadas em frasco contendo 1,5 mL de solução tampão t.E (Tris-HCL 10 mM pH 8,0; EDTA 1 mM) e estocadas a – 20º para ser utilizada a técnica de captura híbrida, onde foi identificado se o HPV era de alto ou de baixo risco oncogênico. Realizado no laboratório Alvaro.
XXVII 4.5.1 – Metodologia da citologia oncótica utilizando a coloração de Papanicolaou:
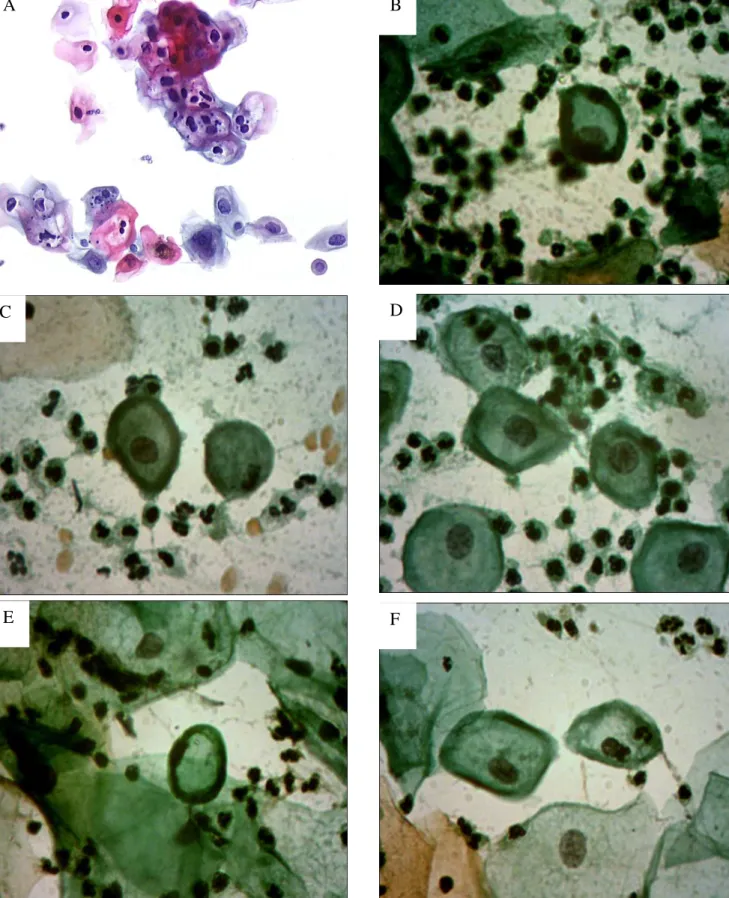
As Pacientes foram encaminhadas para o setor de anamnese, onde foi preenchida sua ficha, em seguida foi coletado material cervico vaginal das mesmas utilizando espátulas de Ayre e escova vaginal e confeccionado os esfregaços em duas lâminas sendo estas fixadas em álcool absoluto e em seguida foram coradas pela técnica de Papanicolaou, onde se analisou estas lâminas e observou a presença de coilócitos ou não, que caracteriza o efeito citopático compatível com HPV. Fig. 03.
XXVIII
A B
C D
E F
Figura 03 - Células escamosas com características coilocíticas. (Fonte: Própria)
A- Grupamentos de células escamosas maturas tipo superficiais e intermediárias apresentando binucleação, hipertrofia e hipercromasia nuclear com halos perinucleares que caracteriza a coilocitose. B- Células metaplásicas maturas com núcleos periféricos e espessa periferia citoplasmática, acentuado infiltrado leucocitário.
C- Células metaplásicas maturas com núcleo central pouco dilatado caracterizando um coilócito típico, infiltração leucocitária e hemácias.
D- Células intermediarias e metaplásicas com núcleos pouco volumosos e espessa periferia citoplasmática, infiltrado leucocitário.
E- Célula metaplásica com periferia citoplasmática espessa com núcleo excêntrico, leucócitos
XXIX 4.5.2 – Metodologia da citometria de fluxo no estudo do perfil imunológico:
4.5.2.1 - Análise hematológica de pacientes e grupo controle
Dez mililitros (10 mL) de sangue venoso periférico foi coletado em tubos vacutainer contendo EDTA e foram homogeneizados imediatamente. A contagem de glóbulos brancos (WBC), dosagem de hemoglobina, e contagem de plaquetas foram realizadas no analisador hematológico (Cell Dyn-3.000). A análise citomorfológica foi realizado em esfregaços de sangue corados pelo Leishmann. Um total de 100 leucócitos foram contados e o resultado marcado em porcentagem. Para conversão em valores absolutos, os valores percentuais foram multiplicados pela contagem de leucócitos absolutos e divididos por 100.
4.5.2.2 - Análise de citometria de fluxo de perfil imunológico:
A imunofenotipagem foi realizado em amostras de sangue periférico por citometria de fluxo. Marcadores de superfície celular foram identificados usando anticorpos monoclonais (MoAb) específico para: i) Linfócitos B e T (CD3FITC/CD19PE/CD45PerCP), ii) T helper e supressor de linfócitos citotóxicos (CD4FITC/CD8PE/CD3PerCP), iii) NK e células NKT (CD3FITC/CD16-56PE/CD45PerCP). Todos os AcMo foram adquiridos sistema Imunocitoquímica Becton-Dickinson,San Jose, CA.
XXX
Solution / Becton Dickinson). Em seguida, suspensão celular foi submetida a uma nova incubação por mais 10 minutos em temperatura ambiente ao abrigo da luz. Ao fim deste tempo, a suspensão celular foi centrifugada por 5 minutos a 1.500 RPM, o sobrenadante foi descartado e o sedimento celular ressuspendido em solução salina tamponada de fosfato (PBS, pH 7,2) e centrifugado novamente a 1.500 RPM; sendo esta última etapa foi repetida mais uma vez. Finalmente, o pellet celular foi ressuspenso em 1 mL solução de formol a 1% em PBS .
A leitura (aquisição das amostras) foi realizada em um total de 20 mil eventos (células) por tubo em um analisador de fluorescência celular ativado (FACScan, San Jose, CA, EUA), com software Cell Quest (Software Cell Quest-TM, Becton Dickinson Immunocytometry Systems, San Jose, CA, EUA)
.
Após a aquisição, as células foram analisadas pelos parâmentros determinado pelo espalhamento luminoso do laser sobre as células sanguíneas: Forward Scatter (FSC) em escala linear que avalia o tamanho celular e Side Scatter (SSC), também em escala linear, determinante da complexidade celular. Por meio destes parâmetros foi feito o procedimento de isolamento da população linfocitária (gate) e procedida a análise das fluorescências relativas FL1, FL2 e FL3 em escala logaritimica que detecta verde, laranja, vermelho e fluorescência, respectivamente, representativo da reação antígeno-anticorpo conjugado ao Isohtiocyanate fluorescein (FICT ), Phicoeritrin (PE), e Peridin Protein clorophyl (PerCP), respectivamente.
XXXI
Tabela 01 – Valores de referência da sub-população linfocitária.
Referência: Adaptado de SANTAGOSTINO et al, 1999.
Subpopulação Linfocitária Valores de Referência (%) / µL
Linfócitos T ou CD3 (60 – 87) / 605 - 2.460
Linfócito T Helper ou CD3+/CD4+ (32 - 61) / 600 - 1.666
Linfócito T Supressor Citotóxico ou CD3+/CD8+ (14 - 43) / 224 - 1.112
Células Natural killer ou CD16-56+ (04 - 28) / 73 - 654
Linfócitos B ou CD19 (05 - 20) / 72 - 520
XXXII Figura 4 – Representação esquemática do perfil imunológico por cintometria de fluxo de uma paciente com lesão induzida por HPV.
F E
C D
XXXIII Figura 5 – Representação esquemática do perfil imunológico por cintometria de fluxo de uma paciente do grupo controle..
A B
C D
XXXIV 4.5.3 – Metodologia da Captura Híbrida:
A detecção do DNA- HPV foi obtida através do exame de captura hibrida (Digene Diagnostic Inc®). O material para análise consistia de rapado endocervical, coletado com escova fornecida pelo laboratório. Após a coleta, a escova contendo o material biológico era condicionada em tubo com meio liquido especialmente desenvolvido para conservação das células com seu respectivo DNA. O processamento desse material biológico foi realizado no laboratório Álvaro, conforme protocolos técnicos do fabricante. A carga viral mensurada em URL/CP, por quimioluminômetro, com intensidade de luz proporcional a carga de DNA-HPV. Com o propósito de classificar os exames em positivos ou negativos, estabelecia-se, a cada processamento, um valor de corte para a intensidade de luz. Quando esta intensidade superava o valor de corte, considerava-se o exame como positivo; do contrário, era classificado como negativo. A proporção de URL/CP para considerar o exame como positivo era de 1, que corresponde a 1 pg/ml de DNA-HPV, ou 0,1 cópia e vírus/ célula.
Nas mulheres com exame positivo, dada a concentração de valores de carga viral desviada para a direita, optou-se por usar uma escala logarítmica de distribuição e agrupá-las graficamente em 1 a < 10, 10 a < 100, 100 a <1000 e > 1000 URL/CP. As sondas incluídas neste estudo eram dirigidas apenas aos tipos 16,18,31.33, 35, 39, 45, 51,52, 56, 58, 59 e 60, considerados de alto risco oncogênicos.
4.6 - Análise Estatística
XXXV
testes estatísticos e gráficos e considerados estatisticamente significativos quando p < 0,05.
Para melhor compreensão da correlação entre mulheres infectadas ou não pelo HPV e parâmetros hematológicos e imunológicos, foram confeccionados gráficos e calculadas médias, medianas, desvios, empregando o softwareMicrosoft ® Excel 2000 versão 9.0.
XXXVI
5. RESULTADOS
5.1. Características gerais e parâmetros hematológicos da população investigada.
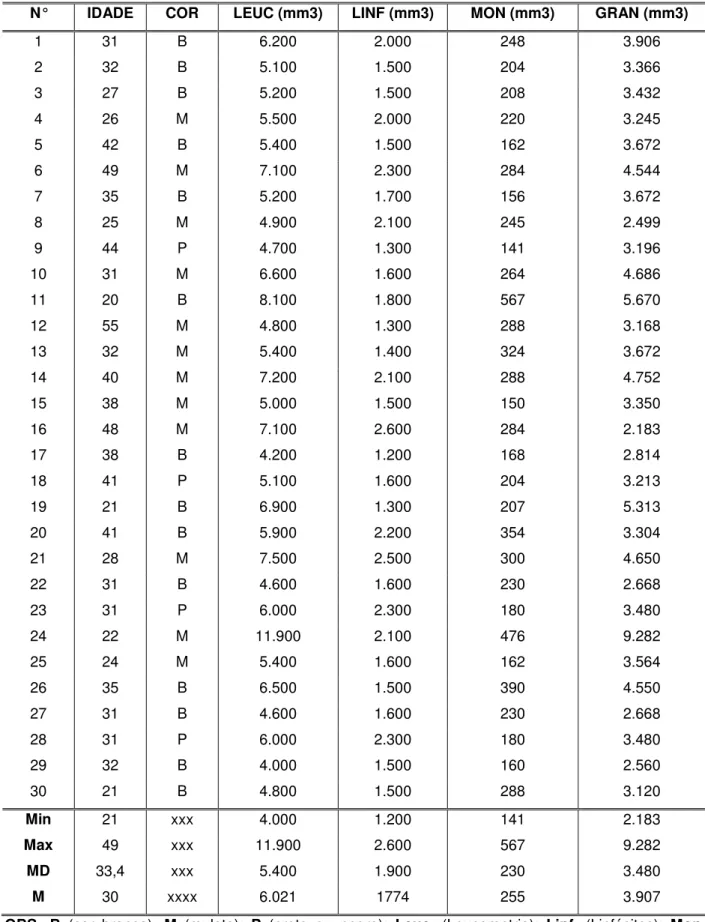
Nas 30 mulheres pertencentes ao grupo controle, 14 eram de cor branca, quatro pretas e 12 mulatas. Com relação à faixa etária, observou-se variação de 21 a 49 anos com media de 30 anos (Tabela 2).
Ainda neste grupo, a leucometria variou de 4.000 a 11.900/mm3 com media de 5.900/mm3. A contagem de linfócitos variou de 1.200/mm3 a 2.600/mm3, com mediana de 1.760/mm3. Com relação à contagem de monócitos observaram-se os seguintes resultados: i) mínimo de 140/mm3, ii) máximo de 476/mm3, iii) mediana de 252/mm3. A contagem mínima de granulócitos foi de 2.183/mm3, máxima de 9.282/mm3 e mediana de 3.789/mm3 (Tabela 2).
No grupo pertencente a mulheres infectadas pelo HPV, 20 eram de cor branca, uma preta e nove mulatas. Com relação à faixa etária, observou-se variação de 18 a 49 anos com media de 30 anos (Tabela 3).
Neste, grupo, a leucometria variou de 4.100 a 13.000/mm3 com média de 2.490/mm3. A contagem de linfócitos variou de 1.000/mm3 a 5.000/mm3, com mediana de 2.493/mm3. Com relação à contagem de monócitos, observaram-se os seguintes resultados: i) mínimo de 164/mm3, ii) máximo de 1.300/mm3, iii) mediana de 580/mm3. A contagem de granulócitos mínima foi de 2.625/mm3, máxima de 8.300/mm3 e mediana de 4.960/mm3 (Tabela 3).
XXXVII
XXXVIII
Tabela 2. Características gerais e parâmetros hematológicos das mulheres pertencentes ao grupo controle.
N° IDADE COR LEUC (mm3) LINF (mm3) MON (mm3) GRAN (mm3)
1 31 B 6.200 2.000 248 3.906
2 32 B 5.100 1.500 204 3.366
3 27 B 5.200 1.500 208 3.432
4 26 M 5.500 2.000 220 3.245
5 42 B 5.400 1.500 162 3.672
6 49 M 7.100 2.300 284 4.544
7 35 B 5.200 1.700 156 3.672
8 25 M 4.900 2.100 245 2.499
9 44 P 4.700 1.300 141 3.196
10 31 M 6.600 1.600 264 4.686
11 20 B 8.100 1.800 567 5.670
12 55 M 4.800 1.300 288 3.168
13 32 M 5.400 1.400 324 3.672
14 40 M 7.200 2.100 288 4.752
15 38 M 5.000 1.500 150 3.350
16 48 M 7.100 2.600 284 2.183
17 38 B 4.200 1.200 168 2.814
18 41 P 5.100 1.600 204 3.213
19 21 B 6.900 1.300 207 5.313
20 41 B 5.900 2.200 354 3.304
21 28 M 7.500 2.500 300 4.650
22 31 B 4.600 1.600 230 2.668
23 31 P 6.000 2.300 180 3.480
24 22 M 11.900 2.100 476 9.282
25 24 M 5.400 1.600 162 3.564
26 35 B 6.500 1.500 390 4.550
27 31 B 4.600 1.600 230 2.668
28 31 P 6.000 2.300 180 3.480
29 32 B 4.000 1.500 160 2.560
30 21 B 4.800 1.500 288 3.120
Min 21 xxx 4.000 1.200 141 2.183 Max 49 xxx 11.900 2.600 567 9.282 MD 33,4 xxx 5.400 1.900 230 3.480
M 30 xxxx 6.021 1774 255 3.907
XXXIX Tabela 3. Características gerais e parâmetros hematológicos das mulheres infectadas pelo HPV
N° IDADE COR LEUC (mm3) LINF (mm3) MON (mm3) GRAN (mm3)
01 39 B 7.100 1.400 710 5.396
02 42 B 5.700 1.800 570 3.306
03 24 B 8.600 3.000 774 4.730
04 30 B 8.400 1.700 840 5.796
05 34 B 5.000 1.000 700 3.300
06 29 M 9.500 2.600 1.235 5.605
07 31 B 5.000 1.700 400 2.900
08 44 M 5.000 1.900 450 2.650
09 38 B 6.500 2.400 650 3.380
10 38 B 8.000 1.600 560 4.560
11 29 B 7.000 2.100 270 4.340
12 48 M 7.500 3.300 247 2.625
13 35 M 9.000 3.500 540 4.950
14 35 M 11.000 4.100 660 6.160
15 32 B 8.700 3.000 435 5.220
16 34 B 5.000 1.200 250 3.500
17 30 B 9.000 2.700 540 5.760
18 34 M 10.000 3.000 500 6.500
19 18 M 10.000 3.900 500 5.600
20 39 B 6.000 2.300 300 3.300
21 35 B 13.000 3.300 1.300 8.300
22 27 M 11.300 3.300 452 7.400
23 34 M 4.100 1.200 164 2.700
24 36 B 7.000 2.500 280 4.200
25 43 P 9.800 3.100 784 5.800
26 40 B 12.000 3.000 840 7.400
27 35 B 11.800 5.000 826 8.300
28 35 B 7.000 2.200 490 4.270
29 42 B 8.500 1.700 765 6.035
30 35 B 6.500 1.300 390 4.810
Min 18 xxx 4.100 1.000 164 2.625 Max 49 xxx 13.000 5.000 1.300 8.300 Med 34,8 xxx 8.200 2.450 540 4.880
M 30 xxx 8.129 2.525 590 4.991
XL
5.2. Detecçãodo papilomavírus humanoemamostras decitologia cervical
De acordo comanálises citológicas, 30 (50%) pacientes apresentaram lesão
intraepitelial cervical de baixo grau ou LSIL do termo em inglês low grade squamous intraepithelial lesion, associadas ao HPV, diagnosticada pela citologia
cervicale 30 (50%) não apresentaram alterações associadas ao HPV (mulheres saudáveis). Para a confirmação da etiopatogenia das lesões e tipificação do HPV foi utilizada a técnica de captura híbrida nas pacientes com o vírus HPV e LSIL,
apresentado o seguinte resultado: oito 08 (27%) apresentaram HPV de alto
risco, 16 (53%) e 6 das 30 (20%) estavam infectadas com os dois tipos de HPV (Tabela4 e 5).
Tabela 4. Porcentagem de pacientes portadoras de HPV de alto risco e de baixo risco oncongênico.
Tipo de HPV Número de pacientes (%)
HPV – A 08 27,0%
HPV – B 16 53,0%
HPV AB 06 20%
XLI
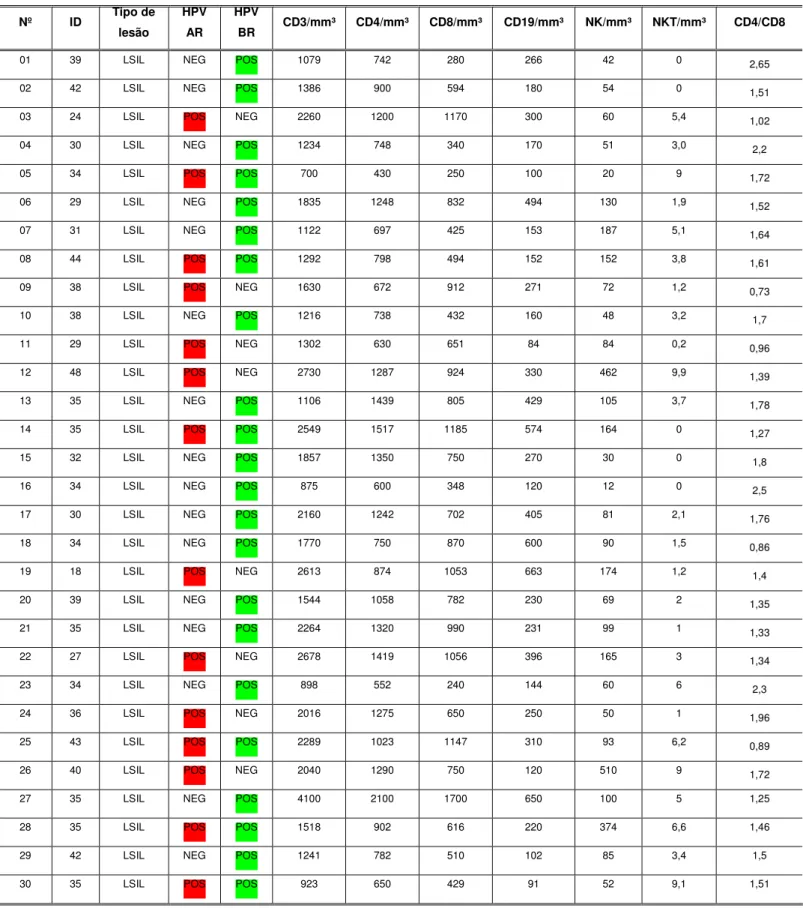
Tabela 5.Parâmetros clínicos e epidemiológicos de 30 pacientes com LSIL estratificada por idade, tipo de lesão, presença oncogênico de baixo grau ( destaque em verde) e alto risco (destaque em vermelho) do HPV e perfil imunológico.
Nº ID Tipo de lesão
HPV AR
HPV
BR CD3/mm³ CD4/mm³ CD8/mm³ CD19/mm³ NK/mm³ NKT/mm³ CD4/CD8
01 39 LSIL NEG POS 1079 742 280 266 42 0 2,65
02 42 LSIL NEG POS 1386 900 594 180 54 0 1,51
03 24 LSIL POS NEG 2260 1200 1170 300 60 5,4 1,02
04 30 LSIL NEG POS 1234 748 340 170 51 3,0 2,2
05 34 LSIL POS POS 700 430 250 100 20 9 1,72
06 29 LSIL NEG POS 1835 1248 832 494 130 1,9 1,52
07 31 LSIL NEG POS 1122 697 425 153 187 5,1 1,64
08 44 LSIL POS POS 1292 798 494 152 152 3,8 1,61
09 38 LSIL POS NEG 1630 672 912 271 72 1,2 0,73
10 38 LSIL NEG POS 1216 738 432 160 48 3,2 1,7
11 29 LSIL POS NEG 1302 630 651 84 84 0,2 0,96
12 48 LSIL POS NEG 2730 1287 924 330 462 9,9 1,39
13 35 LSIL NEG POS 1106 1439 805 429 105 3,7 1,78
14 35 LSIL POS POS 2549 1517 1185 574 164 0 1,27
15 32 LSIL NEG POS 1857 1350 750 270 30 0 1,8
16 34 LSIL NEG POS 875 600 348 120 12 0 2,5
17 30 LSIL NEG POS 2160 1242 702 405 81 2,1 1,76
18 34 LSIL NEG POS 1770 750 870 600 90 1,5 0,86
19 18 LSIL POS NEG 2613 874 1053 663 174 1,2 1,4
20 39 LSIL NEG POS 1544 1058 782 230 69 2 1,35
21 35 LSIL NEG POS 2264 1320 990 231 99 1 1,33
22 27 LSIL POS NEG 2678 1419 1056 396 165 3 1,34
23 34 LSIL NEG POS 898 552 240 144 60 6 2,3
24 36 LSIL POS NEG 2016 1275 650 250 50 1 1,96
25 43 LSIL POS POS 2289 1023 1147 310 93 6,2 0,89
26 40 LSIL POS NEG 2040 1290 750 120 510 9 1,72
27 35 LSIL NEG POS 4100 2100 1700 650 100 5 1,25
28 35 LSIL POS POS 1518 902 616 220 374 6,6 1,46
29 42 LSIL NEG POS 1241 782 510 102 85 3,4 1,5
30 35 LSIL POS POS 923 650 429 91 52 9,1 1,51
XLII
5.3. Investigação dos parâmetros imunológicos da população analisada
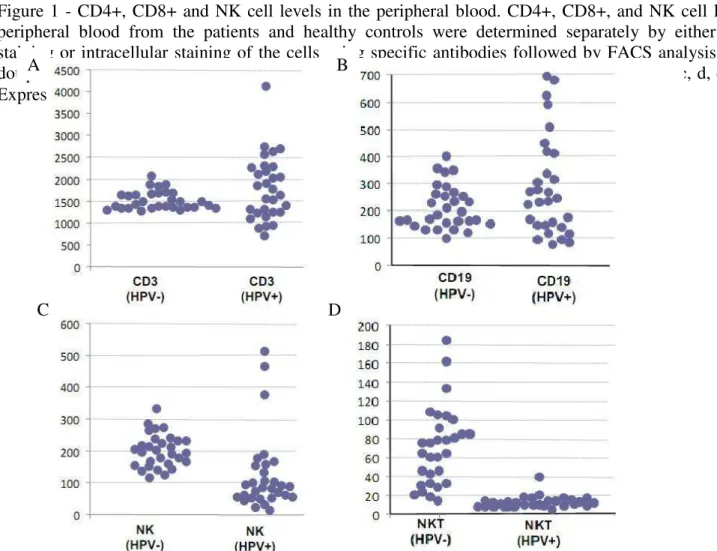
Com base na resposta imune aoHPV, investigamos possíveis associações entre HPV e avaliação quantitativa da subpopulação linfocitária determinada pela citometria de fluxo (Tabelas 5 a 7 e Figuras 10 a 16).
Na avaliação quantitativa do perfil imunológico determinado pela contagem ds
linfócitos T (CD3+) e subpopulações: T helper (CD3+/CD4+) e T
supressor/citotóxico (CD3+/CD8+), linfócitos B (CD19+), células NK
(CD16-56+/CD45+) e células NKT (CD3+/CD16-56+), constatou-se elevada contagem de
linfócitos TCD8+ predominantemente nas pacientes infectadas por HPV de alto risco quandocomparados com mulheres debaixo risco (Tabela5).
Na mulheres com DNA do HPV de alto risco, 5 das 8 pacientes (62,5%)
tiveram aumento da expressão de linfócitos TCD8+. Inversamente, considerando
apenas os pacientes com DNA de HPV de baixo risco, apenas 2 das 16 (12,5%) pacientes apresentaram um aumento de linfócitos CD8 positivos T quando comparado com pacientes que exibem alto risco DNA HPV. Além disso, a avaliação quantitativa deCD19 foi normal em pacientes que exibem LSILeHPV, quando comparado com o grupo controle composto por mulheressaudáveis (Tabela 5).
XLIII
CD4/CD8 mostraram-se dentro dos limites de normalidade conforme demonstrado anteriormente na tabela 2 (Tabela 6).
No grupo de mulheres infectadas pelo HPV, a contagem de linfócitos T variou de 700 a 4.100/mm3 com média de 1.700/mm3. A contagem de linfócitos T helper variou de 430/mm3 a 2.150/mm3 com mediana de 910/mm3. Para os linfócitos T supressor citotóxico constataram-se os seguintes níveis: contagem mínima de 280/mm3, máximo 1.700/mm3 e mediana de 728/mm3. Com relação às contagens de linfócitos B, observaram-se os seguintes resultados: mínimo de 84/mm3, máximo de 663/mm3 e mediana de 240mm3. A contagem mínima de células NK foi de 12/mm3, máxima de 510/mm3 e mediana de 84,5/mm3. As células NKT por sua vez observou-se ausência dessas células em 5 casos; contagem máxima de 30/mm3 e mediana de 3,3/mm3. Neste grupo, de mulheres, o cálculo da relação CD4/CD8 mostrou variação de 0,73 a 2,65 com mediana de 1,5 (Tabela 7).
XLIV Tabela 6. Perfil imunológico das mulheres pertencentes ao grupo controle
Caso n Linf. T CD3/m m3 Linf. Th CD4 /mm3
LTSC CD8 /mm3
Rel. CD4/CD8
Linf. B CD19 /mm3
Cel. NK CD16-56 /mm3
Cel. NKT CD16-56/CD3/mm3
01 1.480 920 600 1,37 260 280 20 02 1.110 660 390 1,69 120 240 60 03 1.000 780 285 1,69 150 315 45 04 1.440 960 580 2,73 160 340 100 05 1.065 690 300 1,65 165 180 75 06 1.794 1038 690 2,3 253 322 23 07 1.479 918 405 1,5 170 255 17 08 1.323 924 462 2 357 231 42 09 1.040 799 630 2 143 156 13 10 1.184 774 268 1,6 128 176 32 11 1.260 738 504 1,95 342 252 108 12 949 624 264 1,5 130 234 78 13 1.050 574 405 2,2 182 182 28 14 1.491 1.092 441 1,4 294 168 105 15 1.110 630 420 2,7 210 210 90 16 2.080 750 650 1,5 286 260 104 17 1.125 660 288 2,0 156 180 78 18 1.072 640 400 2,3 160 240 80 19 988 715 403 1,6 130 130 84 20 1.738 1.144 572 1,8 264 143 132 21 1.800 1.250 475 2,0 400 325 75 22 1.248 800 320 2,0 160 224 32 23 1.541 1.035 667 2,6 230 276 184 24 1.575 840 805 2,5 336 399 84 25 1.088 800 336 1,6 256 208 64 26 1.095 720 495 1,45 165 195 30 27 1.248 720 320 2,25 96 226 64 28 1.541 1.150 667 1,72 230 276 161 29 1.140 750 300 2,5 195 285 45 30 1.050 750 420 1,79 225 165 60
Min. 949 574 264 1,15 65 130 13
Max 2.080 1.250 805 2,75 400 399 184 Med 1.216 777 420 1,87 188 232 69
M 1.316 833 463 1,92 213 237 72
OBS: Linf B. (Linfócitos B), Linf T (Linfócitos T); Linf Th (Linfócitos T helper); Linf TSc
XLV Tabela 7. Perfil imunológico das mulheres infectadas pelo HPV
Caso n
Linf. T CD3/mm3
Linf. Th CD4 /mm3
LTSC CD8 /mm3
Rel. CD4/CD8
Linf. B CD19 /mm3
Cel. NK CD16-56 /mm3
Cel. NKT CD1656/CD3/mm3
01 1.079 742 280 2,65 266 42 0
02 1.386 900 594 1,51 180 54 0
03 2.260 1.200 1.170 1,02 300 60 5,4
04 1.234 748 340 2,2 170 51 30
05 700 430 250 1,72 100 20 9
06 1.835 1.248 832 1,52 494 130 1,9 07 1.122 697 425 1,64 153 187 5,1 08 1.292 798 494 1,61 152 152 3,8 09 1.630 672 912 0,73 271 72 12 10 1.216 738 432 1,7 160 48 3,2 11 1.302 630 651 0,96 84 84 0,2 12 2.730 1.287 924 1,39 330 462 9,9 13 2.106 1.439 805 1,78 429 105 3,7 14 2.549 1.517 1.185 1,27 574 164 0 15 1.857 1.350 750 1,8 270 30 0
16 875 600 348 2,5 120 12 0
17 2.160 1.242 702 1,76 405 81 2,1 18 1.770 750 870 0,86 600 90 1,5 19 2.613 874 1.053 1,4 663 174 1,2 20 1.544 1.058 782 1,35 230 69 2 21 2.264 1.320 990 1,33 231 99 1 22 2.678 1.419 1.056 1,34 396 165 3
23 898 552 240 2,3 144 60 6
24 2.016 1.275 650 1,96 250 50 1 25 2.289 1.023 1.147 0,89 310 93 6,2 26 2.040 1.290 750 1,72 120 510 9 27 4.100 2.100 1.700 1,25 650 100 5 28 1.518 902 616 1,46 220 374 6,6 29 1.241 782 510 1,5 102 85 3,4
30 923 650 429 1,51 91 52 9,1
Min. 700 430 280 0,73 84 12 0
Max. 4.100 2.100 1.700 2,65 663 510 30
Med. 1.700 901 726 1,54 240 84,5 3,3
M 1.813 1.006,9 742 1,56 289 131 4,73
OBS: Linf B. (Linfócitos B), Linf T (Linfócitos T); Linf Th (Linfócitos T helper); Linf TSc (Linfócit supressor citotóxico); Cel. NK (Células Natural Killer); Cel. NKT (Células NKT); Min. (mínimo); M
XLVI Figura 6. Distribuição da leucometria em mulheres HPV+ e HPV-.
.
p=0.0002
XLVII Figura 7. Distribuição da contagem de linfócitos em mulheres HPV+ e HPV-.
HPV
+ HPV-
XLVIII Figura 8. Distribuição da contagem de monócitos em mulheres HPV+ e HPV-.
p<0.0001
HPV-XLIX Figura 9. Distribuição da contagem de granulócitos em mulheres HPV+ e HPV-.
p=0.01
HPV-L Figura 10. Distribuição dos valores de linfócitos TCD3+ em mulheres HPV+ e HPV-.
HPV-p=0.018
LI Figura 11. Distribuição dos valores de linfócitos BCD19+ em mulheres HPV+ e HPV-.
HPV-p=0.03
LII Figura 12. Distribuição dos valores de linfócitos TCD4+ em mulheres HPV+ e HPV-.
HPV+ HPV
LIII Figura 13. Distribuição dos valores de linfócitos TCD8+ em mulheres HPV+ e HPV-.
HPV-LIV Figura 14. Distribuição da relação CD4/CD8 em mulheres HPV+ e HPV-.
p=0.003
HPV-LV Figura 15. Distribuição dos valores de células NK (CD16-56+) em mulheres HPV+ e HPV-.
HPV
+
LVI Figura 16. Distribuição dos valores de células NKT (CD3+/CD16-56+) em mulheres HPV+ e HPV
p<0.00001
HPV-LVII 6 - DISCUSSÃO
A comunidade médica mundial está empenhada na elaboração de programas de vacinação contra o HPV. Antes que estes sejam implementados é importante reconhecer, que talvez este esforço isolado não seja suficiente, uma vez que a erradicação da infecção pelo HPV é também dependente da resposta imune celular. Estudos têm demonstrado níveis significativamente mais baixos de células de defesa tipo TH1 (células de Langerhans) no epitélio cervical de pacientes portadoras de lesões intraepiteliais de alto grau (LIEAG) quando comparadas aquelas encontradas no epitélio cervical de pacientes saudáveis (EVANS et al, 1997; BONTKES et al 2000; ).
Sabe-se ainda que os linfócitos T citotóxicos (LTC) desempenham um papel importante na imunidade local, impedindo a progressão da doença.
Existe na literatura fortes evidências de que os LTC específicos para o HPV de alto poder oncogênico parecem ter um papel central na inibição da carcinogênese cervical (BOR-CHING SHEU, et al.,2007). As referidas células desempenham uma função importante no reconhecimento e defesa contra antígenos específicos do HPV e agindo dessa forma como sentilenas no combate de células infectadas. Trabalhos têm demonstrado que dependendo do tipo de resposta Th específica para o vírus HPV-16 produtor da oncoproteína E7 pode resultar no clearance ou na persistência do vírus em pacientes com neoplasia cervical (DE GRUIJL TD, et al., 1998).
Em estudo prévio, KADISH (2002) avaliou in vitro a resposta imune celular linfoproliferativa aos peptídios E6 e E7 do HPV 16 em 136 mulheres portadoras de NIC (neoplasia intraepitelial cervical) I e II seguidas durante um ano, Neste estudo observou-se que a resposta imune celular ao peptídio E7 esteve relacionada a clarificação da infecção e a regressão da doença neste período de tempo.
LVIII linfocitária do sangue periférico por citometria de fluxo em mulheres infectadas com o HPV de baixo ou alto risco oncogênico e portadoras de LSIL. Estudando também paralelamente mulheres com as mesmas características sem doença, as quais constituiram o grupo contole
Identificamos uma diminuição na contagem de linfócitos TCD4+, com relativo aumento no número de células TCD8+ entre as pacientes acometidos com HPV de alto risco quando comparados com aquelas infectadas com HPV de baixo risco e principalmente com as mulheres pertencentes ao grupo controle (Tabelas 5 a 7 e Figuras 10, 12, 13 e 14). Tal fato sugere que possivelmente, o HPV, especialmente o de alto risco poderia estar induzindo um efeito citopático nos linfócitos TCD4+ como uma estratégia de subverter a resposta imunitária destas pacientes frente à infecção.
Estudos anteriores demonstram que pacientes com câncer cervical foi observado uma perda completa ou uma diminuição da expressão das moléculas de classe I em células tumorais. Este mecanismo poderia representar uma estratégia do vírus para escapar da vigilância imunológica e, consequentemente, não ser reconhecido em virtude da ausência da diminuição da expressão dos antígenos por parte destas moléculas apresentadoras. Consequentemente, as pacientes apresentariam uma redução do número de linfócitos T específicos necessárias para erradicar o vírus. (
MONNIER-BENOIT S, et al., 2006; DE BOER MA, et al., 2007). Em contrapartida,
KANODIA (2007) observou que a expressão de moléculas imunossupressoras no
microambiente cervical favoreceu ao escape viral.
O que nos faz pensar inicialmente que ocorreria uma maior expressão de moléculas imunossupressoras a nível local, que posteriormente seriam inibidas a nível sistêmico. O que justifica nossos achados.
LIX resposta imune e contribuindo desta forma para o quadro de imunodeficiência (WATTRE P, et al., 1996).
Todavia, quando analisamos a população de células NK e NKT, independente do poder oncogênico do HPV, observou-se uma diminuição acentuada nas duas sub-populações avaliadas (Tabelas 5 a 7 e Figuras 15 e 16). O decréscimo observado nestas sub-populações pode estar relacionado com a expressão aumentada de proteínas pro-apoptóticas, que poderia ser decorrente da ativação de mecanismos indutores de apoptose.
Entretanto, não observamamos diferenças significativa na contagem de linfócitos B no sangue periférico nos dois grupos de mulheres estudados (com e sem HPV), o que talvez não ocorresse se tivesse sido avaliado material cérvico vaginal, uma vez que a mucosa genital normal é infiltrada por linfócitos TCD4+, TCD8 + , células plasmáticas , células dendríticas (DCs) e macrófagos (GARCIA-CHACON R, et al.
2009; INSINGA R.P, et al., 2009). Nossos resultados poderiam traduzir ainda uma
participação limitada da resposta imune humoral , quando a infecção já está instalada.
Constatamos também uma contagem mais elevada de linfócitos nas pacientes portadoras de HPV. Em adição, outro estudo examinou a expressão aumentada de linfócitos T CD3 entre as pacientes com NIC III (MALUF PJ, et al., 2008). Resultados semelhantes foram observados em uma análise por imunohistoquímica da expressão de células TCD4+ e TCD8+ na presença do HPV de alto risco oncogênico em lesões pré malignas e malignas do colo uterino (MONNIER-BENOIT et al, 2006).
Concluindo, podemos dizer que as respostas imune celular e humoral são essenciais no processo de progressão ou regressão da infecção e ou lesão induzida pelo HPV. Associada a isso, diferentes linhas de pensamento evidenciam principalmente o papel da resposta imune celular neste processo. ( KARIM 2011).
LX 7. CONCLUSÕES
Baseados nos objetivos propostos, concluímos que:
• Observou-se a uma modulação do sistema imune adaptativo a nível sistêmico durante a infecção pelo HPV, independente do grau de oncogenicidade do vírus, sendo pronunciadamente mais evidente na diminuição do número de células NK e NKT e aumento das células TCD8+.
• Durante a infecção pelo HPV as mulheres acometidas com o vírus de alto poder oncogênico apresentam uma modulação da resposta imune adquirida mais acentuada quando comparada com as mulheres infectadas pelo HPV de baixo grau, caracterizada pela diminuição acentuada na contagem de linfócitos TCD4+ com relativo aumento dos linfócitos TCD8+.
• Não foi observada correlação estatisticamente significativa na contagem de células B (CD19+), levando a crer na pouca participaçào desses linfócitos imunidade humoral na resposta imune a nível sistêmico da infecção pelo HPV.
• O aprofundamento nos estudos envolvendo uma maior caracterização imunofenotípica destas células do sistema imune e também a nível local associada a imunobiologia do vírus pode contrubuir de forma significativa aos conhecimentos atuais acerca de prováveis mecanismos entre virus e sistema imune do hospedeiro.
LXI 8 – REFERÊNCIAS BIBLIOGRÁFICAS
1. ABBAS AK, et al. (2008). “Celular and molecular Immunology”, 6.ed USA: Wb Saunders.
2. ADAMS, V. et al. (1996). "Detection and typing of human papillomavirus in biopsy and cytological specimens by polymerase chain reaction and restriction enzyme analysis: A method suitable for semiautomation". J. Med. Virol. 48:161-170.
3. ALBRING L, et al. (2006). “O cancer do colo do útero, o Papilomavírus Humano (HPV) e seus fatores de risco e as mulheres indígenas Guarani: Estudo de revisão”. RDAC, 38(2): 87-90.
4. ALMADORI G, et al. (2005). “Molecular markers in laryngeal squamous cell carcinoma: towards integrated clinicobiological approach”. Eur J câncer;
41(5): 638-93.
5. ALVES DB, et al. (2010). “CD4 and CD8 T lymphocytes and NK cells in the stroma of the uterine cervix of women infected with human papillomavirus”. Rev Soc Bras Med Trop, 4: 425-9.
6. AU, WW. (2004) “Life style, envirinomental and genetic susceptibility to cervical cancer”. Toxicology, 198(1-3), p.117-20.
7. BAUER, H.M.; MANOS, M.M. (1993). "PCR Detection of Genital Human Papillomavirus". In: PERSING, D.H. et al. (Ed.). "Diagnostic molecular microbiology principles and applications". Rochester: Mayo Foundation. cap. 2.16, p.407-413.
8. BERNARD, H.U. et al. (1994). "Identification and assessment of known and novel human papillomaviruses by polymerase chain reaction amplification, restriction fragment length polymorphisms, nucleotide sequence, and phylogenetic algorithms". J. Infect. Dis. 170:1077-1085.
9. BONTKES HJ, et al. (2000). “Human papillomavirus type 16, E6/E7-specific cytotoxic T lymphocytes in women with cervical neoplasia”. Int J Cancer. 88: 92–98.
LXII
11. BOR-CHING SHEU, et al. (2007). “Immune concept of human papillomaviruses and related antigens in local cancer milieu of human cervical neoplasia”. Journal compilation Japan Society of Obstetrics and Gynecology;
3: 103-13.
12. BOSCH, FXAN, et al. (2008) “Epidemiology and natural history of human papilomavirus infections and type-specific implications in cervical neoplasia. Vaccine”, 26(10), p, k 1-16.
13. BRASIL mds. (2008). Instituto Nacional de Câncer do Ministério da Saúde (INCA).
14. CAMPOS et al. (2005) “Prevalência do Papilomavírus humano e seus genótipos em mulheres portadoras e não portadoras do vírus da imunodeficiência humana”. Revista Brasileira de Ginecologia e obstetrícia,
27(5): 248-56.
15. CHOW, V.T.K. et al. (2000). "Identification of multiple genital HPV types and sequence variants by consensus and nested type-specific PCR coupled with cycle sequencing". Pathology. 32:204-208.
16. COX, J.T. (1999). "Evaluating the role of HPV testing for women with equivocal Papanicolaou test findings". JAMA. 281:1645-1647.
17. CUZICK, J. (2000). "Human Papillomavirus testing for primary cervical cancer screening". JAMA. 283:108-109.
18. DE BOER MA, et al. (2007). “Circulating human papillomavirus type 16 specific T-cells are associated with HLA Class I expression on tumor cells, but not related to the amount of viral oncogene transcripts”. Int J Cancer;
121:2711–2715.
19. DE GRUIJL TD, et al. (1998). “Differential T helper cell responses to human papillomavirus type 16, E7 related to viral clearance or persistence in patients with cervical neoplasia: a longitudinal study”. Cancer Res; 58:1700– 1706.
20. EDDIE et al. (1999). “Freqüência da infecção pelo Papilomavírus Humano em Mulheres com ectopia Cervical. Revista Brasileira de Ginecologia Obstetrícia”. 21(8).
LXIII
22. ETTINI, JS, et al. (2003). “PCR diagnosis of HPV in cervical biopsies of CIN and invasive neoplasia formerly diagnosed a HPV negative”. Acta Cytol.
47(4): 545-9.
23. EVANS EML, et al. (1997). “Infiltration of cervical cancer tissue with human papillomavirus-specific cytotoxic T-lymphocytes”. Cancer Res. 57: 2943–2950
24. FARAH, S.B. (2008). “DNA Segredos e mistérios”, 2.ed São Paulo: Sarvier.
25. FEBS J., (2010) Aug 28: doi: 10.1111/j.1742-4658.2010.07833.x
26. FIDLER, IJ. (2003). “The pathogenesis of cancer metastasis: the seed and soil hypothesis revisited”. Nat Rev cancer, 3(6):453-8.
27. FILIPPIN et al. (2006) “Determinação do número de regiões organizadoras de nucléolo (agnor) em lesões do epitelio cervical uterino”. RDAC, 38(3):133-139.
28. FRANCESCHI, S. (2005). “The IARC commitment to câncer prevention: The example of papillomavirus and cervical câncer”. Recent Results Cancer Res,V. 166, p. 277-97.
29. GARCIA-CHACON R, et al. (2009). “Immunobiology of HPV Infection”. Arch Med Res. 40:443-8.
30. GOMPLES C, et al. (1997). "Citologia ginecológica e suas bases anatomoclinicas”. São Paulo:Manole.
31. GONÇALVES, M.A. e E.A. DONADI. (2004). “Immune cellular response to HPV: current concepts”. Braz J Infect Dis. 8(1): 1-9.2204.
32. GRAVITT, P.E. et al. (1998). "Genotyping of 27 human papillomavirus types by using L1 consensus PCR products by a single hybridization, reverse line blot detection method". J. Clin. Microbiol. 36:3020-3027.
33. GUERRA, MR, et al. (2005). “Risco de câncer no Brasil: tendência e estudos epidemiológicos mais recentes”. Revista Brasileira da Cancerologia,
51(3): 227-234.
34. HIETANEN, S. et al. (1997). "Type I diabetic pregnancy and subclinical human papillomavirus infection". Clin. Infect. Dis. 24:153-156.
LXIV
systematic review of the literature in the development of an HPV dynamic transmission model”.BMC Infect Dis. 29:119.
36. IWASAWA, A. et al. (1997). "J. Human papillomavirus in squamous cell carcinoma of the vulva by polymerase chain reaction". Obstetr. Gynecol. 89 :81-84.
37. KANESHIMA et al., (2001). “Avaliação do método PCR- RFLP para tipagem de HPV em infecções cervicais de pacientes atendidas do Lepac, Universidade Estadual de Maringá. Acta Scientiarum”. 23(3): 731-737.
38. KANODIA S, et al. (2007). Mechanisms used by human papillomaviruses to escape the host immune response. Curr Cancer Drug Targets. 7, p.79-89. 39. KARIM R, et al. (2011). “Human papillomavirus deregulates the response of a cellular network comprising of chemotactic and proinflammatory genes”. PLoS One. 14;6(3):e17848.
40. KELLY, A.,P.,J.J. MONACO, et al. (1991). “A new human HLA class II – related locus”, DM. Nature, 353(6344): 571-3.
41. KODON K. (2009). “Development of na HPV vaccine – remainig issues and perspective”. Nippon rinsho; 67(1): 62-8.
42. LANIER, L.L. (1997). “Natural Killer cells: from no receptors to too many”. Immunity, 6(4):371-8.
43. LEPIQUE AP, et al. (2009). “HPV vaccionation: the beginning of the end of cervical cancer? – A review”. Memoriais do Instituto Oswaldo Cruz; 104 (1): 1-10.
44. LINDSEY et al. “Vírus do Papiloma: Vias de transmição, Risco oncogênico e co-fatores”. Laes e Haes. 25/146.
45. MADKAN VD, et al. (2007). "The oncogenic potential of human papillomaviruses: a rewiew onthe role of rost genetics and environmetal cofactors".
British Journal of dermatology. 157(2):2208-241.
46. MALUF PJ, et al. (2008). “EFT lymphocytes (CD3) may participate in the recurrence of cervical intraepithelial neoplasia grade III”. Arch Gynecol Obstet.
278(6):525-30.
47. MANOS, M.M. et al. (1989). "Use of polymerase chain reaction amplification for the detection of genital human papillomaviruses". Cancer Cells.
LXV
48. MONNIER-BENOIT S, et al. (2006). “Immunohistochemical analysis of CD4+ and CD8+ T-cell subsets in high risk human papillomavirus–associated pre-malignant and malignant lesions of uterine cervix”. Gynecol Oncol, 102 :22-31.
49. MOSCICKI AB, et al. (2006). “Updating the natural history of HPV and anogenital cancer”. Vaccine.24: 42–51.
50. MUNOZ N, et al. (2003). “Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med. 348: 518– 527.
51. NAKAGAWA et al. (1999). “CD4 positive and CD8 positive cytotoxic T Lynphocytes contribute Human Papillomavirus Type 16 E6 and E7 responses”. Clinical and dianostic laboratory immunology. 6(4): 494 – 498. 52. NELSON, J.H. et al. (2000). "A novel and rapid PCR-based method for genotyping human papillomaviruses in clinical samples". J. Clin. Microbiol.
38:688-695.
53. PINHO AA, et al. (2003). "Prevenção do câncer do útero: um modelo teórico para analisar o acesso e a utilização do teste de Papanicolaou". Rev Bras Mater Infant. 3:95-112.
54. ROITT, IVAN, et al. (2003). “Imunologia”. 6. ed. Barueri: Manole. 481 p. Titulo original: “Immunology”. ISBN: 85-204-1439-7.
55. RÓLON, P.A. et al. (2000). "Human papillomavirus infection and invasive cervical cancer in Paraguay". Int. J. Cancer. 85:486-491.
56. SANTAGOSTINO A, et al. (1999). “An Italian national multicenter study for the definition of a reference ranges for normal values of peripheral blood lymphocyte subsets in healthy adults”. Haematologica, 84:499-504.
57. SANTIN et al. “Induction of Human Papilomavirus-Specific CD4+ and CD8+ Lynph by E7 – pulsed autologous Dendritic Cells in Patientes whit Human Papilomavirus Type 16 and 18 positive Cervical Cancer”.
58. SATHISH N, et al. (2004). “HPV DNA in plasma of patients with cervical carcinoma”. J Clin Virol; 31 (3): 204-9.