Viviane de Oliveira Vasconcelos
Identificação e purificação de proteínas de
Angiostrongylus vasorum (Baillet, 1886),
Kamensky, 1905 e avaliação da resposta
humoral em cães com angiostrongilose
ii
Viviane de Oliveira Vasconcelos
Identificação e purificação de proteínas de
Angiostrongylus vasorum (Baillet, 1886)
Kamensky, 1905 e avaliação da resposta humoral
em cães com angiostrongilose
Tese apresentada ao Departamento de
Parasitologia do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais, como parte dos requisitos necessários para a obtenção do grau de Doutora em Ciências.
Área de Concentração: Helmintologia. Orientador: Dr.Walter dos Santos Lima
iii
Viviane de Oliveira Vasconcelos
Identificação e purificação de proteínas de
Angiostrongylus vasorum (Baillet, 1886)
Kamensky, 1905 e avaliação da resposta humoral
em cães com angiostrongilose
Orientador:
Dr. Walter dos Santos Lima
Laboratório de Helmintologia Veterinária, Departamento de Parasitologia, Instituto de Ciências Biológicas, Universidade Federal de Minas Gerais, Belo Horizonte - MG.
Co-orientador:
Dr. Ricardo Wagner de Almeida Vítor
Laboratório de Toxoplasmose, Departamento de Parasitologia, Instituto de Ciências Biológicas, Universidade Federal de Minas Gerais, Belo Horizonte - MG.
Colaborador:
Dr. Luiz Guilherme Dias Heneine
Laboratório de Imunologia e Bioprodutos, Departamento de Ciências-Biomédicas, Fundação Ezequiel Dias, Belo Horizonte - MG.
iv
Trabalho realizado no Laboratório de Helmintologia Veterinária, no
Laboratório de Toxoplasmose do Departamento de Parasitologia, Instituto
de Ciências Biológicas, Universidade Federal de Minas Gerais e no
Laboratório de Imunologia e Bioprodutos do Departamento de
Ciências-Biomédicas, Fundação Ezequiel Dias, com o apoio financeiro do Conselho
v
vi
$
%
& !
'
!
(
%
!
!
)
vii
)
“Vou te contar meus olhos já não podem ver
Coisas que só o coração pode entender
Fundamental é mesmo o amor é impossível ser feliz sozinho
O resto é mar, é tudo que não sei contar
São coisas lindas que eu tenho pra te dar
Vem de mansinho à brisa e me diz é impossível ser feliz
sozinho...”
viii
AGRADECIMENTOS
Agradecimentos... Este é o item que todo mundo que está redigindo a sua tese deseja chegar. Sinaliza o final de mais uma etapa. Estive pensando neste item a pelo menos uns 3 meses atrás. São tantas as pessoas que participaram, não somente da elaboração deste trabalho, mas do meu crescimento espiritual. Precisaria começar a agradecer deste o inicio da minha formação, desde a minha chegada a UFJF até aqui, onde me encontro. Quem diria em!!!! Estou na UFMG.
Então vamos aos agradecimentos: primeiramente não poderia deixar de agradecer a uma pessoa que me incentivou ao máximo para que eu pudesse continuar após o meu mestrado... Dr. John Furlong.... foi mais que um professor, um mestre, um amigo,não tenho palavras para agradecer a esta pessoa que tanto acreditou no meu potencial quando não mais queria dar continuidade a pesquisa achando que eu não iria dar “conta do recado”. Uma pessoa que vale a pena ter passado pela sua vida, quem não o conhece está perdendo uma grande oportunidade. A você John, meu muitíssimo obrigado por tudo, mesmo que as circunstâncias nos tenham levado a tomar outros rumos, outras decisões, eu nunca esquecerei o quanto importante você foi para a minha formação.
ix
Carol, Lucas e todos os estagiários do laboratório de Toxoplasmose, sem a ajuda de vocês este trabalhado ficaria muito mais difícil de ser realizado.
A segunda parte do meu trabalho foi realizada na FUNED. O Dr. Luiz Guilherme do laboratório de Imunologia e Bioprodutos é um pesquisador como poucos. Uma pessoa que se prontificou a embarcar neste trabalho, uma pessoa pronta a expandir seus conhecimentos, porque, mesmo trabalhando com toxinas, foi fundamental para a execução deste trabalho. Juntamente com ele, as pessoas que trabalham ou trabalharam em seu laboratório: Paty Cota, Elaine, Zumpano, Isabela, Joice com “i”, Horácio, Paulo, Theonys e Mariana, muito obrigado pela amizade. A secretária da Divisão Biomédica, Regina, minha companheira nas horas do almoço e Ana Valentim, a mestre da cromatografia. A FUNED, na pessoa da Dr. Thaís Viana que permitiu o uso das dependências da fundação para a realização deste trabalho.
Bom, quando o Dr. John me propôs que fizesse o doutorado na UFMG, ele foi logo ligando para um amigo no qual poderia me auxiliar. Marcamos uma entrevista com ele e o nervosismo tomou conta de mim. Os primeiros meses foram muito difíceis, cidade diferente, não conhecia ninguém. E para piorar a situação, eu não estava me sentindo a vontade e por isso não aparecia no laboratório, fui me afastando, daí veio o primeiro “puxão de orelhas”. Precisava de alguém que me colocasse em órbita novamente e uma frase que o professor Walter me disse que eu nunca vou me esquecer: “.... para mim a primeira impressão não é a que fica e sim a última”. Foi a minha sorte, porque percebi que não havia deixado uma boa impressão. A partir daí fui me interando dos assuntos do laboratório, fui conhecendo as pessoas que ali trabalhavam e a amizade que construí foi fundamental para que eu pudesse dar inicio ao meu trabalho. Identifiquei-me tanto com as pessoas do laboratório que acabei mudando o meu projeto inicial de doutorado.
x
FUNED e cuidar dos cães na Federal. Ao casal vinte, Renata e Sydnei, pelo apoio e pela grande amizade. A Dra. Joziana ao Dr. Thales que sem a ajuda de vocês eu não conseguiria nem ao menos começar os experimentos. Que correria para conseguir os conjugados em!!!! E por fim, mas não menos importante, o “chefe”, professor Walter. Um profissional que me ensinou a ser perseverante e ter coragem de arriscar. Walter, meu muito obrigado por tudo, por ter me acolhido em seu laboratório, por ter acreditado em mim.
Aos amigos que fiz durante o curso, Andrey, Ceres, Cíntia, Léo, Raul, Lívio e Kézia, obrigada pelo melhores momentos que passei nos corredores do Departamento, no cafezinho do seu Nerí!!!
Agradeço a todos que direto ou indiretamente contribuíram para a execução deste trabalho, a professora Norma e ao professor Nélder que contribuíram durante a qualificação e relatoria, aos professores e funcionários do Departamento de Parasitologia e ao Programa de Pós-graduação em Parasitologia na pessoa de seu coordenadorProfessor Pedro Marcos Linardi. Agradeço também ao CNPq pelo auxílio financeiro.
Grande parte da força que temos para conseguir alcançar os objetivos vem da família. O porto seguro nas horas que mais precisamos de colo. Quantas vezes ao telefone não conseguimos conter a emoção de estarmos distante e a vontade de sair correndo ao encontro é quase inevitável. Por isso, agradeço por fazer parte desta “grande família” que no começo éramos somente três e que em tão pouco tempo crescemos e agora somos sete. Mãe, Marcinho, Val, Léo, Lucas e o mais novo membro da família Otávio. Sem vocês eu não teria chegado tão longe!!! Milhões de beijos a todos e amo muito vocês.
xi
xii
SUMÁRIO
1 - INTRODUÇÃO 01
1.1 – Histórico... 04
1.2 – Posição Taxonômica... 04
1.3 – Morfologia de Angiostrongylus vasorum... 05
1.4 - Distribuição... 05
1.5 - Ciclo Evolutivo... 06
1.6 – Patologia... 08
1.7 – Diagnóstico... 10
2 – JUSTIFICATIVA 14 3 – OBJETIVOS 17 3.1 - Objetivo Geral... 18
3.2 - Objetivos Específicos... 18
4 - MATERIAL E MÉTODOS 19 4.1 - Manutenção da Cepa de Angiostrongylus vasorum... 20
4.1.1 - Recuperação de larvas de primeiro estádio (L1)... 20
4.1.2 - Infecção dos moluscos... 20
4.1.3 - Recuperação de larvas de terceiro estádio (L3)... 21
4.2 - Animais... 21
4.2.1 - Infecção experimental... 22
4.2.2 – Coleta dos soros... 23
4.3 - Procedimento de Necrópsia... 23
4.4 - Identificação das Proteínas de Angiostrongylus vasorum... 24
4.4.1 - Preparações de antígenos de L1 e parasito adulto... 24
4.4.2 - Eletroforese em gel de poliacrilamida (SDS-PAGE)... 25
4.4.2.1 - Coloração pelo Azul de Coomassie... 26
xiii
4.5-Purificação dos Anticorpos Policlonais (PcAbs) anti-Angiostrongylus
vasorum por Cromatografia de Imunoafinidade... 30
4.5.1-Preparação da Sepharose CL-4B ligada a antígenos de parasito adulto de Toxocara canis, Ancylostoma caninum, Dipylidium caninum... 30
4.5.2-Purificação dos anticorpos policlonais anti-Angiostrongylus vasorum... 31
4.5.3-Preparação da Sepharose CL-4B ligada a antígenos de parasito adulto de Angiostrongylus vasorum... 31
4.5.4-Avaliação da especificidade dos anticorpos policlonais anti-Angiostrongylus vasorum... 31
4.6-Purificação de Proteínas Específicas de Angiostrongylus vasorum por Cromatografia de Imunoafinidade... 33
4.6.1-Preparação da coluna imunoafinidade contendo de Proteína A ligada aos PcAbs purificados anti-Angiostrongylus vasorum... 33
4.6.2-Purificação das proteínas de antígeno bruto solúvel de parasito adulto de Angiostrongylus vasorum... 34
4.6.2.1-Coloração do gel de poliacrilamida por Nitrato de Prata... 35
4.7-Avaliação da Especificidade das Proteinas Purificadas de Parasito Adulto de Angiostrongylus vasorum... 35
4.7.1 -Cálculo do limite de detecção ... 36
4.8-Análise Estatística... 36
4.8.1-Cálculo da Sensibilidade e Especificidade... 37
5 – RESULTADOS 38 5.1-Separação das Proteínas de L1 de Angiostrongylus vasorum por Eletroforese... 39
5.2-Separação das Proteínas de Parasito Adulto de Angiostrongylus vasorum por Eletroforese... 40
5.3-“Immunoblotting”... 41
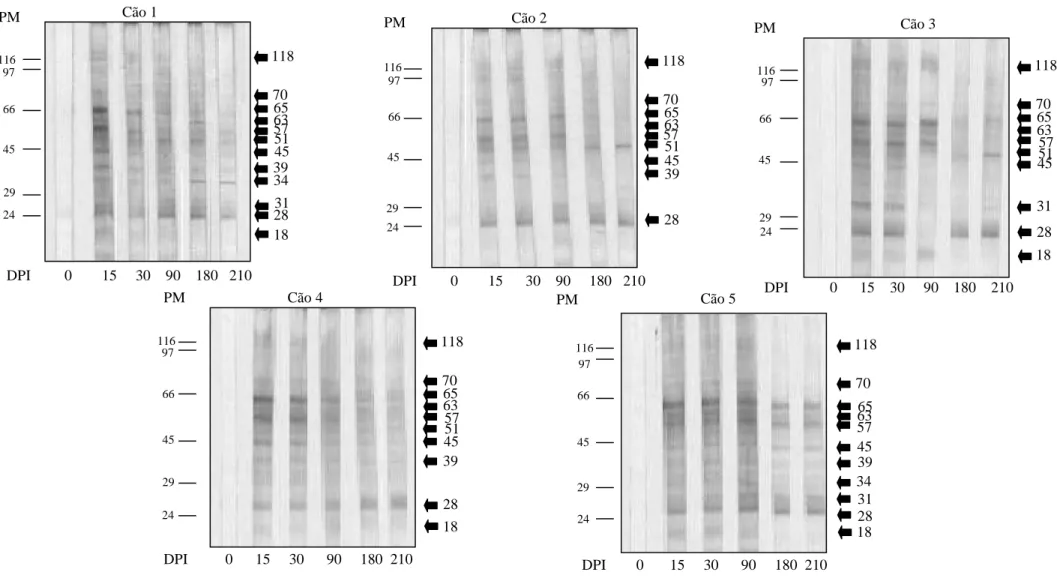
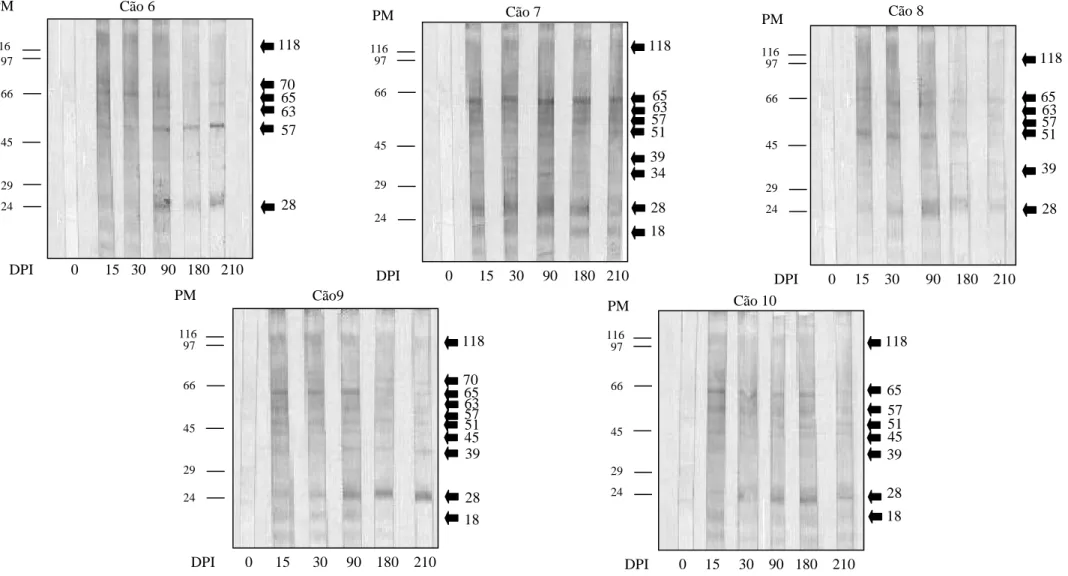
5.3.1-Identificação de proteínas de Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgG... 41
5.3.2-Identificação de proteínas de Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgM... 49
5.3.3-Identificação de proteínas de Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgA... 57
5.3.4-Identificação de proteínas de Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgE... 65
5.4-Purificações dos Anticorpos Policlonais Anti-Angiostrongylus vasorum... 74
xiv
5.6-Purificações de Proteínas Específicas de Parasito Adulto de Angiostrongylus vasorum... 78
5.7-Avaliação da Cinética de Produção de Anticorpos Policlonais IgG Anti-Proteina Purificada de Parasito Adulto de Angiostrongylus vasorum... 75
5.8-Avaliação da Especificidade da Proteína de 51 kDa Purificada de Parasito Adulto de Angiostrongylus vasorum... 80
6 – DISCUSSÃO 84
6.1-Identificação de Proteínas de Larvas de Primeiro Estádio (L1) e de Parasito Adulto de Angiostrongylus vasorum Reconhecidas por Anticorpos de Diferentes Isotipos... 84
6.2-Purificação da Proteína Purificada de 51 kDa de Parasito Adulto de
Angiostrongylus vasorum... 88
6.3-Avaliação da Cinética de Produção de Anticorpos Policlonais IgG anti-Proteina Purificada de Parasito Adulto de Angiostrongylus vasorum... 90
7 – CONCLUSÕES 94
8 - REFERENCIAS BIBLIOGRÁFICAS 96
xv
LISTA DE FIGURAS
Figura 1-Análise eletroforética do antígeno bruto solúvel de larvas de primeiro estádio (L1) de Angiostrongylus vasorum analisado em gel de poliacrilamida com redução na concentração de 10% corado pelo Azul de Coomassie... 39
Figura 2-Análise eletroforética do antígeno bruto solúvel de parasito adulto de
Angiostrongylus vasorum analisado em gel de poliacrilamida com redução na
concentração de 7,5%corado pelo Azul de Coomassie... 40
Figura 3-Identificação das proteínas de larvas de primeiro estádio (L1) de
Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgG presentes nos
soros de cães experimentalmente infectados por Angiostrongylus vasorum em diferentes dias após a infecção... 43
Figura 4-Identificação das proteínas de parasitos adultos de Angiostrongylus
vasorum reconhecidas por anticorpos do isotipo IgG presentes nos soros de cães
experimentalmente infectados por Angiostrongylus vasorum em diferentes dias após a infecção... 46
Figura 5-Identificação das proteínas de parasito adulto de Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgG presentes nos soros de cães naturalmente
infectados por Toxocara canis, Ancylostoma caninum e Dipylidium
caninum... 48
Figura 6-Identificação das proteínas de larvas de primeiro estádio (L1) de
Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgM presentes nos
soros de cães experimentalmente infectados por Angiostrongylus vasorum em diferentes dias após infecção... ... 51
Figura 7-Identificação das proteínas de parasitos adultos de Angiostrongylus
vasorum reconhecidas por anticorpos do isotipo IgM presentes nos soros de cães
experimentalmente infectados por Angiostrongylus vasorum em diferentes dias após a infecção... 54
Figura 8-Identificação das proteínas de parasito adulto de Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgM presentes nos soros de cães naturalmente infectados por Toxocara canis, Ancylostoma caninum e Dipylidium
caninum ... 56
Figura 9-Identificação das proteínas de larvas de primeiro estádio (L1) de
Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgA presentes nos
xvi
Figura 10-Identificação das proteínas de parasitos adultos de Angiostrongylus
vasorum reconhecidas por anticorpos do isotipo IgA presentes nos soros de cães
experimentalmente infectados por Angiostrongylus vasorum em diferentes dias após a infecção... ... 62
Figura 11-Identificação das proteínas de parasito adulto de Angiostrongylus
vasorum reconhecidas por anticorpos do isotipo IgA presentes nos soros de cães
naturalmente infectados por Toxocara canis, Ancylostoma caninum e Dipylidium
caninum... 64
Figura 12-Identificação das proteínas de larvas de primeiro estádio (L1) de
Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgE presentes nos
soros de cães experimentalmente infectados por Angiostrongylus vasorum em diferentes dias após a infecção... 67
Figura 13-Identificação das proteínas de larvas de primeiro estádio (L1) de
Angiostrongylus vasorum reconhecidas por anticorpos do isotipo IgE presentes nos
soros de cães naturalmente infectados por Toxocara canis, Ancylostoma caninum e
Dipylidium caninum... 69
Figura 14-Identificação das proteínas de parasito adulto de Angiostrongylus
vasorum reconhecidas por anticorpos do isotipo IgE presentes nos soros de cães
experimentalmente infectados por Angiostrongylus vasorum em diferentes dias após a infecção... 71
Figura 15-Identificação das proteínas de parasito adulto de Angiostrongylus
vasorum reconhecidas por anticorpos do isotipo IgE presentes nos soros de cães
naturalmente infectados por Toxocara canis, Ancylostoma caninum e Dipylidium
caninum... 73
xvii
LISTADEQUADROS
Quadro 1-Protocolo para identificação de proteínas imunoreativas de antígeno bruto de larva de primeiro estádio (L1) e parasito adulto de Angiostrongylus vasorum utilizando soros de cães experimentalmente infectados... 28
Quadro 2 –Painel de anticorpos utilizados nos testes imunológicos para detectar classes de imunoglobulinas presentes nos soros de cães infectados por
xviii
LISTADETABELAS
Tabela 1-Freqüência absoluta da reatividade no “Immunoblotting” de anticorpos do isotipo IgG presentes em soros de cães experimentalmente infectados por
Angiostrongylus vasorum em diferentes dias após a infecção utilizando antígeno
bruto solúvel de larva de primeiro estádio (L1)... 42
Tabela 2-Freqüência absoluta da reatividade no “Immunoblotting” de anticorpos do isotipo IgG presentes em soros de cães experimentalmente infectados por
Angiostrongylus vasorum em diferentes dias após a infecção utilizando antígeno
bruto solúvel de parasito adulto... 45
Tabela 3-Freqüência absoluta da reatividade no “Immunoblotting” de anticorpos do isotipo IgM presentes em soros de cães experimentalmente infectados por
Angiostrongylus vasorum em diferentes dias após a infecção utilizando antígeno
bruto solúvel de larva de primeiro estádio (L1)... 50
Tabela 4-Freqüência absoluta da reatividade no “Immunoblotting” de anticorpos do isotipo IgM presentes em soros de cães experimentalmente infectados por
Angiostrongylus vasorum em diferentes dias após a infecção utilizando antígeno
bruto solúvel de parasito adulto... 53
Tabela 5-Freqüência absoluta da reatividade no “Immunoblotting” de anticorpos do isotipo IgA presentes em soros de cães experimentalmente infectados por
Angiostrongylus vasorum em diferentes dias após a infecção utilizando antígeno
bruto solúvel de larva de primeiro estádio (L1)... 58
Tabela 6-Freqüência absoluta da reatividade no “Immunoblotting” de anticorpos do isotipo IgA presentes em soros de cães experimentalmente infectados por
Angiostrongylus vasorum em diferentes dias após a infecção utilizando antígeno
bruto solúvel de parasito adulto... 61
Tabela 7-Freqüência absoluta da reatividade no “Immunoblotting” de anticorpos do isotipo IgE presentes em soros de cães experimentalmente infectados por
Angiostrongylus vasorum em diferentes dias após a infecção utilizando antígeno
bruto solúvel de larva de primeiro estádio (L1)... 66
Tabela 8-Freqüência absoluta da reatividade no “Immunoblotting” de anticorpos do isotipo IgE presentes em soros de cães experimentalmente infectados por
Angiostrongylus vasorum em diferentes dias após a infecção utilizando antígeno
xix
LISTA DE GRÁFICOS
Gráfico 1-Anticorpos policlonais anti-Angiostrongylus vasorum purificados a partir de soro de cães experimentalmente infectados por Angiostrongylus vasorum por cromatografia de afinidade usando Sepharose 4B-CNBr ligada a antígeno bruto solúvel de parasito adulto de Angiostrongylus vasorum... 74
Gráfico 2-Especificidade dos anticorpos policlonais anti-Angiostrongylus vasorum purificados por cromatografia de afinidade usando Sepharose 4B CNBr ligada aos antígenos de Toxocara canis, Ancylostoma caninum e Dipylidium caninum por ELISA indireto... 76
Gráfico 3-Especificidade dos anticorpos policlonais anti-Angiostrongylus vasorum purificados por cromatografia de afinidade Sepharose 4B CNBr ligada ao antígeno de Angiostrongylus vasorum por ELISA indireto... 77
Gráfico 4-Cinética de produção de anticorpos IgG que reagem com antígeno bruto e proteína purificada de 51 kDa de Angiostrongylus vasorum... 80
xx
LISTA DE ABREVIATURAS
Abs Absorbância
AcMo Anticorpo monoclonal
AgL1Av Antígeno de larva de primeiro estádio de A. vasorum
AgPAAv Antígeno de Parasito adulto de A. vasorum
AgPAAc Antígeno de Parasito adulto de A. caninum
AgPADc Antígeno de Parasito adulto de D.caninum
AgPATc Antígeno de Parasito adulto de T. canis
BSA Soro albumina bovina
CCZ-BH Centro de Controle de Zoonoses de Belo Horizonte
CETEA Comitê de Ética em Experimentação Animal
CNBr Brometo de Cianogênio
COBEA Colégio Brasileiro de Experimentação Animal
DPI Dias pós infecção
ELISA “Enzyme Linked Immunosorbent Assay”
FUNED Fundação Ezequiel Dias
g Gravidade
HD Hospedeiro definitivo
HI Hospedeiro intermediário
HPRO Peroxidase
ICB kDa
Instituto de Ciências Biológicas Kilodaltons
L1 Larva de primeiro estádio
L2 Larva de segundo estádio
L3 Larva de terceiro estádio
M N
Molar
Controle negativo mL
mA
Mililitro Miliamper
xxi
µ L µg
Microlitro Micrograma
µm Micrômetro
nm Nanômetro
OPD P
o-fenilenodiamina Controle positivo
PBS “Phosphate Buffered Saline”
PcAbs Anticorpos Policlonais
PM Padrão de Peso Molecular
SRD SDS ST
Sem raça definida Dodecilsulfato de Sódio Solução tampão
TA Temperatura ambiente
UFMG Universidade Federal de Minas Gerais
V Voltagem
Vam Valor médio da absorbância
xxii
RESUMO
Angiostrongylus vasorum é um nematóide parasito cujas formas adultas podem ser
xxiii
ABSTRACT
Angiostrongylus vasorum is a parasitic nematode that infect the circulatory system of
2
1- INTRODUÇÃO
As 13 espécies conhecidas de parasitos pertencentes ao gênero Angiostrongylus (Nematoda: Angiostrongylidae) localizam-se nas artérias pulmonares e no sistema circulatório de mamíferos insetívoros, roedores, canídeos e felídeos (ANDERSON, 1992; COSTA et al., 2003). Dentre essas, três são de importância médica - veterinária:
Angiostrongylus cantonensis, Angiostrongylus costaricensis e Angiostrongylus vasorum
(ECKERT & LÄMMLER, 1972).
A. cantonensis, agente etiológico da meningite eosinofílica humana, é parasito
de artérias pulmonares de roedores e possue moluscos como hospedeiros intermediários. O homem se infecta ao ingerir acidentalmente moluscos infectados ou alimentos contaminados com larvas de terceiro estádio, os quais migram para o sistema nervoso central ocasionando distúrbios neurológicos. Este parasito é endêmico no Sudoeste da Ásia, Índia, Austrália e América do Norte (ALICATA, 1988; PIEN & PIEN, 1993).
A. costaricensis, localiza-se nas artérias mesentéricas de roedores, é o agente
etiológico da angiostrongilose abdominal das américas. A infecção humana ocorre acidentalmente via ingestão de alimentos e água contaminados com larvas de terceiro estádio presentes na secreção ou por contato direto com o muco de moluscos infectados (WAISBERG, et al., 1999). A angiostrongilose abdominal tem sido registrada deste o sul dos Estados Unidos, norte da Argentina e Sul do Brasil (MOREIRA, 1988 apud GRAEFF-TEIXEIRA et al., 1991).
A. vasorum, é um nematóide cujas formas adultas podem ser encontradas
parasitando artérias pulmonares e suas ramificações de cães domésticos e canídeos silvestres. Apresenta uma ampla distribuição geográfica, abrangendo todos os continentes. A patologia e as manifestações clínicas são múltiplas estando relacionadas com o desenvolvimento e localização do parasito nos órgãos infectados (DODD, 1973; PRESTWOOD et al., 1981; RAMSEY et al., 1996; BRENNAN et al., 2004).
Apesar de ainda não terem sido relatados casos em humanos infectados por A.
vasorum, a possibilidade não pode ser descartada. Segundo, McCARTHY & MOORE
3
consequentemente a um reconhecimento significativo de infecções helmínticas com potencial zoonótico.
O diagnóstico da angiostrongilose canina é confirmado através do encontro de L1 nas fezes de cães infectados, pelo método de Baermann. A identificação torna-se mais precisa quando os parasitos são avaliados pelo exame morfológico. Porém, este método é raramente possível, uma vez que a liberação larval é irregular.
Diante das dificuldades dos exames parasitológicos, tem-se a necessidade de se recorrer aos exames sorológicos para o diagnóstico da angiostrongilose canina. Vários ensaios imunológicos têm sido desenvolvidos ao longo dos anos, porém com algumas limitações, como por exemplo, a presença de antígenos comuns a outros parasitos, caracterizando reatividade cruzada. Portanto, os esforços vêm sendo dirigidos na busca de um antígeno que permita identificar especificamente os anticorpos produzidos contra
4
1.1 – Histórico
A. vasorum é um parasito do sistema circulatório de cães domésticos e canídeos
silvestres que foi encontrado pela primeira vez por SERRES (1853) na França, após a observação de nematóides no sistema circulatório de um cão que morreu subitamente na cidade de Toulouse.
Em 1866, BAILLET descreveu este parasito como sendo Strongylus vasorum e posteriormente BOSSI, em 1871 o classificou como Ematozoa filaria cardiaca.
Em 1905, KAMENSKY, discutindo a posição sistemática destas duas espécies de protostrongilideos e pelas suas características morfológicas concluiu que as espécies descritas anteriormente, pertenceriam ao gênero distinto: Angiostrongylus, incluindo as espécies Angiostrongylus vasorum (Baillet, 1866) e Angiostrongylus cardiacus (Bossi, 1871).
Mais tarde, RAILLET & HENRY (1907) criaram o gênero Haemostrongylus para a espécie Strongylus vasorum. Este gênero foi reconhecido por diversos autores, porém estabelecendo a prioridade do nome Angiostrongylus, conforme as regras Internacionais de Nomenclatura Zoológica, fazendo o gênero Haemostrongylus cair em sinonímia.
COSTA (1992) comparando as descrições feitas do parasito por vários autores, concluiu como sinônimos de Angiostrongylus vasorum (Baillet, 1866) Kamensky, 1905, as seguintes espécies: Strongylus vasorum Baillet, 1866; Entomozoa filaria cardiaca Bossi, 1971; Haemonchus vasorum (Baillet, 1866) Slviter & Swellwngrebel, 1912;
Haemostrongylus railliet Travassos, 1927; Angiostrongylus railliet (Travassos, 1927)
Dougherty, 1946; Angiocaulus railliet (Travassos, 1927) Grisi, 1971.
1.2 - Posição Taxonômica
Na classificação taxonômica atual, a espécie Angiostrongylus vasorum segundo COSTA et al., (2003) pertence à Classe Nematoda, Ordem Strongylidae, Superfamília Metastrongyloidea, Família Protostrongylidae, Subfamília Angiostrongylinae, Gênero
5
1.3 - Morfologia de Angiostrongylus vasorum
A espécie é caracterizada por apresentar corpo delgado e alongado, ligeiramente atenuado nas extremidades, coloração esbranquiçada ou rósea quando recém-colhidos. A cutícula é fina e transparente, deixando perceber o aspecto helicoidal dos órgãos genitais em torno do tubo digestivo, contrastando sua coloração esbranquiçada com a tonalidade rósea ou acinzentada do intestino. Apresenta uma ligeira dilatação na cutícula da extremidade cefálica, abertura bucal pequena e ovalada e apresentando seis papilas peri-bucais. O poro excretor situa-se ventralmente abaixo da união do esôfago e intestino. Os machos medem cerca de 13 mm de comprimento por 0,24 mm de largura, apresentando a extremidade posterior levemente recurvada ventralmente. Apresentando bolsa copuladora e raios bursais evidentes. As fêmeas, entretanto, são maiores e mais robustas, medem cerca de 17 mm de comprimento por 0,26 mm de largura (LIMA et.
al., 1985; COSTA, 1992; COSTA et al., 2003). As larvas de primeiro e terceiro estádio
de A.vasorum têm em comum a presença de um botão cefálico na extremidade anterior e cauda levemente recurvada (CONBOY, 2000).
1.4 - Distribuição
A distribuição de A. vasorum parasitando cães domésticos é caracterizada por áreas endêmicas e regiões de ocorrência isolada do parasito (BOLT et al., 1994). Dentre as principais áreas endêmicas está o oeste da Alemanha (PALLASKE, 1967), Irlanda (DODD, 1973; JACOBS & PROLE, 1975; LYNCH, 1977, WILLIAMS et al., 1985) Inglaterra (SIMPSOM & NEAL, 1982; COBB & FISHER, 1990; SIMPSOM, 1996; KRIEK, 2001; CHAPMAN et al., 2004) e a Dinamarca (BOLT et al., 1993). Com relação aos casos isolados, existem relatos de A. vasorum em paises como Suíça (ECKERT & LÄMMLER, 1972), Uganda (BWANGAMOI, 1974), Ásia (ECKERT & LÄMMLER, 1972), Austrália (ROBERTS, 1940), Itália (POLI et al., 1984), Dinamarca (WILLINGHAM et al., 1996), Estados Unidos, Canadá (CONBOY et al, 1997), Espanha (SEGOVIA et al. 2001) e Hungria (SRÉTER et al., 2003).
6
canídeos silvestres são escassos. DODD (1973) encontrou 80% de infecção natural em cães na Irlanda, BWANGAMOI (1974) verificou em Uganda, na África, a ocorrência de 21% de cães naturalmente infectados. Na Itália, foi observada uma prevalência de 26,6% de raposas parasitadas por A. vasorum (POLI 1984). Em Copenhagenm, WILLINGHAN (1996) encontrou uma prevalência de 35,6% de A.vasorum em raposas e mais recentemente, SEGOVIA et al. (2001) determinaram uma prevalência de 21% de infecção em lobos na Espanha, demonstrando desta forma, a importância destes animais na manutenção do ciclo deste parasito.
No Brasil, TRAVASSOS (1927) relatou um caso de canídeo silvestre infectado, por Haemostrongylus railliet (= A. vasorum) recuperados do ventrículo direito e artéria pulmonar de cachorro do mato (Cerdocyon thous azarae), provenientes do município do Rio de Janeiro. A ocorrência de A. vasorum em cães domésticos (Canis familiaris) provenientes do Rio Grande do Sul foi relatada por GONÇALVES (1961). Em 1962, LANGENEGGER et al., registraram o encontro de dois cães naturalmente infectados na cidade do Rio de Janeiro. Em Salvador-BA, FEHRINGER & FIEDLER (1977) cita a ocorrência de dois casos de A. vasorum em cães domésticos (Canis familiaris). No interior do Estado do Paraná, GIOVANONNI et al., (1985), relataram a ocorrência de
A. vasorum em um cão adulto, atendido e necropsiado pelo Serviço de Clínica Médica
do Hospital da Escola de Agronomia e Veterinária da Universidade Federal do Paraná. Em Minas Gerais, LIMA et al. (1985) realizaram a descrição morfológica de espécimes de A. vasorum, colhidos das artérias pulmonares de dois cães (Canis familiaris) procedentes do município de Caratinga – MG. Estudando a ocorrência de helmintos em cães do mato na Zona da Mata Mineira, HORTA-DUARTE et al., 2004, encontraram A.
vasorum parasitando uma fêmea de canídeo silvestre (C.thous azarae).
1.5 – Ciclo Evolutivo
7
ração de cães, lesmas do gênero Arion provenientes de área enzoótica demonstrou pela primeira vez a participação de moluscos no ciclo evolutivo de A. vasorum possibilitando assim, um melhor entendimento do ciclo.
Posteriormente a este trabalho pioneiro, várias espécies de lesmas (Arion ater,
Arion rufus, Arion lusitanicus, Deroceras reticulatum, Limax flavus, laevicaulus altes)
gastrópodos terrestres (Achatina fulica, Arianta arbustorum, Bradybaena similaris,
Cepaea nemoralis, Cochlodina laminata, Eceparympha physana, Helix pomatia, Helix aspersa, Prosopeas javanicum, Subulina octona, Succinea putris) e gastrópodos
aquáticos (Biomphalaria glabrata, Biomphalaria pfeifferi, Physa sp.) foram descritas como possíveis hospedeiros intermediários de A. vasorum (ROSEN et al., 1970; GUILHON & CENS, 1973; SAUERLANDER & ECKERT, 1974).
Assim, após a ingestão ou penetração das larvas de primeiro estádio (L1) do parasito, que são eliminadas junto com as fezes do cão, o molusco passa a fazer parte do ciclo, ocorrendo mudas de larvas de primeiro estádio (L1) para larva de segundo estádio (L2) e para larva de terceiro estádio (L3). Embora o molusco não faça parte da alimentação eleita pelos cães, à ingestão pode ocorrer de forma acidental junto com a água, grama ou ainda pelo hábito coprofágico realizados por alguns cães que acabam ingerindo moluscos infectados que colonizam fezes de cães (BESSA, 1996). Além de moluscos como hospedeiros intermediários, BOLT, et al (1993), demonstraram que rãs (Rana temporaria) infectadas experimentalmente por A. vasorum, podem ser inseridas ao ciclo biológico deste parasito, atuando como hospedeiros paratênicos.
8
pulmonares ou são deglutidas, sendo eliminadas junto com as fezes (GUILHON & CENS, 1973; BWANGAMOI, 1974; MAHAFFEY et al, 1981; PATTESON et al., 1993).
No ambiente, as L1 podem permanecer no bolo fecal ou atingir coleções de água na qual o molusco pode se infestar dando continuidade ao ciclo.
Segundo CURY & LIMA (1996) o período pré-patente de A. vasorum em cães experimentalmente infectados pode variar de 28 a 108 dias. Em infecções crônicas e subclínicas os parasitos adultos podem viver e continuar a colocar ovos durante toda a vida do hospedeiro (CONBOY, 2000).
LIMA et al. (1994) ao encontrarem larvas de primeiro estádio de A. vasorum nas fezes de raposas (Dusicyon vetulus) ressaltaram a importância de canídeos silvestres como reservatório na manutenção da infecção em cães domésticos. Além de canídeos, o
A. vasorum também foi observado parasitando texugos (Meles meles) (TORRES et al.,
2001) e mustelídeo como a irara (Tayra barbara senex) (YAMAGUTI, 1961). Adicionalmente, as infecções experimentais comprovaram a permissividade do chacal dourado (Canis aureus), gato doméstico (Felis cattus domesticus) e do rato do Nilo (Arvicanthis niloticus) (ECKERT & LÄMMLER, 1972).
1.6 - Patologia
As primeiras descrições anátomo-patológicas em cães parasitados por A.
vasorum foram realizadas por LAULANIÉ (1882, 1884) apud ECKERT & LAMMLER
(1972) no qual observou alterações ao nível cárdio-pulmonar, estando relacionada com desenvolvimento do parasito e a localização nos órgãos do cão infectado, como trato intestinal, linfonodos mesentéricos, fígado, pulmão, coração e outros órgãos os quais são invadidos acidentalmente pelo parasito.
9
Com relação às lesões cardíacas, frequentemente observa-se uma dilatação do ventrículo direito e hipertrofia do ventrículo esquerdo devido à resistência a circulação pulmonar pela presença do parasito nos pulmões. Também foram relatadas miocardite crônica e áreas enfartadas que podem variar de acordo com a fase da doença (DARRASPEN et al., 1953; ACEDO et al., 1979).
Os linfonodos mediastinos, bronquiais e submandibulares podem-se apresentar intumescidos e hemorrágicos, caracterizando uma linfadenite generalizada (PRESTWOOD et al., 1981).
Lesões renais decorrentes da infecção também foram observadas. Estas incluem infarto glomerular levando a uma necrose e glomerulonefrite crônica, devido à presença de imunoglobulinas, complemento e fibrinogênio, além de antígenos de parasitos adultos nos glomérulos e tubos coletores (BWANGAMOI, 1974; CARUSO & PRESTWOOD, 1988).
Anormalidades de coagulação sanguínea também é um quadro que pode ocorrer na angiostrongilose canina, onde se observa sufusões hemorrágicas e hematomas cerebrais, as quais desenvolvem trombocitopenia e aumento do tempo de protrombina parcial ativada. As anormalidades de coagulação foram atribuídas à presença do parasito no interior das artérias causando um depósito de imuno-complexos levando inapropriadamente, a ativação da cascata de coagulação fazendo presente a coagulopatia de consumo (SCHELLING et al., 1986; RAMSEY et al., 1996).
Dentre as manifestações clínicas decorrentes da angiostrongilose canina, pode-se observar perda de peso, intolerância a exercícios, dispnéia, alterações nos batimentos cardíacos e presença de edemas localizados em diferentes áreas como no espaço submandibular, tórax e pernas, (DODD, 1973; SIMPSON & NEAL, 1982; PATTESON
et al. 1987; MIGAUD et al., 1992; BOLT et al., 1994 e CURY & LIMA 1996). Também
se pode observar tosse seca persistente, mucosas pálidas e dores abdominais (JONES et
al., 1980; BRENNAN et al., 2004).
Distúrbios no sistema nervoso como ataxia, depressão e paralisia dos membros, assim como lesão ocular e conseqüente perda da visão associada à infecção por
A.vasorum foram descritas por PERRY et al., (1991). Adicionalmente, um caso não usual
10
Resultados de diversos autores mostraram que não existe um comportamento ortodoxo de migração das larvas deste parasito. Assim, as localizações erráticas constituem um fato importante na patogenia da infecção pelo A. vasorum, pois, as larvas podem morrer e produzir lesões extensas e graves a ponto de subverter a arquitetura do órgão no qual estão localizadas (ROSEN et al., 1970; BHAIBULAYA, 1975; PERRY
et al., 1991; COSTA, 1992; CURY & LIMA, 1995; COSTA & TAFURI, 1997;
OLIVEIRA-JÚNIOR et al., 2004).
Apesar de a doença estar, geralmente, associada a esses sinais bastante variados, foram observados casos de animais assintomáticos, o que sugere que a distribuição desta parasitose possa ser bem maior que o relatado na literatura (RAMSEY et al. 1996). Contudo, as profundas alterações produzidas no hospedeiro definitivo em decorrência do parasitismo por A. vasorum, não são patognomônicas e podem ser confundidas com outras patologias (MAHAFFEY et al., 1981).
1.7 - Diagnóstico
Para o diagnóstico da angiostrongilose canina, o encontro de larvas de primeiro estádio nas fezes do cão é primordial para um diagnóstico específico (CONBOY, 2000). O método de Baermann é o método clássico usado para a demonstração de larvas do parasito nas fezes de cães infectados. O diagnóstico post mortem pode ser realizado, onde parasitos adultos, ovos e larvas podem ser encontrados em órgãos parasitados, principalmente no coração e pulmões (COSTA, 1992).
O diagnóstico conclusivo pode ser feito com base nos resultados dos testes laboratoriais conjuntamente com os dados clínicos e epidemiológicos. Entretanto, um diagnóstico definitivo da doença requer a demonstração do parasito. A maior dificuldade, no diagnóstico, porém, deve-se ao fato de os sinais clínicos da doença não serem muito específicos, uma vez que podem ser confundidos com os de outras enfermidades.
11
promovidas pelo parasitismo (CURY, 1999; CURY et al., 2001). DARRASPEN et al., (1953), utilizaram o eletrocardiograma em cães infectados naturalmente e observaram presença de hipertrofia e/ou dilatação do ventrículo direito. Estudos radiológicos em cães naturalmente e experimentalmente infectados demonstraram as primeiras alterações entre cinco a sete semanas após a infecção (PATTESON et al., 1993; RAMSEY et al., 1996; CONBOY, 2000).
Em cães, a lavagem broncoalveolar é utilizada na colheita de amostras para a realização de exames complementares importantes para o diagnóstico de diversas infecções pulmonares (MELLO & FERREIRA, 2003), como por exemplo, na angiostrongilose canina. Embora seja uma metodologia relativamente invasiva, sua utilização permite o encontro de L1 vivas e ativas, recuperadas diretamente dos pulmões, além de permitir um diagnóstico mais rápido detectando larvas antes da passagem pelo trato gastrointestinal (BARÇANTE, 2004).
GUILHON et al., (1970) estudando a reação de hipersensibilidade cutânea em cães infectados experimentalmente por A. vasorum e A. cantonensis utilizando antígenos de parasitos adultos de A. cantonensis, observaram que 11 cães entre 16 inoculados com A. vasorum mostraram intradermoreação positiva para o antígeno em questão.
Relatos sobre a utilização dos testes sorológicos demonstram que os mesmos podem se utilizados conjuntamente com os exames parasitológicos no diagnóstico da angiostrongilose canina.
GUILHON et al (1971), realizaram os primeiros ensaios de diagnóstico imunológico utilizando antígenos preparados a partir de adultos de A. vasorum. Testaram soros de cães inoculados por A. vasorum e por A. cantonensis e encontraram uma alta especificidade com o antígeno preparado usando os testes de reações de aglutinação de látex, imunoeletroforese e reação de fixação de complemento. Observaram também, que a resposta humoral em cães infectados é caracterizada por um aumento expressivo nos níveis de anticorpos anti- A. vasorum.
MISHRA & BENEX (1972) estudaram a especificidade imunológica de A.
vasorum e A. cantonensis e fizeram observações com soros homólogos e reação cruzada
12
detectadas pelo teste de dupla difusão e eletroforese mostraram linhas comuns de precipitação, demonstrando a presença de antígenos comuns, além de antígenos específicos nos extratos antigênicos desses dois nematóides.
O teste “Enzyme Linked Immunosorbent Assay” (ELISA) foi utilizado pela primeira vez por COSTA et al., (1996) como um método de diagnóstico da angiostrongilose canina detectando anticorpos reativos para A. vasorum. Segundo os autores, há presença de altos níveis de anticorpos IgG circulantes em cães experimentalmente infectados a partir do 14o dia após a infecção decorrente da síntese de antígenos durante a migração e mudas das larvas e a grande atividade metabólica dos parasitos.
Segundo CURY et al., (1996), o teste de ELISA foi capaz de detectar anticorpos específicos anti - A. vasorum a partir do 14o dia após a infecção, corroborando com os resultados obtidos por BARÇANTE (2004). Porém, este teste também foi capaz de detectar anticorpos não específicos, caracterizando a ocorrência de reação cruzada com antígenos de outros helmintos. A necessidade de uma pré-adsorção dos soros de cães infectados por A. vasorum com antígenos de outros parasitos podem minimizar a interferência de anticorpos não específicos encontrado frequentemente em cães (CURY
et al., 1996). Desta forma, para se definir o teste como método sorológico eficiente e
específico para o diagnóstico da angiostrongilose canina, há necessidade de se verificar a ausência de reações cruzadas com outras helmintoses.
Com relação à técnica de Immunoblotting, CURY et al., (2002), analisaram o comportamento do anticorpo IgG presente nos soros de cães experimentalmente infectados por A. vasorum utilizando antígeno somático de parasitos adultos. Foi observado um forte reconhecimento das proteínas de peso molecular estimados em 115 e 102 KDa, indicando-as como as principais proteínas na infecção por A. vasorum.
13
Diversos grupos de pesquisas vêm demonstrando que a utilização de antígenos purificados em lugar de antígenos totais, contribui para o aumento significativo na especificidade das técnicas de diagnóstico imunológico de helmintos (KAMIYA et al., 1973; SUZUKI et al., 1975; KUM & KO, 1985, 1986; YEN & CHEN, 1991; EAMSOBHANA et al., 2001; ABRAHAM et al. 2004).
A identificação e caracterização dos componentes antigênicos são de fundamental importância quando se prepara um antígeno adequado para técnicas de sorodiagnóstico, preparação de vacinas e análises imunopatológicas (REVILLA-NUÍN
et al., 2005). Como exemplo, antígenos purificados de Fasciola hepatica, Dirofilaria immitis e Schistosoma mansoni dentre outros, já são utilizados em técnicas de
diagnóstico que mostram uma alta sensibilidade e especificidade (GOMEZ-MUNOZ, et
15
2- JUSTIFICATIVA
Cães infectados por A. vasorum podem apresentar manifestações clínicas múltiplas que vão desde uma anemia, alopecia e tosse crônica podendo chegar a uma broncopneumonia hemorrágica e até mesmo levar o animal a morte por insuficiência cardio-respiratória.
Associado a isso, a ocorrência de cães assintomáticos sugere que as condições relacionadas à epidemiologia podem ser mais difundidas do que realmente se tem relatado (MARTIM et al., 1993).
Assim, uma vez que o diagnóstico clínico é pouco conclusivo, novas técnicas têm sido estudadas no intuito de se obter maiores subsídios para um acompanhamento e diagnóstico da infecção.
O método de diagnóstico mais freqüentemente utilizado envolve o encontro e identificação de larvas de primeiro estádio nas fezes de cães (BOLT et al., 1994). Entretanto, em alguns casos, as larvas não são excretadas continuamente, intercalando períodos de alta eliminação com períodos de negativação do exame parasitológico nas fezes, levando a resultados falso-negativos. (PATTESON et al, 1993; BOLT, 1994).
Até o presente, os testes padronizados para o diagnóstico da angiostrongilose canina não levam a resultados satisfatórios, visto que uma vez que detectam anticorpos específicos contra A. vasorum, também podem detectar anticorpos inespecíficos, o que resultaria em reações cruzadas contra outros helmintos como Toxocara canis,
Ancylostoma caninum e Dipylidium caninum podendo levar a uma resposta imunológica
com uma especificidade variada.
O “padrão ouro” para a obtenção de resultados positivos para casos de angiostrongilose canina ainda é o exame parasitológico, sendo necessário à padronização de outras técnicas citadas na literatura para o diagnóstico definitivo.
16
Assim, a separação e a purificação das proteínas que compõem o extrato solúvel de diferentes estádios deste parasito que possam funcionar como antígenos que identifiquem uma resposta sorológica no hospedeiro definitivo são de grande importância para aprimorar técnicas no diagnóstico afirmativo desta helmintose.
A cromatografia é um método que utiliza diversas técnicas de isolamento e purificação de uma amostra biológica e que está fundamentada na migração diferencial dos componentes de uma mistura. Esta técnica é o método comumente usado para a obtenção de proteínas purificadas (COPELAND, 1994).
18
3- OBJETIVOS
3.1 – Objetivo Geral
Identificar e purificar proteínas de parasitos adultos de A. vasorum selecionando-as para o imunodiagnóstico da angiostrongilose canina pelo ELISA indireto.
3.2 - Objetivos Específicos
- Identificar as proteínas que compõem o antígeno total de larvas de primeiro estádio e parasito adulto de A. vasorum;
- Determinar por “Immunoblotting” os antígenos de L1 e de parasitos adultos que se ligam a anticorpos (IgG, IgA, IgE e IgM) e medir a freqüência de reconhecimento das proteínas que interagem com estes anticorpos presentes no soro de cães experimentalmente infectados em diferentes fases da infecção;
- Verificar se há reações cruzadas com proteínas de L1 e de parasito adulto de A.
vasorum com soros de cães naturalmente infectados com helmintos gastrointestinais Toxocara canis, Ancylostoma caninum e Dipylidium caninum;
- Purificar, através de cromatografia de imunoafinidade, as proteínas de parasito adulto de A. vasorum;
- Padronizar o teste de ELISA para detecção de anticorpos específicos que reagem com as proteínas purificadas de A. vasorum;
- Avaliar a cinética de produção do anticorpo IgG no soro de cães experimentalmente infectados por A. vasorum utilizando as proteínas purificadas A. vasorum;
20
4- MATERIAL E MÉTODOS
4.1- Manutenção da Cepa de Angiostrongylus vasorum
A cepa de A. vasorum utilizada neste trabalho foi originalmente isolada das fezes de um cão naturalmente infectado, proveniente do Município de Caratinga – MG (LIMA et al., 1985) e vem sendo mantida em laboratório através de passagens sucessivas em cães mantidos no Biotério de Cães do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais (ICB-UFMG) e em moluscos da espécie
Biomphalaria glabrata mantidos no moluscário do Departamento de Parasitologia.
4.1.1 - Recuperação de larvas de primeiro estádio (L1)
Para a recuperação de larvas de primeiro estádio (L1), foram coletadas amostras de fezes de cães experimentalmente infectados e mantenedores da cepa.
Após recolhidas, as fezes foram submetidas à realização do exame Baermann Moraes (BAERMANN & MORAIS, 1948), o qual consiste em um funil de vidro de 15 cm de diâmetro conectado a um tubo de hemólise através de uma mangueira de látex. As fezes foram pesadas, envolvidas com gaze cirúrgica e colocadas dentro do funil de vidro onde posteriormente foi adicionada água aquecida a 40oC. Após um período de 24 horas, o tubo de hemólise foi recolhido, centrifugado a 200g por 5 minutos e o sobrenadante desprezado. O sedimento foi ressuspenso em cinco mL de água de torneira e retiradas três alíquotas de 10 µl para a contagem de larvas em microscópio estereoscópio (25X). A quantidade de L1 por mL foi estimada por regra de três simples, utilizando à média das três alíquotas retiradas anteriormente. Após a contagem, as L1 foram armazenadas em alíquotas de 500 µl a -20oC até sua utilização.
4.1.2 - Infecção dos moluscos
21
Os moluscos foram colocados individualmente em placas de cultura de célula de seis poços (Falcon, Becton Dickinson Labware, Franklin Lakes, NJ, EUA) onde foram colocados 1000 L1 de A. vasorum diluídas em 10 mL de água não tratada com cloro. As placas foram mantidas sob foco de luz com lâmpada de 60W a uma distância de 50 cm por 24 horas. Após este período, os moluscos foram transferidos para uma cuba de plástico, medindo 25 x 16x 10 cm, preenchida com um volume de 1 litro de água não tratada com cloro. As cubas foram mantidas à temperatura ambiente no moluscário do Departamento de Parasitologia do ICB-UFMG. Os animais foram alimentados a cada três dias com alface fresca e a higienização das cubas foi realizada semanalmente.
4.1.3 - Recuperação de larvas de terceiro estádio (L3)
Os moluscos com 21 dias de infecção foram triturados em gral e pistilo de porcelana e, em seguida enrolados em gaze cirúrgica e submetidos ao aparelho de Baermann e Morais por 24 horas. Após este período, o tubo de hemólise contendo as larvas de terceiro estádio foi centrifugado a 250g por 5 minutos. Em seguida o sobrenadante foi desprezado e o sedimento foi ressuspenso em 5 mL de PBS 0,1M pH 7,2 retirando-se três alíquotas de 10µl para a contagem das larvas L3 utilizando microscópio estereoscópio (25X), as quais foram utilizadas na infecção experimental dos cães.
4.2-Animais
22
três exames de fezes, em intervalos de três dias, pelo método de Sedimentação Espontânea (FERREIRA-NETO & MAGALHÃES, 1982) para pesquisa de ovos de helmintos e pelo método de Baermann para pesquisa de larvas de helmintos pulmonares. A partir do 30º dia de vida, os cães foram imunizados com vacina octopla-valente (Duramune®, Fort Dodge) em três doses, com intervalos de vinte dias. Aos seis meses de idade, os cães receberam uma dose de vacina anti-rábica (Rai-Vac ®,Fort Dodge).
Os cães foram criados livres de A. vasorum, em compartimentos individualizados e cimentados. A higienização das celas e dos solários foi realizada diariamente com hipoclorito de sódio 1%. Os cães foram alimentados com ração comercial, conforme indicação do fabricante e água fresca ad libitum.
Trinta dias antes do início da realização dos experimentos, foram coletados, de todos os animais, 5 mL de sangue por punção da veia broncocefálica cranial, para realização de exames para pesquisa de leishmaniose visceral e babesiose canina.
4.2.1 - Infecção experimental
Os animais utilizados no experimento foram divididos aleatoriamente em 3 grupos:
O grupo A constituído por 20 animais infectados individualmente com 100 larvas infectantes/Kg de peso vivo (Kg/pv) ressuspensas em 5 mL de PBS 0,1M pH 7,2 com auxílio de uma seringa de 10mL. Os cães foram fisicamente contidos e infectados diretamente na porção final da cavidade bucal do animal, facilitando a deglutição.
O grupo B constituído por cinco animais correspondendo ao grupo controle onde todos os animais receberam um inóculo de 5 mL de PBS 0,1M pH 7,2.
O grupo C constituído por três animais infectados individualmente com 200 larvas infectantes/Kg de peso vivo (Kg/pv) ressuspensas em 5 mL de PBS 0,1M pH 7,2 com auxílio de uma seringa de 10mL, diretamente na porção final da cavidade bucal do animal para a recuperação de parasitos adultos.
23
4.2.2- Coleta dos soros
No dia da infecção (dia zero) e aos 15, 30, 90, 180, e 210 dias após a infecção, os cães foram fisicamente contidos, e de cada animal foram coletados 5 mL de sangue através da punção da veia radial, utilizando sistema de coleta Vacuntainer® (Becton Dickinson).
Foram ainda utilizados soros de 60 cães não infectados por A. vasorum porém positivos para um ou mais helminto gastrintestinal dos gêneros Toxocara, Dipylidium e
Ancylostoma que compõe a soroteca do Laboratório de Helmintologia Veterinária do
Instituto de Ciencias Biológicas.
Esses animais foram provenientes do Centro de Controle de Zoonoses da Prefeitura Municipal de Belo Horizonte – MG (Anexo VIII). O diagnóstico destes cães foi realizado através de exames de fezes pelo método de Sedimentação para pesquisa de ovos de helmintos, pelo método de Baermann para pesquisa de larvas de helmintos pulmonares e posteriormente, realizada a necrópsia seguindo o mesmo protocolo descrito no item 4.3.
As amostras de sangue foram acondicionados em tubos de hemólise, centrifugados por dez minutos a 200 g para a obtenção do soro. O soro foi dividido em alíguotas de 200 µ L e estocados em freezer a – 20oC para posterior realização dos testes imunológicos.
4.3 - Procedimento de Necrópsia
Para a recuperação de parasitos adultos foram utilizados os animais do Grupo C mencionado no item 4.2.1.
A partir do 35º dia de infecção, foram colhidas fezes dos animais, diariamente para a realização do exame de Baermann e para a determinação do período pré-patente, consequentemente comprovando a infecção.
24
que estabelece normas práticas Didático-Científico da vivissecção de animais (Anexo VII). Todos os procedimentos relacionados à eutanásia, necrópsia e coleta de material foram aprovados pelo Comitê de Ética em Experimentação Animal da Universidade Federal de Minas Gerais (CETEA/UFMG) e acompanhados de um Médico Veterinário.
Após exame geral macroscópico, foi retirado o conjunto cárdio-pulmonar e colocado em um Pirex de vidro contendo PBS 0,1M pH 7,2. Cada órgão foi examinado individualmente fazendo observações de seu aspecto.
Para recuperação dos helmintos, o coração e pulmões foram separados e submersos em um Pirex de vidro contendo PBS 0,1M pH 7,2. As artérias pulmonares e suas ramificações foram abertas com o auxílio de tesoura de ponta fina. Os parasitos foram retirados com auxílio de um estilete e colocados em uma placa de Petri contendo PBS 0,1M pH 7,2. Posteriormente, os parasitos foram lavados em PBS estéril, colocados em tubos cônicos para micro-centrífuga e congelados em freezer à temperatura de – 20oC, para posterior utilização no preparo de antígenos para o uso nos testes imunológicos.
4.4 - Identificação das Proteínas de Angiostrongylus vasorum
4.4.1 - Preparações de antígenos de L1 e de parasitos adultos
Para os procedimentos de identificação e transferência das proteínas foram utilizadas preparações contendo 16X105 L1 ou 600 parasitos adultos (machos e fêmeas). O material acondicionado conforme descrito nos itens 4.1.1 e 4.3 foi colocado em um tubo de centrífuga, ressuspenso em 5 mL de PBS 0,1M pH 7,2 contendo 20 µl de coquetel de inibidores de proteases (Complete Protease Inhibitor Cocktail – Boehringer Manheimm Biochemicals). Posteriormente, o material foi sonicado (potência de 20 W, freqüência de 20 ondas ultrasonográficas por segundo, amplitude 4, potência máxima) em aparelho de ultra-som (Branson Sonc Power Company-Sonofer Cell Disruptor 450),
25
O material sonicado foi transferido para tubos de micro-centrífuga e centrifugado durante 30 minutos a 12000g, 4oC (Eppendorf Centrifugue 5410 – Brinkmann Instruments Inc. – Cantiaque) e posteriormente filtrado em um filtro Millex HV de 0,25µm (Millipore®), sendo denominado a seguir de antígeno bruto solúvel de larva de primeiro estádio de A. vasorum (AgL1Av) e antígeno bruto solúvel de parasito adulto de A. vasorum (AgPAAv).
O antígeno bruto solúvel de parasito adulto de T. canis (AgPATc), A. caninum (AgPAAc) e D. caninum (AgPADc) foram obtidos seguindo o mesmo protocolo referido para A. vasorum.
A concentração total de proteínas nas amostras de antígenos foi estimada pelo método de LOWRY et al (1951) usando como padrão concentrações conhecidas de soro albumina bovina (BSA). A seguir, o antígeno foi aliquotado e estocado à – 20oC.
4.4.2 - Eletroforese em gel de poliacrilamida (SDS-PAGE)
A SDS-PAGE para a separação das proteínas que compõem o AgL1Av e AgPAAv foi realizada segundo LAEMMLI (1970). Foram testadas concentrações de proteínas de 0,5 mg/mL, 1 mg/mL e 3 mg/mL.
O gel de separação a 10% de poliacrilamida, para aplicação de amostra de L1 e 7,5%, para aplicação de amostra de parasito adulto (Anexo I) foi polimerizado entre duas placas de vidro mantidas a uma distância de 1 mm por meio de espaçadores de plástico. Após sua polimerização, foi aplicado o gel de concentração a 4% (Anexo I).
Após a padronização, as amostras de antígenos na concentração de 1 mg/mL foram diluídas em tampão de amostra 2X concentrado (Anexo I) fervidas a 100 oC por três minutos e aplicados em um mini-gel de canaleta única no aparelho Mini-Protean II (Bio Rad).
A corrida das proteínas foi conduzida a 30 mA e 100 V., à temperatura ambiente por aproximadamente 90 minutos.
26
4.4.2.1 - Coloração pelo azul de Coomassie
Após a eletroforese, o gel de poliacrilamida foi mantido por 15 minutos em solução corante de azul de Coomassie à temperatura ambiente (Anexo I), sob agitação. Em seguida, o gel foi submerso em uma solução descorante de proteínas (Anexo I), sendo mantido a temperatura ambiente sob agitação por um período de 5 minutos ocorrendo várias trocas da solução descorante até a visualização das bandas de proteínas.
4.4.3 – “Immunoblotting”
Para a identificação de proteínas do AgL1Av e AgPAAv foram utilizados soros de 10 animais pertencentes ao Grupo A no dia da infecção (dia zero), 15, 30, 90, 180 e 210 dias após a infecção, bem como 30 soros de animais naturalmente infectados por T.
canis, A. caninum e D. caninum nas concentrações de 1:25, 1:50, 1:100 e 1:200.
A transferência das proteínas do gel (Mini-Protean II) para a membrana de nitrocelulose (SIGMA, MO, USA) foi realizada no aparelho Minitrans-Blot (Bio Rad). Os “sanduíches” para a transferência foram montados da seguinte forma: esponja “Scoth Brite”, quatro folhas de papel filtro, membrana de nitrocelulose mais quatro folhas de papel filtro e novamente esponja “Scoth Brite”. As esponjas assim como os papéis de filtro foram previamente umedecidas em tampão de transferência (Anexo II). Em seguida, o suporte de acrílico foi fechado e inserido na cuba de transferência (BIORAD). As transferências foram realizadas em temperatura ambiente por 18 horas a 30 V. e 40 mA, seguida de uma hora a 90 V.. O sucesso da transferência foi certificado pela coloração de parte da membrana com solução de Ponceau’s a 1 % (Anexo II) por um minuto e descoradas em água destilada para a visualização das proteínas transferidas e dos padrões de peso molecular.
27
adicionadas, em cada canaleta, concentrações pré-estabelecidas de soros de animais positivos e negativos para A. vasorum em diferentes fases da infecção, bem como soros de animais naturalmente infectados por outros helmintos diluídos em PBS 0,1M pH 7,2 Tween 20 a 0,05% + Leite Molico desnatado 1% (Quadro 1). A seguir, a membrana foi colocada sob agitação lenta por 1 hora à temperatura ambiente.
Após este período, os soros foram retirados das canaletas e as fitas lavadas três vezes por 10 minutos com PBS 0,1M pH 7,2 Tween 20 a 0,05% sob agitação. Posteriormente, as membranas foram incubadas por 60 minutos com anticorpo conjugado com peroxidase, previamente diluído em PBS em concentrações previamente padronizadas que reconhece imunoglobulinas de cão (IgG, IgE, IgM ou IgA- Tabela 1) sob agitação e à temperatura ambiente. Decorrido o período de incubação, as membranas foram novamente lavadas três vezes por dez minutos com PBS 0,1M pH 7,2 Tween 20 a 0,05%, sendo que na última lavagem foi utilizado PBS 0,1M pH 7,2, sob agitação e incubadas com substrato (Anexo II) por aproximadamente 30 seg. a 60 seg. A reação foi interrompida colocando as fitas em água destilada por 5 minutos.
28
Quadro 1 - Protocolo para identificação de proteínas imunoreativas do antígeno bruto solúvel de larva (L1) e parasito adulto de Angiostrongylus vasorum utilizando soros de cães experimentalmente infectados.
Procedimentos Ag.L1 Ag.
PA Volume/Canaleta Tempo
IgG 1:100 1:100
IgM 1:100 1:100
IgA 1:50 1:50
IgE
Diluição da amostra
1:100 1:200
1 mL de PBS-T + leite em pó desnatado 1%
60 min.
Lavagem das canaletas – 2 mL PBS –T 0,05% (três vezes de 10 minutos)
IgG 1:1000 1:1000
IgM 1:1000 1:1000
IgA 1:500 1:500
IgE
Diluição do anticorpo conjugado com
peroxidase 1:1000 1:2000
1 mL de PBS
0,1M pH 7,2 60 min.
Lavagem das canaletas – 2 mL PBS –T 0,05% (duas vezes de 10 minutos), sendo a terceira lavar em PBS pH 7,4
Revelação
(12 mg de 3,5 Diaminobenzidina diluídos em 12 mL de PBS e 06 mg
de 4- Cloro – 1 naftol diluídos em 02 mL de metanol e 10 mL de PBS 0,1M pH 7,2) acrescentar 10 µL de
Peróxido de Hidrogênio 30%
Aproximadamente 30 seg.-IgG,IgM,IgE
60 seg.- IgA
Interrupção da
reação Água destila por cinco minutos
Ag. L1 – Antígeno de larva de primeiro estádio de Angiostrongylus vasorum Ag. PA - Antígeno de parasito adulto de Angiostrongylus vasorum
29
Quadro 2 – Painel de anticorpos utilizados nos testes imunológicos para detectar classes de imunoglobulinas presentes nos soros de cães infectados por Angiostrongylus
vasorum, cães infectados por outros helmintos e cães controle.
Ac anti-Ig-Cão para Avaliação da Resposta Imune Humoral Especificidade
Hospedeiro Clone Isotipo
Afinidade Molecular
IgA – HPRO Camundongo K117 1AB IgG2b Cadeia α
IgG – HPRO Cabra - - Molécula
Total
IgE - HPRO Camundongo E6-2A1 IgG2a Cadeia ε
IgM – HPRO Cabra - - Cadeia µ
Todos os anticorpos foram produzidos pela Bethyl Laboratories, INC (Montgomery – Texas, EUA)
IgA-HPRO - α Imunoblobulina A conjugada com peroxidase
IgG-HRPO – Cadeia total de Imunoglobulina G conjugada com peroxidase IgM-HRPO - γ Imunoglobulina M conjugada com peroxidase
30
4.5 - Purificação dos Anticorpos Policlonais (PcAbs)
anti-Angiostrongylus vasorum por Cromatografia de Imunoafinidade
A purificação dos PcAbs anti-A. vasorum teve como objetivo a eliminação de anticorpos inespecíficos visando posteriormente, a purificação de antígenos específicos de A. vasorum.
4.5.1 - Preparação da Sepharose CL 4B ligada a antígenos de parasito
adulto de Toxocara canis, Ancylostoma caninum, Dipylidium caninum
A purificação dos PcAbs anti-A. vasorum foi realizada em duas etapas: a primeira etapa consistiu da preparação de uma coluna de imunoafinidade Sepharose 4B ativada com Brometo de Cianogênio (Sepharose 4B-CNBr) ligada a antígenos de T.
canis, A. caninum, D. caninum e soro de cães não parasitados.
Esses antígenos foram ligados á Sepharose 4B-CNBr de acordo com as recomendações do fabricante (Amersham Pharmacia). Foram utilizados 3 g da resina Sepharose 4B – CNBr ressuspensa em HCl 1mM e centrifugada a 3000 g durante 15 minutos a 4oC por cinco vezes descartando o sobrenadante. Após esta etapa, a resina foi lavada com Tampão de ligação 0,1M pH 8,3 contendo NaCl 0,5M (Anexo III) e centrifugada duas vezes a 3000 g durante 15 minutos.