UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE ODONTOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM PATOLOGIA ORAL
DENISE HÉLEN IMACULADA PEREIRA DE OLIVEIRA
EXPRESSÃO IMUNO-HISTOQUÍMICA DAS PROTEÍNAS GLUT-1 E HIF-1
α
EM LESÕES VASCULARES DE MUCOSA ORAL.
Denise Hélen Imaculada Pereira de Oliveira
EXPRESSÃO IMUNO-HISTOQUÍMICA DAS PROTEÍNAS GLUT-1 E HIF-1
α
EM LESÕES VASCULARES DE MUCOSA ORAL.
Dissertação apresentada ao Colegiado do Programa de Pós-Graduação em Patologia Oral da Universidade Federal do Rio Grande do Norte - UFRN, como parte dos requisitos para obtenção do Título de Mestre em Patologia Oral
Orientadora: Profª. Lélia Maria Guedes Queiroz
Oliveira, Denise Hélen Imaculada Pereira de.
Expressão Imuno-histoquímica das proteínas GLUT-1 e HIF-1α em lesões vasculares de mucosa oral / Denise Hélen Imaculada Pereira de Oliveira. – Natal, RN, 2011.
108 f. : il.
Orientadora: Profª. Drª. Lélia Maria Guedes Queiroz.
Dissertação (Mestrado em Patologia Oral) – Universidade Federal do Rio Grande do Norte. Centro de Ciências da Saúde. Programa de Pós-Graduação em Patologia Oral.
1. Neoplasias de Tecido Vascular – Dissertação. 2. Diagnóstico diferencial – Dissertação. 3. Biomarcadores Farmacológicos – Dissertação. I. Queiroz, Lélia Maria Guedes. II. Título.
A Deus, por me permitir esta VITÓRIA!
Tudo no tempo e na vontade de Deus, que é boa, perfeita e agradável.
A Maria Santíssima, que me ilumina e me conforta nessa caminhada rumo ao céu. “Imaculada Maria do povo. Mãe dos aflitos que estão junto à cruz”
Aos meus pais, Francisco Nirton e Honorina Maria, os melhores pais, meu eterno amor e agradecimento. Que mesmo com todas as dificuldades e a saudade nunca pouparam esforços para a realização dos meus sonhos. Tudo que eu sou devo a vocês. Todo meu
amor eu dedico a vocês.
! " ! " !
# ! ! ! $
% ! ! &
AGRADECIMENTO ESPECIAL
À Professora Drª Lélia Maria Guedes Queiroz
Palavras não são o bastante para expressar toda minha gratidão por minha querida orientadora. Admiração que trago desde a graduação, onde me foi dada a
primeira oportunidade para entrar no mundo da pesquisa e da docência. Obrigada por ser minha orientadora, amiga, cúmplice, facilitar minha vida em alguns
momentos e, principalmente, por me apoiar sempre.
Que nos próximos anos essa cumplicidade possa sempre continuar aumentando.
" ! ! !&
AGRADECIMENTOS
Bem, essa parece ser a parte mais fácil de uma dissertação, mas digo a vocês, não é! Ter que lembrar de cada pessoa que de alguma forma te deu forças, ânimo, te empolgou pra fazer esse trabalho e fazê-lo direito é uma grande responsabilidade.
Aos demais familiares, principalmente aos meus avós maternos, a minha tia Lucinete e minha prima (irmã) Aline.
Obrigada pelo apoio e compreensão por eu permanecer “longe” de casa.
! " 2 ! -! ! 3
! + ! $ ! 45
# # !&
,-! $ ! 6 .78..1
Aos Professores
Profª Drª Ana Miryam da Costa Medeiros - minha querida “Tia Miryam”, exemplo de simplicidade e sabedoria inata, muito obrigada pelo incentivo, acolhimento e carinho de sempre.
Profª Drª Éricka Janine Dantas da Silveira - que eu tenho como minha “irmã” (patológica) mais velha, meu respeito, minha admiração e meu exemplo de determinação. Agradeço por contribuir, e muito, com meu conhecimento científico ao longo do curso.
Profª Drª Lélia Batista de Souza - que no seu jeito singular de ser, mostra verdadeira disposição de contribuir com o crescimento científico de todos os seus “filhos”. Rígida em alguns momentos, mas, ao mesmo tempo compreensível e adoradora do seu trabalho.
Profº Drª Márcia Cristina da Costa Miguel - exemplo de inteligência e profissionalismo. Inteligência como a sua, poucos têm.
Profº Drª Roseana de Almeida de Freitas – agradeço pela disponibilidade, atenção e pelo aprendizado.
Profº Drº Manuel Antônio Gordón-Núñez - professor jovem, belo, simples e sempre com um sorriso no rosto e disposto a dividir seus conhecimentos.
Profº Drº Antônio de Lisboa Lopes Costa - nosso tão querido “Costinha”, sempre tão alto astral e atencioso.
Profº Drº Leão Pereira Pinto - professor culto, responsável pela fundação desse Programa de Pós-Graduação que já formou muitos mestres e doutores.
Aos Funcionários da Patologia Oral - UFRN
Francisco Canindé de Macedo, Hévio Lucena, Ricardo Lima, Idelzuite de Souza, Maria das Graças Galvão e Sandovânia Oliveira (Sandrinha), agradeço ao apoio, a paciência, o auxílio e a disponibilidade.
Lourdes Souza (Lourdinha) – minha querida “Garotinha”, você merece um obrigada especial. Agradeço imensamente pela alegria contagiante, por tornar os dias mais leves no convívio diário. Com você sempre está “Tudo legal, Positivo”.
Patrícia – querida Patrícia, a clínica de estomatologia, sem dúvidas, é mais prazerosa graças aos seus cuidados e atenção com todos nós.
Ao Programa de Pós Graduação em Patologia Oral /UFRN
Agradeço pela oportunidade de seguir a área de ensino que sempre me identifiquei.
Aos colegas da Patologia
Adriana Costa, Adriana Amorim, Águida Henriques (Sempre tão solícita), Alessandra Barreto, Ana Rafaela (Sempre tão bela), Conceição Aparecida (Cida, querida), Cinthya Helena (que talvez nem saiba, mas você me deu um conselho que nunca esquecerei, quando ainda não era bolsista da patologia na graduação: “Procure o professor que você mais gosta e diga que quer participar da base de pesquisa em Patologia Oral”, meu obrigada especial), Emeline Lima (uma das pessoas mais pura de coração que eu conheço “Emyline, Obrigadinha”), Emília Beatriz, Felipe Matos, Fernando Nóbrega (meu irmão patológico, sempre sorrindo), Joabe Pereira (grande personalidade), José Nazareno, Keila Martha, Maiara de Moraes, Marcelo Gadelha, Pedro Paulo (PP, para sempre “mucocele”), Rodrigo Gadelha e Stefânia Ferreira (Sté, empatia à 1ª vista e à 1ª saída), obrigada a todos pelo coleguismo e amizade, pela troca de experiências.
A minha turma do mestrado
Ana Luiza, Bárbara Monteiro, Clarissa Demeda, Dmitry Sarmento, Edilmar Santos, Lucileide Castro, Natália Guimarães, Pedro Carlos e Roseane Vasconcelos.
Para a realização desse trabalho foi essencial também o convívio com aqueles que quase diariamente estavam ao meu redor; ajudando nas dúvidas que por vezes me surgiam, apoiando nos momentos difíceis que todos nós passamos e, até mesmo, presentes nos momentos mais descontraídos. Ter vocês como amigos de turma fez toda a diferença nesses dois anos de mestrado. O meu Sincero Agradecimento acompanhado de muito carinho e amizade.
As minhas “Xuxu’s ”
de cumplicidade eterna, e até na data de aniversário – Dia 15 de Julho é nosso dia, nosso aniversário - “O que Deus une... ninguém separa”. Você é minha Xuxuzinha mais “Perfeita” e eficiente.
Bárbara Monteiro – A Xuxu Flor, tenho em você um modelo (ou, “uma modelo”, pra combinar com seu jeito de ser) de mulher forte que sabe o que quer, e mais ainda o que não quer. Você não é somente “Brabara”, você é “Bárbara Esplêndida” e eu tenho muito orgulho de te ter como companheira de doutorado e de amizade.
Clarissa Demeda – A Xuxu mais espelhada por todas as outras. Um exímio exemplo de organização, determinação e por que não de “Nerd”? Sua presença na nossa turma fez toda a diferença. Tenho muita alegria por continuarmos amigas de pós-graduação.
Natália Guimarães - A Xuxu mais doce de todas. Natália você é única e por ti tenho um carinho mais que especial. Você é a última a saber das coisas, mas tenho certeza que é uma das primeiras a ser lembrada quando se trata de pessoas puras e doces. O que teria sido esse mestrado sem seus seminários perfeitos? Você é muito querida, viu!
Roseane Vasconcelos - A Xuxu Ímpar! E se existe “outras vidas” tenho certeza que somos amigas desde a 1ª, pois só isso para explicar tanta amizade, tanta cumplicidade e tanta afinidade entre nós. Você me deu uma prova de amizade mesmo antes de nos considerarmos amigas: apresentou no mestrado o 1º seminário de Imunologia (de Imuno!!) no meu lugar só para me ajudar. Vasconzinha, já vivemos 1001 histórias: “Encontramos o Fofinho, procuramos o Nemo, achamos Painho” e estarei sempre pronta e à disposição para viver outros milhões de histórias.
Aos Amigos que a Patologia me deu
Pedro Carlos – “Peter Charles”, pessoas como você estão em extinção. Obrigada por ter nos proporcionados momentos memoráveis nesse mestrado. “Você é um homem bom de um coração melhor ainda”.
Raniel Peixoto - meu Rani querido, meu companheiro de dança, meu amigUSP.... que Ribeirão Preto te proporcione todo o sucesso que você merece e terá. Rani, meu amigo. Que possamos dividir as alegrias e sofrimentos da vida de pós-graduando.
As Minhas Amigas companheiras da graduação
“Amigos são anjos enviados por Deus para nos proteger e cuidar de nós aqui na terra”
Vocês, minhas amigas de anos, que mesmo sem saber, estavam sempre me ajudando. Toda atenção dispensada comigo, as conversas que eram pra aliviar a cabeça. Sempre que estou com vocês parece que tenho mais paz, calma, tranquilidade, que são itens fundamentais para manter nosso eterno laço de amizade! Vocês são testemunhas da minha descoberta pelo gosto da docência. Obrigada de coração a Aline (amow), Amanda (Amandão coisa linda), Camyla (Cacau anjo), Carlinha (flor), Clara (minha alma gêmea), Dani (minha solicitude), Débora (minha eterna dupla, minha futura comadre), Éricka (meu bem), Nanda Amorim (minha sempre torcida), Janine (Jam, meu amor), Luana (Lú), Pryscyla (Preki, meu bem, minha pequena grande mulher) e Raíssa (Rá), vocês não são apenas parte de mim, mas da minha vida! Coloquei em ordem pra não dizer que amo mais uma que a outra!
As minhas amigas “Dádivas de Deus”
- ! ! ! ! 2 ! ! !
# $ # " !&
, 9! : ;1
RESUMO
O correto diagnóstico histológico de lesões vasculares em mucosa oral é fundamental, sobretudo na hora de definir o tratamento e prognóstico, visto que algumas dessas lesões apresentam involução. Este trabalho analisou a expressão imuno-histoquímica da proteína humana transportadora de glicose (GLUT-1), em tumores vasculares benignos orais e reclassificou tais lesões de acordo com sua imunoexpressão. Além disso, avaliou a expressão imuno-histoquímica do fator 1 induzível por hipóxia (HIF-1α), principal fator de transcrição envolvido na adaptação celular à hipóxia. Foram analisados 60 casos de tumores vasculares benignos orais, sendo 30 casos com diagnóstico histológico de HEM e 30 casos de granulomas piogênicos orais (GP). Os resultados desta pesquisa demonstraram que das 30 lesões inicialmente classificadas como HEM, apenas 7 apresentaram imuno-positividade para GLUT-1, permanecendo com o diagnóstico inicial. As 23 restantes foram reclassificadas em malformação vascular (MV) 13 casos e GP 10 casos . Todos os casos da amostra com diagnóstico inicial de GP apresentaram-se negativos para GLUT-1. Quanto à imunoexpressão do HIF-1α, o teste de Mann-Whitney revelou diferença estatisticamente significativa entre os casos de GP e MV(p=0,002), onde a mediana do GP (m=78) foi superior a da MV (m=53). Com base nesses resultados, este estudo mostrou que o diagnóstico histológico por si só nem sempre é suficiente para o diagnóstico correto do HEM oral e que o HIF-1α participa da patogênese das lesões vasculares.
ABSTRACT
The correct histological diagnosis of vascular lesions in the oral mucosa is critical, especially in defining the treatment and prognosis, as some vascular lesions show spontaneous involution and others do not show such behavior. This study analyzed the expression immunohistochemistry of human glucose transporter protein (GLUT-1), in oral benign vascular tumors and to reclassify such lesions according to with his immunoexpression. In addition, we evaluated the immunohistochemical expression of hypoxia-inducible factor 1 alpha (HIF-1α), the main transcription factor involved in cellular adaptation to hypoxia. We analyzed 60 cases of benign oral vascular tumors: 30 cases with histological diagnosis of HEM and 30 cases of oral pyogenic granuloma (PG). The results of this research showed that of the 30 lesions initially classified as HEM, only 7 showed immuno-positivity for GLUT-1, remaining with the initial diagnosis. The remaining 23 were reclassified as vascular malformation (VM) (13 cases) and PG (10 cases). All cases in the sample with an initial diagnosis of PG were negative for GLUT-1, demonstrating the accuracy of histological diagnosis of these lesions. Concerning to the immunoexpression of HIF-1α, the Mann-Whitney test revealed a statistically significant difference between the cases of GP and MV (p = 0.002), where the median of GP (m=78) was higher than the MV (m=53). Based on these results, this study showed that a histological diagnosis alone is not always sufficient for the correct diagnosis of oral HEM and that HIF-1α participates in the pathogenesis of vascular lesions.
LISTA DE ILUSTRAÇÕES
Página Quadro 1. Classificação das lesões vasculares - Mulliken e Glowacki (1982).. 35 Quadro 2. Classificação das lesões vasculares – Sociedade Internacional
para o estudo de anomalias vasculares – ISSVA (1996)... 36 Quadro 3. Distinção das características entre hemangiomas e malformações
vasculares. Pedron et al. (2008)... 40 Quadro 4. Especificidade, clone, fabricante, diluição, recuperação antigênica
e tempo de incubação dos anticorpos primários a serem utilizados
no estudo... 63 Quadro 5. Critérios histopatológicos para o diagnóstico das lesões
vasculares... 65 Figura 1. Estrutura molecular bidimensional da GLUT. Fonte: Adaptado de
Machado; Schaan, Seraphim (2006)... 42 Figura 2. Processos Fisiológicos e Patológicos nos quais o HIF tem função
regulador central. Fonte: Semenza (2000)... 48
Figura 3. Representação esquemática da família do HIF. Fonte: Rankin; Giaccia
(2008)……… 49
Figura 4. Genes ativados na presença do HIF. Fonte: Rankin; Giaccia
(2008)... 52 Figura 5. Fotomicrografia do GP exibindo a superfície da lesão composta
por área de ulceração e um tecido conjuntivo fibroso frouxo com intenso infiltrado misto permeado por numerosos vasos
sanguíneos de calibres variados (H/E- 100x). Natal,
RN-2012... 73 Figura 6. Detalhe em maior aumento do GP, mostrando vasos sanguíneos
associados a uma inflamação mista difusa (H/E- 400x). Natal,
RN-2012... 73
Figura 7. Fotomicrografia do HEM exibindo numerosos vasos associados a uma proliferação endotelial (H/E- 100x). Natal,
RN-2012... 74
Figura 8. Detalhe em maior aumento do HEM, mostrando intensa proliferação de células endoteliais (H/E- 400x). Natal,
Figura 9. Fotomicrografia demonstrando a imunoexpressão da GLUT-1.
Natal, RN-2012... 75
Figura 10. Fotomicrografia demonstrando a imunoexpressão d HIF-1α.
LISTA DE TABELAS
Página Tabela 1. Imunoexpressão do anticorpo anti-GLUT-1 em GP e HEM
orais. Natal, RN-2012... 69 Tabela 2. Percentuais médios do número de células positivas para a
proteína HIF-1α na amostra de GP oral. Natal, RN-2012... 70 Tabela 3. Percentuais médios do número de células positivas para a
proteína HIF-1α na amostra de HEM oral. Natal, RN-2012... 71 Tabela 4. Percentuais médios do número de células positivas para a
proteína HIF-1α na amostra de MV orais. Natal, RN-2012... 71 Tabela 5. Tamanho da amostra, mediana, quartis 25 e 75 e média dos
postos para os percentuais de expressão da proteína HIF-1α entre as lesões categorizadas. Natal, RN-2012...
LISTA DE SIGLAS E ABREVIATURAS bFGF Fator básico de crescimento de fibroblastos GLUT Facilitadores de transporte de glicose GLUT-1 Proteína humana transportadora de glicose
GP Granuloma Piogênico
HEM Hemangioma
HEMCRI Hemangioma congênito rapidamente involutivo HEMCNI Hemangioma congênito não involutivo
HIF Fator de transcrição induzível por hipóxia HIF-1α Fator 1-α induzível por hipóxia
HIF-1β Translocador nuclear receptor aril hidrocarbono, ARNT HPH HIF prolil-hidroxilase
HK Hemangioendotelioma kaposiforme HREs Elementos responsivos à hipóxia IFN-α Interferon alfa
ISSVA Sociedade Internacional para o Estudo de Anomalias Vasculares
MV Malformação vascular
MAV Malformação arterio-venosa MCV Malformação capilar-venosa
MCLV Malformação capilar-linfática-venosa MLV Malformação linfática-venosa
MCAV Malformação capilar-arterio-venosa
MCLAV Malformação capilar-linfática-arterio-venosa ODD Domínio de degradação oxigênio-dependente PDGF Fator de crescimento derivado de plaquetas pVHL Proteína supressora de tumor
SGLT Transportadores de glicose ligados ao íon sódio TIMP-1 Inibidores de metaloproteinase do tipo 1
SUMÁRIO
Página 1 INTRODUÇÃO... 28 2 REVISÃO DA LITERATURA... 31 2.1 GRANULOMA PIOGÊNICO... 31 2.2 HEMANGIOMA E MALFORMAÇÕES VASCULARES... 34 2.3 GLUT-1... 40 2.4 HIF-1α... 46 3 PROPOSIÇÃO... 57 4 MATERIAIS E MÉTODOS... 59 4.1 CARACTERIZAÇÃO DO ESTUDO... 59 4.2 POPULAÇÃO... 59 4.3 AMOSTRA... 59 4.3.1 Critérios de inclusão da amostra... 60 4.3.2 Critérios de exclusão da amostra... 60 4.4 ESTUDO MORFOLÓGICO... 60 4.5 ESTUDO IMUNO-HISTOQUÍMICO... 60 4.5.1 Método imuno-histoquímico... 60 4.5.2 Análise imuno-histoquímica... 63 4.6 ANÁLISE ESTATÍSTICA... 65 5 RESULTADOS... 68 5.1 RESULTADOS MORFOLÓGICOS... 68 5.2 RESULTADOS IMUNO-HISTOQUÍMICOS... 68 5.2.1 Análise Qualitativa da marcação Imuno-histoquímica pelo
anticorpo Anti-GLUT-1... 68 5.2.2 Análise Quantitativa da marcação Imuno-histoquímica pelo
1. INTRODUÇÃO
Conceitua-se anomalia vascular a lesão de etiologia congênita ou adquirida cujos componentes predominantes são estruturas vasculares. São incluídas neste grupo todas as malformações congênitas do sistema vascular, os tumores vasculares benignos, como o hemangioma (HEM) e granuloma piogênico (GP) e também os tumores vasculares malignos (ENJORAS; WASSEF; CHAPOT, 2009).
Apesar da padronização dessa classificação, alguns autores continuaram classificando, genericamente, essas lesões como HEM, dificultando o estudo e o conhecimento das mesmas (HASSANEIN et al., 2011). O HEM pode apresentar características histológicas e clínicas similares ao GP e à malformação vascular (MV), o que também dificulta a classificação das lesões.
O GP é um crescimento tumoral reacional bastante comum na cavidade oral. Representa cerca de 30 a 60% de todas as lesões que acometem a gengiva. Histologicamente, caracteriza-se por uma exuberante reação de granulação rica em vasos sanguíneos de calibres variados, por vezes ingurgitados por eritrócitos e dilatados, sendo os mesmos revestidos por células endoteliais e pericitos mitoticamente ativos (SILVEIRA et al., 2004; JAFARZADEH; SANATKHANI; MOHTASHAM, 2006; SHENOY; DINKAR, 2006).
O termo hemangioma foi restrito a lesões que exibiam proliferação celular, que surgia após o nascimento (em 60% dos casos), crescia rapidamente e regredia em um período variável. Microscopicamente, nessa lesão observam-se numerosas células endoteliais proliferantes dilatadas e o lúmen vascular geralmente indistinto que durante o estágio de progressão, originam abundantes espaços vasculares de diversos tamanhos (RODRIGUES et al., 1998; FREITAS et al., 2005; GONTIJO et al., 2005). As MVs estão presentes ao nascimento, têm um crescimento proporcional ao da criança, e microscopicamente apresentam endotélio quiescente e são considerados defeitos na morfogênese vascular, provavelmente devido a uma disfunção nas vias de regulação da embriogênese e vasculogênese, compreendendo todas as malformações congênitas do sistema vascular, tais como as malformações arteriais, venosas, linfáticas, capilares e suas combinações. (ENJORAS; WASSEF; CHAPOT, 2009).
investigar fatores que possam contribuir no diagnóstico diferencial, haja visto que essas lesões em muitas situações exibirem características clínicas e histológicas semelhantes devido a presença do componente vascular.
A proteína humana transportadora de glicose (GLUT-1), identificada por North et al. (2000) tem recebido especial atenção por ser atualmente considerada um marcador imuno-histoquímico sensível e específico para HEM de pele. Merece destaque também o marcador de hipóxia, representado pelo fator 1 induzível por hipóxia (HIF-1α), devido ao fato da hipóxia tumoral ser um evento importante no desenvolvimento e progressão dos tumores, sendo considerado um fator prognóstico adverso em tumores sólidos, particularmente nos localizados em cabeça e pescoço.
2.1GRANULOMA PIOGÊNICO
O granuloma piogênico (GP) consiste em uma lesão benigna de natureza não neoplásica relativamente comum de tecido mole, que se desenvolve a partir do tecido conjuntivo como uma reação inflamatória a uma irritação crônica, não específica e de baixa intensidade. Esse tecido conjuntivo altamente vascularizado é sede de uma reação de granulação (GOMES; DUARTE, 2008). Apresenta uma grande incidência na cavidade oral, correspondendo a 3,81% a 7% de todas as lesões orais, embora possa ocorrer em outras mucosas e pele (SILVEIRA et al, 2004; LAWOYIN et al., 1997; AVELAR et at., 2008).
O GP foi descrito pela primeira vez por Porcet e Dor (1887), com o nome de infecção botrimicótica. O termo Granuloma Piogênico é citado no texto “Doenças da
pele” por Croker (1903), passando a ser utilizado na literatura mundial em 1904, após
ter sido inserido por Hartzell, que sugere que essa lesão fosse causada por microrganismos piogênicos capazes de desencadear uma inflamação granulomatosa (FOWLER et al.,1996; NEVILLE et al., 2009).
Contudo, apesar desta denominação ser a mais utilizada, sabe-se que a lesão não é um granuloma verdadeiro, isso, pelo fato de não se evidenciar uma formação exuberante de material purulento (REGEZI; SCIUBBA; JORDAN, 2008). Outras denominações são, também, citadas na literatura para esta lesão, como o termo hemangioma capilar lobular, introduzido em 1980, por médicos dermatologistas, por muitas vezes, ser caracterizado por uma intensa proliferação vascular organizada em lóbulos, e granuloma gravídico, para configurar as lesões que acometem frequentemente, as mulheres em gestação (SILLS et al., 1996; HARRIS et al., 2000).
Existem diversos fatores que podem estar associados à patogênese do GP. Para muitos, a lesão representa, na maioria dos casos, uma resposta tecidual excessiva do tecido conjuntivo a uma irritação local ou a um trauma (SHENOY; DINKAR, 2006). Inicialmente se descrevia que o GP era uma infecção por Estafilococos e Estreptococos
Dentre os fatores que podem acarretar o aumento tecidual, podem-se destacar principalmente as irritações crônicas locais e traumas de baixa intensidade, tais como cálculos dentários, restaurações defeituosas, biofilme, raízes residuais, próteses inadequadas, corpos estranhos, além de outros agentes traumáticos (JAFARZADEH et al., 2006).
Destacam-se também como fatores etiológicos desta lesão, o uso de certas drogas como a ciclosporina, além das influências hormonais e anomalias citogenéticas (TOLENTINO; TOLENTINO, 2009). O papel dos hormônios na etiologia do GP ainda não está totalmente esclarecido. Alterações hormonais que geralmente ocorrem na puberdade, ou provocadas pelo uso de contraceptivos orais e na gravidez podem modificar a resposta reparadora gengival a agentes irritantes. Nestes casos, podem-se visualizar lesões gengivais múltiplas ou hiperplasia gengival generalizada (REGEZI; SCIUBA; JORDAN, 2008).
Nichols et al. (1992) citaram em sua pesquisa que o estrogênio e a progesterona não são fatores determinantes para o surgimento do GP em gestantes e em mulheres que faziam uso de contraceptivos orais, visto que as lesões avaliadas não apresentavam receptores específicos para esses hormônios. Outros autores afirmam que esses hormônios não são fatores decisivos na patogênese da lesão, mas sim contribuitórios ou secundários (WHITAKER et al, 1994).
Por sua vez, Yuan, Jin e Lin (2002) analisaram em ratas ovariectomizadas, quando estas eram submetidas à injeção de β-estradiol, que a presença dos hormônios femininos não apenas intensificam a quantidade de fatores angiogênicos produzidos por monócitos e macrófagos, mas também os protegem da apoptose, prolongando os efeitos da angiogênese. Os autores concluíram então que o GP trata-se de um crescimento reacional, tanto angiogênico como hormônio-dependente.
Com relação aos aspectos clínicos, o GP freqüentemente apresenta-se como um nódulo ou tumor, pediculado ou séssil, com superfície lisa, lobulada que comumente está ulcerada, recoberta por fibrina, exibindo tendência para hemorragia espontânea ao mínimo traumatismo. Sua coloração vai do vermelho intenso ao vermelho violáceo, dependendo da vascularização. Com consistência que pode ser mole ou firme, e apesar de geralmente ser indolor, em alguns casos apresenta-se latejante ou com discreto ardor. Pode atingir até 2,5 cm e geralmente alcança seu tamanho máximo em semanas ou meses. Radiograficamente, geralmente não há evidências de envolvimento ósseo, mas em alguns casos, ligeira erosão óssea superficial pode ser vista (MARTINS-FILHO et al., 2011). Em 3% dos casos de GP podem ser visualizados extensa perda de osso alveolar e mobilidade dos dentes (SILVERSTEIN; BURTON; SINGH, 1995).
No tocante à localização, o GP pode ser observado na mucosa oral, face e dedos. Em mucosa oral, geralmente, o seu início é a partir de uma papila interdental, correspondendo 30 a 60% de todas as lesões reacionais que acometem a gengiva, sua localização predominante (DEZOTTI et al., 2000; BRUST; DOMINGUES, 2009). Pode manifestar-se, também nos lábios, língua, bochechas e outras áreas da mucosa oral. A região anterior de maxila apresenta-se mais afetada que a mandíbula (SARAVANA, 2009), mais na porção anterior, na faixa de 21 a 50 anos, devido aos efeitos vasculares provocados pelos hormônios femininos (AGUILO, 2002).
O predomínio do sexo feminino foi observado em diversos estudos (SHAMIN et al., 2008; AVELAR et al., 2008; SARAVANA, 2009).
Gordón-Núñez et al. (2010) em uma análise de 293 casos de GP constataram que a essa lesão foi predominantemente na gengiva (83%), seguida por lábios e língua, palato, mucosa jugal e assoalho de boca. Quanto à idade e o sexo, a maior incidência foi na 2ª década de vida e o sexo feminino foi o mais afetado.
Histologicamente esta lesão apresenta uma proliferação de vasos de calibres variados, semelhante ao tecido de granulação, onde os vasos são de calibres variados, por vezes dilatados e obliterados por eritrócitos e, revestidos por células endoteliais e pericitos mitoticamente ativos. Devido a este quadro, o GP, de acordo com alguns autores, também pode ser considerado uma forma de hemangioma capilar (PATIL; MAHIMA; LAHARI, 2006; KUMAR; ABBAS; FAUSTO, 2005).
tipo fibroso frouxo com proliferação de componentes inflamatórios e fibrosos. Na região central, encontra-se tecido de granulação. Observa-se também a presença de numerosos espaços vasculares revestidos por endotélio e a proliferação excessiva de fibroblastos e brotamento de células endoteliais. O conteúdo de eritrócitos nos espaços vasculares é responsável pela coloração vermelha da lesão. Com a cronificação, a lesão torna-se mais fibrosa e há obliteração capilar, redução do componente inflamatório e maior deposição de colágeno (SOLETTI et al., 2004; JAFARZADEH et al., 2006; SHENOY; DINKAR, 2006; NEVILLE et al., 2009). O infiltrado inflamatório é formado por linfócitos e plasmócitos localizados preferentemente na porção profunda da lesão, além de neutrófilos, estando esses últimos localizados próximos da superfície ulcerada (SHENOY; DINKAR, 2006; NEVILLE et al., 2009).
De acordo com Sanchez et al. (2000), o diagnóstico definitivo é confirmado por biópsia. Para Harris et al. (2000), apesar do exame histopatológico determinar o diagnóstico definitivo do GP, certas situações, tais como, ausência de ulceração superficial, com conseqüente diminuição do infiltrado inflamatório misto, e proliferação vascular irregular podem aparentar outra lesão vascular, dificultando o diagnóstico do granuloma piogênico.
2.2HEMANGIOMA E MALFORMAÇÕES VASCULARES
As lesões vasculares são as anomalias congênitas e neonatais mais comuns (WERNER et al., 2001; WERNER et al., 2006). Até recentemente, não houve nenhuma padronização para as lesões vasculares que fosse universalmente aceita (EIVAZI et al., 2009).
Virchow (1863) foi o primeiro autor a classificar, com base na histologia, as anomalias vasculares em: angioma simplex, angioma cavernosum e angioma
racemosum, onde qualquer um desses subtipos poderia transformar um no outro através
clinicamente se apresenta como lesão elevada e avermelhada. Histologicamente, estas lesões eram compostas por uma fina rede de capilares podendo organizar-se em lóbulos. O HEM cavernoso clinicamente era identificado por marca de nascença na face ou como um nódulo azulado na superfície mucosa da boca. Estas lesões eram compostas histologicamente por vasos dilatados com paredes finas. A fístula arterio-venosa congênita era uma persistência da rede vascular embriogênica, manisfestando-se após o nascimento, sendo histologicamente caracterizada por regiões de hipertrofia vascular com a presença de artérias e veias intercomunicantes.
Em 1982, Mulliken e Glowacki sugeriram uma nova classificação das lesões vasculares de acordo com as manifestações clínicas, com o quadro histopatológico e história natural, com o intuito de distinguir malformações vasculares e hemangiomas. As malformações vasculares (MV) estão presentes ao nascimento, têm um crescimento proporcional ao da criança, e microscopicamente apresentam células endoteliais achatadas. O termo hemangioma foi restrito a lesões que exibiam proliferação celular, que surgia após o nascimento (em 60% dos casos), crescia rapidamente e regredia em um período variável (Quadro 1).
HEMANGIOMA MALFORMAÇÕES
Fase Proliferativa e involutiva Sem Fase Proliferativa e Involutiva Proliferação de células endoteliais Ciclo de células normais
40%-Presentes ao nascimento 90%-Presentes ao nascimento Crescimento pós-natal rápido e
Involução lenta
Crescimento proporcional a criança
Razão Sexo (F:M) – 5:1 Razão Sexo (F:M) – 1:1
Quadro 1. Classificação das lesões vasculares – Mulliken e Glowacki (1982).
tufos, hemangioendotelioma kaposiforme (HK) e granuloma piogênico. As MVs consistem em erros da morfogênese e são classificadas de acordo com o vaso
predominante: capilar, venosa, arterial, linfática e combinada. (Quadro 2). Apesar desta classificação não ser absoluta, ela possui uma relevância clínica porque possibilitou um importante avanço na abordagem das anomalias vasculares.
TUMORES VASCULARES MALFORMAÇÕES VASCULARES
Simples Combinadas
HEM Capilar Fístula AV
HEM Congênito Involutivo Linfática MAV, MCV
HEM Congênito Não-Involutivo Venosa MCLV, MLV
GP Arterial MCAV, MCLAV
HK
Angiomas em tufos
(Fístula AV – Fístula Arterio-venosa; MAV-Malformação arterio-venosa; MCV-Malformação capilar-venosa; MCLV-MCV-Malformação capilar-linfática-venosa; MLV-Malformação linfática-venosa; MCAV-MLV-Malformação capilar-arterio-venosa; MCLAV-Malformação capilar-linfática-arterio-venosa.)
Quadro 2. Classificação das lesões vasculares – Sociedade Internacional para o Estudo de Anomalias Vasculares – ISSVA (1996).
Mesmo após a classificação da ISSVA (1996), o termo HEM é usado para diversas lesões, levando a uma confusão no entendimento das lesões vasculares (VERY et al., 2002; JOHANN et al., 2007). Além disso, o HEM pode apresentar características clínicas e histológicas similares ao GP e à MV, o que leva a erros no diagnóstico (NORTH et al., 2000; LEON-VILLAPALOS et al.,2005).
um crescimento limitado (EIVAZI et al., 2009). Os HEMs sofrem crescimento pós-natal por 8-12 meses (fase proliferativa), seguido de regressão para os próximos 1-5 anos (fase de involução), com melhoria contínua até 6-12 anos (fase involuído).
Segundo Buckmiller et al. (2010), os HEMs são sub-divididos em duas categorias com base no seu comportamento clínico e histológico. O mais comum o HEM “infantil” surge logo após o nascimento, prolifera e em seguida, sofre uma involução prolongada. Exibem aparência variável, podem apresentar isolados, multifocais ou como lesões segmentares. Além, de evidenciarem imunopositividade ao marcador GLUT-1 (proteína humana transportadora de glicose), considerado específico para essa lesão. O 2º tipo, menos comum, é o HEM “congênito”. Este tipo raro está presente ao nascimento, não possui uma fase de crescimento como sua contraparte infantil. Por este tipo ser GLUT-1 negativo (NORTH et al., 2001) especulações sobre sua verdadeira origem tem sido levantada. Os HEMs congênitos podem rapidamente involuir (HEM congênito involutivo) ou nunca involuir (HEM congênito não involutivo).
Ambos os tipos apresentam patogênese relacionada à proliferação de células endoteliais. Entretanto, a causa da proliferação aberrante e focal das células endoteliais permanece confusa. A origem dos HEMs, embora ainda discutida, tem sido associada à angioblastos placentários endoteliais ou células progenitoras endoteliais intrínsecas com a habilidade de duplicar clonalmente em um meio preciso de citocinas e estrógenos (KLEINMAN et al., 2005; BARNES et al., 2007).
A origem das células endoteliais dos HEMs da infância tem sido discutida desde que foi demonstrado em estudo imuno-histoquímico uma similaridade entre a vasculatura dos HEMs e da placenta com a descoberta de marcadores tissulares específicos coexpressos nos HEMs e em vasos placentários como GLUT-1, Ag Lewis Y e antígeno endotelial placentário. Estas proteínas não são expressas nas células endoteliais de MVs (NORTH et al., 2000). Com isso, há a hipótese de que as células endoteliais do HEM na verdade, são provenientes da placenta ou se ambas as células endoteliais do HEM e da placenta simplesmente compartilham uma mesma forma de fenótipo imaturo.
caracterizados pela intensa proliferação do endotélio capilar com acúmulo de mastócitos e fibroblastos. Em 1971, Folkman formulou o conceito de que as lesões são angiogênese-dependentes e que moléculas angiogênicas atuariam sobre as células endoteliais e pericitos induzindo a formação da rede capilar (TAKAHASHI et al., 1994).
Avanços nos conhecimentos da angiogênese têm identificado algumas moléculas chaves que controlam o desenvolvimento vascular, incluindo o fator de crescimento celular endotelial vascular (VEGF), que é responsável pela indução de células endoteliais, e o fator básico de crescimento de fibroblastos (bFGF), o qual atua em sinergia com o VEGF, contribuindo, assim, com ativação de angioblastos. Os níveis de VEGF e bFGF são altos no estágio proliferativo do tumor e baixos na fase evoluída ou de resolução (SUN; ZHAO; ZHANG, 2007).
Sundine e Garrett (2007) descreveram os principais fatores angiogênicos envolvidos na formação do HEM que seriam o VEGF, bFGF, fator de necrose tumoral (TNFα), interleucina 8 e os fatores antiangiogênicos, que incluem os inibidores de metaloproteinases tipo 1 (TIMP-1), fator de crescimento transformador beta (TGF-β) e interferon alfa.
De acordo com Chiller et al. (2003) e Freitas et al. (2005), os HEMs infantis são basicamente conseqüência do excesso de angiogênese, enquanto que as MVs poderiam ser o resultado de erros na remodelação do vaso.
Freitas et al. (2005) em seu estudo reforçaram o papel dos fatores angiogênicos na etiopatogênese dos HEMs e GPs, entretanto, através da avaliação da expressão imuno-histoquímica do VEGF e da medição da atividade angiogênica pela coloração de fator von Willebrand (vWF) e CD31 foi mostrado que a quantificação microvascular não é útil no diagnóstico diferencial dessas lesões.
Vasconcelos et al. (2011) avaliaram a atividade angiogênica através da expressão imuno-histoquímica dos anticorpos anti-CD105 e anti-CD34 em 20 casos de MV e 20 casos de GP. Os resultados dessa pesquisa demonstraram que não houve diferença estatisticamente significativa entre as médias de contagem microvascular. Este ensaio reforçou a participação dos fatores angiogênicos na etiopatogênese dos HEMs e dos GPs orais, porém a quantificação da angiogênese não pode ser utilizada como parâmetro para diagnóstico diferencial entre as duas lesões.
localização e a profundidade no tecido, além do grau de congestão dos vasos (REGEZZI; SCIUBBA; JORDANN, 2008).
Corrêa et al. (2007) analisaram 154 casos de lesões vasculares categorizadas como HEM, MV e varizes de boca. Destas, as varizes de boca (65,6%) foram as lesões mais freqüentes. Os pacientes do sexo feminino foram os mais acometidos pelo HEM e varizes de boca. As MV e varizes de boca foram mais prevalentes na 7ª e 6ª década de vida, respectivamente. A localização prevalente dos HEM e varizes de boca foram a superfície ventral de língua, e das MV, os lábios.
O tamanho do HEM é variável dependendo de diversos fatores que incluem, entre outros, idade do paciente e local da lesão. Em geral, é relativamente flácido à palpação, podendo ser circunscrito ou difuso apresentando-se plano ou elevado, com superfície lisa ou nodular e, na maioria das vezes, assintomático (ROCHA et al., 2000). Na maxila ou na mandíbula, ocorrem, ocasionalmente, HEMs centrais (intraósseos), que se apresentam com aspecto radiolúcido, uni ou multilocular, semelhante a alguns cistos (KHURANA et al., 2001). Nesses casos, pode-se ter dificuldade na realização do diagnóstico diferencial por apresentarem aspecto radiográfico semelhante a outras lesões.
Histopatologicamente, os HEMs em desenvolvimento inicial caracterizam-se por apresentarem numerosas células endoteliais dilatadas e lúmem vascular freqüentemente pequeno, comumente denominado de HEM juvenil; já as lesões maduras apresentam células endoteliais achatadas e pequenas e espaços vasculares mais volumosos. O HEM Capilar e HEM Cavernoso são definidos de acordo com o tamanho dos espaços vasculares. O HEM capilar é composto de pequenos vasos de paredes finas do tamanho de capilares, revestidos por uma camada única de células endoteliais achatadas e circundados por uma camada descontínua de pericitos e fibras reticulares. O HEM cavernoso consiste de vasos de paredes finas ou sinusóides cavernosos de permeio a um estroma (NEVILLE et al., 2009; ZHENG et al., 2008). Ao passo que os HEMs sofrem involução, os espaços vasculares tornam-se mais dilatados e amplamente espaçados (NEVILLE et al., 2009).
múltiplas, ou disseminadas e podem variar no padrão de crescimento, bem como podem ser bem delimitadas ou ter infiltração difusa (BUCKMILLER et al., 2010).
Clinicamente, as MVs podem ainda ser subdivididas em lesões de baixo fluxo (incluindo manchas de vinho do Porto, malformações venosas, malformações linfáticas, e algumas lesões combinadas) e lesões de alto fluxo (incluindo malformações arteriovenosas). Para se ter uma melhor correlação entre HEMs e as MVs congênitas, Pedron et al. (2008) relataram um conjunto adicional de orientações para diagnóstico, baseada em três características distintas, incluindo: 1) presença evidente da anomalia ao nascimento, 2)crescimento, 3) evidência de involução da lesão (Quadro 3).
CARACTERÍSTICAS HEM MV
Presente ao nascimento Apenas 30% dos
hemangiomas estão presentes ao nascimento.
Sempre presente ao
nascimento, mesmo que não seja aparente.
Crescimento Crescimento rápido, brusco e
chamativo com duração média entre 8 e 14 meses.
Crescimento lento que só se faz evidente com o passar dos anos.
Involução da lesão Salvo uma porcentagem mínima os hemangiomas sempre involuem em maior ou menor proporção.
Não involuem. Alteração de tamanho está relacionada a infecções, alterações hormonais ou traumas.
Quadro 3. Distinção das características entre hemangiomas e malformações vasculares (PEDRON et al., 2008).
2.3PROTEÍNA HUMANA TRANSPORTADORA DE GLICOSE (GLUT)
Em mamíferos, a oxidação da glicose é responsável pela maior fonte de energia metabólica celular. A membrana plasmática é impermeável a moléculas polares como a glicose, necessitando assim de proteínas carreadoras para transportá-las para o meio intracelular (BELL et al., 1990; OLSON; PESSIN, 1996; BROWN, 2000).
A glicose entra na célula através de dois tipos de proteínas carreadoras: os transportadores de glicose ligados ao íon sódio (SGLT) e os facilitadores de transporte de glicose (GLUT). Os SGLT transportam glicose acoplando sua captura com a do sódio (BELL et al., 1990; SCHEEPERS et al., 2004). A GLUT funciona regulando o movimento bilateral da glicose entre os espaços extra e intracelular, assegurando que um suprimento constante de glicose circulante esteja disponível para o metabolismo através de difusão facilitada (OLSON; PESSIN, 1996). A difusão facilitada é uma forma de transporte passivo na qual a proteína carreadora facilita a passagem de moléculas, se prendendo quimicamente a elas transportando-as assim através da membrana (GUYTON; HALL, 1996).
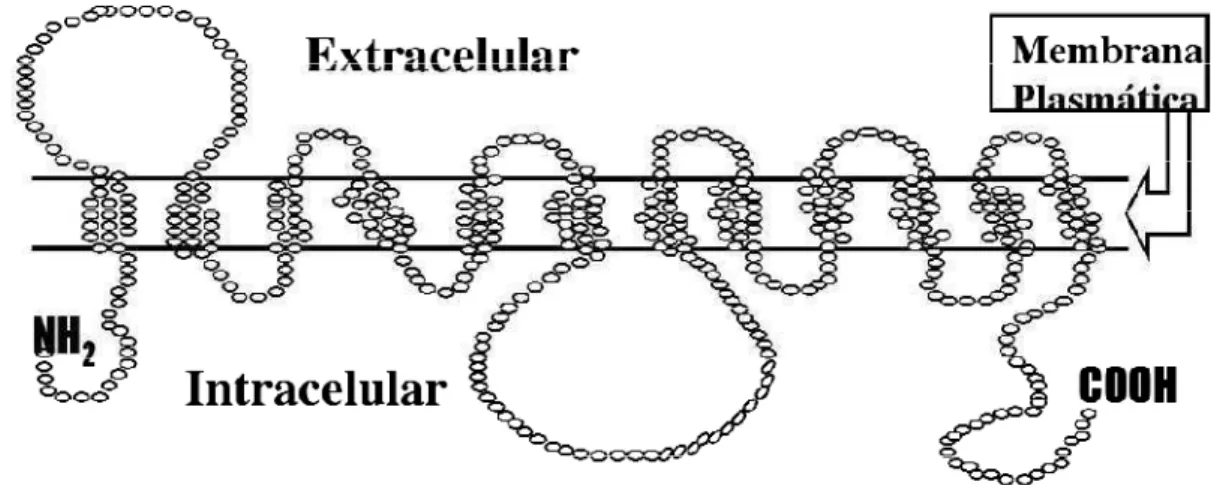
Os facilitadores de transporte de glicose são uma família de 14 membros: GLUT-1 ao GLUT-12, transportador HMIT–H+– ligado ao mio-inositol e GLUT-14. Essas proteínas de 50-60 kDa, são expressas de forma tecido e célula-específicos, apresentando propriedades cinéticas e reguladoras distintas que refletem seus papéis definidos no metabolismo celular da glicose e homeostase glicêmica corporal total. Todas as isoformas possuem 12 segmentos transmembrânicos, hidrofóbicos, inseridos na porção lipídica da membrana plasmática. Os segmentos transmembrânicos estão ligados por alças de conexão, e as terminações NH2 e o COOH localizam-se no intracelular. Nas GLUTs, as sequências transmembrânicas são muito homólogas, enquanto as alças de conexão e as terminações são altamente heterólogas, determinando as especificidades de cada isoforma. (WU; FREEZE, 2002; MACHADO et al., 2006) (Figura 1).
Embora 14 isoformas de GLUT já tenham sido caracterizadas, as 5 primeiras variantes descritas parecem ser as principais, e têm sido foco de estudos que buscam caracterizar os fluxos de glicose, tanto em situações fisiológicas como fisiopatológicas (MACHADO et al., 2006).
1992); o transportador insulino-dependente, GLUT-4 é conhecido por ser expressa em tecido muscular e gordura. GLUT-5 está presente nos enterócitos humanos e tem sido encontrado para ser em grande parte um transportador de frutose (BURANT et al., 1992).
Figura 1. Estrutura molecular bidimensional da GLUT. FONTE: Adaptado de Machado; Schaan, Seraphim, 2006.
A GLUT-1 apresenta um modelo conformacional de doze segmentos transmembrana α-hélice, um amino- e um carboxi-terminal intracelular, um grande “loop” intracelular, e um sítio de N-glicolisação no primeiro “loop” extracelular. O gene GLUT-1 localiza-se no cromossomo 1 (1p35.31.3) (KLEPPER; VOIT, 2002). A expressão deste gene é supra-regulada por uma variedade de agentes e condições: fatores séricos e de crescimento, transformação oncogênica, inoforos de cálcio, hormônio da tireóide; e em resposta a redução na concentração externa de glicose, hipóxia e inibição da fosforilação oxidativa (BEHROOZ; ISMAIL-BEIGI, 1999; BURSTEIN et al., 2006). A estrutura molecular básica das GLUTs é apresentada na Figura 1 (MACHADO et al., 2006).
(mama, pulmão, fígado, estômago, ovário, pele, cabeça e pescoço) como passível de utilização para informação diagnóstica e prognóstica (KUNKEL et al., 2003; MORI et al., 2007).
Uma forte expressão da GLUT-1 em neoplasias ocorre quando as células, em condições de hipóxia, necessitam da via glicolítica como fonte de energia durante a isquemia ou hipóxia tecidual que ocorrem como conseqüência de um fornecimento insuficiente de oxigênio pelo sangue resultante de uma rede vascular tumoral desestruturada. Deste modo, a hipóxia tumoral induz uma superexpressão de genes específicos associados ao crescimento e progressão tumoral, como a GLUT-1, anidrase carbônica e o VEGF, os quais podem ser controlados pelo fator 1 induzível por hipóxia (HIF-1) (KUNKEL et al., 2003; AHOBA et al., 2010 ).
A GLUT1 é indetectável imuno-histoquimicamente na vasculatura da pele normal e tecido subcutâneo, mas é altamente expressa em endotélio em sítios de tecidos sanguíneos, incluindo cérebro, olhos, nervos e placenta sugerindo possíveis associações patogênicas entre hemangiomas juvenil e esses tecidos (HARIK et al., 1990; FARRELL et., 1992).
North et al. (2000) avaliaram a GLUT-1 como um marcador imuno-histoquímico
para diferenciar o HEM do GP e da MV. A marcação de GLUT-1 foi positiva em todas as fases do HEM e negativa nos casos de MV, de GP e hemangioendotelioma. Observaram, também imuno-positividade focal para GLUT-1 em 3 dos 12 angiossarcomas. Esses autores alegaram que alguns patologistas confundem o HEM na fase proliferativa com outras lesões proliferativas como o GP, afirmando que é extremamente difícil distinguir, histologicamente, o HEM, nas fases em involução e involuída, da MV venosa ou arterio-venosa. Concluíram, assim, que GLUT-1 é um marcador imuno-histoquímico confiável e altamente específico para HEM.
hemangioendotelioma. Esses autores observaram que o perfil imuno-histoquímico do HEM é similar ao da placenta, sugerindo uma relação entre a placenta e o HEM e novas hipóteses sobre a origem desses tumores.
Dyduch et al. (2004) avaliaram a expressão de GLUT-1 em 26 casos de HEM,
15 casos de GP, 9 casos de HEM epitelióide de pele. Dezessete dos casos de HEM (65%) apresentaram positividade para GLUT-1 nos vasos. Os casos de GP e HEM epitelióide foram negativos.
Mo et al. (2004) analisando 19 casos de lesões vasculares hepáticos (HEM e MV), observaram nos casos de HEM, imuno-reatividade para GLUT-1 no endotélio dos vasos, mesmo na fase involutiva. Já nos casos de MV hepática não se observou imuno-reatividade para GLUT-1. Esses autores concluíram que a imuno-positividade para GLUT-1 em HEM hepático é uma ferramenta útil para distinguir essa lesão de MV hepática.
Adicionalmente, Nguyen et al. (2004), asseguraram em seu estudo, uma intensa marcação para GLUT-1, em células endoteliais de 100% de casos de HEMs localizados em tronco, genitália e na cabeça incluindo a boca: 2 casos no lábio e 2 na mucosa jugal.
Leon-Villapalos et al. (2005) avaliaram em 19 casos de HEM, 2 de HEM congênito não involutivo, 29 de MV e 4 de GP a expressão de GLUT-1. Foi observada forte marcação da GLUT-1 nas células endoteliais em 95% dos casos de HEM, e ausência de marcação em HEM congênito não involutivo, MV e GP. Os autores concluíram que esse marcador é confiável e específico para HEM, útil na diferenciação de anormalidades vasculares.
Hernández et al. (2005) classificaram 11 casos de lesões vasculares do fígado com base na expressão de GLUT-1 independente de seu diagnóstico histológico. Em seguida, os autores compararam os resultados da expressão de GLUT-1 com o diagnóstico histológico e observaram que a histologia das lesões positivas para esta proteína correspondia a do HEM. A maioria das lesões vasculares negativas para GLUT-1 eram congênitas e provavelmente representavam HEM congênito rapidamente involutivo e HEM congênito não involutivo. Verificou-se que as lesões positivas para GLUT-1 apresentavam maior taxa de proliferação do que as negativas.
boca mostraram negatividade para GLUT-1, sendo reclassificados como GP ou MV de boca. A análise histológica não foi suficiente para concluir o diagnóstico de HEM de boca pelo fato de nenhum desses ser HEM verdadeiro. Todos os casos com classificação inicial de GP e MV foram imuno-negativos para esta proteína, o que demonstrou a eficácia da análise histológica para estas lesões. Portanto, os autores asseguraram que a GLUT-1 é um marcador efetivo para auxiliar no diagnóstico das lesões vasculares benignas de boca.
O carcinoma de células escamosas de cabeça e pescoço também tem sido alvo de estudo para avaliação do valor prognóstico da GLUT-1. Conforme Gillies e Gatenby (2008), a GLUT-1, induzida por hipóxia, poderia provocar um ambiente ácido, devido o estímulo à glicólise, contribuindo, portanto com a invasão celular, degradação da matriz extracelular e angiogênese. Os tumores de baixo grau não experimentariam esse tipo de “pressão ambiental”, pelo fato de que as células malignas ainda poderiam recorrer predominantemente a fosforilação oxidativa para fornecimento de energia.
Kunkel et al. (2003), buscando associar o mecanismo do metabolismo da glicose no crescimento e desenvolvimento tumoral, avaliaram em 118 espécimes de carcinomas de cabeça e pescoço a expressão de GLUT-1. Os autores verificaram que a imunoexpressão da GLUT-1 era mais fraca nos indivíduos com taxa de sobrevida superior a 138 meses, quando comparado com os pacientes com taxa de 60 meses. Além do mais, aqueles pacientes que apresentaram uma resposta negativa a radiação pós-operatória obtiveram uma forte expressão, constatando, portanto, uma alta atividade glicolítica nessas lesões.
Li et al. (2008), ressaltando a importância da expressão da GLUT-1 como preditor de prognóstico em 25 lesões de cabeça e pescoço, constataram que a expressão imuno-histoquímica dessa molécula era significantemente mais fraca nas lesões primárias e bem diferenciadas, quando comparada com os tumores recorrentes (P=0,03) e indiferenciados (P=0,02), respectivamente.
GLUT-1 e que a taxa de sobrevida dos grupos com imunomarcação forte foi inferior quando comparado com as lesões fracamente marcadas.
Ohba et al. (2010) investigaram a expressão imuno-histoquímica da GLUT-1 em 24 casos de carcinoma epidermóide oral e observaram que a marcação estava associada a áreas de front de invasão, profundidade do tumor (p < 0.023) e a taxa de sobrevida,
sugerindo um pior prognóstico (p < 0.046), porém os autores não puderam inferir uma relação dessa proteína com os parâmetros idade, gênero, tamanho do tumor e estágio linfonodal.
2.4FATOR 1 INDUZÍVEL POR HIPÓXIA (HIF-1)
Hipóxia significa deficiência de oxigênio, referindo-se assim a qualquer estado em que existe uma redução do oxigênio disponível. É uma causa extremamente importante e comum de lesão e morte celular, além de ser um dos mais fundamentais de todos os estímulos ambientes (FERREIRA et al., 2006). Assim, como o crescimento tumoral exige oxigênio, nutrientes e função metabólica adequada para se desenvolver, torna-se necessário promover a angiogênese para inibir a apoptose das células tumorais desencadeada pela hipóxia.
As células respondem a estímulos extra e intracelulares para manter a homeostase, e a hipóxia é um dos mais fundamentais de todos os estímulos ambientais (FERREIRA et al., 2006).
A progressão de uma célula normal para a malignidade envolve a capacidade de esta estimular a angiogênese. Inicialmente, o desenvolvimento de um tumor é suprido por vasos sanguíneos próximos. Entretanto, em certo momento de crescimento tumoral estes vasos sanguíneos não são mais suficientes e novos vasos sangüíneos são necessários para continuar o crescimento. A capacidade do tumor de induzir a formação de novos vasos sanguíneos foi denominado “angiogenic switch” e pode ocorrer em diferentes fases da progressão do tumor, sendo dependente do tipo de tumor e do meio ambiente (BERGERS; BENJAMIN, 2003).
suprimento do mesmo oriundo da vascularização os seus vasos, assim as células ficam sob condições de hipóxia (HORSMAN, 1998). Regiões hipóxicas se desenvolvem dentro de tumores sólidos devido a formações aberrantes de vasos sangüíneos e também em decorrência da expansão tumoral.
O fator 1 induzível por hipóxia (HIF-1) é um fator de transcrição envolvido na adaptação celular à hipóxia. Tem um importante papel em processos fisiológicos e patológicos. O HIF facilita o fornecimento de oxigênio e adaptação à privação de oxigênio através da regulação da expressão de genes que estão envolvidos em muitos processos celulares, incluindo a absorção de glicose e do metabolismo, a angiogênese, a eritropoiese, proliferação celular e apoptose (SEMENZA, 2000; SEMENZA, 2001; RANKIN; GIACCIA, 2008; UEHARA, et al., 2009) (Figura 2).
O HIF-1 é um fator de transcrição nuclear que funciona na forma de heterodímero, pertencente à família de fatores de trascrição basic-helix-loop-helix-PAS
Figura 2. Processos Fisiológicos (círculo interno) e patológicos (círculo externo) nos quais o HIF-1 tem função como regulador central. FONTE: Semenza, 2000.
Figura 3. Representação esquemática da família do gene HIF. FONTE: (RANKIN; GIACCIA, 2008).
O gene hif-a humano que codifica a proteína HIF-1α possui 2.478 pares de base e a proteína consiste de 836 aminoácidos, com uma massa molecular que varia de 104 a 116 kDa (RICHARD et al., 1999). O hif-a encontra-se no cromossomo 14 e consiste de
15 exons interrompidos por 14 introns. O exon 2 codifica o domínio bHLH, essencial para dimerização e ligação da proteína com DNA, enquanto a região que vai dos exons 3 ao 8 codifica o domínio PAS. A região carboxi-terminal, que compreende os domínios responsáveis pela ativação e estabilidade da proteína, é codificada nos exons 9 a 15 (SEMENZA, 2006). O gene arnt humano localiza-se na região q21 do cromossomo 1 e
possui 22 exons. O gene processado que codifica para o ARNT possui 2.367 pares de base e a proteína consiste de 789 aminoácidos com uma massa molecualr de 94 kDa (FERREIRA et al., 2007).
O mecanismo de transativação pelo 1 envolve a ligação do complexo HIF-1α/ARNT aos motivos HREs (elementos responsivos à hipóxia), localizados nos promotores e enhancers dos genes alvos. Para a ativação dos genes alvos vários
oxigênio e produz um efeito sinérgico com CBP. Esse efeito é fortemente potencializado pela proteína regulatória do estado redox Ref-1 (fator redox 1), uma proteína que tem atividade redutora de cisteína (CARRERO et al., 2000). Ref-1 interage fisicamente com ambos os domínios TAD-C e TAD-N, levando a uma transativação mais potente. Adicionalmente, a ligação do HIF-1 aos HREs não é suficiente para indução de muitos genes pela hipóxia. Tem-se verificado cooperações sinérgicas entre HIF-1α e outros fatores de transcrição, tais como Smad-3, fator 4 nuclear de hepatócito (HNF4), ATF1/CREB1, proteína 1 ativadora (AP1) e Ets-1 (BRACKEN et al., 2003).
Embora a atividade de muitos fatores de transcrição seja afetada pela oxigenação dos tecidos, portanto, influenciando a regulação gênica, tem se tornado mais evidente que HIF-1 é o fator de transcrição dominante que regula a expressão gênica em resposta aos níveis de oxigênio (PUGH et al., 1997).
A habilidade e a atividade do HIF-1α são reguladas por várias modificações pós-traducionais, tais como hidroxilação, acetilação, nitrosilação e fosforilação (SEMENZA, 2003; FEREIRA et al., 2007). O óxido nítrico promove a estabilização do HIF-1α, ligação ao DNA e a sua transativação sob condições de normóxia, o que favorece o acúmulo HIF-1α; já sob condições de hipóxia o óxido nítrico inibe ou impede o acúmulo de HIF-1α (FEREIRA et al., 2007).
Em relação à fosforilação, muitos genes/oncogenes supressores de tumor influenciam ou são constituintes de cascatas de fosforilação e assim interferem os níveis de expressão do HIF-1α independente do oxigênio. Essas cascatas podem ser iniciadas após fatores de crescimento se ligarem aos receptores de tirosina quinase, que por sua vez ativam os alvos posteriores da via. Existem duas vias principais de fosforilação envolvidas na ativação do HIF-1, vias da proteína quinase ativada e da fosfatidilinositol-3-quinase (FERREIRA et al., 2007).
enzima transfere um átomo de O2 para os resíduos de prolina e o segundo átomo de O2 reage com o 2-oxoglutarato gerando o succinato. Ela também requer ferro como cofator, o qual se liga ao O2 quando mantido no estado ferroso pelo ácido ascórbico. Sua atividade é suprimida pelo decréscimo na tensão de O2. Quando HPH é inibida, a via de degradação do HIF-1α é bloqueada, levando assim ao acúmulo dessa proteína e sua migração para o núcleo, onde ela ativa genes responsivos à hipóxia (BRUICK; MCKNIGHT, 2001).
Em condições de hipóxia, o mínimo de hidroxilação ocorre, há o recrutamento do coativador p300/CPB, em seguida, HIF-1α transloca-se para o núcleo, formando o heterodímero com o ARNT, onde se ligam ao motivo HRE dos genes alvos. Sob condição de hipóxia, HIF-1α não é degradada e assim seus genes alvos são expressos e uma resposta fisiológica à concentração de oxigênio é ativada (COOK; FIGG, 2010). Chilov et al. (1999) mostraram que o acúmulo de HIF-1α no núcleo em células submetidas à hipóxia é uma característica intrínsica desse fator de transcrição, já que ele é independente da presença do ARNT.
No mecanismo da acetilação, foi verificado que o resíduo do aminoácido lisina 532 (K532), localizado no domínio ODD do HIF-1α é acetilado por uma acetiltransferase chamada arrest-defective-1 (ARD1). A acetilação da K532 favorece a interação do HIF-1α com o pVHL e assim desestabiliza o HIF-1α. Uma mutação na K532, substituindo-a por um resíduo de arginina resulta em uma estabilidade aumentada do HIF-1α (TANIMOTO et al., 2000). A atividade das acetiltransferases não é alterada pelos níveis de oxigênio, mas os níveis do mRNA do ARD1 (e conseqüentemente da proteína) diminuem sob condições de hipóxia, levando a um menor nível de acetilação do HIF-1α do que sob normóxia (JEONG et al., 2002).
O HIF regula a expressão de mais de 100 genes que regulam aspectos chave da tumorigênese, incluindo a angiogênese, o metabolismo, proliferação, invasão e metástase (HICKEY; SIMON, 2006; RANKIN; GIACCIA, 2008) (Figura 3).
como o GLUT-1 e 3, fosfofrutoquinase L (PFK), fosfoglicerato quinase 1 (PGK1) e lactato desidrogenase-A (LDH) (SEMENZA, 2003).
Muitos fatores pró-angiogênicos como o VEGF, fator de crescimento tumoral β2 (TGF-β2), receptor do VEGF, bFGF e PDGF são induzidos por HIF-1 para promover a angiogênese. Outros genes ativados pelo HIF-1 incluem fatores que regulam a proliferação e sobrevivência celular, apoptose, motilidade e estrutura do citoesqueleto, metabolismo da matriz extracelular, tônus vascular, adipogênese, desenvolvimento de células B e resistência a drogas (SEMENZA, 2003; SEMENZA, 2006; RANKIN; GIACCIA, 2008) (Figura 4).
Figura 4. Genes ativados na presença do HIF. FONTE: (RANKIN; GIACCIA, 2008).
O HIF-1 se liga aos genes alvos em sítios contendo o centro de reconhecimento 5'-RCGTG-3' (SEMENZA, 2006). A presença dos sítios de ligação do HIF-1 (HBS) é necessária, mas não suficiente para a expressão dos genes em resposta à hipóxia, indicando que o HIF-1 deve interagir com outros fatores de transcrição ligados a sítios adjacentes (FERREIRA et al., 2007).
insulina, trombina, peptideos vasoativos tais como angiotensina II, citocinas pró-inflamatórias, carbacol que ativa os receptores de acetilcolina muscarínicos. Além disso, o HIF-1 também é ativado por metais tais como, cobalto, cromo, níquel e arsênio, como também por estresse mecânico. No entanto, os mecanismos pelos quais esses estímulos não hipóxicos induzem o HIF-1 não são completamente conhecidos, embora algumas evidências apontam para o papel dos EROs (espécies reativas de oxigênio) como mensageiros, regulando a atividade do HIF-1 (FERREIRA et al., 2007).
Giaccia et al. (2003) resumiram o conhecimento discutido no Encontro de Keystone sobre a biologia da hipóxia. Foi observado que as respostas induzidas pela hipóxia são fortemente reguladas no desenvolvimento embrionário normal e podem ser desreguladas em diferentes estados das doenças. A identificação das proteínas reguladas pelo oxigênio como os fatores transcricionais da família HIF representa um paradigma para a percepção do oxigênio a nível molecular. Todavia, considera-se que esta família seja um dos exemplos envolvidos na regulação da expressão protéica em resposta a hipóxia. Uma variedade de organelas intracelulares também pode estar relacionada com a percepção do oxigênio como, por exemplo, os canais iônicos, mitocôndrias e retículos endoplasmáticos. Finalmente, os pesquisadores concluíram que o conhecimento de como as células percebem e respondem a hipóxia é fundamental para entender o papel da hipóxia em doenças, bem como para aprimorar os diagnósticos e tratamentos.
Yamakawa et al. (2003) investigaram os eventos moleculares envolvidos na regulação da resposta angiogênica pelo fator transcricional HIF-1α durante a hipóxia. E observaram que baixo nível de expressão dos fatores angiogênicos foi observado nas células endoteliais em normóxia. Em contraposição, em condição de hipóxia a expressão dos fatores envolvidos na angiogênese estava aumentada. Através dos resultados, pode-se sugerir que o HIF-1α medeia a resposta angiogênica à hipóxia, pela regulação de múltiplos fatores angiogênicos, especialmente do VEGF e do sistema da angiopoetinas.
Fang et al. (2001), com o objetivo de identificar as moléculas e os mecanismos envolvidos com a troca do fenótipo angiogênico durante a progressão tumoral, desenvolveram um modelo de condrosarcoma in vivo. O papel do VEGF e do bFGF e
expressão do VEGF. Contrariamente, a concentração de bFGF não foi aumentada nos nódulos avasculares, mas foi duas vezes maior nos nódulos vasculares. Como a expressão do VEGF foi regulada transcripcionalmente pelo HIF-1α, análises da imunohistoquímica dos nódulos do condrosarcoma revelaram que a translocação nuclear do HIF-1α foi detectada exclusivamente em nódulos do tumor avascular. Estes resultados indicaram que o aumento da expressão do VEGF foi mediada pelo fator de transcrição HIF-1α, o que não ocorreu para o bFGF na troca do fenótipo angiogênico durante o desenvolvimento tumoral.
Aranha (2008) ponderando o potencial angiogênico das células pulpares humanas em hipóxia observou ausência da ativação do fator transcricional HIF-1α nas células-tronco e de fibroblastos de polpas de dentes permanentes humanos em condição de normóxia. Por outro lado, houve aumento da expressão do HIF-1α e do VEGF em ambas linhagens celulares, quando as células foram colocadas em condição de hipóxia. Demonstrando assim, que a hipóxia foi suficiente para induzir o potencial angiogênico de células pulpares humanas.
Em amostras clínicas, elevada expressão de HIF-1 correlaciona com uma pobre evolução do paciente com câncer de cabeça e pescoço, carcinoma de nasofaringe, colorretal, pâncreas, mama, cervical, osteosarcoma, ovário, endométrio, bexiga, glioblastoma, e carcinomas gástricos (OSADA et al., 2007; WINTHER et al., 2006).
Ameri et al. (2010) realizaram um estudo com o objetivo de avaliar a associação entre a hipóxia e as células tumorais circulantes, com a hipótese de que a hipóxia poderia desempenhar um papel na seleção de células com fenótipos mais agressivos. E observaram que as células tumorais circulantes mostraram uma resposta a hipóxia alterada e um fenótipo agressivo mais forte in vivo e in vitro.
Tilakaratne et al. (2008) estudaram a expressão do HIF-1α em casos de fibrose submucosa oral, com a hipótese de que a hipóxia poderia desempenhar um papel na transformação e progressão desta condição potencialmente maligna. E observaram correlação estatisticamente significante com o grau de displasia das fibroses submucosas orais, podendo indicar a possível participação da hipóxia na transformação maligna desta lesão.