UNIVERSIDADE ESTADUAL PAULISTA
“JÚLIO DE MESQUITA FILHO”
INSTITUTO DE BIOCIÊNCIAS – RIO CLARO
unesp
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA CELULAR E MOLECULAR
ANÁLISE PROTEÔMICA DOS ALÉRGENOS IMUNODOMINANTES DO
VENENO DA VESPA SOCIAL Polybia paulista
LUCILENE DELAZARI DOS SANTOS
UNIVERSIDADE ESTADUAL PAULISTA
“JÚLIO DE MESQUITA FILHO”
INSTITUTO DE BIOCIÊNCIAS – RIO CLARO
unesp
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA CELULAR E MOLECULAR
ANÁLISE PROTEÔMICA DOS ALÉRGENOS IMUNODOMINANTES DO
VENENO DA VESPA SOCIAL Polybia paulista
LUCILENE DELAZARI DOS SANTOS
ORIENTADOR: PROF. DR. MARIO SERGIO PALMA
595.798 Santos, Lucilene Delazari dos
S237a Análise proteômica dos alérgenos imunodominantes do veneno da vespa social Polybia paulista / Lucilene Delazari dos Santos. – Rio Claro : [s.n.], 2006
198 f. : il.
Tese (doutorado) – Universidade Estadual Paulista, Instituto de Biociências de Rio Claro
Orientador: Mário Sérgio Palma
1. Vespa. 2. Análise proteômica. 3. Alergia. 4. Polybia paulista. I. Título.
i
“Quando compreendi que em qualquer circunstância, eu estava no lugar certo, na hora certa, no momento exato, eu pude relaxar. Hoje sei que isso é Auto-estima.
Quando pude perceber que a minha angústia, meu sofrimento emocional, não passava de um sinal de que estou indo contra as minhas verdades, encontrei a minha
Autenticidade.
Quando comecei a perceber como é ofensivo tentar forçar alguma situação ou alguém, apenas para realizar aquilo que desejo, sabendo que não é o momento ou que a pessoa não está preparada (inclusive eu mesmo), descobri o Respeito.
Quando parei de desejar que a minha vida fosse diferente e comecei a ver que tudo o que acontece contribui para o meu crescimento, notei meu Amadurecimento.
Quando comecei a me livrar de tudo que não fosse saudável... pessoas, tarefas, tudo e qualquer coisa que me pusesse para baixo, minha razão chamou essa atitude de egoísmo. Hoje sei que se chama Amor-Próprio.
Quando deixei de temer meu tempo livre e desisti de fazer grandes planos, abandonei os projetos megalômanos de futuro. Hoje faço o que acho certo, o que gosto, quando quero e no meu próprio ritmo. Hoje sei que isso é Simplicidade.
Quando desisti de querer ter sempre razão e, com isso, errei muito menos vezes, descobri a Humildade.
Quando desisti de ficar revivendo o passado e de me preocupar com o futuro, me mantendo no presente, onde é que a vida acontece, encontrei a Plenitude.
Percebi que a minha mente pode me atormentar e me decepcionar. Mas quando eu a coloco a serviço do meu coração, ela se torna uma grande e valiosa aliada. Acredito que isso seja Saber Viver”.
ii
Aos meus queridos pais, à minha irmã
e cunhado, aos meus sobrinhos e ao
iii
Agradecimentos
Não poderia deixar de agradecer primeiramente ao meu fiel amigo... por me acompanhar em todas os momentos... me protegendo, me conduzindo, me confortando, me dando liberdade de ir e vir sem ao menos me pedir algo em troca... Ele sabe dos meus mais preciosos sonhos e dos meus limites... Deus!
Ao meu orientador, Prof. Dr. Mario Sergio Palma, pelo conhecimento científico, pelas oportunidades proporcionadas, pela acolhida e reconhecimento; pela amizade, por acreditar em meu potencial, por entender que meu amadurecimento possa ocorrer mais devagar.
Aos colaboradores Prof. Dr. Edécio Cunha-Neto e Prof. Dr. Fábio Morato Castro da Universidade Paulista de Medicina, Instituto do Coração, S.P., pela amizade e pelo material biológico fornecido; aos professores Dr. Gilberto Domont da Universidade Federal do Rio de Janeiro e Dr. Jonas Perales da Fundação Oswaldo Cruz, R.J., por me receberem com carinho e pelo auxílio na Espectrometria de Massas.
Aos meus pais, Antônio e Glauci, pelo simples fato de vocês existirem... por serem meus exemplos mais próximos de perseverança, auto-estima, dignidade, caráter... por permanecerem sempre ao meu lado, me estimulando a continuar mesmo quando o cansaço e o desânimo apareciam... por participarem ativamente da elaboração dos meus sonhos e suas concretizações.
À minha irmã querida, Regilene, por me permitir nela espelhar, de mostrar que podemos sempre mais, que fazer as coisas simplesmente por fazer não se faz necessário e sim, de fazer pela vida toda com atitude, com garra... por acreditar que vale a pena ser cientista ... por acreditar que vale a pena ser professor nesse país. Ao meu cunhado Milton e meus sobrinhos João Caetano e Pedro Henrique, por serem constantes alegrias em minha vida... por me mostrarem que constituir uma família é um sonho digno e incomensurável para o ser humano.
iv
mais essa etapa se você não me cedesse liberdade, paciência, companheirismo, e principalmente, completasse meus dias com sua existência e seu amor.
Aos meus amigos do Laboratório de Biologia Estrutural e Zooquímica.... por dividirem comigo experiências pessoais e profissionais durante todos esses anos. Por me ensinarem à importância do trabalho em grupo, o qual requer comprometimento com a ciência e com o próximo, paciência constante e disposição para novos projetos, experimentos, protocolos e padronizações... à Lílian, Roberta, Nicoli, Daniel, Paulo
César, Luiz Carlos, Meire, Vírginia e Alessandra, Bob, Marília... ao Beto e a Nathália
que, além de todo auxílio fornecido durante esse ano, permitiram que eu transmitisse meus conhecimentos e me sentisse um pouco mais professora e cientista.
À Fernandinha, Thalita, Bibi e Keity, por serem muito mais do que colaboradoras do
meu projeto científico, por participarem de todas as minhas alegrias e tristezas, por lutarem comigo nos meus ideais de vida, por simplesmente, quererem o meu bem. Aos amigos do Mini-TLC de Laranjal Paulista e de Botucatu, pois me mostram constantemente que trabalhar pra Cristo nos engrandece... que ser Igreja por onde passamos se faz necessário, auxiliando o próximo a enxergar que nós temos que diminuir para que Deus cresça em nossa vida... que ajudar o próximo não é somente um dever e sim, a busca da graça de Deus e da construção de seres humanos melhores... por viverem o verdadeiro amor entre irmãos, por fazer da nossa amizade, um constante festa... À Alessandra Camargo, Fernanda Capucho e Nayara Cuani... por serem mais que amigas.... por respeitarem e viverem comigo meu mundo cor-de-rosa.... Irmãs eternas.
Àqueles que de alguma forma contribuíram para meu crescimento pessoal e intelectual em toda minha vida... um simples olhar, um abraço, um consolo, um caminho oferecido, a oportunidade cedida.... qualquer coisa... Tenham certeza de que me proporcionaram tudo aquilo que era preciso e necessário e, talvez, muito mais do que eu merecia.
v
INDICE
1. RESUMO... 1
2. ABSTRACT... 3
3. REVISÃO BIBLIOGRÁFICA ... 5
3.1. Os insetos da Ordem Hymenoptera... 5
3.2. Alergia a venenos de Himenópteros ... 6
3.3. Diagnósticos e Tratamento de alergia ao veneno de Himenópteros... 9
3.4. Composição dos venenos de vespas ... 12
4. REFERÊNCIAS BIBLIOGRÁFICAS ... 18
CAPÍTULO 1. ... 28
1. INTRODUÇÃO ... 29
2. OBJETIVOS ... 33
3. MATERIAIS E MÉTODOS... 34
3.1. Obtenção do veneno da vespa Polybia paulista ... 34
3.2. Eletroforese Bidimensional ... 34
3.3. Eletrotransferência... 35
3.4. Espectrometria de Massas ... 36
3.5. Identificação das Proteínas... 37
4. RESULTADOS E DISCUSSÃO ... 39
5. REFERÊNCIAS BIBLIOGRÁFICAS ... 62
CAPÍTULO 2. ... 70
1. INTRODUÇÃO ... 71
2. OBJETIVOS ... 78
3. MATERIAIS E MÉTODOS... 79
3.1. Coleta das Amostras de Sangue ... 79
3.1.1. Relatos dos Casos ... 79
3.1.1.1. Acidentes provocados pela vespa Polybia paulista... 79
3.1.1.2. Acidentes provocados pela vespa Agelaia pallipes pallipes... 80
3.1.1.3. Acidente provocado pela abelha Apis mellifera... 80
vi
3.3. Eletroforese Bidimensional ... 81
3.4. Eletrotransferência... 82
3.5. Imunodetecção ... 83
3.6. Espectrometria de Massas ... 84
3.7. Identificação das Proteínas... 85
4. RESULTADOS E DISCUSSÃO ... 87
5. REFERÊNCIAS BIBLIOGRÁFICAS ... 98
CAPÍTULO 3. ... 103
1. INTRODUÇÃO ... 104
2. OBJETIVOS ... 106
3. MATERIAIS E MÉTODOS... 107
3.1. Materiais Biológicos ... 107
3.1.1. Obtenção do veneno da vespa Polybia paulista... 107
3.1.2. Obtenção dos soros dos pacientes sensibilizados ... 107
3.2. Clonagem e Determinação da Seqüência Protéica ... 107
3.3. Quantificação de Proteínas... 108
3.4. Purificação das fosfolipases pela Cromatografia de Troca Iônica ... 108
3.5. Atividade Fosfolipásica ... 109
3.6. Eletroforese Bidimensional ... 110
3.7. Aquisição das Imagens... 110
3.8. Eletrotransferência ... 111
3.9. Microsequenciamento por Química Degradativa de Edman ... 112
3.10. Microsequenciamento C-Terminal ... 112
3.11. Imunodetecção ou Immunoblotting ... 112
3.12. Detecção de Glicoproteínas... 114
3.13. Identificação das Proteínas... 114
4. RESULTADOS E DISCUSSÃO ... 115
vii
CAPÍTULO 4. ... 138
1. INTRODUÇÃO ... 139
2. OBJETIVOS ... 142
3. MATERIAIS E MÉTODOS... 143
3.1. Materiais Biológicos ... 143
3.1.1. Obtenção do veneno da vespa Polybia paulista... 143
3.7.1. Obtenção dos soros dos pacientes sensibilizados ... 143
3.2. Eletroforese Bidimensional ... 143
3.3. Eletrotransferência... 144
3.4. Imunodetecção ... 145
3.5. Detecção de Glicoproteínas... 147
3.6. Sequenciamento Peptídico ... 147
3.6.1. Sequenciamento por Química Degradativa de Edman ... 147
3.6.2. Microsequenciamento C-Terminal... 147
3.6.3. Microsequenciamento por Espectrometria de Massas MS/MS ... 148
3.7. Identificação das Proteínas... 149
3.8. Modelagem Molecular por Homologia ... 150
3.9. Avaliação do Modelo Estrutural pelo Prockeck ... 151
4. RESULTADOS E DISCUSSÃO ... 153
5. REFERÊNCIAS BIBLIOGRÁFICAS ... 173
viii
ABREVIAÇÕES
% - por cento - Alfa - Beta L – Microlitros mol – Micromoles 2D – Bidimensional 3D – Tridimensional A° - Angstron
Ala - Resíduo de aminoácido alanina Arg - Resíduo de aminoácido arginina Asp - Resíduo de aminoácido asparagina BSA - Albumina Bovina
CBB – Coomassie Brilliant Blue cDNA – DNA complementar
CHAPS – Sulfato de 3-[(3-Colamidopropil)-dimetil-amônio]-1-propano
cm – Centímetros
Ca-C – Ângulo descrito pelo carbono alfa e carbono
Da – Daltons DDT – Ditioltreitol
DPP - Dipeptidil peptidase ECL – Quimiluminescência
FPLC - Cromatografia Líquida de Baixa Pressão
Gln - Resíduo de aminoácido glutamina Gly – Resíduo de aminoácido glicina HCl – Ácido Clorídrico
His – Resíduo de aminoácido de histidina HPLC – Cromatografia Líquida de Alta Pressão
HRP – Horseradish Peroxidase Complex hs – Horas
HSP – Proteínas de Choque Térmico IAA – Iodoacetamida
IgE – Imunoglobulina do tipo E
IgG – Imunoglobulina do tipo G IgM – Imunoglobulina do tipo M IPG – Gradiente imobilizado de pH Kb – Kilobites
KDa – Kilodaltons Kg – Kilogramas
Leu - Resíduo de aminoácido leucina M – Molar
m/v – Massa por volume m/z – Razão massa/carga mA – MiliAmper
mg – Miligramas min - Minutos mL – Mililitros mm – Milimetros mM – Milimolar
MS – Espectro de massas dos íons pais e/ou fragmentos peptídicos da amostra MS/MS – Espectro de massas resultante da fragmentação de um único íon e/ou fragmento peptídico, gerando sua seqüência peptídica correspondente NaCl – Cloreto de Sódio
N-Ca – Ângulo descrito pelo nitrogênio e carbono alfa
nm –Nanômetros nmol - Nanomol
º
C – Graus
PAGE - Gel de Eletroforese de Poliacrilamidade
PCR – Polymerase Chain Reaction PDB – Banco de dados de proteínas pI – Ponto isoelétrico
PLA1 – Fosfolipase A1
PLA2 – Fosfolipase A2
ix
Pro – Resíduo de aminoácido prolina PRP – Proteínas relacionadas com patogenicidade
PVDF - Fluoreto de Polivinilideno rpm – Rotação por minuto SDS - Dodecilsulfato de Sodio Ser - Resíduo de aminoácido serina TBS – Tampão Tris
TFA – Ácido trifluoracético U - Unidade
V – Volts
v/v – Volume por volume
Val - Resíduo de aminoácido valina µg - Microgramas
f – Ângulo phi – Ângulo psi
TRADUÇÕES
Coils – estruturas aleatórias
Gaps – espaços vazios numa seqüência de proteína ou DNA.
In-gel - proteínas localizadas na malha da poliacrilamida do gel de eletroforese
Loops – regiões conservadas
Primers – fragmentos de DNA iniciadores
Skin prick test – teste cutâneo para verificar se um individuo é alérgico ou não e, qual a
possível origem da alergia observada
Spot – mancha protéica ou proteína.
Template – modelo estrutural
Turns- voltas
x
ÍNDICE DAS FIGURAS
CAPÍTULO 1...28
FIGURA 1: Microscopia eletrônica do aparelho de ferroar da vespa social Polybia paulista. (A) representa o reservatório de veneno, e (B) a lanceta do ferrão. Cedido por Rocha, T. (2005)...39
FIGURA 2: Gel de Eletroforese Bidimensional em SDS-PAGE 15%(m/v) do veneno da vespa social Polybia paulista. As proteínas foram focalizadas em fitas de pI de 3 a 10, com 13 cm de comprimento. Aproximadamente, 225 proteínas foram detectadas pela coloração de CBB...40
FIGURA 3: Provável mecanismo de ação dos componentes protéicos veneno da vespa social Polybia paulista durante o envenenamento de suas vítimas...60
CAPÍTULO 2...70
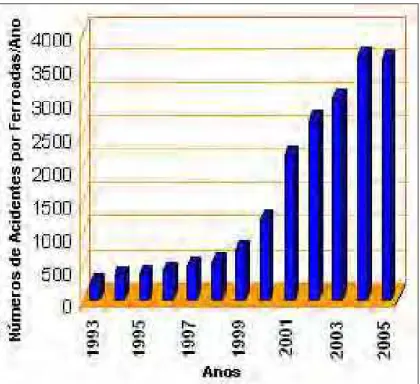
FIGURA 1: Dados estatísticos fornecidos pelo Ministério da Saúde e pela Secretaria da Saúde do Estado de São Paulo, sobre o número anual de acidentes de ferroadas causados por insetos da ordem Hymenoptera...77
FIGURA 2: Gel de Eletroforese Bidimensional em SDS-PAGE 15%(m/v) do veneno da vespa social Polybia paulista. As proteínas foram focalizadas em fitas de pI de 3 a 10, com 7 cm de comprimento. Aproximadamente, 225 proteínas foram detectadas pela coloração de CBB...87
FIGURA 3: Imunodetecção com os soros dos pacientes sensibilizados com o veneno da vespa P.paulista, frente ao veneno de vespas da mesma espécie. As 16 proteínas assinaladas são
consideradas imunogênicas ao reagirem com IgE-específicas presentes nos soros dos pacientes sensíveis ao veneno de P. paulista...88
FIGURA 4: Imunodetecção com os soros dos pacientes sensibilizados com o veneno da vespa social Agelaia palipes palipes, frente ao veneno de P. paulista. As proteínas enumeradas conforme a numeração original mostrada na figura 2, apresentaram reação imunogênica cruzada ao reagirem com IgE-específicas presentes nos soros dos pacientes sensíveis ao veneno da A.p.pallipes...93
FIGURA 5: Imunodetecção com soro de paciente sensibilizado com o veneno da abelha Apis mellifera, frente ao veneno de P.paulista. As proteínas enumeradas conforme a numeração
original mostrada na figura 2, apresentaram reação imunogênica cruzada ao reagirem com IgE-específicas presentes no soro do paciente sensível ao veneno de A. mellifera...94
CAPÍTULO 3...103
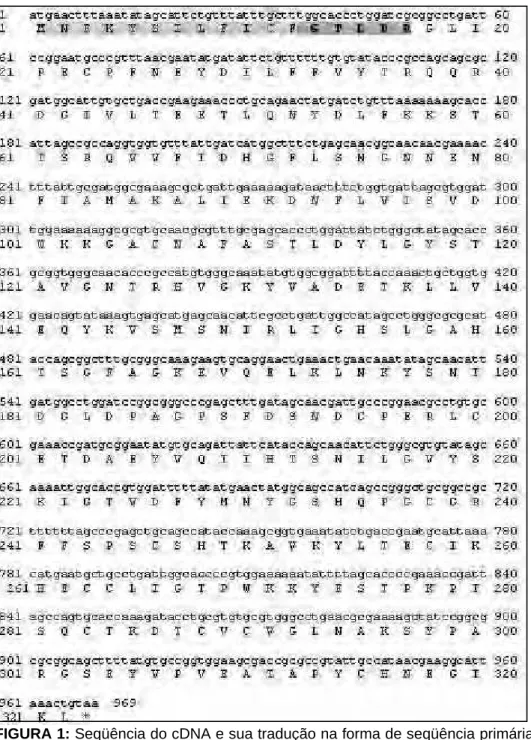
FIGURA 1: Seqüência do cDNA e sua tradução na forma de seqüência primária de aminoácidos para a Fosfolipase A1 do veneno da vespa social P.paulista. A região marcada de
cinza claro indica o peptídeo sinal, enquanto que a região marcada em cinza escuro indica o propeptídeo. O códon de finalização está indicado por *...116
xi
FIGURA 2: Alinhamento da seqüência da Fosfolipase A1 da P.paulista (PLA1_POLPA) com 12
lipases conhecidas: fosfolipase A1 humana (fosfatidilserina – PS), fosfolipase suína (PLRP2),
lipase pancreática humana (PL), lipase de células endoteliais humana (EDL), lipase lipoprotéica humana (LPL) e lipase hepática humana (HL), fosfolipase A1 de Vespula germânica (PLA1_VESGE), fosfolipase A1 de Vespula maculifrons (PLA1_VESMC), fosfolipase
A1 de Vespula vulgaris (PLA1_VESVU), fosfolipase A1 de Dolichovespula maculata
(PLA1_DOLMA), fosfolipase A1 de Polistes anularis (PLA1_POLAN) e fosfolipase A1 de Polistes dominulus (PLA1_POLDO). As estrelas indicam as posições dos resíduos de
aminoácidos da tríade catalítica, os pontos indicam os resíduos conservados de cisteínas; os resíduos de aminoácidos conservados em todas as seqüências desse alinhamento estão nas áreas negras...118
FIGURA 3: Alinhamento das seis seqüências primárias de Fosfolipases A1 de veneno de
vespas de espécies endêmicas no hemisfério norte (PLA1_VESGE, PLA1_VESMC, PLA1_VESVU, PLA1_DOLMA, PLA1_POLAN e PLA1_POLDO), em comparação com a enzima da espécie de vespa endêmica da região neotropical Polybia paulista; os resíduos de aminoácidos conservados em todas as seqüências desse alinhamento estão nas áreas negras...120
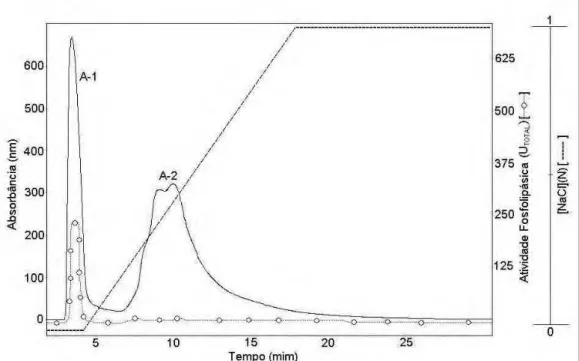
FIGURA 4: Perfil cromatográfico por Troca Catiônica do veneno bruto da vespa social P. paulista. O fracionamento foi realizado em coluna semi-preparativa Hiprep FF CM (160 mm x
10 mm, 20 mL – GE Amersham Biosciences), previamente equilibrada e eluída até os primeiros 20 minutos com tampão Acetato de Sódio 50 mM, pH 5,2, e então sob um gradiente linear de 0 a 1 M de NaCl no mesmo tampão de 20,01 a 180,00 minutos, num fluxo de 2 mL/,min; frações de 2 mL foram coletadas. A eluição foi monitorada por medidas de absorbância a 280 nm. A eluição das proteínas está representada pela linha contínua ( ____ ), enquanto que a linha (o ... o) representa a atividade fosfolipásica e (---) representa o gradiente de NaCl...121
FIGURA 5: Perfil cromatográfico por troca aniônica da fração A. O fracionamento foi realizado em coluna semi-preparativa Hitrap Q (16 mm x 25 mm, 1mL - Amersham Biosciences), pré-equilibrada com tampão Tris-HCl 20 mM, pH 8 acoplada a um sistema AKTA-FPL. A eluição foi realizada sob condições isocráticas durante os 3 primeiros minutos e então, sob gradiente linear de 0 a 1 M de NaCl no mesmo tampão de equilíbrio de 3.01 a 17.00 min; após esse período até os 30 minutos, a eluição foi realizada com tampão Tris-HCl 20 mM, pH 8, contendo NaCl 1M. O fluxo foi de 1 mL/mim, sendo coletadas frações de 1 mL; a eluição foi monitorada a 280 nm. A eluição das proteínas está representada pela linha contínua ( ______ ), enquanto que (o ……o) representa a atividade fosfolipásica e (---) representa o gradiente de NaCl...122
FIGURA 6: Perfil cromatográfico por troca aniônica da fração E. O fracionamento foi elaborado em coluna semi-preparativa Hitrap Q (16 mm x 25 mm, 1mL - Amersham Biosciences), pré-equilibrada com tampão Tris-HCl 20 mM, pH 8 acoplada a um sistema AKTA-FPL. A eluição foi realizada sob condições isocráticas durante os 3 primeiros minutos e então, sob gradiente linear de 0 a 1 M de NaCl no mesmo tampão de equilíbrio de 3.01 a 17.00 min; após esse período até os 30 minutos, a eluição foi realizada com tampão Tris-HCl 20 mM, pH 8, contendo NaCl 1M. O fluxo foi de 1 mL/mim, sendo coletadas frações de 1 mL; a eluição foi monitorada a 280 nm. A eluição das proteínas está representada pela linha contínua ( _____ ), enquanto que (o ……o) representa a atividade fosfolipásica e (---) representa o gradiente de NaCl...123
xii
FIGURA 8: Gel de Eletroforese Bidimensional 15%(v/v) do veneno bruto da vespa Polybia paulista, mostrando as nove isoformas de fosfolipases identificadas nas frações A1 e E1,
oriundas do fracionamento do veneno da vespa P.paulista por cromatografia de troca aniônica. As proteínas foram focalizadas em fitas de pI de 3 a 10, com 7 cm de comprimento e a coloração realizada com CBB. Os spots enumerados de 1 a 9 representam as nove isoformas de PLA1 identificadas no veneno...125
FIGURA 9: Perfil protéico da eletroforese 2-D da mistura das frações A-1 e E-1, onde as glicoproteínas foram coradas com o corante fluorescente Pro-Q Emerald 300. A visualização foi realizada por fluorescência sob luz UV a 300 nm...129
FIGURA 10: Imunodetecção da mistura das frações A -1 e E-1 com os soros dos pacientes sensíveis ao veneno da vespa P.paulista...130
CAPÍTULO 4...138
FIGURA 1: Gel de Eletroforese Bidimensional em SDS-PAGE 15%(m/v) do veneno da vespa social Polybia paulista. As proteínas foram focalizadas em fitas de pI de 3 a 10, com 13 cm de comprimento. Aproximadamente, 225 proteínas foram detectadas pela coloração de CBB. Os
spots enumerados são as isoformas do alérgeno Antígeno 5 e do alérgeno Sol i III
identificados pela análise proteômica do veneno bruto da P. paulista...153
FIGURA 2: Espectro de massas MALDI-TOF-MS obtido após a digestão do spot 125 com a enzima Tripsina. Os fragmentos de massas estão enumerados conforme sua localização na seqüência primária do Antígeno 5 em estudo...156
FIGURA 3: Espectro de Massas MALDI-TOFMS obtido após a digestão do spot 125 com a enzima Quimiotripsina. Os fragmentos de massas estão enumerados conforme sua localização
na seqüência primária do Antígeno 5 em
estudo...157 FIGURA 4: Espectro de massas MALDI-Tof-MS obtido após a digestão do spot 125 com a enzima Protease V8. Os fragmentos de massas estão enumerados conforme sua localização na seqüência primária do Antígeno 5 em estudo...158
FIGURA 5: Seqüência primária do Antígeno 5 do veneno da vespa social Polybia paulista obtida por superposição dos fragmentos peptídicos obtidos por digestão do spot 125 com Tripsina, Quimiotripsina e Protease V8 e seqüenciados por espectrometria de massas tandem, com aqueles seqüenciados por química Degradativa (N- e C-terminal) à partir do sequenciamento da proteína correspondente ao spot 125 por Química Degradativa...159
FIGURA 6: Alinhamento do Antígeno 5 da vespa social Polybia paulista (Ag5_POLPA) com a seqüência primária do Antígeno 5 da P.scutellaris (Ag5_POLSC) e com as seqüências consensos do alérgeno Antígeno 5 dos principais gêneros de vespa: Vespa, Dolichovespula,
Vespula e Polistes. As regiões de identidades mais importantes estão assinaladas em preto,
enfatizando os resíduos altamente conservados nesse tipo de alinhamento...161
FIGURA 7: Modelo da estrutura tridimesional da proteína Antígeno 5 gerado à partir do programa MolMol (KORADI et al., 1996)...163
xiii
FIGURA 9: Perfil protéico da eletroforese 2-D do veneno bruto da vespa P. paulista, onde 16 glicoproteínas foram coradas com o corante fluorescente Pro-Q Emerald 300. A visualização foi realizada por fluorescência sob luz UV a 300 nm. Os spots 125 e 134 assinalados são isoformas glicoprotéicas do alérgeno Antígeno 5...168
FIGURA 10: Imunodetecção do veneno da vespa P. paulista com os soros dos pacientes sensíveis ao veneno da mesma vespa. Dezesseis proteínas são imunoreativas, sendo que os
spots assinalados correspondem ao alérgeno Antígeno 5...169
FIGURA 11: Seqüência primária do Antígeno 5. A indicação das prováveis clivagens que ocorreram para gerar as isoformas do Antígeno 5 presentes no veneno da P. paulista estão representadas pelos números maiores correspondem aos números dos spots onde tais formas
xiv
INDICE DAS TABELAS
CAPÍTULO 1...28
TABELA 1: Identificação das proteínas que provavelmente constituem o veneno da vespa social Polybia paulista (Hymenoptera, Vespidae)...42
TABELA 2: Proteínas identificadas provavelmente oriundas da musculatura que envolve o reservatório de veneno da vespa Polybia paulista...53
TABELA 3: Proteínas identificadas provavelmente oriundas das células rompidas do reservatório de veneno da vespa Polybia paulista...56
CAPÍTULO 2...70
TABELA 1: Proteínas identificadas como imunogênicas ao veneno de P. paulista contra os soros dos pacientes sensibilizados com o veneno dessa vespa...89
TABELA 2: Proteínas identificadas como imunogênicas no veneno da P.paulista que apresentaram reatividade cruzada com IgE-específicas para o veneno de
A.p.pallipes...93
TABELA 3: Proteínas identificadas como imunogênicas no veneno da P.paulista que apresentaram reatividade cruzada com IgE-específicas para o veneno de Apis
mellifera...94
CAPÍTULO 3...103
TABELA 1: Dados da purificação das isoformas de fosfolipase A1 e recuperação da atividade
fosfolipásica nas diferentes etapas do protocolo de purificação...126
TABELA 2: Propriedades Proteômicas das Fosfolipases A1 e A2 do veneno da vespa social P. paulista...127
TABELA 3: Seqüências N- e C-terminais, massas moleculares hipotéticas e localização das seqüências das sete isoformas de PLA1 do veneno da vespa P. paulista ao longo de toda
seqüência primaria da enzima intacta em sua forma ativa...128
TABELA 4: Propriedades glicoprotéicas e imunológicas das isoformas de PLA1 do veneno da P.paulista...131
CAPÍTULO 4...138 TABELA 1: Caracterização molecular dos Antígenos 5 e do Alérgeno Sol i III do veneno da vespa social P. paulista. As seqüências parciais foram obtidas pela digestão tríptica dos spots recortados do gel de eletroforese bidimensional do veneno bruto da vespa em estudo, sendo que os peptídeos resultantes foram detectados por espectrometria de massas MALDI-TOF-MS e seqüenciados por espectrometria de massas MS/MS...154
xv
TABELA 2: Fragmentos peptídicos do spot 125 gerados pela digestão com a enzima tripsina e seqüenciados por espectrometria de massas tandem. Os resíduos de aminoácidos indicam a localização do fragmento na seqüência primária da proteína em estudo...156
TABELA 3: Fragmentos peptídicos do spot 125 gerados pela digestão peptídica com a enzima quimiotripsina e seqüenciados por espectrometria de massas tandem. Os resíduos de aminoácidos indicam a localização do fragmento na seqüência primária da proteína em estudo...157
TABELA 4: Fragmentos peptídicos do spot 125 gerados pela digestão peptídica com a enzima Protease V8 e seqüenciados por espectrometria de massas tandem. Os resíduos de aminoácidos indicam a localização do fragmento na seqüência primária da proteína em estudo...158
TABELA 5: Valores de identidade e similaridade entre as seqüências primárias consensos do alérgeno Antígeno 5 dos principais gêneros de vespa já estudados...162
TABELA 6: Seqüências N- e C-terminais, massas moleculares hipotéticas e localização das seqüências das sete isoformas do Antígeno 5 do veneno da vespa P. paulista ao longo de toda seqüência primaria da enzima intacta em sua forma ativa...166
Resumo
1. RESUMO
A prevalência de sensibilização de humanos aos venenos de
himenópteros sociais foi estimada entre 9,3% e 28,5% na população mundial;
muitas das alergias causadas por insetos desta ordem são provocadas por
ferroadas de abelhas (família Apidae), vespas (família Vespidae) e formigas
(família Formicidae). Há um interesse crescente no conhecimento da estrutura
e função dos componentes do veneno desses insetos, principalmente no
campo da imunologia clínica. Entre os Hymenoptera sociais, os venenos de
abelhas e vespas endêmicas do hemisfério norte têm sido extensivamente
estudados e, principalmente, seus componentes foram isolados e identificados.
Por outro lado, os venenos de espécies de vespas das regiões neotropicais
como aquelas típicas da biodiversidade brasileira têm sido pouco
caracterizados. Apesar da ausência de dados epidemiológicos sobre esse
assunto, a prática clínica diária mostra que as reações alérgicas ao veneno de
Himenópteros são bastante freqüentes no Brasil. Cerca de 500 espécies
diferentes de vespas sociais são conhecidas em todo Brasil; a maioria dessas
espécies apresenta diferentes tipos de comportamentos biológicos em relação
àquelas espécies endêmicas do hemisfério norte. Os extratos comercialmente
disponíveis de extratos de venenos de vespas usados para diagnósticos e
terapias de pacientes alérgicos a venenos de vespas são oriundos dos Estados
Unidos e/ou da Europa. Apesar da história de reações sistêmicas após a
ferroada destes insetos, a maioria dos pacientes brasileiros (sensíveis aos
venenos de vespas) apresentam testes cutâneos negativos quando extratos de
venenos importados são utilizados nesses testes. Com o objetivo de
aperfeiçoar e alcançar uma melhor compreensão da bioquímica e imunologia
dos venenos das principais espécies de vespas do Sudeste do Brasil, o veneno
da vespa social Polybia paulista (uma espécie muito agressiva que causa
muitos acidentes por ferroadas todos os anos no Estado de São Paulo) foi
investigado. Esse veneno foi submetido a uma abordagem proteômica para
identificar os componentes protéicos e as principais proteínas alergênicas
foram bioquimicamente e imunologicamente caracterizadas. Dois grandes
Resumo
vespas (toxinas); 2) as proteínas contaminantes provavelmente oriundas da
ruptura das células das membranas dos músculos que envolvem o reservatório
de veneno e da glândula de veneno. A análise proteômica revelou cerca de 225
proteínas, das quais 94 foram identificadas, sendo as mais abundantes:
Fosfolipases -A1 e -A2 (PLA1 e PLA2), Antígeno 5, Hialuronidase,
Metaloproteinases, Desintegrinas, Superóxido Dismutase, Proteínas de
Choque Térmico e Argininas Quinases. Análises de imunodetecção com os
soros de pacientes sensíveis ao veneno da P.paulista revelaram que 16
proteínas foram imunoreativas, as quais provavelmente constituem os
alérgenos imunodominantes desse veneno. Entre essas proteínas, foram
identificadas PLA1, Antígeno 5, Hialuronidase e Arginina Quinase. A
investigação das reações cruzadas com os soros dos pacientes sensíveis aos
venenos de abelha (Apis mellifera) e outra espécie de vespa social (Agelaia
pallipes pallipes) revelou que a forma intacta do Antígeno 5 foi o alérgeno
comum, o qual provavelmente pode ser considerado o principal alérgeno
imunodominante do veneno da P.paulista. Dois importantes alérgenos foram
bioquimicamente e imunologicamente caracterizados: a PLA1 e o Antígeno 5. A
PLA1 foi purificada e a forma intacta e ativa da PLA1 foi clonada a partir de
RNAm, sendo então preparado seu cDNA, que foi seqüenciado; 7 diferentes
isoformas dessa enzima foram identificadas pela abordagem proteômica, das
quais 3 foram imunoreativas à IgE-específica; duas dessas isoformas
apresentaram carboidratos anexados à elas. Seis isoformas de Antígeno 5
foram identificadas; a seqüência completa de forma intacta desse alérgeno foi
obtida pela combinação de Digestões Proteolíticas in gel, Sequenciamento
peptídico por Espectrometria de Massas e pelos métodos de Química
Degradativa (N- e C-terminal). Quatro isoformas dessa proteína foram
imunoreactivas à IgE-específica; duas delas também apresentaram
carboidratos anexados à elas. A estrutura tridimensional da forma intacta do
Antígeno 5 foi modelada por ferramentas de Bioinformática Estrutural,
revelando que a proteína é constituída de 5 regiões de estruturas secundárias
Abstract
2. ABSTRACT
The prevalence of human sensitivity to social Hymenoptera venom was
estimated from 9.3 to 28.5% of word population; many allergies are caused by
stingings of the insects representatives of Hymenoptera order such as bees
(Apidae), ants (Formicidae) and wasps (Vespidae). There is a keen interest in
the knowledge about the structure and function of the venom components of
these insects, mainly in the field of clinical immunology. Among the social
Hymenoptera the venoms of honeybees and wasps endemic from the North
Hemisphere have been extensively studied and many of their components were
isolated and identified. Meanwhile, the venoms of wasps species from the
Neotropical regions of the planet like those typical of Brazilian biodiversity have
been poorly characterized. Despite the absence of epidemiological data about
this subject in the most of Brazilian regions, it well known by the doctors that
this type of accident of very frequent in Southeast Brazil. About five hundreds
different species of social wasps are reported all over Brazil; the large most of
these species present different biology and aggressive behaviour in relation to
those species endemic from the cold regions of the planet. The commercially
available wasp venom extracts used for diagnosis and therapy of allergic
patients to wasp venoms are produced by foreign pharmaceutical companies
with the venom of wasp species obtained in United States and/or Europe.
Despite of the history of systemic reactions when stung by local wasp species,
the most of Brazilian patients (sensitive of wasps venoms) present negative skin
tests when imported venom extracts are used in these tests. With the aim to
improve the knowledge and to get a better understanding about the
biochemistry and immunology of venoms of the most abundant wasp species
from Southeast Brazil, the venom of the social wasp Polybia paulista (a very
aggressive specie which causes many stinging accidents all over year in São
Paulo Sate) was investigated. This venom was submitted to a proteomic
approach to identify the protein components and the most important allergenic
proteins were biochemically and immunologically characterized. Two large
groups of proteins were identified in the venom: i) the typical wasp venom
Abstract
disrupture both of the muscles involving the venom reservoirs and also from the
venom glands. The proteomic analysis revealed about 225 proteins, from which
the 94 most abundant ones were identified; The most important are:
Phospholipases -A1 and -A2, Antigen 5, Hyaluronidase, Metalloproteinases,
Desitegrins, Superoxide Dismutase, allergenic proteins and Arginine Kinases.
Immunoblotting analysis with the sera of patients sensitive to P. paulista venom
revealed 16 IgE-immunoreactive proteins, which probably constitute the
immunodominant allergens in this venom. Among these proteins were identified
Phospholipase-A1, Antigen 5, Hyaluronidase and Arginine Kinase. The
investigation of immunological crossed reactions with the sera of patients
sensitive to the venoms of honeybees (A. mellifera) and another social wasp
(A. p. pallipes) revealed that the intact form of Antigen 5 was a common
allergen, which probably constitutes the major immunodominant protein from P.
paulista venom. Two important allergens were biochemically and
immunologically characterized: the Phospholipase A1 and Antigen 5. The
Phospholipase-A1 was purified and the intact and active form of
Phospholipase-A1 was cloned from its cDNA and sequenced; seven different isoforms of this
enzyme were identified by a proteomic approach, from whose three isoforms
were immunoreactive to specific-IgE; two of these isoforms presented
carbohydrates attached to their molecules. Six isoforms of Antigen 5 were
identified; the complete sequence of the intact form of this allergen was
obtained by using the combination of in gel proteolytic digestions, mass
spectrometry peptide sequencing and Western Blotting associated to
microsequencing through degradation chemistry methods (N- and C-terminal
sequencing). Four isoforms of this protein were immunoreactive to specific-IgE;
two of these isoforms also presented carbohydrates attached to their molecules.
The 3-D structure for the intact Antigen 5 was modeled by using structural
biology bioinformatic tools, revealing a protein constituted of five regions of
secondary structure presenting -helices, five regions presenting structure of ß–
Revisão Bibliográfica
3. REVISÃO BIBLIOGRÁFICA
3.1. Os insetos da Ordem Hymenoptera
A extraordinária dominância dos insetos e outros artrópodes nos
continentes pode ser atribuída à imensa diversidade de mecanismos químicos
de defesa. Além das secreções glandulares de defesa, alguns artrópodes
desenvolveram armas químicas defensivo-ofensivas sofisticadas. Neste
aspecto, o aparecimento de venenos e do aparelho de ferroar entre os insetos
representa atributos evolucionários que contribuíram para a adaptação desses
animais em diferentes ambientes terrestres (WHITMAN et al., 1990). Além
disso, diferentes ordens de insetos “criaram” suas armas biológicas,
particularmente os himenópteros (abelhas, vespas e formigas), que
desenvolveram em seu veneno e aparelho de ferroar de acordo com sua
biologia e comportamento (PALMA, 2006).
A ordem Hymenoptera é composta por aproximadamente 100.000
espécies de abelhas, vespas e formigas. Muitos membros pertencentes a esta
ordem desenvolveram glândulas especializadas na produção de veneno e um
aparelho de ferroar, os quais podem ser usados tanto na caça de presas
quanto em sua própria defesa (STEEN et al., 2005).
Os insetos da ordem Hymenoptera podem ser classificados em dois
grupos, de acordo com sua história evolutiva: social e solitário. A maioria dos
Hymenoptera solitários desenvolveu um veneno especializado, principalmente
para causar paralisia das presas, permitindo assim, o desenvolvimento de suas
larvas em suas próprias presas. Dentre outras atividades, alguns componentes
desses venenos ainda podem causar paralisia parcial ou permanente nas
presas, enquanto outros podem agir na prevenção de contaminações do
alimento ou de infecções da progênie futura.
As vespas pertencentes ao grupo dos Hymenoptera Aculeata (com
ferrão) estão divididas em três grandes superfamílias: Bethyloidea, Sphecoida
e Vespoidea. A família Vespidae é uma subdivisão da superfamília Vespoidea,
onde são encontrados os casos de eusociabilidade em vespas, com mais de
800 espécies eusociais. Estas vespas habitam colônias fundadas por apenas
Revisão Bibliográfica
família de vespas é composta por três subfamílias, Stenogastrinae, Polistinae e
Vespinae, onde a subfamília Polistinae é a única encontrada no Brasil, sendo
representada por três tribos: Polistini, Epiponini e Mischocyttarini. A tribo
Epiponini é constituída por 23 gêneros e 405 espécies, dentre as quais a
espécie Polybia paulista está localizada (CHAUD-NETTO et al., 1994). Nesse
estudo, o veneno da vespa social Polybia paulista será o estudo alvo, uma vez
que, muitos acidentes por ferroadas dessa vespa ocorrem no Estado de São
Paulo.
3.2. Alergia a venenos de Himenópteros
Os venenos dos himenópteros sociais possuem componentes que estão
relacionados principalmente ao comportamento de defesa desses animais, ou
seja, na proteção de suas colônias contra o ataque de predadores. Os
principais efeitos desses venenos são as reações inflamatórias e/ou
imunológicas em suas vítimas. Algumas vezes é possível observar a ocorrência
de efeitos sistêmicos, como por exemplo, deficiência respiratória podendo
chegar até à morte (CASTRO, 2001).
As reações sistêmicas de maior importância médica são aquelas que
afetam os sistemas respiratório e/ou circulatório. Em geral, são caracterizadas
como reações cutâneas, vasculares ou respiratórias. As reações cutâneas que
afetam somente a pele se manifestam como urticária, angiodema, coceira,
inchaço ou eritema. As reações vasculares envolvem o sistema circulatório,
muitas vezes com queda de pressão arterial e aumento da permeabilidade
vascular. Essas reações podem levar à inconsciência e desmaios. Já as
reações respiratórias, consistem em inchaços ou aumento de fluídos no
sistema respiratório. São caracterizadas por dificuldade de respirar, espirros,
edema de glote, contração do pulmão, displasia e asma. Em pacientes
sensíveis, podem ocorrer ainda, desordens gastrointestinais, cólicas, diarréia,
náusea, vômito, incontinência, dor de cabeça, calafrio e febre (SCHMIDT,
1986).
Revisão Bibliográfica
permeabilidade dos vasos sanguíneos da pele. A dor pode continuar por várias
horas e a ardência por alguns dias. Além dessa ação direta da ferroada da
vespa, em muitos casos podem ser observadas reações alérgicas, e até
mesmo anafiláticas, que muitas vezes, chegam a ser letais (OLIVEIRA, 2000).
A grande maioria das mortes causadas por ferroadas de vespas está
diretamente relacionada ao desencadeamento de reações imunológicas, porém
algumas se devem à toxicidade direta do veneno (LORENZI, 2002).
Devido a componentes vasoativos do veneno de himenópteros, muitas
pessoas apresentam reações locais quando ferroadas por vespas,
consistindo-se em: rubores, edemas e dores prolongadas. Essas reações são limitadas,
pois desaparecem em poucas horas. Se a ferroada ocorrer próximo da ou na
cavidade oral, pode haver um comprometimento da respiração da vitima.
Ocasionalmente, as vitimas de ferroadas podem permanecer com os edemas
por várias semanas, podendo agravar se infecções secundárias vierem ocorrer
nos locais da ferroada, o que é comum em acidentes de ferroadas de formigas.
Por outro lado, há vários eventos conseqüentes da ferroada de vespas como
pruridos locais, urticária, angiodema, náuseas, vômitos, diarréia, dores
abdominais, perda de memória e tontura. As reações sistêmicas são os
quadros mais agravantes, os quais envolvem hipotensão, aritimia, bronco
espasmos, paradas cardíacas e respiratórias e morte do paciente (REISMAN et
al., 1989; FREEMAN, 2004).
A prevalência de sensibilização contra esses insetos foi estimada entre
9,3% e 28,5% na população mundial (ANTONICELLI et al., 2002). Muitas das
alergias causadas por insetos da ordem Hymenoptera são provocadas por
ferroadas de abelhas (família Apidae), vespas (família Vespide) e formigas
(família Formicidae). Há um interesse crescente em relação aos componentes
químicos dos venenos destes insetos, sobretudo no campo da alergia e
imunologia clínica (ROSS et al., 2000). Dentre os himenópteros sociais, os
venenos de abelhas e vespas endêmicos do hemisfério norte têm sido
extensivamente estudados e muitos de seus componentes moleculares, já
Revisão Bibliográfica
enquanto que os componentes dos venenos das espécies neotropicais como
as espécies brasileiras, têm sido pouco estudados.
A prevalência de alergia a venenos destes insetos é avaliada
freqüentemente devido aos altos índices de acidentes por ferroada. Estudos
epidemiológicos realizados em países europeus demonstraram que 20% das
vítimas de acidentes por ferroadas por esses insetos apresentam sintomas
alérgicos locais, 15% apresentaram reações sistêmicas e 17% dos casos eram
pacientes assintomáticos. Apesar de não apresentarem reações após as
ferroadas, esses pacientes apresentaram testes positivos de IgE específica, o
que pressupõe que os mesmos estão predispostos a desenvolver sintomas
alérgicos num próximo acidente (NITTNER-MARSZALSHA et al., 2004).
McDougle et al. (1995) ao questionarem indivíduos de 37 estados Norte
Americanos, verificaram que 70% dos indivíduos entrevistados eram sensíveis
a venenos de himenópteros, pois sofreram reações alérgicas e/ou anafiláticas
nos últimos 12 meses, quando ferroados por vespas, formigas ou abelhas,
sendo que poucos procuraram tratamentos imunoterápicos.
Esher et al. (2001), avaliando 138 pacientes com histórico de reações
alérgicas a abelhas, vespas e formigas no Brasil, relataram que os métodos de
determinação para IgE específica, apresentam baixa sensibilidade e
especificidade em nosso meio, principalmente para os componentes dos
venenos de vespas. Provavelmente, a grande diversidade de espécies no
Brasil é diferente daquelas utilizadas para a obtenção dos extratos usados para
diagnóstico e tratamento imunoterápico, provenientes da Europa e Estados
Unidos.
Embora os venenos de himenópteros sociais apresentem vários tipos de
peptídeos e proteínas, alguns dos quais são capazes de induzir toxicidade e
respostas vasoativas, é estimado que aproximadamente 1500 ferroadas
fossem necessárias para injetar uma dose letal de veneno de Hymenoptera
num homem adulto de 70Kg (GODDARD, 2003). Apesar dessa estimativa, 40
mortes por ano são atribuídas a ferroadas de Hymenoptera sociais nos EUA
Revisão Bibliográfica
desenvolveram IgE específica para vários componentes do veneno (REISMAN
et al., 1989).
Kim et al. (2001), ao estudar um grupo de pacientes sensibilizados pelo
veneno da formiga Pachycondyla chinensis, relatou manifestações clínicas de
processos anafiláticos característicos como: urticária, rinites alérgicas,
hipersensibilidade brônquica, paradas cardíacas e perda da consciência.
Nas reações por venenos de insetos podem estar envolvidos os
mecanismos básicos de hipersensibilidade: (1) imediata, com a participação de
IgE específica, porém, doses elevadas de veneno neste tratamento
(Imunoterapia), podem provocar anafilaxia e até mesmo, morte do indivíduo
alérgico; (2) citotóxica, com a participação de anticorpos IgG e IgM contra
antígenos da superfície celular ou da matriz celular; mas esta
hipersensibilidade pode causar doenças como anemia hemolítica; (3) por
acúmulo de imunocomplexos, com a participação de imunocomplexos
circulantes IgG e IgM com antígenos de venenos, que, quando em grande
quantidade, depositam-se próximos ao leito vascular e ativam o sistema
imunológico complemento. O exemplo clínico mais característico dessa
hipersensibilidade é a doença do soro, ou seja, baixa qualidade e quantidade
de células de defesa presentes no organismo; e (4) por mecanismos tóxicos e
pseudo-alérgicos, que são reações resultantes das ações farmacológicas dos
componentes dos venenos. Isso pode ser exemplificado na mastocitose, na
qual os mastócitos são ativados diretamente, levando a degranulação, seguida
da liberação de mediadores químicos, e também no envolvimento da ativação
do sistema complemento, com a produção de anafilotoxinas e subprodutos
biologicamente ativos (CASTRO, 2001).
3.3. Diagnósticos e Tratamento de Alergia ao Veneno de Himenópteros
Os venenos de insetos são largamente utilizados nos diagnósticos e
tratamentos de alergias provocadas por ferroadas dos mesmos. Nesses
tratamentos imunoterápicos, de nanogramas a microgramas de veneno bruto
são injetados no indivíduo alérgico, para se obter imunidade em ferroadas
Revisão Bibliográfica
do nível de anticorpos IgG e diminuição do nível do antígeno IgE no organismo
do indivíduo alérgico (KING,1989). Atualmente, a especificidade da
imunoterapia tem mostrado resultados efetivos em pacientes alérgicos; porém,
a mesma deve ser ministrada por especialistas treinados para usar técnicas
emergenciais, caso ocorram reações anafiláticas (BOUSQUET, 1998).
A utilização de venenos de himenópteros para diagnósticos e tratamento
de reações alérgicas a ferroadas de insetos da ordem Hymenoptera foram
introduzidos no final dos anos 70 (JOHANSSON et al., 2001). Métodos
diagnósticos de alergia são extensivamente aplicados para auxiliar no
tratamento de pacientes sensíveis ao veneno desses insetos. História clínica
de reação sistêmica após uma ferroada de insetos venenosos, teste de pele
intradermal, sorologia para quantificação de IgE específica e imunoterapia
específica anti-IgEs são alguns dos métodos empregados atualmente
(HAMILTON et al., 2004).
A eficácia da imunoterapia específica no tratamento de pacientes
hipersensíveis ao veneno de himenópteros sociais foi demonstrada por Ross et
al. (2000) durante uma análise minuciosa em casos de imunoterapias
realizados entre 1966 a 1996, onde 453 pacientes sensíveis foram envolvidos.
Nesta meta-análise, concluiu-se que há uma significativa redução na taxa de
reações sistêmicas quando uma subsequente exposição ao veneno ocorre
paralelamente com um tratamento de imunoterapia específica. Estudos
realizados por Oude Elberink et al. (2002), revelaram que a imunoterapia
resultou numa importante melhoria na qualidade de vida em relação à saúde
dos pacientes alérgicos ao veneno de vespas após essa desensibilização.
Testes de provocação durante a imunoterapia mostraram que 95% dos
pacientes alérgicos a venenos de vespas foram completamente protegidos e
não desenvolveram sintomas de alergia generalizada, enquanto que nos
pacientes sensíveis ao veneno de abelhas, essa proteção foi de 80-90%.
Porém, efeitos colaterais durante a imunoterapia ocorreram em 20-40% dos
pacientes durante o tratamento com veneno de abelha e 5 a 10% dos
Revisão Bibliográfica
aperfeiçoamento de diagnósticos e da imunoterapia para o tratamento de
alergia a venenos de himenópteros ainda se faz necessário (MULLER, 2002).
Muitos projetos proteoma que envolvem bioquímica, genética e métodos
computacionais (bioinformática proteômica) estão sendo amplamente
utilizados para elucidar funções de milhares de proteínas. Os resultados têm
promovido valiosas informações para a compreensão dos processos
fisiológicos básicos e para o desenvolvimento de novas terapias. O
desenvolvimento de extratos específicos para o tratamento de pacientes
sensíveis ao veneno de vespas se faz necessário, uma vez que, podem existir
proteínas no veneno que causem lesões teciduais e/ou ações farmacológicas
indesejáveis, porém sem apresentar qualquer imunoreatividade.
Atualmente, o diagnóstico de alergias e os processos de imunoterapia
específica a venenos de himenópteros sociais são elaborados com extratos
brutos, os quais geralmente são composições muito complexas, constituídos de
um grande número de proteínas. Não é possível determinar a composição
exata dos venenos; além disso, fatores naturais como degradação das
proteínas e heterogenidade da origem dos alérgenos, podem acarretar
problemas durante os diagnósticos de alergia e processos de imunoterapia
(NIEDERBERGER et al., 2004).
Estudos demonstraram que 20% dos indivíduos que não apresentam
histórico de reações sistêmicas por ferroadas de himenópteros mostraram
testes cutâneos positivos. Desses pacientes, 30 a 50% reagiram a
subseqüentes ferroadas (RUEFF et al., 2001; MULLER, 2002). Dessa forma,
os testes cutâneos e a determinação in vitro da IgE específica apresentam um
valor preditivo limitado, mesmo quando o indivíduo alérgico possui uma história
de reação sistêmica, pois, os extratos comercialmente disponíveis para a
realização dos testes, são provenientes de outros países e em muitas ocasiões
como é o caso das vespas, diferem das espécies encontradas no Brasil e
geralmente não apresentam reações imunogênicas cruzadas (PALMA et al.,
Revisão Bibliográfica
3.4. Composição dos Venenos de Vespas
Os alérgenos encontrados nos venenos de vespas apresentam a
propriedade de sensibilizar, ou seja, induzir o sistema imune a produzir
anticorpos com elevada especificidade, e, desencadear sintomas alérgicos em
pacientes sensibilizados. Um dos maiores desafios da alergologia molecular é
predizer o potencial alergênico das proteínas (AALBEESE, 2000). Estudos
moleculares que levam à identificação dos epítopos imunogênicos dos
alérgenos são muito relevantes, porque permitem identificar as regiões da
molécula do alérgeno que interagem com os anticorpos do paciente
sensibilizado (ASTWOOD et al., 1996). Os alérgenos mais importantes
geralmente são caracterizados por: 1) serem solúveis, estáveis e apresentarem
uma compactação na sua estrutura tridimensional (TEUBER et al., 1998) e 2)
pela prevalência de IgE nos pacientes que são sensibilizados pelos mesmos
(BREITENEDER et al., 1999).
Os venenos de vespas sociais são ricos em peptídeos biologicamente
ativos e proteínas, responsáveis pelas dores prolongadas, edema, eritema,
reações alérgicas e sistêmicas (LORENZI, 2002). Normalmente, estes venenos
contêm vários tipos de aminas biogênicas, peptídeos e proteínas (NAKAJIMA
et al., 1986). Os principais alérgenos dos venenos de vespas são: fosfolipases
A1, hialuronidases e antígenos 5 (KING et al., 1996). Um quarto alérgeno,
serino-protease, foi identificado recentemente nestes venenos (Mc NAIRY et
al., 2000). Além disso, o tamanho das moléculas e a presença de determinadas
proteínas aumentam as propriedades antigênicas do veneno, sendo assim, um
potente ativador do sistema imune (VETTER et al., 1998).
Estudos de Wood et al. (1983) demonstraram a complexidade de vários
venenos de himenópteros. Cerca de 40 proteínas foram isoladas dos venenos
de Apis mellifera, Polistes fuscatus, P.apachus, P. Metricus, P. exclamans, P.
annularis, Vespula flavopilosa, V. squamosa, V. sulphurea, Dolichovespula
maculata e Vespa Cabro; esses registros são pioneiros na literatura mundial na
caracterização do perfil protéico de venenos de himenópteros. Esses estudos
Revisão Bibliográfica
processos de imunoterapias dependem do conhecimento sobre a composição
desses venenos e da compreensão de seus mecanismos de ação.
Hoffman et al. (1984) obtiveram cinco proteínas alergênicas do veneno
bruto da vespa Vespula maculifrons, isolando-as por eletroforese
bi-dimensional, entre as quais estão a Vmacl (97 KDa), a Hialuronidase (46 KDa),
a Vmac3 (39 KDa), as Fosfolipases A e B (34 KDa) e o Antígeno 5 (22 KDa).
Há vários antígenos comuns entre os diferentes venenos de vespas sociais do
Hemisfério Norte (FOUBERT et al., 1958; HOFFMAN, 1985).
As Polibitoxinas -I, -II, -III e –IV do veneno da vespa Neotropical Polybia
paulista foram purificadas e caracterizadas bioquimicamente. Elas são
fosfolipases A2 com potentes atividades hemolíticas (OLIVEIRA et al., 1998).
Estudos comparativos sobre o efeito da fosfolipase A2 foram realizados com
anti-soros de venenos de abelhas (Apis melífera) e de vespas (Vespula
arenaria, V.vulgaris. e V maculata), onde verificou-se que o anti-soro do veneno
de A. melifera foi capaz de neutralizar a atividade da fosfolipase A2 do veneno
bruto da abelha. No entanto, os anti-soros contra a PLA2 das três vespas, não
inibiram a atividade da fosfolipase A2 dos respectivos venenos brutos (NAIR et
al., 1976).
COSTA et al. (2000) isolaram uma toxina a partir do veneno da vespa A.
p.palipes, designada Agelotoxina, a qual apresentou atividade de fosfolipase A2
e também mostrou atividade hemolítica cerca de 220 vezes mais potente que a
PbTx de P.paulista, 740 vezes mais que a PLA2 de A.mellifera, 570 vezes mais
que a PLA2 de Naja nigricolis e 1250 vezes mais potente que a cardiotoxina de
Naja naja atra.
Entre as diversas espécies de vespas asiáticas, as espécies Vespa
basalis, V. mandarinia e V. verutina são responsáveis pela morte de muitos
indivíduos dessa região. Dessa forma, Ho e colaboradores (1999) trabalhando
com o veneno da V. verutina isolaram três toxinas designadas Verutoxinas
VT-1 (34,9 KDa), VT-2a (33,3 KDa) e VT-2b (33,3 KDa). Neste estudo, a VT-VT-1
mostrou maior atividade fosfolipásica A2, enquanto que, as isotoxinas VT-2 a e
Revisão Bibliográfica
A fosfolipase A2 constitui cerca de 12% do veneno de abelhas; ela é
capaz de causar efeitos farmacológicos como: hipotensão, aumento da
permeabilidade vascular (REISMAN et al., 1987), além de contrações
musculares e paradas respiratórias (NAIR et al., 1976).
A purificação e caracterização de duas fosfolipases B, denominadas de
e , foram obtidas do veneno da Vespa mandarinia, apresentando massas
moleculares de 29,5 e 26,0 KDa, respectivamente; ambas ainda apresentaram
atividades hemolíticas e cardiotóxicas, assim como as fosfolipases reveladas
em outras espécies de vespas (ABE et al., 2000).
Estudos demonstraram que a toxicicidade do veneno de vespas
requerem a ação sinérgica dos componentes inflamatórios do veneno.
Segundo King et al. (2003), um mastoparano com ação degranuladora de
mastócitos, potencializa a ação da fosfolipase A1 nas respostas associadas aos
processos inflamatórios.
As fosfolipases também induzem IgE específica, hidrolisam fosfolipídeos
da membrana celular, agem sinergisticamente com outras toxinas, causando
lise de eritrócitos e mastócitos, hipotensão e podem inibir a coagulação
sanguínea (NAKAJIMA, 1986; HO et al., 1994). Estudos sobre a estrutura
desses alérgenos demonstram vários níveis de identidade entre suas
seqüências primárias, variando de 60% para as Fosfolipases e Antígenos 5 a
80% para as hialuronidases (HOFFMAN, 1993; KING et al., 2000).
A função biológica do alérgeno Antígeno 5 ainda é desconhecida,
embora muitos estudos demonstrem a sua alergenicidade (HOFFMAN, 1993).
Antígenos 5 de várias espécies de Vespula apresentam 95% de identidade em
suas seqüências primárias, enquanto que 58-67% de identidade entre as
espécies do gênero Dolichovespula e Polistes, respectivamente (KING et al.,
1996; PANTERA et al., 2003). Isto promove uma completa reatividade cruzada
com as espécies do gênero Vespula, enquanto que entre alguns gêneros da
família Vespidae, ocorre uma baixa reatividade cruzada. A estrutura
tridimensional do Alérgeno 5 do veneno de Vespula vulgaris foi determinada
Revisão Bibliográfica
caracterizaram a proteína Antígeno 5 do veneno da vespa Neotropical Polybia
scutellaris. Ela é uma estrutura monomérica, apresentando 207 resíduos de
aminoácidos e massa molecular em torno de 23 KDa com 8 resíduos de
cisteína, formando 4 pontes de disulfeto e ponto isoelétrico acima de 9
(CASCONE et al., 1995). Sua estrutura secundária contém 22% de hélices-a,
22% de folhas-ß e 56% entre estruturas dobras e estruturas aleatórios (turn e
coil) (PIRGIGNANI et al., 2002).
A Hialuronidase age no interstício celular, potencializando a difusão do
veneno, ao hidrolisar parcialmente a matriz extracelular, facilitando a ação dos
demais componentes do veneno. A hialuronidase tem sido isolada dos venenos
de Hymenoptera sociais por diversos passos de cromatografia, incluindo
filtração em gel e troca catiônica (KING et al., 1976; HOFFMAN, 2006). Estudos
de Markovic-Housley et al. (2000) elucidaram a estrutura tridimensional da
hialuronidase de Apis mellifera por cristalografia de raio-X, a qual apresenta
cerca de 350 resíduos de aminoácidos, com duas pontes de disulfeto e quatro
sítios de glicosilações. As hialuronidases encontradas nos venenos de vespas
são similares àquelas encontradas nos venenos das abelhas (LU et al., 1995),
as quais apresentam quantidades significativas de carboidratos em suas
cadeias (KUBELKA et al., 1995).
A presença de um quarto alérgeno, a serino-protease, foi identificada
nos venenos de Polistes dominulus e Polistes exclamans por McNairy et al.
(2000). A serino-protease “Bom p4” foi identificada no veneno da abelha
Bombus pennsylvanicus por Hoffman et al (1996). Recentemente, três
serino-proteases foram isoladas do veneno de B.pennsylvanicus e do veneno das
vespas européias P.dominulus e P.exclamans, as quais demonstraram um
elevado grau de resíduos conservados em suas seqüências primárias. Além
disso, todas apresentaram atividades significativas de respostas a IgE
específica (WINNINGHAM et al., 2004).
Pouco se sabe sobre proteases de veneno de vespas. Uma protease de
36,6 KDa do veneno da vespa Polistes gallicus isolada por cromatografia de
afinidade, apresentou a seqüência N-terminal IVNGVXTEINEFPXMV, onde X
Revisão Bibliográfica
seqüência completa de duas proteases do veneno das abelhas Apis mellifera
(SCHMIDT et al., 2002) e Bombus pennsylvanicus, além de 20 resíduos do
N-terminal da protease de Bombus terrestris (HOFFMAN et al., 2001) estão
disponíveis nos bancos de proteínas (PANTERA et al., 2003).
Nos últimos anos, a engenharia proteômica tem desenvolvido
microtécnicas que possibilitam a caracterização molecular de componentes
bioativos, presentes em diferentes tipos de células, tecidos, extratos e/ou
fluídos corporais (HEINE, 1997; RESING et al., 1999; PANDEY et al., 2000). A
proteômica é uma ferramenta que começou a ser utilizada na identificação e
seqüenciamento molecular de alérgenos em geral (BEYER et al., 2002; TICHÁ
et al., 2002; TODA et al., 2002).
Embora a quantidade de informações de seqüências de DNAs nas
bases de dados seja ampla, não é suficiente para ajudar a elucidar todas as
funções biológicas das proteínas de um organismo. A proteômica é uma
técnica complementar a genômica, pois ela se concentra nos produtos gênicos,
os quais são agentes ativos nas células. Por essa razão, a proteômica contribui
diretamente para a identificação de alvos protéicos, contra os quais podem ser
desenvolvidas de drogas de uso terapêutico (PANDEY et al., 2000).
A proteômica é uma ferramenta que começou a ser utilizada na
identificação e seqüenciamento molecular de alérgenos em geral. A abordagem
proteômica utilizada neste trabalho é composta por três tecnologias principais:
a) a separação das proteínas; b) o microsequenciamento das proteínas por
Espectrometria de Massas e Química Degradativa de Edman; e c) a
identificação das proteínas por estratégicas de Bioinformática Proteômica.
Além disso, técnicas de eletrotransferência e imunodetecção auxiliarão a
caracterizar os alérgenos imunodominantes nessa abordagem adotada. Dessa
forma, será possível caracterizar molecularmente as proteínas presentes no
veneno da vespa social Polybia paulista, que se trata de uma das vespas que
Revisão Bibliográfica
4. REFERÊNCIAS BIBLIOGRÁFICAS
AALBERSE, R.C. Structural Biology of Allergens. J. Allergy Clin Immunol,
Saint Louis, v.106, n.2, p.228-238, 2000.
ABE, T.; SUGITA, M.; FUJIKURA, T.; HIYOSHI, J.; AKASU, M. Giant hornet
(Vespa madarinia) venomous phospholipases. The purification, characterization
and inhibitory properties by biscoclaurine alkaloids. Toxicon, Elmsford, v.38,
n.12, p.1803-1816, 2000.
ANTONICELLI, L.; BILO, M.B. BONIFAZI, F. Epidemiology of Hymenoptera
Allergy. Curr. Opin. Allergy Clin. Immunol., London, v.2, p.341-346, 2002.
ASLAM, A.; KESSLER, B.; BATYCKA, M.; CALLAGHAN, C.A.O; MISBAH,
S.A.; WARRELL, D.A.; OGG, G. Defining the T cell antigen proteome of wasp
venom. Clin. Exp. Allergy, Oxford, v.36, p. 1274-1280, 2006.
ASTWOOD, J.D.; LEACH, J.N.; FUCHS, R.L. Stability of food allergens to
digestion in vitro. Nat. Biotechnol., New York, v.14, p.1269-1273, 1996.
BARNARD, J.H.J. Studies of 400 Hymenoptera sting deaths in the United
States. J. Allergy Clin. Immunol., Saint Louis, v.52, p.259-264, 1973.
BEYER, K.; BARDINA, L.; GRISHINA, G.; SAMPSON, H.A. Identification of
sesame seed allergens by 2-dimensional proteomics and Edman sequencing:
Seed storage proteins as common food allergens. J. Allergy Clin. Immunol.,
Saint Louis, v.110, p.154-159, 2002.
BOUSQUET, J. Immunotheraphy: State of the art. Res. Immunol., Paris, v.149,
p.233-234, 1998.
BREITENEDER, H.; SOWKA, S.; WAGNER, S.; KREBITZ, M.; HAFNER, C.