UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS BIOLÓGICAS
DEPARTAMENTO DE BIOQUÍMICA
MOACIR FERNANDES DE QUEIROZ NETO
QUITOSANA E SEUS DERIVADOS CONJUGADOS COM ÁCIDO
GÁLICO: AVALIAÇÃO DE SEU POTENCIAL ANTIOXIDANTE E
DE INTERFERÊNCIA NA FORMAÇÃO DE CRISTAIS DE
OXALATO DE CÁLCIO
MOACIR FERNANDES DE QUEIROZ NETO
QUITOSANA E SEUS DERIVADOS CONJUGADOS COM ÁCIDO
GÁLICO: AVALIAÇÃO DE SEU POTENCIAL ANTIOXIDANTE E
DE INTERFERÊNCIA NA FORMAÇÃO DE CRISTAIS DE
OXALATO DE CÁLCIO
Dissertação apresentada ao Departamento de Bioquímica da Universidade Federal do Rio Grande do Norte como requisito parcial para obtenção do título de Mestre em Bioquímica.
Orientador: Hugo Alexandre de Oliveira Rocha.
UFRN / Biblioteca Central Zila Mamede Catalogação da Publicação na Fonte
Queiroz Neto, Moacir Fernandes de.
Quitosana e seus derivados conjugados com ácido gálico : avaliação de seu potencial antioxidante e de interferência na formação de cristais de oxalato de cálcio / Moacir Fernandes de Queiroz Neto. – Natal, RN, 2014.
78 f. : il.
Orientador: Prof. Dr. Hugo Alexandre de Oliveira Rocha.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Ciências Biológicas. Departamento de Bioquímica.
1. Quitosana – Dissertação. 2. Urolitíase - Dissertação. 3. Cristais de oxalato de cálcio monohidratados - Dissertação. 4. Ácido gálico - Dissertação. 5. Atividade antioxidante - Dissertação. I. Rocha, Hugo Alexandre de Oliveira. II. Universidade Federal do Rio Grande do Norte. III. Título.
MOACIR FERNANDES DE QUEIROZ NETO
QUITOSANA E SEUS DERIVADOS CONJUGADOS COM ÁCIDO GÁLICO: AVALIAÇÃO DE SEU POTENCIAL ANTIOXIDANTE E DE INTERFERÊNCIA NA
FORMAÇÃO DE CRISTAIS DE OXALATO DE CÁLCIO
Dissertação apresentada ao Departamento de Bioquímica da Universidade Federal do Rio Grande do Norte como requisito parcial para obtenção do título de Mestre em Bioquímica.
Aprovado em:
BANCA EXAMINADORA
___________________________________________________ Dr. Hugo Alexandre de Oliveira Rocha
Departamento de Bioquímica - UFRN Orientador
____________________________________________________ Prof. Dr. Eduardo Henrique Cunha de Farias
Centro Universitário do Rio Grande do Norte – UNI-RN 1º Examinador
____________________________________________________ Prof. Dr. Leandro Silva Costa
Dedico esta obra
AGRADECIMENTOS
Primeiramente a Deus, por ter colocado em minha vida tantas pessoas e experiências incríveis que me ajudaram a ser quem eu sou hoje.
Em segundo lugar a minha família, meus pais que sempre me deram todo o apoio para seguir atrás dos meus sonhos, e ensinaram valores de educação e moral que levarei para toda minha vida. Ao meu irmãozinho, por ter crescido comigo e aguentado todas as minhas manias e loucuras. A minhas primas Juliana e Anny que dividiram um pequeno pedaço de sua vida comigo nos últimos anos. Aos meus tantos primos e primas que sempre me recebem bem e me acolhem quando preciso, e pelos anos que dividimos juntos enquanto crianças/adolescentes. Aos meus Tios e Tias, que são um grande exemplo de como uma grande família pode permanecer feliz ao longo de tanto tempo, superando os obstáculos que aparecem no caminho. Vocês são motivo de orgulho, amo todos vocês.
A vovó Adélia, que continua sendo o elo de união de uma grande família.
A Tio Chiquinho Duarte que criou minha mãe essa mulher forte e independente que ela é hoje.
Agradeço imensamente a Hugo, meu orientador, que me recebeu em seu laboratório e me fez sentir a vontade desde o primeiro dia
durante alguns dias e contribuído diretamente com esse trabalho serei eternamente grato.
A todos os professores da pós-graduação, por terem transmitido não só conhecimento, mas também ajudado a formar nosso pensamento crítico e nossa qualidade como educador.
A todos os colaboradores que permitiram que esse trabalho fosse feito e que a ciência aconteça, e que abrem as portas dos seus laboratórios para todos que precisam.
A todos os membros da cultura de células que contribuíram, nem que tenha sido com apenas um boa tarde ou um abraço caloroso durante esse tempo de mestrado. Aos membros de outros laboratórios, que dividem essa nossa vida de pesquisas, seja apenas para trocar uma conversa no corredor ou durante um café, seja para eventos, peladas, experimentos ou apenas uma ia até o Thomas.
Serei sempre grato a Prof. Cadu por ter me dado à primeira oportunidade de trabalhar como Iniciação científica e ter me orientado durante minha graduação. Sempre lembrarei que prof. Naisandra me encontrado na UFRN, durante um feriado para me mostrar pela primeira vez uma sala de cultura e um cultivo de células, apesar de eu ainda não entender praticamente nada do que era aquilo.
Agradeço Keylla, Haroldo e todo pessoal do LabPlasma, pelas colaborações, protocolos aprendidos, tanto os que deram pouco quanto os que deram muito trabalho e inúmeros momentos divididos ao longo tanto da graduação quanto do mestrado. Um agradecimento especial a Michelle que por muito tempo me acompanhou em infindáveis experimentos que gastavam todo nosso dia e no final não davam certo.
Sou muito feliz de ter ao meu lado durante o mestrado dois amigos da graduação, Karol e Gabriel, que tornaram minha vida no Biopol mais agradável e que estão junto comigo tentando tornar o mundo melhor através do ensino e da pesquisa. Karol que infelizmente para ela é um “para-raios de azar” e que as coisas mais absurdas acontecem com ela, mas é uma pessoa com espirito incrível, muito inteligente e extremamente capaz. Gabriel com seu jeitão único conquista amigos por onde passa e é também uma pessoa única. Em nome deles agradeço a todos os amigos da graduação, que continuem cada um a seu jeito perseguindo seus sonhos e objetivos de vida.
A minha turma de mestrado, que além dos já citados acima, também era composta por Ingrid, Vanessa, Henrique, Dani, Nathalia, Luiza, Keith, Lívia, Erika, Isabel e a membro honorária Yara. Obrigado por estarem sempre lá nos momentos de estudo, pela dedicação e pela união que conseguimos encontrar durante o curso e que nos proporcionaram diálogos de alto nível e muito aprendizado durante nossas disciplinas.
Aos meus amigos trolls e suas respectivas, Jaum e Alina, PP e Tânia, Diego e Catharina, Thiago e Fabrícia, Salsicha e Camilinha, China e Thais e minha queridíssima amiga Aninha, obrigado por todos os momentos juntos, vocês não sabem o quanto são importantes para mim e quanta alegria vocês trazem a minha vida. Seja quando nos reunimos para passar um fim de semana na praia ou simplesmente para comer uma pizza, vocês são incríveis.
Agradeço ao futebol americano e aos dois times dos quais fiz parte: Calangos Negros e América Bulls. O esporte me proporcionou coisas além do que eu jamais imaginei: Viajar, jogar, treinar, ser treinador, estudar e lidar com mais de 50 jogadores, além de conhecer diversas pessoas incríveis por todo o Brasil. Esses desafios me fizeram crescer como pessoa e me tornaram capaz de enfrentar desafios cada vez maiores. Em especial a pessoas incríveis como Alysson, Ítalo, Victor, Luciano, Bruno, Eric, Leonardo, Glen, Alessandro e Armando sem esquecer de todos de fora do RN que contribuem todo o dia para o crescimento do esporte. Aos meus amigos de Segue-me, que sempre que nos encontramos é um dia feliz, que não conseguimos parar rir nem por um minuto quando juntos. Que nossa amizade se fortaleça cada vez e que sejamos sempre essa grande mundiça. “Por isso vem e segue-me, um batalhão de amor está aqui”.
A Capes, CNpQ, MCTI, FAPERN e todas as instituições de fomento que permitem que a pesquisa cresça cada vez mais.
"Vencer é um habito. Preste atenção a seus pensamentos, eles se tornam suas crenças. Preste atenção a suas crenças, elas se tornam suas ações. Preste atenção a suas ações, elas se tornam seus hábitos. Preste atenção a seus hábitos, eles se tornam o seu caráter."
RESUMO
Quitina é segundo polissacarídeo mais abundante na natureza e seu derivado quitosana tem sido amplamento estudado, devido a suas propriedades químicas e farmacológicas singulares. Contudo, estudos mostram que essa molécula quando no organismo, tende a se acumular no tecido renal e também promove um aumento na excreção de cálcio. Apesar disso, o efeito da quitosana sobre a formação de cristais de oxalato de cálcio (OxCa) nunca foi avaliado. A formação de cálculos renais (urolitíase) é a enfermidade que mais comumente afeta os rins e o sistema urinário, além de ser uma doença que possui altas prevalência e recorrência. Muitas moléculas com capacidade antioxidante tem demonstrado potencial para diminuir a formação de cristais de OxCa in vitro. Diante do exposto o objetivo desse trabalho foi avaliar o potencial antioxidante e de interferência na formação de cristais de uma quitosana de baixo peso molecular e seus derivados conjugados com ácido gálico (AG). As analises físico-químicas confirmaram a identidade da quitosana. Esta foi submetida a 5 testes antioxidantes e apresentou uma excelente atividade quelante de cobre, porém nenhuma outra atividade antioxidante expressiva foi detectada. Já quando submetida aos testes de formação de cristais in vitro, a quitosana aumentou o número de cristais de OxCa monohidratados formados, modificou a morfologia desses cristais, modificou as proporções entre populações de cristais em solução e aumentou o potencial zeta desses cristais formados. Foram obtidas quatro moléculas de quitosana conjugadas com AG. As análises físico-químicas confirmaram que houve ligação covalente entre quitosana e AG, porém, não se observou uma conjugação de AG de forma dose-dependente. Quando estes derivados foram submetidas a testes antioxidantes, todas as quitosanas conjugadas apresentaram potencial antioxidante maior que seus percussores. Contudo, houve diferença de atividade entre as diferentes quitosanas conjugadas, indicando que a posição onde o AG está conjugado é um fator importante para determinação da atividade. Quando as quitosanas conjugadas foram submetidas aos testes de formação de cristais in vitro, houve uma redução na quantidade de cristais observados quando comparados com aqueles formados na presença da quitosana não-conjugada. A quitosana possui uma forte capacidade indutora de formação de cristais de OxCa monohidratados, bem como modifica sua morfologia e potencial zeta. O processo de conjugação de AG à quitosana levou a um aumento no potencial antioxidante dessa molécula e também foi capaz de diminuir sua capacidade de induzir à formação de cristais in vitro.
ABSTRACT
Chitin is the second most abundant polysaccharide in nature and its derivative chitosan has been widely studied due to its unique chemical and pharmacological properties. However, studies show that when this molecule is used as food, drug, etc. it tends to accumulate in renal tissue and promotes an increase in calcium excretion. Nevertheless, the effect of chitosan on the formation of calcium oxalate (OxCa) crystals has never been evaluated. The formation of kidney stones (urolithiasis) is the disease that most often affects the kidneys and the urinary system. In addition, this is a disease with high prevalence and recurrence. Many molecules with antioxidant activity have been shown to decrease the potential for in vitro OxCa crystals formation. Thus, the aim of this study was to evaluate the effect of low molecular weight chitosan and its derivatives conjugated to gallic acid (AG) as antioxidant and inhibitor of OxCa crystals formation. The physico-chemical analysis confirmed the identity of chitosan. This molecule was subjected to five antioxidant tests and showed an excellent copper chelating activity. However, chitosan did not show other significant antioxidant activity. When chitosan was subjected to in vitro crystal formation tests, it increased the number of OxCa monohydrate crystals, modified the morphology of the crystals, modified the proportions between populations of crystals in solution and increased the zeta potential of these crystals formed. Four molecules of chitosan conjugated with GA were obtained. The physico-chemical analysis confirmed that chitosan and AG were covalently bonded. However, the amount of GA liked to chitosan did not increase even when 10 times more GA was used in experiment. When these derivatives were subjected to antioxidant tests, all chitosan conjugates showed higher antioxidant potential than their precursors. However, they showed different activity between them, which indicating that the position where AG is conjugated is an important factor for chitosan-GA activity. When conjugated chitosans were submitted to in vitro crystal formation tests, a reduction in the crystals number was observed when compared with those formed in the presence of unconjugated chitosan. Chitosan has a strong capacity for inducing OxCa monohydrate crystal formation, as well as modify their morphology and zeta potential. Over all, the process of conjugating AG to chitosan led to an increase in antioxidant potential of this molecule and was also able to decrease its capacity of inducing in vitro crystal formation.
LISTA DE FIGURAS
Figura 1 – Estrutura quimica da quitina (A) e quitosana (B) ... 20 Figura 2 - Patogênese dos cálculos de oxalato de cálcio nos rins ... 25 Figura 3 - Imagens de Microscopia Eletrônica de Varredura de Cristais de Oxalato de Cálcio ... 27 Figura 4 - Diferentes imagens de COM ... 28 Figura 5 - Modelo hipotético da representação da deposição/internalização do cristal de oxalato de cálcio nas células renais por endocitose e processo intracelular por oxalúria durante condições hiperoxalúricas ... 29
Figura 6 – Propriedades do grupamento funcional Fenol ... 32
Figura 14 – Espectros de infravermelho da quitosana não conjugada
comparado as quitosanas conjugadas ... 50
Figura 15 – Espectros de ressonância dos quitosanas ... 51
Figura 16 – Capacidade antioxidante total das amostras, em µg de Ac. Ascórbico/g de amostra ... 52
Figura 17 – Atividade de quelação de cobre das amostras ... 53
Figura 18 – Poder redutor das amostras ... 54
Figura 19 – Atividade quelante de ferro ... 55
Figura 20 – Perfil de formação dos cristais de OxCa na presença das quitosanas conjugadas ... 56
Figura 21 – Morfologia dos cristais formados na presença e ausência dos quitosanas ... 57
LISTA DE TABELAS
LISTA DE ABREVIATURAS / SIGLAS
AG Ácido gálico OxCa Oxalato de cálcio SOD Superoxido desmutase GPX Glutationa peroxidase GSH Glutationa reduzida
COD Cristais de oxalato de cálcio Di-hidratados COM Cristais de oxalato de cálcio monohidratado COT Cristais de oxalato de cálcio trihidratados DPPH 2,2-difenil-1-picril-hidrazila
DSS 2,2-dimethyl-2-silapentane-3,3,4,4,5,5-d6-5-sulfonate TCA Ácido tricloro acético
D2O Água Deuterada
RMN Ressonancia magnética nuclear
FTIR Fourier transform infrared spectroscopy
IUPAC União Internacional de Química Pura e Aplicada GD Grau de desacetilação
CAT Capacidade antioxidante total AA Ácido ascórbico
EDTA Ethylenediamine tetraacetic acid
ANOVA Análise de variância ND Não Detectado
EAA Equivalente de ácido ascórbico
SUMÁRIO
1 INTRODUÇÃO 19
1.1 QUITINA E QUITOSANA 19
1.2 USOS DA QUITOSANA 21
1.3 QUITOSANA X NANOTECOLOGIA 22
1.5 QUITOSANA E O TECIDO RENAL 24
1.6 UROLITÍASE 24
1.6 QUITOSANA COMO ANTIOXIDANTE 29
1.7 AG e MODIFICAÇÕES DE POLISSACARÍDEOS 31
2 MATERIAIS E MÉTODOS 34
2.1 MATERIAIS 34
2.1.1 Chitosan 34
2.1.2 Outros materiais 34
2.1.3 Aparelhos 34
2.2 MÉTODOS 35
2.2.1 Caracterização química da molécula 35
2.2.1.1. Análise de espectroscopia de infravermelho 35 2.2.1.2 Análise de espectroscopia de ressonância magnética nuclear 35 2.2.1.3 Determinação do grau de desacetilação (GD) 35
2.2.1.4 Dosagem de compostos fenólicos totais 36
2.2.2.1 Determinação da capacidade antioxidante total (CAT) 36 2.2.2.3 Avaliação do sequestro do radical hidroxila (OH.) 37 2.2.2.4 Avaliação da capacidade de quelar de ferro 37 2.2.2.5 Determinação da capacidade quelante de cobre 38
2.2.3 Ensaios de formação de cristais de OxCa 38
2.2.3.1 Ensaio de cristalização do oxalato de cálcio 38 2.2.3.2 Análise da morfologia dos cristais de CaOx por imagem microscópica 38 2.2.3.3 Medida do potencial zeta (ζ) dos cristais de CaOx 39
2.2.4 Conjugação do quitosan com ácido gálico 39
2.2.5 Análise estatística 41
3 RESULTADOS 42
3.1 ANÁLISE DO ESPECTRO DE INFRAVERMELHO DA QUITOSANA. 42 3.2 ANÁLISE DO ESPECTRO RESSONÂNCIA MAGNÉTICA NUCLEAR DA
QUITOSANA. 43
3.3 AVALIAÇÃO DA ATIVIDADE ANTIOXIDANTE DA QUITOSANA 44 3.4 FORMAÇÃO DE CRISTAIS DE OXALATO DE CÁLCIO NA PRESENÇA DE
QUITOSANA. 44
3.5 AVALIAÇÃO DA MORFOLOGIA DOS CRISTAIS DE OXCA FORMADOS NA
PRESENÇA DE QUITOSANA 46
3.6 DETERMINAÇÃO DO POTENCIAL ZETA (Ζ) DOS CRISTAIS DE OXCA 48
3.8 ANÁLISE DE ESPECTROSCOPIA DE INFRAVERMELHO DAS AMOSTRAS DE
QUITOSANA CONJUGADAS COM ÁCIDO GÁLICO 49
3.9 ANÁLISE DOS ESPECTROS DE 1H RMN DOS QUITOSANAS CONJUGADAS 50 3.10 ANÁLISE DA CAPACIDADE ANTIOXIDANTE DOS QUITOSANAS
CONJUGADAS 52
3.10.1 Capacidade Antioxidante total 52
3.10.2 Atividade de sequestro de radical hidroxila 52
3.10.3 Determinação da capacidade quelante de cobre 53
3.10.4 Avaliação do poder redutor das moléculas de quitosana conjugadas 53 3.10.5 Avaliação da capacidade de quelar ferro das moléculas conjugadas 54 3.11 ANÁLISE DO PERFIL DE FORMAÇÃO DE FORMAÇÃO DE CRISTAIS DE
OXCA 55
3.12 ANÁLISE MORFOLÓGICA DOS CRISTAIS DE OXCA FORMADOS NA
PRESENÇA DOS QUITOSANAS MODIFICADAS. 56
3.13 POTENCIAL ZETA 57
4 DISCUSSÃO 59
5 CONCLUSÃO 71
1 INTRODUÇÃO
1.1 QUITINA E QUITOSANA
A história da descoberta da quitina começa em 1811, ano em que Henri Braconnot, francês e professor de história natural, descobriu uma substância particularmente resistente ao ácido sulfúrico que estava presente na parede celular de fungos e a chamou de fungina. Em 1823, outro pesquisador conhecido como Odier encontrou o mesmo material em insetos e plantas e o chamou de quitinae
(KHOUSHAB e YAMABHAI, 2010), que em grego significa túnica ou envelope e que em português foi grafado de quitina. Em 1843, Lassaigne demonstrou que havia nitrogênio na estrutura da quitina. A partir desse ponto diversos pesquisadores começaram a estudar e identificar várias fontes de quitina presentes na natureza e a encontrar diferentes usos para essa molécula (KHAVITHA, et. al., 2011).
20
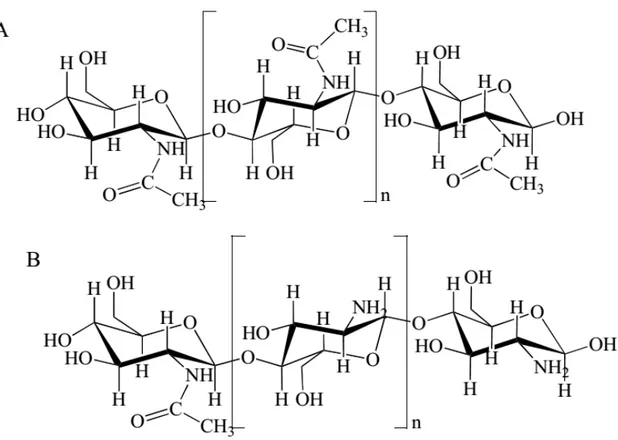
Figura 1 – Estrutura quimica da quitina (A) e quitosana (B).
Fonte: Aranaz et. al., 2009.
Dessa forma, o exoesqueleto dos crustáceos é a principal fonte da quitina que é utilizada em atividades humanas, porém essa fonte ainda é muito pouco aproveitada, para se ter uma ideia, aproximadamente 2,3 milhões de toneladas de quitina que poderiam ser usados, são descartadas pela indústria pesqueira anualmente (RAFTERY, et. al., 2013). O acesso a esse “lixo” permitiria usar essa fonte renovável de material de forma economicamente viável. Apesar dessas características, a quitina é um polissacarídeo de difícil manipulação, no contexto físico-químico, uma vez que é quimicamente inerte e insolúvel tanto em água quanto em vários solventes orgânicos (RAFTERY, et. al., 2013).
Mediante o exposto, o progresso das pesquisas com a quitina permitiu, portanto, formas de modificar essa substância, aumentando sua solubilidade e obtendo, dessa forma, diversos polímeros derivados da quitina. O primeiro a fazê-lo foi Rouget em 1859, que manipulando química e termicamente a quitina ele foi capaz de obter uma molécula solúvel, chamada de quitosan (KHAVITA, et. al.,
é um polímero formado por N-acetil-D-glucosamina e também por D-glucosamina, ambas dispostas de modo aleatório na cadeia do polímero (Fig. 1B) (JAYAKUMAR, et. al., 2010). É um polímero funcional e seus resíduos de açúcares desaminados possuem três grupos funcionais: amina, hidroxila primária e hidroxila secundária (RAFTERY, et. al., 2013). O que torna a quitosana bastante reativa quando comparado à quitina, vale salientar que a quitina é considerada o único polímero catiônico natural, e a quitosana é seu derivado semi-sintético, que possui propriedades únicas que podem ser aplicadas nas diversas áreas de pesquisa, especialmente na biomédica, como membranas, nanomaterias, adjuvantes, suplementos alimentares, liberação controlada e entrega de fármacos, hidrogeis, etc (WEY, et. al., 2012).
1.2 USOS DA QUITOSANA
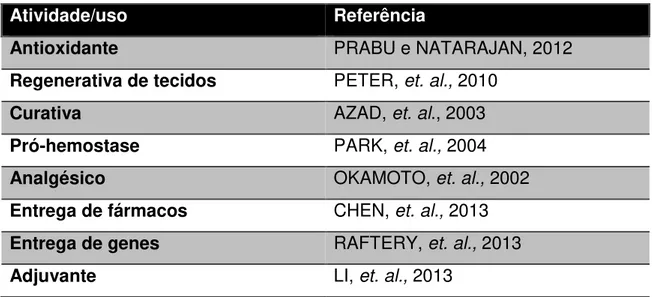
A quitosana é uma molécula amplamente estudada. Só no ano de 2013, foram mais de 6000 artigos publicados sobre quitosana, um número significativamente maior que os artigos publicados sobre outros importantes polissacarídeos como gomas (4956 artigos), glicosaminoglicanos (669 artigos), polissacarídeos sulfatados (548 artigos) e alginatos (81 artigos) e (Reuters, 2014). Na tabela 1, cita-se alguns usos e atividades biológicas atribuídas a moléculas de quitosana.
Tabela 1: Aplicações da quitosana Atividade/uso Referência
Antioxidante PRABU e NATARAJAN, 2012
Regenerativa de tecidos PETER, et. al., 2010
Curativa AZAD, et. al., 2003
Pró-hemostase PARK, et. al., 2004
Analgésico OKAMOTO, et. al., 2002
Entrega de fármacos CHEN, et. al., 2013
Entrega de genes RAFTERY, et. al., 2013
22
Regenerativa óssea LI, et. al., 2014
Suplementação alimentar LIU, et. al., 2008
Antitumoral JEON, et. al., 2002
Sintese de Nanopartículas JAYAKUMAR, et. al., 2010
Adjuvante para indústria
alimentícia
LIMA, et. al., 2010
Tratamento de água CHUNG, et. al., 2005
Abaixo se descreve alguns usos e aplicações da quitosana que estão relacionados com o decorrer dessa dissertação.
1.3 QUITOSANA X NANOTECOLOGIA
Polímeros sintéticos apresentam alguns problemas de biocompatibilidade e biodegradabilidade, o que coloca em xeque sua aplicação em humanos. Esse tipo de problema é pouco encontrado com o uso compostos naturais, como por exemplo, a quitosana. Isso faz desse polímero natural uma excelente alternativa aos materiais sintéticos aplicados em diferentes terapêuticas. Além da sua origem, que é responsável por sua conhecida biocompatibilidade, a quitosana também possui outras características físicas singulares, como: comportamento dependente de pH, mutabilidade conformacional dependente do meio em que se encontre, mucoadesividade e facilidade de ultrapassar as junções epiteliais. Além de suas características físicas, a quitosana também apresenta atividades farmacológicas, favorecendo ainda mais seu uso em detrimento dos materiais sintéticos (LAURIENZO, 2010; CASSETARI, et. al., 2012).
Uma das áreas na quais a quitosan vem sendo amplamente usado é a da produção de nanopartículas. A produção acadêmica nessa área reflete o interesse da comunidade científica no desenvolvimento desses biomateriais, pois até o ano de 2012 havia aproximadamente 10.000 artigos publicados relacionanda quitosana e nanotecnologia, acumulando mais de 119.000 citações (MELO-SILVEIRA, et. al., 2013).
se interessam por essa molécula. Outro motivo é exatamente a natureza polissacarídica da quitosana, que pela literatura é um composto com baixa toxicidade (KEAN e THANOU, 2010; BALDRICK, 2010). Na verdade, os poucos relatos de toxicidade dos nanocompostos de quitosan tem sido relacionadas à presença de outros componentes das nanopartículas e não da quitosan propriamente dito (GARCIA-FUENTES e ALONSO, 2012).
A existência de uma literatura tão vasta sobre as nanopartículas de quitosan deve-se também ao fato do quitosan poder ser utilizado em diversos métodos de produção de nanopartículas, a tabela 2 ilustra algumas dessas metodologias. Além desses inúmeros processos citados na tabela, a quitosana ainda pode sofrer modificações melhorando sua solubilidade e interação com outras moléculas, o que permite a produção de nanoparticulas mistas de quitosan combinado com outras moléculas (MELO-SILVEIRA, et. al., 2013)
Tabela 2: Diferentes métodos de produção de nanopartículas de quitosana Método de produção Composição da Matriz Aplicação
Emulção e reticulação
Quitosana, glutaraldeido Entrega de 5-fluororacil
Emulsão por aglutinação de gotículas
Quitosana Entrega de gadolinium
Emulsão de difusão de solvente
Quitosana Encapsulação de fármacos
hidrofóbicas
Micelização reversa Quitosana, glutaraldeido Entrega de fármacos, imobilização de enzimas e encapsulação de
oligonucleotídeos Gelificação Iônica Quitosana, tripolifosfato Entrega otimizada de
diferentes fármacos Complexação
polieletrolítica
Quitosana, alginato, goma arábica, carboxymetil celulose, carragenana, condroitin sulfato,
24 ciclodextrinas, dextrano
sulfatado, ácido poliacrílico, poli- -ácido glutâmico, insulina, DNA
Gelificação iônica modificada com polimerização de radical
Quitosana, ácido acrílico, Ácido metacrílico,
polietilenoglicol, poliéter
Administração de insulina, albumina bovina e peptídeos
Dessolvação Quitosana Formação de nanopartículas
Fonte: GRENHA (2012), adaptada
1.5 QUITOSANA E O TECIDO RENAL
Ao chegar na corrente sanguínea os nanocompostos de quitosana tendem a se decompor, liberando a quitosana livre no sangue (WANT et. al., 2011). Essa quitosana na circulação chega a diversos órgãos, porém, tende a se acumular nos rins, cerca de 8 horas após a administração por via oral (ZHANG et. al., 2011; XIA et. al., 2011), mais especificamente em células do túbulo proximal (YUAN et. al., 2009). Apesar de ser conhecido esse metabolismo da quitosana, nenhum relato de toxicidade da quitosana no tecido renal foi encontrado, ou qualquer outro tipo de relação entre essa molécula e doenças comuns do sistema urinário, como urolitíase, que é a formação de cálculos renais. Contudo, existem dados que mostram uma correlação positiva entre o aumento da ingestão de quitosana e o aumento da quantidade de cálcio excretado na urina (WADA, et. al., 1997), condição que está relacionada com a urolitíase.
1.6 UROLITÍASE
HOPPE, 2010). Pacientes que desenvolveram cálculos renais pela primeira vez tem entre 50 e 70% de chance de recorrência nos 10 anos seguintes (MAHMOOD, et. al., 2007).
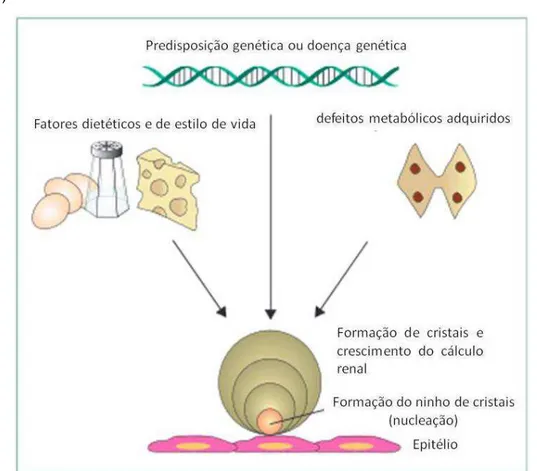
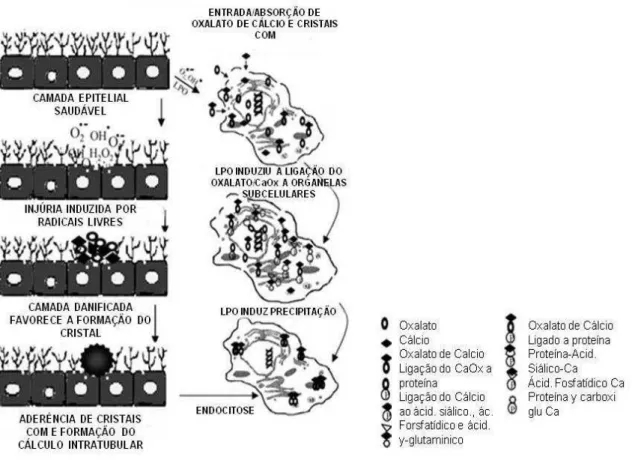
Figura 2 - Patogênese dos cálculos de oxalato de cálcio nos rins. Três categorias de fatores
(genética, metabólica e alimentar), em conjunto ou isoladamente para levar a formação do cálculo. O processo de nucleação heterogênea provavelmente precisa de um nicho iniciando no epitélio, que constitui o substrato para a cristalização e para o crescimento.
Fonte: MOE, 2006, adaptada.
26 união de um ou mais núcleos, essa agregação resulta em cristais grandes e pesados que podem se precipitar (OGAWA, MIYAZATO e HATANO, 2000).
As pedras renais podem ser formadas de diversos minerais, como: oxalato de cálcio, fosfato de cálcio, ácido úrico, cistina e cristais derivados de infeção como estruvita e carbonato de apatita, além de cristais mistos. (BICHER et. al., 2002; LÓPEZ e HOPPE, 2010). Dentre esses destaca-se os cristais de oxalato de cálcio, que representam mais de 40% dos cristais encontrados em pacientes com urolitíase. O stress oxidativo é outro fator relacionado com a formação de cálculo renal (THAMISELVAN, HACKETT e KHAN, 1997). Estudos com ratos que foram induzidos a formarem cálculos renais de oxalato de cálcio (OxCa) mostraram que há uma diminuição plasmática das atividades das enzimas antioxidantes superoxido dismutase (SOD), catalase, glutationa peroxidase (GPx), glucose-6-fosfato desidrogenase, glutationa-S-transferase, bem como diminuição dos níveis plasmáticos dos sequestradores de radicais livres: vitamina E, vitamina C, proteína tiol e glutationa reduzida (GSH). Foi demonstrado que também havia um aumento plasmático de moléculas marcadoras de peroxidação lipídica (SELVAN, 2002). Estudos realizados com pacientes com tendência a formar cálculos de OxCa também obtiveram resultados semelhante, indicando uma relação entre defesa antioxidantes e formação de cálculos de OxCa (ANBAZHAGAN et. al., 1999). Outros estudos indicam que moléculas com capacidade antioxidante podem inibir a formação de cristais de OxCa no tecido renal in vitro (DAVALOS, et. al., 2010) e in vivo (HOLOCH e TRACY, 2011).
possuem uma morfologia drusiforme (fig. 2C), porém esses raramente são encontrados na urina de paciente devido a sua instabilidade.
Figura 3 - Imagens de Microscopia Eletrônica de Varredura de Cristais de Oxalato de Cálcio.
(A)Mono-hidratado; (B) Di-hidratado; (C) Tri-hidratado
Fonte: GRASES et al., 1989
A supersaturação de íons na urina tem um papel importante na formação dos cristais, cristais tipo COM e COD formam-se naturalmente na urina e este último tem certa instabilidade e possui uma tendência em se converter em COM. Em pacientes não formadores de cálculos existem mecanismos que aumentam a estabilidade dos COD, pois eles são mais facilmente excretados. Em pacientes formadores de pedras nos rins existe uma falha nesses mecanismos de estabilização, diminuindo sua eficiência e aumentando a população de COM (LIESK, DEGANELLO e TOBACK, 1999). Estudos mostram que o principal componente dos cálculos urinários é COM. Há diversas hipóteses que tentam explicar a formação dos cálculos renais e a presença dos cristais COM dentro desses cálculos. Porém, nenhuma delas é satisfatória em elucidar todos as nuances desse processo. Já que fatores como, hipercalciúria, hiperoxalúria, promotores e inibidores de formação de cristais (saturação urinária, presença pré-existente de partículas sólidas e níveis de
A
B
28 substâncias inibidoras de formação de cristais) influenciam em diferentes níveis a formação do cálculo renal. (KÖNIGSBERGER, 2006; SOUZA e ELIAS, 2006)
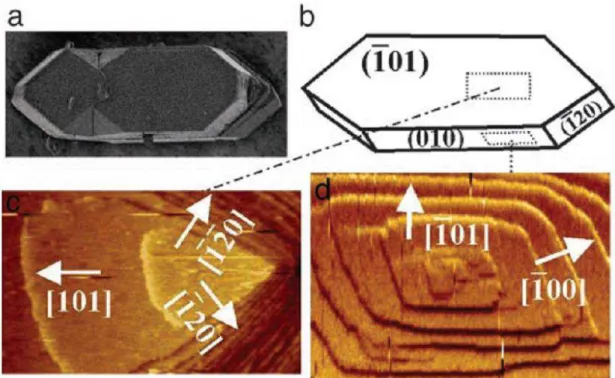
Os cristais COM apresentam três faces de crescimento (fig. 3A-B). Face (101), (010) e (120). O crescimento desses cristais ocorre a partir da deposição gradual de íons formando camadas, esse crescimento não é homogêneo, e ao se observar em escala manométrica verifica-se que essas camadas não se sobrepõe totalmente, levando a formação de degraus e terraços (fig. 3C-D) a cada camada sobreposta (QIU et. al., 2003).
Figura 4 - Diferentes imagens de COM. COM observado em microscopia de varredura (a).
Diagrama das faces dos cristais de OxCa (b). Visão da face (101) em microscopia de força atômica (c). Visão da face (010) em microscopia de força atômica (d).
Fonte: QIU et al., 2003, Adaptado
cristais dentro do citoplasma celular provoca dano oxidativo e lesão celular. Um dos resultados do dano oxidativo é a peroxidação lipídica da superfície celular, o que, por conseguinte provoca a perda das moléculas protetoras da superfície celular, permitindo que os cristais COM interajam com essa superfície. Alguns desses cristais vão se combinar entre si e com outras moléculas para formar cálculos renais, que leva a dano físico na célula e lesão, já outros vão ser endocitados. Os cristais intracelulares junto com os cristais endocitados (COM) geram mais stress oxidativo, que induz a formação de mais cristais e consequentemente a formação do cálculo renal (fig. 4). (LIESK, DEGANELLO E TOBACK, 1999; YUEN, et. al., 2010).
Figura 5 - Modelo hipotético da representação da deposição/internalização do cristal de oxalato de cálcio nas células renais por endocitose e processo intracelular por oxalúria durante condições hiperoxalúricas.
Fonte: SELVAN,2002, Adaptada
1.6 QUITOSANA COMO ANTIOXIDANTE
30 atividade. Isso reflete também nas definições existentes para compostos antioxidantes, tendo isso em mente, Gutteridge e Halliwell (2010) sugerem uma definição simples, mas que contempla o estado da arte atual sobre definição de compostos antioxidantes. Segundo eles um antioxidante é: ‘‘any substance that delays, prevents or removes oxidative damage to a target molecule”, cuja traduçãolivre seria: “qualquer substância que retarde, previna ou remova dano oxidativo de uma molécula-alvo”.
O dano oxidativo é causado pelas espécies reativas e o processo de formação dessas espécies reativas ocorre através de uma reação em cadeia envolvendo três fases (iniciação, propagação e terminação), em que os antioxidantes podem atuar através de vários mecanismos. Assim, podem-se utilizar vários testes para avaliar a atividade antioxidante de um composto nos diferentes estágios de iniciação (por exemplo: capacidade antioxidante total e poder redutor), de propagação (por exemplo: quelação de cobre e de ferro) e de terminação (por exemplo: sequestro do radical superóxido e de hidroxila). Por isso, é tão difícil afirmar se um composto é melhor antioxidante que outro, já que o mesmo composto pode ter uma excelente atividade em testes que avaliam a fase de iniciação e ter atividade ínfima em testes que avaliam as outras fases, por exemplo (Gutteridge e Halliwell, 2010).
A quitosana também não foge a essa regra, ela não é um excelente antioxidante em todos os testes, sua atividade é pronunciada principalmente nos testes de propagação e terminação.
Dados de alguns autores mostram que a atividade sequestradora da quitosana é dependente do seu grau de desacetilação. Como por exemplo, pode-se citar o trabalho de Park e colaboradores (2004), nesse trabalho três quitosanas com diferentes graus de desacetição (90, 75 e 50%) obtidos da dasacetilação do mesmo tipo de quitina, foram avaliados nos testes de sequestro de radical hidroxila, radical DPPH, superóxido e radical alquil, os resultados indicaram uma correção positiva entre o grau de desacetilação e a atividade sequestradora de radicais (tabela 3).
Tabela 3: Influência das prorpriedades da quitosana na atividade antioxidante Propriedade físico-química Efeito na atividade antioxidante
↑Grau de desacetilação Atividade sequestradora
↑Massa molecular Efeito sequestrador de radicais Potencia de quelação de íons
Fonte: Adaptada de (Aranaz et. al., 2009)
Estudos com quitoligossacarídeos têm trazido informações importantes para que se façam correlações entre estrutura e atividade da quitosana. Tem sido observado que os grupamentos amino livres desses oligos têm um papel importante na atividade sequestradora, pois eles dão estabilidade ao complexo formado entre o oligo e o radical livre, o que provavelmente deve ser o que está acontecendo com as moléculas de quitosana (JE, PARK e KIM, 2004).
1.7 AG e MODIFICAÇÕES DE POLISSACARÍDEOS
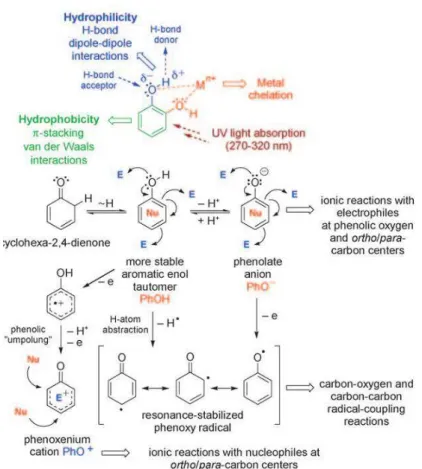
O ácido gálico (3,4,5-trihidroxi ácido benzóico) é um composto fenólico natural com atividade antioxidante, sintetizado por diferentes plantas. Como por exemplo, ele é encontrado em grande quantidade no chá-verde. Ele é facilmente extraído e purificado de outras plantas, além de poder ser sintetizado. Estas características fazem do ácido gálico um produto barato e com potencial para ser utilizado em diversas atividades humanas. Ele é amplamente utilizado na indústria de alimentos, fármacos e cosméticos devido, entre outras coisas, a sua capacidade de inibir a peroxidação lipídica (LU et al., 2006).
32 da molécula a qual o ácido gálico está conjugado, além disso essas três hidroxilas fornecem um alto poder redutor ao ácido gálico (JI et al., 2006) ; o anel benzênico do ácido gálico conjugado à moléculas como polissacarídeos é capaz de bloquear as pontes de hidrogênio inter e intramoleculares, impedindo a formação de agregados moleculares e por conseguinte aumenta a solubilidade da molécula à qual ele está conjugado; devido aos seus grupamentos carboxila e hidroxila o ácido gálico é capaz de aumentar a hidrofilicidade das moléculas as quais ele está conjugado; a presença do grupamento carboxila torna o ácido gálico uma molécula facilmente conjugável, já que este pode realizar ataques nucleofílicos a aminoácidos, monossacarídeos e outras moléculas; e ele também é um produto natural (PASANPHAN & CHIRACHANCHAI, 2008).
A conjugação do AG a quitosana possui diferentes metodologias relatadas, como a de Pasanphan e Chirachanchai (2008) e a de Curcio e colaboradores (2009), em ambos foi possível ligar covalentemente o AG a cadeia do polissacarídeo, criando assim uma molécula com um potencial ainda pouco explorado.
Figura 6 – Propriedades do grupamento funcional Fenol. E: Eletrofílico, Nu: Nucleofílico.
Diante do exposto o objetivo desse trabalho foi avaliar o potencial antioxidante e de interferencia de formação de cristais de OxCa de uma quitosana de baixo peso molecular e seus derivados conjugados com ácido gálico (AG)
Para obtenção dos objetivos propostos pretende-se:
Caracterizar fisico-quimicamente a quitosana utilizada nesta dissertação; Avaliar atividade antioxiante in vitro da quitosana caracterizada no item acima; Verificar a interferência dessa quitosana na formação de cristais de OxCa in
vitro;
Conjugar a quitosana citada nos objetivos acima com AG;
Caracterizar fisico-quimicamente as quitosanas conjugadas com AG;
34
2 MATERIAIS E MÉTODOS 2.1 MATERIAIS
2.1.1 Chitosan
O chitosan de baixo peso molecular foi comprado da Sigma-Aldrich (Referência: 448869 – 250g, Lote: 61496MJ).
2.1.2 Outros materiais
Acetato de sódio trihidratado (3 H2O) da VETEC
Ácido ascórbico, ferrozina, cloreto de cálcio, oxalato de sódio, cloreto de sódio, acetato de sódio, citrato trisódico, violeta de pirocatecol, 2,2-dimethyl-2-silapentane-3,3,4,4,5,5-d6-5-sulfonate (DSS) e sulfato de cobre II pentahidratado da Sigma-Aldrich Brasil (São Paulo, SP, Brasil);
Ácido Gálico da CAQ Casa de Química Ind. E Com. (Diadema, SP, Brasil);
Ácido acético, ácido sulfúrico, ácido tricloro acético (TCA), álcool metílico, fosfato de sódio dibásico, fosfato de sódio monobásico, hidróxido de sódio, peróxido de hidrogênio e sulfato de ferro heptahidratado da CRQ (Diadema, SP, Brasil);
Molibdato de amônia da Reagen Quimibrás Industrias Químicas (Rio de Janeiro, RJ, Brasil);
Reagente Folin-Ciocalteau, acetona, D2O e Cloreto de Ferro II da Merck; Brometo de potássio da VETEC
Todos os demais materiais e reagentes foram de grau laboratorial.
2.1.3 Aparelhos
Agitador orbital modelo 255-B da FANEM Ltda (São Paulo, SP, Brasil);
Banhos e estufas de temperatura controlável da FANEM Ltda (São Paulo, SP, Brasil);
Espectrômetro Bruker Avance III de 400 MHz com uma sonda de banda larga inversa de 5 milímetros, da Bruker BioSpin Corporation, USA (departamento de bioquímica UFPR);
Medidor de pH PHTEK, modelo Meter PHS 3B (Tóquio, Japão); Balança analítica e de precisão da TECNAL (Piracicaba, SP, Brasil); Microscópio NIKON Eclipse Ti-U (Melville, NY, EUA)
“Density light scattering” (Zetaplus®), da Instrutécnica (Campinas, SP, Brasil) Thermo-Nicolet Nexus 470, da Thermo-Nicolet, USA.
2.2 MÉTODOS
2.2.1 Caracterização química da molécula
2.2.1.1. Análise de espectroscopia de infravermelho
Os polissacarídeos (10 mg) foram misturados cuidadosamente com brometo de potássio e prensados para a obtenção de uma pastilha. Essa pastilha foi então submetida ao aparelho de espectrometria de infravermelho Thermo-Nicolet Nexus 470 pesetas e os espectros de infravermelho foram obtidos em uma faixa compreendida entre 500 e 4000 cm-1. Trinta e duas varreduras em uma resolução de 4 cm-1 foram calculados e referenciada contra o ar.
2.2.1.2 Análise de espectroscopia de ressonância magnética nuclear
Uma massa de 50 mg dos diferentes polissacarídeos foi dissolvida em 800 µL de D2O. Espectro (1H) de ressonância magnética nuclear (RMN) foi obtido a 70 ºC, no espectômetro Bruker Avance III, a 400 MHz. As diferenças químicas são expressas em δ relativa a acetona em δ 2.21, baseado no sódio 2,2-dimethyl-2-silapentane-3,3,4,4,5,5-d6-5-sulfonate (DSS) em δ=0.00 de acordo com as recomendações da IUPAC.
2.2.1.3 Determinação do grau de desacetilação (GD)
36 colaboradores (2003) que melhor se aplicava ao nosso quitosan. A fórmula abaixo descreve quais picos foram integrados e como foi realizado o cálculo:
GD % = (H D + H A) ∗H D
2.2.1.4 Dosagem de compostos fenólicos totais
Não existe um método específico para a dosagem de ácido gálico. Entretanto, o ácido gálico é um composto fenólico por isso foi utilizado o método de quantificação de compostos fenólicos para determinar a quantidade de ácido gálico ligado covalentemente a quitosana após o processo de conjugação
Os compostos foram quantitativamente avaliados pelo método colorimétrico de Folin-Ciocalteau e as leituras realizadas a 765 nm. O ácido gálico foi utilizado como padrão de leitura (COSTA, et al., 2010) resultado foi expresso como a razão de mg de ácido gálico/g de amostra, a solução com quitosan não conjugado foi utilizado como branco.
2.2.2 Atividade antioxidante in vitro
2.2.2.1 Determinação da capacidade antioxidante total (CAT)
2.2.2.2 Avaliação do poder redutor
Para avaliar o poder redutor, 4 mL de solução contendo as amostras em diferentes concentrações (0,1 – 1,00 mg/mL) foram misturadas ao tampão fosfato (0,2M, pH 6,6) e ferricianeto de potássio (1%) e incubados por 20 min a 50 ºC. A reação foi interrompida pela adição de TCA (acido tricloroacético) a 10%. Por fim adicionou-se água destilada e cloreto de ferro. A absorbância da solução é medida a 700 nm e ácido ascórbico é utilizado como padrão (ATHUKORALA, KIM E JEON, 2006; WANG et al., 2008).
2.2.2.3 Avaliação do sequestro do radical hidroxila (OH.)
Para a realização esse teste, o radical hidroxila foi gerado utilizando-se 3 mL de tampão de fosfato de sódio (150 mM, pH 7.4), que continha 10 mM de FeSO4 · 7H2O, 10 mM de EDTA, 2 mM de salicilato de sódio, 30% de H2O2 e concentrações diferentes dos polissacarídeos. O radical foi gerado devido a reação de Fenton (Fe2 + + H2O2 Fe3+ + OH-+ OH.). Para o controle foi utilizado tampão fosfato em substituição ao peróxido de hidrogênio. Após incubação a 37 ºC por 1 hora, a presença de radical hidroxila foi medida através da absorbância a 510 nm. O ácido gálico foi utilizado como controle.
2.2.2.4 Avaliação da capacidade de quelar de ferro
A capacidade quelante das amostras foi analisada utilizando a seguinte metodologia: as amostras em diferentes concentrações foram colocadas em uma mistura de reação constituída de cloreto de ferro II (0,05 mL, 2 mM) e ferrozina (0,2 mL, 5 mM). Após agitação por alguns segundos as soluções foram mantidas a temperatura ambiente por 10 min para que ocorressem as reações necessárias e posteriormente a absorbância da solução foi obtida a 562 nm. Controle positivo foi o EDTA e a capacidade quelante das amostras foi determinada conforme a equação abaixo.
Quelação % = (Ac Ae− Aa a
38
2.2.2.5 Determinação da capacidade quelante de cobre
O método se baseia na capacidade do violeta de pirocatecol em se associar a íons de cobre e formar um complexo colorido (ANTON, 1960), quando o cobre é quelado, impede a formação desse complexo e consequentemente a intensidade da coloração da solução é menor. O teste é realizado em microplaca. Em cada poço foram adicionados amostra em diferentes concentrações (0,1 – 2,0 mg/mL), violeta de pirocatecol (4 mM) e sulfato de cobre II pentahidratado (50 µg/mL), após a adição de cada ítem os poços são homogeneizados. A absorbância foi medida a 632 nm. Para o controle foi utilizado EDTA e a capacidade de quelação foi calculada utilizando a equação abaixo:
Quelação de Cobre % = (Ac e− Aa a
Ac e ) ∗
2.2.3 Ensaios de formação de cristais de OxCa 2.2.3.1 Ensaio de cristalização do oxalato de cálcio
Quando cristais de oxalato de cálcio se formam em solução a partir de Ca2+ e oxalato, eles alteram a turbidez do meio em que se encontram, permitindo que essa formação possa ser avaliada através de espectrofotometria. Zhang e colaboradores (2012) descrevem um ensaio em que se mede essa formação por 30 min a 620 nm. Para tal, se mistura de cloreto de cálcio (8 mmol/L), oxalato de sódio (1 mmol/L), cloreto de sódio (200 mmol/L) e acetato de sódio (10 mmol/L). As concentrações dessa mistura estão próximas das concentrações fisiológicas da urina. A formação dos cristais foi avaliada na presença ou na ausência dos polissacarídeos. A partir dos valores de absorbância obtidos foi possível montar um gráfico que representa o perfil de formação de cristais de CaOx na presença daquela amostra.
2.2.3.2 Análise da morfologia dos cristais de CaOx por imagem microscópica
CaOx e foi ressuspendido em 0,5 mL de água e uma alíquota de 0,1 mL foi colocada em lâmina histológica e observada em microscópio ótico (600x) imediatamente após a ressuspenção. Foram obtidas imagens de 10 campos diferentes, selecionados aleatoriamente, de cada lâmina, que foram analisados utilizando o software NIS Elements AR 4.00.03 64 bit. Através do software foi realizada a análise de tamanho dos cristais, onde o diâmetro máximo dos cristais foi medido. Foram realizados 3 experimentos distintos.
2.2.3.3 Medida do potencial zeta (ζ) dos cristais de CaOx
Após 30 minutos do início da formação dos cristais na presença e na ausência dos polissacarídeos, as soluções foram centrifugadas (5000 g). O sobrenadante foi descartado e o precipitado rico em cristais de CaOx foi ressuspendido em 1,5 mL de água e avaliado no Zeta Plus® para obtenção do potencial zeta.
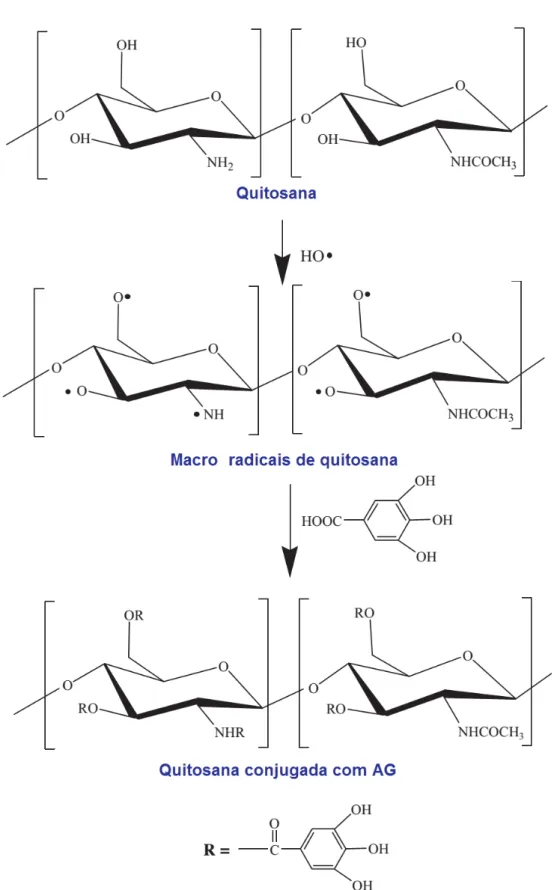
2.2.4 Conjugação do quitosan com ácido gálico
40
Figura 7 - Processos que ocorrem durante a conjugação de AG em quitosana através do método sugerido.
2.2.5 Análise estatística
42 3 RESULTADOS
3.1 ANÁLISE DO ESPECTRO DE INFRAVERMELHO DA QUITOSANA.
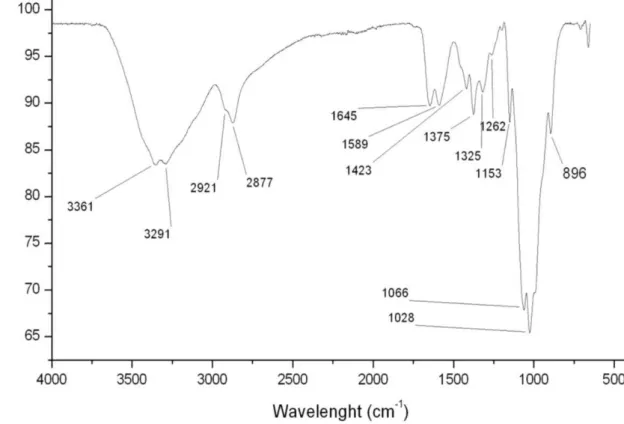
Na figura 8 pode-se observar o espectro de infravermelho obtido a partir da quitosana. Identificaram-se vários sinais característicos dos grupos funcionais encontrados na quitosana. Na região em torno de 3426 cm-1 há um sinal largo que corresponde a sobreposição dos sinais das vibrações de alongamento das hidroxilas e das pontes de hidrogênio intramoleculares, já na região de 2921 e 2877 cm-1 tem-se os sinais de estiramento assimétrico e simétrico dos grupos C-H, respectivamente. Estes sinais são característicos de polissacarídeos. A presença do grupamento carbonila (C=O) do radical acetil foi confirmada pelo sinal em 1665 cm-1. E a presença dos grupos NH2 foi confirmada pelo sinal em torno de 665 cm-1. Os sinais em 1645 e 1589 cm-1 confirmam que os grupos NH2 estão na forma de aminas primárias. Já a presença do nitrogênio ligado aos grupos acetis foi confirmada pelos sinais em 1423, 1375 e 1325 cm-1.
Figura 8 - Espectro de Infravermelho referente a quitosana. Os picos indicados são picos
3.2 ANÁLISE DO ESPECTRO RESSONÂNCIA MAGNÉTICA NUCLEAR DA QUITOSANA.
Na Figura 9 pode-se observar o espectro de 1H RMN da quitosana. Na região compreendida entre 3.8 e 4.2 ppm encontram-se os sinais de H2, H3, H4, H5 e H6 dos resíduos de açucares da molécula, eles estão sobrepostos o que torna impossível o seu assinalamento. Já os sinais dos hidrogênios anoméricos (H1) estão claros; em 5,25 ppm encontra-se um pico que foi assinalado como H anomérico de um resíduo denominado de D (D-1) e o sinal em 5,0 ppm foi assinalado como H anomérico do resíduo denominado de A (A-1). O pico em 3.5 ppm foi assinalado como H2 da resíduo D (D-2), e o pico em 2.5 ppm corresponde aos hidrogênios dos grupos metil do resíduo A. O pico em 4.75 ppm corresponde aos hidrogênios do solvente.
Figura 9 - Espectro de ressonância magnética nuclear dos hidrogênio referente a quitosana.
44 A partir do espectro de 1H RMN da quitosana foi possível determinar o seu grau de desacetilação. Para tal, Utilizou-se a fórmula descrita em materiais e métodos e chegou-se ao valor de 76,47 ± 4,8 %.
3.3 AVALIAÇÃO DA ATIVIDADE ANTIOXIDANTE DA QUITOSANA
A atividade antioxidante da quitosana foi avaliada em cinco diferentes testes conforme descrito em materiais e métodos. Os resultados são demonstrados na tabela 4, na qual se pode verificar que nas condições testadas a quitosana não apresentou capacidade sequestradora de íons hidroxila e capacidade quelante de ferro. Por outro lado, a quitosana apresentou capacidade antioxidante em outros três testes: Capacidade antioxidante total, poder redutor e quelação cúprica. Com destaque para este último, em que foi observado um efeito quelante de metal em torno de 70 %.
Tabela 4: Atividades antioxidantes da Quitosana avaliadas por diferentes testes
Teste Condição Resultado
Capacidade antioxidante
Total 1 mg/mL 0,0324 ± 0,003 mg AA/g quitosana
Poder Redutor 0,5 mg 34 ± 3%
Quelação de Cobre 0,25 mg/mL 70,36 ± 4,16 %
Quelação de Ferro de 0,25 até 2 mg ND
Sequestro de Hidroxila de 0,25 até 2 mg ND
3.4 FORMAÇÃO DE CRISTAIS DE OXALATO DE CÁLCIO NA PRESENÇA DE QUITOSANA.
Quando a formação de OxCa foi avaliada na presença de quitosana verificou-se uma alteração no perfil do gráfico em comparação com aquele obtido com os dados do grupo controle. Visualiza-se claramente um aumento nos valores de absorbância que chagaram a valores próximos a 0,400, que são dez vezes maiores que os valores observados na situação controle. Além disso, a fase I se prolongou até o término do experimento. Esse efeito pôde ser observado nas diferentes concentrações avaliadas.
Figura 10 – Perfil de formação dos cristais. (A) situação controle, (B) formação na presença de
46
Tendo em vista a alteração nesse gráfico de formação de cristais, analisou-se a morfologia desses cristais produzidos.
3.5 AVALIAÇÃO DA MORFOLOGIA DOS CRISTAIS DE OXCA FORMADOS NA PRESENÇA DE QUITOSANA
Os cristais formados in vitro na presença ou ausência de quitosana foram avaliados morfologicamente utilizando-se um microscópio de luz clara. A observação dos cristais formados na condição controle indica a presença de três tipos distintos de cristais. O cristais que apresentam formato retangular com arestas proeminentes são os cristais de OxCa monohidratados (COM) e são a forma predominante (fig. 11A). Já os cristais com forma semelhante a uma estrela com 4 pontas, são cristais bipiramidais tetragonais são formados por OxCa dihidratado (COD). Bem no centro da fig. 11A encontra-se um cristal drusiforme, que é forma característica de cristais de OxCa trihidratados (COT) que é a forma mais instável de cristal.
Figura 11 – Imagens dos cristais formados sob diferentes condições. (A) cristais formados no controle; (B) Cristais formados na presença de quitosan; (C) Tamanho médio dos COM formados nas 2 situações. Setas brancas indicam COD e setas pretas indicam COM. Letras diferentes indicam diferença significativa (p <0,05).
48 3.6 DETERMINAÇÃO DO POTENCIAL ZETA (Ζ) DOS CRISTAIS DE OXCA
O potencial zeta representa a carga superficial das partículas em comparação ao solvente em que se encontram essas partículas. Na condição controle, o potencial zeta medido foi de aproximadamente 10 mV (Fig. 12). Quando os cristais foram formados na presença da quitosana o potencial zeta medido subiu para aproximadamente 28 mV.
Chito sana Contr ole 0 10 20 30
a
b
Amostras P o te n ci al Z et a( m V )Figura 12 – Avaliação do potencial zeta dos cristais formados na presença eausência de
quitosana. Letras diferentes indicam diferenças estatística (p <0,05).
3.7 CONJUGAÇÃO DE QUITOSANA COM ÁCIDO GÁLICO (AG)
Na figura 13 pode-se observar que não houve diferença significativa na quantidade de AG conjugado a molécula de quitosana nas quatro condições utilizadas no processo de conjugação. A quantidade de AG presente nas amostras variou de 9,33 ± 0,5 mg AG/g Quitosana (Chit-Gal2) até 10,19 ± 1,48 mg AG/g Quitosana (Chit-Gal4).
Dosagem de Fenólicos
Chit-Ga l1 Chit-Ga l2 Chit-Ga l3 Chit-Ga l4 0 5 10 15
a
a
a
a
Amostras A G m g /g c h it o sa nFigura 13 – Dosagem de compostos fenólicos das quitosanas conjugadas. Letras diferentes
indicam resultados estatisticamente diferentes (p <0,05).
3.8 ANÁLISE DE ESPECTROSCOPIA DE INFRAVERMELHO DAS AMOSTRAS DE QUITOSANA CONJUGADAS COM ÁCIDO GÁLICO
50
Figura 14 – Espectros de infravermelho da quitosana não conjugada comparado as quitosanas
conjugadas. (A) Chit-Gal1; (B) Chit-Gal2; (C) Chit-Gal3; (D) Chit-Gal4.
3.9 ANÁLISE DOS ESPECTROS DE 1H RMN DOS QUITOSANAS CONJUGADAS
52 3.10 ANÁLISE DA CAPACIDADE ANTIOXIDANTE DOS QUITOSANAS
CONJUGADAS
3.10.1 Capacidade Antioxidante total
A capacidade antioxidante total das quitosanas modificadas quimicamente é mostrada na fig. 16. A atividade antioxidante total de dois derivados (Chit-Gal2 e Chit-Gal3) não foi significativamente diferente da quitosana não modificada, apesar dos seus valores serem maiores que aqueles observados na quitosana não modificado. Por outro lado, a atividade de Chit-Gal1 e Chit-Gal4 foram significativamente superiores à atividade da quitosana e das outras moléculas conjugadas, mas não apresentaram diferença significativa entre si.
Capacidade Antioxidante Total
Chito san Ch it-Gal1 Ch it-Gal2 Ch it-Gal3 Ch it-Gal4 0.00 0.02 0.04 0.06 0.08
*
*
*
#
#
Amostras E q . d e A A ( g /g )Figura 16 - Capacidade antioxidante total das amostras, em µg de Ac. Ascórbico/g de amostra.
Sinais diferentes indicam resultados estatisticamente diferentes (p <0,05).
3.10.2 Atividade de sequestro de radical hidroxila
3.10.3 Determinação da capacidade quelante de cobre
Pode-se comparar a atividade da quitosana e as quitosanas conjugadas através da figura 17. Pode-se observar que em baixas concentrações (até 0,25 mg/mL) a capacidade quelante de cobre das quitosanas modificadas difere da capacidade quitosana original. Porém em concentrações um pouco mais altas (a partir de 0,5 mg/mL) não houve diferença significativa entre a capacidade quelante de cobre da quitosana não modificada comparada a capacidade de seus conjugados, nem diferença na capacidade dos conjugados quando comparadas entre si.
Quelação de Cobre
0.0 0.5 1.0 1.5 2.0 2.5 0 20 40 60 80 100
Chitosan
Chit-Gal1
Chit-Gal2
Chit-Gal3
Chit-Gal4
* * # # § * * * *Concentração mg/mL
%
Q
u
el
aç
ão
Figura 17 - Atividade de quelação de cobre das amostras. Sinais diferentes indicam valores
estatisticamente diferentes (p <0,05). EDTA foi utilizado como controle positivo e obteve 100% de atividade na concentração de 0,05 mg/mL.
3.10.4 Avaliação do poder redutor das moléculas de quitosana conjugadas
54 os conjugados, tendo em vista que Chit-Gal1 e Chit-Gal4 possuíram atividade de poder redutor mais proeminente que Chit-Gal2 e Chit-Gal3.
Poder Redutor
Chito san Ch it-Gal1 Ch it-Gal2 Ch it-Gal3 Ch it-Gal4 0 50 100 150
a
a,b
b,c
c
d
Amostras % d a at iv . d a V it . CFigura 18 - Poder redutor das amostras. Letras diferentes indicam diferença estatística (p <0,05).
3.10.5 Avaliação da capacidade de quelar ferro das moléculas conjugadas
Quelação de Ferro
0.0 0.5 1.0 1.5 2.0 2.5
0 20 40 60 80 Chitosan Chit-Gal1 Chit-Gal2 Chit-Gal3 Chit-Gal4 a b c d e f g g,h h i Concentração (mg/mL)
%
Q
u
el
aç
ão
Figura 19 – Atividade quelante de ferro. Letras diferentes indicam diferença estatística (p <0,05).
EDTA foi utilizado como controle positivo e obteve 100% de atividade na concentração de 25 µg/mL.
3.11 ANÁLISE DO PERFIL DE FORMAÇÃO DE FORMAÇÃO DE CRISTAIS DE OXCA
56
Figura 20 - Perfil de formação dos cristais de OxCa na presença das quitosanas conjugadas.
3.12 ANÁLISE MORFOLÓGICA DOS CRISTAIS DE OXCA FORMADOS NA PRESENÇA DOS QUITOSANAS MODIFICADAS.
Na figura 21 observa-se os cristais de OxCa depois da indução de sua formação na presença dos diferentes polissacarídeos. Em todas as condições de formação dos cristais na presença dos quitosanas conjugadas houve a presença de cristais COM. Contudo, estes cristais formados apresentam uma diferença morfológica quando comparados com aqueles na situação controle, eles são menores e com morfologia elíptica.
Com relação ao número de cristais formados por campo, na presença de Chit-Gal1 não houve diferença significativa na quantidade de cristais formados em comparação com o grupo controle. Com relação as outras quitosanas conjugadas, todas diminuíram a quantidade de cristais formados quando comparados a quitosana não modificada, sendo a menor redução observada na presença de Chit-Gal2 e a maior na presença de Chit-Gal4. Nesta ultima condição o número de cristais formados se aproximou do número formado na condição controle.
0 0,02 0,04 0,06 0,08 0,1 0,12 0,14 0,16
0 2 4 6 8 10 12 14 16 18 20 22 24 26 28 30
Controle
Chit-gal1 - 100
Chit-gal2 - 100
Chit-gal3 - 100
Chit-gal4 - 100
Figura 21 - Morfologia dos cristais formados na presença e ausência das quitosanas. (A) Controle. (B) Formação de cristais na presença da quitosana; (C-F) Conjugados de 1 – 4, respectivamente. Setas brancas indicam COM e Setas pretas COD.
3.13 POTENCIAL ZETA
58 presença da quitosana e na presença de Chit-Gal2 e Chit-Gal3, apesar de os valores observados em Chit-Gal2 e Chit-Gal3 serem menores do que os observados com a quitosana. Já em Chit-Gal1 e Chit-Gal4 os valores do potencial zeta são os que menos interferiram no potencial zeta dos cristais quando comparados com o controle, as análises estatísticas demonstram que não há diferença estatística entre eles e o controle.
Contr ol Chito san Ch it-Gal1 Ch it-Gal2 Ch it-Gal3 Ch it-Gal4 0 10 20 30
a
b
a
a
a,b
a,b
Amostras P o te n ci al Ze ta ( m V )Figura 22 – Potencial zeta dos cristais formados na presença dos diferentes quitosans. Letras
4 DISCUSSÃO
A quitosana utilizada neste trabalho foi adquirida comercialmente, e como os resultados obtidos com relação aos testes de formação de cristais seriam inéditos, era crucial que se tivesse certeza que o efeito observado não era decorrente da presença de contaminantes encontrados neste produto comercial. Os dados obtidos tanto na FTIR, quanto na H1RMN, confirmaram que o produto adquirido comercialmente era constituído essencialmente de quitosana, já que os sinais encontrados nos espectros dessas análises são aqueles esperados para moléculas de quitosana (VINO, et. al., 2012; SONG, et. al., 2013; CZECHOWSKA-BISKUP, et. al., 2012; LAVERTU, et. al., 2003). Além disso, não foram encontrados sinais que indicassem a contaminação por proteínas (BARTH, 2007; KAINOSHO, et. al., 2006), outros polissacarídeos (COSTA, et. al., 2012) e polifenóis (LIU, et. al., 2013).
Diante da comprovação da identidade da quitosana, ela foi então utilizada nos testes seguintes. Para se avaliar a atividade antioxidante da quitosana realizaram-se cinco testes que possibilitam verificar ação do composto nos três diferentes estágios da cadeia de formação de espécies reativas: iniciação (CAT e poder redutor); propagação (quelação de ferro e de cobre); terminação (sequestro de hidroxila).
No teste do poder redutor a quitosana apresentou uma atividade máxima na concentração de 1 mg/mL que correspondeu a 34% da atividade de 0,1 mg/mL de vitamina C. Este valor apesar de ser baixo se assemelhou ao encontrado por vários autores quando trabalharam com outras moléculas de quitosana (VINO, et. al., 2012; PRABU e NATARAJAN, 2012; KUPPUSAMY e KARUPPAIAH, 2013), o que indica que a capacidade de doar elétrons da quitosana nas condições físico-químicas do teste utilizado são baixas. Contudo, vale salientar que outros polissacarídeos também têm esta baixa capacidade, como fucanas sulfatadas da alga Spatoglossum schröederi e galactanas sulfatadas das algas Caulerpa cupressoides, Caulerpa prolifera e Gracilaria caudata (COSTA, et. al., 2010) que apresentaram atividade semelhante à observada pela quitosana aqui avaliada.
60 moléculas, inclusive polissacarídeos, como os polissacarídeos sulfatados estudados por COSTA e colaboradores (2012), que trabalhando com polissacarídeos sulfatados da alga Caulerpa cupressoides encontraram resultados que variaram entre 10 – 20 mg de EAA/grama de polissacarídeo. Já no trabalho de MELO-SILVEIRA e colaboradores (2012), foi demonstrados que polissacarídeos neutros ricos em xilose (xilanas) apresentaram atividade, em torno de 48 mg de EAA/g de amostra. Nesses dois trabalhos a CAT apresentado por esses polissacarídeos foi considerada baixa, o que leva a conclusão que a atividade observada com a quitosana também é baixa.
O teste de CAT foi realizado em condições físico-químicas diferentes daquelas observadas no teste do poder redutor e mesmo assim este polissacarídeo apresentou baixa atividade. Os dados obtidos com os dois testes levam a proposição de que a propriedade de doar elétrons não é o principal mecanismo de ação antioxidante da molécula de quitosan aqui avaliada.
A capacidade de quelar íons metálicos foi medida na presença de Ferro e de Cobre. Com a quitosana comercial não foi observado atividade deste composto para o teste de quelação de ferro. Este fato foi curioso, pois trabalhos mostram que quitosanas possuem potencial para quelar ferro. Porém a atividade das moléculas de quitosana nunca ultrapassa 35%, isso quando foi avaliada pelo mesmo teste que foi utilizado nesta dissertação (PRABU e NATARAJAN, 2012; CHIEN, et. al., 2007; XING, et. al., 2005). Portanto, decidiu-se avaliar a atividade quelante de ferro da quitosana empregando-se outro teste, que segundo análise da literatura, é um método muito utilizado para se verificar a atividade quelante de moléculas de quitosana. Porém, mesmo assim, a quitosana comercial utilizada nesta dissertação não apresentou atividade quelante de ferro.