FACULDADE DE CIÊNCIAS FARMACÊUTICAS
CÂMPUS DE ARARAQUARA
Avaliação das propriedades antioxidantes da Curcumina
em sistemas-modelo in vitro.
Aline de Melo Orlandi
LABORATÓRIO DE BIOQUÍMICA CLÍNICA
Avaliação das propriedades antioxidantes da
Curcumina em sistemas-modelo in vitro.
Aline de Melo Orlandi
Trabalho de conclusão de curso apresentado ao Curso de graduação em
Farmácia- Bioquímica da Faculdade de Ciências Farmacêuticas de
Araraquara, da Universidade Estadual Paulista para a obtenção do grau de
Farmacêutica-Bioquímica
Orientador: Prof. Dr. Iguatemy Lourenço Brunetti
Co-Orientadora: Vânia Ortega Gutierres
Araraquara-SP
Á Deus por sempre me guiar, dar força e iluminar meu caminho.
Aos meus pais, que sempre estiveram ao meu lado, pelo amor e dedicação
que sempre demonstraram a mim! Amo vocês!
Ao meu irmão Gustavo, pelo carinho e momentos de descontração. Amo
você!
Ao meu namorado Juliano, pelo amor e carinho dispensados a mim, pela
paciência, pela atenção e disponibilidade em me ajudar. Amo você!
Ao orientador, Prof. Dr. Iguatemy Lourenço Brunetti, pela orientação
sempre presente e atenciosa. Obrigada pela oportunidade, pelos
ensinamentos, paciência e pela amizade.
À co-orientadora Vânia, por toda a ajuda e disponibilidade, obrigada pela
paciência e atenção.
Aos amigos de laboratório, Renata, Vânia, Juliana, Carlos, Bianca e
descontração.
À Faculdade de Ciências Farmacêuticas – UNESP pelo suporte físico e
oportunidade.
Resumo ... 5
Lista de Figuras ... 6
Lista de Abreviaturas ... 8
1. Introdução ... 9
1.1 Mieloperoxidase (MPO) ... 17
2. Objetivos ... 19
3. Material e Métodos ... 19
3.1 Amostras e cálculo de inibição ... 19
3.2 Sistemas não enzimáticos. ... 20
3.2.1 Capacidade de captura sobre o ABTS+• ... 20
3.2.2 Capacidade de captura sobre o DPPH• ... 21
3.2.3 Capacidade de captura sobre o HOCl/OCl- ... 22
3.2.4 Capacidade de captura sobre o H2O2 ... 23
3.2.5 Capacidade de captura sobre o O2• - ... 25
3.3 Sistemas enzimáticos ... 27
3.3.1 Obtenção da MPO do exsudado peritoneal de ratos ... 27
3.3.2 Dosagem de Proteínas no extrato de Neutrófilos. ... 27
3.3.3 Determinação da atividade da MPO no EBN ... 29
3.3.4 Ensaio da via peroxidativa MPO/ H2O2/Guaiacol ... 31
3.3.5 Ensaio da produção de HOCl pelo sistema MPO / H2O2 / Cl- (via clorinante), pelo ensaio da taurina-cloroamina e tetrametilbenzidina (TMB)... 32
3.4 Análises Estatísticas ... 33
4. Resultados e Discussão ... 33
4.1 Capacidade de captura sobre o ABTS• + ... 33
4.2 Capacidade de captura sobre o DPPH• ... 39
4.3 Capacidade de captura sobre o O2• - ... 45
4.4 Capacidade de captura sobre o HOCl/ OCl- ... 51
4.5 Capacidade de captura sobre o H2O2 ... ..57
4.6 Ensaios da via peroxidativa no sistema MPO/ H2O2/ Guaiacol ... 62
4.7 Efeito da curcumina sobre o sistema MPO/H2O2/Cl- (via clorinante) ... 65
5. Conclusão ... 76
6. Referências Bibliográficas ... 78
utilizada em alimentos, principalmente aqueles condimentados com curry e açafrão. Vários estudos demonstram seu efeito benéfico em diversas doenças, tais como: diabetes, hepatopatias, câncer, entre outras. Uma de suas propriedades é a atividade antioxidante, pois em pequenas quantidades é capaz de inibir ou retardar processos oxidativos. Para substanciar o estudo desta propriedade, comparou-se a capacidade de captura de espécies reativas radicalares e não radicalares pela curcumina, com padrões (biomoléculas, exceto o trolox) antioxidantes: ascorbato, crocina, glutationa, quercetina, rutina, trolox e urato, em sistemas-modelo in vitro, sobre a captura dos radicais: 2-2'-azino-bis (3-etilbenzotiazolina-6-ácido sulfônico) (ABTS●+); 2,2-difenil-1 picril-hidrazila (DPPH●); ânion radical superóxido (O2●-); HOCl/OCl- e H2O2. Investigou-se
também seu efeito inibitório na geração do HOCl no sistema, mieloperoxidase (MPO)/H2O2/Cl
(via clorinante) e na inibição da oxidação do guaiacol MPO/H2O2/Guaiacol (via peroxidativa). A curcumina nos ensaios com ABTS●+ ou O2●-,
apresentou o 3° menor IC50, 4,93 e 99,66 µmol/L, respectivamente; com o DPPH●
apresentou o 6° menor IC50, 24,70 µmol/L; com o HOCl/OCl
apresentou o menor IC50,
1,12µmol/L e no ensaio com o H2O2 não atingiu o IC50. No ensaio com o sistema
MPO/H2O2/Cl
-, observou-se alteração da banda de absorção (bleaching) da curcumina (420 nm), além disso, nos ensaios com a via clorinante (MPO/H2O2/Cl
-) e revelados com 3, 3’, 5, 5’- tetrametilbenzidina (TMB) e iodeto de potássio em meio ácido, observou-se aumento da absorbância (650 nm), o que impossibilitou o estudo de sua inibição nesta via. Entretanto, na via peroxidativa, observou-se uma diminuição significativa da absorbância do produto de oxidação do guaiacol (470 nm) com o tempo, mas também observou - se o bleaching da curcumina, na ausência do guaiacol, ou seja, no sistema MPO/H2O2/Curcumina. Os resultados das vias clorinante e peroxidativa,
evidenciam a interação entre MPO / H2O2 e curcumina. O conjunto desses resultados
salienta a eficiência da interação da curcumina com espécies de relevância biológica, como o O2●- ou HOCl/OCl
Figura 2: Mecanismo de ação da mieloperoxidase. Ciclo peroxidásico clássico e a via
clorinante, com formação de HOCl. ... 18
Figura 3: Formação do Cátion Radical ABTS+• ... 21
Figura 4: Estrutura molecular do DPPH• ... 22
Figura 5: Estrutura molecular da 3, 3’, 5, 5’- tetrametilbenzidina (TMB) ... 23
Figura 6: Estruturas moleculares do DTNB e do TNB. ... 24
Figura 7: Representação da geração do ânion superóxido em presença de um antioxidante...26
Figura 8: Diagrama de calibração para determinação de proteínas ... 29
Figura 9: Cinética da MPO ... 30
Figura 10: Inibição (captura) do ABTS• + pela: A, rutina; B, quercetina ... 34
Figura 11: Inibição (captura) do ABTS• + pela: A, curcumina; B, glutationa ... 35
Figura 12: Inibição (captura) do ABTS• + pelo: A, trolox; B, urato de sódio ... 36
Figura 13: Inibição (captura) do ABTS• + para: A, ácido ascórbico; B, crocina ... 37
Figura 14: Inibição (Captura) do radical ABTS• + (IC50 µmol/L), pela curcumina e padrões ... 38
Figura 15: Inibição (captura) do DPPH• pela: A, quercetina; B, ácido ascórbico. ... 41
Figura 16: Inibição (captura) do DPPH• pelo: A, trolox; B, urato de sódio. ... 42
Figura 17: Inibição (captura) do DPPH• pela: A, rutina; B, curcumina ... 43
Figura 18: Inibição (captura) do DPPH• pela: A, glutationa; B, crocina. ... 44
Figura 19: Inibição (captura) do DPPH• (IC50 µmol/L), pela curcumina e padrões. ... 45
Figura 20: Inibição (captura) do O2• - pela: A, quercetina; B, rutina ... 47
Figura 21: Inibição (captura) do O2• - pela: A, curcumina; B, crocina ... 48
Figura 22: Inibição (captura) do O2• - pelo: A,ácido ascórbico; B, glutationa ... 49
Figura 23: Inibição (captura) do O2• - pelo Trolox ... 50
Figura 27: Inibição (captura) do HOCl/OCl- pela: A, glutationa; B, urato ... 55
Figura 28: Inibição (captura) do HOCl/OCl- pelo: A, trolox; B, ácido ascórbico ... 56
Figura 29: Inibição (captura) do HOCl/OCl- (IC50 µmol/L), pela curcumina e padrões ... 57
Figura 30: Inibição (captura) do H2O2 pela catalase ... 59
Figura 31: Inibição (captura) do H2O2 pelo: A, ácido ascórbico; B, glutationa ... 60
Figura 32: Inibição (captura) do H2O2 (IC 50 µmol/L) pelo ácido ascórbico e glutationa ... 61
Figura 33: Reação da via Peroxidativa na presença e na ausência de curcumina ... 62
Figura 34: Reação da Via peroxidativa na presença de curcumina e ausência de Guaiacol ... 63
Figura 35: Representação do Bleaching da curcumina na via Peroxidativa... 65
Figura 36: Representação da velocidade da reação na via Clorinante na presença de Taurina ... 67
Figura 37: Representação da reação do EBN na via clorinante variando as concentrações de H2O2 ... 68
Figura 38: Representação da reação do EBN na via clorinante na presença e na ausência de Taurina ... 69
Figura 39: Representação da reação do EBN na via clorinante na presença e na ausência de taurina, na presença de curcumina ... 70
Figura 40: Representação da reação do EBN na via clorinante na ausência de H2O2 ... 71
Figura 41: Representação da reação do EBN na via clorinante na ausência de MPO ... 72
Figura 42: Representação da reação de variação da concentração de OCl- revelando com TMB ... 73
Figura 43: Representação da reação entre o radical HOCL/OCl- na presença e na ausência de curcumina ... 74
Figura 44: Representação do bleaching da curcumina ... 75
BSA Albumina Sérica Bovina
DMSO Dimetilsulfóxido
DPPH 2,2’-difenil-1-picrilhidrazil
EBN Extrato bruto de neutrófilos
ERN ERO
Espécie reativa de nitrogênio Espécie reativa de oxigênio
GSH Glutationa reduzida
H2O2 Peróxido de Hidrogênio
HO· Radical hidroxila
HOCl Ácido Hipocloroso
LPMN Leucócitos polimorfonucleares
MPO Mieloperoxidase
NBT Azul de nitrotetrazólio
NADH Nicotinamida adenina dinucleotídeo reduzida
1
O2 Oxigênio singlete
O2
·- Ânion radical superóxido
PMS Metassulfato de fenazina
RO· Radical alcoxila
ROO· Radical peroxila
SOD Superóxido dismutase
TMB 3, 3’, 5, 5’-tetrametilbenzidina
1. Introdução
A curcumina foi isolada pela primeira vez em 1815 e obtida em forma cristalina em 1870; sua estrutura molecular (1,7bis (4-hidroxi-3-metoxifenil)-1,6-heptadieno-3,5 diona) foi descrita por Lampe em 1910 (LAMPE, 1913). É um derivado polifenólico hidrofóbico, muito utilizado como pigmento natural, encontrada em vários alimentos, principalmente aqueles condimentados com curry e açafrão (SRINIVASAN; SAMBAIAIH, 1991; AGGARWAL; KUMAR; BHARTI, 2003; GOEL; KUNNUMAKKARA; AGGARWAL, 2008).
Vários estudos demonstram seus efeitos benéficos em diversas doenças tais como: diabetes, hepatopatias, câncer, Alzheimer, sinusite, reumatismo e na prevenção de doenças cardiovasculares (AGGARWAL; KUMAR; BHARTI, 2003; MURUGAN; PARI, 2007; EPSTEIN; SANDERSON; MACDONALD, 2009) e ainda descrevem atividade: antiinflamatória, antimicrobiana e antioxidante (CHAN, 1995; ANTUNES; BIANCHI, 2004; MESA, 2006; ZENG et al., 2007; VILLEGAS; FIDALGO; LASTRA, 2008). Atualmente a curcumina ainda não é muito utilizada em tratamento(s), pois durante sua metabolização no fígado (ou intestino) gera metabólitos secundários, com menor eficiência; além disso, sua absorção ocorre principalmente no trato gastrointestinal, influindo na sua ação nos demais órgãos (KOTWAL, 2010).
(GUTIERRES et al., 2011). O “designer” de alimentos ou alimentos funcionais está
ganhando importância como forma de prevenir doenças e promover a saúde da
população (RAJASEKARAN; KALAIVANI, 2012) e assim os alimentos enriquecidos
com curcumina podem ser considerados alimentos funcionais.
O termo radical livre refere-se á um átomo ou molécula contendo elétron(s) não emparelhado(s) em sua última camada eletrônica, motivo pelo qual apresentam alta reatividade. O radical pode ser formado pela subtração ou adição de elétron(s) a partir de uma espécie não-radicalar. No nosso organismo os radicais livres podem ser formados pela ação da radiação ionizante, luz ultravioleta, por reações catalisadas por metais como ferro e cobre, em sistemas enzimáticos durante o metabolismo normal, ou mesmo devido aos subprodutos da respiração e da biossíntese de estruturas mais complexas (HALLIWELL; GUTTERIDGE, 2010).
Portanto observa-se que os radicais livres estão envolvidos na produção de energia, fagocitose, regulação do crescimento celular, sinalização intercelular e síntese de biomoléculas importantes, mas seu excesso pode apresentar efeitos deletérios ao organismo (ALVES et al., 2010), tais como danos ao DNA, proteínas e organelas celulares como as mitocôndrias e sobre as membranas, provocando assim alterações na estrutura e função celular e, por isso, também encontram-se envolvidos em diversas patologias como câncer, envelhecimento precoce, doenças cardiovasculares, degenerativas e neurológicas, entre outras. Para manter a homeostase o organismo produz, ou obtém da dieta, biomoléculas capazes de regenerar ou prevenir os danos oxidativos, agindo como antioxidantes (ALVES et al., 2010).
Algumas espécies derivadas de radicais livres, em especial aquelas contendo O2,
molécula de oxigênio é um bi-radical (possui dois elétrons livres em orbitais antiligantes), e reage preferencialmente com moléculas de configuração eletrônica semelhante, mas como a maioria das biomoléculas não são bi-radicais, e possuem grande número de ligações covalentes, o oxigênio fica impedido (devido a restrição de “spin”) de reagir com as mesmas, evitando assim a lesão de alvos celulares importantes; contudo o oxigênio pode dar origem a diversas espécies reativas, seja por transferência de elétrons ou absorvendo energia radiante como ocorre na geração do oxigênio singlete, onde a restrição de “spin” pode desaparecer, conferindo-lhe um maior poder oxidante.(ROVER et al., 2001).
Um antioxidante pode ser definido como qualquer composto que em pequenas quantidades é capaz de retardar ou inibir processos oxidativos, pois retira ou doa elétron, neutralizando o radical livre, prevenindo assim, as células de danos com o excesso de espécies reativas. Devido aos diferentes tipos de ERO e as suas diferentes formas de atuação no organismo, dificilmente existirá um método simples e universal pelo qual a atividade antioxidante possa ser avaliada quantitativamente com exatidão. (ALVES et. al, 2010)
A utilização de compostos naturaisantioxidantes encontrados na dieta ou mesmo sintéticos é um dos mecanismos de defesa contra as ERO e são empregados nas indústrias de alimentos, de cosméticos e também na medicina, pois tais espécies estão envolvidas em processos fisiológicos como o envelhecimento (BIANCHI; ANTUNES, 1999). Os antioxidantes naturais são opções de grande interesse para minimizar ou retardar os processos de deterioração oxidativa em alimentos e para o desenvolvimento de alimentos funcionais. (VELLOSA, 2008). Alguns estudos relatam problemas que podem ser provocados pelo consumo de antioxidantes sintéticos como ação carcinogênica e reações de hipersensibilidade, o que tem estimulado várias pesquisas no estudo de produtos naturais com atividade antioxidante. (SOARES, 2002).
As ERO de existência independente, como o ânion radical superóxido (O2
.-),
radical hidroxila (HO•), radicais peroxila (ROO•)e alcoxila (RO•) ou mesmo espécies não radicalares como o H2O2 e o HOCl, tem sua formação em processos de
transferência de elétrons no metabolismo celular e/ou pela exposição a fatores externos como aos xenobióticos, (ROSS; MOLDEUS, 1991) e são formados no citoplasma, na mitocôndrias e membranas celulares (ROSS; MOLDEUS, 1991; BIANCHI; ANTUNES, 1999). Os danos induzidos pelas ERO podem afetar várias biomoléculas, incluindo os lipídeos, proteínas, carboidratos e o Ácido Desoxirribonucleico (DNA).
Os peróxidos afetam a atividade de diversas enzimas, alteram as LDL envolvidas no desenvolvimento de lesões arterioscleróticas, pois se postula que a oxidação das LDL seja uma das principais causas de doenças cardiovasculares como o infarto do miocárdio (HALLIWELL; GUTTERIDGE, 2010).
transforma numa partícula muito reativa e potencialmente letal para as artérias, e os antioxidantes possuem um papel fundamental de defesa, uma vez que aumentam a resistência das LDL frente à oxidação (SOARES et al.,2002).
Uma das ERO mais importantes do nosso organismo é o O2• - formado pela
redução monoeletrônica do oxigênio por processos enzimáticos e não- enzimáticos e ocorre em quase todas as células aeróbicas, sendo produzidos em altas quantidades durante a ativação máxima de neutrófilos, macrófagos e eosinófilos em processos inflamatórios; está envolvida também na alteração do tecido epitelial arterial observada ao longo dos anos no processo de envelhecimento (HALLIWELL; GUTTERIDGE, 1990; HALLIWEL; GUTTERIDGE, 2010).
O H2O2 derivado da dismutação do O2• -, espontânea ou catalisada pela superóxido
dismutase (SOD); é um metabólito reativo, e ainda participa das reações que originam o HO• que é um dos radicais mais reativos. O HO• possui elevado poder oxidante sendo
capaz de iniciar a oxidação de lipídeos com um efeito muito deletério, tem meia-vida muito curta e sua captura in vivo é muito difícil; quando produzido próximo ao DNA acarreta modificações das bases nitrogenadas levando à mutações.
Nos ensaios de laboratório o HO• pode facilmente ser capturado por ser muito
reativo. No entanto, para que os resultados se reproduzam in vivo, é necessário administrar altas doses de antioxidantes (FERREIRA; MATSUBRA, 1997; HALLIWELL; GUTTERIDGE, 2010).
O HOCl é formado na oxidação do cloreto pelo H2O2 em reação catalisada pela
HOCl e O2
•
ou pelas reações de Fenton e Harber-Weiss. (HALLIWELL;
GUTTERIDGE, 2010; VELLOSA, 2008). O HOCl também pode causar dano tecidual principalmente em áreas inflamadas.
Em algumas situações a quantidade de ERO pode aumentar devido a uma maior geração intracelular e/ou deficiência nos mecanismos antioxidantes naturais, gerando um desequilíbrio, com ocorrência do estresse oxidativo. Nesses casos há um aumento na mobilização de antioxidantes para reduzir os danos celulares causados pelas ERO. A remoção destas espécies reativas pode ocorrer por: (i) reações enzimáticas como a da SOD, presente em quase todas as células e considerada essencial para a defesa do organismo, pois remove o O2• - convertendo-o em H2O2; a catalase que converte H2O2
em água e oxigênio etc, e (ii) reações não enzimáticas como a da glutationa reduzida (GSH) que participa da remoção do HO• e do oxigênio singlete, espécies altamente
reativas para uma grande variedade de compostos biológicos, como os lipídeos de membrana. Tais considerações possibilitaram sistematizar a defesa antioxidante (BIANCHI; ANTUNES, 1999):
1 - O primeiro mecanismo de defesa contra os radicais livres ou ERO é impedir a sua formação, principalmente pela inibição das reações em cadeia como aquelas contendo a participação de ferro e o cobre;
2 - Interceptações das ERO formadas pelo metabolismo celular e/ou induzidas por fontes exógenas. As vitaminas E, C e A, glutationa, flavonóides e carotenóides, são extremamente importantes nesse processo;
3 - Remoções por enzimas antioxidantes como a superóxido dismutase (O2
•
-);
catalase (H2O2) e glutationa peroxidase (ROO
•
4- Reparos das lesões causadas pelos radicais, como a remoção de danos na molécula de DNA e a reconstituição das membranas celulares danificadas, etc. Nesse contexto a ação coadjuvante dos antioxidantes naturais exógenos é de extrema relevância, e vários compostos fenólicos como os flavonóides têm sido revelados como excelentes antioxidantes, que podem agir sinergicamente com biomoléculas endogénas antioxidantes, de extrema importância para homeostase das ERO (BIANCHI; ANTUNES, 1999).
Testes realizados avaliando o poder antioxidante dos principais componentes da
Curcuma longa L. revelaram que dentre os curcuminoídes analisados, a curcumina
possui maior atividade antioxidante quando comparada aos seus análogos naturais (SREEJAYAN; RAO, 1996; CAI et al., 2006; EPSTEIN; SANDERSON; MACDONALD, 2009).
Estudos realizados in vitro, demonstraram que a curcumina possui uma boa atividade seqüestradora de ERO, para o NO2 e HO
•
(TUBA; GÜLÇIN, 2008), para o
2,2’-difenil-1-picrilhidrazil (DPPH•), e na proteção das hemácias na hemólise oxidativa (SHANG et al., 2010). Suas atividades antioxidantes incluem ainda o efeito na inibição da peroxidação lipídica, e a proteção das macromoléculas celulares, na formação de superóxidos em macrófagos e na proteção da hemoglobina na oxidação induzida por nitrito (KUNCHANDY; RAO, 1990; OKADA et al., 2001; SOMPARN et al., 2007; VOLP; RENHE; STRINGUETA, 2009), entre outras.
Sua capacidade antioxidante tem sido explicada pela presença do hidrogênio fenólico ou devido ao hidrogênio metilênico central encontrada na fração heptadieno, presente na molécula de curcumina (CORT, 1974; WEI et al., 2006), figura 1.
Figura 1: Estrutura da curcumina (SRINIVASAN, 2006).
Antioxidantes fenólicos seqüestradores de ERO também podem funcionar como quelantes de metais (SHAHIDI; WANASUNDARA, 1992), agindo tanto na etapa de iniciação como na propagação do processo oxidativo. A atividade antioxidante de compostos fenólicos deve-se principalmente às suas propriedades redutoras. Estas características desempenham um papel importante na neutralização ou captura de radicais livres. Os produtos intermediários são relativamente estáveis devido à ressonância do anel aromático apresentada por estes compostos. (ATOUI et al., 2005; SOARES, 2002)
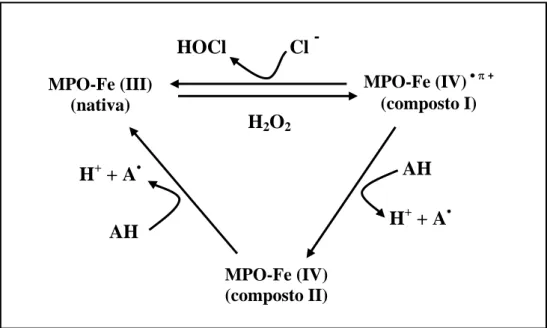
1.1 Mieloperoxidase (MPO)
A MPO desempenha uma função importante no sistema de defesa celular do organismo contra patógenos invasores, pois participa com eficiência da ação microbicida dos neutrófilos, produzindo HOCl através da utilização de íons cloreto e do H2O2 (KLEBANOFF, 2005), contudo também cresce as evidências de sua participação
em patologias em que está envolvido o sistema inflamatório, com dano tissular do hospedeiro (PODREZ; ABU-SOU; HAZEM, 2000; MALLE; BUCH; GRONE, 2003; YAP; WHITEMAN; CHEUNG, 2007; DAVIES et al., 2008).
A MPO é uma heme-proteína que catalisa a reação entre concentrações fisiológicas de Cl- e o H2O2, no surto oxidativo dos leucócitos polimorfonucleares
(LPMN) em especial neutrófilos (BABIOR, 1987). No seu sítio ativo possui um átomo de ferro no estado férrico (Fe+3) localizado no interior de uma fenda, adequada para a passagem do H2O2 e pequenos íons (SANTOS, 2010). A MPO é uma proteína catiônica
em pH fisiológico e, portanto, é capaz de se ligar a estruturas biológicas aniônicas, tais como os fosfolipídeos de membranas celulares. Seu mecanismo da ação envolve a sua interação na forma férrica (MPO nativa) com H2O2 para formar um intermediário redox
Figura 2: Mecanismo de ação da mieloperoxidase. Via clorinante, com formação de HOCl (MPO nativa MPO composto I MPO nativa), ciclo peroxidásico clássico (MPO nativa MPO composto I MPO composto II MPO nativa)( ABU-SOUD; HAZEN, 2000 modificado).
Assim o HOCl é formado pela oxidação de íons cloreto com H2O2 em reação
catalisada pela MPO (LAPENNA; CUCCURULLO, 1996):
O HOCl apresenta ações adversas, de proteção e agressão, aos tecidos dos mamíferos, pois suas células e também as células bacterianas não podem detoxicar o HOCl por via catalítica, como procedem com o ânion radical superóxido e o H2O2,
devido à presença das enzimas SOD e catalase, respectivamente. Uma vez que defesas enzimáticas diretas contra compostos clorinantes estão ausentes (LAPENNA; CUCCURULLO, 1996); a falta de um sistema capaz de remover HOCl pode ser
ou
MPO-Fe (III) (nativa)
MPO-Fe (IV) • + (composto I)
MPO-Fe (IV) (composto II)
AH
H++ A• H+ + A•
AH
HOCl Cl -
considerado um fator deletério; se todo HOCl não atacar somente as bactérias; poderá interagir com constituintes do nosso organismo gerando danos (EATON,1991).
2. Objetivos
Para substanciar o conhecimento da ação antioxidante da curcumina, o objetivo do presente trabalho foi determinar comparativamente a capacidade antioxidante entre a curcumina e outros compostos com reconhecida ação antioxidante (padrões) como: quercertina, glutationa reduzida, urato de sódio, ácido ascórbico, trolox, rutina e crocina em sistemas-modelo “in vitro”; investigou-se assim a capacidade de captura sobre o ABTS• +; DPPH•; O2• -; H2O2 e HOCl/OCl-; bem como o seu efeito na geração de HOCl,
no sistema MPO/H2O2/Cl- , e na oxidação do guaiacol no sistema MPO/ H2O2/ guaiacol.
3.
Material e Métodos
3.1 Amostras e cálculo de inibição
Foi utilizado curcumina extraída da Curcuma longa L. (Fluka Sigma-Aldrich®) em diferentes concentrações até que houvesse uma inibição de 50% (IC50), e os
monitoramento dos ensaios cinéticos foi realizado no espectrofotômetro UV vis Ocean Optics USB 4000,com agitação magnética e temperatura constante (sistema peltier).
As amostras (curcumina e padrões) foram dissolvidas nos respectivos tampões dos ensaios quando solúveis, ou utilizando solventes orgânicos:para quercetina e rutina pouco solúveis em tampão foi utilizado etanol, para curcumina e crocina foi utilizado dimetilsulfóxido(DMSO), exceto no teste do HOCl que a curcumina foi dissolvida em dimetilformamida e a crocina dissolvida em metanol.
O cálculo para a porcentagem de inibição (IC50) foi baseado na seguinte
equação, exceto quando especificado:
% Inibição = (1- Aa/ At) x 100 ( Equação 1)
Onde: Aa é a absorbância do radical ou cromóforo na presença de amostra, e. At é a absorbância do radical ou cromóforo na ausência de amostra
Desta forma, considerando que obtêm-se a porcentagem de inibição via equação de uma reta (equação 1), os resultados nesse trabalho estão apresentados conforme esta relação.
3.2 Sistemas não enzimáticos
3.2.1 Capacidade de captura sobre o ABTS+•
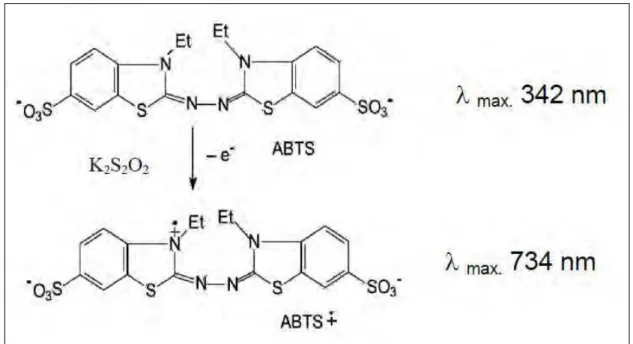
A oxidação do ABTS (2,2´-Azinobis (3-etilbenzotiazolina 6-sulfonada - (C18H24N6O6S4, SIGMA) pelo persulfato de potássio (K2S2O8), forma o cátion radical
ABTS+• (figura 3). O ABTS+• foi preparado a partir da reação do ABTS, 7 mmol/L com K2S2O8 140 mmol/L , em tampão fosfato de sódio pH 7,4, mantida em repouso de 12 a
fosfato de sódio pH 7,4, cuja absorbância à 734 nm foi de aproximadamente de 0,7. O ABTS• + é um radical de coloração azul/verde que possui bandas de absorção a 645 nm, 734 nm e 815 nm ( RE et al.1999).
Figura 3: Representação da formação do Cátion Radical ABTS+• (RE et al. ,1999 )
O ensaio foi realizado segundo Pellegrini et al. (1999), monitorando-se o decréscimo da absorbância em 734 nm, após 15 minutos de incubação no escuro do ABTS+• à temperatura ambiente, na ausência e na presença de curcumina ou dos
padrões, em diferentes concentrações.
3.2.2 Capacidade de captura sobre o DPPH•
ensaios foram realizados segundo Soares et. al. (1997), monitorando-se o decréscimo da absorbância em 517 nm do DPPH•, após 20 minutos de incubação no escuro, a 25°C, na presença e na ausência de curcumina ou dos padrões, em diferentes concentrações.
Figura 4: Estrutura molecular do DPPH• (ALVES et al., 2010)
3.2.3 Capacidade de captura sobre o HOCl
A concentração de HOCl foi determinada espectrofotometricamente a partir do seu coeficiente de extição molar (Ɛ= 350 M-1cm-1 em 292 nm), e dissolvido em NaOH 10 mmol/L (ZGLICZYNSKI et al., 1971).
Figura 5: Estrutura molecular da 3, 3’, 5 , 5’- tetrametilbenzidina (TMB) (VELLOSA.; BARBOSA; OLIVEIRA, 2007 modificado)
As reações entre o HOCl / OCl- e os compostos foram efetuadas em tampão fosfato de potássio 50 mmol/L, pH 7,4 a 25˚C, com volume final da reação de 300 µL. Após a incubação de 5 minutos no escuro foi adicionado o TMB 1,4mmol/L em dimetilformamida 50%, acido acético 0,8 mol/L e iodeto de potássio 0,01 mol/L e a leitura monitorada a 655 nm (KETTLE; WINTERBOURN, 1994). Neste ensaio a curcumina foi dissolvida em dimetilformamida e a crocina em metanol.
3.2.4 Capacidade de captura sobre o H2O2
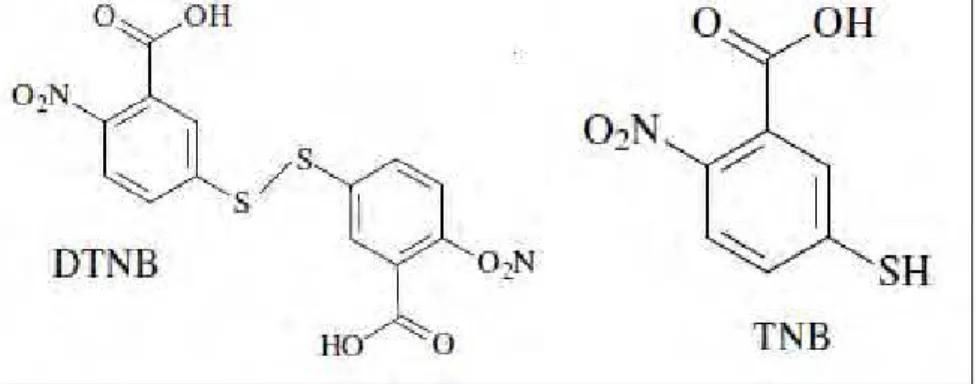
O H2O2 oxida o ácido 5-tio-2- nitrobenzóico (TNB) a ácido
5-5’-ditio-2-nitrobenzóico (DTNB), com diminuição da absorbância a 412 nm e aumento a 325 nm (figura 6).
A capacidade de captura sobre o H2O2 foi determinada segundo Ching; Jong;
Bast (1994) pelo ensaio com o TNB. A reação foi realizada em tampão fosfato de sódio 50 mmol/L, pH 7,4 com diferentes concentrações da curcumina e dos padrões, H2O2
concentração do TNB e do H2O2 foram obtidas através dos seus respectivos coeficientes
de absorção molar (Ɛ=13600 M-1cm-1) em 412 nm (CHING; JONG; BAST, 1994) e do H2O2 (Ɛ= 80 M-1cm-1; em 230 nm) (BRESTEL, 1985).
Figura 6: Estruturas moleculares do DTNB e do TNB. (VASCONCELOS et al, 2007 modificado)
A porcentagem de inibição da oxidação do TNB (% de captura do H2O2) é calculada
da seguinte forma:
Onde: Abs Máx. é a absorbância do TNB na ausência do agente oxidante (H2O2) e da amostra.
Abs Amostra é a absorbância do TNB na presença do agente oxidante e da amostra.
3.2.5 Capacidade de captura sobre o O2
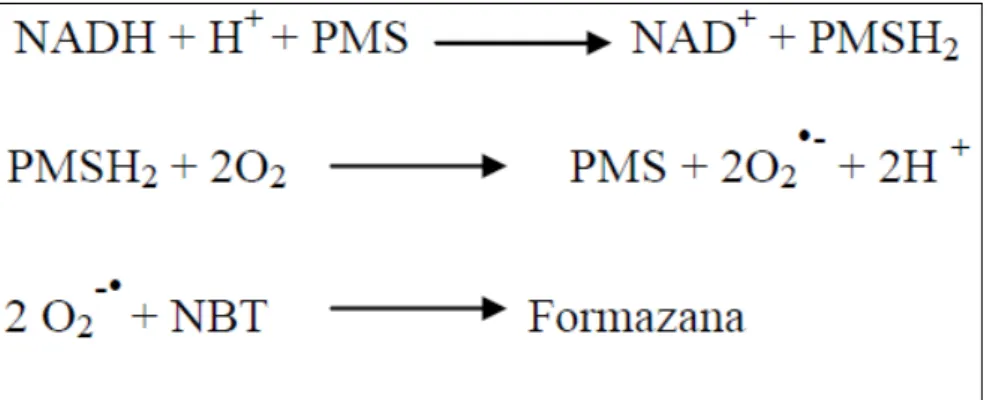
•
-O ensaio foi realizado em solução tampão de pirofosfato de sódio (25 mmol/L, pH 8,3), segundo Kakkar; Das; Viswanathan (1984). Neste sistema o ânion radical superóxido foi gerado pela reação entre metassulfato de fenazina e NADH. O ânion superóxido reage com o azul de nitrotetrazolium (NBT) para formar uma formazana colorida. A intensidade de cor da mistura da reação foi monitorada a 560nm, na ausência e na presença de diferentes concentrações de curcumina e dos padrões.
A mistura reacional continha metasulfato de fenazina (372 mol/L), NBT (600 mol/L), NADH (1560 mol/L) e diferentes concentrações da curcumina e dos padrões. As reações foram iniciadas pela adição de NADH, com incubação no escuro por 90 segundos a 25oC; a reação foi finalizada pela adição de 100 µL de ácido acético glacial, totalizando um volume final de 900 µL e incubação de mais 5 minutos; após agitação a intensidade de cor da formazana foi monitorada com a mudança da coloração amarelo pálido do NBT para uma coloração púrpura da formazana, as moléculas que atuam como antioxidantes interagem com o O2
Esquema das reações:
Esquema 1: Formação da Formazana
Figura 7: Representação da geração do ânion superóxido em presença de um antioxidante. (OLIVEIRA; VALENTIM; GOULART, 2009).
3.3 Sistemas enzimáticos
3.3.1 Obtenção da MPO do exsudado peritoneal de ratos
A obtenção da MPO foi através da injeção intraperitoneal de 5 mL de solução de glicogênio de ostra a 1% em NaCl a 0,85%, em ratos machos da linhagem Wistar, que estimulou uma inflamação local; após doze horas o animal foi sacrificado e a cavidade abdominal foi lavada, injetando-se 10 mL de tampão fosfato Dulbeco (PBS-D) e colhendo-se o lavado peritoneal através de sucção com seringa (heparinizada 10 UI) e agulha, o qual transferido para um tubo cônico siliconizado e centrifugado a 200 x g, por 3 minutos (1500 rpm). As células sedimentadas foram lavadas duas vezes com PBS-D e ressuspensas em 500 L do mesmo tampão. Esta suspensão é incubada a -20ºC por aproximadamente 12 horas onde ocorre o rompimento das células. Após a ruptura das células, esse extrato é centrifugado (2 minutos/200 x g) e o sobrenadante separado, sendo denominado extrato bruto de neutrófilos (EBN) com alta atividade de MPO. (SILVA, 2000; KHALIL, 2002).
3.3.2 Dosagem de Proteínas no extrato de Neutrófilos.
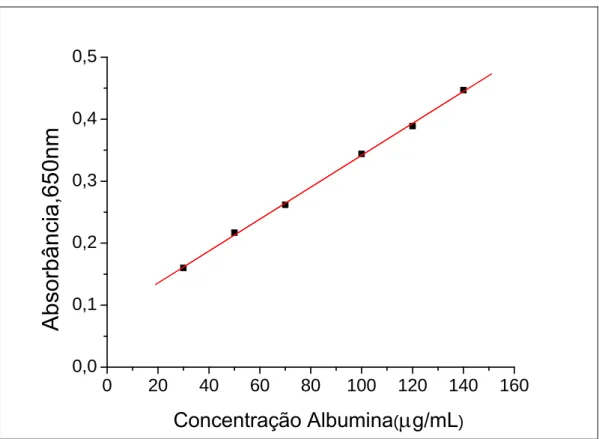
Foi utilizado o método de Lowry modificado do Hartree (HARTREE, 1972), para determinação das proteínas do EBN. Utilizou-se como padrão a Albumina Sérica Bovina (BSA). Foram preparadas três soluções de reagentes:
Solução A - 2g de Tartarato de sódio e potássio, 100g de Na2CO2, dissolvidos
em 500mL de NaOH 1 mol/L e diluídos com água (Milli-Q) para um litro.
Solução B- 2g de Tartarato de sódio e potássio, 1g de CuSO4 . 5H2O,
Solução C- 1 volume do reagente Folin-Ciocalteu diluído em 15 volumes de água (Milli-Q). Esta solução (preparada diariamente) e deve estar entre 0,15 mol/L e 0,18 mol/L quando titulada para pH 10 com NaOH 1 mol/L.
O princípio do método baseia-se numa mistura contendo molibdato, tungstato e ácido fosfórico, (reagente Folin-Ciocalteau), que se reduz quando reage com proteínas, na presença do catalisador cobre (II), e produz um composto de coloração azul, com absorção na região de 650 nm (ZAIA; ZAIA; LICHTING, 1998).
0 20 40 60 80 100 120 140 160 0,0
0,1 0,2 0,3 0,4 0,5
A
b
s
o
r
b
â
n
c
i
a
,
6
5
0
n
m
C o n c e n t r a ç ã o A l b u m i n a
(
g / m L
)
Figura 8: Diagrama de calibração para determinação de proteínas pelo método de Hartree- Lowry em tampão PBS- Dulbeco, 650nm, utilizando a albumina sérica bovina como padrão.
3.3.3 Determinação da atividade da MPO no EBN
O meio reacional continha guaiacol 0,013 mol/L, H2O2 0,00033 mol/L em
tampão fosfato de sódio 0,01 mol/L pH 7,0, extrato com MPO (5 µL), volume final da reação de 2000 µL, a 37ºC e sob agitação. A reação foi iniciada com adição do H2O2 e
0 10 20 30 40 50 60 70 0,00 0,01 0,02 0,03 0,04 0,05 0,06 0,07
Eq da reta: Y=A+Bx
A= 0,01914 B= 7,85811. 10-4 R= 0,995
A
b
s
o
r
b
â
n
c
i
a
4
7
0
n
m
T e m p o s e g u n d o s
0 10 20 30 40 50 60 70
0,00 0,01 0,02 0,03 0,04 0,05 0,06 0,07
Equaçمo da reta:Y= A+Bx
A= 0,01615 B= 7,10966.10-4 R= 0,986 A b s o r b â n c i a 4 7 0 n m
T e m p o s e g u n d o s
Figura 9: Cinética da MPO monitorada durante 60 segundos a 470 nm.
multiplicado por 60 segundos. O valor em unidades correspondente ao volume de extrato adicionado de 5 µL e foi corrigido para 1 mL, conforme as relações abaixo apresentadas:
Portanto de acordo com esses cálculos a atividade da MPO no EBN utilizada nos ensaios foi de 1,268U/mg de proteínas.
3.3.4 Ensaio da via peroxidativa MPO/ H2O2/Guaiacol ( Via Peroxidativa)
A ação peroxidativa da MPO foi realizada utilizando-se 40 µL (1,268U/mg de proteínas), o que equivale a 0,359 U de MPO com os substratos, guaiacol 60 mmol/L e H2O2 0,05 mmol/L. Estes ensaios foram realizados em tampão fosfato de sódio 50
3.3.5 Ensaio da produção de HOCl pelo sistema MPO / H2O2 / Cl- (via clorinante), pelo ensaio da taurina-cloroamina e tetrametilbenzidina (TMB)
Neste ensaio o HOCl/OCl- foi produzido pelo sistema MPO/H2O2/Cl-, e tem a
capacidade de clorinar o aminoácido taurina, quando presente, formando a taurina-cloroamina que também oxida o TMB, formando um cromóforo com absorção máxima em 650 nm, proporcional ao HOCl formado. Os oxidantes conhecidos como cloraminas, são formados através da reação do HOCl/OCl- com aminas primárias ou secundárias, prontamente disponíveis em sistemas biológicos (THOMAS; GRISHAM; JEFFERSON, 1986; WEISS, 1989).
O ensaio foi realizado em tampão fosfato de sódio 20 mmol/L com 100 mmol/L de NaCl em pH 6,5, na ausência e na presença de taurina 5 mmol/L, e iniciada com H2O2 0,1mmol/L; após 1 minutos de incubação a 37ºC a reação foi encerrada com
3.4 Análises Estatísticas
Os dados foram analisados por análise de variância (ANOVA) seguida pelo Student-Newman-Keuls, utilizando o software Sigma Stat 2.03, considerando um nível de significância estatística, limite de 5% (p< 0,05).
4. Resultados
e
Discussão
4.1 Capacidade de captura sobre o ABTS• +
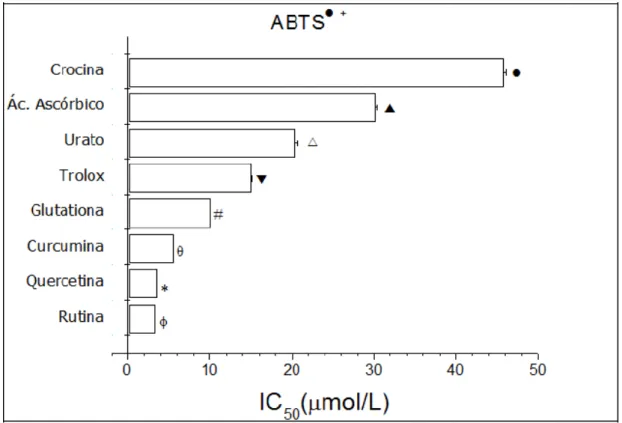
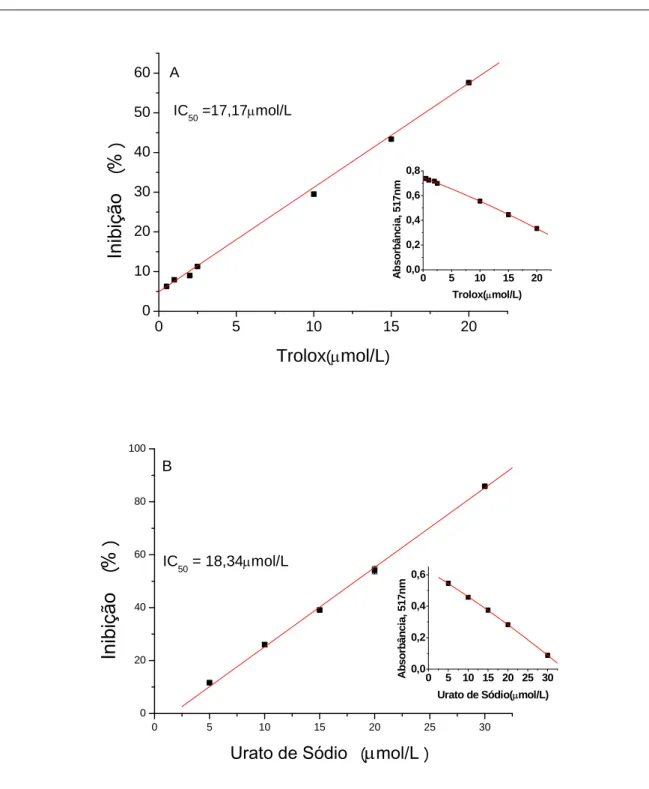
O radical ABTS é muito utilizado em ensaios in vitro para avaliar o potencial antioxidante, pois determinados compostos reduzem o ABTS• +, diminuindo sua absorbância a 734 nm (PELLEGRINI et al., 1999). Nestes estudos da interação entre amostras e radicais livres, é comum utilizar radicais-modelos, não biológicos, para se avaliar o potencial desta interação, e destaca-se dentre esses o ABTS• + (PRABHU et al., 2011; RE et al., 1999). Nas figuras de 10 a 13 pode-se observar que a curcumina e os analitos atingiram o IC50 para o ABTS•+, cujos valores apresentaram- se
aproximadamente de 3 a 50 µmol/L.
A figura 14 apresenta os valores em IC50 da curcumina e dos analitos para a
captura do ABTS+•, onde observa-se a seguinte ordem crescente do IC50 (µmol/L):
0 1 2 3 4 5 6 0 20 40 60 80
1 2 3 4 5 7 9 0,0 0,2 0,4 0,6 0,8 Absor b ância, 7 3 4 n m
Rutina (mol/L)
A
IC
50= 3,12 mol/L
I n i b i ç ã o %
Rutina(mol/L)
0 1 2 3 4 5 6
0 20 40 60 80
1 2 3 4 5 7
0,0 0,2 0,4 0,6 0,8 A b sorbân c ia , 73 4nm
Quercetina(mol/L)
I n i b i ç ã o %
Quercetina
(
mol/L)
IC50= 3,27mol/L
B
Figura 10: Inibição (captura) (IC50 µmol/L) do ABTS• + para: A, rutina; B, quercetina; em tampão fosfato de
0 1 2 3 4 5 6 7 0 20 40 60 80
1 2 3 4 5 7 9 1215 0,0 0,2 0,4 0,6 0,8 A b s o rb ân cia, 7 3 4n m
Curcumina(mol/L)
IC50= 4,93mol/L
A I n i b i ç ã o %
C u r c u m i n a
(
m o l / L)
0 2 4 6 8 10 12 14
0 10 20 30 40 50 60
1 2 3 4 5 7 9 12 15 20 30
0,0 0,2 0,4 0,6 0,8 A b so rb ân ci a, 734n m
Glutationa(mol/L)
IC50= 10,16mol/L
B I n i b i ç ã o %
G l u t a t i o n a
(
m o l / L
Figura 11: Inibição (captura) (IC50 µmol/L) do ABTS• + para: A, curcumina; B, glutationa; em
0 2 4 6 8 10 12 14 16 18 20 22 0 10 20 30 40 50 60 70
0 5 10 15 20
0,0 0,2 0,4 0,6 A b sor b ânci a, 734nm
Trolox (mol/L)
A
IC50 = 14,82mol/L
I n i b i ç ã o %
T r o l o x
(
m o l / L
)
0 10 20 30 40
0 20 40 60 80 100 120
5 10 15 20 30 40
0,0 0,2 0,4 0,6 0,8 Ab so rb ân ci a, 73 4 n m
Urato de Sódio(mol/L)
B
IC 50= 21,17mol/L
I n i b i ç ã o %
U r a t o d e s ó d i o
m o l / L
Figura 12: Inibição (captura) (IC50 µmol/L) do ABTS• + para: A, trolox; B, urato de sódio; em tampão
0 10 20 30 40 0 20 40 60 80
0 10 20 30 40
0,0 0,2 0,4 0,6 0,8 Abs o rbâ nci a, 73 4 nm
Ác. Ascórbico(mol/L)
A
IC50 = 30,73 mol/L
I
n
i
b
i
ç
ã
o
%
Á c . A s c ó r b i c o
m o l / L
0 20 40 60 80 100
0 20 40 60 80 100
0 20 40 60 80 100
0,0 0,2 0,4 0,6 A b sor b ânci a, 734 n m
Crocina(mol/L)
B
IC50 = 48,30 mol/L
I
n
i
b
i
ç
ã
o
%
Crocina(mol/L)
Figura 13: Inibição (captura) (IC50 µmol/L) do ABTS• + para: A, ácido ascórbico; B, crocina; em tampão
Figura 14: Inibição (Captura) do radical ABTS• + (IC50 µmol/L), pela curcumina e padrões, em tampão
fosfato de sódio 10 mmol/L pH 7,4; = 734nm. Diferenças estatísticas significativas:rutina vs. crocina; ácido ascórbico; urato; trolox; glutationa e curcumina.(p< 0,05); *quercetina vs.crocina; ácido ascórbico; urato; trolox; glutationa e curcumina (p<0,05); curcumina vs.crocina; ácido ascórbico; urato; trolox e glutationa (p<0,05); glutationa vs. crocina; ácido ascórbico; urato; trolox. (p<0,05); trolox vs. crocina; ácido ascórbico; ácido úrico. (p<0,05); urato vs. ácido ascórbico e crocina. (p<0,05) e
ácido ascórbico vs. crocina. (p<0,05)
valor de 4,93µmol/L, muito próximo do encontrado por Feng; Liu (2009) que foi de aproximadamente 6,00 µmol/L.
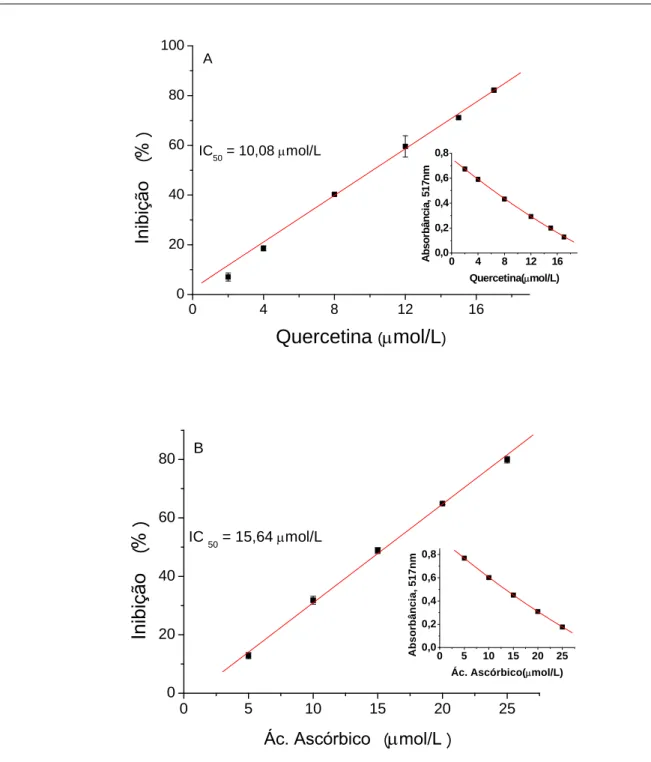
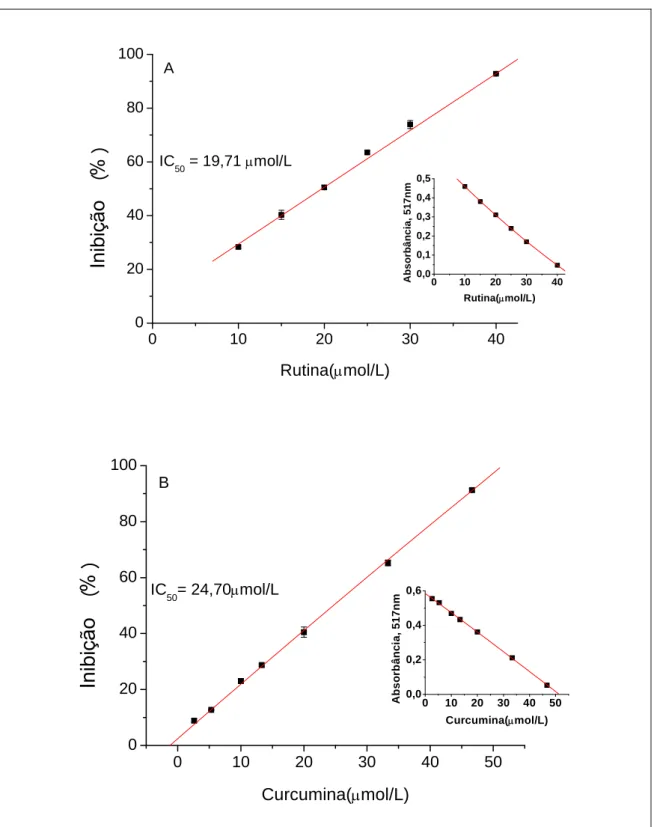
4.2 Capacidade de captura sobre o DPPH•
Nas figuras de 15 a 18 pode-se observar que a curcumina e os analitos atingiram o IC50 para o DPPH
•
, cujos valores apresentaram- se entre 10 a 350 µmol/L.
A figura 19 apresenta os valores dos IC50 da curcumina e padrões para a captura
do DPPH•, onde se observa a seguinte ordem crescente do IC50 (µmol/L): quercetina<
ácido ascórbico< trolox< urato< rutina< curcumina< glutationa< crocina, o que representa uma ordem decrescente na eficiência da captura do radical DPPH•
.
Alguns estudos mostram que o orto-metoxi fenol na estrutura na curcumina é fundamental para a atividade antioxidante, mas que a hidrogenação na porção heptadiona também aumenta a atividade antioxidante (SOMPARN, 2007). A curcumina não foi tão eficiente quanto a quercetina e o ácido ascórbico neste ensaio, os analitos quercetina, ácido ascórbico, trolox, urato, rutina e curcumina todos com IC50 entre 10 a
25µmol/L, bem diferentes da glutationa e crocina com IC50> 90 µmol/L. Brand;
Cuvelier; Berset (1995), concluíram que a interação de um antioxidante com o DPPH• depende, sobretudo, de sua conformação estrutural e do número de grupos hidroxílicos disponíveis.
Com a curcumina obteve-se o IC50 de 24,70 µmol/L, valor muito próximo a
do anel fenólico aumenta ainda mais a sua atividade, pois o análogo da curcumina sem o grupamento metóxi obteve uma atividade menor (ou seja, com IC50 maior, de 32,08
µmol/L) e a tetrahidrocurcumina que possui dois grupamentos metóxi mostra o menor IC50 (18,22 µmol/L), sendo assim a mais eficiente. Outros trabalhos também mostram
que sua atividade é favorecida pelas hidroxilas da molécula (FENG; LIU, 2009), esses autores também encontraram um valor de 24,2 µmol/L para o IC50 da curcumina,
0 4 8 12 16 0 20 40 60 80 100
0 4 8 12 16 0,0 0,2 0,4 0,6 0,8 A b sor b â n c ia, 51 7 n m
Quercetina(mol/L)
A
IC
50 = 10,08 mol/L
I n i b i ç ã o %
Quercetina (mol/L)
0 5 10 15 20 25
0 20 40 60 80
0 5 10 15 20 25 0,0 0,2 0,4 0,6 0,8 Abso rb ânc ia, 517n m
Ác. Ascórbico(mol/L)
B
IC
50 = 15,64 mol/L
I n i b i ç ã o %
Á c . A s c ó r b i c o
m o l / L
0 5 10 15 20 0 10 20 30 40 50 60
0 5 10 15 20 0,0 0,2 0,4 0,6 0,8 A b s o rb â n c ia, 51 7nm
Trolox(mol/L)
A
IC50 =17,17mol/L
I n i b i ç ã o %
Trolox(mol/L)
0 5 10 15 20 25 30
0 20 40 60 80 100
0 5 10 15 20 25 30 0,0 0,2 0,4 0,6 A b sor b ânci a, 517nm
Urato de Sódio(mol/L)
B
IC50 = 18,34mol/L
I n i b i ç ã o %
U r a t o d e S ó d i o
m o l / L
Figura 16: Inibição (captura) (IC50 µmol/L) do DPPH• em etanol pelo: A,trolox; B, urato de sódio. =
517nm. A figura inserida apresenta a média das absorbâncias (duplicata) do DPPH• na presença de diferentes concentrações das amostras.
0 10 20 30 40 0 20 40 60 80 100
0 10 20 30 40 0,0 0,1 0,2 0,3 0,4 0,5 Ab so rb â n ci a, 51 7nm
Rutina(mol/L)
A
IC50 = 19,71 mol/L
I n i b i ç ã o %
Rutina(mol/L)
0 10 20 30 40 50
0 20 40 60 80 100
0 10 20 30 40 50 0,0 0,2 0,4 0,6 Abs o rb ânc ia, 517n m
Curcumina(mol/L)
B
IC50= 24,70mol/L
I
n
i
b
i
ç
ã
o
%
Curcumina(mol/L)
Figura 17: Inibição (captura) (IC50 µmol/L) do DPPH• em etanol pela: A ,rutina; B, curcumina. =
0 30 60 90 120 150 0 20 40 60 80
0 30 60 90 120 150 0,0 0,1 0,2 0,3 0,4 0,5 0,6 A bsor bâ nc ia, 517nm
Glutationa(mol/L)
A
IC
50 = 91,04 mol/L
Inibição (
%)
Glutationa (mol/L)
0 100 200 300 400 0 10 20 30 40 50 60
100 200 300 400 0,1 0,2 0,3 0,4 0,5 0,6 A b so rbân c ia , 5 1 7n m
Crocina(mol/L)
B
IC50 = 350,70 mol/L
I n i b i ç ã o %
Crocina(mol/L)
Figura 18: Inibição (captura) (IC50 µmol/L) do DPPH• em etanol pela: A, glutationa; B, crocina. =
Figura 19: Inibição (captura) do DPPH• (IC50), pela curcumina e padrões, em etanol. = 517nm.
Diferenças estatísticas significativas: *quercetina vs.crocina; glutationa; curcumina; rutina; urato, trolox e ácido ascórbico (p< 0,05);ácido ascórbico vs.crocina; glutationa; curcumina; rutina; urato e trolox (p< 0,05); trolox vs. crocina; glutationa, curcumina, rutina e urato (p<0,05); urato vs. crocina; glutationa; curcumina e rutina (p<0,05); rutina vs. crocina; glutationa; curcumina (p<0,05);
curcumina vs. crocina e glutationa (p<0,05) eglutationa vs. crocina (p<0,05).
4.3 Capacidade de captura sobre o O2
• -
O O2- formado após a redução monoeletrônica do oxigênio ocorre em quase
antioxidante local, favorecem o stress oxidativo (HALLIWELL; GUTTERIDGE, 2010; CADENAS; DAVIES, 2000).
Nas figuras de 20 a 23 observa-se que a curcumina e os demais padrões atingiram o IC50 para o O2
•
-, exceto o urato. Observa-se ainda que os valores de IC50
praticamente ficaram divididos em três grupos na captura do O2
•
-, os mais eficientes representados pelos flavonóides quercetina e rutina com IC50 até 33 µmol/L, a
curcumina intermediária com IC50 de 99,66 µmol/L e os menos eficientes com IC50>
390µmol/L, com uma diferença entre o intermediários e os menos eficientes de aproximadamente 4 vezes. A figura 24 apresenta os valores do IC50 (µmol/L) da
curcumina e dos padrões para a captura do O2
•
-, em ordem crescente: quercetina< rutina< curcumina< crocina< ácido ascórbico< glutationa< trolox e o que representa uma ordem decrescente na eficiência da captura do radical O2
•
-.
O urato até asconcentrações testadas não atingiu o IC50.
Reddy e Lokesh (1992) observaram que a curcumina é capaz de seqüestrar radicias livres de oxigênio. Esta propriedade avaliada como um sequestrador potente do O2
•
0 10 20 30 40 50 0 20 40 60 80
0 10 20 30 40 50 0,0 0,1 0,2 0,3 0,4 0,5 0,6 A bso rb ânc ia , 5 6 0nm
Quercetina(mol/L)
A
IC50 = 31,97 mol/L
I n i b i ç ã o %
Quercetina(mol/L)
0 10 20 30 40 50 60
0 10 20 30 40 50 60 70
0 10 20 30 40 50 60
0,0 0,1 0,2 0,3 0,4 Ab sorb ân c ia, 56 0 n m
Rutina(mol/L)
B
IC 50= 32,47 mol/L
I n i b i ç ã o %
Rutina(mol/L)
Figura 20: Inibição (captura) (IC50 µmol/L) do O2• - pela: A, quercetina; B, rutina; em tampão pirofosfato
de sódio 25 mmol/L pH 8,3. = 560nm. A figura inserida apresenta a média da absorbância do O2• - em
0 20 40 60 80 100
0 10 20 30 40 50 60
0 20 40 60 80 100 0,0 0,1 0,2 0,3 0,4 0,5 0,6 A b so rb ân ci a , 5 6 0nm
Curcumina(mol/L)
A
IC50 = 99,66 mol/L
I
n
i
b
i
ç
ã
o
%
Curcumina (mol/L)
0 50 100 150 200 250 300 350 400 450 0 10 20 30 40 50 60
0 100 200 300 400 0,0 0,1 0,2 0,3 0,4 A b sor b ânc ia , 560 nm
Crocina(mol/L)
B
IC50 = 401,49 mol/L
I n i b i ç ã o %
Crocina (mol/L)
Figura 21: Inibição (captura) (IC 50 µmol/L) do O2• - pela: A,curcumina; B, crocina; em tampão pirofosfato
de sódio 25 mmol/L pH 8,3. = 560nm. A figura inserida apresenta a média da absorbância do O2• - em
0 200 400 600 800 1000
0 20 40 60 80
0 200 400 600 800 1000 0,0 0,1 0,2 0,3 0,4 0,5 A bso rb ân ci a , 56 0nm
Ác. Ascórbico(mol/L)
A
IC 50 = 694,66 mol/L
I n i b i ç ã o %
Á c . A s c ó r b i c o
m o l / L
0 200 400 600 800 1000 1200
0 10 20 30 40 50 60
0 300 600 900 1200 0,0 0,1 0,2 0,3 0,4 0,5 A bs or bânci a, 560 nm
Glutationa(mol/L)
B
IC
50= 999,40 mol/L
I n i b i ç ã o %
Glutationa (mol/L)
Figura 22: Inibição (captura) (IC50 µmol/L) do O2• - pelo: A,ácido ascórbico; B, glutationa; em tampão
pirofosfato de sódio 25 mmol/L pH 8,3. = 560nm. A figura inserida apresenta a média da absorbância do O2• - em diferentes concentrações das amostras.
0 400 800 1200 1600 2000 2400 2800 0 10 20 30 40 50 60
500 1000 1500 2000 2500 3000 3500
0,10 0,15 0,20 0,25 0,30 0,35 0,40 0,45 0,50 0,55 A b s o rb â n c ia, 56 0n m
Trolox(mol/L)
IC
50= 2219,15 mol/L
I
n
i
b
i
ç
ã
o
%
Trolox (mol/L)
Figura 23: Inibição (captura) (IC50 µmol/L) do O2• - pelo Trolox em tampão pirofosfato de sódio 25
mmol/L pH 8,3. = 560nm. A figura inserida apresenta a média da absorbância do O2• - em diferentes
concentrações das amostras.
Figura 24: Captura do radical O2
•
(IC50), pela curcumina e padrões, em solução de pirofosfato
de sódio 25 mmol/L, pH 8,3. = 560nm. Diferenças estatísticas significativas: quercetina vs. trolox; glutationa; ácido ascórbico; crocina e curcumina.(p< 0,05) *rutina vs. trolox; glutationa; ácido ascórbico; crocina e curcumina (p<0,05); curcumina vs. trolox; glutationa; ácido ascórbico e crocina. (p<0,05);
crocina vs. trolox; glutationa e ácido ascórbico (p< 0,05); ácido ascórbico vs. trolox e glutationa (p<0,05); # glutationa vs. trolox (p< 0,05).
4.4 Capacidade de Captura sobre o HOCl/ OCl-
Nas figuras de 25 a 28 observa-se que a curcumina e os padrões atingiram o IC50
para o HOCl/OCl- ,cujos valores apresentaram- se entre 1,15 a 22 µmol/L.
A figura 29 apresenta os valores do IC50 (µmol/L) da curcumina e dos padrões
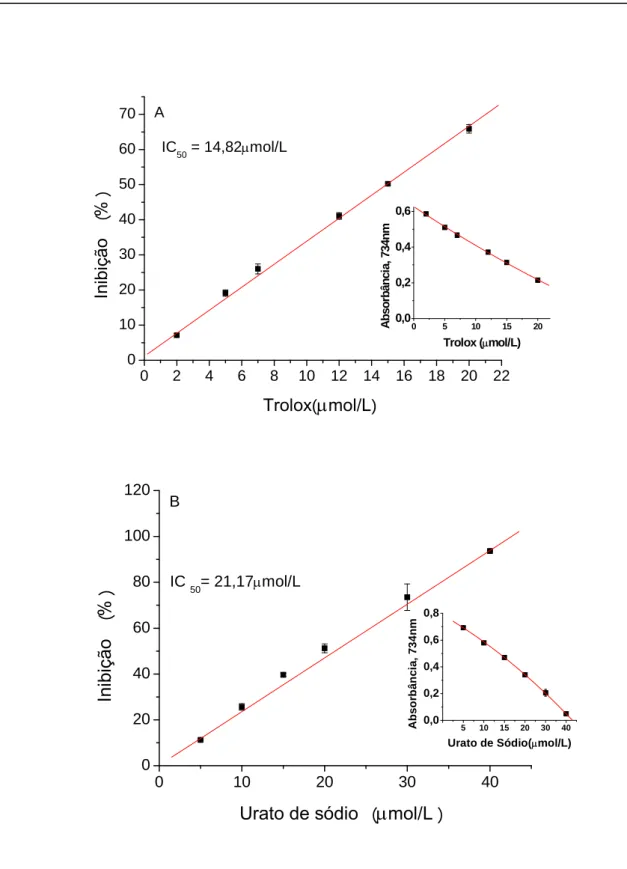
para a captura do HOCl/OCl-, e observa-se a seguinte ordem crescente: curcumina< quercetina< rutina< crocina< glutationa< urato< trolox< ácido ascórbico, o que representa uma ordem decrescente na eficiência da captura do HOCl/OCl- .
A curcumina mostrou-se muito eficaz para a captura do HOCl/OCl- obtendo o menor IC50, e até mais eficaz que a quercetina e rutina. Analisando a figura 29
observa-se ainda que não há diferença estatística entre o urato e a glutationa; e entre a rutina e a quercetina, novamente observa- se que há um grupo mais eficiente com IC50 de 1,12 a 3
µmol/L, com curcumina, quercetina, rutina e crocina; um grupo intermediário com IC50
0 1 2 3 4 5 0 20 40 60 80 100
0 1 2 3 4 5 6
0,0 0,2 0,4 0,6 0,8 1,0 A b sorbân ci a, 6 55 n m
Curcumina(mol/L)
A
IC50= 1,12 mol/L
I n i b i ç ã o %
Curcumina (mol/L)
0,0 0,5 1,0 1,5 2,0 2,5 3,0
0 20 40 60 80
0,0 0,5 1,0 1,5 2,0 2,5 3,0 0,0 0,3 0,6 0,9 1,2 1,5 A b so rbân c ia , 655n m
Quercetina(mol/L)
B
IC50= 1,74 mol/L
I n i b i ç ã o %
Quercetina(mol/L)
Figura 25: Inibição (captura) (IC50 µmol/L) do HOCl/OCl- pela: A, curcumina; B, quercetina; em tampão
0 1 2 3 4 0 20 40 60 80
0,0 0,5 1,0 1,5 2,0 2,5 3,0 0,0 0,3 0,6 0,9 1,2 1,5 A b s o rb ân ci a , 6 55n m
Rutina(mol/L)
A
IC50 = 1,86 M
I n i b i ç ã o %
Rutina (mol/L)
0,0 1,5 3,0 4,5 6,0 7,5
0 20 40 60 80
0,0 1,5 3,0 4,5 6,0 7,5 0,0 0,2 0,4 0,6 0,8 A b so rb â n ci a , 6 5 5 n m
Crocina(mol/L)
B
IC50 = 2,67 mol/L
I n i b i ç ã o %
Crocina (mol/L)
Figura 26:Inibição (captura) (IC50 µmol/L) do HOCl/OCl- pela: A, rutina; B, crocina; em tampão fosfato
0 2 4 6 8 10 0 20 40 60 80
0 2 4 6 8 10
0,0 0,2 0,4 0,6 0,8 1,0 1,2 A b sor b ân ci a, 65 5n m
Glutationa(mol/L)
A
IC50= 5,79 mol/L
I n i b i ç ã o %
Glutationa (mol/L)
0 3 6 9 12 15
0 20 40 60 80
0 3 6 9 12 15
0,0 0,2 0,4 0,6 0,8 1,0 Ab sorb ân c ia, 6 55n m
Urato de Sódio(mol/L)
B
IC50 = 5,97 mol/L
I n i b i ç ã o %
U r a t o d e S ó d i o
m o l / L
Figura 27:Inibição (captura) (IC50µmol/L) do HOCl/OCl- pela: A, glutationa; B, urato de sódio; em
0 4 8 12 16 20 24 28 0 20 40 60 80
0 4 8 12 16 20 24 0,0 0,3 0,6 0,9 1,2 1,5 A b s o rb ân c ia, 6 55 n m
Trolox(mol/L)
A
IC50= 20,42 mol/L
I n i b i ç ã o %
Trolox (mol/L)
0 4 8 12 16 20 24 28
0 20 40 60 80
0 4 8 12 16 20 24 28 0,0 0,3 0,6 0,9 1,2 A b so rb ân ci a, 6 55n m
Ác. Ascórbico(mol/L)
B
IC50 = 21,17 mol/L
I n i b i ç ã o %
Á c . A s c ó r b i c o
m o l / L
Figura 28:Inibição (captura) (IC50 µmol/L) do HOCl/OCl- pelo: A, trolox; B, ácido ascórbico; em tampão
C u r c u m i n a Q u e r c e t i n a R u t i n a C r o c i n a G l u t a t i o n a U r a t o T r o l o x A c . A s c ó r b i c o
0 5 10 15 20
*
HOCl/OCl
-IC50(mol/L)
P
a
d
r
õ
e
s
Figura 29: Inibição (captura) do HOCl/OCl-, pela curcumina e padrões, em tampão fosfato de potássio 50 mmol/L, pH 7,4.= 655nm. Diferenças estatísticas significativas: curcumina vs.ácido ascórbico; trolox; urato; glutationa; crocina; rutina e quercetina (p<0,05);* quercetina vs.ácido ascórbico; trolox; urato; glutationa e crocina.(p< 0,05); rutina vs. ácido ascórbico; trolox; urato; glutationa e crocina (p< 0,05); crocina vs. ácido ascórbico; trolox; urato e glutationa (p<0,05);glutationa vs. ácido ascórbico e trolox. (p<0,05); urato vs. ácido ascórbico e trolox. (p<0,05) e trolox vs. ácido ascórbico (p<0,05).
4.5 Capacidade de Captura sobre o H2O2
O H2O2 é gerado in vivo pela dismutação do radical ânion superóxido (O2
•−
) espontânea ou catalisada pela SOD ou é produzido por enzimas oxidases e pela oxidação de ácidos graxos. O efeito deletério do H2O2 vem de sua fácil conversão para o
radical hidroxila, por exposição à luz ultravioleta ou por interação com metais de transição como o ferro, através da reação abaixo, conhecida como reação de Fenton (ALVES et al., 2010).
Fe
2++ H
2O
2Fe
3++ HO
•+ HO
-A capacidade de captura foi determinada segundo Ching; Jong; Bast (1994) pelo ensaio com o TNB. Nesses ensaios a maioria das amostras não atingiram o IC50 nas
concentrações utilizadas, e somente o Ácido Ascórbico e a Glutationa conseguiram atingi-lo.
Antes de utilizar as amostras (curcumina e padrões) foi utilizada a catalase para validar o método, pois a catalase é reconhecidamente eficaz na conversão do H2O2 em
água e oxigênio (HALLIWELL; GUTTERIDGE, 2010).
Com a concentração da catalase comercial expressa em unid/mg de sólidos , foi preparada uma solução com concentração de 20 unid/ mL, para a utilização nos ensaios. Para efeito comparativo e assumindo-se que a massa da catalase pesada estivesse pura, converteu-se o valor do IC50 obtido para concentração molar assim como os demais
analitos, dessa forma a concentração da catalase onde conseguiu- se a inibição de 50% foi de 0,42 µmol/L (Figura 30).
0,0 0,1 0,2 0,3 0,4 0,5 0
20 40 60 80
IC
50= 0,31unid/mL
0,0 0,2 0,4 0,6 0,8 1,0 0,0
0,2 0,4 0,6 0,8 1,0 1,2 1,4
A
b
sor
b
â
n
c
ia,
412nm
Catalase(unid/mL)
I
n
i
b
i
ç
ã
o
%
C a t a l a s e
u n i d / m L
Figura 30:Iinibição (captura) do H2O2 (IC50 µmol/L) pela catalase; em tampão fosfato de potássio 50
mM, H2O2 0,3 mmol/L pH 7,4 revelado com 1,7mmol/L TNB. = 412nm. A figura inserida apresenta a
média das absorbâncias do TNBna presença de diferentes concentrações das amostras.
0,0 0,5 1,0 1,5 2,0 2,5
0 20 40 60 80
0,0 0,5 1,0 1,5 2,0 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 Abs o rb ân ci a, 4 1 2 n m Ác. Ascórbico(mmol/L)
IC 50= 1,89mmol/L
I n i b i ç ã o %
Á c . A s c ó r b i c o m m o l / L
A
0,0 0,5 1,0 1,5 2,0 2,5 3,0
0 20 40 60 80 100 120
0,0 0,5 1,0 1,5 2,0 2,5 3,0 0,0 0,2 0,4 0,6 0,8 1,0 1,2 A b so rb â n ci a (41 2 n m ) Glutationa(mM) I n i b i ç ã o %
G l u t a t i o n a m m o l / L
IC50= 1,4mmol/L B
Figura 31: Inibição (captura) (IC50 µmol/L) do H2O2 pelo: A, ácido ascórbico;B, glutationa; em tampão
A figura 32 apresenta os valores do IC50 (mmol/L) dos analitos para a captura do
H2O2 onde observou-se a seguinte ordem crescente do IC50: ácido glutationa< ácido
ascórbico, o que representa uma ordem decrescente na eficiência da captura do H2O2.
Como pode ser observado na figura 32, a quantidade necessária para atingir a inibição de 50 % dos analitos foi muito superior em relação à quantidade necessária para atingir o IC50 com a catalase.
Figura 32: Inibição (captura) do H2O2 (IC 50 µmol/L) em tampão fosfato de Potássio 50 mmol/L pH 7,4
4.6 Ensaios da via peroxidativa no sistema MPO/ H2O2/ Guaiacol
Nestes ensaios utilizou- se 40µL (1,268U/mg de proteínas), que equivalem a 0,359 U totais de MPO, guaiacol 60 mmol/L e H2O2 0,05 mmol/L, com volume final de
reação de 2mL. Nestas condições ocorre a oxidação do guaiacol à diidroguaiacol, pela via peroxidativa, a qual foi monitorada a 470 nm por 5 minutos na ausência e na presença de curcumina.
A figura 33 mostra o comportamento da reação (absorbância do produto em função do tempo) na ausência e na presença de curcumina (em duplicata).
0 50 100 150 200 250 300 350
0,0 0,1 0,2 0,3 0,4
Absorbância(470nm)
Tempo(segundos)
R e a ç ã o n a a u s ê n c i a d e C u r c u m i n a
R e a ç ã o n a p r e s e n ç a d e C u r c u m i n a 1 0 m m o l / L R e a ç ã o n a p r e s e n ç a d e C u r c u m i n a 1 0 m m o l / L
Figura 33: Reação entre MPO 0,359U na presença de guaiacol 60 mmol/L, com H2O2 0,05mmol/L em
Na figura 33 observa-se uma diminuição significativa na variação da absorbância com o tempo, a qual aparentemente pode ser atribuída a uma menor formação do produto. Contudo, quando realizou-se a reação na ausência de guaiacol e monitorando-se a curcumina, que também absorve a 470 nm, observou-se o seu decaimento (bleaching), ou seja, a diminuição desta absorbância, conforme demonstra a figura 34, comparativamente a mesma reação na ausência de curcumina.
0 50 100 150 200 250 300 350
0,00 0,05 0,10 0,15 0,20 0,25
Absorbância(470nm)
Tempo(segundos)
R e a ç ã o n a a u s ê n c i a d e c u r c u m i n a 1 0
m o l / L
R e a ç ã o n a p r e s e n ç a d e c u r c u m i n a 1 0
m o l / L e n a a u s ê n c i a d e g u a i a c o l
Figura 34: Reação entre MPO 0,359U na presença de guaiacol 60mmol/L, H2O2 0,05mmol/L em
Tais resultados tornam complexa a análise cinética do efeito da curcumina sobre a reação peroxidativa e ao mesmo tempo também indicam um efeito inibitório, que pode ser uma via competitiva entre os dois substratos, o guaiacol e a curcumina.
Para confirmar as observações anteriores monitorou-se o bleaching da curcumina na região do seu pico máximo de absorbância (figura 35). Nessa figura com o monitoramento da reação a 430 nm, pode-se ainda observar que praticamente não há alteração da absorbância na mistura da curcumina somente com H2O2 ou apenas com
MPO, contudo quando o sistema está completo, isto é, na presença de MPO e H2O2
0 50 100 150 200 250 300 0,0 0,1 0,2 0,3 0,4
250 300 350 400 450 500 550 0,00 0,05 0,10 0,15 0,20 0,25 0,30 A b so rb ân cia
Curcumina (10mol/L) mais H2O2
Curcumina (10mol/L) mais MPO
Curcumina (10mol/L) mais MPO mais H2O2
A
b
s
o
r
b
â
n
c
i
a
4
3
0
n
m
T e m p o
s e g u n d o s
Figura 35: Reação entre o EBN com 0,359U de MPO, curcumina 10µmol/L a e H2O2 0,05 mmol/L em
tampão fosfato pH 7,4 durante 5 minutos a 37ºC em 430nm. A figura inserida mostra o espectro da curcumina em tampão e 5% de DMSO, em diversos tempos de incubação a 37ºC.
4.7 Efeito da curcumina sobre o sistema MPO/H2O2/Cl- (via clorinante)
Nestes ensaios o sistema MPO/H2O2/Cl-, produz HOCl / OCl- via MPO-I, e o
OCl- oxida o TMB. Quando a reação é realizada na presença de taurina forma-se taurina-cloramina, e este produto também oxida o TMB formando um cromóforo azul (max = 650 nm) proporcional a formação do HOCl ou da taurina-cloramina (DYPBUKT et al., 2005).