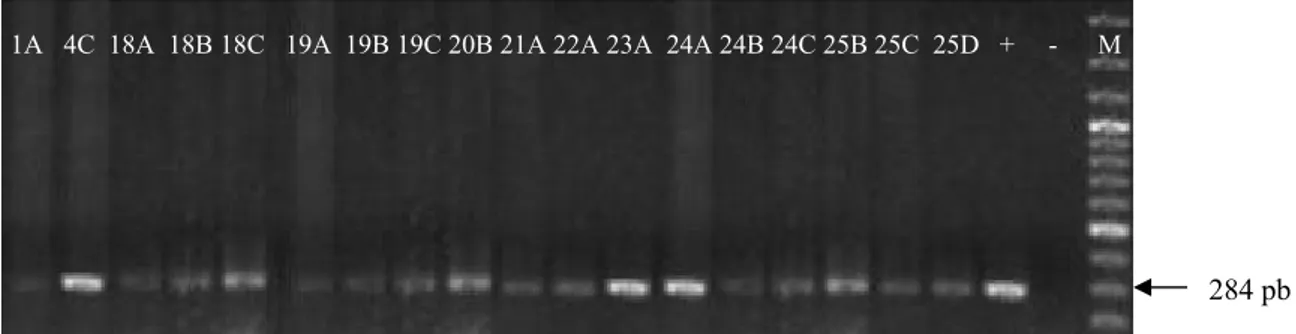
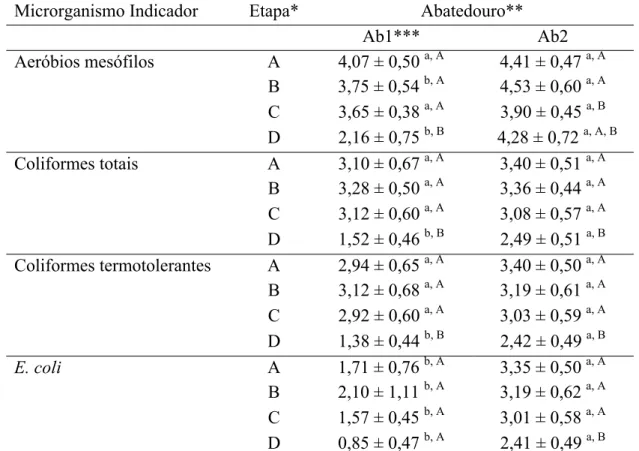
Contaminação microbiana de carcaças de frangos obtidas em dois sistemas de abate e avaliação de um protocolo de Reação em Cadeia de Polimerase (PCR) para detecção de Salmonella spp.
Texto
Imagem



Outline
Documentos relacionados
a)a quantidade total, mas não a qualidade da água disponível no Planeta. c)a qualidade da água disponível, apenas no subsolo terrestre. Ao resfriar-se, o vapor de água
A equação de estado de um sistema composto por moléculas ocupando um volume V , mantido a uma pressão P e sujeito a banho térmico que o mantém a uma temperatura T é uma
Com essa seleção, é possível identificar qual embrião tem maior potencial produtivo evitando-se a gestação de embriões de baixo potencial produtivo, de modo que
A participação foi observada durante todas as fases do roadmap (Alinhamento, Prova de Conceito, Piloto e Expansão), promovendo a utilização do sistema implementado e a
Para atingir este fim, foram adotados diversos métodos: busca bibliográfica sobre os conceitos envolvidos na relação do desenvolvimento de software com
Objetivo: Garantir estimativas mais realistas e precisas para o projeto, ao considerar nesta estimativa o esforço necessário (em horas ou percentual do projeto) para
Ainda segundo Gil (2002), como a revisão bibliográfica esclarece os pressupostos teóricos que dão fundamentação à pesquisa e às contribuições oferecidas por
O estudo múltiplo de casos foi aplicado para identificar as semelhanças e dissemelhanças na forma como as empresas relacionam seus modelos de negócios e suas