MINISTÉRIO DA EDUCAÇAO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIENCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
INFLUÊNCIA DO TAMOXIFENO ASSOCIADO AO
DIABETE MELITO NA DENSIDADE MINERAL ÓSSEA
MARIA MARGARETH CÂMARA DE ALMEIDA
Orientador: Profª Drª Adriana Augusto de Rezende Co-orientador: Profª Drª Maria das Graças Almeida
MINISTÉRIO DA EDUCAÇAO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIENCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS
INFLUÊNCIA DO DIABETE MELITO ASSOCIADO AO TAMOXIFENO NA DENSIDADE MINERAL ÓSSEA
MARIA MARGARETH CÂMARA DE ALMEIDA
Dissertação submetida ao programa de pós-graduação em ciências Farmacêuticas como requisito para a obtenção do grau de MESTRE em ciências Farmacêuticas, área de concentração Bioanálises.
Orientador: Profª Drª Adriana Augusto de Rezende Co-orientador: Profª Drª Maria das Graças Almeida
MARIA MARGARETH CÂMARA DE ALMEIDA
INFLUÊNCIA DO DIABETE MELITO ASSOCIADO AO TAMOXIFENO NA DENSIDADE MINERAL ÓSSEA
COMISSÃO JULGADORA
DISSERTAÇÃO PARA OBTENÇÃO DO GRAU MESTRE
Profª . Drª . Adriana Augusto de Rezende Orientadora
1° Examinador
2° Examinador
_______________________________________________________________ 3° Examinador
AGRADECIMENTO ESPECIAL
Ao Laboratório de análises clínicas Hemolab,
DEDICATÓRIA
Em primeiro lugar a Deus, a quem me apeguei nas horas difíceis, a quem agradeço com louvor pelas dádivas.
Aos meus amados filhos Karoline, Leonardo e Julliana que suportaram o “débito de atenção” com paciência sempre me apoiando e torcendo por minhas conquistas, e compartilham da minha felicidade em concluir este trabalho.
Ao meu esposo, Hélio, pela dedicação eterna a família, compreendendo minha ausência nos muitos fins de semana dedicados a pesquisa, pela ajuda com as tabelas e planilhas. Enfim pelo apoio familiar que preencheu as diversas falhas que fui tendo por forças das circunstâncias. Meu guia, meu exemplo de força e carinho.
AGRADECIMENTOS
A Profª. Drª Adriana Augusto de Rezende, minha orientadora, por me ensinar a vivenciar, admirar e amar a pesquisa, e pela sua dedicação e competência para conclusão deste trabalho.
Ao Profª Drª Maria das Graças Almeida,
pelo excelente desempenho na tarefa de manter sempre viva a atividade de pesquisa, e pelos constantes incentivos ao estudo das análises clínicas e toxicológicas.
A Profª Drª Ana Maria de Oliveira Ramos, pela oportunidade dada para o aprimoramento dos meus conhecimentos e pela realização das análises histomorfométricas em secções do tecido ósseo, indispensáveis para a avaliação estatística.
Aos colegas de pesquisa Elaine, Teresa, Carlos, e do Hemolab, Lucília, Luciana, Raine e Rivanilton pela amizade e pelo companheirismo e valiosa colaboração nos experimentos e análises bioquímicas.
RESUMO
A influência do tratamento com Tamoxifeno (TAM) na densidade mineral óssea foi estudada em ratos Wistar fêmeas diabéticos. Foram utilizados 60 ratos Wistar fêmeas (180-250g), sendo divididos em quatro grupos: controle C (n=5), tratado com TAM T (n=5), diabete D (n=5) e diabete tratado com TAM DT (n=5). Foi feita avaliação do ciclo estral durante 15 dias antes do início do experimento para selecionar os animais com ciclos regulares e durante os períodos de 30, 60 e 90 dias, em todos os grupos estudados. O diabete foi induzido com injeção intraperitoneal de estreptozotocina STZ (45 mg/Kg) e os animais foram sacrificados em períodos de 30, 60 e 90 dias após a instalação do diabete melito (glicemia ≥ 250 mg/dL). Foram
ABSTRACT
Considering that osteopenia and osteoporosis are diabetes mellitus complications, and that tamoxifen (TAM) is an anti-estrogenic drug used in breast cancer treatment, this drug may have a beneficial action preventing accentuaded bone loss associated to diabetes. Female Wistar rats (n=60) weighting 180-250g were divided in four groups: Group C, control animals (n=5); Group T, animals treated with TAM (n=5); Group D, diabetic animals (n=5); and Group DT, diabetic animals treated with TAM (n=5). Oestrus cycle was evaluated before the beggining of experimental period to select the animals with regular cycle. This evaluation continued throughout the study period and for all studied groups. Diabetes was induced by a intra perithoneal injection of streptozotocin (STZ) in a concentration of 45 mg/Kg of body weight. Those animals with serum glicose levels ≥ 250 mg/dL were considered diabetics.
SUMÁRIO
RESUMO ABSTRACT
ABREVIAÇÕES i
LISTA DE FIGURAS ii
1INTRODUÇÃO 1
1.1Tamoxifeno e biomineralização 1
1.2 Diabete e doença óssea generalizada 11
2 OBJETIVOS 17
2.1 Objetivo geral 17
2.2 Objetivos específicos 17
3 MATERIAIS E MÉTODOS 18
3.1 Animais 18
3.2 Avaliação do ciclo estral 19
3.3 Indução do diabete melito 20
3.4 Tratamento com solução aquosa de sorbitol e TAM 21
3.5 Determinação da glicemia 21
3.6 Análise histomorfométrica do fêmur 22
3.7 Preparação das amostras de sangue 24
3.8 Avaliação dos parâmetros bioquímicos 24
3.8.1 Determinação da concentração de glicose 24
3.8.2 Determinação da atividade da fosfatase alcalina 25
3.8.3 Determinação da atividade da fosfatase ácida tartarato- resistente 26
3.8.4 Determinação da concentração do cálcio total 26
3.8.5 Determinação da concentração do fósforo 27
3.8.6 Determinação da concentração de magnésio 27
3.8.7 Determinação da concentração de uréia 28
3.8.8 Determinação da concentração de creatinina 28
3.8.9 Determinação da concentração de proteínas totais 29
4 ANÁLISE ESTATÍSTICA 30
5 RESULTADO 30
5.1 Avaliação do ciclo estral 30
5.2 Análise Histomorfométrica 31
5.3 Caracterização do estado diabético 38
5.4 Avaliação de parâmetros bioquímicos 39
5.4.1 Fosfatase alcalina (FAL) e fosfatase ácida tartarato- resistente (TRAP) 40 5.4.2 Cálcio, magnésio 41
5.4.3 Fósforo 42
5.4.4 Proteínas totais 42
5.4.5 Albumina 43
5.4.6 Uréia 44
5.4.7 creatinina 45
6 DISCUSSÃO 46
7 CONCLUSÕES 60
8 REFERÊNCIAS BIBLIOGRÁFICAS 61 9 ANEXOS
ABREVIAÇÕES
ADP – Adenina Difosfato
Ampol – 2 -amino-2-metil-1-propanol ANOVA – Análise de Variância
bALP – Isoforma Óssea da Fosfatase Alcalina CMC – Carboximetilcelulose
CO2 – Gás Carbônico
CTX – Telopeptídeo C terminal do Colágeno tipo 1 CYP34A- Isoenzima Citcromo P450 3A4
DEXA – Absorciometria por Raio X de Dupla Energia dL - Decilitro
DMO – Densidade Mineral Óssea DNA – Ácido Desoxirribonuclêico DPD – Deoxipiridinolina
FAL – Fosfatase Alcalina Total FDA – Food and Drug Administration
g – Grama
GH – Hormônio do Crescimento HE – Hematoxilina-Eosina HYP – Hidroxiprolina i.p. – Intraperitoneal
IGF – Fator de Crescimento Semelhante à Insulina
IL-6 – Interleucina 6 mg – Miligramas
NAD – Nicotinamida Adenina Dinucleotideo…
NADP – Nicotinamida Adenina Dinucleotideo Fosfato
NASBP P-1 – National Surgical Adjuvant Breast Bowel Project P-1 Study
NTX – Telopeptídeo N terminal do Colágeno tipo 1 (NF)-kB – Fator Nuclear kappa B
OC – Osteocalcina
OHTAM – Hidroxitamoxifeno OPG – Osteoprotegerina
PICP – Pró-peptídeo C-terminal do Pró-colágeno tipo 1 PINP – Pró-peptídeo N-terminal do Pró-colágeno tipo 1 PTH – Paratormônio
PTHrp – Receptor do Paratormônio
PTHrP – Peptídeos Relacionados ao Paratormônio PYD – Piridinolina
qsp – Quantidade suficiente para RANK – Receptor ativador do NF-kB
RANKL – Ligante do Receptor Ativador do NF-kB RE – Receptor de Estrógeno
SERMs – Moduladores Seletivos do Receptor de Estrógeno STZ – Estreptozotocina
TAM – Tamoxifeno
TGF-β – Fator de Crescimento de transformação β
TRAP – Fosfatase Ácida Tartarato-Resistente U/L – Unidades por Litro
UFRN – Universidade Federal do Rio Grande do Norte v.o. – Via Oral
LISTA DE FIGURAS
FIGURA 1 – Espessura trabecular dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias.
FIGURA 2 – Distância intertrabecular dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias.
FIGURA 3 – Volume trabecular (%) dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias.
FIGURA 4 – Análise histomorfométrica das secções ósseas e volume ósseo trabecular (%) do fêmur esquerdo de ratos controle (A), tratados com TAM (B), diabéticos (C) e diabéticos tratados com TAM (D) no período de 30 dias. Coloração HE. Amplificação 100x.
FIGURA 6 – Análise histomorfométrica das secções ósseas e volume ósseo trabecular (%) do fêmur esquerdo de ratos controle (A), tratados com TAM (B), diabéticos (C) e diabéticos tratados com TAM (D) no período de 90 dias. Coloração HE. Amplificação 100x.
FIGURA 7 – Glicemia dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias.
FIGURA 8 – Peso corporal dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante o período de 30, 60 e 90 dias.
FIGURA 9 – Atividade da fosfatase Alcalina dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante o período de 30, 60 e 90 dias.
FIGURA 10- Níveis séricos de Fósforo dos animais controles (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias.
FIGURA 11 - Níveis séricos de Proteínas Totais dos animais controles (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias.
A
FIGURA 12 - Níveis séricos de Albumina dos animais controles (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante o período de 30, 60 e 90 dias.
FIGURA 13 - Níveis séricos de ureia dos animais controles (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante o período de 30, 60 e 90 dias.
1 INTRODUÇÃO
1.1 Tamoxifeno e biomineralização
O tamoxifeno (TAM) é um composto estrogênico não esteróide usado amplamente no tratamento do câncer de mama. É a primeira geração dos moduladores seletivos de receptor de estrógeno (SERMs) que age como antagonista do estrogênio no tecido mamário, embora apresente efeitos específicos do hormônio em outros tecidos como o efeito agonista no fígado, endométrio, ovários e osso (SMITH et al., 2000; MOREIRA et al., 2004; JÚNIOR et al., 2005; BERRY et al., 2006).
O TAM tem sido utilizado desde 1971 para o tratamento do câncer de mama e foi aprovado pela Food and Drug Administration (FDA) em outubro de
1998 para ser usado como agente preventivo (POLE et al., 2004). As Organizações de saúde recomendam um regime de 5 anos com uma dose de 20mg/dia, via oral, para mulheres que apresentam receptor de estrógeno (RE) positivo (CURTIS, 2001; ROUANET et al., 2005).
exceder sete dias. A enzima envolvida no metabolismo e ativação do TAM é a CYP3A4 que promove a desmetilacão da droga em fígado humano (SMITH et al., 2000; MOREIRA et al., 2004; MICHALETS, 1998; NAYFIELD e GORIN,1996; KUO e RUNOWICZ,1995).
Em relação ao mecanismo de ação, o TAM se liga aos receptores estrogênicos induzindo a uma mudança conformacional dos mesmos. Como conseqüência, disso a expressão dos genes que dependem destes receptores será bloqueada, alterada ou sofrerá queda. O resultado final é uma redução da atividade da DNA- polimerase, uma deteorização na utilização de timidina, um bloqueio da captação de estradiol e uma resposta estrogênica diminuída. A maior parte da atividade do TAM se observa quando a célula tumoral se encontra na fase G-2 do ciclo, comportando-se o TAM como citostático. Além disso o TAM tem outros efeitos tais como, reduz os níveis de fator de crescimento insulina like tipo 1, um fator que estimula a proliferação de células tumorais e induz a secreção do fator de transformação de crescimento ( TGF ) um fator que atua como inibidor do crescimento de células tumorais. Pelos seus efeitos estrogênicos o TAM pode ser utilizado para induzir a ovulação em mulheres anovulatórias. Finalmente, o TAM estimula a produção hipotalâmica do hormônio liberador de gonadotrofina que por sua vez afeta a secreção de outros hormônios pela pituitária. Todos os outros efeitos induzem a ovulação. (MICHALETS, 1998; NAYFIELD e GORIN,1996; KUO e RUNOWICZ,1995).
pelas fezes. A maior parte dos produtos de eliminação é conjugada, sendo apenas 30% não conjugados. Devido não haver excreção renal, não são necessários ajustes na dose nos doentes renais ao contrário de doentes com êxtase biliar podem necessitar de uma redução na dose. (MICHALETS, 1998; NAYFIELD e GORIN,1996; KUO e RUNOWICZ,1995).
Estudos conduzidos nos Estados Unidos pela NASBP P-1 (National Surgical Adjuvant Breast Bowel Project P-1 Study), revelaram que o TAM
reduziu o risco do câncer de mama invasivo (metastático) e não invasivo (não metastático), bem como o risco de doenças benignas (adenose, cistos, ductoectasia, doença fibrocística, hiperplasia e metaplasia), a morbidade, os custos de diagnósticos repetitivos e tratamentos associados (Journal of the National Cancer Institute, 2003; 3rd European Breast Cancer Conference, 2002).
Estudos realizados pela Breast Câncer Prevention Trial (BCPT) e Multiple Outcomes of Raloxifene (MORE) indicam que TAM reduz o risco de carcinogênese em tumores RE positivos e não em RE negativos, porém Esserman et al, (2005) utilizando dados da BCPT, MORE e NSABP, produziu um modelo matemático demonstrando que TAM e outros antiestrogênicos podem reduzir a carcinogênese tanto em tumores RE positivo quanto RE negativos.
A ação do estrógeno é mediada pelos receptores de estrógeno (RE) α
ou β os quais tem estruturas semelhantes, mas funções diferentes entre si. Os
efeitos são mediados primeiramente via RE α e β o qual são membros da
subseqüentemente estimula a expressão gênica. O RE α é estimulado por duas
distintas regiões ativadoras, região ativadora – 1 (AF-1) e região ativadora – 2 (AF-2). O TAM significantemente reduz a recorrência de tumor de mama por se ligar ao domínio AF-2 do RE (GLAROS, 2006).
O RE α tem sido predominantemente encontrado no interior da pituitária,
útero, vagina, testículo, fígado e rim e o RE β é principalmente encontrado na
tireóide, ovário, próstata, pele, pulmão e trato gastrointestinal. Ambos são encontrados na mama bem como no osso. O RE α é expresso em osteoblastos
e osteoclastos, e o RE β só em osteoblastos, sugerindo um efeito direto no
metabolismo ósseo. A determinação das diferenças entre estes subtipos de receptores em relação à afinidade de ligação e distribuição nos tecidos poderia contribuir para explicar a ação seletiva dos agonistas ou antagonistas do RE em diferentes órgãos e sistemas (PELLETIER, 2000; YONEDA et al., 2002).
O mais importante aspecto da terapia com TAM compreende a influência no tecido ósseo e metabolismo lipídico (CZERNYL et al., 2003)
Vários estudos, embora controversos, têm relatado a relação entre densidade mineral óssea (DMO) e o polimorfismo genético de RE α e β.
Yoneda et al, (2002) estudaram a relação do efeito de TAM com o polimorfismo genético dos genes dos receptores de estrógeno α e β em
mulheres japonesas posmenopausadas com câncer de mama. Além disso, avaliaram o efeito do tratamento na DMO e nos marcadores do turnover ósseo.
Os autores observaram que o TAM se liga tanto ao RE α quanto ao RE β
Em relação ao RE β Windahl et al, (2002) demonstraram um aumento
no conteúdo mineral ósseo em camundongos nocaute para RE β indicando
uma função repressiva deste receptor no conteúdo mineral ósseo.
Broulik, (2000) relatou que a castração de camundongos machos resultou em osteopenia, o que reforça a relação de andrógenos e estrógenos com o metabolismo ósseo. Entre os grupos estudados estão animais controles tratados com TAM, animais castrados e animais castrados tratados com TAM. Os animais castrados apresentaram redução da DMO com diminuição no conteúdo de cálcio e fósforo. Por outro lado, o tratamento com TAM preveniu significantemente a redução da DMO ocasionada pela castração.
Recentemente Tiitinen et al, (2004) demonstraram que o tratamento de um ano em humanos com TAM foi necessário para aumentar a DMO em 2%, estando associado com a redução da incidência de fraturas.
O modelo de ratos ooforectomizados tem sido também alvo de estudo e representativo da condição de pós menopausa e conseqüente osteopenia. Estudos realizados por Ruenitz, (1998) utilizando ratos ooforectomizados e que receberam como tratamento 17 beta estradiol, TAM ou clomifeno, mostraram através da analise histomorfométrica uma prevenção da perda óssea e supressão do turnover ósseo a níveis comparáveis aos animais controles. Esta
condição foi confirmada pela diminuição dos níveis séricos de osteocalcina, reconhecida como marcador do turnover ósseo.
(IGF-I, IGF-II e TGF- β) (FREEMONT, 1993; DEQUEKER, 1994; WATKINS et al.,
2001).
As ações diferenciadas do PTH sobre formação e reabsorção ósseas têm sido intensamente estudadas e novos aspectos sobre sua ligação com o receptor e as vias de sinalização intracelular nos osteoblastos têm sido descritas. Os receptores de PTH foram identificados nos osteoblastos e seus precursores que são as células progenitoras pluripotentes de linhagem mesenquimal. Nos osteoclastos, ou em seus precursores, não se identificou até o momento nenhum receptor de PTH, o que nos leva a concluir que os efeitos do PTH sobre a reabsorção óssea são intermediados pelos osteoblastos. (STREWLER, 2001; GRACITELLI et al., 2002; SWATHOUT et al., 2002)).
De uma forma global o PTH induz nas células estromais a expressão de genes relacionados a vários fatores de crescimento, incluindo IGF-I, IGF-II, TGF- β. Além disso, o PTH induz a produção de proteína ligante de IGF
(IGFBP), como IGFBP-I, III, IV e V. Esses fatores de crescimento agem recrutando células pré-osteoblásticas, derivadas das células estromais da medula óssea, e induzem a diferenciação e maturação destas células em osteoblastos maduros, capazes de sintetizar colágeno em grande quantidade (GOLTZMAN, 1999; ROSEN, RACKOFF, 2001; GRACITELLI et al., 2002).
tem a capacidade de se ligar ao receptor de membrana RANK presente nos osteoclastos.
Além disso, o PTH estimula a síntese de IL-6, também capaz de desencadear a diferenciação osteoclástica provavelmente pelas mesmas vias (GRACITELLI et al., 2002).
Considerando que o osso é um tecido responsivo a estrógenos, este hormônio tem importante função na manutenção da densidade mineral óssea (DMO). O estrógeno suprime a diferenciação osteoclástica induzida pelo RANKL por aumentar a expressão de OPG em osteoblastos humanos (TSANGARI et al., 2004).
A OPG, uma proteína solúvel da família do TNF é sintetizada pelos osteoblastos sendo responsável por elaborar sinais de transdução entre osteoblastos e osteoclastos e atua inibindo a diferenciação e ativação dos osteoclastos, competindo com RANKL pelo RANK presente nas células progenitoras hematopoiéticas induzindo assim a diferenciação em osteoclastos. (GOLTZMAN, 1999; BEKKER et al., 2001; MITNICK et al., 2001; GRACITELLI et al., 2002).
Modelos in vitro e in vivo sugerem que a hiperexpressão de RANKL fator
de diferenciação osteoclástica e a baixa expressão de osteoprotegerina (OPG) estão envolvidos com a perda óssea que ocorre durante a deficiência de estrógeno (SHEVDE et al., 2000; CENCI et al., 2000; ROGGIA et al., 2001; UELAND, 2004).
pró-inflamatórias. A interleucina-1 (IL-1), interleucina-6 (IL-6) e membros da superfamília do TNF participam da patogênese da osteoporose pós-menopausa e níveis aumentados destes mediadores estão associados com aumento da osteoclastogênese e um balanço negativo da remodelação.
Estudos realizados por Nanes (2003) com cultura de células ósseas na presença de TNF ou cultura de osteoblastos mineralizados demonstraram um aumento na liberação de cálcio e supressão na produção da matriz protéica, sugerindo uma estimulação na reabsorção óssea e inibição da formação. O TNF diminui tanto o número de receptores da Vitamina D presentes nas células osteoblásticas como a ativação destes receptores os quais são estimulados pela Vit.1,25-diidroxi-D3 (NANES et al., 1991; MAYUR et al., 1993; NANES, 2003)
As anormalidades esqueléticas freqüentemente relacionadas com a diminuição do conteúdo mineral do esqueleto são osteopenia e/ou osteoporose. A osteopenia caracteriza-se por uma perda de massa óssea sem alteração da estrutura dos ossos. A osteoporose caracteriza-se por uma fragilidade óssea assintomática e progressiva devido a uma redução da massa óssea e o subseqüente desenvolvimento do risco elevado a fraturas traumáticas ou não traumáticas (SAGGESE et al., 1988; PATEL, 1996; CASTELO-BRANCO, 1998; KONG et al., 2000; HAMDY et al., 2005).
fraturas osteoporóticas estão associadas com significante aumento da morbidade e mortalidade, e compromete a qualidade de vida (HAMDY et al., 2005).
Não obstante muitos dos casos de osteoporose permanecem não diagnosticados e conseqüentemente não tratados. O diagnóstico tardio leva a um aumento ao risco de fraturas (HAMDY et al., 2005).
Baseados na fase do ciclo de remodelação, os marcadores do metabolismo ósseo podem ser convenientemente classificados em marcadores de formação óssea ou de reabsorção óssea. Marcadores de formação óssea avaliam tanto a atividade sintética osteoblástica como o metabolismo de liberação do pró-colágeno. Os marcadores de reabsorção óssea refletem a atividade osteoclástica e/ou a degradação do colágeno (GUR et al., 2005).
Exames laboratoriais para avaliar o grau de formação e degradação óssea têm sido realizados através dos marcadores bioquímicos da remodelação óssea. Estes marcadores, que refletem o estado geral do turnover
ósseo, contribuem de forma importante na avaliação das taxas de remodelação óssea em portadores de doenças ósseas generalizadas (osteoporose, osteomalácia, osteodistrofia renal) e doenças localizadas (doença de Paget e metástases). Para a avaliação das taxas de remodelação óssea sugere-se associar os marcadores de formação e reabsorção óssea de acordo com as características do paciente e dos ensaios disponíveis (ROSEN e TENENHOUSE, 1998; WATTS, 1999).
propeptídeos do colágeno tipo 1 [propeptideo N-terminal do procolágeno tipo 1 (PINP) e propeptideo C-terminal do procolágeno tipo 1 (PICP)].
Como marcadores de reabsorção, tem-se: cálcio urinário, hidroxiprolina (HYP), fosfatase ácida tartarato-resistente (TRAP), moléculas interligadoras do colágeno tipo 1 [piridinolina(PYD), deoxipiridinolina (DPD) e os telopeptideos C e N terminal, CTX e NTX, respectivamente (RUSSEL, 2000).
Os marcadores são considerados indispensáveis nas avaliações de efetividade de drogas para o tratamento da osteoporose, além proporcionar grandes contribuições científicas sobre fisiologia e fisiopatologia do tecido ósseo. (LAZARETTI-CASTRO, 2002).
A fosfatase alcalina é uma das principais enzimas envolvidas no processo da formação óssea, sendo sintetizada pelos osteoblastos e freqüentemente utilizada como um marcador inicial da diferenciação dessas células ósseas. Esta enzima está amplamente distribuída em vários órgãos e as suas isoenzimas são separadas a partir da eletroforese em diferentes frações, como a hepática, renal, óssea, intestinal e placentária. (KOYAMA et al., 1998; DEMERS, 2001; DUARTE et al., 2005).
A fosfatase alcalina total é medida através da sua atividade e corresponde a soma das diversas isoformas presentes no soro. Cerca de 90% do seu valor correspondem as isoformas hepática e óssea. A medida da isoforma óssea específica tem vantagem sobre a total uma vez que além de não sofrer influências hepáticas, é mais sensível a pequenas variações no “pool” circulante (SARAIVA e LAZARETTI-CASTRO, 2002).
Apresenta-se resistente ao ácido tartárico e tem sido reconhecida e indicada como um marcador do processo da reabsorção óssea, está presente em grandes quantidades nos osteoclastos, refletindo mais o número do que a atividade destes (SUZUKI et al., 2000; SARAIVA E LAZARETTI-CASTRO, 2002; DUARTE et al., 2005).
A avaliação dos telopeptídeos do colágeno tipo I parecem mostrar maior correlação com a dinâmica do osso. Podem ser dosados no sangue e na urina, sendo que uma série de ensaios diferentes existem, o que muitas vezes dificulta sua solicitação e interpretação pelo clínico. Ao contrário da HYP não sofrem influência da dieta (GARNERO e DELMAS, 1998; SARAIVA e LAZARETTI-CASTRO, 2002).
1.2 Diabete melito e doença óssea generalizada
O diabete melito é um grupo de doença metabólica caracterizada por hiperglicemia resultante de defeitos na secreção de insulina, ação da insulina ou ambos. A hiperglicemia crônica do diabete está associada a futuros danos, disfunção e falência de vários órgãos, especialmente os olhos, rins, nervos, coração e vasos sanguíneos (DIABETES CARE, 2006).
As complicações do diabete a longo prazo incluem, retinopatia com potencial dano a visão; nefropatia levando a uma falência renal; neuropatia periférica com risco de úlceras no pés, amputações; neuropatia autonômica causando disfunção gastrointestinal, geniturinária e cardiovascular (DIABETE CARE, 2006). Além disso, é conhecido o risco de osteoporose em pacientes com diabete melito (DUARTE et al., 2005).
Alterações específicas associadas ao metabolismo ósseo têm sido associadas com diabete melito, e várias possibilidades patogênicas têm sido propostas, tais como, insulinopenia, microangiopatia óssea, diminuição da regulação do metabolismo mineral, alteração de fatores locais que regulam a remodelação e ainda uma desordem intrínseca associada ao diabete tipo 1. Nos últimos anos, tem sido crescente o interesse nos estudos das várias alterações do diabete relacionadas ao metabolismo ósseo, entre elas a diminuição dos níveis séricos de vitamina D, modificações do colágeno, osteopenia, mudanças na absorção do cálcio e fósforo e alterações no nível sérico do PTH e calcitonina (REDDY et al., 2001; SUZUKI et al., 2000;
THOMAS et al., 2000; TAKESHITA et al, 1995; DUARTE et al., 2005).
As principais alterações relacionadas com a formação óssea são inibições na formação da matriz de colágeno; alteração na síntese protéica; aumento no tempo e mineralização do osteóide; redução do turnover ósseo;
diminuição no número de osteoblastos e osteoclastos; alteração no metabolismo ósseo e redução na produção de osteocalcina (MIAZGOWSKI e CZEKALSKI, 1998; TSUCHIDA et al., 2000).
Segundo Green et al (2004), indivíduos com diabete tipo 1 tem massa óssea reduzida e no diabete a deficiência de insulina e hiperglicemia, é provável ter efeito na formação óssea.
A correlação entre o diabete melito e as alterações no metabolismo mineral e ósseo tem sido cada vez mais estudada tanto em humanos quanto em animais diabéticos experimentais (REZENDE et al., 1993; KEMINK et al., 2000; SUZUKI et al., 2000; DUARTE et al., 2005).
Diante da necessidade de uma melhor compreensão das complicações associadas ao diabete, a indução desta doença em modelos animais vem sendo freqüentemente utilizada, mesmo porque alguns experimentos não poderiam ser realizados em humanos, além de simularem muitos aspectos das complicações do diabete (CONVINGTON et al., 1993; JUNIOR et al.,2005).
Entre as drogas utilizadas estão a aloxana e streptozotocina (STZ) as quais possuem ação específica nas células beta das ilhotas de Langehans do pâncreas. O mecanismo de ação da STZ consiste em alterar as seqüências de bases do DNA das células beta das ilhotas pancreáticas e estimular a sintetase polinuclear (ADP-ribose) diminuindo assim os níveis de NAD e NADP intracelular. A depleção de NAD pela STZ inibe a síntese de pró-insulina induzindo assim o diabete (PANCHNADIKAR e BHONDE, 2003).
BOUILLON et al (1995) observaram redução do turnover ósseo em
A diminuição da densidade mineral ósseo (DMO), avaliada por diferentes técnicas densitométricas, associada a alterações dos marcadores circulantes do metabolismo ósseo tem levado ao reconhecimento da osteopenia diabética como uma das complicações crônicas do diabete melito tipo 1 (MIAZGOWSKI e CZEALKSI, 1998; MIEDANY et al., 1999; PASTOR et al., 2000; DUARTE, 2005).
As desordens degenerativas do osso estão freqüentemente relacionadas com o conteúdo mineral do esqueleto. A osteopenia ocorre com a perda de massa óssea sem alteração da estrutura dos ossos e a osteoporose é uma desordem esquelética comum caracterizada pela perda de massa óssea e deterioração da micro arquitetura do tecido ósseo com aumento da susceptibilidade a fraturas. A osteoporose tem uma etiologia complexa e é considerada uma doença poligênica multifatorial os quais determinantes genéticos são modulados por fatores hormonais, ambientais e nutricionais (GENNARI et al, 2004).
A osteoporose é uma das doenças severas mais predominantes e pode ser caracterizada por possuir início insidioso, com degeneração óssea progressiva e assintomática, e subseqüente desenvolvimento de fraturas traumáticas e não-traumáticas (SAGESSE et al.,1988; CASTELO-BRANCO, 1998; PACHECO et al., 2002).
A osteopenia é uma das complicações decorrentes da deficiência de insulina e ocorre no diabetes tanto em humanos como em animais experimentais.
pesquisadores a associam à diminuição da formação óssea com acelerada reabsorção pelos osteoclastos (MUÑOZ-TORRES et al., 1996; MIEDANY et al., 1999; SUZUKI et al., 2000).
Existe uma grande probabilidade de um quadro de osteopenia evoluir para osteoporose, um dos maiores problemas mundiais, visto que a incidência de fraturas relacionadas a essa doença aumenta a cada dia. A relação osteoporose-fratura acarreta uma diminuição significante da mobilidade, com conseqüente mortalidade. Em pacientes diabéticos tipo 1, a osteoporose acomete principalmente as mulheres na pós-menopausa, originada por acelerada diminuição de osso trabecular, podendo resultar em fraturas vertebrais (SONG et al., 2001; LIEFDE et al., 2005; HAMDY et al., 2005).
Há alguns séculos atrás, os patologistas definiram osteoporose como um aumento na porosidade do osso significando uma redução na mineralização da massa óssea. Mais tarde, esse conceito foi definido pelos radiologistas como um aumento da radiotransparência do esqueleto o qual é detectada na prática, quando há uma redução da ordem de mais de 30% na mineralização da massa óssea (FERRETI et al., 2003).
A densitometria óssea tem sido amplamente empregada para avaliar a densidade mineral óssea da espinha lombar e fêmur é o método DEXA (Absorciometria por Raios-X de Dupla Energia) que utiliza Raios-X como fonte de energia (MUNOZ-TORRES, 1996).
colágeno tipo 1 entre outros (SUZUKI et al., 2000; PACHECO et al., 2002; PAFUME et al., 2002).
Estudos com pacientes diabéticos tipo 1 mostraram uma diminuição nos níveis circulantes de 1,25 (OH)2D, aumento na absorção de cálcio,
hipercalciúria, e diminuição dos níveis de cálcio ionizado. Resultados semelhantes também foram observados em ratos diabéticos. Considerando que o PTH e a insulina apresentam sua ação celular mediada pela concentração de cálcio; condições que alteram a regulação do cálcio nas células-alvo alteram seus efeitos sobre as células osteoclásticas e osteoblásticas (LEVY et al., 1989).
A vitamina D é essencial para aumentar a absorção de cálcio intestinal. Certamente em indivíduos com deficiência em vitamina D apenas 15% do cálcio é absorvido da dieta e em indivíduos não deficientes 30 a 80% são absorvidos. Em relação ao cálcio o esqueleto contém mais de 98% de todo o cálcio corporal. O cálcio é mobilizado do esqueleto para manter constantes os níveis séricos de cálcio (HAMDY et al., 2005).
Um estudo conduzido por Bond et al (2005) utilizando ratos fêmeas Sprague–Dawley para avaliar o conteúdo mineral de ratos neonatos de mães diabéticas, mostrou redução no conteúdo mineral e/ou retardo no desenvolvimento esquelético em neonatos de ratos transgênicos diabético induzidos por STZ.
2 OBJETIVOS
2.1. Objetivo geral
Avaliar o efeito de TAM no tecido ósseo de ratos Wistar diabéticos por STZ, através de análise histomorfométrica do fêmur e parâmetros séricos, determinando assim a influência do TAM associado ao diabete melito na densidade mineral óssea.
2.2. Objetivos específicos
2.2.1. Acompanhar o ciclo estral, dos animais dos grupos controle (C), tamoxifeno (T), diabete (D) e diabete/tamoxifeno (DT) durante os períodos de 30, 60 e 90 dias.
2.2.2. Induzir diabete melito através de injeção intraperitoneal (i.p.) de STZ 45mg/Kg de peso corporal , nos animais dos grupos D e DT.
2.2.3. Administrar TAM durante os períodos de 30, 60, e 90 dias aos animais dos grupos T e DT e administrar solução aquosa de sorbitol 10% (veículo utilizado para dissolução de TAM, na administração aos animais) durante os períodos de 30, 60, e 90 dias aos animais do grupo C.
2.2.5. Realizar dosagens bioquímicas em amostras de sangue, dos animais dos grupos C, T, D e DT nos períodos de 30, 60 e 90 dias, de analitos relacionados ao metabolismo ósseo como fósforo, magnésio, cálcio, fosfatase alcalina, fosfatase ácida tartarato- resistente, e analitos relacionados ao metabolismo geral dos animal tais como, glicose, uréia , creatinina, proteínas totais e albumina.
3 MATERIAIS E MÉTODOS
3.1. Animais
Ratos Wistar fêmeas, com ciclo estral regular pesando entre 180-250g, foram fornecidos e mantidos pelo Biotério do Núcleo de Cirurgia Experimental Professor Travassos Sarino, do Centro de Ciências da Saúde da Universidade Federal do Rio Grande do Norte – UFRN. Durante o período experimental, os animais foram mantidos em condições padrão de temperatura em ciclos de 12 horas noite/dia, com uma dieta padrão (purina, São Paulo, Brasil) e água ad libitum.
Os procedimentos higiênicos de rotina incluíam lavagem das gaiolas plásticas e mudança diária da água durante todo período experimental.
animais diabéticos induzidos por STZ e Grupo diabetes/tamoxifeno (DT) – n=5 animais diabéticos em uso de TAM.
Os animais foram distribuídos e sacrificados nos períodos de 30, 60 e 90 dias após administração da suspensão de sorbitol v.o., administração de TAM v.o. e instalação do diabete. Os procedimentos e tratamentos dos animais foram conduzidos de forma a minimizar o sofrimento e limitar o número de espécimes necessário às investigações, de acordo com o Guide for the Care and Use of Laboratory Animals (National Research Council, 1996).
3.2. Avaliação do ciclo estral
A avaliação diária das fases do ciclo estral foi realizada de acordo com Duarte et al (2005), a coleta da secreção vaginal foi realizada utilizando um conta-gotas, contendo um pequeno volume de soro fisiológico, o qual foi introduzido na vagina do animal para liberação do soro e posterior aspiração do fluido vaginal.
O material colhido foi estendido em uma lâmina limpa e livre de gordura e a leitura a fresco dos esfregaços foi realizada através de microscopia óptica.
induzir o diabete. Apenas os animais que apresentaram o ciclo estral regular após a análise de três ciclos consecutivos foram utilizados para a indução do diabete. O ciclo estral dos animais dos grupos C, T, D e DT foi acompanhado até o período de sacrifício.
3.3. Indução do diabete melito
Após jejum alimentar de 12 horas e água ad libitum, os animais
receberam via intraperitoneal (i.p.) STZ (Sigma) dissolvida em tampão citrato de sódio 0,01 M, pH 4,5, na proporção de 45 mg/Kg de massa corporal. O quinto dia após a indução foi considerado o dia zero, sendo esse período necessário para a instalação do diabete crônico. Foram considerados diabéticos, os animais que apresentaram níveis glicêmicos igual ou superior a 250 mg/dL, associados a poliúria, polifagia, polidpsia e perda de peso corporal.
3.4. Tratamento com solução aquosa de sorbitol e TAM
Os animais do grupo C foram tratados diariamente com 0,25mL de solução aquosa de sorbitol 10% por via oral (v.o.).
3.5. Determinação da glicemia
A glicemia dos animais foi determinada utilizando-se um monitor Advantage-Boerhinger Mannheim (ROCHE), a partir de uma gota de sangue obtida de um corte superficial da extremidade da cauda do animal. Esta glicemia foi determinada no dia zero e posteriormente semanalmente de acordo com o período em estudo. Foram considerados diabéticos, apenas os animais que após receberem injeção de STZ alcançaram níveis glicêmicos iguais ou superiores à 250 mg/dL. Para os animais controles as glicemias foram determinadas no início do período e no dia do sacrifício.
A evolução da massa corporal dos animais foi paralelamente acompanhada ao longo dos períodos. Essa avaliação foi realizada no dia zero e, posteriormente, a cada intervalo de 15 dias, de acordo com o período em estudo.
3.6. Análise histomorfométrica do fêmur
A análise histomorfométrica foi realizada utilizando-se os fêmures esquerdos extraídos dos animais dos grupos C, T, D e DT nos períodos de 30, 60 e 90 dias após a instalação do diabete.
O fragmento foi então incluído em bloco de parafina e seccionado em um micrótomo rotativo em secções de 4 micrômetros de espessura. As lâminas foram levadas à estufa de secagem durante 30 min para em seguida serem coradas com hematoxilina-eosina (H & E).
As médias de quatro medidas das espessuras das trabéculas ósseas e das distâncias entre as mesmas, de cada animal, colhidas na região metadiafisária, foram obtidas empregando-se lente ocular milimetrada em microscópio Nikon, Eclipse E200, objetiva de X10, encontrando-se o resultado em milímetros, através da multiplicação do valor obtido pelo fator de correção indicado para lente com tal aumento e diâmetro (0,0078).
A Análise da percentagem de área ocupada pelo osso trabecular e medula óssea intratrabecular foi realizada utilizando microfotografias retiradas da região metadiafisária dos fêmures dos animais com aumento de X200. Essas microfotografias digitalizadas foram processadas através do programa
Photostudio 5.5 SE, empregando-se a ferramenta Tilling 3D grid, com grade
tamanho médio. A planimetria foi feita por superposição de pontos observadas na secção, e a contagem dos pontos realizada em todas as transecções incluídas no osso trabecular, excetuando-se os pontos das bordas da imagem. Foi utilizado o princípio Delesse, o qual estabelece que a fração do volume Vvi (fração de volume oculpada por i) de uma componente i (densidade volumétrica) em um tecido, pode ser estimada pela medida da fração de área AAi (fração de área da secção de i). A fração Ppi (fração de pontos testes
incluídos em i) de pontos localizados nas transecções de i dividida por PT
Vvi = AAi
Vvi =
T
P
Ppi
O percentual foi encontrado usando-se a média da fração de volume de densidade de cada animal em cada grupo. A análise histomorfométrica dos fêmures dos animais C, T, e DT foi realizada com a colaboração do Laboratório de Patologia Clínica da Universidade Federal do Rio Grande do Norte – UFRN.
3.7. Preparação das amostras de sangue
As amostras de sangue destinadas a determinação dos parâmetros bioquímicos foram obtidas de animais do grupo C, T, D e DT, submetidos a um jejum alimentar, água ad libitum, por cerca de 10-12 horas, nos períodos de 30,
60 e 90 dias após o dia zero. Os animais foram sacrificados por deslocamento cervical e submetidos a laparotomia para coleta de cerca de 6mL de sangue através de punção cardíaca. O sangue coletado sem anticoagulante, foi centrifugado utilizando uma centrífuga Sigma (Modelo 2k15, Alemanha) a 1.000g por 10 minutos. O soro obtido foi utilizado para determinar a glicemia, a atividade das enzimas fosfatase alcalina e fosfatase ácida tartarato resistente e as concentrações séricas de cálcio, fósforo, magnésio, creatinina, uréia, proteínas totais e albumina.
3.8. Avaliação dos parâmetros bioquímicos
A determinação da concentração de glicose foi realizada utilizando-se como amostra 10 µL do soro dos animais de acordo com a metodologia Labtest da enzima glicose oxidase/peroxidase. O peróxido de hidrogênio formado reage com a 4-aminoantipirina e fenol sob ação catalizadora da peroxidase através de uma reação oxidativa de acoplamento uma antipirilquinonimina vermelha cuja intensidade de cor é proporcional à concentração da glicose na amostra.
A determinação da concentração de glicose foi medida por espectrofotometria através da leitura da absorbância em 500 nm, em um analisador automático COBAS MIRA (Roche , Suíça).
3.8.2. Determinação da atividade da fosfatase alcalina (E.C. 3.1.3.1)
A atividade da fosfatase alcalina total foi determinada utilizando-se 20
Foi considerada uma unidade de enzima a quantidade de fosfatase alcalina que hidrolisa 1,0 mmoL de 4-nitrofenilfosfato por min, a 37 oC. A
determinação da concentração de fosfatase alcalina foi medida por espectrofotometria através da leitura da absorbância em 650 nm, em um espectrofotômetro RA 50 (Bayer Diagnósticos, Irlanda).
3.8.3. Determinação da atividade da fosfatase ácida tartarato-resistente (E.C. 3.1.3.2)
A atividade da TRAP foi determinada utilizando-se 100 µL da amostra de soro dos animais a metodologia BioSystems Reagents & Instruments.
A fosfatase ácida presente na amostra catalisa, em meio ácido, a hidrólise do grupo fosfato do α-naftil fosfato. O α-naftol formado reage com um sal de diazonio originando um cromógeno. A atividade catalítica foi determinada a partir da velocidade de formação do cromógeno, tendo sido a absorbância determinada em 405 nm, utilizando um espectrofotômetro RA 50 (Bayer Diagnósticos, Irlanda).
A reação ocorre a partir da mistura de 1,0 mL da solução reagente e 100
µL da amostra de soro, seguido de agitação e inserção em um porta cubeta termostatizado à 37oC. As leituras foram efetuadas a cada minuto durante 3 min.
A determinação da concentração do cálcio total foi realizada em amostras de soro dos animais nos grupos C,T, D e DT sendo necessário um volume de 15 µL de acordo com a metodologia. O cálcio reage com a púrpura de ftaleína em meio alcalino formando um complexo de cor violeta que é medido em 570 nm, em um analisador automático COBAS MIRA (Roche, Suíça )
3.8.5. Determinação da concentração do fósforo
A determinação da concentração do fósforo foi realizada em amostras de soro dos animais nos grupos C,T, D e DT sendo necessário um volume de 10 µL de acordo com a metodologia Labtest.
O método se baseia na reação do fósforo presente na amostra com o molibdato na presença de ácido sulfúrico, havendo a formação do complexo fosfomolibdato que foi medido por espectrofotometria através da leitura da absorbância em 340 nm, em um espectrofotômetro COBAS MIRA (Roche, Suíça ).
3.8.6. Determinação da concentração de magnésio
O método se baseia na reação do magnésio presente na amostra com o calmagite em meio alcalino, havendo a formação de um complexo colorido que foi medido por espectrofotometria através da leitura da absorbância em 520 nm, em um analisador automático COBAS MIRA (Roche, Suíça ).
3.8.7. Determinação da concentração de uréia
A determinação da concentração de uréia foi realizada utilizando-se como amostra 10µL do soro dos animais nos grupos C,T, D e DT de acordo com a metodologia Labtest. A uréia é hidrolisada pela urease a íons amônia e CO2. Os íons amônia reagem em pH alcalino com salicilato e hipoclorito de
sódio, sob a ação catalisadora do nitroprussiato de sódio, para formar azul de indofenol. A formação de cor é proporcional à quantidade de uréia na amostra. A absorbância do teste e padrão foi obtida em 600 nm que foi medido em um analisador automático COBAS MIRA (Roche, Suíça).
3.8.8. Determinação da concentração de creatinina
A determinação da concentração de creatinina foi realizada utilizando o soro dos animais sendo nos grupos C,T, D e DT necessário um volume de 20
µL, de acordo com o metodologia Labtest do picrato alcalino.
pode ser medido por espectrofotometria através da leitura da absorbância em 500 nm, em um espectrofotômetro COBAS MIRA (Roche, Suíça).
A adição de um acidificante abaixa o pH para 5,0 promovendo a decomposição do picrato de creatinina permanecendo inalterada a cor derivada dos cromogênios, que também é medida fotometricamente. A diferença entre as duas leituras fornece o valor da creatinina .
3.8.9. Determinação da concentração de proteínas totais
A determinação da concentração das proteínas totais foi realizada utilizando-se 20µL como amostra o soro dos animais nos grupos C,T, D e DT de acordo com o metodologia Labtest do Biureto.
As proteínas do soro reagem com o biureto desenvolvendo coloração roxa, proporcional à concentração protéica da amostra. A quantificação das proteínas totais foi medida por espectrofotometria através da leitura da absorbância em 545 nm, em um analisador automático COBAS MIRA (Roche, Suíça ).
3.8.10. Determinação da concentração de albumina
A determinação da concentração de albumina foi realizada em amostras de soro dos animais nos grupos C,T, D e DT sendo necessário um volume de 5
O método se baseia na reação da albumina presente na amostra com o verde de bromocresol em meio ácido, havendo a formação de um complexo colorido que será medido por espectrofotometria através da leitura da absorbância em 630 nm, em um analisador automático COBAS MIRA (Roche, Suíça ).
4 ANÁLISE ESTATÍSTICA
5 RESULTADO
5.1. Avaliação do ciclo estral
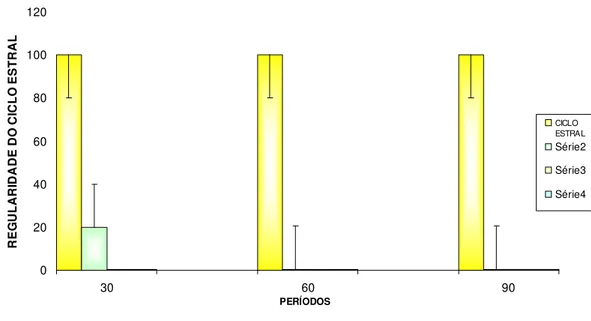
Em relação aos animais controle, as fases do ciclo estral apresentaram-se regulares durante todos os períodos estudados (30 60 e 90 dias).
Já para o grupo T apenas 20% dos animais apresentaram ciclo estral regular durante o período 30 dias e nos períodos 60 e 90 dias todos se tornaram irregulares. Para os animais do grupo D e DT, observou-se que as fases do ciclo estral tornaram-se irregulares logo após a indução, até o fim dos períodos de 30, 60 e 90 dias.
0 20 40 60 80 100 120
30 60 90
PERÍODOS R E G U L A R ID A D E D O C IC L O E S T R A L CICLO ESTRAL Série2 Série3 Série4
5.2. Análise Histomorfométrica
A espessura das trabéculas ósseas (Figura 2) encontrou-se diminuída nos animais do grupo D em relação aos do grupo C a partir de 30 dias sendo essa diminuição mais efetiva nos períodos 60 e 90 dias. Para os animais do grupo T, observou-se manutenção da espessura óssea, com valores sempre próximos aos controles e o grupo DT foi notado aumento significativo da espessura óssea quando comparado ao grupo D nos períodos 30, 60 e 90 dias. 0 0,01 0,02 0,03 0,04 0,05 0,06
30 60 90
Período (dias) E sp es su ra t ra b ec u la r (m m ) C T D DT
Figura 2 – Espessura trabecular dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias. Os resultados são expressos como média ± desvio padrão. * (p < 0,01 ) DT vs D (30, 60 e 90 dias).
*
Um aumento da distância intertrabecular foi encontrado nos animais do grupo D comparado aos do grupo C em todos os períodos estudados. A Figura 3 mostrou ainda uma redução da distância entre trabéculas no osso dos animais do grupo DT a partir do período 30 dias em relação ao grupo D, sendo esta redução significativa no período 90 dias. Nos animais dos grupos T não foi observado alteração nos períodos estudados quando comparado ao grupo controle. 0,00 5,00 10,00 15,00 20,00 25,00 30,00 35,00 40,00
30 60 90
Períodos (dias) D is tâ n ci a tr ab ec u la r (m m ) C T D DT
Figura 3 – Distância intertrabecular dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias. Os resultados são expressos como média ± desvio padrão. * (p < 0,01 ) DT vs D (90 dias).
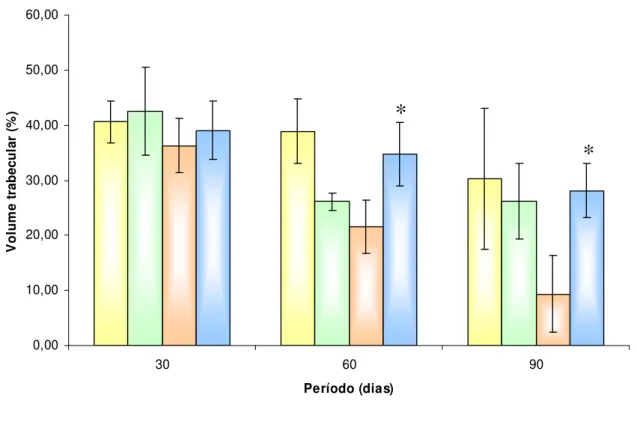
A Figura 4 mostra a análise histomorfométrica das secções ósseas e do volume trabecular ósseo (%) nos períodos 30, 60 e 90 dias para os animais C, T, D e DT. Foi possível observar um aumento do volume ósseo trabecular para os animais do grupo DT em todos os períodos estudados sendo este aumento significativo em 60 e 90 dias quando comparado ao grupo D. Em relação ao grupo T não observou-se variação significativa quando comparado ao controle.
0,00 10,00 20,00 30,00 40,00 50,00 60,00
30 60 90
Período (dias) V o lu m e tr ab ec u la r (% ) C T D DT
Figura 4 – Volume trabecular (%) dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias. Os resultados são expressos como média ± desvio padrão. * (p < 0,01 ) DT vs D (60 e 90 dias)
*
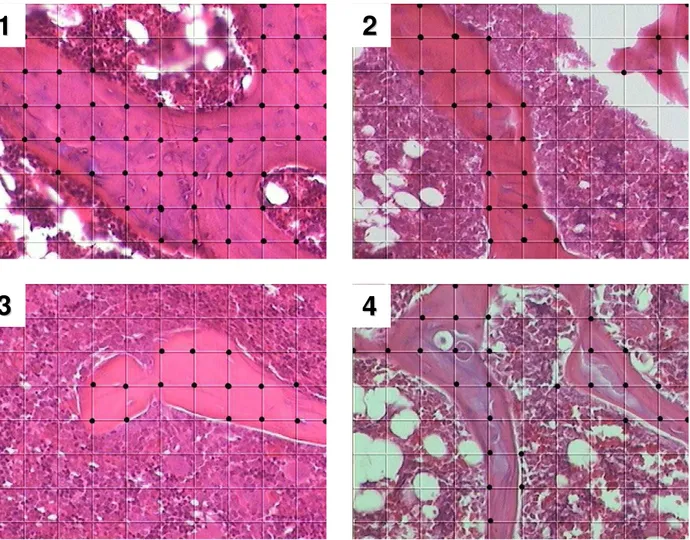
A figura 5 mostra simultaneamente a proporção de trabéculas ósseas presentes no espaço medular e o volume ósseo trabecular no período de 30 dias, sendo possível observar um discreto aumento da área trabecular para os animais do grupo DT (4) em relação ao D (3), não havendo alteração para o grupo T (2) comparado ao grupo C (1) .
Figura 5 – Análise histomorfométrica das secções ósseas e volume ósseo trabecular (%) do fêmur esquerdo de ratos controle (1), tratados com TAM (2), diabéticos (3) e diabéticos tratados com TAM (4) no período de 30 dias. Coloração HE. Amplificação 100x.
2
2
4
4
1
1
3
Figura 6 – Análise histomorfométrica das secções ósseas e volume ósseo trabecular (%) do fêmur esquerdo de ratos controle (1), tratados com TAM (2), diabéticos (3) e diabéticos tratados com TAM (4) no período de 60 dias. Coloração HE. Amplificação 100x.
1
1
4
4
2
2
Figura 7 – Análise histomorfométrica das secções ósseas e volume ósseo trabecular (%) do fêmur esquerdo de ratos controle (1), tratados com TAM (2), diabéticos (3) e diabéticos tratados com TAM (4) no período de 90 dias. Coloração HE. Amplificação 100x.
1
1
4
4
2
2
3
5.3. Caracterização do estado diabético
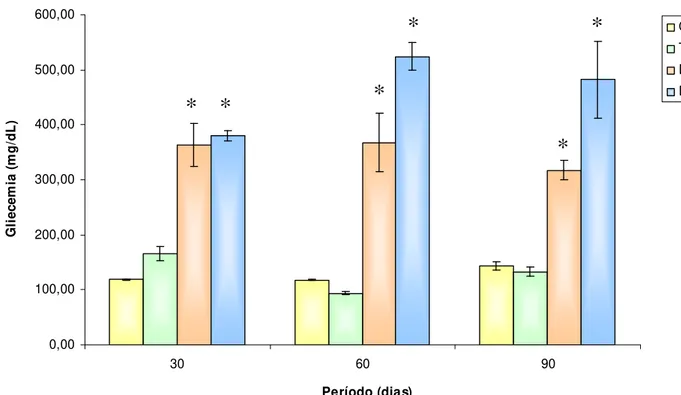
A caracterização do estado diabético dos animais em estudo foi realizada através do acompanhamento dos níveis glicêmicos e da evolução do peso corporal de cada animal além da observação dos quadros de polifagia, polidipsia e poliúria durante os períodos 30, 60 e 90 dias após a instalação do diabete .
0,00 100,00 200,00 300,00 400,00 500,00 600,00
30 60 90
Período (dias) G li ec em ia ( m g /d L ) C T D DT
Figura 8 – Glicemia dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias. Os resultados são expressos como média ± desvio padrão. * (p < 0,01 )D vs CeT / DT vs CeT (30, 60 e 90 dias)
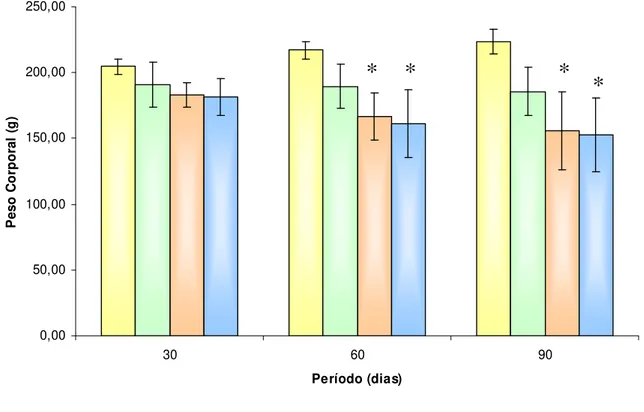
Em relação ao peso corporal dos animais, avaliados nos períodos de 30, 60 e 90 dias, observou-se que os animais do grupo D e DT apresentaram perda de peso corporal progressiva quando comparados com os animais dos grupos C e T, após a instalação do diabete, sendo significativa nos períodos 60 e 90 dias.
* *
*
0,00 50,00 100,00 150,00 200,00 250,00
30 60 90
Período (dias) P es o C o rp o ra l (g ) C T D DT
Figura 9 – Peso corporal dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante o período de 30, 60 e 90 dias. Os resultados são expressos como média ± desvio padrão. * (p < 0,01) D vs C e T, DT vs C e T ( 60 e 90 dias).
5.4. Avaliação de parâmetros bioquímicos
Os resultados do teste de Tukey para os parâmetros bioquímicos, embora baseado em amostras pequenas, apontam diferenças estatisticamente significantes entre diversas comparações dos grupos, especialmente entre os animais do grupo C e os animais dos grupos D e DT, bem como entre esses últimos e o grupo que fez uso de TAM.
B
*
*
A avaliação dos parâmetros bioquímicos foi realizada em amostras de sangue (soro) de ratos dos grupos C, T, D e DT, nos períodos 30, 60 e 90 dias após a instalação do diabete.
5.4.1 Fosfatase alcalina (FAL) (E.C.3.1.3.1.) e fosfatase ácida tartarato resistente (TRAP)(E.C.3.1.3.2.)
A atividade sérica da fosfatase alcalina foi analisada durante os períodos de 30, 60 e 90 dias em ratos dos grupos C, T, D e DT. O grupo D apresentou valores de atividade sérica para FAL significativamente mais elevados quando comparado aos obtidos para o grupo C durante os períodos de 30, 60 e 90 dias.
0,00 200,00 400,00 600,00 800,00 1.000,00 1.200,00 1.400,00 1.600,00
30 60 90
Período (dias) F o sf at as e A lc al in a (U /d L ) C T D DT
Figura 10 – Atividade da fosfatase Alcalina dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante o período de 30, 60 e 90 dias. Os resultados são expressos como média ± desvio padrão. * (p < 0,01) D vs C e T, DT vs C e T
A atividade sérica da TRAP acompanhada durante os períodos 30, 60 e 90 dias em ratos dos grupos C, T, D e DT, manteve-se inalterada como mostra a figura 11.
GRUPOS/PERÍODOS 30 DIAS 60 DIAS 90 DIAS
C
6,07
7,23
6,31
T
5,57
6,61
7,52
D
5,94
5,93
6,06
DT
6,25
6,12
5,57
Figura 11 – Atividade da TRAP dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante o período de 30, 60 e 90 dias. Os resultados são expressos como média.
5.4.2. Cálcio, magnésio
5.4.3.Fósforo
Em relação ao fósforo a Figura 12 mostra uma diferença significativa entre os grupos D e DT e os demais grupos no período 30 dias. Nos períodos 60 e 90 dias não foram observadas diferenças significativas nos grupos estudados. 0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00
30 60 90
Período (dias) F ó sf o ro ( m g /d L ) C T D DT
Figura 12 - Níveis séricos de Fósforo dos animais controles (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias. Os resultados são expressos como média ± desvio padrão. (p < 0,01) D vs C e T, DT vs C e T (30 dias).
5.4.4. Proteínas totais
Em relação à dosagem de proteínas totais, os animais do grupo C para os períodos de 30, 60 e 90 dias apresentaram-se dentro dos valores de referência para este analito.
Os animais diabéticos por sua vez apresentaram níveis semelhantes em relação aos animais do grupo C, o que indica nos períodos estudados 30, 60 e 90 dias, que os níveis de proteínas totais não sofreram influência da instalação do diabetes.
Para os grupos T e DT não foram observadas diferenças significativas.
0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00 9,00 10,00
30 60 90
Período (dias) P ro te ín as T o ta is ( g /d L ) C T D DT
dias. Os resultados são expressos com média ± desvio padrão. * (p < 0,01)
5.4.5. Albumina
Para os níveis séricos de albumina durante os períodos 30, 60 e 90 dias (Figura 14), não foi observada diferença entre os grupos C, T e D, mas foi notada uma discreta diminuição para os grupos DT no período 60 dias em relação aos demais grupos. No período 90 dias observou-se uma diminuição significativa dos grupos D e DT em relação a C e T.
0,00 1,00 2,00 3,00 4,00 5,00 6,00
30 60 90
Período (dias) A lb u m in a (g /d L ) C T D DT
Figura 14 - Níveis séricos de Albumina dos animais controles (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90
dias. Os resultados são expressos com média ± desvio padrão. * (p < 0,01) D e DT vs C e T ( 90 dias).
5.4.6. Uréia
A determinação da concentração sérica de uréia, realizada nos grupos C, T, D e DT durante o período de 30, 60 e 90 dias (Figura 15) revelou que o tratamento com TAM não promoveu alteração nos níveis de uréia em relação aos animais do grupo C, mas para o grupo D e na associação do diabete melito e TAM houve nos períodos de 30, 60 e 90 dias, um aumento significativo da concentração sérica de uréia em relação aos grupos C e T.
0,00 20,00 40,00 60,00 80,00 100,00 120,00
30 60 90
Período (dias) U ré ia ( m g /d L ) C T D DT
Figura 15 - Níveis séricos ureia dos animais controles (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos
tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias. Os resultados são expressos com média ± desvio padrão. * (p < 0,01) D e DT vs C e T (30, 60 e 90 dias).
5.4.7. Creatinina
Os valores obtidos para a concentração sérica de creatinina nos grupos estudados, não revelou nenhuma alteração no período de 30 e 60 dias, uma vez que estes resultados estão dentro do intervalo dos valores referência para a creatinina. Já para o período 90 dias observou-se um aumento significativo de creatinina nos grupos D e DT quando comparado ao grupo C.
0,00 0,50 1,00 1,50 2,00 2,50
30 60 90
Período (dias) C re at in in a (m g /d L ) C T D DT
Figura 16 - Níveis séricos de creatinina dos animais controle (C), animais tratados com TAM (T), animais diabéticos (D) e animais diabéticos tratados com TAM (DT), durante os períodos de 30, 60 e 90 dias. Os
resultados são expressos com média ± desvio padrão. * (p < 0,01) D e DT ( 90 dias)
6 DISCUSSÃO
Em função da ação estrogênica e antiestrogênica do TAM, e da importância da insulina na síntese de estrógeno, observou-se a grande necessidade de acompanhar o ciclo estral dos animais.
Variações na concentração plasmática de estrógeno, como as que ocorrem no ciclo estral, alteram o metabolismo ósseo. Na mulher, os marcadores da reabsorção óssea apresentam pico de elevação próximo à ovulação e durante a fase lútea. Com relação ao metabolismo mineral, a absorção intestinal do cálcio é máxima no período periovulatório da mulher e da rata (OCARINO et al., 2003).
A avaliação do ciclo estral dos ratos fêmeas Wistar, realizada durante pelo menos 3 ciclos completos (4-6 dias cada) e consecutivos antes da indução do diabete melito por STZ e posteriormente durante todo o período de estudo (30, 60 e 90 dias) até o sacrifício dos animais, permitiu identificar a regularidade no ciclo. A vantagem deste procedimento é reconhecida por ser um método preciso, sensível e rápido para identificar as fases do ciclo estral (proestro, estro, metaestro e diestro) e definir os animais que apresentaram ciclo estral regular (ALLEN, 1922; DUARTE et al., 2005).
importante para a síntese do hormônio esteróide, estrógeno, bem como para a própria atuação do mesmo (PORETSKY e KALIN, 1987). Já a irregularidade do ciclo estral dos animais tratados com TAM poderia ser explicada possivelmente pelo fato deste fármaco competir com o estrogênio pelos receptores esteroídicos, impedindo assim, a ação do hormônio, necessário a manifestação normal do ciclo estral nos animais.
Além disso, o TAM eleva os níveis séricos da globulina carreadora dos hormônios sexuais e da globulina carreadora de corticosteróides, provavelmente devido ao efeito estrogênico no fígado, acarretando redução na fração livre de estrogênios, facilitando a sua ligação com o receptor esteroídico ( GEBRIM e LIMA, 2003)). Estes achados estão em concordância com outros autores (SILVA et al, 2005; JUNIOR et al, 2005).
Estudos contraditórios que envolvem animais experimentais mostram a combinação dos efeitos de ovariectomia e diabete melito na densidade mineral óssea e que a associação da falta de estrógeno e diabetes pode levar a diminuição do metabolismo ósseo com predominância da reabsorção óssea (FUKUHARO et al, 2000 DUARTE et al, 2005).