RENORBIO
Programa de Pós-Graduação em Biotecnologia
Produção e caracterização de quitooligossacarídeos
produzidos pelo fungo Metarhizium anisopliae e
avaliação da citotoxicidade em células tumorais
Cristiane Fernandes de Assis
RENORBIO
Programa de Pós-Graduação em Biotecnologia
Produção e caracterização de quitooligossacarídeos
produzidos pelo fungo Metarhizium anisopliae e
avaliação da citotoxicidade em células tumorais
Tese de Doutorado apresentada ao Programa de Pós-Graduação em Biotecnologia - PPG-B, Área de concentração: Biotecnologia Industrial Linha de Pesquisa: Bioprocessos
Cristiane Fernandes de Assis
Orientador: Everaldo Silvino dos Santos
Divisão de Serviços Técnicos
Cat alogação da Publicação na Font e. UFRN / Bibliot eca Cent ral Zila M amede
Assis, Crist iane Fernandes de.
Produção e caracterização de quitooligossacarídeos produzidos pelo fungo Metarhizium anilopliae e avaliação da citotoxicidade em células tumorais / Cristiane Fernandes de Assis. – Natal, RN, 2009.
110 f.
Orientador: Everaldo Silvino dos Santos. Co-orientador: Gorete Ribeiro de Macedo.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Tecnologia. Programa de Pós-Graduação em Biotecnologia.
1. Quitosana – Tese. 2. Glicosamina – Tese. 3. N-acetilglicosamina – Tese. 4. Quitooligossacarídeos – Tese. 5. Metarhizium anilopliae – Tese. 6. Citotoxicidade – Tese. I. Santos, Everaldo Silvino dos. II. Macedo, Gorete Ribeiro de. III. Universidade Federal do Rio Grande do Norte. IV. Título.
anisopliae e avaliação da citotoxicidade em células tumorais
Tese apresentada a Rede Nordeste de Biotecnologia (RENORBIO) para obtenção do título de Doutor em Biotecnologia.
Área de Concentração: Biotecnologia Industrial
Aprovada em 18 de janeiro de 2010 por:
Presidente
Rede Nordeste de Biotecnologia (RENORBIO)/ UFRN
1º Examinador:
____________________________________ 2º Examinador: Prof.ª Dr.ª Luciana Rocha Barros
Gonçalves Universidade Federal do Ceará (UFC) _____________________________________
3º Examinador: Prof.ª Dr.ª Sueli Rodrigues Universidade Federal do Ceará (UFC) _____________________________________ 4º Examinador: Prof.ª Dr.ª Maria de Fátima Vitória de Moura
2. REVISÃO DA LITERATURA ... 4
2.1. Quitina e Quitosana ... 4
2.2. Aplicações da quitosana ... 6
2.3. Hidrólise química e enzimática da quitosana ... 10
2.4. Produção de quitosanases ... 11
2.5. Fungo Metarhizium anisopliae ... 13
2.6. Quitooligossacarídeos ... 16
2.7. Aplicações dos Quitooligossacarídeos ... 18
2.8. Células não tumorais e tumorais ... 23
2.9. Citotoxicidade ... 24
3. REFERÊNCIAS BIBLIOGRÁFICAS... 27
4. ARTIGOS DERIVADOS DA TESE... 49
4.1. Primeiro artigo: Chitooligosaccharides enzymatic production by Metarhizium anisopliae Abstract ………..……….…. 50
Introduction ………....…….. 51
Materials and Methods ………..…...…….…….. 52
Reagents ………..………....…….. 52
Microrganism ………..………...….….. 53
Fermentation Conditions ………...… 53
Chitosanolytic activity ………...……… 53
Chitooligosaccharides Production ………. 54
Analysis and quantification of chitosan oligosaccharides ………. 54
Results and Discussion ………...…. 55
Production of Chitosanolytic activity ………..……….. 55 Detection of quantification of oligomers produced during 48 hour of 56
LISTA DE FIGURAS
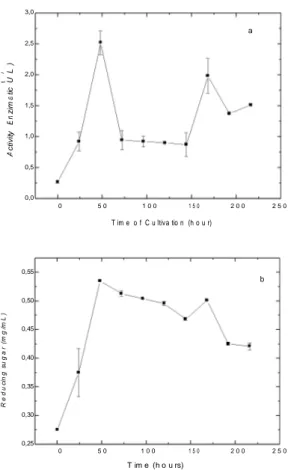
Fig. 1 (a) Production of chitosanase enzyme by M. anisopliae in medium containing chitosan 65 (0.2%), at 25ºC, 110 rpm and (b) reducing sugar produced during cultive. Values are means of triplicate replicaes with standard deviations less than 10%...
Fig. 2 Chromatograms of the (GlcN)n, 2-6 patterns (a) and of the production of COS formed 66 over 48 hours of cultivation of M. anisopliae (b). Chromatograms were performed through HPLC of Shim-Pack CLC-NH2 column. Oligomer analysis was carried out using acetonitrile (60%) as a mobile phase at a flow rate of 0.8 ml/min and a Refractive Index (RI) detector……….………...………
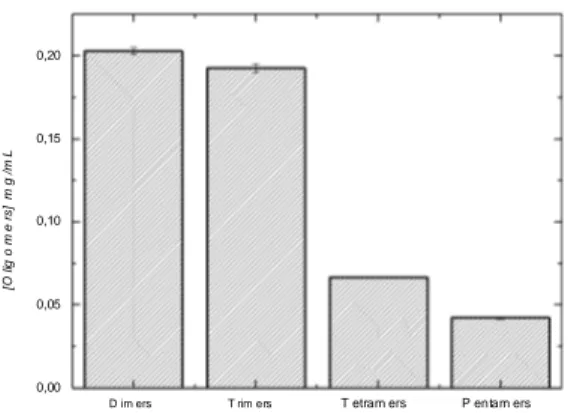
Fig. 3 Concentration of oligosaccharides (dimers to pentamers) during 48 hours of fungus 67 cultivation in medium containing 0.2% chitosan, 0.1% K2HPO4, 0.05% MgSO4, 0.5 % KCl, 0.3% yeast extract, 0.5% peptone, 0.2% NaNO3, and 0.001% FeSO4 (pH 5.5). The growth was carried out in a rotation incubator for 2 days at 25°C and 110 rpm………...………. Fig. 4 Chromatograms of hydrolyzed chitosan formed by the incubation of chitosan with the
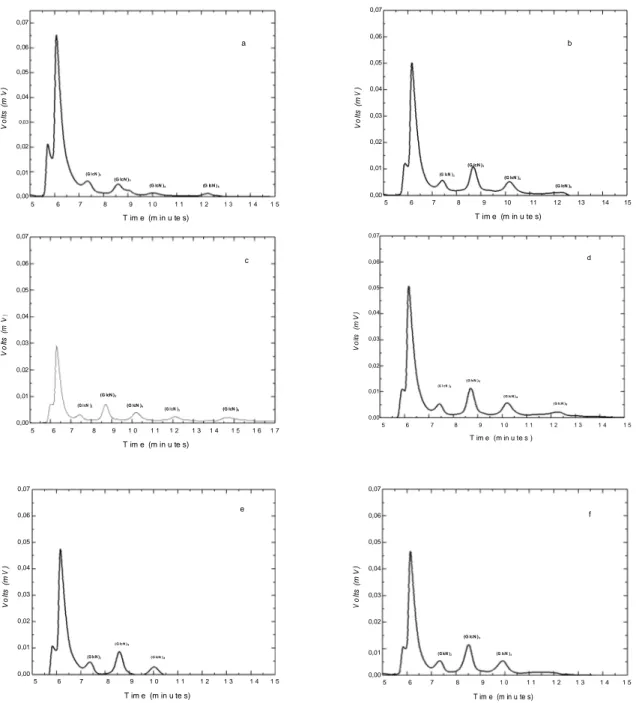
crude enzyme extract produced by the Metarhizium anisopliae fungus. (a) 10, (b) 20, (c) 30, 68 (d) 40, (e) 50, (f) 60 minutes. Chromatograms were performed through HPLC of Shim-Pack CLC-NH2 column. Oligomer analysis was carried out using acetonitrile (60%) as a mobile phase at a flow rate of 0.8 ml/min and a Refractive Index (RI) detector……….
Fig. 5 Concentration of chitosan COS by the crude enzyme extract produced by Metarhizium 70
anisopliae. Dimers (■), trimers (●), tetramers (▲), pentamers (▼) and hexamers (♦) The
results represent the ± SD mean of three experiments in triplicate………. LISTA DE TABELAS
Table 1 (GlcN) 2-6 oligomers production measured in HPLC ………...………….. 69
Reagents ……….………... 73
Preparation of chitosan ……….………. 74
Chitooligosaccharides production ………….……… 74
Hydrolysate analysis by HPLC ... 74
Cell Culture ... 74
Cell proliferation assay ………..……… 75
MTT Assay ... 75
Determination of total antioxidant capacity ... 76
Hydroxyl radical scavenging activity assay ... 76
Superoxide radical scavenging activity assay ... 76
Reducing power ... 77
Ferric chelating ... 77
Statistical analysis ... 77
Results ………...………….………….…………...………. 78
Chitosan hydrolysate composition ... 78
Assessment of cell proliferation and cytotoxicity ………..…. 78
Antioxidant activity ………... 79
Discussion and Conclusion ………..………..……….…..……. 80
Acknowledgments ………..………. 84
References ……….………... 84 LISTA DE FIGURAS
Fig. 1. Cytotoxic assessment of the effect of the olygomer mixture on HepG2, HeLa and 3T3 cells. The cells were treated with different concentrations of the olygomer mixture:
92 compound A (GlcN), (GlcN)3 (GlcN)4, (GlcN)5, compound B (GlcN), (GlcN)3 (GlcN)4, and compound C (GlcN), (GlcN)3, for 72 hours. In the absence of these compounds the reduction of MTT was considered as being 0.0%. * p < 0.05 ... Fig. 2. Cytotoxic assessment of the effect of olygomers on HepG2, HeLa and 3T3 cells. The cells were treated with different concentrations of (GLcN), (GLcN)2, (GLcN)3, (GLcN)4,
(GlcN)4, (GlcN)5], compound B [(GlcN), (GlcN)3 (GlcN)4], and compound C [(GlcN), (GlcN)3]. The results are expressed as ascorbic acid equivalents. Data are expressed as means±stardand deviation. Different letters indicates a significant difference between COS 94 by one –way Anova followed by Student -Newman-Keuls test
(p<0.05) ...
Fig.4. Reducing power of COS being Compound A [(GlcN), (GlcN)3 (GlcN)4, (GlcN)5], compound B [(GlcN), (GlcN)3 (GlcN)4], and compound C [(GlcN), (GlcN)3]. Data are
96 expressed as means ± satandard deviation. Reducing power is expressed as a percentage of the activity shown by 0.2mg/mL of acid ascorbic. ...
LISTA DE TABELAS
Table 1: (GlcN) 2-6 oligomers production by different times of hydrolysis measured in HPLC.. 91
Table 2: Hidroxil and superoxide radical scavenging and ferric chelating activity of COS…… 95
Table 3: IC50 values of chitosan oligomers according to MTT assays in HepG2, HeLa and 97 3T3 cells ……….…... ... 4.3. Terceiro artigo: Cytotoxicity of chitosan oligomers produced by crude enzyme extract from the fungus Metarhizium anisopliae Abstract ... 98
Manuscript ………..……….……… 99
Acknowledgments ………..……….……… 103
References ………..………….….…….... 103 LISTA DE FIGURAS
Figure 1: Concentration of chitooligosaccharides formed by the incubation of chitosan with 106 the crude enzyme extract during 20 minutes ……….….……….
Figure 2: Cytotoxic assessment of the effect of the oligomers mixture in HepG2 (■), HeLa
(●) and 3T3 (♦) cells. The cells were treated with different concentrations of the supernatant, for
5.1. Trabalhos futuros ... 109 LISTA DE FIGURAS
Figura 1: Estrutura da quitina e quitosana... 6 Figura 2: Mecanismo de hidrólise de uma molécula de quitosana 80% 12 desacetilada sob ação das enzimas da subclasse I, II, III... Figura 3: Placa de petri contendo o fungo Metarhizium anisopliae em meio 15 PDA ...
LISTA DE TABELAS
GlcN - 2-amino-2-deoxi-D-glicose
KDa - Quilo daltons (1000 daltons)
QCOS/COS Quitooligossacarídeos
GP - Grau de polimerização
CLAE - Cromatografia Liquída de Alta Eficiência
SD Desvio Padrão
MTT [3-(4,5-dimetiltiazol-2il)-2,5-difeniltetrazolium brometo)]
HepG2 Células de hepatocarcinoma Humano
HeLa Células de carcinoma uterino Humano
3T3 Células de fibroblastos de embrião de ratos
IC50 Concentração Inibitória de 50%
VEGF Fator de crescimento endotelial vascular
EAT Tumor de ascite de Ehrlish
SNC Sistema Nervoso Central
IL-1 Interleucina 1
PDA Potato Dextrose Agar
Aos meus pais, Vânia e J uvenal, que são muit o impor t ant es na minha vida e que não medir am esf or ços par a que eu conseguisse alcançar
meus obj et ivos. Muit o obr igada pela f or ça, pelas palavr as de incent ivo nos moment os dif íceis, pelos moment os de alegr ia. Às minhas quer idas ir mãs, Alessandr a, Camila, pelo car inho, at enção e amizade e por sempr e est ar em t or cendo por mim. Obr igada por
Ao Gr upo Volunt ár io I r mão J oão Cecílio da Cost a e ao nosso ment or J oão Cecílio, pela aj uda, f or ça e or ient ações dadas, que levar ei par a sempr e dur ant e t oda a minha vida pr of issional e pessoal.
Ao pr of essor Ever aldo, por mesmo sem conhecer meu t r abalho aceit ou me or ient ar e nunca mediu esf or ços par a me aj udar na r ealização do meu t r abalho. Os seus
ensinament os f or am muit o impor t ant es par a mim e que guar dar ei comigo t odos eles, com a cer t eza de que t odo esf or ço é válido quando se quer vencer .
A pr of essor a Gor et e, por me r eceber em seu labor at ór io e pela conf iança em mim deposit ada. Obr igada pela aj uda e pelas palavr as de incent ivo “que t udo ir ia dar
cer t o” nos moment os em que mais pr ecisamos ouvir essas palavr as.
Ao pr of essor Hugo, amigo par a t odas as hor as e t odos os moment os, obr igada por t oda a sua compr eensão e paciência com meus desesper os de f inal de t ese! Admir o muit o a sua capacidade e deu t r abalho!!!
A pr of essor a Már cia Pedr ini pelo empenho em conseguir o micr or ganismo par a a r ealização dest e t r abalho!
À banca de qualif icação pr of essor as Sueli Rodr igues e Ana Por t o pelas valiosas cont r ibuições e sugest ões apr esent adas em meu t r abalho!
À CAPES, pela concessão de bolsa de est udo e ao CNPq pelo f inanciament o do pr oj et o.
À minha amiga Gio, com quem pude apr ender bast ant e dur ant e o desenvolviment o
da t ese onde sempr e discut íamos os melhor es caminhos par a melhor o nosso
t r abalho. Obr igada pela sua at enção, car inho e est ímulo const ant e dur ant e est e
per íodo. Sou muit o f eliz por t er sua amizade, por t er passado t ant os moment os
alegr es ao seu lado e poder cont ar sempr e com você. Com a cer t eza de que agor a
t er emos uma longa caminhada no Depar t ament o de Far mácia e saiba que poder á
À Nat h, pela sua amizade e sincer idade sempr e dispost a a me aux iliar nas at ividades do labor at ór io. Obr igada pela sua dedicação!
A t odos do Labor at ór io de Engenhar ia Bioquímica, pelos moment os agr adáveis compar t ilhados dur ant e est a j or nada.
Ao Thyr one, por est ar sempr e dispost o a ensinar e aj udar .
A t odos os docent es, f uncionár ios e pós-gr aduandos do Depar t ament o de Engenhar ia Q uímica e Depar t ament o de Bioquímica que, dir et a ou indir et ament e, cont r ibuír am par a a r ealização dest e t r abalho.
À J essiane, Saint Clair (secr et ár ios do pont o f ocal UFRN) e a Kar ine (secr et ár ia da Renor bio)
nenhum efeito em células HepG2 e células de fibroblastos (3T3).
Palavras chaves: quitooligossacarídeos, quitosanases, Metarhizium anisopliae, células
any effect in HepG2 cells and fibroblast cells (3T3).
Key words: chittoligosaccharides, chitosanases, Metarhizium anisopliae, tumoral cells,
_____________________________
Capítulo 1
Introdução
1. INTRODUÇÃO
Nos últimos anos, a busca de alternativas mais eficientes para a terapia de doenças infecciosas e neoplásicas tem mobilizado profissionais de diferentes áreas. Resultados promissores têm surgido, com a utilização de substâncias produzidas por microrganismos.
A quitosana é um biopolímero hidrofílico obtido a partir da quitina (termo derivado da palavra grega Khitón, que significa carapaça, casca ou caixa de revestimento, e que designa um polissacarídeo abundante na natureza, perdendo apenas para a celulose em quantidade produzida anualmente (Senel & McClure, 2004). A quitosana é o produto da desacetilação da quitina sendo quimicamente conhecida como seu derivado N-desacetilado, embora o correto grau de desacetilação que diferencie a quitina da quitosana não esteja totalmente definido (Muzzarelli & Rocchetti, 1973). A literatura costuma aceitar materiais obtidos a partir da quitina, com grau de desacetilação superior a 75% e solúveis em ácidos como o acético e o fórmico, como sendo quitosana (Kumar, 2000).
progresso da reação. Esse método produz baixos rendimentos de pentâmeros e hexâmeros. A hidrólise enzimática tem algumas vantagens para a produção dos quitooligossacarídeos, algumas quitosanases podem catalisar a hidrólise sob condições brandas e não produzir monossacarídeos (Ming et al., 2006).
Alguns QCOS têm sido produzidos com o objetivo de se pesquisar novas substâncias com atividade antifúngica (Hirano & Nagao, 1989), antibacteriana (Cheng & Li, 2000), antitumoral (Huang, Mendis & Kim, 2006) e antioxidante (Mendis et al., 2007).
Dessa forma, o presente trabalho tem como objetivo estudar a viabilidade de produzir um extrato bruto enzimático a partir do fungo Metarhizium anisopliae para hidrolisar a quitosana produzindo QCOS. Identificar e quantificar os oligômeros produzidos, utilizando Cromatografia Liquída de Alta Eficiência (CLAE), e avaliar a proliferação celular e citotoxicidade destes QCOS em células tumorais e células normais e verificar a atividade antioxidante destes compostos in vitro.
_____________________________
Capítulo 2
Revisão da Literatura
2. REVISÃO DA LITERATURA
2.1. Quitina e Quitosana
A quitina é um polissacarídeo estrutural e constitui o segundo polímero mais abundante do planeta. É um heteropolímero linear, formando copolímero com a quitosana que apresenta o mesmo tipo de unidade monomérica a β-(1-4) N-acetilglicosamina (MacCarthy et al., 1997; Bathia & Ravi, 2000; Canela & Garcia, 2001). Como se trata de um polímero encontrado na natureza, dependendo da maneira como é extraída a quitina pode apresentar percentual de grupos amino próximo a 50% e ser facilmente confundido com a quitosana (Roberts, 1992). A quitina é extraída com abundância de fontes tais como, camarão e caranguejo, atingindo uma produção de 1010 a 1011 toneladas por ano (Kumar, 2000; Kurita, 2001). Sua imunogenicidade é excepcionalmente baixa, apesar da presença do nitrogênio. A quitina é um material semelhante a celulose em sua baixa solubilidade e reatividade química (Majeti & Kumar, 2000).
respectivamente (Furusaki et al., 1996). Modificações químicas nesses grupos têm ampliado o número de aplicações do material em diferentes áreas (Kurita, 1996).
O grau de desacetilação, grau de esterificação, grau de metilação, ou ainda, grau de substituição, juntamente com a determinação da massa molecular, são parâmetros primordiais para a caracterização de um polímero, pois através deles é possível diferenciar e, muitas vezes, explicar as propriedades físico-químicas dos polímeros com estrutura química similar (Domard, 1987). O parâmetro que diferencia quitosana e quitina é sem dúvida, o grau de desacetilação ou grau de acetilação, que são complementares entre si para o valor de 100% do grau determinado (Sannan, Kurita & Iwakura, 1976).
Figura 1. Estrutura da quitina e quitosana
2.2. Aplicações da Quitosana
A quitosana é um polímero caracterizado por propriedades específicas que revelam seu potencial para inúmeras aplicações, destacando-se sua alta biocompatibilidade. Abaixo estão algumas das aplicações da quitosana.
Nos tratamentos de efluentes industriais a quitosana age como quelante para remoção de metais pesados e resíduos (Janegitz et al., 2007), podendo remover corantes. Na indústria de alimentos atua como clarificante de sucos (Devlieghere, Vermeulen & Debevere, 2004).
Na agricultura, a quitosana pode ser usada como protetora de sementes e como estimulante do crescimento de microrganismos, produtores de quitinase, destruidoras de nematóides patogênicos e ovos (Peter, 2001). A quitosana potencializa a germinação de sementes, além de ser um agente de encapsulamento para liberação lenta de nutrientes e adubos. A mesma pode ser usada como um filme protetor biodegradável para embalagens de frutas e verduras para melhorar a sua conservação (Synowiecki & Al Khateeb, 1997). Neste caso, é um conservante ideal por suas características anti fúngicas e também por induzir a produção de quitinase (enzima de defesa contra agentes agressores) e apresentar segurança para uso humano evidenciado por estudos toxicológicos (Hirano & Itakura, 1990). Além disso, forma um filme semipermeável sobre o fruto e, por modificar a atmosfera interna do tecido, a quitosana pode retardar o amadurecimento de frutas.
Na indústria papeleira, a quitosana potencialmente poderia ser utilizada devido à capacidade de formar filmes, aumentando a resistência mecânica e impermeabilidade do papel. Ela também pode ser usada na curtição e no acabamento na fabricação de artefatos de couro (Koide, 1998).
estimular a deposição correta, montagem e orientação de fibrilas de colágeno, que são incorporados dentro dos componentes da matriz extracelular (Muzzarelli, 2009).
Vários materiais injetáveis baseados na quitosana e seus derivados têm sido usados como substitutos em ossos osteogênicos. Compostos de fosfato de cálcio quitosana e compostos fosforilados de quitosana tem sido usados para preencher defeitos no rádio e tíbia in vivo (Lee et al., 2000a, b).
A quitosana age como antiácido natural e solubiliza-se na presença de ácido gástrico estomacal, capturando íons H+ do meio e retirando o excesso de ácido gástrico do estômago elevando assim o pH. Devido à sua ação antiácida também eleva o pH da região bucal, onde atua ligando-se às bactérias que causam a placa dentária e, consequentemente, a cárie e, assim, prevenindo ambos (Goosen, 1997).
A quitosana pode inibir a replicação de bacteriófagos pelos seguintes mecanismos: a) diminuição da viabilidade da cultura de células bacterianas, b) neutralização da infectividade de partículas da fase madura no inóculo e/ou partículas da fase filha e c) bloqueio da replicação da fase de virulência (Chirkov, 2002).
A quitosana é usada como aditivo natural, em diversas áreas, no lugar dos
aditivos sintéticos. Novos produtos baseados na quitosana e seus derivados têm sido criados com sucesso para a indústria de alimentos (Muzzarelli, 2009). A Tabela 1 mostra um resumo das aplicações da quitosana em diversas áreas.
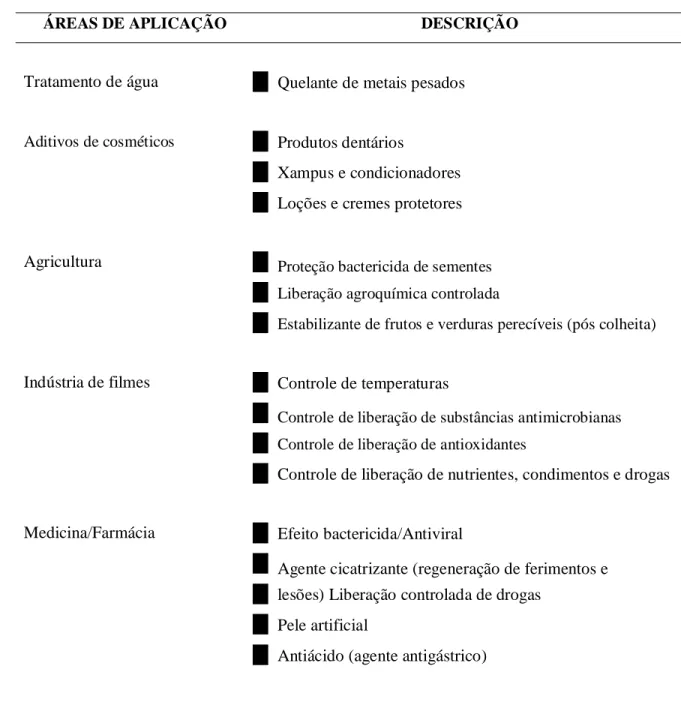
Tabela 1: Diversas áreas de aplicação da quitosana e uma pequena descrição das atividades.
ÁREAS DE APLICAÇÃO DESCRIÇÃO
Tratamento de água
Aditivos de cosméticos
Agricultura
Indústria de filmes
Medicina/Farmácia
Quelante de metais pesados
Produtos dentários
Xampus e condicionadores Loções e cremes protetores
Proteção bactericida de sementes Liberação agroquímica controlada
Estabilizante de frutos e verduras perecíveis (pós colheita)
Controle de temperaturas
Controle de liberação de substâncias antimicrobianas Controle de liberação de antioxidantes
Controle de liberação de nutrientes, condimentos e drogas
Efeito bactericida/Antiviral
Agente cicatrizante (regeneração de ferimentos e lesões) Liberação controlada de drogas
Pele artificial
2.3. Hidrólise química e enzimática da quitosana
A hidrólise da quitosana resulta em despolimerização da cadeia polimérica pela clivagem das ligações glicosídicas β-(1-4). A despolimerização da quitosana aumenta a solubilidade em água e também reduz a viscosidade da solução, facilitando a aplicação dos materiais de quitosana em várias áreas (Shin-Ya et al., 2001).
A hidrólise pode ser conduzida pelo uso de ácidos orgânicos ou inorgânicos (hidrólise química) ou pela utilização de enzimas hidrolíticas específicas ou não específicas (hidrólise enzimática), degradação oxidativa com peróxido de hidrogênio, degradação ultra-sônica, químico-enzimático (Kim & Rajapakse, 2005) e radiação (Hai et al., 2003).
A hidrólise química é um método de fácil execução, porém, esse mecanismo resulta em um baixo rendimento de oligômeros e grande quantidade de monômeros (D-glicosamina), além de não poderem ser utilizados como material bioativo devido à possível presença de contaminação por compostos químicos tóxicos; principalmente, nas hidrólises com HNO2 podem ocorrer modificações estruturais no produto final (Cabrera & Cutsem, 2005). Outro inconveniente desse método é a necessidade de utilizar altas temperaturas e grandes concentrações de reagentes, podendo causar problemas ambientais (Roncal et al., 2007).
uma alternativa efetiva com respeito à obtenção de oligossacarídeos e de polímeros de menor massa molar e, ao mesmo tempo, de custo relativo menor em comparação às enzimas específicas. Foi evidenciada a atividade hidrólitica sobre quitosana para as enzimas papaína (de origem vegetal), lípase, celulase, pectinase, glucanase e protease (de origem microbiana) –(Muzzarelli et al., 1995; Izume et al., 1992). A quitosanase, por apresentar maior especificidade, é a principal enzima utilizada para a hidrólise da quitosana.
2.4. Produção de Quitosanases
As enzimas quitosanases são um membro da família 46 do grupo glicosil hidrolase, sendo produzidos por uma grande variedade de microrganismos, incluindo bactérias, actinomicetos e fungos e, em pequena quantidade, em plantas (Chen, Xia & Yu, 2005). De uma maneira geral as quitosanases apresentam baixo peso molecular em uma faixa de 10-50 KDa (Grenier & Asselin, 1990).
& Rajapaske, 2005). De acordo a especificidade, as quitosanases são classificadas em 3 subclasses. Na classe I as enzimas quebram as ligações GlcN-GlcN ou GlcNAc-GlcN. Quitosanases da classe II quebram somente as ligações GlcN-GlcN, reconhecendo especificamente a seqüência –(GlcN)3. As enzimas da classe III quebram as ligações das unidades GlcN-GlcN e GlcN-GlcNAc (Peter, 2005; Saito et al., 1999). Na Figura 2 é possível visualizar como acontece a hidrólise de uma molécula de quitosana.
Figura 2: Mecanismo de hidrólise de uma molécula de quitosana 80% desacetilada, sob ação das enzimas da subclasse I, II e III.
Os mecanismos de hidrólise da quitosana podem variar de acordo com o tipo de quitosanase obtida, pois diferentes microrganismos produzem enzimas
com determinadas diferenças na conformação da molécula o que leva a terem mecanismos de ação hidrolíticas diferentes (Kurita et al., 1977; Sakai et al., 1991,
diversos tamanhos. As exoquitosanases hidrolisam as terminações não redutoras, resultando em produtos finais com unidades redutoras (Peter, 2005).
Muitas bactérias e fungos secretam quitosanases extracelularmente (Monaghan et al., 1973; Hedges & Wolfe, 1974; Price & Storck, 1975; Fenton & Eveleigh, 1981; 1984; Yabuki et al., 1988; Pelletier & Sygusch, 1990; Sakai et al., 1991; Boucher et al., 1992; Yamasaki et al.,1992; Shimosaka et al., 2001). As quitosanases intracelulares são encontradas em plantas (Grenier et al., 1991) e fungos zigomicetos (Reyes et al., 1985). Neste caso as enzimas estão diretamente envolvidas nas modificações da parede celular. Ambas as formas induzíveis e constitutivas são conhecidas.
2.5. Fungo Metarhizium anisopliae
A ampliação dos conhecimentos sobre a capacidade biossintética dos microrganismos permitiu o desenvolvimento da biotecnologia bem como auxiliou na aplicação de produtos. Estas perspectivas, associadas aos produtos de alto valor agregado e de interesse industrial, têm conduzido nos últimos anos a investigações e desenvolvimento de modelos que constituem as bases das novas tecnologias para processos unitários de origem microbiana (Campos-Takaki, 2005).
Os fungos são microrganismos unicelulares ou multicelulares formados por células eucarióticas. A parede celular é rica em quitina, além de galactose e manana, e alguns também podem apresentar celulose (β-1,4-glucana), como é o caso dos
Oomycota. De um modo geral, os fungos são microrganismos aeróbios, entretanto
alguns estão envolvidos diretamente nos processos fermentativos. As formas unicelulares podem formar estruturas alongadas, em condições especiais denominados pseudo – hifas. As formas filamentosas, consideradas as mais numerosas, apresentam-se como células tubulares, denominadas hifas, sendo o conjunto de hifas denominado micélio (Trufem, 2000).
A produção de esporos por fungos filamentosos é um importante estágio na reprodução do fungo e consiste na formação e liberação de conidiosporos. Essa produção de conidiosporos é diretamente relacionada com a quantidade e natureza das fontes de carbono e nitrogênio avaliadas em meio de cultura e depende de alguns fatores: modo de inoculação, presença de sais, razão de carbono e nitrogênio, aeração e conteúdo de água (Papagianni, 2004; Gárcia-Soto et al., 2006).
Os fungos entomopatogênicos exercem a função de controle de insetos em ambientes naturais e ecossistemas agrícolas, ocupando um lugar relevante na manutenção do equilíbrio ecológico. No Brasil, a utilização de fungos entomopatogênicos está na produção de ingrediente ativo de micoinseticidas, sendo o fungo Metarhizium anisopliae o mais utilizado, capaz de infectar uma grande variedade de pragas. No Nordeste o M. anisopliae é utilizado para controle da cigarrinha–da–folha da cana de açúcar (Faria & Magalhães, 2001). Ele produz enzimas quitosanolíticas, as quais têm importante papel na digestão da cutícula dos insetos durante o
deuteromiceto pertencente à ordem Moniliales, família Moniliaceae (Tulloch, 1976; Rombach, Humber, Evans, 1987).
As características morfológicas e fisiológicas do M. anisopliae apresentam grande variação em diferentes meios de cultura. Em alguns casos, ocorre alteração na coloração dos conídios em resposta à composição do meio. É tolerante a uma faixa de pH de 2,0 a 8,5, sendo 6,9 a melhor condição para o crescimento vegetativo e esporulação. Com relação à composição nutricional, é um microrganismo pouco exigente, desenvolvendo-se em diversos meios de cultura, utilizando como fonte de carbono: amido, glicose, glicerina, levulose, maltose, sacarose e quitina (Jabor et al., 2003).
2.6. Quitooligossacarídeos
Oligossacarídeos são polímeros contendo de 2 a 10 unidades de monossacarídeos unidos por ligações hemiacetálicas, denominadas ligações glicosídicas. Na polimerização de n moléculas de monossacarídeos ocorrem à liberação de n-1 moléculas de água, obtidas a partir da condensação do grupo hidroxila anomérico de um monossacarídeo com uma das hidroxilas da unidade adjacente. É essa hidroxila anomérica que confere propriedades redutoras ao monossacarídeo e reduz, principalmente, íons metálicos como cobre e prata e que se oxida a ácido carboxílico. Esses carboidratos são denominados redutores devido a essas propriedades (Ribeiro & Seravalli, 2007).
A hidrólise da quitosana é um processo similar ao que ocorre com outros polissacarídeos, onde a presença de determinados agentes rompe as ligações glicosídicas. Esse rompimento das ligações glicosídicas pode ser obtido utilizando diferentes metodologias, nas quais os produtos gerados (QCOS) variam o grau de polimerização, o número, e a seqüência das unidades de GlcN e GlcNAc no oligômero gerado.
Para a produção em grande escala de QCOS a hidrólise ácida pode ser utilizada para romper as ligações glicosídicas da quitosana, esta pode ser realizada através do uso de HCl (Domard & Cartier, 1989) ou HNO2 (Tømmeraas et al., 2001).
hidrólise da quitosana (Kittur et al., 2003; Muzzarelli et al., 2004; Pantaleone, Yalpani e Scollar, 1992; Qin et al, 2004; Yalpani & Pantaleone, 1994).
A produção dos QCOS de quitosana pode também ser realizada utilizando um complexo enzimático incluindo celulase, alfa-amilase e proteinase (Zhang et al. 1999).
A produção contínua de oligossacarídeos de quitosana tem sido estudada por muitos pesquisadores. Jeon & Kim (2000a, 2000b) desenvolveram um sistema de reator de membrana e um sistema duplo de reatores. Nos dois casos o objetivo foi aumentar a produção dos QCOS com maior grau de polimerização, minimizando a produção dos monômeros.
O sistema descontínuo de produção de oligossacarídeos utilizando enzimas livres foi realizado por Kuroiwa e colaboradores (2002) obtendo aumento da concentração dos produtos com 40 e 50 minutos de hidrólise. O sistema contínuo para a produção dos oligossacarídeos usando enzimas quitosanases imobilizadas mostrou um maior rendimento de pentâmeros e hexâmeros (Kuroiwa et al., 2003). A partir daí a utilização do sistema de enzimas imobilizadas para produção dos oligômeros de quitosana foi realizada em suportes de ágar, utilizando nanopartículas magnéticas e utilizando um biorreator de membranas (Ming et al., 2006; Kuroiwa et al., 2008, 2009).
Liu & Zeng (2009) utilizaram uma quitosanase recombinante para a produção dos quitooligossacarídeos.
A produção de QCOS usando extrato bruto de enzimas de Paenibacillus
illioisensis KJA-424 (Jung et al., 2007) e Bacillus amyloliquefaciens V656 (Liang et al.,
2.7. Aplicações Biológicas dos Quitooligossacarídeos
Os QCOS de baixo peso molecular têm recebido atenção, por causa de suas propriedades biológicas, incluindo seus efeitos inibitórios no crescimento de fungos e bactérias, atividade antitumoral associada, ativação da resposta imune. A atividade antioxidante dos QCOS tem sido bastante estudada até mesmo por estar relacionada com muitas patologias.
QCOS (N-acetilquitohexose e quitohexose) inibiram o crescimento do tumor sólido Meth A camundongos (BALB/c) transplantados em quando administrados por via endovenosa (Tokoro et al., 1988).
O macrófago é uma das células mais importantes imunocompetentes e tem um papel central na defesa imunológica do hospedeiro. Os macrófagos ativados podem liberar citocinas tais como: interleucina 1 (IL-1), fator de necrose tumoral alfa (TNF-α) e intermediários ativos de oxigênio para defender o hospedeiro contra infecção microbiana e lisar células tumorais. Esses oligômeros são captados para o interior das células através de receptores de manose presentes na superfície do macrófago (Feng, Zhao & Yu, 2004).
O Carcinoma hepatocelular é um dos mais comuns tumores sólidos e tem como características um longo estabelecimento, rápido crescimento, forte malignidade, fácil invasão e metástase. Apoptose é a morte fisiológica programada da célula e desempenha papel essencial na sobrevivência do organismo (Jones, 2001). A apoptose em células de hepatoma com drogas antitumorais poderia ser uma promissora terapia do câncer de fígado e também auxiliaria no tratamento de outras doenças. Os QCOS induziram apoptose em células de hepatocarcinoma (SMMC-7721) e o mecanismo possível é que eles regulam a expressão da proteína pró-apoptótica BAX e ativação de caspases (serino proteases), acionando o programa de apoptose da célula (Xu et al., 2008).
A metástase é um processo altamente complexo que ocorre através de múltiplos passos, os quais incluem a invasão e migração celular, transporte através do sistema circulatório, novamente invasão e crescimento em órgãos secundários (Mehlen & Puisieux, 2006), este processo representa a transição do estágio benigno para progressão maligna (Deryugina & Quigley, 2006). QCOS (derivados de quitina e quitosana) foram capazes de manifestar efeito inibitório de crescimento e antimetastático em carcinoma de pulmão de ratos com administração intramuscular (Tsukada et al., 1990). Os QCOS produzidos por fungos inibiram a proliferação celular de carcinoma hepatocelular humano (HepG2) e a metástase tumoral no pulmão de ratos in vitro e in vivo (Shen et al., 2009).
proteção ocorre devido à internalização dos QCOS no núcleo celular o que provavelmente deve induzir vias de sinalização na célula para sua proteção.
O estresse oxidativo tem sido identificado como um ponto comum para várias doenças tais como diabetes, artrite, doenças neurodegenerativas, cardiovasculares e tumores. Essas doenças estão diretamente e indiretamente relacionadas com a oxidação de biomoléculas celulares por espécies reativas de oxigênio geradas extensivamente pelos tecidos (Calabrese et al., 2005).
Em algumas doenças, tratamentos envolvendo antioxidantes têm mostrado ser efetivo em reduzir marcadores do estresse oxidativo levando ao crescente interesse na progressão do desenvolvimento mundial para explorar efetivos antioxidantes especialmente de origem natural (Mendis et al., 2007).
Os seqüestradores de radicais livres são antioxidantes preventivos e a presença destes compostos pode quebrar as sequências oxidativas em diferentes níveis (Kim & Rajapakse, 2005).
As propriedades antioxidantes dos quitooligossacarídeos têm atraído à atenção dos pesquisadores, pricipalmente, devido a sua habilidade de doar prótons. Essa propriedade depende, portanto, do grau de desacetilação e do peso molecular desses quitooligossacarídeos (Rajapakse et al., 2007).
apoptose e na progressão do ciclo celular por atenuar o estresse oxidativo exógeno (Liu & Zeng, 2009).
Os neutrófilos são uma classe de células sanguíneas leucocitárias que faz parte do sistema imunológico do organismo. Essas células em repouso têm uma expectativa de vida muito baixa principalmente quando in vitro, quando tratados com QCOS a viabilidade in vitro, produção de intermediários reativos de nitrogênio – NO e produção de intermediários reativos de oxigênio (O-2) foi aumentada, porém, os QCOS regularam negativamente os neutrófilos ativados. Esse fato chama a atenção para uma aplicação potencial dos QCOS utilizando-os em tratamento à resposta inflamatória onde ocorre extenso dano tecidual devido a prolongada sobrevivência dos neutrófilos durante o processo inflamatório (Dou et al., 2007). Em outro estudo, os QCOS mostraram capacidade pró-apoptótica nos neutrófilos quando utilizado um modelo animal (ratos com peritonite induzida por glicôgenio), por mediar a geração do ânion superóxido contribuindo para a apoptose do neutrófilo o que pode diminuir o dano tecidual causado pelos mesmos (Dou et al. 2009).
Os autores verificaram uma possível indução de apoptose nas células EAT tratadas com os QCOS. A diminuição do número de células EAT e a ascite na cavidade intraperitoneal e também a inibição especialmente em direção a pequenos vasos sanguíneos germinados foram observados quando os ratos foram tratados com os QCOS.
A heparanase está envolvida indiretamente facilitando a migração e a proliferação das células endoteliais e atuam auxiliando a invasão tumoral e metástase (Neta, Michael & Israel, 2006). Quan e colaboradores (2009) verificaram que os QCOS podem inibir competitivamente a enzima heparanase por sua semelhança estrutural com o substrato desta enzima, que trata-se de um glicosaminoglicano.
Os fatores de crescimento são responsáveis por estimular a proliferação celular mediante a regulação do ciclo celular, iniciando a mitose, mantém a sobrevivência celular, estimulam a migração celular, a diferenciação celular e também a apoptose. Guminska, Ignacak & Wojck (1996) observaram que os QCOS podem reprimir a expressão do fator de crescimento endotelial vascular (VEGF) ou inibir a secreção de tais fatores, assim inibindo a formação de novos vasos sanguíneos, isso ocorre pela diminuição da glicólise nas células EAT pela diminuição na captação de glicose em nível de ATP, provavelmente devido à inibição de variante tumor específico da piruvato quinase. Esse fato não foi observado em ratos com músculo e fígado normais.
inibidor da angiogênese provavelmente por inibir a expressão do VEGF (fator de crescimento endotelial vascular).
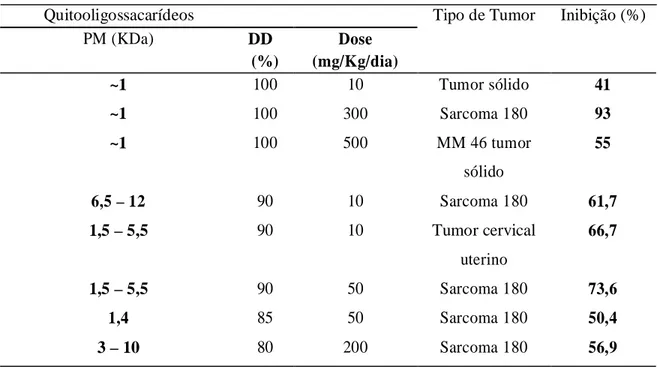
Os QCOS aumentaram a viabilidade das células de uma cultura primária das ilhotas pancreáticas de ratos, uma vez que aumentaram a proliferação destas células em altas concentrações e estimularam a liberação de insulina de 6 a 14 vezes mais quando comparada a um grupo de células normais (Liu et al., 2007). A Tabela 2 apresenta o efeito dos QCOS no crescimento de diferentes tumores.
Tabela 2: Efeito dos QCOS no crescimento de diferentes tumores
Quitooligossacarídeos Tipo de Tumor Inibição (%)
PM (KDa) DD Dose
(%) (mg/Kg/dia)
~1 100 10 Tumor sólido 41
~1 100 300 Sarcoma 180 93
~1 100 500 MM 46 tumor 55
sólido
6,5 – 12 90 10 Sarcoma 180 61,7
1,5 – 5,5 90 10 Tumor cervical 66,7
uterino
1,5 – 5,5 90 50 Sarcoma 180 73,6
1,4 85 50 Sarcoma 180 50,4
3 – 10 80 200 Sarcoma 180 56,9
Fonte: Kim & Rajapakse (2005)
2.8. Células não tumorais e tumorais
destacam-se a alta velocidade de proliferação celular, alta eficiência de clonagem, a estabilidade do cariótipo e a manutenção das características após a criopreservação.
As células HepG2 foram isoladas em 1979 por Aden e colaboradores e são uma linhagem de células derivadas de hepatocarcinoma humano de um paciente de 11 anos de idade e do sexo masculino, livre de agentes virais hepatotrópicos conhecidos que expressam uma grande variedade de funções metabólicas específicas do fígado (Javitt, 1990).
As células HeLa são as primeiras células de linhagem de câncer (Gey, Coffman & Kubiceck, 1952) e receberam essa designação porque foram retiradas de uma paciente com tumor cervial, chamada Henrietta Lacks, de 30 anos. Posteriormente descobriu-se que o que causou o tumor em Lacks foi uma infecção com HPV (Herpes Papiloma Vírus) conhecido por estar presente em grande parte dos casos de câncer cervical, e que tem marcadores moleculares que podem ser encontrados nas células HeLa (Masters, 2002).
2.9. Citotoxicidade
A determinação da toxicidade de um xenobiótico é tão importante quanto à verificação de sua atividade biológica. É de fundamental importância a análise do efeito terapêutico versus toxicidade de um composto para determinar seu índice terapêutico.
O estudo toxicológico in vivo tem sido preterido em virtude da utilização de elevado número de animais, acarretando alto custo financeiro, além de aspectos éticos questionados por entidades protetoras de animais. Desta forma, estudos in vitro têm sido cada vez mais utilizados, já que o efeito deletério de um xenobiótico em determinada linhagem celular é um indicativo da sua toxicidade in vivo. Além disto, apesar das limitações da cultura de células, os resultados obtidos são reprodutíveis (Freshnet, 1994; Rodriguez & Haun, 1999).
Citotoxicidade é a medida do potencial de um agente causar injúria celular como: alterações morfológicas, lesões na membrana, perda de atividade metabólica, viabilidade e adesão; inibição do crescimento celular; danos no material genético (genotoxicidade) e morte celular.
Estudos de citotoxicidade são realizados para avaliar a viabilidade celular, os quais podem avaliar a função celular através da integridade da membrana e de organelas, conteúdo celular (metabólito ou macromolécula) e atividade enzimática (Loveland et al., 1992; Repeto & Sanz, 1993; Olivier et al., 1995). Vários métodos foram descritos nas últimas décadas, para a avaliação da toxicidade in vitro, sendo ainda usualmente empregados:
Redução do MTT [brometo de (3-(4,5-dimetiltiazol-2-il)-2,5-difenil tetrazolio] – avalia a função mitocondrial através da atividade de enzimas como a succinato desidrogenase (Mosmann, 1983).
Incorporação do vermelho neutro (cloridrato de 2-amino-3-metil-7-dimetil-amino fenanzina) - analisa a função lisossomal (Renzi et al., 1993).
Conteúdo de ácidos nucléicos e proteínas – fornecem uma estimativa do número de células (Cingi et al., 1991).
_____________________________
Referências Bibliográficas
3. REFERÊNCIAS BIBLIOGRÁFICAS
ADEN, D. P.; FOGEL, A.; PLOTKIN, S.; DAMJANOV, I.; KNOWLES, B. Controlled synthesis of HBsAG in a differentiated human liver carcinoma-derived cell line. Nature
(London), 282, 615 - 616, 1979.
AOYAMA, H.; MELO, P. S.; GRANJEIRO, P. A.; HAUN, M.; FERREIRA, C. V. Cytotoxicity of okadaic acid and kinetic characterization of protein tyrosine phosphatase activity in V79 fibroblasts. Pharmacy and Pharmacologyl Communication, 6: 331-334, 2002.
BATHIA, S. C.; RAVI, N. A magnetic study of Fe-chitosan complex and its relevance to other biomolecules. Biomacromolecules, 1, 413 – 417, 2000.
BOUCHER, I.; DUPUY, A.; VIDAL, P.; NEUGEBAUER, W. A.; BRZEZINSKI, R. Purification and characterisation of a chitosanase from Streptomyces N174. Applied.
Microbiology and Biotechnology, 38, 188 - 93, 1992.
CABRERA, J. C.; CUTSEM, P. V. Preparation of chitooligosaccharides with degree of polymerization higher than 6 by acid or enzymatic degradation of chitosan. Biochemical
CALABRESE, V.; LODI, R.; TONON, C.; D’ ÁGATA, V.; SAPIENZA, M.; SCAPAGNINI, G.; MANGIAMELI, A.; PENNISI, G.; STELLA, A. M.; BUTTERFIELD, D. A. Oxidative stress, mitochondrial dysfunction and cellular stress response in Friedreich’s ataxia. Journal of the Neurological Science, 233: 145 – 162, 2005.
CAMPOS-TAKAKI, G.M. The versatility on copolymers chitin and chitosan production. In: DUTTA, P. K. Chitin and Chitosan opportunities & challenges. India 2005.
CANELLA, K. N. C.; GARCIA, R. B. Caracterização de quitosana por cromatografia de permeação em gel-influência do método de preparação e do solvente. Química Nova, 24 (1), 13 - 17, 2001.
CARERE, A.; STAMMATI, A.; ZUCCO, F. In vitro toxicology methods: impact on regulation from technical and scientific advancements. Toxicology Letters, 127: 153-160, 2002.
CARMELIET, P. Angiogenesis in health and disease. Nature Medicine, 9, 653–660, 2003.
CHENG, C. Y.; LI, Y. An Aspergillus chitosanase with potential for large-scale preparation of chitosan oligosaccharides. Biotechnology and Appied Biochemistry, 32, 197 - 203., 2000.
CHIRKOV, S. N. The antiviral activity of chitosan (review). Applied Biochemistry and
Microbiology, 38 (1) 1-8, 2002.
CHOI D.W. Glutamate neurotoxicity and diseases of the nervous system, Neuron 1, 623 – 634, 1988.
CINGI, M. R.; DE ANGELIS, I.; FORTUNATI, E.; REGGIANI, D.; BIANCHI, V.; TIOZZO, R.; ZUCCO, F. Choice and standardization of test protocols in cytotoxicology: a multicentre approach. Toxicology in Vitro, 5, (2) 119 - 125, 1991.
in vitro toxicity assays used to test the first 30 reference chemical. American
Theological Library Association, 24, 251 - 272, 1996.
CUERO, R. G. Antimicrobial action of exofenous chitosan. Experientia, 87, 315 – 333, 1999.
DASS, C. R.; TRAN, T. R.; CHOONG, P. F. M. Angiogenesis inhibitor and the need for antiangiogenic therapetutics. Critical Reviews in Oral Biology and Medicine, 10, 927–36, 2007.
DERYUGINA, E. I.; QUIGLEY, J. P. Matrix metalloproteinases and tumor metastasis.
Cancer and Metastasis Reviews, 25 (1), 9 - 34, 2006.
DEVLIEGHERE, F.; VERMEULEN, A.; DEBEVERE, J. Chitosan: antimicrobial activity, interactions with food components and applicability as a coating on fruit and vegetables. Food Microbiology, 21, 703 - 714, 2004.
DOMARD, A. pH and c.d. measurements on a fully deacetylated chitosan: application to CuII—polymer interactions International Journalof Biological. Macromolecules, 9, 98 - 104, 1987.
DOU, J.; TAN, C.; DU, Y.; BAI, X.; WANG, K.; MA, X. Effects of chitooligosaccharides on rabbit neutrophils in vitro. Carbohydrate Polymers, 69 (2), 209 - 213, 2007.
DOU, J.; XU, Q.;TAN, C.; WANG, W.; DU, Y.; BAI, X.; MA, X. Effects of chitosan oligosaccharides on neutrophils from glycogen-induced peritonitis mice model.
Carboydrates Polymers, 75, 119 - 124, 2009.
FARIA, M. R.; MAGALHÃES B. P. O uso de fungos entomopatogênicos no Brasil.
Biotecnologia Ciência e Desenvolvimento, 22, 18 - 21, 2001.
FASANARO, P.; MAGENTA, A.; ZACCAGNINI, G.; GICCHILLITTI, L.; FUCILI, S.; EUSEBI, F.; BIGLIOLI, P.; CAPOGROSSI, M. C.; MARTELLI, F. Cyclin D1 degradation enhances endothelial cell survival upon oxidative stress. FASEB Journal, 20, 1242 - 1244, 2006.
FENG, J.; ZHAO, L.; YU, Q. Receptor-mediated stimulatory effect of oligochitosan in macrophages. Biochemical and Biophysical Research Communication, 317, 414 - 420, 2004.
FRESHNEY, R. I. In: Culture of Animal Cells. A manual of basic technique. 3rd. Ed. Wiley-Liss, 1994.
FURUSAKI, E.; UENO, Y.; SAKAIRI, N.; TOKURA, S. (1996). Faciel preparation and inclusion ability of a chitosan derivative bearing carboxymethyl-β-Cyclodextrin.
Carboydrate Polymers, 9, 29 - 34, 1996.
GARCÍA-SOTO, M. J.; BOTELLO-ÁLVAREZ, E.; JIMÉNEZ-ISLAS, H.;NAVARRETE-BOLAÑOS, J.; BARAJAS-CONDE, E.; RICO-MARTÍNEZ, R. Growth morphology and hydrodynamics of filamentous fungi in submerged cultures
Advances in Agricultural and Food Biotechnology, 17 - 34, 2006.
GEY, G. O.; COFFMAN, W. D.; KUBICECK, M. T. Tissue culture studies of the proliferation capacity of cervical carcinoma cell and normal epithelium. Cancer
Research, 12, 264 - 265, 1952.
GOOSEN, M. F. A. Aplications of chitin and chitosan. Lancaster: technomic, 1997, 336.
GRENIER, J.; BENHAMOU, N.; ASSELIN, A. Colloidal gold-complexed chitosanase: a new probe for ultrastructural localisation of chitosan in fungi. Journal of General
Microbiology, 137, 2007 – 2015, 1991.
GROTH, T.; FALCK P.; MIETHKE R. R. Cytotoxicity of biomaterials – basic mechanisms and in vitro test methods: a review. American Theological Library
Association, 23, 790 – 799, 1995.
GUMINSKA, M.; IGNACAK, J.; WOJCK, E. In vitro inhibitory effect of chitosan and its degradation products on energy metabolism in Ehrlich ascites tumor cells (EAT). Polish Journal of Pharmacology, 48, 495 – 501, 1996.
HAI, L.; DIEP, T.B.; NAGASAWA, N.; YOSHII, F.; KUME, T. Radiation depolymerization of chitosan to prepare oligomers. Nuclear Instruments and Methods in
Physics Research B, 208, 466 - 470, 2003.
HEDGES, A.; WOLFE, R. S. Extracellular enzyme from Myxobacter Al-l that exhibits both b-l-4 glucanase and chitosanase activities. The journal of Bacteriology, 120, 844 - 853, 1974.
HIRANO, S.; ITAKURA, C. Chitosan as na ingredient for domestic animal feeds.
HUANG, R. E.; MENDIS, E.; RAJAPAKSE, N.; KIM, S. K. Strong electronic charge as an important factor for anticancer activity of chitooligosaccharides (COS) Life
Science 78(20): 2399-2408, 2006.
ITO, M.; HIDAKA, Y., NAKAJIMA, M., YAGASAKI, H., HAFRAWY, A. H. Effect of hydroxyapatite content on physical properties and connective tissue reations to a chitosan – hidroxyapatite composite membrane. Journal of Biomedicals Matterials
Resesearch, 45 (3) 204 - 208, 1999.
IZUME, M.; NAGAE, S.; KAWAGISHI, H.; MITSUTOMI, M.; OHTAKARA, A. Action pattern of Bacillus sp. No. 7-M chitosanase on partially N-acetylated chitosan.
Bioscience. Biotechenology and Biochemistry, 5 (3), 448 - 453, 1992.
JABOR, I, A. S.; PAMPHILE J. A.; RODRIGUES, S.B.; MARQUES-SILVA, G. G.; ROCHA, C. L. M. S. C. Análise do desenvolvimento do fungo entomopatogênico
Metarhizium anisopliae em resposta a fatores nutricionais. Acta Scientiarum Agronomy,
25 (2), 497 - 501, 2003.
JEON, Y. J.; KIM, S. K. Production of chitooligosacchades using ultrafiltration membrane reactor and their antibacterial activity. Carboydrate Polymers, 41, 133 - 141, 2000a.
JEON, Y. J.; KIM, S. K. Continuous production of chitooligosaccharides using a dual reactor system. Process Biochemistry, 35, 623 – 632, 2000b.
JONES, A.M. Programmed cell death in development and defense. Plant Physiology, 125, 94 - 97. 2001.
JUNG, W-J.; SOULEIMANOV, A.; PARK, R-D.; SMITH, D. L. Enzymatic production of N-acetyl chitooligosaccharides by crude enzyme derived from Paenibacillus
illioisensis KJA-424. Carboydrate Polymers 67: 256-259, 2007.
KIM, S. Y.; SHON, D. H.; LEE, K. H. Purification and characteristics of two types of chitosanases from Aspergillus fumigatus. Journal of Microbiology and Biotechnology, 8, 568 – 574, 1998.
KIM, S. K.; RAJAPAKSE, N. Enzymatic production and biological activies of chitosan oligosaccharides (COS): a review. Carbohydrate Polymers, 62, 357 - 368, 2005.
KITTUR, F. S.; KUMAR, A.; GOWDA, L. R.; THARANATHAN, R. N.
Chitosanolysis by a pectinase isozyme of Aspergillus niger—A non-specific activity.
KOIDE, S. S. Chitin-Chitosan: Properties, Benefits and Risks. Nutrition Research, 18, 1091 – 1101, 1998.
KUMAR, M. N. V. R. A review of chitin and chitosan applications. Reactive and
Functional Polymers, 46, 1 - 27, 2000.
KUO, C. H.; CHEN, C.C.; CHIANG B. H. Properties process characteristics of hydrolysis of chitosan in a continuous ezymatic membrane reactor. JFS E: Food
Engineering and Physical, 69, 332 - 337, 2004.
KURITA, K. Chemical modifications of chitin and chitosan. Chitin in nature and Technology, (Muzarelli, R. A. A.; Jeuniaux, C.; Gooday, G. W. Eds.). pp 287-293, Plenum Press New York, USA, 1996.
KURITA, K. Controlled functionalization of the polysaccharide chitin. Progress in
Polymer Science, 26, 1921 - 1971, 2001.
KUROIWA, T.; ICHIKAWA, S.; HIRUTA, O.; SATO, S.; MUKATAKA S. Factors affecting the composition of oligosaccharides produced in chitosan hydrolysis using immobilized chitosanases. Biotechnology Progress, 18, 969 - 974, 2002.
KUROIWA, T.; IZUTA, H.; NABETANI, H.; NAKAJIMA, M.; SATO, S.; MUKATAKA, S.; ICHIKAWA S. Selective and stable production of physiologically active chitosan oligosaccharides using an enzymatic membrane bioreactor. Process
Biochemistry, 44, 283 - 287, 2009.
KUROIWA, T.; NOGUCHI, Y.; NAKAJIMA, M.; SATO, S.; MUKATAKA, S.; ICHIKAWA, S. Production of chitosan oligosacchades using chitosanase immobilized on amylose – coated magnetic nanoparticles. Process Biochemistry, 43, 62 - 69, 2008.
KUROIWA, T.; SOSAKU, I.; SATO, S.; MUKATAKA, S. Improvement of yield of physiologically active oligosaccharides in continuous hydrolysis of chitosan using immobilized chitosanases. Biotechnology and Bioengineering, 84 (1), 121 - 127, 2003.
LEE, H. W.; CHOI, J. W.; HAN, D. P.; PARK, M. J.; LEE, N. W.; YI, D. H. Purification and characteristics of chitosanase from Bacillus sp. HW-002. Journal of
Microbiology and Biotechnology, 6, 19 – 25, 1996.
LEE, Y-M.; PARK, Y-J.; LEE, S-J.; KU, Y.; HAN, S-B.; KLOKKEVOLD, P-R.; CHUNG, C-P. The bone regenerative effect of platelet-derived growth factor delivered with a chitosan/tricalcium phosphate sponge carrier. Journal of Periodontology, 71, 418–424, 2000b.
LIANG, T-W.; CHEN, Y-J.; YEN, Y-H.; WANG, S-L. The antitumor activity of the hydrolysates of chitinous materials hydrolyzed by crude enzyme from Bacillus
amyloliquefaciens V656. Process Biochemistry, 42(4), 527 – 534, 2007.
LIU, Z. H.; ZENG, S. Cytotoxicity of ginkgolic acid in HepG2 cells and primary rat hepatocytes. Toxicology Letter, 131-136, 2009.
LIU, B.; LIU, W-S.; HAN, B-Q.; SUN, Y-Y. Antidiabetic effects of
Chitooligosaccharides on pancreatic islet cells in streptozotocin-induced diabetic rats.
World Journal of Gastroenterology, 13 (5), 725-731, 2007.
LOVELAND, B. E.; JOHNS, T. G.; MACKAY, I. R.; VAILLANT, F.; WANG. Z. X.; HERTZOG, P. J. Validation of the MTT dye assay for enumeration of cells in proliferative and antiproliferative assays. Biochemistry International, 27: 501-510, 1992.
MACCARTHY, M.; PRATUM, T.; HEDEGES, J.; BENNER, R. Chemical
MAJETI, N. V.; KUMAR, R. A review of chitin and chitosan applications. Reactive
and Functional Polymers, 46, 1-27, 2000.
MASTERS, J. R. HeLa cells 50 years on: the good, the bad and the ugly. Nature
Reviews Cancer, 2, 315-319, 2001.
MEHLEN, P.; PUISIEUX, A. Metastasis: a question of life or death. Nature Reviews
Cancer, 6, 449-458, 2006.
MILKIEWICZ, M.; ISPANOVIC, E. Regulators of angiogenesis and strategies for their therapeutic manipulation. International Journal of Biochemistry & Cell Biology, 38, 333–357, 2006.
MING, M.; KUROIWA, T.; ICHIKAWA, S.; SATO, S.; MUKATAKA, S. Production of chitosan oligosaccharides by chitosanase directly immobilized on an agar gel-coated multidisk impeller. Biochemical Engineering Journal, 28, 289-294, 2006.
MENDIS, E.; KIM, M. M.; RAJAPAKSE, N.; KIM, S. An in vitro cellular analysis of radical scavenging efficacy of chitooligosaccharides. Life Sciences, 80, 2118 – 2127, 2007.
MOSMANN, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunoogical Methods, 65, 55 - 63, 1983.
MUZZARELLI, R.A.; ROCCHETTI, R. The determination of molybdenum in sea water by hot graphite atomic absorption spectrometry after concentration on p-aminobenzylcellulose or chitosan. Analytica Chimica Acta, 64, 371 - 379, 1973.
MUZZARELLI, C.; STANIC, V.; GOBBI, L.; TOSI, G.; MUZZARELLI R. A. A. Spray-drying of solutions containing chitosan together with polyuronans and characterization of the microspheres. Carboydrate Polymers,57, 73 - 82, 2004.
MUZZARELLI, R. A. A. Chitins and chitosan for the repair of wounded skin, nerve, cartilage and bone. Carboydrates Polymers, 76, 167 - 182, 2009.
MUZZARELLI, R.; XIA, W.; TOMASETTI, M.; ILARI, P. Depolymerization of chitosan and substituted chitosans with the aid of a wheat germ lipase preparation.
Enzyme and Microbial Technology, 17, 541 – 545, 1995.
NETA, I.; MICHAEL, E.; ISRAEL, V. Regulation, function and clinical significance of heparanase in cancer metastasis and angiogenesis. The International Journal of
OLIVIER, P.; TESTARD, P.; MARZIN, D.; ABBOTT, D. Effect of high polyol concentrations on the neutral red absorption assay and tetrazolium-MTT test of rat hepatocytes in primary culture. Toxicology in vitro, 9, 133 - 138, 1995.
PANDIAN, R. P.; KUTALA, V. K.; LIAUGMINAS, A.; PARINANDI, N. L.; KUPPUSANY, P. Lipopolysaccharides-induced alterations in oxygen consuption and radical generation in endothelial cells. Molecular and Cellular Biochemistry, 278, 119 - 127, 2005.
PANTALEONE, D.; YALPANI, M.; SCOLLAR, M. Unusual susceptibility of chitosan to enzymic hydrolysis. Carbohydrate Research, 237, 325–332, 1992.
PAPAGIANNI, M. Fungal morphology and metabolite production in submerged mycelial processes. Biotechnology Advances, 22, 189 - 259, 2004.
PELLETIER, A.; SYGUSCH, J. Purification & characterisation of three chitosanase activities from Bacillus megaterium Pl. Applied Environmental Microbiology, 56, 844 - 848, 1990.
PETER, M. G. Chitin and chitosan from aninal sources. In: STEINBUCHEL, A.; RHEE, S.K. Polysaccharides and Polyamides in the Food Industry. Weinheim: Wiley-vch,. v. 1. p. 115-208, 2005.
PRASHANTH, K. V. H.; THARANATHAN, R. N. Depolymerized products of chitosan as potent inhibitors of tumor-induced angiogenesis. Biochimica et Biophysica
Acta (BBA) - General Subjects, 1722(1), 22-29, 2005.
PRICE, J. S.; STORCK, R. Production, purification and characterisation of an extracellular chitosanase from Streptomyces. The Journal of Bacteriology, 124, 1574-85, 1975.
QUAN, H.; ZHU, F.; HAN, X.; XU; Z.; ZHAO, Y.; MIAO Z. Mechanism of anti-angiogenic activities of chitooligosaccharides may be through inhibiting heparanase activity. Medical Hypotheses, 73, 205–206, 2009.
QIN, C.; ZHOU, B.; ZENG, L.; ZHANG, Z.; LIU, Y.; DU, Y.; XIAO, L. The physicochemical properties and antitumor activity of cellulase-treated chitosan. Food
Chemistry, 84, 107–115, 2004.
RAJAPAKSE, N.; KIM, M. M.; MENDIS, E.; KIM, S. Inhitition of free radical-mediated oxidation of cellular biomolecules by carboxylated chitooligosaccharides.
RENZI, D.; VALTONILA, M.; FOSTER, R. The evaluation of a multi-endpoint citotoxicity assay system. American Theological Library Association, 21, 89-96, 1993.
REPETTO, G.; SANZ, P. Neutral red uptake, cellular growth and lysosomal function: in vitro effect of 24 metals. American Theological Library Association, 21, 501-507, 1993.
REYES, F.; LAHOZ, R.; MARTINEZ, M. J.; ALFONSO, C. Chitosanases in the autolysis of Mucor rouxii. Mycopathologia, 89, 181-7, 1985.
RIBEIRO, E. P.; SERAVALLI, E. A. G. Química de Alimentos. São Paulo: Edgard Blucher, 2. ed. 2007, 184p.
ROBERTS, G. A. F. Chitin Chemistry, London, Macmillan, 349, 1992.
RODRIGUEZ, J.A.; HAUN, M. Cytotoxicity of trans-dehydrocrotonin from Croton cajucara on V79 cells and rat hepatocytes. Planta Medica, 65, 1-5, 1999.
ROLLER, S.; COVILL, N. The antifungal properties of chitosan in laboratory media and apple juice. International Journal Food Microbiology, 47, 67 – 77, 1999.
RONCAL, T.; OVIEDO, A.; ARMENTIA, I. L.; FERNANDEZ, L.; VILLARAN, M. C. High yield production of monomer-free chitosan oligosaccharides by pepsin catalyzed hydrolysis of a high deacetylation degree chitosan. Carbohydrate Research, 342, 2750-2756, 2007.
SAITO, J; KITA A.; HIGUCHI, Y.; NAGATA, Y.; ANDO, A.; MIKI, K. Cristal structure of chitosanase from Bacillus circulans MH-K1 at 1.6-A resolution and its substrate recognition mechanism. The Journal of Biological Chemistry, 274, 30818-30825, 1999.
SANNAN, T.; KURITA, K.; IWAKURA, Y. Studies on chitin: Effect of deacetylation on solubility. Die Makromoleculare Chemiel, 177, 3589 – 3600, 1976.
SAKAI, K.; KATSUMI, R.; ISOBE, A.; NANJO, F. Purification and hydrolytic action of a chitosanase from Nocardia orientalis. Biochemica et Biophysica. Acta, 1097, 65-72, 1991.
SEINO, H.; TSUKUDA, K.; SHIMASUE, Y. Properties and action pattern of a chitosanase from Bacillus sp. PI- 7S. Agricultural Biological Chemistry, 55, 2421 - 2423, 1991.
SENEL, S.; MCCLURE, S.J. Potential applications of chitosan in veterinary medicine.
SHAHIDI, F.; ARACHCHI, J. K. V.; JEON, Y. J. Food applications of chitin and chitosans. Trends in Food Science & Technology. 10, 37-51, 1999.
SHEN, K-T.; CHEN, M-H.; CHAN, H-Y.; JENG, J-H.; WANG, Y-J. Inhibitory effects of chitooligosaccharides on tumor growth and metastasis. Food and Chemical
Toxicology, 47, 1864-1871, 2009.
SHIMOSAKA, M.; NOGAWA, M.; WANG, X.Y.; KUMEHARA, M.; OKAZAKI, M.; SHIN –YA, Y.; LEE, M.Y.; HINODE, H.; KAJIUCHI, T. Effect of N-acetylation degree on N- acetylated chitosan hydrolisis with commercially avaliable and modified pectinases. Biochemical Engineering Journal, 7, 85-88, 2001.
SHIN-YA, Y.; LEE, M-Y.; HINODE, H.; KAJIUCHI, T. Effects of N-acetylation degree on N-acetylated chitosan hydrolysis with commercially available and modified pectinases. Biochemical Engineering Journal, 7, 85–88, 2001
SOMOSHEKAR, D.; JOSEPH, R. Chitosanases - Properties and applications: a review.
Bioresource Technology, 55, 35-55, 1996.
EU/COLIPA in vitro phototoxicity validation study results of phase II (blind trial). Part I: the 3T3 NRU phototoxicity test. Toxicology in vitro 12, 305-327,1998.
SUZUKI, K.; TOKORO, A.; OKAWA, Y.; SUZUKI, S.; SUZUKI, M. Enhancing effects of N- acetyl-chito-oligosaccharide on the active oxygen –generating and microbicidal activities of peritoneal exudate cells in mice. Chemical & Pharmaceutical
Bulletin, 33, 886-888, 1986.
SYNOWIECKI, J.; AL- KHATEEB, N. A. Q. Mycelia of Mucor rouxii as a source of chtin and chitosan. Food Chemistry, 60 (4) 605 -610, 1997.
TOKORO, A.; TATEWAKI, N.; SUZUKI, K.; MIKAMI, T.; SUZUKI, S.; SUZUKI, M. Growth_inhibitory effect of hexa-N-acetylchitohexaose and chitohexaose against Meth-A solid tumor. Chemical and Pharmaceutical Bulletin, 36,784-790, 1988.
TØMMERAAS, K.; VARUM, K. M.; CHRISTENSEN, B. E.; SMIDSROD, O. Preparation and characterisation of oligosaccharides produced by nitrous acid depolymerisation of chitosans. Carbohydrate Research, 333, 137-144, 2001.
TRABULSI, L. R.; ALTHERTUM, F.; GOMPERTZ, O. F.; CANDEIAS, J. A. N. Microbiologia. São Paulo, Atheneu: 4 ed. 2004, 110p.
TSUKADA, K.; MATSUMOTO, T.; AIZAWA, K.; TOKORO, A.; NARUSE, R.; SUZUKI, S.; SUZUKI, M. Antimestastatic and growth-inhibitory effects of N-acetylchitohexaose in mice bearing lewis lung carcinoma. Japanese Journal of Cancer
Research, 81, 259 -265, 1990.
TULLOCH, M. The genus Metarhizium anisopliae. Transaction. British. Mycoogical.
Society, 66, 407-11, 1976.
WANG, G. Inhibition and inativation of five species of foodborne pathogens by chitosan. Journal Food Protection, 55, 916-919, 1992.
XIONG, C.; WU, H.; WEI, P.; PAN M.; TUO Y.; KUSAKABE, I.; DU, Y. Potent angiogenic inhibition effects of diacetylated chitohexaose separated from chitooligosaccharides and its mechanism of action in vitro. Carboydrate Research. DOI 10. 1016/j.carres.2009.06.36.
XU, Q.; DOU, J.; WEI, P.; TAN, C.; YUN, X.; WU, Y.; BAI, M. A, X.; DU, Y. Chitooligosaccharides induce apoptosis of human hepatocellular carcinoma cells via up-regulation of Bax. Carboydrates Polymers, 71, 509-514, 2008.