DEPARTAMENTO DE ODONTOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM PATOLOGIA ORAL
PEDRO CARLOS DA ROCHA NETO
EXPRESSÃO IMUNO-HISTOQUÍMICA DAS PROTEÍNAS IFN- E
TGF-
β
1 EM CISTOS RADICULARES E CISTOS DENTÍGEROS
-2012-Pedro Carlos da Rocha Neto
EXPRESSÃO IMUNO-HISTOQUÍMICA DAS PROTEÍNAS IFN- E
TGF-
β
1 EM CISTOS RADICULARES E CISTOS DENTÍGEROS
Natal/RN
-2012-Dissertação apresentada ao Programa de Pós-Graduação em Patologia Oral da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para obtenção do título de Mestre em Patologia Oral.
Rocha Neto, Pedro Carlos da.
Expressão imuno-histoquímica das proteínas IFN- e TGF- 1 em cistos radiculares e cistos dentígeros / Pedro Carlos da Rocha Neto. – Natal, RN, 2012.
80f. : il.
Orientador: Prof.Dr. Antonio de Lisboa Lopes Costa.
Dissertação (Mestrado em Patologia Oral) – Universidade Federal do Rio Grande do Norte. Centro de Ciências da Saúde. Programa de Pós-Graduação em Patologia Oral.
1. Cisto Radicular – Dissertação. 2. Cisto Dentígero – Dissertação. 3. Imuno-histoquímica – Dissertação. 4. Interferon Gama –
Dissertação. 5. Fatores de Crescimento Transformadores. – Dissertação. I. Costa, Antonio de Lisboa Lopes. II. Título.
“Ao meu querido e saudoso irmão Antônio Carlos da Rocha Ramalho, que partiu para
eternidade tão cedo, porém deixando um legado de alegria nos corações de quem o conheceu”.
“Aos meus pais, Antônio Cruz Ramalho e Maria das Graças da Rocha Ramalho, como forma de retribuição por tudo o que eles investem em mim tão amorosamente”.
“Aos meus irmãos João Carlos da Rocha Ramalho e Dayana Karla da Rocha Ramalho, por tudo que me proporcionam como família exemplar”.
“Aos meus avós Pedro Carlos da Rocha, Raimunda Isaura da Rocha, Antônio Leite Ramalho e Severina Cruz Ramalho (in memoriam), por serem as minhas raízes e as folhas mais altas que eu quero alcançar na escalada da vida”.
“Agradeço ao meu amado Senhor e Salvador Jesus Cristo, que me deu a maior prova de amor ao morrer na cruz humilhado, para que eu pudesse ter o direito de ser chamado filho de Deus, mesmo sendo tão falho e indigno de ter os pecados perdoados por pura graça...Quão constrangedor é esse amor!”
“Agradeço aos meus pais, que sempre foram para mim um exemplo de amor, fidelidade, honestidade e de tudo o que há de melhor embaixo do céu”.
“Agradeço aos meus avós, pelo exemplo e história de vida, em que eu tanto tento me espelhar”.
“Agradeço ao meu orientador e amigo Prof. Antonio de Lisboa Lopes Costa, por sua valiosa orientação e por não me deixar desanimar nos momentos difíceis que enfrentei durante meu curso de mestrado, sempre me animando e dizendo que tudo daria certo. E de fato deu”.
“Agradeço a todos os meus amigos do mestrado e aos do doutorado, por terem muitas vezes me ajudado em minhas limitações, e por terem se tornado parte da minha vida. Eu nunca os esquecerei”.
“Agradeço a todos os meus professores do mestrado, que tanto contribuíram na minha formação intelectual e profissional, e por que não dizer pessoal, desde os meus tempos de graduação. Eu sempre os terei como referencial de dedicação e sucesso”.
“Agradeço ao prof. Paulo Roberto Medeiros de Azevedo, pela preciosa contribuição na avaliação estatística”.
“Agradeço a todos os funcionários do departamento de Patologia Oral, pela amizade que formamos ou fortalecemos durante os dois anos do meu curso de mestrado”.
Jesus era desprezado, e o mais rejeitado entre os homens, homem de dores, e experimentado nos trabalhos; e, como um de quem os homens escondiam o rosto, era desprezado, e não fizemos dele caso algum... Mas ele foi ferido por causa das nossas transgressões, e moído por causa dos nossos pecados; o castigo que nos traz a paz estava sobre ele, e pelas suas pisaduras fomos sarados.
preenchidas por líquido, células descamadas, ou outros materiais. As lesões intra-ósseas, como o cisto radicular e o cisto dentígero, apresentam um potencial de expansão capaz de promover a destruição do tecido ósseo circunjacente. Os mecanismos relacionados a esse processo de expansão são a proliferação do epitélio cístico, o aumento da osmolaridade do fluido cístico e a síntese de fatores de reabsorção óssea como IFN-γ e TGF- 1. O objetivo deste estudo foi avaliar e comparar a expressão imuno-histoquímica do IFN-γ e do TGF- 1 entre cistos radiculares e cistos dentígeros com a finalidade de compreender o papel e o comportamento dessas proteínas no processo de expansão destes cistos. Selecionamos 20 casos de cisto radicular e 20 casos de cisto dentígero retirados dos arquivos do Laboratório de Patologia Oral da UFRN. Após análise dos dados clínicos, os casos foram submetidos a técnica de coloração de rotina (HE) e ao método imuno-histoquímico para evidenciação da expressão do IFN-γ e do TGF- 1 no epitélio e na cápsula dos referidos cistos. A análise estatística dos dados utilizando o teste de Mann-Whitney revelou que não houve diferença estatisticamente significativa da imunoexpressão do IFN- entre os epitélios (p=0,565) e cápsulas (p=0,414) dos cistos radiculares e cistos dentígeros. Além disso, não houve diferença estatisticamente significativa da imunoexpressão do TGF- 1 entre os epitélios (p=0,620) e cápsulas (p=0,056) dos cistos radiculares e cistos dentígeros. O teste de Wilcoxon revelou que não houve diferença estatisticamente significativa entre as
imunoexpressões do IFN- e do TGF- 1 no epitélio (p=0,225) e na cápsula (p=0,370) dos cistos radiculares. Não houve diferença estatisticamente significativa entre as imunoexpressões do
e do TGF- 1 no epitélio (p=0,361) dos cistos dentígeros. No entanto, houve diferença estatisticamente significativa entre as imunoexpressões do IFN- e do TGF- 1 na cápsula (p=0,001) dos cistos dentígeros, sendo o TGF- 1 o que apresentou a imunoexpressão mais significativa. Diante destes resultados, concluímos que não houve diferença de expressão imuno-histoquímica do IFN-γ e do TGF- 1 entre os cistos radiculares e dentígeros e que o TGF- 1 foi mais expressivo do que o IFN-γ na cápsula dos cistos dentígeros.
Odontogenic cysts are pathologic cavities covered by odontogenic epithelium and filled by liquid, desquamated cells or other materials. The intraosseous lesions, such as radicular cyst and dentigerous cyst, present a potential of expansion capable of promoting the destruction of the surrounding osseous tissue. The mechanisms related to this process of expansion are the proliferation of cystic epithelium, the increase of the osmolarity of the cystic fluid and the synthesis of reabsorption factors such as IFN- and TGF- 1. The aim of this study was to evaluate and compare the immunohistochemical expression of IFN- and TGF- 1 between radicular cysts and dentigerous cysts in order to understand the role and behavior of these proteins in the expansion of these cysts. We selected 20 cases of radicular cyst and 20 cases of dentigerous cyst chosen from the files of UFRN’s Laboratory of Oral Pathology. After analyzing the clinical data, the cases underwent the routine staining technique (HE) and immunohistochemistry for the appearance of IFN- and TGF- 1 in the epithelium and capsule of these cysts. The statistical analysis using the Mann-Whitney test revealed no statistically significant difference in immunoexpression of IFN- between the epithelium (p = 0.565) and capsules (p = 0.414) of radicular cysts and dentigerous cysts. Moreover, there was no statistically significant difference of immunoexpression of TGF- 1 between the epithelium (p = 0.620) and capsules (p = 0.056) of radicular cysts and dentigerous cysts. The Wilcoxon test revealed no statistically significant difference between IFN- and TGF- 1 imunoexpressions in the epithelium (p = 0.225) and capsules (p = 0.370) of radicular cysts. There was no statistically significant difference between IFN- and TGF- 1 imunoexpressions in the epithelium (p = 0.361) of dentigerous cysts. However, there was a statistically significant difference between IFN- and TGF- 1 immunoexpressions in the capsule (p = 0.001) of dentigerous cysts, being TGF- 1 the factor which presented the most significant immunoexpression. Given these results, we conclude that there was no difference in immunohistochemical expression of IFN- and TGF- 1 between radicular and dentigerous cysts and that TGF- 1 was more significant than the IFN- in the capsule of dentigerous cysts.
Figura 1 - Frequências dos dados relativos a idade nos casos de CR... 38 Figura 2 - Frequências dos dados relativos a idade nos casos de CD... 38 Figura 3 - Epitélio de cisto radicular apresentando hiperplasia, espongiose e degeneração hidrópica.
Observe o infiltrado inflamatório na cápsula fibrosa. Hematoxilina-eosina (400X)... 53 Figura 4 - Epitélio de cisto dentígero apresentando poucas camadas de células. Observe o escasso
infiltrado inflamatório mononuclear e o extravasamento hemorrágico na cápsula. Hematoxilina-eosina (400X)... 53 Figura 5 - Imunomarcação do epitélio de cisto radicular pelo IFN-gama. Observe o padrão de
marcação citoplasmático. LSAB (400X)... 54 Figura 6 - Imunomarcação de epitélio de cisto radicular pelo TGF- 1. Observe a marcação nuclear e
citoplasmática. LSAB (400X)... 54 Figura 7 -Imunomarcação de epitélio de cisto dentígero pelo IFN-gama. Observe marcação nuclear
e citoplasmática. LSAB (400X)... 55 Figura 8 - Imunomarcação de epitélio de cisto dentígero pelo TGF- 1. Observe marcação nuclear e
citoplasmática. LSAB (400X)... 55 Figura 9 - Imunomarcação de células inflamatórias mononucleares e células endoteliais pelo
IFN-gama na cápsula de cisto radicular. Observe o padrão de marcação citoplasmático. LSAB (1000X).... 56 Figura 10 - Imunomarcação de células polimorfonucleares, mononucleares e células da linhagem
monocítico-macrofágica pelo TGF- 1 na cápsula de cisto radicular. Observe a marcação nuclear e citoplasmática, além do padrão de marcação da matriz extra-celular. LSAB (1000X)... 56 Figura 11 - Imunomarcação de macrófagos e fibroblastos pelo IFN-gama na cápsula de cisto
dentígero. Observe o padrão de marcação nuclear e citoplasmático. LSAB (1000X)... 57 Figura 12 - Imunomarcação de células inflamatórias mononucleares pelo TGF- 1 na cápsula de
LISTA DE TABELAS
Tabela 1 - Distribuição dos escores da marcação imuno-histoquímica para os anticorpos anti-IFN- e anti-TGF- 1 no epitélio dos cistos radiculares e dos cistos dentígeros. Natal, RN – 2012... 41 Tabela 2 - Distribuição dos percentuais de células imunopositivas para os anticorpos anti-IFN- e anti-TGF- 1 na cápsula dos cistos radiculares. Natal, RN – 2012... 43 Tabela 3 - Distribuição dos escores da marcação imuno-histoquímica para os anticorpos anti-IFN- e anti-TGF- 1 na cápsula dos cistos radiculares. Natal, RN – 2012... 44 Tabela 4 - Distribuição dos percentuais de células imunopositivas para os anticorpos anti-IFN- e anti-TGF- 1 na cápsula dos cistos dentígeros. Natal, RN – 2012... 46 Tabela 5 - Distribuição dos escores da marcação imuno-histoquímica para os anticorpos
LISTA DE ABREVIATURAS E SIGLAS
ALK5 – cinase semelhante ao receptor à activina-5 AP – proteína ativadora
BMP – proteína óssea morfogenética CD – cisto dentígero
CR – cisto radicular IFNs – Interferons
IFN- – interferon gama
IL – interleucina
JNK – c-Jun N-terminal kinase
MAPK – proteína quinase ativada por mitógeno M-CSF - fator macrofágico estimulador de colônia
MHC classe II – complexo principal de histocompatibilidade classe II NF-κB – fator nuclear κB
OPG – osteoprotegerina
RANK - receptor ativador do fator nuclear κappa
RANKL - ligante do receptor ativador fator nuclear κappa
SMAD – do inglês Mothers against decapentaplegic homolog, corresponde a fusão do nome do gene Mothers against decapentaplegic com o do gene Sma.
STAT-1 – sinal transdutor e ativador de transcrição 1 T-bet – fator de transcrição T-box
TGF- – fator de crescimento transformador beta TNF-α - fator de necrose tumoral alfa
TGF-SUMÁRIO
1 INTRODUÇÃO ... 16
2 REVISÃO DA LITERATURA ... 18
2.1 CISTO RADICULAR ... 18
2.2 CISTO DENTÍGERO ... 20
2.3 TECIDO ÓSSEO ... 22
2.4 INTERFERON-GAMA (IFN- ) ... 23
2.5 FATOR DE CRESCIMENTO TRANSFORMADOR 1 (TGF- 1) ... 25
3 PROPOSIÇÃO ... 29
4 MATERIAL E MÉTODOS ... 30
4.1 CARACTERIZAÇÃO DO ESTUDO ... 30
4.2 POPULAÇÃO... 30
4.3 AMOSTRA ... 30
4.4 CRITÉRIOS DE SELEÇÃO DA AMOSTRA ... 30
4.4.1 Critérios de inclusão ... 30
4.4.2 Critérios de exclusão ... 31
4.5 ESTUDO MORFOLÓGICO ... 31
4.6 COLETA DOS DADOS CLÍNICOS ... 31
4.7 ESTUDO IMUNO-HISTOQUÍMICO ... 31
4.7.1 Coloração pelo método imuno-histoquímico ... 32
4.7.2 Análise da marcação imuno-histoquímica ... 34
4.8 ANÁLISE ESTATÍSTICA ... 35
4.9 IMPLICAÇÕES ÉTICAS ... 35
5 RESULTADOS ... 36
5.1 ASPECTOS HISTOPATOLÓGICOS DA AMOSTRA SELECIONADA PARA O ESTUDO ... 36
5.2 ANÁLISE DESCRITIVA DE FREQUÊNCIA DOS DADOS ... 36
5.2.1 Distribuição dos dados por gênero, cor da pele, localização da lesão e sintomatologia ... 36
5.3 ANÁLISE DESCRITIVA DOS RESULTADOS IMUNO-HISTOQUÍMICOS 39
5.3.1 No epitélio ... 39
5.3.1.1 Cistos radiculares ... 39
5.3.1.2 Cistos dentígeros ... 40
5.3.2 Na cápsula ... 42
5.3.2.1 Cistos radiculares ... 42
5.3.2.2 Cistos dentígeros ... 45
5.4 ANÁLISES ESTATÍSTICAS ... 49
5.4.1 Comparação entre os grupos de cistos CR e CD com relação a imunoexpressão epitelial dos biomarcadores IFN- e TGF-β1 (teste de Mann-Whitney)... 49
5.4.2 Comparação entre os grupos de cistos CR e CD com relação a imunoexpressão, em suas cápsulas, dos biomarcadores IFN- e TGF-β1 (teste de Mann-Whitney)... 49
5.4.3 Comparação entre as imunoexpressões dos biomarcadores IFN- e TGF-β1 no epitélio e na cápsula dos CR (teste de Wilcoxon) ... 50
5.4.3.1 No epitélio ... 50
5.4.3.2 Na cápsula ... 50
5.4.4 Comparação entre as imunoexpressões dos biomarcadores IFN- e TGF-β1 no epitélio e na cápsula dos CD (teste de Wilcoxon)... 51
5.4.4.1 No epitélio ... 51
5.4.4.2 Na cápsula ... 51
6 DISCUSSÃO ... 58
7 CONCLUSÕES... 66
REFERÊNCIAS ... 67
APÊNDICES ... 73
1 INTRODUÇÃO
Os cistos são cavidades patológicas revestidas por epitélio e preenchidas por líquido, células descamadas, ou outros materiais. De acordo com sua origem, os cistos podem ser classificados em cistos de desenvolvimento, de origem desconhecida, e cistos inflamatórios, oriundos de um processo inflamatório. Os cistos de desenvolvimento podem ser de vários tipos, como o dentígero, odontogênico ortoceratinizado, gengival (alveolar) do recém-nascido, gengival do adulto, periodontal lateral, odontogênico calcificante, além de odontogênico glandular. Já os cistos inflamatórios compreendem os cistos periapicais (radiculares), periapicais residuais e o da bifurcação vestibular (NEVILLE et al., 2009).
As lesões periapicais crônicas, que são caracterizadas por destruição óssea, ocorrem como resultado da resposta imuno-inflamatória do hospedeiro a infecções bacterianas no canal radicular. A infecção que se inicia no canal radicular progride para a região periapical através do fluxo contínuo de microrganismos e seus produtos pelo forame apical (MENEZES et al., 2006; VERNAL et al., 2006; KAWASHIMA et al., 2007; MENEZES et al., 2008). A mobilização dos mecanismos de defesa na tentativa de eliminar o agente agressor pode também destruir o tecido normal e induzir à reabsorção óssea, resultando no desenvolvimento de lesões inflamatórias no osso maxilar, como os cistos radiculares (HREN E IHAN, 2009). Já os cistos dentígeros são cistos de desenvolvimento, que se originam da separação entre o folículo e a coroa de um dente não erupcionado. Sua patogênese é desconhecida, entretanto, acredita-se que ele se desenvolve pelo acúmulo de líquido entre o epitélio reduzido do órgão do esmalte e a coroa do dente (NEVILLE et al., 2009).
periapicais (TAY et al., 2004, DA SILVA et al., 2008; VERNAL et al. 2004; MENEZES et al. 2006).
A identificação do RANKL e da OPG e a elucidação da regulação do RANK no desenvolvimento e ativação dos osteoclastos têm criado novas possibilidades para o desenvolvimento de novas drogas para o tratamento da perda óssea (BAUD’HUIN et al., 2007; ANDRADE et al., 2008). Sendo assim, sabendo-se do papel central que essas três proteínas apresentam no processo de reabsorção óssea, pode-se inferir que outras moléculas que atuem sobre a síntese das mesmas apresentem papéis igualmente importantes nesse processo. Teng et al. (2005) sugeriram a existência de inter-relações complexas entre citocinas e RANK/RANKL/OPG, que podem promover a osteoclastogênese. O IFN-γ tem sido implicado como promotor da osteoclastogênese pela indução da síntese de RANKL (GAO et al., 2007; TENG et al., 2005; KOTAKE et al., 2005). Por sua vez, o TGF- 1 também tem sido associado a reabsorção óssea, pois tem se mostrado um fator indispensável na osteoclastogênese induzida por RANKL (YASUI et al., 2011; FULLER et al., 2000). Apesar disso, de acordo com alguns estudos, essas duas citocinas têm mostrado atividades contraditórias no metabolismo ósseo, a saber: o IFN-γ tanto pode inibir como induzir a osteoclastogênese; e o TGF- 1 tanto pode promover a osteoclastogênese como a osteoblastogênese (YASUI et al., 2011; GAO et al., 2007; FULLER et al., 2000).
2 REVISÃO DA LITERATURA
2.1 CISTO RADICULAR
Os cistos radiculares (CR), também denominados de cistos apicais, periapicais, periodontais apicais ou perirradiculares, são lesões odontogênicas de natureza inflamatória formados pela proliferação dos restos epiteliais odontogênicos contidos no granuloma periapical, seguido de alterações degenerativas que dão origem a cavidade cística (NEVILLE et al., 2009; NETO, DANESI, UNFER, 2004). A presença de um estímulo inflamatório é suficiente para a formação do cisto que, histologicamente apresenta-se com uma cavidade delimitada por epitélio pavimentoso estratificado não ceratinizado, preenchida por líquido e células descamadas. Mais externamente, se encontra uma cápsula de tecido conjuntivo fibroso (NEVILLE et al., 2009; REGEZI, SCIUBBA, JORDAN, 2008).
Os cistos radiculares são os cistos mais comuns da região maxilofacial, representando cerca de 55% dos cistos odontogênicos, e consistindo em 50 a 75% de todos os cistos encontrados na literatura (NEVILLE et al., 2009; REGEZI, SCIUBBA, JORDAN, 2008; JONES, CRAIG, FRANKLIN, 2006). Sua incidência entre as lesões periapicais varia de 6 a 55% (LIN, HUANG, ROSENBERG, 2007). A distribuição por idade varia da terceira à sexta décadas da vida, sendo relativamente rara a ocorrência na primeira década de vida, mesmo sendo frequentes as lesões de cárie nesse período. A maioria dos casos ocorre em indivíduos do sexo masculino e, quanto à localização, 60% ocorrem na maxila, especialmente na região anterior, seguida da região maxilar posterior, região posterior de mandíbula e por último, região mandibular anterior ((NEVILLE et al., 2009; REGEZI, SCIUBBA, JORDAN, 2008; JONES;CRAIG;FRANKLIN, 2006).
imunopatológicos. A reação imunológica de defesa na região periapical é caracterizada pela participação de várias células inflamatórias como neutrófilos, macrófagos e linfócitos, que sintetizam numerosos mediadores químicos da inflamação em resposta aos fatores irritativos bacterianos como lipopolissacarídeos. Dentre esses mediadores estão as interleucinas (IL-1, IL-2, IL-6, IL-8, IL-12), TNF-α, M-CSF, IFNs, TGF- , óxido nítrico, prostaglandinas e metaloproteinases, relacionados com a progressão e expansão da lesão (DANIN et al., 2000; VERNAL et al., 2006; KAWASHIMA et al., 2007).
Diversas teorias tentam elucidar o processo de formação da cavidade cística. A teoria da deficiência nutricional aponta que as ilhas epiteliais proliferantes tornam-se grandes, de maneira que as células mais centrais perdem sua fonte de nutrição, sofrendo degeneração e liquefação com formação da cavidade. Os restos celulares decompostos promovem um aumento na concentração de proteínas, o que favorece o transporte de fluido do tecido conjuntivo adjacente para o interior da cavidade, auxiliando o crescimento cístico (LIN, HUANG, ROSENBERG, 2007; NEVILLE et al., 2009).
Clinicamente, os CR caracterizam-se por serem uma lesão geralmente assintomática, a menos que sofram reagudização. Geralmente não causam expansão da cortical óssea, porém em alguns casos podem atingir dimensões consideráveis, causando uma tumefação dura e indolor. A presença de um dente desvitalizado é determinante para seu diagnóstico, sendo assim os testes de vitalidade pulpar do dente relacionado se mostram negativos. Cistos radiculares de longa duração podem provocar reabsorção radicular, deslocamento ou mobilidade dos dentes próximos a ele. Eles são frequentemente descobertos de maneira casual durante exames radiográficos de rotina e apresentam-se radiograficamente como uma lesão radiolúcida bem definida, de formato redondo a oval, associada ao ápice do dente acometido. Observa-se ainda perda de nitidez da lâmina dura ao nível do ápice e uma margem radiopaca estreita delimitando o cisto, que se continua com a lâmina dura acima da região apical (NEVILLE et al., 2009; REGEZI, SCIUBBA, JORDAN, 2008; NETO, DANESI, UNFER, 2004).
cápsula calcificações distróficas, extravasamento hemorrágico e imagens negativas de cristais de colesterol associadas a células gigantes multinucleadas (NEVILLE et al., 2009; REGEZI, SCIUBBA, JORDAN, 2008).
O tratamento dos CR varia desde procedimentos conservadores como tratamento endodôntico até cirurgia apical ou exodontia (NEVILLE et al., 2009).
2.2 CISTO DENTÍGERO
O cisto dentígero (CD) é o segundo tipo mais comum dos cistos odontogênicos e o mais comum entre os cistos odontogênicos de desenvolvimento, correspondendo a cerca de 20% de todos os cistos dos ossos gnáticos (NEVILLE et al., 2009; REGEZI, SCIUBBA, JORDAN, 2008). Os cistos dentígeros são cistos odontogênicos de desenvolvimento, de origem desconhecida, caracterizados por uma radiolucidez bem definida, geralmente associada a coroa de um dente incluso, impedindo a sua erupção (NEVILLE et al., 2004; GONDIM et al., 2008).
Apesar dos cistos dentígeros serem considerados de desenvolvimento, alguns casos apresentam características de patogênese inflamatória, como por exemplo, aqueles cistos que se desenvolvem subjacente a dentes decíduos com lesões radiculares ou em terceiros molares inferiores parcialmente erupcionados que desenvolvem lesões císticas ao longo da face distal ou vestibular (NEVILLE et al., 2009).
epitelial, síntese de fatores de reabsorção óssea e aumento da osmolaridade do fluido cístico (REGEZI, SCIUBBA, JORDAN, 2008).
Eles se desenvolvem com maior freqüência na segunda e terceira décadas de vida, havendo uma leve predileção pelo gênero masculino. Clinicamente, aparecem como lesões geralmente assintomáticas, descobertas em radiografias de rotina, envolvendo principalmente terceiros molares inferiores ou caninos superiores. Ele pode ocasionar uma expansão óssea na região afetada, deslocamento do dente afetado e assimetria facial. O retardo da erupção de um dente muitas vezes é um indicador de sua ocorrência (NEVILLE et al., 2009; REGEZI, SCIUBBA, JORDAN, 2008). Radiograficamente, o cisto dentígero apresenta-se mais comumente como uma lesão radiolúcida unilocular bem definida, envolvendo a coroa de um dente não erupcionado. Porém, pode se apresentar como uma radiolucidez envolvendo parte da coroa e se extendendo lateralmente ao longo da superfície radicular, ou ainda como uma radiolucidez envolvendo toda a coroa e parte das raízes, de forma que quase todo o dente se localiza dentro do cisto. Comumente, a área radiolúcida tem uma margem bem definida e muitas vezes esclerótica (NEVILLE et al., 2009; REGEZI, SCIUBBA, JORDAN, 2008).
O exame histopatológico de um cisto dentígero não inflamado revela um revestimento epitelial não ceratinizado constituído por 2 a 6 camadas de células delimitando o lúmen cístico, e uma cápsula fibrosa de tecido conjuntivo frouxo, podendo conter ainda ilhas e cordões de epitélio odontogênico. A interface epitélio-cápsula é plana. Porém, na presença de processo inflamatório, o cisto dentígero apresenta uma cápsula mais colagenizada, apresentando um infiltrado inflamatório crônico de intensidade variável. O limitante epitelial apresenta-se hiperplásico, com desenvolvimento de projeções epiteliais e aspecto escamoso mais definido (REGEZI, SCIUBBA, JORDAN, 2008; NEVILLE et al., 2009).
O diagnóstico deve ser feito com base nos critérios clínicos, radiográficos e histopatológicos da lesão (REGEZI, SCIUBBA, JORDAN, 2008; NEVILLE et al., 2009; GONDIM et al., 2008).
2.3 TECIDO ÓSSEO
O osso é um tecido dinâmico que é permanentemente remodelado num mecanismo intrínseco que integra estímulos químicos, hormonais e biomecânicos. Ao longo da vida o tecido ósseo sofre contínua remodelação por meio de um processo coordenado de reabsorção e formação óssea. A reabsorção ocorre pela ação dos osteoclastos, células derivadas da linhagem celular macrofágica, enquanto que a formação óssea se deve a ação dos osteoblastos, que são células de origem mesenquimal. A maioria das doenças ósseas é causada por um distúrbio no número e atividade das células osteoclásticas, resultando em inapropriada perda óssea que excede a capacidade compensatória dos osteoblastos (HENERT et al., 2010). O aumento da atividade osteoclástica é vista em numerosas desordens osteopênicas como a osteoporose pós-menopausa, Doença de Paget, metástases ósseas e artrite reumatóide (FUKADA et al., 2009).
A atividade macrofágica é associada ao desenvolvimento de lesões no periápice dental e a destruição óssea, através da secreção de citocinas osteorreabsortivas. Os macrófagos são considerados a maior fonte de citocinas (IL-1α, IL-1 , TNF-α), metaloproteinases e prostaglandinas, que contribuem para o processo inflamatório e o resultado destrutivo nas lesões (VERNAL et al., 2006). Os Metabólitos do ácido araquidônico (via ciclooxigenase – prostaglandinas e tromboxanos; e via lipooxigenase – leucotrienos) são encontrados em cistos dentígeros e cistos radiculares. As prostaglandinas e o TNF-α, produzidos por macrófagos ativados, são reconhecidos por estimularem a reabsorção óssea através do aumento da expressão do RANKL em osteoblastos e células estromais (TAY et al., 2004).
Os osteoblastos induzem a diferenciação dos osteoclastos através do fator de diferenciação osteoclástica (ODF), ou RANKL, em resposta a vários fatores estimuladores de sua secreção. As células progenitoras osteoclásticas reconhecem o RANKL nos osteoblastos e, através da interação célula-célula diferenciam-se em osteoclastos (KATAGIRI, TAKAHASI, 2002).
inflamatórios, como por exemplo o IFN-γ e o TGF- 1. O IFN-γ possui a capacidade de induzir a expressão de MHC classe II, e, portanto, de estimular a apresentação de antígenos aos linfócitos T, provocando assim sua ativação e consequente liberação de fatores osteoclastogênicos como RANKL e TNF-α (GAO et al., 2007) . Por sua vez, o TGF- 1 tem se mostrado um fator indispensável na osteoclastogênese induzida por RANKL (YASUI et al., 2011; FULLER et al., 2000). Apesar disso, essas duas citocinas têm mostrado atividades contraditórias no metabolismo ósseo, a saber: o IFN-γ tanto pode inibir como induzir a osteoclastogênese; e o TGF- 1 tanto pode promover a osteoclastogênese como a osteoblastogênese (YASUI et al., 2011; GAO et al., 2007; FULLER et al., 2000).
2.4 INTERFERON-GAMA (IFN- )
A citocina IFN-γ é uma proteína homodimérica, produzida por células NK e linfócitos TH1 CD4+ e T CD8+, que possui atividade antiviral e antiparasitária (SHIN et al., 2010; ABBAS,
LICHTMAN E PILLAI, 2008). Ela desempenha um papel importante na imunidade natural, sendo secretada por células NK estimuladas por ligantes ativadores na superfície de células hospedeiras infectadas ou lesadas, e indo atuar sobre os macrófagos, ativando-os para eliminação de microrganismos fagocitados. Já na imunidade adquirida, os linfócitos T secretam o IFN-γ, após serem estimulados pelo reconhecimento antigênico, com a mesma função de ativar os macrófagos. Em ambas as respostas imunológicas a secreção de IFN-γ é estimulada pelas citocinas IL-12 e IL-18, produzidas por macrófagos ativados (MUNK et al., 2011; ABBAS, LICHTMAN E PILLAI, 2008).
capacidade de promover a transcrição gênica de citocinas Th2, como IL-4 (SHIN et al., 2010; ABBAS, LICHTMAN E PILLAI, 2008; PENG, 2006). Os linfócitos Th1 CD4+ regulam as respostas imunológicas mediadas por células, marcadas pela produção de citocinas pró-inflamatórias, tais como IFN-γ, TNF-α, IL-2 e IL-12, que têm o potencial de promover destruição tecidual (SHIN et al., 2010; QUEIROZ-JUNIOR et al., 2010). Os efeitos destas citocinas sobre o metabolismo ósseo têm sido amplamente estudados, sobretudo a participação do IFN-γ, que tem mostrado atividades contraditórias sobre a osteoclastogênese, podendo atuar tanto promovendo como inibindo a reabsorção óssea (GAO et al., 2007; QUEIROZ-JUNIOR et al., 2010). O IFN-γ suprime a diferenciação osteoclástica induzida por RANKL, a partir das células precursoras de osteoclastos, assim como a função de osteoclastos maduros, por induzir a rápida degradação de TRAF6, o que resulta em forte inibição da ativação dos fatores de transcrição NF-κB e JNK, desta forma, comprometendo a cascata de sinalização para a síntese de genes específicos de osteoclastos. Sob esse aspecto, o IFN-γ age como uma citocina osteoprotetora (GAO et al., 2007; QUEIROZ-JUNIOR et al., 2010; Ji et al., 2009). Por outro lado, o IFN-γ é o indutor fisiológico da expressão de MHC classe II e, portanto, da apresentação de antígenos. Como resultado, ele é capaz de provocar a ativação de células T, que, por sua vez, realizam a secreção dos fatores osteoclastogênicos RANKL e TNF-α, desta forma funcionando como uma citocina indutora de reabsorção óssea. Sendo assim, esses dados sugerem que o IFN-γ apresenta o potencial tanto de inibir diretamente a diferenciação osteoclástica, por meio de uma atuação direta sobre as células precursoras de osteoclastos (através da degradação de TRAF6), como de promover a osteoclastogênese indiretamente, através da estimulação da apresentação de antígenos e consequente ativação de linfócitos T para produzirem fatores osteoclastogênicos. Portanto, o efeito final do IFN-γ sobre o tecido ósseo se deve ao desequilíbrio entre suas ações osteoprotetora e osteorreabsortiva, que, sob circunstâncias inflamatórias e infecciosas, é favorável a reabsorção óssea (GAO et al., 2007; KOTAKE et al., 2005).
inibitórios sobre a reabsorção óssea (FUKADA et al., 2009; ALAYAN, IVANOVSKI, FARAH, 2007; SATO et al., 2006).
A expressão de IFN-γ em cistos radiculares tem sido observada em estudos que comparam o perfil das respostas imunológicas Th1 e Th2 entre cistos radiculares e outras lesões odontogênicas, principalmente granulomas periapicais.
Fukada et al. (2009), observaram que a expressão de IFN-γ foi semelhante entre cistos radiculares e granulomas periapicais, porém os cisto radiculares, por apresentarem maior expressão de GATA-3, exibiram predominância de resposta Th2 e, portanto, menor atividade osteorreabsortiva que os granulomas periapicais, que apresentaram maior resposta Th1, uma vez que exibiram maior expressão de T-bet. O trabalho de Teixeira-Salum et al. (2010) mostrou prevalência de IFN-γ em cistos radiculares em relação a granulomas periapicais, e associou sua ocorrência a reabsorção óssea periapical ocasionada por estes cistos. Hren e Ihan (2009), comparando a resposta inflamatória de cistos radiculares com a de granulomas periapicais (GP) ocasionados por Streptococcus (GP-S) ou por bactérias anaeróbias (GP-A), observaram que a produção de IFN-γ em cistos radiculares é maior que em GP-S, mas é semelhante a de PG-A. Eles concluíram que infecções provocadas por bactérias anaeróbias provocam uma resposta inflamatória Th1, e, portanto, com maior poder osteorreabsortivo. Por sua vez, Walker et al. (2000), observaram, em cistos radiculares e granulomas periapicais, uma pequena quantidade de células IFN-γ+ comparada à quantidade de células expressando IL-4, IL-6 e IL-10. Portanto, eles concluíram que a predominância da resposta inflamatória Th2 em cistos radiculares e granulomas periapicais tem papel fundamental na modulação da resposta inflamatória e resolução destas lesões.
Trabalhos que relatem a expressão imuno-histoquímica do IFN-γ em cistos dentígeros não foram encontrados durante a revisão da literatura do presente trabalho.
2.5 FATOR DE CRESCIMENTO TRANSFORMADOR 1 (TGF- 1)
proliferação e diferenciação celular, e possuem funções essenciais durante a embriogênese (JANSSENS et al., 2005; SHI, MASSAGUE´, 2003). A família TGF- é representada por três moléculas intimamente relacionadas, originadas a partir de um ancestral comum, porém codificadas por genes diferentes. As três isoformas são TGF- 1, TGF- 2 e TGF- 3, que apresentam grande similaridade no domínio C-terminal, com nove resíduos de cisteína conservados. Porém, apesar dessa alta homologia de sequência, estudos in vivo das funções dessas três isoformas, através de genes knockouts, revelaram diferenças impressionantes, demonstrando ausência de redundância das suas funções. De modo geral, TGF- 1 é a isoforma mais abundante, sendo produzida principalmente pelo tecido ósseo e células como plaquetas, eosinófilos, linfócitos T estimulados por antígeno e fagócitos mononucleares ativados por LPS, além de osteoclastos e osteoblastos, dentre outras (JANSSENS et al., 2005; ABBAS, LICHTMAN e PILLAI, 2008; DANIN et al., 2000; TYLER et al., 1999).
TGF- 1 regula uma grande quantidade de processos biológicos como proliferação, sobrevivência, diferenciação, reconhecimento, apoptose e migração celular, e produção de matriz extra-celular, apresentando assim funções importantes nas respostas imunológicas, angiogênese, cicatrização de lesões, desenvolvimento do organismo e metabolismo ósseo. Sendo assim, devido a grande diversidade de processos nos quais TGF- 1 está envolvido, fica clara a grande importância desta citocina durante a embriogênese e na manutenção da homeostase de tecidos durante a vida (JANSSENS et al., 2005; SHI, MASSAGUE´, 2003; EHNERT et al., 2010). No caso de lesões inflamatórias periapicais, o TGF- 1 tem sido relacionado a modulação da resposta inflamatória e ao processo de reparo das mesmas (GAZIVODA et al., 2009; DANIN et al., 2000; TYLER et al., 1999).
nenhum outro tecido apresenta a grande quantidade de SLC como o tecido ósseo, o que sugere uma importante função para esta forma de apresentação do TGF- 1 no osso, provavelmente funcionando como um pool de TGF- 1 prontamente disponível (EHNERT et al., 2010; JANSSENS et al., 2005).
A ativação do TGF- 1 é promovida por processos enzimáticos que provocam a liberação do LLC da matriz extra-celular, bem como a degradação da LAP ou ruptura das ligações não covalentes entre LAP e o peptídeo maduro, possibilitando desta forma a interação dos epítopos deste último com os receptores de TGF- 1. No tecido ósseo essa ativação se dá devido a acidificação local proporcionada pelos osteoclastos, que provoca a quebra das ligações não covalentes entre LAP e o peptídeo maduro, e provavelmente também pela ação de proteases liberadas por essas células (EHNERT et al., 2010; JANSSENS et al., 2005).
Para exercer suas diversas funções após sua ativação, o TGF- 1 interage com seus receptores, que correspondem a duas proteínas transmembrana que apresentam um domínio serina/treoniona cinase citoplasmático: T RI (ou ALK5) e T RII (SHI, MASSAGUE´, 2003). A ligação do TGF- 1 ao T RII promove o recrutamento e fosforilação do T RI, que, por sua vez, provoca a ativação de cascatas de sinalização tanto pela via Smad como pela via não Smad. Na via Smad, o Smad 2 e o Smad 3 ativados se ligam ao Smad 4, e o complexo Smad 2/3/4 migra para o núcleo, onde vai atuar auxiliando a transcrição gênica. Já na via não Smad, estão envolvidas várias vias Smad independentes, tais como ramos de MAPK (YASUI et al., 2011; ZHOU, 2011; EHNERT et al., 2010). É através dessas vias que o TGF- 1 promove seus efeitos sobre o tecido ósseo (JANSSENS et al., 2005).
(EDWARDS et al., 2010), o TGF- 1 pode ser considerado uma citocina com potenciais tanto osteoprodutivo, como osteorreabsortivo.
Yasui et al. (2011) e Fuller et al. (2000) concluíram em seus estudos que o TGF- 1 é indispensável na osteoclastogênese induzida por RANKL. Por outro lado, Tachi et al. (2010) observaram que o TGF- 1 funciona como um grande potencializador da formação de osso ectópico induzida por BMP-2. Já, Ehnert et al. (2010) investigaram a hipótese de que o aumento dos níveis séricos de TGF- 1 a longo prazo em doenças crônicas como osteodistrofia hepática ou renal deve ser um potencial indutor da perda de densidade óssea associada a essas doenças. Em seu estudo eles investigaram os efeitos do TGF- 1 sobre osteoblastos humanos durante um período de cultura de 20 dias e observaram que, apesar do TGF- 1 induzir a proliferação dos osteoblastos nos estágios iniciais do experimento, a contínua estimulação dessas células desenvolveu eventos desfavoráveis a ação osteoblástica como diminuição da atividade de AP e dos níveis de BMP-2, assim como aumento da expressão de RANKL, o que ocasionou perda de função dessas células. Esses efeitos do TGF- 1 poderiam explicar a perda de densidade óssea em pacientes com doenças inflamatórias crônicas, que apresentam níveis séricos elevados de TGF- 1 por longos períodos de tempo.
3 PROPOSIÇÃO
4 MATERIAL E MÉTODOS
4.1 CARACTERIZAÇÃO DO ESTUDO
Este estudo observacional retrospectivo caracterizou-se por uma análise descritiva dos dados clínicos de pacientes apresentando CR e CD, assim como uma análise comparativa da expressão imuno-histoquímica dos biomarcadores IFN-γ e TGF- 1 no epitélio e cápsula desses cistos radiculares e cistos dentígeros.
4.2 POPULAÇÃO
Todos os casos de cistos radiculares e cistos dentígeros pertencentes ao arquivo do serviço de Anatomia Patológica do Departamento de Odontologia da Universidade Federal do Rio Grande do Norte (UFRN), Natal-RN, Brasil.
4.3 AMOSTRA
A amostra do estudo foi constituída por 40 espécimes fixados em formol a 10% e incluídos em parafina, obtidos e selecionados dentre todos os casos registrados no serviço de Patologia Oral da UFRN, sendo 20 espécimes de cistos radiculares e 20 espécimes de cistos dentígeros.
4.4 CRITÉRIOS DE SELEÇÃO DA AMOSTRA
4.4.1 Critérios de inclusão
4.4.2 Critérios de exclusão
Foram excluídos do estudo os espécimes com material insuficiente para análise imuno-histoquímica e os casos que apresentavam poucas informações clínicas dos pacientes. Também foram excluídos os casos de cisto dentígero inflamatório.
4.5 ESTUDO MORFOLÓGICO
Para o estudo morfológico, examinaram-se sob microscopia de luz (OLIMPUS CH30), as lâminas que haviam sido submetidas previamente a cortes histológicos de 5μm de espessura e coradas pela técnica da hematoxilina/eosina. Foi avaliado o tipo de revestimento epitelial, que enquadrava o espécime como caso de cisto radicular ou cisto dentígero.
4.6 COLETA DOS DADOS CLÍNICOS
Após a seleção dos casos, os dados clínicos dos pacientes foram coletados por meio de uma ficha clínica (Apêndice A), que averiguava informações sobre gênero, cor da pele, idade, bem como localização da lesão, sintomatologia e diagnóstico histopatológico. Os dados foram obtidos das fichas que acompanham o material para exame anátomo-patológico.
4.7 ESTUDO IMUNO-HISTOQUÍMICO
Para o estudo imuno-histoquímico, os espécimes emblocados em parafina foram submetidos a cortes de 3 m de espessura, que, por sua vez, foram dispostos em lâminas de vidro previamente preparadas com adesivo à base de organosilano (3-aminopropiltrietoxisilano, Sigma Chemical Co., St. Louis, MO, USA). Posteriormente, os cortes foram submetidos à técnica de
Quadro 1 Especificidade, fabricante, diluição, recuperação antigênica, tempo de incubação e clone dos anticorpos primários utilizados no estudo.
Especificidade Fabricante Diluição Recuperação antigênica
Tempo de
Incubação Clone
IFN-γ Santa Cruz
Biotechnology 1:200
Pepsina pH 1,8 a 1%,
estufa a 37°C, 60’ Overnight SC-8308
TGF- 1 Santa Cruz
Biotechnology 1:700
Pepsina pH 1,8 a 1%,
estufa a 37°C, 60’ Overnight SC-146
4.7.1 Coloração pelo método imuno-histoquímico
Como controle positivo para os anticorpos foram utilizados cortes histológicos de lesões centrais de células gigantes. O controle negativo foi estabelecido pela substituição do anticorpo primário por albumina de soro bovino (BSA) a 1% em solução tampão.
A técnica utilizada seguiu o protocolo descrito abaixo:
Desparafinização: 2 banhos em xilol, à temperatura ambiente (10 minutos cada); Re-hidratação em cadeia descendente de etanóis:
Álcool etílico absoluto I (5 minutos); Álcool etílico absoluto II (5 minutos); Álcool etílico absoluto III (5 minutos); Álcool etílico 95°GL (5 minutos); Álcool etílico 80°GL (5 minutos);
Remoção de pigmentos formólicos com hidróxido de amônia a 10% em etanol 95°, à temperatura ambiente (10 minutos);
Lavagem em água corrente (10 minutos)
Recuperação antigênica;
Lavagem em água corrente (10 minutos);
Duas passagens em água destilada (5 minutos cada);
Duas incubações dos cortes em solução de peróxido de hidrogênio 3% 10 volumes, em proporção de 1/1, para o bloqueio da peroxidase endógena tecidual (10 minutos cada);
Lavagem em água corrente (10 minutos);
Duas passagens em água destilada (5 minutos cada);
Duas passagens em solução tampão TRIS-HCl (Sigma Chemical Co., St. Louis, MO, USA) pH 7,4 (5 minutos cada);
Incubação dos cortes com anticorpos primários, em solução diluente (Antibody diluent with background reducing components, Dako North America Inc., Carpinteria, CA, USA);
Duas passagens em solução de Tween 20 a 1% em TRIS-HCl pH 7,4 (5 minutos cada); Incubação com anticorpo secundário (Biotinylated link universal, DAKO, A/S, Gloustrup, Dinamarca +System, diluição 1:200) durante 30 minutos;
Duas passagens em solução de Tween 20 a 1% em TRIS-HCl pH 7,4 (5 minutos cada); Incubação com o sistema LSAB para IFN-γ e TGF- 1;
Duas passagens em solução tampão TRIS-HCL pH 7,4 (5 minutos cada);
Revelação da reação com solução cromógena de 3,3-diaminobenzidina (Liquid DAB+ Substrate, Dako North America Inc., Carpinteria, CA, USA) (10 minutos);
Lavagem em água corrente (10 minutos); Passagens rápidas em água destilada (2 trocas);
Contracoloração com hematoxilina de Mayer, à temperatura ambiente (10 minutos); Desidratação em cadeia ascendente de etanóis:
Álcool etílico 80°GL (2 minutos); Álcool etílico 95°GL (2 minutos); Álcool etílico absoluto I (5 minutos); Álcool etílico absoluto II (5 minutos); Álcool etílico absoluto III (5 minutos); Duas passagens em xilol (2 minutos cada);
4.7.2 Análise da marcação imuno-histoquímica
Para análise imuno-histoquímica dos antígenos em todos os espécimes incluídos na amostra, o parâmetro consistiu na positividade da marcação, sendo consideradas positivas as células que exibiram coloração acastanhada no núcleo ou no citoplasma. Após o tratamento imuno-histoquímico, as células imunorreativas foram analisadas quantitativamente. A expressão imuno-histoquímica de IFN- e TGF- 1foi avaliada no revestimento epitelial e na cápsula cística dos cistos radiculares e cistos dentígeros.
No epitélio, a análise foi semi-quantitativa de acordo com o método proposto por Leonardi et al. (2003), com algumas modificações relativas aos escores de imunomarcação. Neste método, a imunomarcação epitelial foi classificada de acordo com os seguintes parâmetros, em um aumento de 400X: ≤ 10% de células imunomarcadas (escore 0); marcação em 11 a 25% das células (escore 1); marcação em 26 a 75% das células (escore 2); e, marcação em mais de 75% das células (escore 3) (Apêndice B). Para obtenção do escore (E) em cada caso, foi analisada toda a extensão do epitélio cístico disponível na lâmina histológica. Os resultados foram obtidos avaliando-se a frequência dos escores e a média relativa aos escores dos 20 casos.
células); 2 (marcação em 26 a 75% das células); e 3 (marcação em mais de 75% das células) (Apêndices C, D, E, F).
Estes procedimentos de contagem foram realizados para os dois imunomarcadores, IFN-e TGF- 1, IFN-em ambas as lIFN-esõIFN-es.
4.8 ANÁLISE ESTATÍSTICA
Com o intuito de testar as hipóteses aventadas na presente pesquisa, os resultados obtidos foram submetidos a testes estatísticos apropriados. Os dados coletados foram digitados em planilhas eletrônicas do Excel (Microsoft Office 2007 for Windows) e, posteriormente, transferidos para o programa SPSS (Statistical for Social Science version 17.0 for Windows-SPSS Inc. Chicago, Illinois, 2007) para análises estatísticas.
Para os dados clínicos, realizou-se uma análise descritiva dos dados. Já, para análise da associação dos escores de imunomarcação dos biomarcadores (IFN- e TGF- 1) no epitélio com o tipo de lesão (CR e CD), assim como, para a associação dos escores e percentuais de imunomarcação dos biomarcadores na cápsula cística com o tipo de lesão, foi realizado o teste estatístico de Mann-Whitney.
Por sua vez, para análise da correlação entre os escores de imunomarcação dos biomarcadores (IFN- e TGF- 1) no epitélio dos CR e dos CD, assim como para a correlação entre os escores e percentuais de imunomarcação dos biomarcadores na cápsula dos CR e dos CD, foi realizado o teste estatístico de Wilcoxon.
Para todos os testes estatísticos foi estabelecido o nível de significância de 5% (p 0,05).
4.9 IMPLICAÇÕES ÉTICAS
5 RESULTADOS
5.1 ASPECTOS HISTOPATOLÓGICOS DA AMOSTRA SELECIONADA PARA O ESTUDO
Em nosso estudo os achados histopatológicos dos casos diagnosticados como CR caracterizam-se pela presença de um revestimento epitelial pavimentoso estratificado não ceratinizado, variando muito em sua espessura, sendo na maioria dos casos hiperplásico (Figura 3), exibindo áreas de exocitose, espongiose, degeneração hidrópica e apresentando, em alguns casos, projeções arciformes, além de células mucosas e ciliadas. As cápsulas constituem-se de tecido conjuntivo fibroso denso, contendo quantidades variáveis de células inflamatórias, no entanto, apresentando na maioria dos casos um intenso infiltrado inflamatório predominantemente mononuclear. Além disso, observam-se, em alguns casos, imagens negativas de cristais de colesterol. Os casos de CD caracterizam-se por um revestimento epitelial pavimentoso estratificado não ceratinizado, com poucas camadas de células, se mostrando portanto, na maioria dos casos, atrófico. As cápsulas constituem-se de tecido conjuntivo fibroso de densidade variável, exibindo áreas de hemorragia, pigmentação por hemossiderina e, na maioria dos casos, um leve infiltrado inflamatório mononuclear (Figura 4). Em alguns casos, observam-se ainda ninhos de epitélio odontogênico dispersos na cápsula.
5.2 ANÁLISE DESCRITIVA DE FREQUÊNCIA DOS DADOS
Embora haja certa variação na distribuição dos dados por idade, cor da pele, gênero e localização das lesões, os dados clínicos e histopatológicos serviram para traçar o universo dos grupos selecionados para o estudo. Os dados clínicos relativos a cada caso foram coletados e os resultados dispostos no Quadro 2.
Quadro 2 Frequências dos dados referentes a gênero, cor da pele, localização da lesão e sintomatologia dos casos de cisto radicular e cisto dentígero.
VARIÁVEIS
LESÕES
CR n (%) CD n (%)
Gênero
Feminino 11 (55%) 9 (45,0%)
Masculino 9 (45,0%) 11 (55,0%)
Total n (%) 20 (100,0%) 20 (100,0%)
Cor da pele
Leucoderma 16 (80,0%) 12 (60,0%)
Feoderma 3 (15,0%) 2 (10,0%)
Melanoderma 1 (5,0%) 4 (20,0%)
Total n (%) 20 (100,0%) 18 (90,0%)
Localização
Maxila anterior 9 (45,0%) 7 (35,0%)
Maxila Posterior 1 (5,0%) 1 (5,0%)
Mandíbula Anterior 3 (15,0%) 0 (0,0%) Mandíbula Posterior 5 (25,0%) 10 (50%)
Total n (%) 18 (90,0%) 18 (90,0%)
Sintomatologia
Assintomático 12 (60,0%) 13 (65,0%)
Sintomático 4 (20,0%) 5 (25,0%)
Total n (%) 16 (80,0%) 18 (90%)
Fonte: Programa de Pós-Graduação em Patologia Oral (UFRN). Legenda: CR – cisto radicular; CD – cisto dentígero
5.2.2 Distribuição dos dados por idade
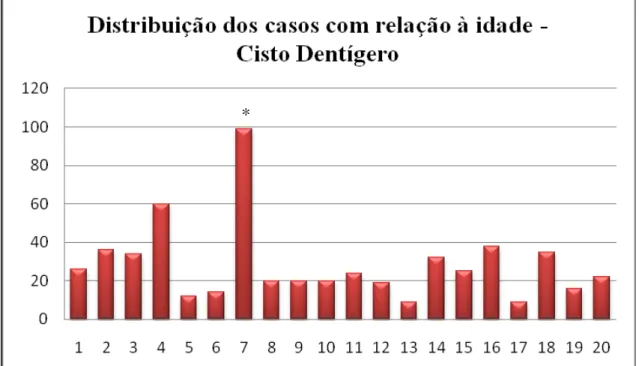
Para os CD a idade variou de 9 a 60 anos (Figura 2) (média: 24,79 anos; desvio-padrão: 12,35 anos).
Figura 1 Frequências dos dados relativos a idade nos casos de CR.
Figura 2 Frequências dos dados relativos a idade nos casos de CD (*dado não informado na ficha clínica).
5.3 ANÁLISE DESCRITIVA DOS RESULTADOS IMUNO-HISTOQUÍMICOS
Em ambas as lesões, tanto o IFN- como o TGF- 1, marcaram os seguintes tipos de células: células epiteliais, células endoteliais, fibroblastos, linfócitos, plasmócitos, neutrófilos e células da linhagem monocítico-macrofágica. O padrão de marcação dos dois imunomarcadores nas duas lesões foi predominantemente citoplasmático em todas essas células, embora, por vezes, as mesmas exibissem marcação nuclear, principalmente as células epiteliais, plasmócitos e células da linhagem monocítico-macrofágica. Além disso, tanto o IFN- como o TGF- 1, apresentaram um padrão de marcação da matriz extra-celular em alguns casos nos dois grupos de lesões. Para uma melhor compreensão dos resultados, eles foram divididos em análises dos resultados no epitélio e na cápsula dos cistos.
5.3.1 No epitélio
5.3.1.1 Cistos radiculares
A expressão imuno-histoquímica do IFN- e do TGF- 1 localizou-se no citoplasma e por vezes no núcleo das células do revestimento epitelial dos cistos radiculares (figuras 5 e 6).
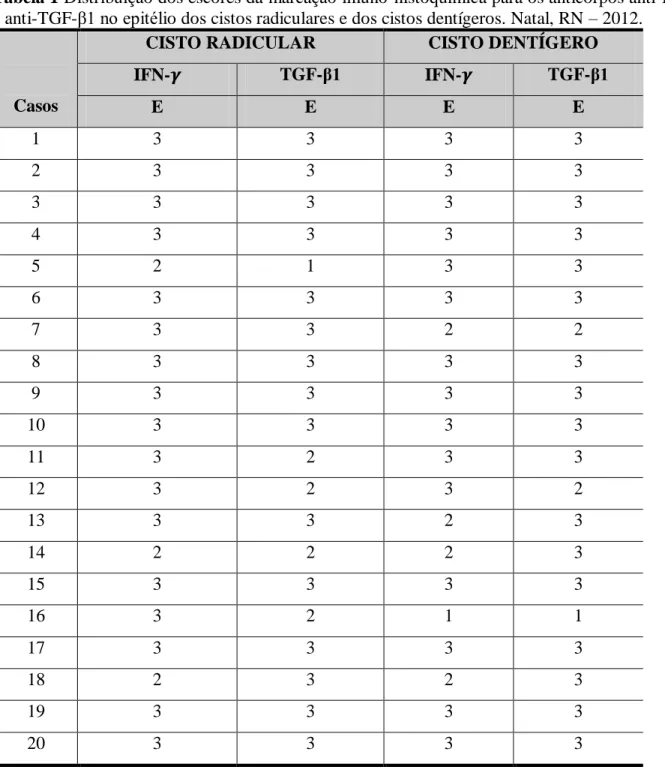
A frequência dos escores de imunomarcação para o IFN- foi de 17 casos com escore 3, o que corresponde a 85% dos casos, seguidos de 3 casos (15%) com escore 2. Para o TGF- 1 houve uma freqüência de 15 casos (75%) com escore 3, seguidos de 4 casos (20%) com escore 2, e 1 caso (5%) com escore 1. (tabela 1)
Portanto, após analisar as frequências dos escores de imunomarcação, observa-se que houve um predomínio do escore 3 (isto é, mais de 75% de células imunomarcadas), tanto para o IFN- como para o TGF- 1 no epitélio dos cistos radiculares.
5.3.1.2 Cistos dentígeros
A expressão imuno-histoquímica do IFN- e do TGF- 1 localizou-se no citoplasma e por vezes no núcleo das células do revestimento epitelial dos cistos dentígeros (figuras 7 e 8).
A frequência dos escores de imunomarcação para o IFN- foi de 15 casos com escore 3, o que corresponde a 75% dos casos, seguidos de 4 casos (20%) com escore 2, e 1 caso (5%) com escore 1. Para o TGF- 1 houve 17 casos (85%) com escore 3, seguidos de 2 casos (10%) com escore 2, e 1 caso (5%) com escore 1 (tabela 1).
Portanto, após analisar as frequências dos escores de imunomarcação, observa-se que houve um predomínio do escore 3 (isto é, mais de 75% de células imunomarcadas), tanto para o IFN- como para o TGF- 1 no epitélio dos cistos dentígeros.
Tabela 1 Distribuição dos escores da marcação imuno-histoquímica para os anticorpos anti-IFN- e anti-TGF- 1 no epitélio dos cistos radiculares e dos cistos dentígeros. Natal, RN – 2012.
Casos
CISTO RADICULAR CISTO DENTÍGERO
IFN- TGF-β1 IFN- TGF-β1
E E E E
1 3 3 3 3
2 3 3 3 3
3 3 3 3 3
4 3 3 3 3
5 2 1 3 3
6 3 3 3 3
7 3 3 2 2
8 3 3 3 3
9 3 3 3 3
10 3 3 3 3
11 3 2 3 3
12 3 2 3 2
13 3 3 2 3
14 2 2 2 3
15 3 3 3 3
16 3 2 1 1
17 3 3 3 3
18 2 3 2 3
19 3 3 3 3
20 3 3 3 3
5.3.2 Na cápsula
Para todos os casos de CR e CD foi estabelecido o percentual de células imunopositivas sobre o total de células contadas nos 10 campos. Esse percentual foi obtido por meio da divisão do número de células marcadas (imunopositivas) pelo número total de células contadas nos 10 campos de cada caso. Esses percentuais foram identificados como PIFN- e PTGF- 1 para IFN- e
TGF- 1, respectivamente. De posse desses percentuais, foram estabelecidos adicionalmente escores de imunomarcação (E) para a cápsula de cada caso dos dois grupos de cisto, a semelhança do que foi feito para o epitélio, considerando-se os mesmos parâmetros de quantidade (em porcentagem) de células imunomarcadas.
5.3.2.1 Cistos radiculares
A expressão imuno-histoquímica do IFN- e do TGF- 1 na cápsula dos cistos radiculares se deu principalmente nas células inflamatórias como linfócitos, plasmócitos, neutrófilos e células de linhagem monocítico-macrofágica, predominantemente com um padrão de marcação citoplasmática, muito embora essas mesmas células, por vezes, exibissem marcação nuclear (Figuras 9 e 10). Outras células como fibroblastos e células endoteliais também apresentaram imunomarcação nuclear e citoplasmática para os dois anticorpos, porém com menor freqüência. Além disso, observou-se ainda um padrão de imunomarcação da matriz extra-celular para os dois anticorpos em alguns casos.
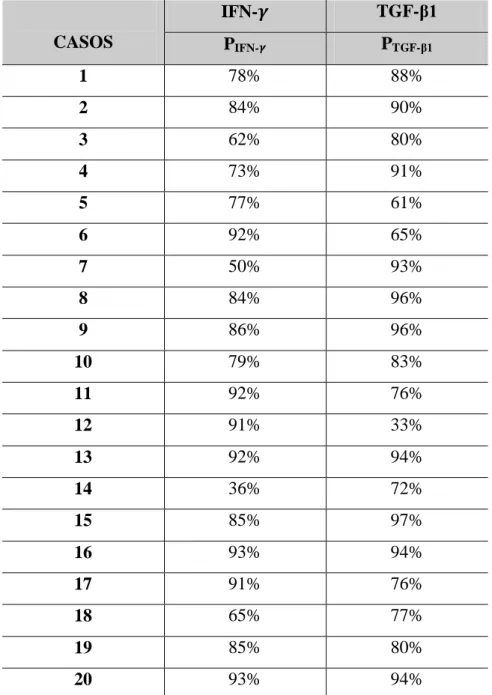
Com relação a imunomarcação do IFN- na cápsula dos CR, a quantidade de células imunopositivas variou de 2 a 126 (Apêndice C), e o percentual de células imunopositivas (PIFN-)
de 36% a 93% (Tabela 2). A média dos percentuais de células imunopositivas ( um desvio padrão) foi de 79 15.
Quanto a imunomarcação do TGF- 1 na cápsula dos CR, a quantidade de células imunopositivas variou de 5 a 118 (Apêndice D), e o percentual de células imunopositivas (P
Tabela 2 Distribuição dos percentuais de células imunopositivas para os anticorpos anti-IFN- e anti-TGF- 1 na cápsula dos cistos radiculares. Natal, RN – 2012.
CASOS
IFN- TGF-β1
PIFN- PTGF-β1
1 78% 88%
2 84% 90%
3 62% 80%
4 73% 91%
5 77% 61%
6 92% 65%
7 50% 93%
8 84% 96%
9 86% 96%
10 79% 83%
11 92% 76%
12 91% 33%
13 92% 94%
14 36% 72%
15 85% 97%
16 93% 94%
17 91% 76%
18 65% 77%
19 85% 80%
20 93% 94%
Legenda: PIFN- - percentual de células imunopositivas para IFN- ; PTGF-1 - percentual de células imunopositivas
para TGF- 1.
predomínio do escore 3 (isto é, mais de 75% de células imunopositivas) para os dois imunomarcadores.
Ademais, a média dos escores de imunomarcação ( um desvio padrão) do IFN- na cápsula dos CR foi de 2,75 0,44. Por sua vez, a do TGF- 1 foi de 2,8 0,41.
Tabela 3 Distribuição dos escores da marcação imuno-histoquímica para os anticorpos anti-IFN- e anti-TGF- 1 na cápsula dos cistos radiculares. Natal, RN – 2012.
CISTO RADICULAR
CASOS
IFN- TGF-β1
E E
1 3 3
2 3 3
3 2 3
4 2 3
5 3 2
6 3 2
7 2 3
8 3 3
9 3 3
10 3 3
11 3 3
12 3 2
13 3 3
14 2 2
15 3 3
16 3 3
17 3 3
18 2 3
19 3 3
20 3 3
5.3.2.2 Cistos dentígeros
Da mesma forma que nos cistos radiculares, a expressão imuno-histoquímica do IFN- e do TGF- 1 na cápsula dos cistos dentígeros se deu principalmente nas células inflamatórias como linfócitos, plasmócitos, neutrófilos e células de linhagem monocítico-macrofágica, predominantemente com um padrão de marcação citoplasmática, muito embora essas mesmas células, por vezes, exibissem marcação nuclear (Figuras 11 e 12). Outras células como fibroblastos e células endoteliais, além de ninhos de epitélio odontogênico, também apresentaram imunomarcação nuclear e citoplasmática para os dois anticorpos, porém com menor freqüência. Além disso, observou-se ainda um padrão de imunomarcação da matriz extra-celular para os dois anticorpos em alguns casos.
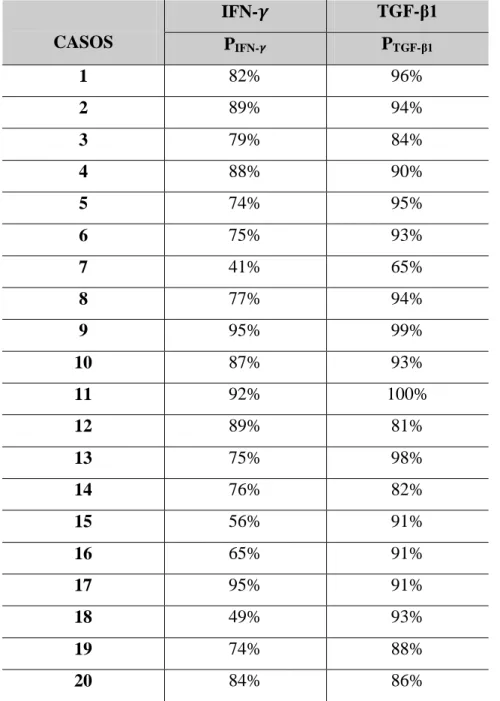
Com relação a imunomarcação do IFN- na cápsula dos CD, a quantidade de células imunopositivas variou de 1 a 92 (Apêndice E), e o percentual de células imunopositivas (PIFN-)
de 41% a 95% (Tabela 4). A média dos percentuais de células imunopositivas ( um desvio padrão) foi de 77 15.
Quanto a imunomarcação do TGF- 1 na cápsula dos CD, a quantidade de células imunopositivas variou de 3 a 80 (Apêndice F), e o percentual de células imunopositivas (PTGF- 1)
Tabela 4 Distribuição dos percentuais de células imunopositivas para os anticorpos anti-IFN- e anti-TGF- 1 na cápsula dos cistos dentígeros. Natal, RN – 2012.
CASOS
IFN- TGF-β1
PIFN- PTGF-β1
1 82% 96%
2 89% 94%
3 79% 84%
4 88% 90%
5 74% 95%
6 75% 93%
7 41% 65%
8 77% 94%
9 95% 99%
10 87% 93%
11 92% 100%
12 89% 81%
13 75% 98%
14 76% 82%
15 56% 91%
16 65% 91%
17 95% 91%
18 49% 93%
19 74% 88%
20 84% 86%
Legenda: PIFN- - percentual de células imunopositivas para IFN- ; PTGF-1 - percentual de células
Os resultados referentes aos escores de imunomarcação para a cápsula dos CD encontram-se dispostos na Tabela 5. A freqüência dos escores de imunomarcação do IFN- na cápsula dos CD foi de 12 casos (60%) com escore 3, seguidos de 8 casos (40%) com escore 2. Para o TGF- 1 a freqüência foi de 19 casos (95%) com escore 3, e apenas 1 caso (5%) com escore 2. Houve um predomínio do escore 3 (isto é, mais de 75% de células imunopositivas) para os dois imunomarcadores. Além disso, observa-se que o TGF- 1 apresentou maior freqüência desse escore.
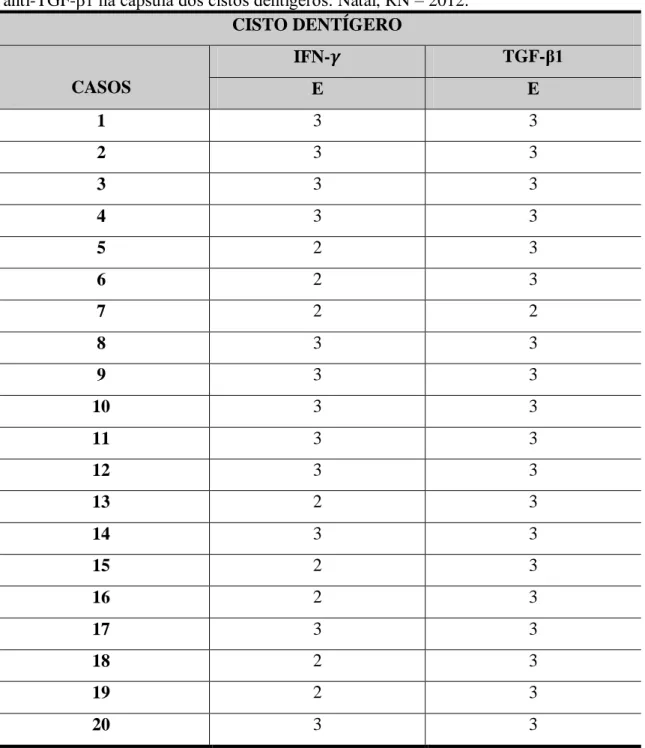
Tabela 5 Distribuição dos escores da marcação imuno-histoquímica para os anticorpos anti-IFN- e anti-TGF- 1 na cápsula dos cistos dentígeros. Natal, RN – 2012.
CISTO DENTÍGERO
CASOS
IFN- TGF-β1
E E
1 3 3
2 3 3
3 3 3
4 3 3
5 2 3
6 2 3
7 2 2
8 3 3
9 3 3
10 3 3
11 3 3
12 3 3
13 2 3
14 3 3
15 2 3
16 2 3
17 3 3
18 2 3
19 2 3
20 3 3
5.4 ANÁLISES ESTATÍSTICAS
5.4.1 Comparação entre os grupos de cistos CR e CD com relação a imunoexpressão epitelial dos biomarcadores IFN- e TGF-β1 (teste de Mann-Whitney)
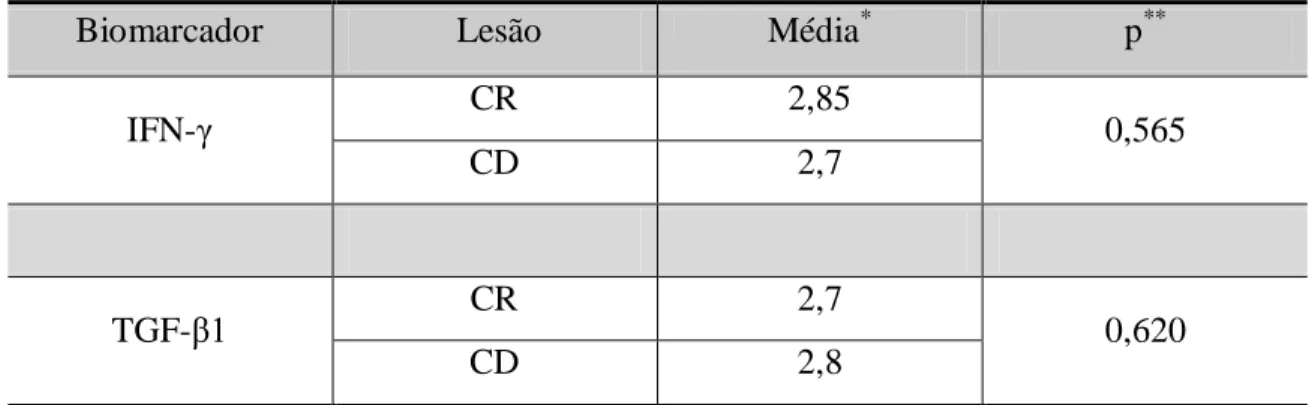
O teste estatístico de Mann-Whitney revelou não existir diferença estatisticamente significativa entre as expressões do IFN- nos epitélios dos CR e CD (p=0,565). O mesmo ocorreu para o TGF- 1 (p=0,620) (Tabela 6).
Tabela 6 Comparação entre os grupos de cistos CR e CD com relação a imunoexpressão epitelial dos biomarcadores IFN- e TGF- 1. Natal, RN - 2012.
Biomarcador Lesão Média* p**
IFN- CR 2,85 0,565
CD 2,7
TGF- 1 CR 2,7 0,620
CD 2,8
* Média dos escores de imunomarcação ** Teste de Mann-Whitney
5.4.2 Comparação entre os grupos de cistos CR e CD com relação a imunoexpressão, em suas cápsulas, dos biomarcadores IFN- e TGF-β1 (teste de Mann-Whitney)
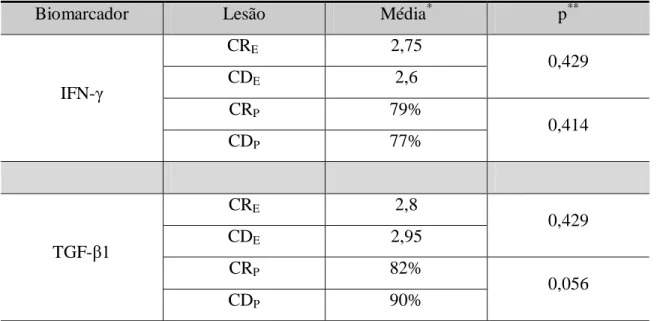
a) escores de imunomarcação: ao analisarmos os escores de imunomarcação, observamos que não houve diferença estatisticamente significativa entre as expressões do IFN- nas cápsulas dos CR e CD (p=0,429). O mesmo ocorreu para o TGF- 1 (p=0,429) (Tabela 7); b) percentuais de células imunopositivas: ao analisarmos os percentuais de células
Tabela 7 Comparação entre os grupos de cistos CR e CD com relação a imunoexpressão, em suas cápsulas, dos biomarcadores IFN- e TGF- 1, considerando-se as avaliações tanto através dos escores de imunomarcação (E) como através dos percentuais de células imunopositivas (P). Natal, RN - 2012.
Biomarcador Lesão Média* p**
IFN-
CRE 2,75
0,429
CDE 2,6
CRP 79%
0,414
CDP 77%
TGF- 1
CRE 2,8
0,429
CDE 2,95
CRP 82%
0,056
CDP 90%
Legenda: CRE: avaliação dos CR através dos escores de imunomarcação; CDE: avaliação dos CD através dos escores
de imunomarcação;CRP: avaliação dos CR através dos percentuais de células imunopositivas; CDP: avaliação dos CD
através dos percentuais de células imunopositivas. *Média dos escores de imunomarcação (E) ou média dos percentuais de células imunopositivas (P); **Teste de Mann-Whitney.
5.4.3 Comparação entre as imunoexpressões dos biomarcadores IFN- e TGF-β1 no epitélio e na cápsula dos CR (teste de Wilcoxon)
5.4.3.1 No epitélio
O teste estatístico de Wilcoxon revelou que não houve diferença estatisticamente significativa entre as expressões dos biomarcadores IFN- e TGF- 1 no epitélio dos CR (p=0,225) (Tabela 8).
5.4.3.2 Na cápsula
b) percentuais de células imunopositivas: ao analisarmos os percentuais de células imunopositivas, observamos que não houve diferença estatisticamente significativa entre as expressões de IFN- e TGF- 1 na cápsula dos CR (p=0,370) (Tabela 9).
5.4.4 Comparação entre as imunoexpressões dos biomarcadores IFN- e TGF-β1 no epitélio e na cápsula dos CD (teste de Wilcoxon)
5.4.4.1 No epitélio
O teste estatístico de Wilcoxon revelou que não houve diferença estatisticamente significativa entre as expressões dos biomarcadores IFN- e TGF- 1 no epitélio dos CD (p=0,361) (Tabela 8).
5.4.4.2 Na cápsula
a) escores de imunomarcação: ao analisarmos os escores de imunomarcação, observamos que houve diferença estatisticamente significativa entre as expressões de IFN- e TGF- 1 na cápsula dos CD (p=0,018) (Tabela 9).
Tabela 8 Comparação entre as imunoexpressões dos biomarcadores IFN- e TGF- 1 nos epitélios dos CR e CD. Natal, RN - 2012.
Lesão Biomarcador Média* p**
CR IFN- 2,85 0,225
TGF- 1 2,7
CD IFN- 2,7 0,361
TGF- 1 2,8
*Média dos escores de imunomarcação **Teste de Wilcoxon
Tabela 9 Comparação entre as imunoexpressões dos biomarcadores IFN- e TGF- 1 nas cápsulas dos CR e CD, considerando-se as avaliações tanto através dos escores de imunomarcação (E) como através dos percentuais de células imunopositivas (P). Natal, RN - 2012.
Lesão Biomarcador Média* p**
CR
IFN- E 2,75
0,735
TGF- 1E 2,8
IFN- P 79%
0,370
TGF- 1P 82%
CD
IFN- E 2,6
0,018
TGF- 1E 2,95
IFN- P 77%
0,001
TGF- 1P 90%
Legenda: IFN- E: avaliação do IFN- através dos seus escores de imunomarcação; TGF- 1E: avaliação do TGF- 1
através dos seus escores de imunomarcação; IFN- P: avaliação do IFN- através dos seus percentuais de células
imunopositivas; TGF- 1P: avaliação do TGF- 1 através dos seus percentuais de células imunopositivas. *Média dos