Artigo
*e-mail: vanessacsp@ima.ufrj.br
USO DA RMN DE BAIXA RESOLUÇÃO NA AVALIAÇÃO DA DINÂMICA MOLECULAR DO Origanumvulgare
Vanessa Cristina dos Santos Peixoto de Oliveira*, Maria Inês Bruno Tavares, Eduardo Miguez Bastos da Silva, Bianca Natividade Barreto de Lima e Roberto Pinto Cucinelli Neto
Instituto de Macromoléculas ‘Professora Eloisa Mano’, Universidade Federal do Rio de Janeiro, 21941-598 Rio de Janeiro – RJ, Brasil
Recebido em 26/08/2014; aceito em 13/11/2014; publicado na web em 03/03/2015
THE USE OF LOW-FIELD NMR FOR EVALUATING THE MOLECULAR DYNAMIC OF Origanumvulgare. In this work, proton NMR relaxometry was used to measure the behavior of spin-lattice relaxation time with T1H as the time constant, and also of spin-spin relaxation time with the time constant T2H. These relaxometry parameters were determined to better understand the changes in the main structures present in commercial and in nature forms of origanum. The T1H relaxation data showed that the structures which had higher molecular mass were more sensitive to degradation with increased temperature treatment. According to the values of the T2H parameter, up to 150 degrees no signiicant change in the mobility and organization of water was observed. These data infer that the ideal cooking temperature and tea preparation mode for this herb should be around 100 degrees for the sample not to lose its characteristics. Also, it is not advisable to cook this herb at higher than 150 degrees but better to consume it at room temperature, especially give commercial herb has already been dehydrated.
Keywords: relaxometry; NMR; origanum.
INTRODUÇÃO
Nas últimas décadas têm-se observado um grande interesse pelo potencial terapêutico das plantas medicinais, 1 de tal modo que
cerca de 30% das drogas prescritas no mundo são obtidas direta ou indiretamente das plantas.2 Estima-se que cerca de 60% da população
mundial faça uso de ervas e produtos naturais para diversos tratamen-tos.3 Muitas espécies de plantas, aromáticas ou não, têm sido testadas
principalmente devido à sua atividade antioxidante, propriedade hipoglicêmica, antimicrobiana, dentre outras.3,4
As plantas da família Lamiaceae tem despertado interesse devido seus efeitos biológicos diversos como: antioxidante, antimicrobiano, hipoglicêmico, antidistúrbios digestivos entre outros.5 Dentre as
plantas desta família, destaca-se o Origanum vulgareL. (orégano), que é uma das espécies mais importantes da família Lamiaceae, e é utilizada como erva aromatizante em muitas cozinhas de todo o mundo, especialmente na culinária mediterrânea.6,7
A composição química dos vegetais depende do clima, da altitude e do período de colheita. Espécies como o orégano apresentam uma composição bastante diversiicada como polímeros naturais, dentre eles podemos citar: polissacarídeos, tais como a celulose e outras ibras, e proteínas.8,9 Compostos de menor massa molar, como os
compostos fenólicos, lipídios, ácidos graxos, lavonóides,10 limoneno,
beta-carioileno, p-cimeno, linalol e alfa-pineno,11 ácido o-cumárico,
ácido ferúlico, ácido cafeico, ácido p-hidroxibenzóico, ácido vanílico e ácido rosmarínico,3 além de uma classe com certa relevância que
são os óleos essenciais com cerca de 30 compostos ativos.12,13
Os óleos essenciais constituem, de uma maneira geral, uma mistura muito complexa de hidrocarbonetos, álcoois e aromáti-cos, encontrados em todo tecido vivo de plantas. Em geral, esses compostos estão concentrados na casca, nas lores, nas folhas, nos rizomas e nas sementes. Sua composição pode variar segundo a localização, embora todos os órgãos de uma planta consigam acu-mular óleos voláteis.14
Em contato com a água, os óleos essenciais apresentam solubi-lidade limitada, mas suiciente para aromatizar as soluções aquosas
denominadas hidrolatos. Por serem voláteis, necessitam ser estocados em recipientes hermeticamente fechados e protegidos da luz direta, calor, umidade e metais.15
Na composição química das folhas do orégano observa-se a existência de até 1% de óleo essencial, com média de 40 a 70% de cavacrol, seguido de borneol, cineol, terpineol, terpineno e timol.16
O óleo essencial é utilizado na composição de aromatizantes de alimentos, de perfumes e na medicina. Toda a planta é utilizada na medicina doméstica, costume esse originário da Itália.17 Cada um de
seus componentes pode também ter uma aplicação especíica, como por exemplo, 1,8-cineol – medicinal e cosmético; p-cimeno-aditivo na indústria de perfumaria, solvente e material de partida para síntese orgânica; farnesol – bactericida; linalol – perfumaria e lavorizantes; acetato de geranila – perfumaria.18
Com relação à composição química dos óleos essenciais, os auto-res destacam a importância de técnicas instrumentais e simples, mas com precisão para a identiicação destes compostos, como a técnica de cromatograia gasosa (CG). É uma das técnicas mais difundidas para análises químicas, por apresentar um processo de separação eiciente na elucidação de estruturas.19,20
Diante dos inúmeros benefícios que as plantas em geral apresen-tam, tem-se veriicado grande avanço cientíico envolvendo estudos químicos, alimentícios e farmacológicos das plantas medicinais, visando obter novos compostos com propriedades farmacêuticas.21
As principais técnicas e análises utilizadas na avaliação de ali-mentos são as técnicas espectroscópicas, tais como: ultravioleta (UV), infravermelho, além das análises cromatográicas. No entanto, poucos trabalhos dedicados ao estudo da planta Origanumvulgare foram publicados. Alguns destes estudos avaliam a atividade antioxidante da planta, enquanto outros investigam a importância dos óleos essenciais no efeito inibitório sobre determinadas bactérias.22
De acordo com essas características da RMN, as análises do núcleo de hidrogênio são fundamentais para o estudo de diferentes sistemas por meio da análise da dinâmica molecular.25-27 Os processos de relaxação
relacionam o tempo necessário para que os spins nucleares retornem ao seu estado fundamental após a liberação da energia absorvida quando do fenômeno da RMN. Os processos de relaxação são de dois tipos: relaxação spin-rede e o processo de relaxação spin-spin.25-30
A relaxação spin-rede também é chamada de longitudinal e está relacionada ao retorno da população de spins ao seu equilíbrio tér-mico, a este processo de relaxação está associada uma constante de tempo, T1, este é um processo entálpico e a transferência de energia
dos spins é doada indiscriminada para a rede, sendo transformada em movimentos rotacionais e translacionais na molécula.25,26 A medida do
tempo necessário para que ocorra essa relaxação fornece informações sobre a presença de domínios de mobilidades diferentes, homogenei-dade, miscibilihomogenei-dade, interação entre componentes, entre outros.25-31
A relaxação transversal, também denominada spin-spin, possui constante de tempo T2 e está relacionada ao decaimento do sinal de ressonância. Neste processo de relaxação ocorre a transferência de energia de um spin para outro spin muito próximo. A relaxação T2 está relacionada tanto ao FID (Free Induction Decay) quanto à largura dos sinais no espectro. Se o FID for curto, ou seja, com decaimento rápido, o T2 correspondente será curto e os sinais obtidos serão largos,
o que é o caso de materiais sólidos. E, de forma análoga, obtendo-se um FID largo, que terá decaimento lento, o T2 será longo e seus sinais
correspondentes serão inos. Assim, amostras que possuem reticu-lação são rígidas, e irão apresentar sinais muito largos. As amostras cristalinas, devido à isotropia obtida pela orientação, irão apresentar sinais mais inos, em comparação a amostras amorfas (anisotrópicas). As amostras que possuem ligações hidrogênio terão um aumento na largura do sinal, devido à menor mobilidade molecular, restrição de movimentos, que essas interações proporcionam à molécula.30-32
Na literatura, encontram-se vários estudos de caracterização por RMN de produtos naturais. Os resultados encontrados demons-tram a potencialidade desta técnica como, por exemplo, seu uso na diferenciação de água e gordura em alimentos, já que estes são os componentes mais abundantes nos alimentos. A água presente nos alimentos pode se comportar de maneira distinta devido as interações que estabelece nesses sistemas. Assim, quando analisadas por RMN via relaxação nuclear mostram a interferência deste comportamento nos valores de relaxação. Com isso, as moléculas de água estão diferentemente associadas a macromoléculas, possuem distintas mobilidades moleculares e, consequentemente, apresentam tem-pos de relaxação diferentes. Essas interações são responsáveis por propriedades químicas variadas, para diferentes itens alimentares como produtos animais e vegetais. Os diferentes comportamentos de populações de água em distintos compartimentos podem ser obtidos pelas curvas de relaxação de RMN, por exemplo, o desvio exponencial do decaimento da relaxação, como mostrado nas Equações 1 e 2.33
St = Ae –t/tn (1)
nas quais St é o total do sinal de relaxação, A é a amplitude
propor-cional de água (igual aos núcleos de hidrogênio na água) e tn é o tempo de relaxação do núcleo de hidrogênio da água para um tipo de hidrogênio encontrado no sistema. Se há dois ou mais compartimentos de água, isso pode ser expresso como:
St = Ae –t / tn1 + Ae –t / tn2 (2)
Em outros estudos, feitos em alimentos por RMN, pretendeu-se determinar os tempos de relaxação dos sistemas de spins nucleares destacando-se as técnicas de relaxometria clássicas.34-36
Baranowska e colaboradores estudaram relaxação nuclear de
1H em suspensão aquosa de amido de batata com gomas arábicas,
xantanas e outras. Neste trabalho foram investigadas as relaxações longitudinal e transversal com referência às moléculas de água presentes na amostra, e constatou-se a inluência da temperatura (55 °C) nos valores de tempos de relaxação detectados para as amostras. Neste estudo, a temperatura de 55 °C é apontada como uma temperatura de mudança nas interações água/polímero, isto é, em 5% de suspensão aquosa de amido de batata em temperatura em elevação até 55 °C há aumento de T1H e T2H. Segundo o autor, esse aumento é devido à consequente produção de desordem causada pela elevação da temperatura. No entanto, T1 tem seu decréscimo quando a análise tem seu início na temperatura de 55 °C, devido ao processo de gelatinização, no qual há imobilização de moléculas de água dentro da estrutura gel formada.37
Em outro estudo de Tang e colaboradores foram realizadas aná-lises com o uso da técnica CPMAS em combinação com relaxação do núcleo de 1H (T
1, T1ρ, T2) para a análise da dinâmica molecular
da parede celular de batatas e sistema de modelos para detalhes estruturais dos domínios presentes. Neste estudo, T1 demonstra ter maior valor para a celulose e os menores valores foram atribuídos à lignina e hemicelulose. Já os valores de T2 para a celulose são me-nores que 20 μs, sendo que a pectina está contribuindo para ambos os tempos de relaxação.38
Além das técnicas de relaxação T1 e T2, outra técnica de
relaxa-ção é muito utilizada na identiicarelaxa-ção e caracterizarelaxa-ção da dinâmica molecular de sistemas complexos, sendo esta chamada de técnica de relaxação de campo cíclico rápido (Fast Field Cycling NMR ou FFC).39,40
Assim, de acordo com o exposto, o objetivo principal deste trabalho foi utilizar a técnica de RMN de baixa resolução, por meio da mudança na relaxação nuclear do hidrogênio, empregando as constantes de tempo T1H e T2H, para avaliar mudanças na estrutura
ou degradação das amostras de orégano quando submetidas ao tra-tamento térmico e durante a cocção.
PARTE EXPERIMENTAL
Coleta do material
O orégano comercial (desidratado) e a planta in natura foram adquiridos em mercado varejista no município do Rio de Janeiro durante os anos de 2013 e 2014.
Preparo das amostras
As amostras comercial e in natura do Origanum vulgare foram postas em estufa com circulação de ar por uma hora, a diferentes temperaturas: 25 °C, 37 °C, 50 °C, 100 °C e 150 °C. As dez amostras foram analisadas pelas técnicas de espectroscopia de absorção na região do infravermelho, determinação do tempo de relaxação spin--rede para determinação do valor de T1 e spin-spin para determinação do valor com constante de tempo T2.
Determinação dos tempos de relaxação spin-rede
Para a determinação das medidas de relaxação nuclear foi uti-lizado um espectrômetro de RMN de baixo campo Maran Ultra 23, operando à frequência de 23 MHz (para o núcleo de hidrogênio) e equipado com sonda de 18 mm, com variação de temperatura. O tempo de relaxação spin-rede do hidrogênio foi determinado diretamente pela sequência de pulso inversão-recuperação
do equipamento. A amplitude do FID foi de 40 pontos variando de 0,1 a 5000 ms, com 4 medidas para cada ponto com um intervalo de reciclo de 1 segundos. O tempo de relaxação spin-spin do hidrogênio foi medido pela sequência de pulso CPMG, com tempo de intervalo entre os pulsos de 90° e 180° de 100 microsegundos. Os valores e as intensidades relativas de relaxação foram obtidos pelo fitting dos dados exponenciais com a ajuda do programa do equipamento denominado winfit (versão 2.4.0.0).
RESULTADOS E DISCUSSÃO
Análise por relaxometria
Com o objetivo de obter informações sobre a dinâmica molecular das amostras de orégano comercial e in natura, foram determinados os tempos de relaxação T1H e T2H, em um espectrômetro de RMN de baixa resolução, no estado sólido, utilizando a técnica-inversão recuperação e CPMG, respectivamente.
Análise dos tempos de relaxação spin-rede
O tempo de relaxação spin-rede é uma maneira rápida e eiciente de avaliar o comportamento dinâmico molecular de um material (fase sólida e fase líquida), pois gera dados sobre mobilidade molecular deste, assim como as interações presentes entre os componentes de um sistema, principalmente em sistemas heterogêneos, como os alimentos.36, 39-42
A determinação dos tempos de T1H foi realizada visando obter informações sobre a fase sólida destas. As Tabelas 1 e 2 exibem os valores de T1H para as amostras do orégano comercial e in natura, respectivamente. Foram determinados dois valores de relaxação spin-rede para ambos os sistemas denominados de T1,1 e T1,2; o menor valor do parâmetro de relaxação (T1,1) é referente a fração de maior
mobilidade molecular e o maior valor (T 1,2)é referente as estruturas de maior massa molar, e consequentemente mais rígidas.
As medidas de relaxação spin-rede mostraram comportamento semelhante para as amostras. No entanto, o efeito da temperatura foi mais acentuado para a fração de maior massa molar. Isso se deve
a maior susceptibilidade das estruturas mais complexas em formar novas e mais fracas interações após a saída da água, pela diminuição das ligações de hidrogênio.
Foi observado que para as temperaturas de 25 °C e 37 °C os valores de relaxação T1,1 sofrem uma diferença signiicativa em face
do efeito da temperatura (similar a temperatura corpórea) devido às quebras das interações das partículas de menor massa molar, perda de água e voláteis. Além disso, a similaridade entre os valores de T1,1 e T1,2 para temperaturas acima de 50 °C reside no fato da perda das
moléculas de maior mobilidade molecular e menor massa molar ter sido signiicativa até a temperatura de 37 °C.
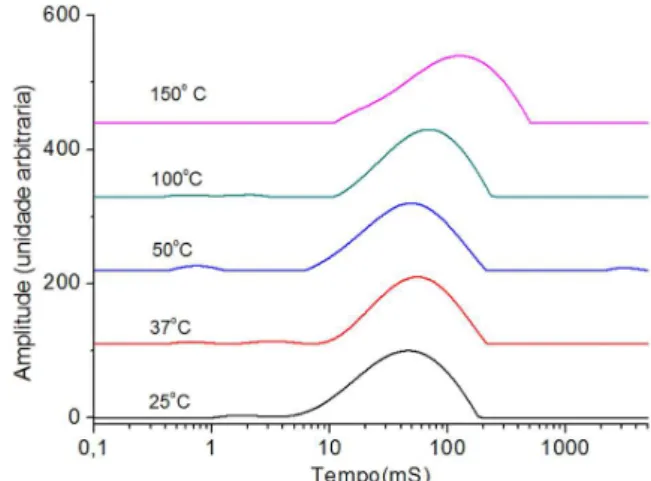
As Figuras 1 e 2 mostram as curvas de distribuição de domínios de relaxação spin-rede das amostras de orégano comercial e in natura, respectivamente. As curvas de domínio de relaxação spin-rede das amostras de orégano comercial e in natura mostraram apenas um pico com uma base muito larga, este alargamento aumenta de acordo com o aumento de temperatura.
As curvas de domínios de relaxação nuclear, quer seja o tempo de relaxação longitudinal, quer seja o tempo de relaxação transversal, mostram o peril exponencial da distribuição dos tempos de relaxação, que nos permite inferir sobre a organização do sistema. Quanto mais alargada for a curva de distribuição dos domínios, mais heterogêneo é o sinal. Essas curvas não apresentam deslocamento químico, mas sim o peril de relaxação dos núcleos totais de hidrogênio presentes no sistema. De acordo com as curvas de domínios da Figura 1, nota-se que para a amostra comercial houve, além do alargamento das curvas de domínio, um deslocamento desta. Entretanto, para a temperatura de 50 °C isto não ocorreu. Esse deslocamento pode ser devido a uma reorganização das estruturas constituintes da planta com a saída dos diferentes tipos de água existentes da amostra, causando um enrijeci-mento das estruturas presentes na mesma. Já para a temperatura de 50 °C, o comportamento se assemelha àquele observado para a amostra a temperatura de 25 °C, pois pode ter havido formação de diferentes tipos de interações, visto que o material inicial não apresentava um teor de água similar ao do material comercial. À temperatura de 100 °C o deslocamento das curvas de domínio foi menor do que o observado para as outras temperaturas. Tal comportamento pode ser explicado pelo fato da saída de diferentes tipos de água ter causado arranjos moleculares e interações inter e intramoleculares diferentes e distintas das outras temperaturas de desidratação. O processo continua à temperatura de 150 °C. Além disso, observa-se também um aumento do alargamento das curvas de domínio mostrando a heterogeneidade do material.
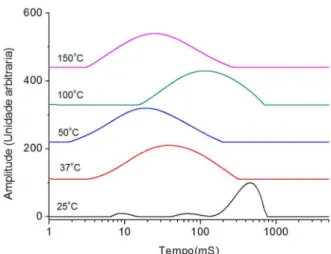
Na Figura 2, que apresenta as curvas de domínio de relaxação longitudinal do núcleo de hidrogênio do orégano in natura, observa-se
Tabela 2. Valores de tempos de relaxação spin-rede do orégano in natura
Temperaturas de desidratação (ºC)
T1H (ms)
T1,1 T1,2
25 26,2 427,3
37 16,0 85,0
50 42,0 172,0
100 34,0 129,0
150 29,0 123,0
Tabela 1. Valores de tempos de relaxação spin-rede do orégano
comer-cial
Temperatura de tratamento (ºC)
T1H (ms)
T1,1 T1,2
25 5,8 34,4
37 23,8 118,0
50 41,7 172,0
100 34,0 129,0
150 29,0 123,0
Figura 1. Curvas de domínio de T1H do orégano comercial desidratado nas
que esta amostra apresenta um alargamento nas curvas de domínio maior do que aquele ocorrido para a amostra comercial, tendo em vista que a amostra comercial já havia sofrido tratamento de desidratação. Esse maior alargamento, assim como o deslocamento para tempos de relaxação menores, indica que a perda dos tipos de água de desidrata-ção também inluenciou na organizadesidrata-ção estrutural da planta, conforme já observado em trabalhos anteriores,33 tornando-a mais heterogênea.
Avaliando as diferentes temperaturas de desidratação observa-se a liberação de água de diferentes ambientes: a 25 °C o sistema mostra que o domínio é regido pela água adsorvida pela mesma estar em grande quantidade; a 37 °C inicia-se a perda da água adsorvida (ex-terna), a 50 °C ocorre à continuidade do processo de perda de água, iniciando-se a visualização da heterogeneidade da amostra, sem a inluência predominante da água adsorvida. Na temperatura de 100 °C observa-se o início de uma degradação/reorganização estrutural por perda de componentes mais voláteis e óleos, implicando num aumento do valor de T1 em face do aumento da rigidez devido à perda da fração mais oleosa. Para 150 °C a diminuição do valor de T1 advém do início de uma possível degradação, por ação térmica das cadeias de constituintes de baixa massa molar, alguns tipos os terpenos e polissacarídeos.
Análise por relaxação spin-spin
Os tempos de relaxação T2H foram determinados visando obter informações sobre a fase líquida das amostras analisadas. As Tabelas 3 e 4 mostram os valores de T2H para as amostras do orégano comercial e in natura, respectivamente. Foram determinados três valores de tempos de relaxação transversais para as amostras. Os dois primei-ros tempos de relaxação remetem aos prótons das águas estruturais enquanto que o terceiro domínio refere-se à água adsorvida.
De acordo com os dados de relaxação nuclear spin-spin listados nas Tabelas 3 e 4, a amostra de orégano in natura é mais susceptível
à degradação quando relacionada ao aumento da temperatura de de-sidratação do que a amostra de orégano comercial, que por ter sofrido um pré-tratamento térmico e, por isso, ter perdido a água adsorvida e uma água mais interna (extracelular), o que pode ter gerado novas organizações estruturais, com menor número de ligação de hidrogê-nio, que promovem proteção maior quando esta amostra é submetida a tratamento térmico. Esse comportamento corrobora com o que já foi observado com relação à avaliação da dinâmica molecular dessas amostras pelo tempo de relaxação spin-rede.
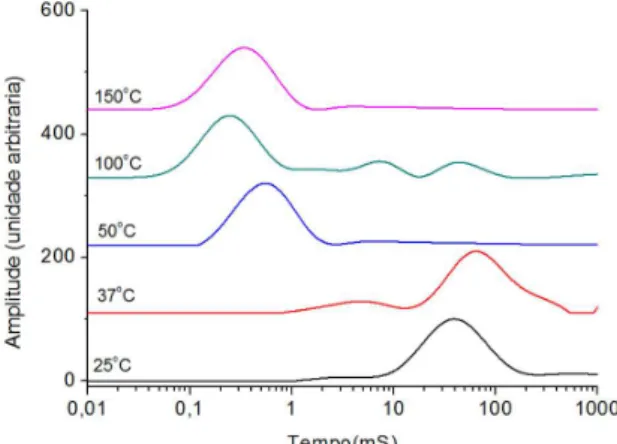
As Figuras 3 e 4 mostram o comportamento das curvas de distri-buição de domínios de relaxação spin-spin do núcleo de hidrogênio das amostras de orégano comercial e in natura, respectivamente. As curvas de domínio de relaxação spin-spin das amostras de orégano comercial e in natura mostraram um pico com base alargada, con-forme o aumento de temperatura, sendo característico da perda de água. Também foi observado o aparecimento de novos domínios, possivelmente pela reorganização estrutural ou o aparecimento de novas estruturas organizacionais pela formação de novas interações inter e intramoleculares pela perda de água das amostras.
A Figura 4 apresenta o mesmo comportamento observado na Figura 2, no qual a temperatura de 50 °C sofreu efeito diferenciado das demais temperaturas de tratamento – desidratação. Já para a Figura 3 o comportamento foi diferente do observado para a Figura 2, mostrando que entre as temperaturas mais baixas (25 e 37 °C) não houve nenhuma mudança signiicativa, e as demais temperaturas tiveram o mesmo comportamento da amostra comercial.
CONCLUSÕES
A avaliação da dinâmica molecular do Origanumvulgare apre-sentada mostrou que o comportamento das amostras comercial e in natura apresentam similaridades e particularidades quanto à formação
Figura 2. Curvas de domínio de T1H do orégano in natura desidratado nas
diferentes temperaturas
Tabela 4. Valores de tempos de relaxação spin-spin do orégano in natura
Temperaturas de desidratação (ºC)
T2 H (ms)
1º domínio 2º domínio 3º domínio
25 22,1 32,3 128,4
37 10,2 15,7 92,5
50 0,4 1,2 11,2
100 0,4 6,8
---150 0,4 5,4
---Tabela 3. Valores de tempos de relaxação spin-spin do orégano comercial
Temperaturas de tratamento (ºC)
T2 H (ms)
1º domínio 2º domínio 3 º domínio
25 0,19 0,70 9,7
37 0,16 0,70 9,8
50 0,24 0,46 4,6
100 0,19 --- 6,5
150 0,08 1,03 9,0
Figura 3. Curvas de domínio de T2H do orégano comercial desidratado nas
e reorganização estrutural. Ambas se devem a perda de água pelo processo de desidratação por temperatura que gera reorganizações estruturais devido à quebra de ligações de hidrogênio inter e intra-moleculares durante o processo de desidratação, propiciando assim a geração de novas e mais fracas ligações nos sistemas. A avaliação por T1H mostra que as estruturas de maior massa molar são mais
sen-síveis ao aumento da temperatura. De acordo com os valores de T2H, até a temperatura de 150 °C não se observa um efeito signiicativo na mobilidade e organização da água estrutural. Esses dados podem inferir na temperatura ideal de cozimento e preparação de chás a partir desta erva, que deve ser em torno de 100 °C.
AGRADECIMENTOS
Os autores agradecem à CAPES e ao CNPQ pelo apoio inanceiro ao Projeto.
REFERÊNCIAS
1. Yunes, R. A.; Pedrosa, R. C.; Cechinel Filho, V.; Quim. Nova. 2001, 24, 152.
2. Koehn, F. E.; Carter, G. T.; Nat. Rev. Drug Discovery2005, 4, 220. 3. Coqueiro, D. P.; Bueno, P. C. S.; Guiguer, E. L.; Barbalho, S. M.; Souza,
M. S. S. S.; Araújo, A. C.; Torres, C. S.; Scacco, G.; Tiveron, A. M.; Costa, J. M.; Vanzo, L. A.; Silva, L. O.; Gil, M. S.; Abib, M. D.; Rossi, P. B. R.; Ozi, R. F.; Abib, T. d.; Gonçalves, U. M.; Scientia Medica
2012, 22, 196.
4. Kaurinovic, B.; Popovic, M.; Vlaisavljevic, S; Trivic, S.; Molecules
2011, 16, 414.
5. Barros, L.; Heleno, S. A.; Carvalho, A. M.; Ferreira, C. F. R.; Food Sci. Technol. 2010, 43, 550.
6. Viuda-Martos, M.; Navajas, Y. R.; Zapata, E. S.; Fernández-López, J.; Pérez-Álvarez, J. A.; Flavour and Fragrance Journal2009, 25, 19. 7. Gulluce, M.; Karadayi, M.; Guvenalp, Z.; Ozbek, H.; Arasoglu, T.;
Baris, O.; Food Chem. 2012, 130, 253.
8. Cipriani, R. T.; Mellinger, C. G.; Souza, L. M.; Baggio, C. H.; Freitas, C. S.; Marques, M. C. A.; Gorin, P. A. J.; Sassaki, G. L.; Iacomini, M.; Carbohydr. Polym. (2008), doi.org/10.1016/j.carbpol.2008.02.012. 9. Cipriani, R. T.; Mellinger, C. G.; Souza, L. M.; Baggio, C. H.; Freitas,
C. S.; Marques, M. C. A.; Gorin, P. A. J.; Carbohydr. Polym. (2009), doi. org/10.1016/j.carbpol.2009.03.026.
10. Kintzios, S. E. Oregano: the genera Origanum ano Lippia; Spiridon, E.; Kintzios, S. E., eds.; London; New York: Taylor & Francis, 2002, cap. 1. 11. Lozano, A. C. C.; Pina, L.G.; Uribe, S. L.; Mejía, E. G.; Arch. Latinoam.
Nutr.2004, 54, 111.
12. Cleff, M. B.; Meinerz, A. R. M.; Faria, R. O.; Xavier, M. O.; Santin,R.; Nascente, P. S.; Rodrigues, M. R.; Meireles, M. C. A.; Arq. Bras. Med. Vet. Zootec. 2010, 62, 1294.
13. Wollenweber, E.; Prog. Clin. Biol. Res.1988, 280, 55.
14. Bussatta, C; Dissertação de mestrado,Universidade Regional Integrada do Alto Uruguai e das Missões – URI, Brasil, 2006.
15. Simões, C. M. O.; Schenkel, E. P.; Gosmann, G.; Mello, J. C. P.; Mentz, L. A.; Petrovick, P. R.; Farmacognosia: Da Planta ao Medicamento, 5 ed., Editora da UFRGS: Porto Alegre, 2003.
16. Rehder, V. L. G.; Machado, A. L. M.; Delarmelina. C.; Sartoratto, A.; Figueira, G. M.; Duarte, M. C. T.; Rev. Bras. Plantas Med. 2004, 6, 71. 17. Signor, D.; Kowalski, A. P.; Alves, M. A.; Lima, F. I.; Biasi, L. A.;
Revista Scientia Agraria Paranaensis 2007,8, 434.
18. Ugaz, O. L.; Investigación Fitoquímica; Fondo Editorial. Lima: Pontiicia Universidad Católica del Peru, Lima: Peru, 1994
19. Nickavar, B.; Mojab, F.; Asgarpanah, J.; International Journal of Aro-matherapy 2005, 15, 53.
20. Vági, E.; Simándi, B.; Suhajda, Á.; Héthelvi, É.; Food Res. Int. 2005,38, 57.
21. Borges, A. M.; Pereira, J.; Cardoso, M. G.; Alves, J. A.; Lucena, E. M. P.; Rev. Bras. Plantas Med. 2012, 14, 665.
22. Pereira, A. A.; Cardoso, M. G.; Abreu, L. R.; Morais, A. R.; Guimarães, L. G. L.; Salgado, A. P. S. P.; Cienc. Agrotecnol.2008,32, 893. 23. Nascimento, A. M. R.; Tavares, M. I. B.; J. Polym. Mater. 2007,56, 115. 24. Belton, P. S.; Magn. Reson. Chem.2011, 49, 132.
25. Maunu, S. L.; Prog. Nucl. Magn. Reson. Spectrosc.2002, 40, 174. 26. Mayer, C.; Prog. Nucl. Magn. Reson. Spectrosc.2002, 40, 366. 27. Abbasi, A. Z.; Gutiérrez, L.; Del Mercato, L. L.; Herranz, F.;
Chubykalo-Fesenko, O.; Veintemillas-Verdaguer, S.; Parak, W. J.; Morales, M. P.; González, J. M.; Hernando, A.; De La Presa, P.; J. Phys. Chem. C2011, 115, 6257.
28. Wang, G.;El-Sharkawy, A. M. M.; Bottomley, P.A.; J. Magn. Reson.
2014, 242, 255.
29. Semernik, R. J.; Baldock, J. A.; Oades, J. M.; Whittaker, A. K.; Solid State Nucl. Magn. Reson.2002, 22, 70.
30. Chiang, J. C.; Kao, H. M.; Woo, E. M.; Wu, R. R; Polymer2002, 43, 176.
31. Adriaensens, P.; Dams, R.; Gelan, J.; Lutsen, L.; Vanderzande, D.; Polymer 2002, 45, 4505.
32. Madsen, B.; Lilholt, H.; Compos. Sci. Technol.2003, 63, 1272. 33. Preto, M. S. M. Dissertação de mestrado,Universidade Federal do Rio
de Janeiro, Brasil, 2007.
34. Straadt, I. K.; Rasmussen, M.; Andersen, H. J.; Bertram, H C.; Meat Sci.
2007, 75, 687.
35. Granizo, D. P.; Reuhs, B. L.; Stroshine, R.; Mauer, L. J.; LWT--Food Sci. Technol.2007, 40, 36.
36. Assifaoui, A.; Champion, D.; Chiotelli, E.; Verel, A.; Carbohydr. Polym.
2006, 64, 97.
37. Baranowska. H. M.; Sikora, M.; Kowalski, S.; Tomasik, P.; Food Hydro-colloids2008, 22, 345.
38. Tang, H.; Belton, P. S.; Ng, A.; Waldron, K. W.; Ryden, P.; Spectrochim. Acta, Part A 1999, 55,894.
39. Conte, P.; Proceedings of the 6º FFC NMR Relaxometry, Turino, 2009. 40. Kimmich, R.; Anoardo, E.; Prog. Nucl. Magn. Reson. Spectrosc. 2004,
44, 257.
41. Pizzolatti, M. G.; Junior, A. C.; Szpoganicz, B.; de Sousa, E.; Quim. Nova2003, 26, 469.
42. Dick, D. P.; Santos, J. H. Z.; Ferranti, E. M.; R. Bras. Ci. Solo2003, 27, 39.
Figura 4. Curvas de domínio de T2H do orégano in natura desidratado nas