EXPRESSÃO DE ZIF268NO CÉREBRO DO LAGARTO Tropidurus hispidus APÓS EXPLORAÇÃO DE UM AMBIENTE ENRIQUECIDO
EXPRESSÃO DE ZIF268NO CÉREBRO DO LAGARTO Tropidurus hispidus APÓS EXPLORAÇÃO DE UM AMBIENTE ENRIQUECIDO
Dissertação apresentada à Pós Graduação em Psicobiologia da Universidade Federal do Rio Grande do Norte como requisito parcial para a obtenção do título de Mestre em Psicobiologia.
Orientador: Prof. Dr. Sidarta Ribeiro Co-orientador: Dr. Marco A. M. Freire
Autor: José Ronaldo dos Santos
Instituição: Universidade Federal do Rio Grande do Norte – UFRN Pós-Graduação em Psicobiologia (Fisiologia)
24 de fevereiro de 2010, Natal-RN
Banca examinadora:
___________________________________________________ Professor Dr. Sidarta Ribeiro (UFRN)
___________________________________________________ Professor Dr. Murilo Marchioro (UFS)
"Tudo que acontece em uma viagem, não apenas faz parte, mas é a própria viagem".
Sempre ouvi que o valor das coisas está diretamente relacionado à dificuldade de consegui-las. Hoje percebo a veracidade desse pensamento e posso afirmar que o mestrado corresponde à etapa da minha vida em que enfrentei os maiores desafios até agora. Para isso, contei com o apoio de diversas pessoas às quais agradeço aqui:
O apoio de meus pais, Josefa Maria e José Augusto, que mesmo sem concordar com minha vinda a Natal, sempre estiveram ao meu lado nos momentos de turbulências. Nunca esquecerei do dia em que saí de casa em busca de um sonho e dos conselhos que me deram nesse dia.
Aos meus irmãos (Edson e Everton) que, mesmo sem entenderem o que faço, sempre torceram pelo meu sucesso.
Ao Professor Dr. Murilo Marchioro da UFS que me apresentou à Neurociência e ensinou-me os primeiros passos do “fazer ciência”. O mesmo é um dos principais responsáveis por eu estar em Natal concluindo o mestrado. Devo esse mestrado a você Murilo.
Ao Pesquisador Dr. Marco Freire, que me aturou durante muito tempo no laboratório de Neurobiologia Celular. Ele me ensinou diversas técnicas e fez sugestões valiosas para esse trabalho.
Aos colegas de laboratório que tornaram o ambiente mais agradável, possibilitaram discussões e sempre deram a maior força: Cristiano Simões, Nelson Lemos, Hindiael Belchior, Nivaldo Vasconcelos, Vitor Santos, Wilfredo Blanco, Valéria Palheta, Ywlliane Meurer, George Nascimento, Gabriela Dias e Natália Mota.
Ao Professor Dr. Claudio Mello por ter cedido reagente e por colaborar com idéias.
Às Professoras da UFRN, Regina Helena, Alessandra Ribeiro e Fívia Lopes. Essas mulheres muitíssimo jovens sempre tinham o conselho certo nos momentos de dúvidas pessoais.
Ao pessoal do Laboratório de Neuroanatomia da UFRN, em nome da Professora Dra. Miriam, que cedeu material e estrutura para a realização de etapas iniciais desse projeto.
Aos amigos de curso que me receberam em Natal de uma forma bastante acolhedora: Rovena, André, Aline, Jane, Breno, Rafaela, Kutaco, Ricardo, Dani, Patrícia, Kathiane e Cris.
Aos Professores da Pós Graduação em Psicobiologia UFRN, que transmitiram grande parte dos conhecimentos que adquiri durante esses dois anos de formação.
Agradeço a todos os funcionário do IINN-ELS (AASDAP). Destaco Adriana Ragoni e Marcelo Carvalho, por estarem sempre dispostos a resolver problemas de ordem burocrática e logística. Lembro também dos amigos “Seu João e o Irmão Jeberson”, que sempre me receberam de forma muito atenciosa.
Ao CNPq, pela bolsa de mestrado concedida durante o desenvolvimento desse trabalho.
Aos amigos que me fizeram sentir em casa aqui em Natal: Marcílio, Mário, Natália Lemos e Gleyson. Obrigado por terem sido minha família durante essa jornada.
Deixo para o fim, não sendo menos importante, meu agradecimento para o “cara” que conheci nas passarelas do Hotel Monte Real em Águas de Lindóia. Esse encontro mudou o rumo de minha vida, descortinou novos horizontes e me fez apaixonar-me cada vez mais pela Neurociência. Esse cara é o Professor Dr. Sidarta Ribeiro (Axé! ... Manda Brasa!...), hoje meu orientador. Nunca esquecerei do primeiro e-mail logo após minha aprovação na Pós Graduação, e das conversas enriquecedoras que tivemos, nas quais, não somente a Neurociência foi discutida, mas também questões pessoais que me fizeram enfrentar melhor os desafios apresentados ao longo do caminho.
A todos, ficam aqui meus agradecimentos.
LISTA DE FIGURAS...i
LISTA DE ABREVIATURAS...v
RESUMO...vii
ABSTRACT ...viii
1. APRESENTAÇÃO ... 1
2. INTRODUÇÃO ... 4
2.1 Expressão de Zif268 e plasticidade neuronal após exploração de ambientes enriquecidos. ... 4
2.2 Evolução do sistema nervoso dos vertebrados ... 9
2.3 Tropidurus hispidus como modelo experimental ...15
3. OBJETIVOS ...19
4. MATERIAIS E MÉTODOS...20
4.1. Animais ...20
4.2 Aparato comportamental e ambiente enriquecido ...21
4.3 Desenho experimental ...21
4.4 Western blot...23
4.5 Perfusão e crioproteção...24
4.6 Coloração de Nissl...25
4.7 Imunohistoquímica para Zif268...25
4.8 Contagem de células ...26
4.9 Análise estatística ...26
5. RESULTADOS...28
5.1 Comportamento ...28
5.2 Presença de Zif268 no cérebro do lagarto Tropidurus hispidus...30
5.3 Células reativas a Zif268 ...31
5.3.1 SEPTO ...32
5.3.5 CÓRTEX LATERAL...36
5.3.6 ÁREA VISUAL...37
5.3.7 ESTRIADO...38
5.4 Correlações da expressão de Zif268 entre as diferentes áreas analisadas41 5.5 Correlações entre a expressão de Zif268 e o comportamento dos animais 42 6. DISCUSSÃO ...49
7. CONCLUSÕES ...55
8. PERSPECTIVAS ...56
LISTA DE FIGURAS
Figura 1: Representação esquemática do mecanismo de indução do gene zif268 6
Figura 2: Níveis de expressão de zif268 no sistema nervoso de animais
submetidos a diferentes condições 8
Figura 3: Diagrama esquemático de cortes coronais do telencéfalo de diferentes
espécies de vertebrados 13
Figura 4: Esquema das principais projeções hipocampais em mamíferos e répteis 15
Figura 5: Imagem do lagarto Tropidurus hispidus 16
Figura 6: Estruturas, camadas e áreas do cérebro do lagarto tropical Tropidurus
hispidus 18
Figura 7: Desenho experimental ao qual os lagartos Tropidurus hispidus foram submetidos
22
Figura 8: Ilustração da metodologia utilizada na contagem de células 27 Figura 9: Análise do comportamento apresentado pelos animais 29 Figura 10: Correlação entre distância percorrida e movimento de cabeça 30 Figura 11: Western blots para testar a especificidade do anticorpo Zif268 em
estratos de cérebros do lagarto
31
Figura 12: Gráficode mediana e quartis para o número de células reativas a Zif268 no Septo do lagarto Tropidurus hispidus 32
de Zif268 no grupo exploração 32
Figura 14: Gráficode mediana e quartis para o número de células reativas a Zif268 no Córtex Medial do lagarto Tropidurus hispidus 33
Figura 15: Córtex Medial do Lagarto Tropidurus hispidus: A, localização esquemática da área analisada. B, coloração de Nissl indicando o padrão citoarquitetônico nessa estrutura. C, padrão de reatividade de Zif268 no grupo controle. D, padrão de reatividade
de Zif268 no grupo exploração 33
Figura 16: Gráficode mediana e quartis para o número de células reativas a Zif268 no Córtex Dorso Medial do lagarto Tropidurus hispidus 34
Figura 17: Córtex Dorso Medial do Lagarto Tropidurus hispidus: A, localização esquemática da área analisada. B, coloração de Nissl indicando o padrão citoarquitetônico nessa estrutura. C, padrão de reatividade de Zif268 no grupo controle. D, padrão de
reatividade de Zif268 no grupo exploração 34
Figura 18: Gráficode mediana e quartis para o número de células reativas a Zif268 no Córtex Dorsal do lagarto Tropidurus hispidus
35
Figura 19: Córtex Dorsal do Lagarto Tropidurus hispidus: A, localização esquemática da área analisada. B, coloração de Nissl indicando o padrão citoarquitetônico nessa estrutura. C, padrão de reatividade de Zif268 no grupo controle. D, padrão de reatividade
de Zif268 no grupo exploração 35
Figura 20: Gráficode mediana e quartis para o número de células reativas a Zif268 no Córtex Lateral do lagarto Tropidurus hispidus 36
reatividade de Zif268 no grupo controle. D, padrão de reatividade
de Zif268 no grupo exploração 36
Figura 22: Gráficode mediana e quartis para o número de células reativas a Zif268 na Área Dorsoventricular do lagarto Tropidurus hispidus 37
Figura 23: Área Dorsoventricular do Lagarto Tropidurus hispidus: A, localização esquemática da área analisada. B, coloração de Nissl indicando o padrão citoarquitetônico nessa estrutura. C, padrão de reatividade de Zif268 no grupo controle. D, padrão de
reatividade de Zif268 no grupo exploração 37
Figura 24: Gráficode mediana e quartis para o número de células reativas a Zif268 no Estriado do lagarto Tropidurus hispidus
38
Figura 25: Estriado do Lagarto Tropidurus hispidus: A, localização esquemática da área analisada. B, coloração de Nissl indicando o padrão citoarquitetônico nessa estrutura. C, padrão de reatividade de Zif268 no grupo controle. D, padrão de reatividade de Zif268 no grupo exploração
38
Figura 26: Médias e desvios do número de células nas diferentes áreas analisadas para cada animal do grupo exploração 39
Figura 27: Médias e desvios do número de células nas diferentes áreas
analisadas para cada animal do grupo controle 40
Figura 28: Aumento de células reativas a Zif268 em estruturas do cérebro do lagarto tropical Tropidurus hispidus após exposição ao
ambiente enriquecido 41
Figura 29: Correlação entre número de células reativas a Zif268 em determinadas áreas telencefálicas e distância percorrida pelos
LISTA DE ABREVIATURAS
ADV Área Dorsoventricular AE Ambiente Enriquecido
ATV Área Telencefálica Ventral (subpallium de teleósteo) Ca Complexo Amigdalóide
CA1 Corno de Ammon (área 1) CA3 Corno de Ammon (área 3) CD Córtex Dorsal
CDM Córtex Dorsomedial CL Córtex Lateral CM Córtex Medial CRT Controle
DAB 3,3' Diaminobenzidina EXP Exploração
GD Giro Denteado
HC Hipocampo
Ht Hipotálamo
LTP Long-Term Potentiation NCx Neocórtex
Pc Porção Central (Pallium de teleósteo) PD Pallium Dorsal
Pd Porção Dorsal (Pallium de teleósteo) PFA Paraformaldeído
Pir Piriforme
Pl Porção Lateral (Pallium de teleósteo) PL Pallium Lateral
PM Pallium Medial
Pm Porção Medial (Pallium de teleósteo) PV Pallium Ventral
RVD Região Ventricular Dorsal
Sep Septo
St Estriado
Ta Tálamo
TB Tampão Bloqueador
RESUMO
Neste trabalho, foram investigadas alterações comportamentais associadas ao aumento da expressão da proteína Zif268 em áreas telencefálicas do lagarto tropical Tropidurus hispidus correspondentes ao Hipocampo (HC) de mamíferos. Foram utilizados 13 animais machos do lagarto T. hispidus, coletados no campus da Escola Agrotécnica Federal do RN, sob a licença do SISBIO (n.19561-1). Quatro animais tiveram seus cérebros removidos a fresco e submetidos a Western blot com anticorpo para a proteína Zif268. Os animais restantes foram separados em dois grupos distintos, grupo controle (n=4) e grupo exploração (n=5). Animais do grupo exploração foram expostos a um Ambiente Enriquecido (AE) com diversas pistas espaciais desconhecidas pelos animais. Os animais do grupo controle permaneceram no ambiente ao qual já estavam previamente habituados. Transcorridos 90min do início da exposição ao ambiente, animais de ambos os grupos, foram submetidos a perfusão intracardíaca com fixador, e os cérebros foram removidos crioprotegidos e congelados. Posteriormente os cérebros foram seccionados a 20µm e submetidos à imunohistoquímica para Zif268. Verificamos a conservação da proteína Zif268 no cérebro do T. hispidus, com antigenicidade para o anticorpo anti-Zif268 produzido em mamíferos. Nos lagartos do grupo exploração detectou-se aumento da expressão da proteína Zif268 no Septo, Estriado, Área Dorsoventricular e áreas corticais que correspondem ao HC (Córtices Medial – CM, Dorsal – CD, Dorsomedial CDM). Esse aumento é proporcional à exploração do ambiente novo, com máxima correlação nas subáreas hipocampais do grupo exploração, Córtex Medial (R = 0,94 e p = 0,004) e Dorsomedial (R = 0,92 e p = 0,006). Os dados corroboram a noção de que o hipocampo reptiliano, assim como o HC de mamíferos, desempenham um papel importante na exploração de novos ambientes.
ABSTRACT
In the present work, we investigated behavioral changes associated with the increase in Zif268 protein expression within telencephalic areas of the tropical lizard Tropidurus hispidus that correspond to the mammalian hippocampus (HC). We used 13 male individuals of this species, collected at the Federal Agrotechnical School of Rio Grande do Norte, under SISBIO license number 19561-1. Four animals had their brains removed and were submitted to a Western blot with antibodies for the Zif268 protein. The remaining animals were separated in two different groups: a control group (n=4) and an exploration group (n=5). Animals from the exploration group were exposed to an enriched environment with many sensory cues novel to them. Control group animals stayed in the environment they were already habituated to. After 90 min from the onset of exposure to the new environment, animals from both groups were submitted to intracardiac perfusion with fixative, and the brains were removed, cryoprotected and frozen. After that, brains were sectioned at 20 µm and the sections were subjected to immunohistochemistry for the Zif268 protein. We verified that the Zif268 protein is likely conserved in the brain of T. hispidus, which showed antigenicity for the antibody anti-Zif268 made in mammals. In animals from the exploration group, we detected an increase of the Zif268 protein in the Septum, Striatum, Dorsoventricular Area and in cortical areas corresponding to the HC. This increase was proportional to the amount of environmental exploration, with maximum positive correlation in the hippocampal subareas Medial Cortex (R = 0.94 and p = 0.004) and Dorsomedial Cortex (R = 0.92 and p = 0.006). The data corroborate the notion that the reptilian hippocampus, as well as the mammalian HC, plays an important role in spatial exploration.
1. APRESENTAÇÃO
Todas as experiências vivenciadas pela primeira vez desencadeiam um mosaico de informações sensoriais e emoções. Essas sensações são diferentes entre os indivíduos, pois estão diretamente relacionadas ao conjunto de experiências individuais adquiridas. A memória formada ao momento do contato com o novo é fruto dos processos mnemônicos provocados pelo estímulo externo e fatores internos de cada organismo. Esse processo biológico que ocorre ao contato com o diferente justifica o pensamento de que “Nada do que foi será de novo do jeito que já foi um dia [...] tudo que se vê não é igual ao que a gente viu há um segundo” (Lulu Santos/Nelson Mota).
pelos animais em resposta a determinados estímulos.
O que fazer para entender como os diferentes grupos de organismos reagem quando submetidos a novas experiências? Será que há fatores evolutivos envolvidos nesses processos? Várias são as questões levantadas quando se trata desse tema. Para responder à primeira questão, é preciso recorrer às pesquisas de caráter comportamental aliadas às neurofisiológicas. A segunda questão parece ter uma resposta óbvia e abre precedentes para novos questionamentos. Certamente há fatores evolutivos envolvidos. Mas quais seriam esses fatores e em que organismos surgiram?
Os estudos de evolução do sistema nervoso em fósseis enfrentam várias dificuldades, já que os mesmos são constituídos por matéria mole e pouco fossilizável. O que se sabe sobre a evolução desse sistema é baseado apenas em informações de volume e forma, deduzidos através da análise do crânio (Krubitzer, 2007). Entretanto, grupos animais atualmente são uma excelente fonte de inferências sobre a ancestralidade comum de caracteres. Associadas a esse recurso natural, novas técnicas experimentais tem contribuído significativamente para o esclarecimento da evolução das funções cerebrais.
O presente estudo objetiva esclarecer aspectos neuroevolutivos entre dois grandes grupos de vertebrados amnióticos, répteis e mamíferos, no que se refere à exploração de ambientes enriquecidos. Para tanto, foi utilizado como modelo animal o lagarto tropical comum Tropidurus hispidus, pertencente à ordem Squamata (Reptilia).
2. INTRODUÇÃO
2.1 Expressão de Zif268 e plasticidade neuronal após exploração de ambientes enriquecidos.
O termo plasticidade deriva do grego plastos que significa moldado. Foi introduzido na neurociência pela primeira vez por William James em 1890 referindo-se a susceptibilidade das alterações comportamentais (Pascual-Leone et al., 2005). Ramón y Cajal (1904) em sua obra, Textura del sistema nervioso del hombre y los vertebrados, fala que para que ocorram os fenômenos de mutabilidade comportamental é necessário que ocorra um reforço de vias orgânicas pré-estabelecidas, a formação de novas vias por ramificação e crescimento progressivo da arborização dendrítica e dos terminais nervosos. Atualmente sabe-se que, além das modificações propostas por Ramón y Cajal, ocorrem modificações moleculares envolvendo transcrição gênica e síntese de proteínas envolvidas nesses processos plásticos.
depois verificaram alterações químicas (aumento de neurotransmissores) e anatômicas (aumento do número de espinhas dendríticas) no sistema nervoso desses animais.
Subsequentemente, muitos outros trabalhos reforçaram a teoria de Hebb, apresentando diferentes fenômenos plásticos no cérebro adulto, incluindo desde alterações químicas, alterações nas arborizações axônicas e dendríticas, neurogênese, gliogênese e sinaptogênese associadas a processos de aprendizagem e memória (Diamond et al. 1966, 1976; Holloway, 1966; Bennett et al. 1969; Walsh et al. 1969; Cummins et al. 1973; Greenough, 1973; Turner & Greenough, 1985; Kempermann, 1997).
O avanço das técnicas para o estudo do sistema nervoso foi um dos fatores que contribuiu para conhecer cada vez mais os fenômenos plásticos ocorridos após exposição ao AE. Umas dessas técnicas é a imunohistoquímica, desenvolvida na década de 1980. Com essa técnica é possível identificar o produto da expressão de genes envolvidos com os fenômenos plásticos oriundos da exposição ao AE, destacando-se o gene zif268.
zif268 pode ser encontrado na literatura pelos nomes de egr-1 (early growth response gene 1), NGFI-A (nerve growth factor-induced gene A), Krox-24 (Kr finger probe), TIS8 (tetradecanoyl phorbol acetate-induced sequence 8) e pelo termo ZENK, que corresponde a um acrônimo dos quatro primeiros citados anteriormente e designa o homólogo em aves do gene clonado em mamíferos (Mello et al., 1992; Knapska & Kaczmarek, 2004). A expressão desse gene envolve as seguintes etapas (Figura 1): despolarização da membrana neuronal, seguida da entrada de cálcio (Ca2+) na célula e conseguinte fosforilação da proteína-ligante-de-elemento-responsivo-a-cálcio (CREB) (Changelian et al. 1989). Tem sido mostrado também que a ativação de diferentes classes de receptores glutamatérgicos (NMDA, AMPA e cainato) pode estimular a expressão de zif268 (Condorelli et al., 1994; Ghosh et al., 1994).
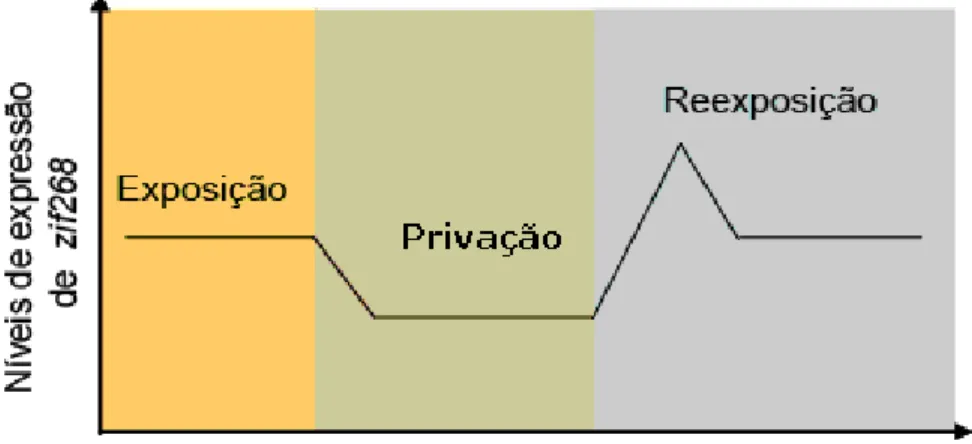
Figura 1: Representação esquemática do mecanismo de indução do gene zif268.
Adaptado de Knapska and Kaczmarek (2004).
Citoplasma
A proteína Zif268, no núcleo celular, atua regulando a expressão de diversos outros genes de transcrição tardia e que estão envolvidos com plasticidade neuronal. Entre eles, descata-se as sinapsinas I e II, o neuropeptídeo Y e a acetilcolinesterase (Knapska & Kaczmarek, 2004).
Figura 2: Níveis de expressão de zif268 no sistema nervoso de animais submetidos a
diferentes condições. Figura adaptada de Kaczmarek (2000).
A associação entre o fenômeno de LTP e a expressão de zif268 tem sido amplamente estudada na plasticidade neural associada a processos de aprendizagem e formação de memórias. Em camundongos geneticamente modificados para não conter o gene zif268, Bozon et al. (2003a) observaram uma redução da LTP no giro denteado (GD) do HC desses animais. Além disso, apesar da ausência total da proteína Zif268 não implicar na diminuição da formação de memórias de curta duração, déficits de memória de longa duração foram observados, confirmando o envolvimento dessa proteína no processo de consolidação de memórias. Knapska & Kaczmarek (2004) defendem a idéia de que a associação entre a LTP e a expressão de zif268 reflete os mecanismos subjacentes à plasticidade neuronal, sendo a expressão gênica em questão responsável pela manutenção do fenômeno plástico resultante.
mnemônicos que envolvem a formação de memórias. Além de mamíferos, a proteína Zif268 já foi encontrada no sistema nervoso de peixes ( Long & Salbaum, 1998; Burmeister & Fernald, 2005), anfíbios (Mangiamele & Burmeister, 2008) e aves (Long & Salbaum, 1998; Mello et al., 1992; Thode et al., 2005). Em répteis a única evidência dessa proteína foi encontrada em culturas de células de tartaruga (Mokin & Keifer, 2005). Até o momento sua presença não foi demonstrada em lagartos.
2.2 Evolução do sistema nervoso dos vertebrados
A evolução dos seres vivos proporcionou, entre outras coisas, o aparecimento de funções cada vez mais complexas. Esse surgimento está orquestrado com o aparecimento de novos tipos celulares, aumento no tamanho e volume de algumas estruturas, surgimento de outras e uma progressiva especialização anatomo-funcional. A origem e desenvolvimento de novas estruturas cerebrais nos vertebrados, ao longo da evolução, expressão transformações fenotípicas desses seres (Krubitzer, 2007). Os estudos sobre a evolução do sistema nervoso permitem um melhor entendimento dos processos mnemônicos que estão envolvidos nos comportamentos apresentados pelos diferentes grupos de vertebrados.
1/Zash 1a são expressos no pallium e subpallium, respectivamente (Wullimann and Mueller, 2004). Em ambas as estruturas, tanto na fase de desenvolvimento quanto na fase adulta, estímulos ambientais demandam diferentes níveis de atividade neuronal (Shumway, 2008). Isso resulta em fenômenos plásticos nessas áreas, mais intensos durante a fase de desenvolvimento do que na fase adulta (O'Leary & Nakagawa, 2002). Quanto menos desenvolvidas essas estruturas, menos especializadas são as modulações, de forma que uma mesma área palial pode estar envolvida com funções diferentes.
Com a mudança de ambiente (aquático para terrestre) o sistema visual dos animais foram aprimorados. A visão, utilizada antes somente por animais de águas rasas e claras, torna-se essencial e necessária na formação de mapas cognitivos que se baseiam em pistas visuais. Concomitantemente, surgiram as estruturas que formam o complexo amigdalóide e o HC, que juntamente com o hipotálamo formam o sistema límbico. Esse sistema conferiu a essas novas espécies comportamentos mais complexos e com maior grau de sofisticação (Ribas, 2006).
apenas da região que corresponde ao CD desse animal ancestral (Northcut & Kass, 1995).
Trabalhos utilizando técnicas de marcação topográfica da expressão de determinados genes envolvidos durante o desenvolvimento telencefálico revelaram um novo componente localizado na região equatorial entre o pallium e o subpallium, denominado de Pallium Ventral (PV) que pode estar relacionado com a origem do NCx (Smith et al., 1998; Puelles et al., 1999; Puelles et al., 2000). O PV de peixes e anfíbios corresponde em répteis a ADV e em mamíferos aos núcleos laterais basais da amígdala. Ambas as estruturas possuem a mesma origem embrionária, assim como o CD de répteis é embriologicamente comparado ao NCx de mamíferos.
Uma outra questão a ser discutida é o desenvolvimento laminar do NCx. Em répteis o córtex é reduzido e formado apenas por três camadas (Figura 3), enquanto que em mamíferos o neocórtex corresponde a uma grande parte da massa encefálica e é formado por seis camadas (Ten Donkelaar, 1998). Uma possível origem das demais camadas corticais presentes em mamíferos pode ser explicada através dos estudos de migração neuronal que ocorrem durante a fase embrionária. Células migraram radial e lateralmente, das camadas mais internas para a periferia e para a lateral, formando o NCx em mamíferos com um grande volume e com maior número de camadas (Aboitiz et al., 2002).
Lateral (CL) de répteis e o NCx de mamíferos (Aboitiz, 1999a; b; Aboitiz et al., 2002a; b; Aboitiz et al., 2002c; Medina e Abellan, 2009).
Pm Pd Pc PI Sep PV PM PD PL St Sep PM PD St RVD Pir ATV CM CDM CD RVD CL St Sep Ca Cc NCx St Ca Pir Ta Ht Hc
PEIXE
Teleósteo
ANFÍBIO
Anuro
AVE
Columbiforme
RÉPTIL
Lagarto
MAMÍFERO
Camundongo
Figura 3: Diagrama esquemático de cortes coronais do telencéfalo de diferentes espécies de vertebrados (peixe, anfíbio, ave, réptil e mamífero), destacando o pallium
indicado pela cor cinza. Abreviaturas: ATV, área telencefálica ventral (subpallium de teleósteo); Ca, Complexo amigdalóide; Cc, corpo caloso; CD, córtex dorsal; CDM, córtex dorso medial; CL, córtex lateral; CM, córtex medial; Hc, hipocampo; Ht, Hipotálamo; NCx, neocórtex; Pc, porção central (pallium de teleósteo); Pd, porção dorsal (pallium de teleósteo); PD, pallium dorsal; Pir, piriforme ou córtex olfatório; Pl, porção lateral (pallium de teleósteo); PL, pallium lateral; Pm, porção medial (pallium de teleósteo); PM, pallium medial; PV, pallium ventral; RVD, região ventricular dorsal; Sep, septo; St, corpo estriado e Ta, tálamo. As figuras correspondentes ao telencéfalo de peixe, anfíbio, ave e mamífero foram adaptadas de Abellan et al. (2009), enquanto a de réptil é de autoria própria.
situam-se mais ventralmente acompanhando o fascículo prosituam-sencefálico medial. As projeções ascendentes deste núcleo ao CM podem ser consideradas como as vias septo-hipocampais (Font et al., 1997). Estas projeções são, além de colinérgicas, GABAérgicas (Martinez-Guijarro & Freund, 1992).
Já em mamíferos a entrada da informação no HC (Figura 4A) ocorre através da via perfurante, que acaba massivamente na metade externa da camada molecular do GD. Nos mamíferos, ao contrário dos répteis, o tálamo quase não projeta ao HC. As principais projeções do tálamo vão direto ao neocórtex e dai retornam. Apenas os núcleos talâmicos da linha média se projetam ao estrato lacunoso molecular da área CA1 e ao córtex parahipocampal (Vertes & Hoover, 2008). Em contraposição, o sistema hipocampo-septal apresenta uma estrutura quase invariável nos amniotas. Sugere-se que o córtex hipocampal está implicado na geração de mapas alocêntricos do ambiente, através dos quais os animais podem navegar e gerar memórias episódicas de diferentes graus de complexidade (Day et al., 2001; Rodriguez et al., 2002).
Figura 4: Esquema das principais projeções hipocampais em mamíferos (A) e répteis (B). Abreviaturas: CA1, (corno de Ammon área 1); CA3 (corno de Ammon área 3); CD, Córtex Dorsal; CDM, Córtex Dorso Medial; CM, Córtex Medial e GD, Giro Denteado. Esquema adaptado de, A (Johnson, 1998) e B (Hoogland, 1988).
2.3 Tropidurus hispidus como modelo experimental
Figura 5: Imagem do lagarto Tropidurus hispidus. Fonte: Ângelo Branco.
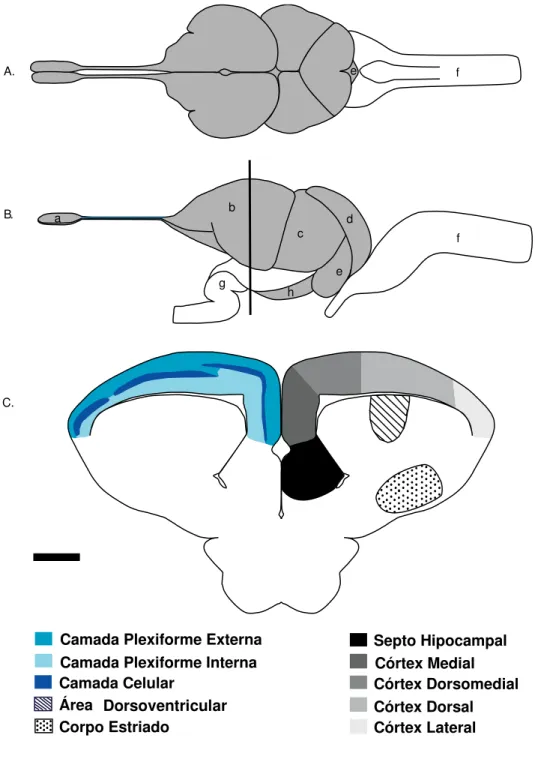
O córtex cerebral desses animais possui relações filogenéticas com o HC em mamíferos (Aboitiz, 1999b; Aboitiz et al., 2002b; Aboitiz et al., 2002c). Essa estrutura pode ser dividida em quatro distintas áreas (CM, CDM, CD, e CL) e em três camadas (plexiforme interna, plexiforme externa e camada celular), (Figura 6). A plexiforme interna encontra-se anexa ao ventrículo lateral e a plexiforme externa encontra-se anexa à pia-máter. A camada celular encontra-se entre as duas plexiformes e possui a maior concentração de células. Comparando-se o córtex cerebral desse animal com o da lagartixa européia Podarcis hispanica, observa-se nessa última que as células do CD apresentam-se concentradas na camada celular, enquanto que em Tropidurus hispidus essa laminação não fica muito evidente (De La Iglesia & Lopez-Garcia, 1997a; b; De La Iglesia et al., 1994).
coordenado pelo pesquisador Murilo Marchioro desenvolve trabalhos com esse modelo. Por ser um animal de pequeno porte, não agressivo e de ampla distribuição, o lagarto constitui um bom modelo experimental, contribuindo para um melhor entendimento dos mecanismos envolvidos na formação de memória em répteis.
A formação de memória em répteis ainda é considerada um assunto controverso, embora alguns estudos mostrem que lesões no cérebro de lagartos, em áreas homólogas ao HC de mamíferos, não causam déficits de memória nesses animais (Day et al., 2001; Ivazov, 1983; Peterson, 1980).
Córtex Dorsal Septo Hipocampal Córtex Medial Córtex Dorsomedial Córtex Lateral a b c
d e f
g a b c d e f A. B. C. h Camada Celular Área Visual Corpo Estriado
Camada Plexiforme Interna Camada Plexiforme Externa
Figura 6: Ilustração A e B são figuras adaptadas de Greeberg (1982). A- Vista dorsal,
B-Vista lateral, C- Corte coronal do telencéfalo indicando as três camadas corticais (camada celular, plexiformes externa e interna) e as principais regiões telencefálicas (septo hipocampal, área visual, corpo estriado, córtices medial, dorsomedial, dorsal e lateral). Observam-se ainda: a- bulbo olfatório, b- hemisférios telencefálicos, c- mesencéfalo (teto ótico), d- cerebelo, e- tronco encefálico (bulbo e ponte), f- medula, g- quiasma ótico e
h-hipotálamo. Escalas: 250 m (A e B), 150 m (C).
3. OBJETIVOS
1 – Estudar o comportamento apresentado pelos animais submetidos ao ambiente enriquecido e compará-lo ao comportamento dos animais que permanecem no ambiente ao qual foram habituados;
2 - Verificar se o anticorpo policlonal reconhece a proteína Zif268 em extratos de cérebro do lagarto Tropidurus hispidus;
3 – Estudar o efeito do AE na expressão de Zif268 nas diferentes áreas do telencéfalo do Tropidurus hispidus,
4. MATERIAIS E MÉTODOS
4.1. Animais
Utilizamos 13 lagartos machos da espécie Tropidurus hispidus coletados no campus da Escola Agrotécnica Federal do Rio Grande do Norte, sob a licença do Instituto Chico Mendes de Conservação da Biodiversidade, do Instituto Brasileiro de Meio Ambiente e dos Recursos Naturais Renováveis (nº. 19561-1) e da Comissão de Ética para Avaliação de Uso e Cuidados de Animais em Pesquisa da Associação Alberto Santos Dumont de Apoio à Pesquisa (AASDAP). Dos animais utilizados nesse trabalho, 4 utilizamos para verificar a presença da proteína Zif268 através da técnica de Western blot, enquanto que os outros 9 submetemos ao delineamento experimental do tópico 4.2. Todos os animais pesavam entre 40 g e 50 g, e mediam de 100 a 120 mm (distância entre a boca e a cloaca). Nenhum dos animais apresentava qualquer tipo de mutilação ou anormalidades corporais.
manipulação por um período de 5 min com a finalidade de habituá-los aos manuseios durante os experimentos.
4.2 Aparato comportamental e ambiente enriquecido
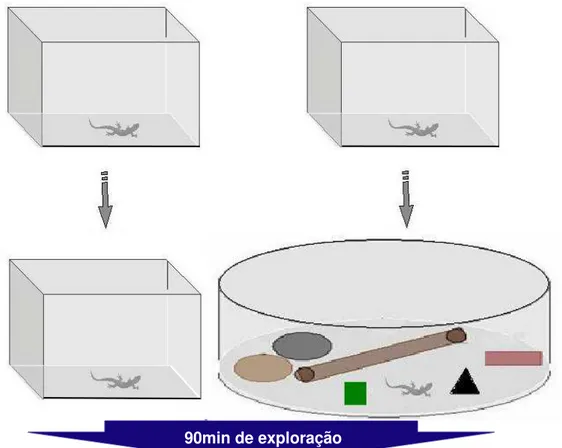
Para a indução de exploração do AE foi utilizada uma arena circular com 1 metro de diâmetro. Na mesma foi distribuídos vários objetos aleatoriamnete de forma a manter os quatro quadrantes da arena com configurações diferenciadas (Figura 7). Entre os objetos utilizados destacam-se pedras ornamentais, esponjas, escovão de limpeza, objetos plásticos de diversas texturas e partes de/ou aparelhos eletrônicos em desuso.
No centro do aparato havia uma caixa de vidro idêntica as que foram utilizadas como aquários para os animais durante o período de habituação. Essas caixas não possuia fundo, possibilitando sua remoção quando assim necessária (ver detalhes no delineamento experimental). Assim como as demais caixas, as paredes de vidro foram revestidas por papel escuro impossibilitando ao animal a visualização do ambiente externo.
4.3 Desenho experimental
Os animais foram divididos em dois grupos (controle e exploração) (Figura 7). O grupo controle (n = 4) permaneceu no ambiente ao qual estava habituado e não recebeu nenhum estímulo diferente dos que recebera durante a quarentena. No dia do experimento, após o animal acordar, desenterrar e apresentar os primeiros movimentos corporais, os animais foram filmados por 90 minutos e depois desse período foram anestesiados com tiopental sódico i.p. (Cristália, Brasil; 60mg/Kg) e imediatamente perfundidos (detalhes da perfusão no Item 4.4).
Figura 7: Desenho experimental ao qual os lagartos Tropidurus hispidus foram
submetidos. Grupo controle (n = 4) e grupo exposto (n = 5).
90min de exploração
Perfusão em PFA (4%) em tampão (PB)
Os animais do grupo exploração (n = 5) foram transferidos da caixa em que viviam para uma outra caixa que ficava dentro de uma arena circular de 1 m de diâmetro (ver detalhes do aparato to tópico anterior). Durante 4 dias os animais permaneceram nesse ambiente com as mesmas condições dadas aos animais do grupo controle. Na noite anterior ao quinto dia, quando os animais estavam enterrados, as paredes da caixa foram removidas e os animais foram filmados. Animais que se desenterrassem ou apresentassem algum movimento foram descartados do experimento. Na manhã do quinto dia, os animais foram filmados por 90 minutos após acordar, enquanto exploravam o novo ambiente. Em seguida, foram anestesiados e submetidos à perfusão da mesma forma que o grupo controle (Figura 7).
4.4 Western blot
Para o Western blot foram utilisados 4 dos animais (Tropidurus hispidus) que se encontravam em quarentena sem novos estímulos. Os animais foram anestesiados com tiopental sódico i.p. (Cristália, Brasil; 60mg/Kg) e logo em seguida o telencéfalo foi removido. Depois foram imediatamente congelados em um pequeno tubo utilizando uma mistura de gelo seco e álcool.
secundário anti-coelho produzido em cabra (Vector Labs, EUA). Foram utilizados anticorpo anti-actina como controle. As bandas foram visualizadas utilizando ECL chemiluminescence system (Amersham Biosciences).
Para demonstrar a especificidade do anticorpo, uma amostra de extrato protéico telencefálico foi incubada, durante 60 minutos, com uma mistura de anticorpo primário (anti-Zif268) mais peptídeo específico que inibia a ação desse anticorpo, procedendo-se em seguida aos ensaios de Western blot.
4.5 Perfusão e crioproteção
4.6 Coloração de Nissl
A técnica de Nissl é uma das técnicas histológicas mais utilizadas para o estudo do sistema nervoso. Essa técnica cora os ácidos nucleicos, marcando o núcleo fortemente e também parte do citoplasma.
As seções previamente montadas em lâminas histológicas carregadas eletricamente (Super Frost Plus, VWR International, EUA) foram mergulhadas em uma solução de ácido acético em água destilada (1µl/6ml) por 6 minutos, depois banhadas em solução de cresil violeta por 8 minutos e submetidas a uma bateria de desidratação (alcoóis 70%, 80%, 90%, 100% e xileno) um minuto cada. Após essa etapa as lâminas foram envolvidas com resina e cobertas por lamínulas.
4.7 Imunohistoquímica para Zif268
lâminas foram submetidas a uma bateria de desidratação de álcoois 70%, 80%, 90%, 100% e xileno, por um minuto cada. Após essa etapa, as lâminas foram cobertas com meio de inclusão (Entellan, Merck) e montadas com lamínula. De modo a certificar a especificidade da marcação para Zif-268, o anticorpo primário foi substituído pelo soro normal em algumas seções, escolhidas aleatoriamente.
4.8 Contagem de células
As células do hemisfério direito de 4 seções consecutivas ao mesmo nível (região intercomissural) foram contadas utilizando um microscópio óptico (Nikon Eclipse 80i) com câmera fotográfica digital acoplada (CX9000 MicroBrightField Inc., USA) e programas de computador específicos para essa finalidade (Neurolucida 8.0, MicroBrightField Inc., USA; PictureFrame TM, versão 2.3 MicroBrightField Inc., USA; NeuroExplorer, MicroBrightField Inc., USA).
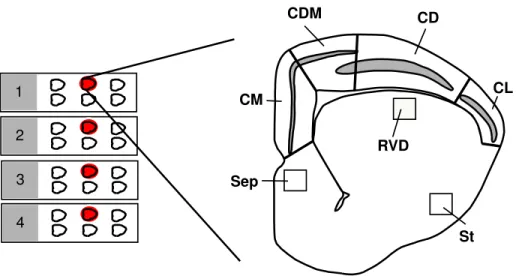
Nas áreas CM, CD, CDM e CL dos cortes analisados, todas as células que apresentaram reatividade para a proteína Zif268 foram contadas. Para a região da área visual, septo e o corpo estriado, um campo de 250x250µm2 foi escolhido no centro dessas áreas e as células presentes nesse campo (Figura 8) foram contadas.
4.9 Análise estatística
da média, dependendo da análise estatística efetuada. Foram realizadas correlações entre os dois comportamentos analisados (distância percorrida durante o período de exploração e movimentos de cabeça para as diferentes ireções) e correlações do número de células reativas a Zif268 entre as áreas telencefálicas aqui estudadas através do coeficiente de Spearman (Rs), sendo considerados significativos valores de p<0,05. Já as correlações entre comportamento e número de células reativas a Zif268, foram realizadas através do coeficiente de Spearman (Rs), mas nesse caso foi aplicado o teste de Bonferroni para correção de múltiplas comparações, sendo considerados significativos valores de p<0,007.
Figura 8: Ilustração da metodologia utilizada na contagem de células. Abreviaturas: CD, córtex dorsal; CDM, córtex dorso medial; CL, córtex lateral; RVD, região ventricular dorsal; Sep, septo e St, estriado. A área selecionada pelo quadrado corresponde a 250x250 µm2.
CM
RVD
CL
St Sep
CDM CD
5. RESULTADOS
5.1 Comportamento
Os animais submetidos ao paradigma de exploração de um ambiente enriquecido apresentaram um maior deslocamento comparado aos animais que permaneceram no ambiente em que estavam habituados (Figura 9A). Esse deslocamento é estatisticamente significativo entre os dois grupos analisados. O Grupo exploração deslocou-se 17,38 ± 0,95 m (média ± erro padrão da média) e o grupo controle 5,6 ± 1,15 m, havendo uma diferença significativa entre os grupos, com p=0,0159 (as medianas correspondem respectivamente a 18,01 e 5,35 m). O grupo exploração permaneceu alguns minutos movendo apenas a cabeça em diversas direções. Transcorridos cerca de dez minutos, os animais passaram a se locomover pela arena. Os períodos de deslocamento foram intercalados por algumas paradas do animal em diversos pontos. Durante essas paradas foi observado que os animais apresentavam exploração visual, movendo a cabeça para os lados. Todos os lagartos do grupo exploração visitaram os quatro quadrantes da arena.
Figura 9: Análise do comportamento apresentado pelos animais. Em A, dados referentes à distância percorrida pelos animais do grupo controle mantidos no ambiente de habituação e pelos animais submetitos ao ambiente enriquecido. Em B, dados de movimentos de cabeça para as diferentes direções.
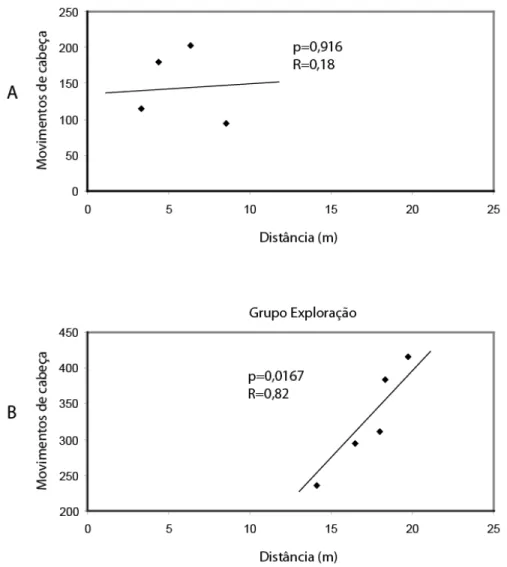
Figura 10: Correlação entre distância percorrida e movimento de cabeça. Em A, correlação para os dados referentes ao grupo controle. Em B, correlação para os dados referentes ao grupo exploração. Os segmentos representam regressões lineares.
5.2 Presença de Zif268 no cérebro do lagarto Tropidurus hispidus
anticorpo utilizando um peptídeo específico foi realizado para verificar a especificidade do anticorpo (Figura 11B).
Figura 11: Western blots para testar a especificidade do anticorpo Zif268 em estratos de
cérebros do lagarto. Em A, observa-se semelhança entre as bandas que representam a proteína Zif268 no Tropidurus hispidus e no rato (Rattus norvegicus). Na figura B, o
bloqueio total da proteína Zif268 indica que o anticorpo produzido em mamífero mantém sua especificidade no lagarto.
5.3 Células reativas a Zif268
5.3.1 SEPTO
Figura 12: Gráficode mediana e quartis para o número de células reativas a Zif268 no Septo do lagarto Tropidurus hispidus. CTRL, grupo controle e EXP, grupo exploração.
Figura 13: Septo do Lagarto Tropidurus hispidus: A, localização esquemática da área
5.3.2 CÓRTEX MEDIAL
Figura 14: Gráfico de mediana e quartis para o número de células reativas a Zif268 no Córtex Medial do lagarto Tropidurus hispidus. CTRL, grupo controle e EXP, grupo
exploração.
Figura 15: Córtex Medial do Lagarto Tropidurus hispidus: A, localização esquemática da
área analisada. B, coloração de Nissl indicando o padrão citoarquitetônico nessa estrutura. C, padrão de reatividade de Zif268 no grupo controle. D, padrão de reatividade de Zif268 no grupo exploração. Nota-se uma maior reatividade no grupo exploração.
5.3.3 CÓRTEX DORSO MEDIAL
Figura 16: Gráfico de mediana e quartis para o número de células reativas a Zif268 no Córtex Dorso Medial do lagarto Tropidurus hispidus. CTRL, grupo controle e EXP, grupo
exploração.
Figura 17: Córtex Dorso Medial do Lagarto Tropidurus hispidus: A, localização
esquemática da área analisada. B, coloração de Nissl indicando o padrão de distribuição citoarquitetônico nessa estrutura. C, padrão de reatividade de Zif268 no grupo controle.
5.3.4 CÓRTEX DORSAL
Figura 18: Gráfico de mediana e quartis para o número de células reativas a Zif268 no Córtex Dorsal do lagarto Tropidurus hispidus. CTRL, grupo controle e EXP, grupo
exploração.
Figura 19: Córtex Dorsal do Lagarto Tropidurus hispidus: A, localização esquemática da
5.3.5 CÓRTEX LATERAL
Figura 20: Gráfico de mediana e quartis para o número de células reativas a Zif268 no Córtex Lateral do lagarto Tropidurus hispidus. CTRL, grupo controle e EXP, grupo
exploração.
Figura 21: Córtex Lateral do Lagarto Tropidurus hispidus: A, localização esquemática da
5.3.6 ÁREA DORSOVENTRICULAR
Figura 22: Gráfico de mediana e quartis para o número de células reativas a Zif268 na Área Dorsoventricular do lagarto Tropidurus hispidus. CTRL, grupo controle e EXP, grupo
exploração.
Figura 23: Área Dorsoventricular do Lagarto Tropidurus hispidus: A, localização
esquemática da área analisada. B, coloração de Nissl indicando o padrão de distribuição citoarquitetônico nessa estrutura. C, padrão de reatividade de Zif268 no grupo controle.
5.3.7 ESTRIADO
Figura 24: Gráfico de mediana e quartis para o número de células reativas a Zif268 no Estriado do lagarto Tropidurus hispidus. CTRL, grupo controle e EXP, grupo exploração.
Figura 25: Estriado do Lagarto Tropidurus hispidus: A, localização esquemática da área
Nas Figuras 26 e 27 pode-se observar os dados da quantificação das células para cada animal. Os gráficos representam as médias e desvios para cada área telencefálica analisada. A Figura 26 corresponde aos dados dos animais pertencentes ao grupo exploração (n=5), enquanto que a Figura 27 representa o grupo controle (n=4). Vale ressaltar que o número de células representado para o CDM, CD, CM e CL equivale à media do total de células encontradas em toda a área. Já o número de células representado para o Sep, St e AV equivale à média do total de células de uma área de 250x250 m2. Os dados encontrados em ambos os gráficos indicam semelhanças entre as médias dos números de células que encontramos entre os animais de cada grupo.
Figura 27: Médias e desvios do número de células nas diferentes áreas analisadas para cada animal do grupo controle.
Figura 28: Aumento de células reativas a Zif268 em estruturas do cérebro do lagarto tropical Tropidurus hispidus após exposição ao ambiente enriquecido. As porcentagens
apresentadas corresponde a razão entre o número de células reativas encontradas em estruturas do cérebro dos animais pertencente ao grupo exploração e o grupo controle. Quatro consecutivas seções do telencéfalo de cada lagarto de ambos os grupos, contendo todas as áreas analisadas no gráfico foram processadas para Zif268. Ver materiais e métodos para mais detalhes sobre a quantificação de células. Em vermelho, áreas que correspondem ao hipocampo do animal. Abreviaturas: CD, córtex dorsal; CDM, córtex dorso medial; CL, córtex lateral; ADV, Área Dorsoventricular; Sep, septo e St, estriado. (*) grupos que apresentam diferença estatisticamente signficativa entre os valores do grupo exploração e controle.
5.4 Correlações entre a expressão de zif268 nas diferentes áreas analisadas
CDM e CD; CM x Sep, CDM e DC). Nas correlações efetuadas entre as áreas dos animais pertencentes ao grupo exploração, apenas foram encontrados valores significativos de Rs para as correlações realizadas entre CM x CDM e CM x CD. Apesar de o CL enviar projeções para CM e CD, não foram encontradas correlação significativa entre essas áreas. Outras possíveis correlações foram realizadas, mas não aparecem na tabela por não apresentarem valores significativos de Rs.
Tabela 1: Correlação entre o número de células reativas para Zif268 das diferentes estruturas cerebrais analisadas.
Sep CM CDM CD St ADV CL
Ctr. Exp. Ctr. Exp. Ctr. Exp. Ctr. Exp. Ctr. Exp. Ctr. Exp. Ctr. Exp.
Sep - - 0,57 0,86 0,21 0,94 0,35 0,88 0,08 -0,12 0,33 -0,16 0,40 0,23
CM 0,57 0,86 - - 0,76 0,89 0,69 0,91 0,10 0,19 0,16 -0,26 0,23 0,29
St 0,08 -0,12 0,10 0,19 0,33 0,20 0,49 -0,30 - - 0,12 0,72 0,36 -0,10 Correlação de Spearman para o número de células reativas a Zif-268 entre as diferentes áreas telencefálicas analisadas. O valor de Rs para cada área foi obtido correlacionando o
número de células reativas a Zif268 encontrados em quatro consecutivas seções do telencéfalo de cada animal (grupo controle ou exploração). Rs foi considerado significativo
quando p<0,05. Outras correlações foram omitidas na tabela por não apresentarem valores significativos. Abreviaturas: CD, córtex dorsal; CDM, córtex dorso medial; CL, córtex lateral; ADV, Área Dorsoventricular; Sep, septo e St, estriado.
5.5 Correlações entre a expressão de zif268 e comportamento dos animais
Os possíveis correlatos comportamentais (distância e movimento de cabeça para as diferentes direções), associados com a expressão de zif268, apresentaram correlações significativas (p<0.007 corrigidas para o teste de Bonferroni).
encontrados valores significativos (p<0,007 após correção pelo teste Bonferroni) para as áreas CM e CDM (Figura 29 B e C).
Figura 29: Continuação da figura iniciada na página 43.
6. DISCUSSÃO
Para compreender melhor as bases comportamentais e neurais da exploração de ambientes novos em lagartos, espécimes da espécie Tropidurus hispidus foram expostos a um AE contendo diversos objetos novos. Verificou-se um aumento considerável da distância percorrida por esses animais no AE, quando comparado ao resultado apresentado pelo grupo controle, em que os animais permaneceram em um ambiente familiar (Figura 9). Esse aumento da atividade exploratória nos animais submetidos ao AE foi relatado pela primeira vez por Hebb, quando expôs ratos habituados a caixas de laboratório a um ambiente contendo diversos objetos novos (Hebb, 1947). Depois de Hebb, vários outros estudos demonstraram o aumento do comportamento exploratório em diferentes modelos animais expostos a novos ambientes (Gortz et al., 2008; Magalhães et al., 2008; Bell et al, 2009). Esses resultados evidenciam que a motivação natural de explorar lugares e objetos anteriormente desconhecidos não é um comportamento exclusivo de mamíferos, e sim um comportamento generalizado entre vertebrados. Nesse sentido, é interessante comparar o lagarto ao rato, importante modelo mamífero sobre o qual há bastante conhecimento acumulado.
ambiente. Zug (1993) descreve que movimentos repetitivos de cabeça são utilizados como uma forma de comunicação entre os lagartos, e que os olhos lateralizados possibilitam uma melhor percepção do ambiente que os cercam. As diferentes formas de exploração refletem a ocupação de nichos ecológicos diferentes entre ratos e lagartos. Enquanto ratos são animais que tipicamente forrageiam alimentos inanimados no escuro, lagartos como o T. hispidus são caçadores que esperam imóveis por presas ativas que passem por perto. Ratos se movem constantemente no forrageio, protegidos pela escuridão e premidos pela necessidade de explorar localmente o espaço, com uso das vibrissas e narinas. Lagartos, por outro lado, mimetizam o ambiente de modo a não serem percebidos sob a luz do sol. Movem cabeça e olhos com freqüência, investigando o ambiente com a visão. Movimentos do corpo inteiro ocorrem apenas ocasionalmente e de forma bastante rápida, permitindo aos animais ganhar posições vantajosas para a observação à distância, e atacar rapidamente as presas que passem por perto inadvertidamente.
Os dois comportamentos analisados neste projeto (distância percorrida e movimento de cabeça para as diferentes direções) apresentaram forte correlação entre si apenas para os animais pertencentes ao grupo exploração (Figura 10), indicando que em ambientes familiares a exploração está bastante diminuída. Os resultados sugerem também que os dois comportamentos estão intimamente relacionados, provavelmente por refletirem um mesmo nível de motivação exploratória do indivíduo.
exploratório, através da quantificação da proteína Zif268, amplamente descrita na literatura como marcadora de fenômenos plásticos no sistema nervoso de vertebrados. Uma vez que essa proteína ainda não havia sido demonstrada em representantes reptilianos, foram realizados Western blots com extratos protéicos preparados com tecido telencefálico de lagartos. Verificou-se que os anticorpos preparados em mamíferos possuem especificidade pela proteína Zif268 de lagartos e foi obtida a confirmação de que a mesma tem peso molecular similar em ratos e lagartos. A presente dissertação é o primeiro trabalho a demonstrar tal resultado em um representante da classe Reptilia. O padrão de marcação celular obtido a partir da técnica de imunohistoquímica e a posição das bandas encontradas em extratos protéicos são semelhantes aos encontrados em outros grupos de vertebrados. Com os resultados desse estudo, fica demonstrada em todos os grupos de vertebrados a presença dessa proteína. A preservação de Zif268 no sistema nervoso de animais pertencentes a todas as classes de vertebrados indica tratar-se de um mecanismo primitivo e antigo envolvido em fenômenos plásticos.
Uma vez determinada a presença da proteína Zif268 no cérebro do Tropidurus hispidus, foram analisadas as variações dos níveis de sua expressão, assim como as áreas em que isso ocorre. Após exposição ao AE verificou-se um aumento da expressão de Zif268 em áreas telencefálicas do lagarto (Figura 28). Essa diferença também foi observada por Olsson (1994) após expor, pela primeira vez, ratos a um AE.
homólogo ao GD de mamíferos corresponde à área em que foi observado um maior aumento do número de células reativas a essa proteína. Talvez esse resultado ocorra por ser o CM a área com maior densidade de células por mm2. Esse dado corrobora o resultado encontrado por Soulé el al. (2008) após apresentar objetos novos a ratos da linhagem Sprague-Dawley. As áreas correspondentes a CA1 e CA3, respectivamente CDM e CD, formadas em sua maior parte por neurônios piramidais, também apresentaram diferença significativa nos níveis de expressão protéica entre os grupos controle e experimental, também observada na região CA1 de ratos (Wallace et al., 1995) e CA3 (Toscano, 1996). A atividade de CA1 em mamíferos está relacionada com o mapeio espacial de ambientes (O'Keefe e Dostrovsky, 1971). Knapska & Kaczmarek (2004), após revisão de vários trabalhos, sugere que a expressão da proteína Zif268 no HC de mamíferos, associada ao fenômeno de LTP, está envolvida com formação de memórias espaciais.
O CL que não apresentou aumento significativo está envolvido com informações quimiossensoriais originárias do bulbo olfatório dos lagartos, correspondendo ao núcleo piriforme em mamíferos (Abellan et al., 2009). Em lagartos, esse núcleo projeta-se para o HC, Sep e amígdala (Molowny et al., 1987).
Foram obtidos valores significativos para algumas das correlações realizadas entre o número de células reativas a Zif268 nas diferentes áreas telencefálica, principalmente entre os animais pertencentes ao grupo exploração (Tabela 1). Destacaram-se as correlações entre o Sep e as áreas hipocampais reptilianas (CM, CDM e CD). Esse resultado aponta para um possível envolvimento do Sep na ativação das demais áreas corticais reptilianas durante a exploração espacial. Winson (1972, 1978) demonstrou a presença de uma onda do tipo teta em CA1 , controlada pelo Sep hipocampal. Correlações significativas também encontradas entre o CM e demais áreas do hipocampo primitivo (CDM e CD), corroborando a interatividade entre essas áreas e suas possíveis funções na formação de memória espacial nesse grupo de vertebrados.
7. CONCLUSÃO
Esse trabalho é o primeiro a apresentar a expressão de Zif268, in vivo, em um representante da classe Reptilia, o lagarto tropical Tropidurus hispidus. A proteína em questão encontra-se conservada em relação à proteína homóloga em ratos, ocorre em regiões telencefálicas do lagarto, e apresenta aumento dos níveis de expressão em áreas do hipocampo reptiliano quando os animais exploram um ambiente novo.
8. PERSPECTIVAS
REFERENCIAL BIBLIOGRÁFICO
Abellan, A., Legaz, I., Vernier, B., Retaux, S., Medina, L., 2009. Olfactory and amygdalar structures of the chicken ventral pallium based on the combinatorial expression patterns of LIM and other developmental regulatory genes. J Comp Neurol. 516, 166-186.
Aboitiz, F., 1999a. Comparative development of the mammalian isocortex and the reptilian dorsal ventricular ridge. Evolutionary considerations. Cereb Cortex. 9, 783-791.
Aboitiz, F., 1999b. Evolution of isocortical organization. A tentative scenario including roles of reelin, p35/cdk5 and the subplate zone. Cereb Cortex. 9, 655-661.
Aboitiz, F., Montiel, J., Lopez, J., 2002a. Critical steps in the early evolution of the isocortex: insights from developmental biology. Braz J Med Biol Res. 35, 1455-1472.
Aboitiz, F., Montiel, J., Lopez, J., 2002b. An hypothesis on the early evolution of the development of the isocortex. Brain Res Bull. 57, 481-483.
Aboitiz, F., Montiel, J., Morales, D., Concha, M., 2002c. Evolutionary divergence of the reptilian and the mammalian brains: considerations on connectivity and development. Brain Res Brain Res Rev. 39, 141-153.
Baiard, D. C., Conhecimento, evolução e complexidade na filosofia sintética de Herbert Spencer., Dissertação FFCLRP USP, Ribeirão Preto, 2008.
Bell, J. A., Livesey, P. J., Meyer, J. F., 2009. Environmental Enrichment Influences Survival Rate and Enhances Exploration and Learning But Produces Variable Responses to the Radial Maze in Old Rats. Dev. Psychobiol 51: 564-578.
Bennett, E. L., Rosenzweig, M. R. & Diamond, M. C., 1969. Rat brain: effects of environmental enrichment on wet and dry weights. Science 164: 825–826.
dorsal forebrain. Psyhobiology. 17, 445-449.
Bozon, B., Davis, S., Laroche, S., 2003a. A requirement for the immediate early gene zif268 in reconsolidation of recognition memory after retrieval. Neuron. 40, 695-701.
Bozon, B., Kelly, A., Josselyn, S. A., Silva, A. J., Davis, S., Laroche, S., 2003b. MAPK, CREB and zif268 are all required for the consolidation of recognition memory. Philos Trans R Soc Lond B Biol Sci. 358, 805-814.
Burmeister, S. S., Fernald, R. D., 2005. Evolutionary conservation of the egr-1 immediate-early gene response in a teleost. J Comp Neurol. 481, 220-232. Cajal, S. R., 1904. Textura del sistema nervioso del hombre y de los vertebrados.,
vol. 1. Imprenta y Librería de Nicolás Moya, Madrid.
Christy, B., Nathans, D., 1989. DNA binding site of the growth factor-inducible protein Zif268. Proc Natl Acad Sci U S A. 86, 8737-8741.
Condorelli, D. F., Dell'Albani, P., Amico, C., Lukasiuk, K., Kaczmarek, L., Giuffrida-Stella, A. M., 1994. Glutamate receptor-driven activation of transcription factors in primary neuronal cultures. Neurochem Res. 19, 489-499.
Cummins, R. A., Walsh, R., Budtz-Olsen, O. E., Konstantinos, T. & Horsfall, C. R., 1973. Environmentally-induced changes in the brains of elderly rats. Nature 243: 516–518.
Davis, K. M., Burghardt, G. M., 2007. Training and long-term memory of a novel food acquisition task in a turtle (Pseudemys nelsoni). Behav Processes. 75, 225-230.
Day, L. B., Crews, D., Wilczynski, W., 2001. Effects of medial and dorsal cortex lesions on spatial memory in lizards. Behav Brain Res. 118, 27-42.
De La Iglesia, J. A., Lopez-Garcia, C., 1997a. A Golgi study of the principal projection neurons of the medial cortex of the lizard Podarcis hispanica. The Journal of Comparative Neurology. 000, 528-564.
De La Iglesia, J. A., Lopez-Garcia, C., 1997b. A Golgi study of the short-axon interneurons of the cell layer and inner plexiform layer of the medial cortex of the lizard Podarcis hispanica. The Journal of Comparative Neurology. 385, 565-598.
Diamond, M. C., Ingham, C. C., Johnson, R. E., Bennett, E. L. & Rosenzweig, M. R. Effects of environment on morphology of rat cerebral cortex and hippocampus. J. Neurobiol. 7: 75–85 (1976).
Diamond, M.C., Law, F., Rhodes, H., Lindner, B., Rosenzweig, M.R., Krech, D., Bennett, E.L., 1966. Increases in cortical depth and glia numbers in rats subjected to enriched environment. J. Comp. Neurol. 128: 117–126.
Font, E., Desfilis, E., Perez-Canellas, M., Alcantara, S., Garcia-Verdugo, J. M., 1997. 3-Acetylpyridine-induced degeneration and regeneration in the adult lizard brain: a qualitative and quantitative analysis. Brain Res. 754, 245-259.
Ghosh, A., Ginty, D. D., Bading, H., Greenberg, M. E., 1994. Calcium regulation of gene expression in neuronal cells. J Neurobiol. 25, 294-303.
Greeberg, N., 1982. A forebrai atlas and stereotaxic technique for the lizard, Anolis carolinensis. Journal of Morphology. 174, 217-236.
Greenough, W. T. & Volkmar, F. R., 1973. Pattern of dendritic branching in occipital cortex of rats reared in complex environments. Exp. Neurol. 40: 491–504.
Gortz, N., Lewejohann, L., Tomm, M., Ambrée, O., Keyvani, K., Paulus, W., Sachser,. N., 2008. Effects of environmental enrichment on exploration, anxiety, and memory in female TgCRND8 Alzheimer mice. Behavioural Brain Research. 191: 43–48
Grisham, W., Powers, A. S., 1989. Function of the dorsal and medial cortex of turtles in learning. Behav Neurosci. 103, 991-997.
Grisham, W., Powers, A. S., 1990. Effects of dorsal and medial cortex lesions on reversals in turtles. Physiol Behav. 47, 43-49.
Guzowski, J. F., Setlow, B., Wagner, E. K., McGaugh, J. L., 2001. Experience-dependent gene expression in the rat hippocampus after spatial learning: a comparison of the immediate-early genes Arc, c-fos, and zif268. J Neurosci. 21, 5089-5098.
Hebb, D.O., 1947. The effects of early experience on problem solving at maturity. Am. Psychol. 2, 306–307.