RÚBENS PRINCE DOS SANTOS ALVES
DESENVOLVIMENTO DE UMA VACINA DE SUBUNIDADE CONTRA
O SOROTIPO 2 DO VÍRUS DENGUE BASEADA NA PROTEÍNA NÃO
ESTRUTURAL 5 (NS5).
Dissertação apresentada ao Programa de Pós-Graduação em Microbiologia do Instituto de Ciências Biomédicas da Universidade de São Paulo, para obtenção do título de Mestre em Ciências.
Área de Concentração: Microbiologia Orientador: Prof. Dr. Luís Carlos de Souza Ferreira
Versão original
RESUMO
ALVES, R. P. S. Desenvolvimento de uma vacina de subunidade contra o sorotipo 2 do vírus dengue baseada na proteína não estrutural 5 (NS5). 2015. 69 f. Dissertação de (Mestrado em Microbiologia) – Instituto de Ciências Biomédicas, Universidade de São Paulo, São Paulo, 2015.
A dengue é uma doença causada por quatro sorotipos do vírus da dengue (DENV 1-4), com milhões de pessoas afetadas em todo o mundo e um número significativo de mortes. Não há nenhum tratamento eficaz ou abordagens vacinais capazes de prevenir a infecção. As estratégias vacinais contra a dengue baseadas em proteínas não estruturais como antígenos têm demonstrado serem mais seguras do que as baseadas em proteínas estruturais. Além disso, respostas imunes celulares direcionadas a proteínas não estruturais desempenham um papel importante no controle da replicação viral. A proteína não estrutural 5 (NS5) do vírus dengue é a proteína mais conservada entre os quatro sorotipos e desempenha um papel crucial na replicação viral. Neste estudo, foi gerada uma forma recombinante da NS5 expressa em E. coli em quantidades elevadas e com propriedades antigênicas preservados em relação à proteína nativa. As condições de cultura foram optimizadas, a fim de permitir a expressão dessa proteína na forma solúvel. A imunização de camundongos Balb/c com a NS5 sozinha ou em combinação com um adjuvante (poli (I:C)) promoveu o aumento da sobrevida de camundongos imunizados após desafio intracraniano com a linhagem JHA1 de DENV2. A combinação da NS5 com poli (I:C) emulsionado em Montanide 720 induziu a expansão de linfócitos T CD8+ específicos. Em
conjunto, os resultados indicam que a proteína recombinante NS5 preserva determinantes antigênicos da proteína nativa e pode ser uma ferramenta útil para estudos sobre a biologia do DENV, busca de drogas anti-viriais e desenvolvimento de vacinas.
.
ABSTRACT
ALVES, R. P. S. Development of a subunit vaccine against dengue virus serotype 2 based on the non-structural protein 5 (NS5). 2015. 69 p. Master thesis (Microbiology) – Instituto de Ciências Biomédicas, Universidade de São Paulo, São Paulo, 2015.
Dengue fever is a disease caused by four dengue virus serotypes (DENV 1-4), affecting millions of people worldwide and causing a significant number of deaths. There are no effective treatments or vaccine approaches capable of preventing such infection. Anti-DENV vaccine strategies based on nonstructural proteins as antigens have been shown to be safer than those based on structural proteins. In addition, anti-DENV cellular immune responses against nonstructural proteins have shown to play a major role in controlling viral replication. The DENV nonstructural protein 5 (NS5), the most conserved protein among the four serotypes, plays a crucial role in viral replication. In this study, we generated a recombinant form of DENV2 NS5 expressed in E. coli in high amounts and with preserved antigenic properties with regard to the native protein. Culture conditions were optimized in order to allow expression of NS5 as a soluble protein. The immunization of Balb/c mice using this protein alone or in combination with poly (I:C) led to increased survival after intracranial challenge with the DENV2 JHA1 strain. The combination of the protein with poly (I:C) emulsified in Montanide 720 led to the activation of NS5-specific CD8+ T lymphocytes. Altogether, the results indicate that the recombinant NS5 protein preserves antigenic determinants of the native protein and may be a useful tool for studies dealing with the DENV's biology, search for anti-viral drugs and vaccine development.
1 INTRODUÇÃO
1.1 O vírus e a doença
A febre da dengue é uma doença de caráter agudo, causada pelo virus Dengue (DENV), um arbovírus componente do gênero Flavivirus pertencente à família Flaviviridae transmitido por mosquitos do gênero Aedes (BHATT et al., 2013; GUZMAN et al., 2010). No ciclo urbano, o DENV circula na forma de quatro tipos imunologicamente distinguíveis (sorotipos): DENV-1, DENV-2, DENV-3 e DENV-4, que apresentam aproximadamente 30% de divergência na sequência de nucleotídeos dos seus genomas (BLOK, 1985; CHAN et al., 1965; DIERCKS, 1959; MYERS et al., 1964; SMITH, 1956). A infecção por um deles confere resposta imunológica protetora permanente contra o mesmo sorotipo e de curta duração contra os outros sorotipos (GUZMAN et al., 2010; GUZMAN; HARRIS, 2014; SABIN, 1952; WHITEHEAD et al., 2007).
Figura 1. Representação esquemática do genoma do vírus dengue. O genoma do vírus dengue é composto por um RNA de fita simples com orientação positiva e possui aproximadamente 11 kB que codifica 10 proteínas maduras, três estruturais: Capsídeo (C), Membrana (M) e Envelope (E) e sete proteínas não estruturais (NS): NS1, NS2 A e B, NS3, NS4 A e B e NS5. Há duas regiões não traduzíveis
em ambas as extremidades da fita de RNA chamadas de UTR (do inglês Untranslated Region). Fonte:
Guzman, et al., 2010.
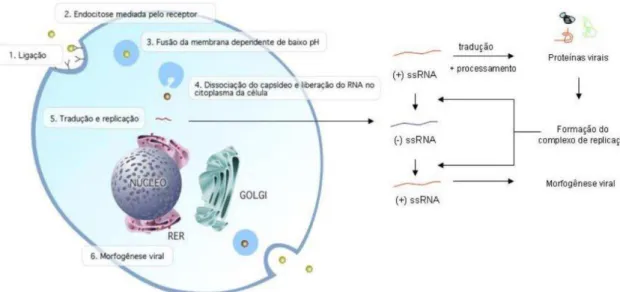
três proteínas estruturais: do capsídeo (C), do envelope (E), e a proteína precursora de membrana (prM), a qual sofre clivagem e origina a proteína de membrana (M); e sete proteínas não-estruturais que são: NS1, NS2a, NS2b, NS3, NS4a, NS4b e NS5 (RODENHUIS-ZYBERT et al., 2010). Quando o mosquito transfere o vírus para o homem, ocorrem as etapas do processo infeccioso e replicação viral (figura 2). Durante a infecção natural, as principais células-alvo de infecção pelo vírus dengue são monócitos, macrófagos e células dendríticas (HALSTEAD et al., 1980).
Figura 2. Etapas do processo de replicação do DENV. A primeira etapa no processo de infecção do DENV é a ligação (1) ao receptor viral, seguido de endocitose mediada por receptor (2). O pH no interior do endossomo é reduzido à medida que se aproxima do centro celular, o que induz a fusão da membrana do vírus com a do endossomo (3), permitindo a liberação do RNA no citoplasma da célula (4). Em seguida, a poli proteína viral é traduzida e maturada, e o RNA replicado pelo complexo de replicação (5), resultando finalmente na morfogênese de novas partículas virais e liberação dessas partículas no meio extracelular. RER: retículo endoplasmático rugoso; (+) ssRNA: RNA de fita simples com orientação positiva; (-) ssRNA: RNA de fita simples com orientação negativa. Fonte: Amorim; Alves; Ferreira, 2009.
depende do domínio MTAse da NS5, que juntamente com a NS3, participam da síntese do CAP tipo I na porção 5’ da fita de RNA e desenovelamento do dsRNA (ACKERMANN; LUO et al., 2008b; PADMANABHAN, 2001). Por fim, há morfogênese viral e liberação de novas partículas infectantes (KUHN et al., 2002).
A infecção pelo DENV, após 4-8 dias de incubação, pode ser assintomática ou com sintomatologia de caráter subclínico. No entanto, a doença se manifesta abruptamente em três fase: febril, crítica e de recuperação. A fase crítica se inicia após a febre e o quadro patológico que pode se manifestar por sinais como: dores de cabeça, mialgia, artralgia, vômitos e dor abdominal aguda, bem como, o aumento da permeabilidade vascular, que podem gerar desde raches cutâneos a choque hipovolêmico, coagulação intravascular disseminada e hemorragia grave (GUZMAN; HARRIS, 2014; WORLD HEALTH ORGANIZATION, 2009). Devido ao amplo espectro de sinais e sintomas que podem ser desenvolvidos na dengue, a organização mundial de saúde (WHO, 2009), substituiu os termos febre hemorrágica da dengue (FHD) e síndrome de Choque da dengue (SCD), pela classificação de dengue com sinais de alerta e dengue com sinais de gravidades (WHO, 2009). Essa nova recomendação de classificação possibilitou que a triagem em áreas endêmicas fosse melhorada, visto que, instituiu o uso de outros sinais clínicos como indicativo de suspeita de dengue. Além disso, a decisão clínica para o tratamento da dengue com sinais de gravidade se tornou mais rápida, visto que o extravasamento de plasma deixou de ser uma característica sine qua non de dengue grave, de modo que o início precoce de tratamento em dengue com sinais de gravidade reduz o risco de morte de 20% para 1% (HORSTICK et al., 2012; SRIKIATKHACHORN et al., 2011).
Estudos recentes mostram que 96 milhões de casos anuais podem ter sintomas com severidade suficiente para alterar a rotina do indivíduo infectado (BHATT et al., 2013) e segundo estudos anteriores, cerca de 500 mil casos evoluem para forma grave. A taxa de mortalidade nestes grupos chega a 10% (50 mil) em indivíduos hospitalizados e 30% (150 mil) em indivíduos não hospitalizados (BARRETO; TEIXEIRA, 2008; GUZMAN et al., 2010 PONGSUMPUN et al., 2008; WHITEHEAD et al., 2007). Estas informações deixam clara a urgente necessidade de desenvolvimento de uma vacina para controle desta doença.
1.2 O desenvolvimento de vacinas contra a dengue
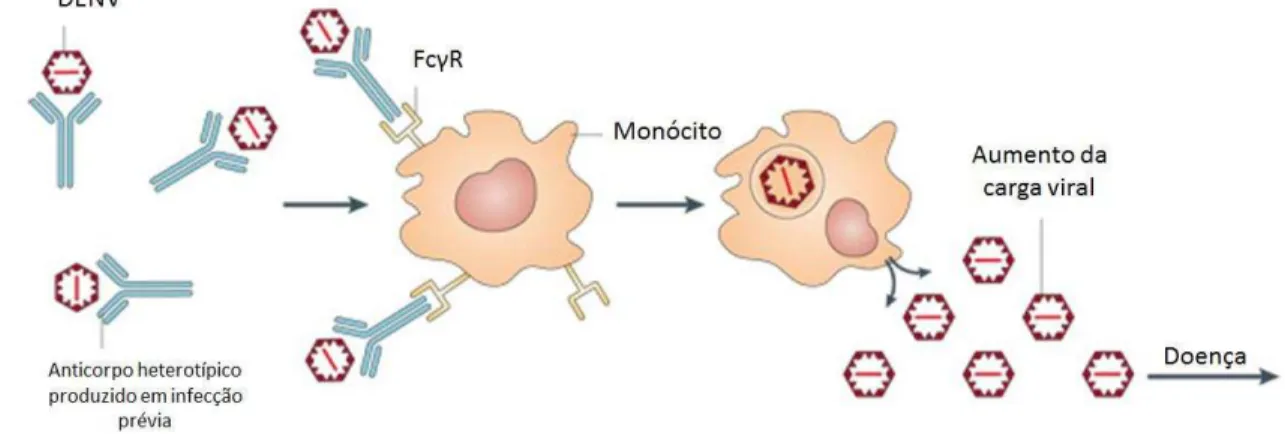
evidencias experimentais e epidemiológicas que indicam que numa infecção secundária por um sorotipo diferente da primeira infecção, a replicação viral seria exacerbada pela facilitação de infecção de células imunológicas por uma via dependente de anticorpos sub-neutralizantes gerados durante a primeira infecção (figura 3). Este processo denominado ADE (do inglês
Antibody Dependent Enhancement) proporciona o aumento da carga viral e intensifica a
resposta inflamatória, sendo associado também ao desenvolvimento das formas de dengue com sinais de gravidade (HALSTEAD et al., 1977, 1980; HALSTEAD; O’ROURKE, 1977; HALSTEAD, 1979). Logo, vacinas monovalentes oferecem riscos quanto à segurança frente a infecções por DENV diferente do sorotipos vacinal.
Figura 3. Modelo do aumento da infecção do vírus dengue mediada por anticorpo. Esse fenômeno ocorre quando anticorpos heterotípicos, formados durante uma infecção primaria com o DENV, ligam-se à partícula viral de outro sorotipo de DENV numa infecção subsequente. Os anticorpos da infecção primária não podem neutralizar o vírus eficazmente. Em vez disso, o complexo anticorpo-vírus se liga
aos receptores chamados receptores Fcγ (FcγR) em monócitos circulantes. Os anticorpos ajudam o vírus
infectar estas células de forma mais eficiente resultando num aumento global da carga viral. Adaptado de Whitehead, et al., 2007.
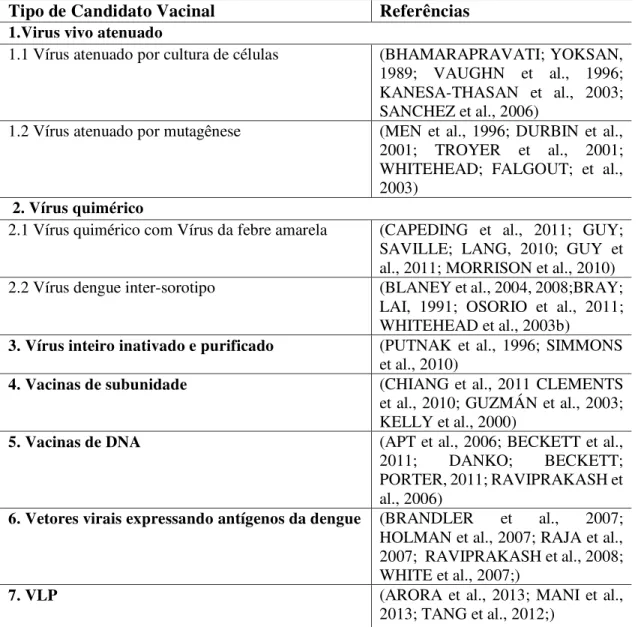
Tabela 1. Diferentes tipos de candidatos vacinais contra a dengue e seus desenvolvedores.
Diversos grupos empenham-se no desenvolvimento de abordagens baseadas nas vacinas de DNA (COSTA; FREIRE; ALVES, 2006; COSTA et al., 2007, 2011; WU et al., 2003a), porém, os riscos de geração de autoimunidade bem como a geração de tolerância ao antígeno continuam sendo os principais riscos associados a esse tipo de abordagem (KLINMAN et al., 2000). Já as vacinas de subunidade, embora, por definição, necessitem de adjuvantes para desencadear efeito protetor, induzem respostas imunológicas consideráveis e fornecem flexibilidade quanto às vias de administração (AMORIM et al., 2012; PANG, 2003). Portanto, as vacinas de subunidade, como as usadas neste trabalho, são mais seguras e de mais fácil aprovação quando comparadas às vacinas de DNA e com o vírus.
Tipo de Candidato Vacinal Referências
1.Virus vivo atenuado
1.1 Vírus atenuado por cultura de células (BHAMARAPRAVATI; YOKSAN,
1989; VAUGHN et al., 1996; KANESA-THASAN et al., 2003; SANCHEZ et al., 2006)
1.2 Vírus atenuado por mutagênese (MEN et al., 1996; DURBIN et al.,
2001; TROYER et al., 2001; WHITEHEAD; FALGOUT; et al., 2003)
2. Vírus quimérico
2.1 Vírus quimérico com Vírus da febre amarela (CAPEDING et al., 2011; GUY;
SAVILLE; LANG, 2010; GUY et al., 2011; MORRISON et al., 2010)
2.2 Vírus dengue inter-sorotipo (BLANEY et al., 2004, 2008;BRAY;
LAI, 1991; OSORIO et al., 2011; WHITEHEAD et al., 2003b)
3. Vírus inteiro inativado e purificado (PUTNAK et al., 1996; SIMMONS et al., 2010)
4. Vacinas de subunidade (CHIANG et al., 2011 CLEMENTS et al., 2010; GUZMÁN et al., 2003; KELLY et al., 2000)
5. Vacinas de DNA (APT et al., 2006; BECKETT et al.,
2011; DANKO; BECKETT;
PORTER, 2011; RAVIPRAKASH et al., 2006)
6. Vetores virais expressando antígenos da dengue (BRANDLER et al., 2007; HOLMAN et al., 2007; RAJA et al., 2007; RAVIPRAKASH et al., 2008; WHITE et al., 2007;)
7. VLP (ARORA et al., 2013; MANI et al.,
As proteínas não estruturais são interessantes como antígenos alvos para uma vacina, visto o alto grau de conservação entre os sorotipos, a grande imunogenicidade das mesmas, e o risco nulo de indução de ADE, visto que essas proteínas não compões o vírion. As principais proteínas não estruturais do DENV são: NS1, NS3 e NS5. A NS1 é uma glicoproteína de 46-55 kDa, que pode ser associada à membrana citoplasmática, ou ainda, ser secretada para o meio extracelular e apesar de sua função biológica não ter sido totalmente elucidada, sabe-se que é altamente imunogênica (AVIRUTNAN et al., 2007a, 2011b; GAO et al., 2008). Dentro dos 26 anos desde o primeiro relato da NS1 em uma formulação vacinal, diversos trabalhos demonstram a capacidade dessa proteína em gerar proteção em modelo murino (AMORIM et al., 2012a; FALGOUT et al., 1990; HENRIQUES et al., 2013; WU et al., 2003b; ZHANG et al., 1988). É válido ressaltar que há algumas evidencias in vitro e in vivo que em condições altamente inflamatórias, a NS1 pode estar envolvida em fenômenos de autoimunidade, o que torna questionável o uso dessa proteína em formulações vacinais (AMORIM et al., 2014; AVIRUTNAN et al., 2007b, 2011a; MLADINICH et al., 2012).
A NS3 tem massa molecular de aproximadamente 70 kDa apresentando um domínio serino-protease (~18kDa) na região N-terminal e helicase (~ 52 kDa) na região C-terminal (LESCAR et al., 2008). A sua função biológica é vital para o ciclo viral, visto que há atuação tanto na clivagem da poli proteína resultante da tradução do RNA viral, bem como na função helicase que em conjunto com a NS5 promovem a replicação viral, sendo portanto, primordiais na biologia do patógeno (LUO; XU; HUNKE; et al., 2008). A NS3H se estende entre os aminoácidos 169-618, apresenta um sítio ATPase e por ser solúvel (diferente do domínio protease da NS3 e da proteína inteira) pode ser mais facilmente obtida (COSTA et al., 2011). Um fato relevante é que a NS3H conserva epítopos capazes de gerar uma resposta celular citotóxica (SPAULDING et al., 1999a) como foi visto no uso de linhagens vacinais de Salmonella Typhimurium como vetor para plasmídeos que continham um epítopo CTL específico presente na NS3H que se estendia entre os aminoácidos 298 e 306.
tetravalentes com vírus dengue atenuado levam à resposta citotóxica direcionada principalmente a essa proteína (WEISKOPF et al., 2014). A referida proteína não está associada a partículas virais livres e, provavelmente, não induz a formação de anticorpos anti-DENV facilitadores de infecção. Há ainda evidências relacionadas ao reconhecimento da NS5 como importante alvo na geração resposta imune celular em macacos Rhesus infectados com o DENV-2. Linfócitos capazes de reconhecer especificamente epítopos da NS5 exibiam perfil polifuncional (MLADINICH et al., 2012). Esse estudo foi pioneiro no uso da NS5 na forma recombinante como antígeno alvo em formulações vacinais contra a dengue.
1.3 Os adjuvantes vacinais
No geral, um adjuvante pode ser definido como um aditivo ou veículo que melhora a resposta imune adaptativa ou estimula o sistema imunológico inato de forma a induzir eficientemente os efeitos imunológicos desejados (SCHIJNS; LAVELLE, 2011). Os adjuvantes podem ser classificados em 3 tipos baseados no seu modo de ação (BRUNNER et al., 2010): Os adjuvantes do tipo A são, em sua maioria, derivados de patógenos e atuam por uma via imunoestimulatória específica nas células apresentadoras de antígenos (APC’s) pela indução de sinais de perigo. Idealmente, pela escolha do sinal correto de perigo, as APC’s podem ser programadas a induzirem uma resposta imunológica ajustada ao patógeno ao qual pertence o antígeno vacinal. Em contraste, os adjuvantes do tipo B promovem aumento da apresentação de antígenos (TEMMERMAN et al., 2011). Um clássico adjuvante desse tipo é o hidróxido de alumínio. Esse sal mineral é amplamente empregado em pesquisas e o único adjuvante viável para vacinas administradas em seres humanos no continente americano (AGUILAR; RODRÍGUEZ, 2007). Ainda dentro dessa classificação se têm: emulsões de óleo-em-água (o/w) e água-em-óleo (w/o), lipossomos, nanopartículas e micropartículas. Como é sabido, esses adjuvantes promovem o prolongamento da apresentação do antígeno via formação de depósito, proteção contra degradação, facilitação de entrega antigência direta nos linfonodos, aumento da captação por APCs e indução de apresentação cruzada. É importante ressaltar que a ausência de um agente imunoestimulatório pode resultar no favorecimento da tolerância imunológica ao antígeno (BRUNNER et al., 2010). Em contraste, os adjuvantes do tipo C promovem um sinal de perigo, porém sem a necessidade ativação das APCs, como exemplo se pode citar o Interferon do tipo 1 e o fator de necrose tumoral na sua forma solúvel em combinação a antígenos (BON, LE et al., 2001; KAYAMURO et al., 2009).
um potencial candidato a adjuvante do tipo 2 para vacinação contra infecções virais. Como sabido, dsRNA são ligantes do receptor do tipo Toll (TLR) 3 que, por sua vez, se localiza na membrana do compartimento endossomal da maioria das APCs (DESMET; ISHII, 2012; TAKEUCHI; AKIRA, 2010).
A combinação de adjuvantes do tipo A (imunoestimulador) com B (sistema de entrega) se mostra como uma estratégia promissora na proteção de ambos, antígeno e do imunoestimulador, contra degradação. Inclusive, já foi sugerido que a apresentação de um antígeno fagocitado é mais eficiente quando co-formulado com um imunoestimulador (BLANDER; MEDZHITOV, 2006; SCHLOSSER et al., 2008). Algumas formulações já foram desenvolvidas para a entrega do antígeno e poli (I:C). Como demonstrado em modelo murinho, o Montanide ISA 720, cria uma emulsão w/o, com o poli (I:C) capaz de desencadear uma resposta Th1 potente e persistente, com a proliferação de linfócitos T CD8+
CONCLUSÕES
Os objetivos almejados para desenvolvimento da presente dissertação foram alcançados e as conclusões obtidas foram:
A forma recombinante da proteína NS5 do DENV-2 foi obtida com alto rendimento em sistema procarioto a partir da fração solúvel. A proteína preserva epitopos conformacionais presentes na sua forma nativa.
A proteína NS5 recombinante aqui obtida é imunogênica quando administrada pela via subcutânea, induzindo a geração de IgG antígeno-especifica, produção de TNF-α e IFN-γ por células imunológicas e aumento de sobrevida em modelo de desafio com DENV-2 cepa JHA1.
A imunogenicidade da NS5 foi potencializada pela adição de adjuvantes em um protocolo vacinal, desencadeando uma resposta humoral sistêmica com perfis de modulação adequado para cada formulação, entretanto nenhum dos adjuvantes induziu sobrevida maior que a induzida pela proteína sozinha.
A formulação M720, que continha além da proteína os adjuvantes poli (I:C) emulsificado em Montanide 720, foi capaz de ativar linfócitos T CD8+ específicos,
REFERÊNCIAS
ACKERMANN, M.; PADMANABHAN, R. De novo synthesis of RNA by the dengue virus RNA-dependent RNA polymerase exhibits temperature dependence at the initiation but not elongation phase. The Journal of biological chemistry, v. 276, n. 43, p. 39926–39937, 2001.
AGUILAR, J. C.; RODRÍGUEZ, E. G. Vaccine adjuvants revisited. Vaccine, v. 25, n. 19, p. 3752–3762, 2007.
AMORIM, J. H.; ALVES, R. P. D. S.; BOSCARDIN, S. B.; FERREIRA, L. C. D. S. The dengue virus non-structural 1 protein: risks and benefits. Virus research, v. 181, p. 53–60, 2014.
AMORIM, J. H.; DINIZ, M. O.; CARIRI, F. A M. O.; et al. Protective immunity to DENV2 after immunization with a recombinant NS1 protein using a genetically detoxified heat-labile toxin as an adjuvant. Vaccine, v. 30, n. 5, p. 837–845, 2012. AMORIM, J. H.; PEREIRA BIZERRA, R. S.; SANTOS ALVES, R. P. DOS; et al. A genetic and pathologic study of a DENV2 clinical isolate capable of inducing encephalitis and hematological disturbances in immunocompetent mice. PloS one, v. 7, n. 9, p. e44984, 2012.
APT, D.; RAVIPRAKASH, K.; BRINKMAN, A.; et al. Tetravalent neutralizing antibody response against four dengue serotypes by a single chimeric dengue envelope antigen. Vaccine, v. 24, n. 3, p. 335–344, 2006.
ARORA, U.; TYAGI, P.; SWAMINATHAN, S.; KHANNA, N. Virus-like particles displaying envelope domain III of dengue virus type 2 induce virus-specific antibody response in mice. Vaccine, v. 31, n. 6, p. 873–878, 2013.
AVIRUTNAN, P.; HAUHART, R. E.; SOMNUKE, P.; et al. Binding of flavivirus nonstructural protein NS1 to C4b binding protein modulates complement activation. Journal of immunology, v. 187, n. 1, p. 424–433, 2011a.
AVIRUTNAN, P.; HAUHART, R. E.; SOMNUKE, P.; et al. Binding of flavivirus nonstructural protein NS1 to C4b binding protein modulates complement activation. Journal of immunology, v. 187, n. 1, p. 424–433, 2011b.
AVIRUTNAN, P.; ZHANG, L.; PUNYADEE, N.; et al. Secreted NS1 of dengue virus attaches to the surface of cells via interactions with heparan sulfate and chondroitin sulfate E. PLoS pathogens, v. 3, n. 11, p. e183, 2007a.
De acordo com:
AVIRUTNAN, P.; ZHANG, L.; PUNYADEE, N.; et al. Secreted NS1 of dengue virus attaches to the surface of cells via interactions with heparan sulfate and chondroitin sulfate E. PLoS pathogens, v. 3, n. 11, p. e183, 2007b.
BARRETO, M. L.; TEIXEIRA, M. G. Dengue no Brasil: situação epidemiológica e contribuições para uma agenda de pesquisa. Estudos Avançados, v. 22, n. 64, p. 53– 72, 2008.
BECKETT, C. G.; TJADEN, J.; BURGESS, T.; et al. Evaluation of a prototype dengue-1 DNA vaccine in a Phase 1 clinical trial. Vaccine, v. 29, n. 5, p. 960–968, 2011.
BHAMARAPRAVATI, N.; YOKSAN, S. Study of bivalent dengue vaccine in volunteers. Lancet, v. 1, n. 8646, p. 1077-1081, 1989.
BHATT, S.; GETHING, P. W.; BRADY, O. J.; et al. The global distribution and burden of dengue. Nature, v. 496, n. 7446, p. 504–507, 2013..
BHATTACHARYA, D.; MAYURI; BEST, S. M.; et al. Protein kinase G phosphorylates mosquito-borne flavivirus NS5. Journal of virology, v. 83, n. 18, p. 9195–9205, 2009.
BIELEFELDT-OHMANN, H.; MEYER, M.; FITZPATRICK, D. R.; MACKENZIE, J. S. Dengue virus binding to human leukocyte cell lines: receptor usage differs between cell types and virus strains. Virus research, v. 73, n. 1, p. 81–89, 2001. BIEN, C. G.; BAUER, J.; DECKWERTH, T. L.; et al. Destruction of neurons by cytotoxic T cells: a new pathogenic mechanism in Rasmussen’s encephalitis. Annals of neurology, v. 51, n. 3, p. 311–318, 2002.
BINDER, G. K.; GRIFFIN, D. E. Immune-mediated clearance of virus from the central nervous system. Microbes and infection / Institut Pasteur, v. 5, n. 5, p. 439– 448, 2003.
BLANDER, J. M.; MEDZHITOV, R. Toll-dependent selection of microbial antigens for presentation by dendritic cells. Nature, v. 440, n. 7085, p. 808–812, 2006. BLANEY, J. E.; HANSON, C. T.; FIRESTONE, C.-Y.; et al. Genetically modified, live attenuated dengue virus type 3 vaccine candidates. The American journal of tropical medicine and hygiene, v. 71, n. 6, p. 811–821, 2004.
BLANEY, J. E.; SATHE, N. S.; GODDARD, L.; et al. Dengue virus type 3 vaccine candidates generated by introduction of deletions in the 3’ untranslated region (3' -UTR) or by exchange of the DENV-3 3'-UTR with that of DENV-4. Vaccine, v. 26, n. 6, p. 817–828, 2008.
BON, A. LE; SCHIAVONI, G.; D’AGOSTINO, G.; et al. Type i interferons potently enhance humoral immunity and can promote isotype switching by stimulating dendritic cells in vivo. Immunity, v. 14, n. 4, p. 461–470, 2001.
BRANDLER, S.; LUCAS-HOURANI, M.; MORIS, A.; et al. Pediatric measles vaccine expressing a dengue antigen induces durable serotype-specific neutralizing antibodies to dengue virus. PLoS neglected tropical diseases, v. 1, n. 3, p. e96, 2007. BRAY, M.; LAI, C. J. Construction of intertypic chimeric dengue viruses by substitution of structural protein genes. Proceedings of the National Academy of Sciences of the United States of America, v. 88, n. 22, p. 10342–10346, 1991. BRIEN, J. D.; UHRLAUB, J. L.; NIKOLICH-ZUGICH, J. West Nile virus-specific CD4 T cells exhibit direct antiviral cytokine secretion and cytotoxicity and are sufficient for antiviral protection. Journal of immunology, v. 181, n. 12, p. 8568– 8575, 2008.
BRUNNER, R.; JENSEN-JAROLIM, E.; PALI-SCHÖLL, I. The ABC of clinical and experimental adjuvants--a brief overview. Immunology letters, v. 128, n. 1, p. 29– 35, 2010.
CAPEDING, R. Z.; LUNA, I. A.; BOMASANG, E.; et al. Live-attenuated, tetravalent dengue vaccine in children, adolescents and adults in a dengue endemic country: randomized controlled phase I trial in the Philippines. Vaccine, v. 29, n. 22, p. 3863– 3872, 2011.
CHAKRABORTY, S.; NAZMI, A.; DUTTA, K.; BASU, A. Neurons under viral attack: victims or warriors? Neurochemistry international, v. 56, n. 6-7, p. 727–735, 2010.
CHAN, Y. C.; KANAPATHIPILLAI, K.; CHEW, K. S. Isolation of two strains of dengue virus type 3 in Singapore. Singapore medical journal, v. 5, n. 3, p. 127–132, 1965.
CHEN, C.; KUO, M.; CHIEN, L.; et al. RNA-protein interactions: involvement of NS3, NS5, and 3’ noncoding regions of Japanese encephalitis virus genomic RNA. Journal of Virology, v. 71, n. 5, p. 3466–3473, 1997.
CHEN, Y.; MAGUIRE, T.; HILEMAN, R. E.; et al. Dengue virus infectivity depends on envelope protein binding to target cell heparan sulfate. Nature medicine, v. 3, n. 8, p. 866–871, 1997.
CHEVALIER, G.; SUBERBIELLE, E.; MONNET, C.; et al. Neurons are MHC class I-dependent targets for CD8 T cells upon neurotropic viral infection. PLoS pathogens, v. 7, n. 11, p. e1002393, 2011.
CLAASSEN, M. A. A.; JANSSEN, H. L. A.; BOONSTRA, A. Role of T cell immunity in hepatitis C virus infections. Current opinion in virology, v. 3, n. 4, p. 461–467, 2013.
CLEMENTS, D. E.; COLLER, B.-A. G.; LIEBERMAN, M. M.; et al. Development of a recombinant tetravalent dengue virus vaccine: immunogenicity and efficacy studies in mice and monkeys. Vaccine, v. 28, n. 15, p. 2705–2715, 2010.
COSTA, S. M.; AZEVEDO, A. S.; PAES, M. V; et al. DNA vaccines against dengue virus based on the ns1 gene: the influence of different signal sequences on the protein expression and its correlation to the immune response elicited in mice. Virology, v. 358, n. 2, p. 413–423, 2007.
COSTA, S. M.; FREIRE, M. S.; ALVES, A. M. B. DNA vaccine against the non-structural 1 protein (NS1) of dengue 2 virus. Vaccine, v. 24, n. 21, p. 4562–4564, 2006.
COSTA, S. M.; YORIO, A. P.; GONÇALVES, A. J. S.; et al. Induction of a protective response in mice by the dengue virus NS3 protein using DNA vaccines. PloS one, v. 6, n. 10, p. e25685, 2011.
COUTARD, B.; DECROLY, E.; LI, C.; et al. Assessment of Dengue virus helicase and methyltransferase as targets for fragment-based drug discovery. Antiviral research, v. 106, p. 61–70, 2014.
CRILL, W. D.; ROEHRIG, J. T. Monoclonal antibodies that bind to domain III of dengue virus E glycoprotein are the most efficient blockers of virus adsorption to Vero cells. Journal of virology, v. 75, n. 16, p. 7769–7773, 2001.
DANKO, J. R.; BECKETT, C. G.; PORTER, K. R. Development of dengue DNA vaccines. Vaccine, v. 29, n. 42, p. 7261–7266, 2011.
DESMET, C. J.; ISHII, K. J. Nucleic acid sensing at the interface between innate and adaptive immunity in vaccination. Nature reviews. Immunology, v. 12, n. 7, p. 479– 491, 2012.
DIERCKS, F. H. Isolation of a type 2 dengue virus by use of hamster kidney cell cultures. The American journal of tropical medicine and hygiene, v. 8, n. 4, p. 488–491, 1959.
DINTZIS, H. M.; DINTZIS, R. Z.; VOGELSTEIN, B. Molecular determinants of immunogenicity: the immunon model of immune response. Proceedings of the National Academy of Sciences of the United States of America, v. 73, n. 10, p. 3671–3675, 1976.
DURBIN, A. P.; KIRKPATRICK, B. D.; PIERCE, K. K.; et al. A single dose of any of four different live attenuated tetravalent dengue vaccines is safe and immunogenic in flavivirus-naive adults: a randomized, double-blind clinical trial. The Journal of infectious diseases, v. 207, n. 6, p. 957–965, 2013.
ELGERT, K. D. Immunology: Understanding The Immune System. Hoboken: Wiley-Blackwel, 2009, 726 p.
FALGOUT, B.; BRAY, M.; SCHLESINGER, J. J.; LAI, C. J. Immunization of mice with recombinant vaccinia virus expressing authentic dengue virus nonstructural protein NS1 protects against lethal dengue virus encephalitis. Journal of virology, v. 64, n. 9, p. 4356–4363, 1990.
FIELD, R.; CAMPION, S.; WARREN, C.; MURRAY, C.; CUNNINGHAM, C. Systemic challenge with the TLR3 agonist poly I:C induces amplified IFNalpha/beta and IL-1beta responses in the diseased brain and exacerbates chronic neurodegeneration. Brain, behavior, and immunity, v. 24, n. 6, p. 996–1007, 2010. FRASER, J. E.; RAWLINSON, S. M.; WANG, C.; JANS, D. A.; WAGSTAFF, K. M. Investigating dengue virus nonstructural protein 5 (NS5) nuclear import. Methods in molecular biology, v. 1138, p. 301–328, 2014a.
FRASER, J. E.; RAWLINSON, S. M.; WANG, C.; JANS, D. A.; WAGSTAFF, K. M. Investigating dengue virus nonstructural protein 5 (NS5) nuclear import. Methods in molecular biology, v. 1138, p. 301–328, 2014b.
GALEA, I.; BECHMANN, I.; PERRY, V. H. What is immune privilege (not)? Trends in immunology, v. 28, n. 1, p. 12–18, 2007.
GAO, G.; WANG, Q.; DAI, Z.; et al. Adenovirus-based vaccines generate cytotoxic T lymphocytes to epitopes of NS1 from dengue virus that are present in all major serotypes. Human gene therapy, v. 19, n. 9, p. 927–936, 2008.
GUPTA, R. K.; SIBER, G. R. Adjuvants for human vaccines: current status, problems and future prospects. Vaccine, v. 13, n. 14, p. 1263–1276, 1995.
GUY, B.; BARRERE, B.; MALINOWSKI, C.; et al. From research to phase III: preclinical, industrial and clinical development of the Sanofi Pasteur tetravalent dengue vaccine. Vaccine, v. 29, n. 42, p. 7229–7241, 2011.
GUY, B.; SAVILLE, M.; LANG, J. Development of Sanofi Pasteur tetravalent dengue vaccine. Human vaccines, v. 6, n. 9, p. 325-332, 2010.
fascicularis immunized with recombinant dengue 4 virus envelope glycoprotein expressed in Pichia pastoris. The American journal of tropical medicine and hygiene, v. 69, n. 2, p. 129–134, 2003.
HAFNER, A. M.; CORTHÉSY, B.; MERKLE, H. P. Particulate formulations for the delivery of poly(I:C) as vaccine adjuvant. Advanced drug delivery reviews, v. 65, n. 10, p. 1386–1399, 2013.
HALSTEAD, S. B. In Vivo Enhancement of Dengue Virus Infection in Rhesus Monkeys by Passively Transferred Antibody. Journal of Infectious Diseases , v. 140 , n. 4 , p. 527–533, 1979.
HALSTEAD, S. B.; O’ROURKE, E. J. Dengue viruses and mononuclear phagocytes. I. Infection enhancement by non-neutralizing antibody. The Journal of experimental medicine, v. 146, n. 1, p. 201–217, 1977.
HALSTEAD, S. B.; O’ROURKE, E. J.; ALLISON, A. C. Dengue viruses and mononuclear phagocytes. II. Identity of blood and tissue leukocytes supporting in vitro infection. The Journal of experimental medicine, v. 146, n. 1, p. 218–229, 1977.
HALSTEAD, S. B.; PORTERFIELD, J. S.; O’ROURKE, E. J. Enhancement of Dengue Virus Infection in Monocytes by Flavivirus Antisera. The American Journal of Tropical Medicine and Hygiene , v. 29 , n. 4 , p. 638–642, 1980. HANLEY, K. A.; LEE, J. J.; BLANEY, J. E.; MURPHY, B. R.; WHITEHEAD, S. S. Paired charge-to-alanine mutagenesis of dengue virus type 4 NS5 generates mutants with temperature-sensitive, host range, and mouse attenuation phenotypes. Journal of virology, v. 76, n. 2, p. 525–531, 2002.
HENDERSON, B. R.; SAEEDI, B. J.; CAMPAGNOLA, G.; GEISS, B. J. Analysis of RNA binding by the dengue virus NS5 RNA capping enzyme. PloS one, v. 6, n. 10, p. e25795, 2011.
HENRIQUES, H. R.; RAMPAZO, E. V; GONÇALVES, A. J. S.; et al. Targeting the non-structural protein 1 from dengue virus to a dendritic cell population confers protective immunity to lethal virus challenge. PLoS neglected tropical diseases, v. 7, n. 7, p. e2330, 2013.
HOLMAN, D. H.; WANG, D.; RAVIPRAKASH, K.; et al. Two complex, adenovirus-based vaccines that together induce immune responses to all four dengue virus serotypes. Clinical and vaccine immunology, v. 14, n. 2, p. 182–189, 2007. HORSTICK, O.; FARRAR, J.; LUM, L.; et al. Reviewing the development, evidence base, and application of the revised dengue case classification. Pathogens and global health, v. 106, n. 2, p. 94–101, 2012.
JOLY, E.; MUCKE, L.; OLDSTONE, M. B. Viral persistence in neurons explained by lack of major histocompatibility class I expression. Science, v. 253, n. 5025, p. 1283–1285, 1991.
KÄGI, D.; LEDERMANN, B.; BÜRKI, K.; ZINKERNAGEL, R. M.; HENGARTNER, H. Molecular mechanisms of lymphocyte-mediated cytotoxicity and their role in immunological protection and pathogenesis in vivo. Annual review of immunology, v. 14, p. 207–232, 1996.
KANESA-THASAN, N.; EDELMAN, R.; TACKET, C. O.; et al. Phase 1 studies of Walter Reed Army Institute of Research candidate attenuated dengue vaccines: selection of safe and immunogenic monovalent vaccines. The American journal of tropical medicine and hygiene, v. 69, n. 6 Suppl, p. 17–23, 2003.
KAYAMURO, H.; ABE, Y.; YOSHIOKA, Y.; et al. The use of a mutant TNF-alpha as a vaccine adjuvant for the induction of mucosal immune responses. Biomaterials, v. 30, n. 29, p. 5869–5876, 2009.
KEDZIERSKA, K.; GRUTA, N. L. LA; TURNER, S. J.; DOHERTY, P. C. Establishment and recall of CD8+ T-cell memory in a model of localized transient infection. Immunological reviews, v. 211, p. 133–145, 2006.
KELLY, E. P.; GREENE, J. J.; KING, A. D.; INNIS, B. L. Purified dengue 2 virus envelope glycoprotein aggregates produced by baculovirus are immunogenic in mice. Vaccine, v. 18, n. 23, p. 2549–2559, 2000.
KNICKELBEIN, J. E.; KHANNA, K. M.; YEE, M. B.; et al. Noncytotoxic lytic granule-mediated CD8+ T cell inhibition of HSV-1 reactivation from neuronal latency. Science, v. 322, n. 5899, p. 268–271, 2008.
KUHN, R. J.; ZHANG, W.; ROSSMANN, M. G.; et al. Structure of dengue virus: implications for flavivirus organization, maturation, and fusion. Cell, v. 108, n. 5, p. 717–725, 2002.
LANCKI, D. W.; HSIEH, C. S.; FITCH, F. W. Mechanisms of lysis by cytotoxic T lymphocyte clones. Lytic activity and gene expression in cloned antigen-specific CD4+ and CD8+ T lymphocytes. Journal of immunology, v. 146, n. 9, p. 3242– 3249, 1991.
LANCKI, D. W.; KAPER, B. P.; FITCH, F. W. The requirements for triggering of lysis by cytolytic T lymphocyte clones. II. Cyclosporin A inhibits TCR-mediated exocytosis by only selectively inhibits TCR-mediated lytic activity by cloned CTL. Journal of immunology, v. 142, n. 2, p. 416–424, 1989.
LESCAR, J.; LUO, D.; XU, T.; et al. Towards the design of antiviral inhibitors against flaviviruses: the case for the multifunctional NS3 protein from Dengue virus as a target. Antiviral research, v. 80, n. 2, p. 94–101, 2008.
interferon-deficient mice and requirement for CD4+ lymphocytes. Journal of virology, v. 75, n. 5, p. 2107–2118, 2001.
LUNDEGAARD, C.; LAMBERTH, K.; HARNDAHL, M.; et al. NetMHC-3.0: accurate web accessible predictions of human, mouse and monkey MHC class I affinities for peptides of length 8-11. Nucleic acids research, v. 36, n. p. 509–12, 2008.
LUO, D.; XU, T.; HUNKE, C.; et al. Crystal structure of the NS3 protease-helicase from dengue virus. Journal of virology, v. 82, n. 1, p. 173–183, 2008.
LUO, D.; XU, T.; WATSON, R. P.; et al. Insights into RNA unwinding and ATP hydrolysis by the flavivirus NS3 protein. The EMBO journal, v. 27, n. 23, p. 3209– 3219, 2008.
MALYALA, P.; SINGH, M. Endotoxin limits in formulations for preclinical research. Journal of pharmaceutical sciences, v. 97, n. 6, p. 2041–2044, 2008. MANI, S.; TRIPATHI, L.; RAUT, R.; et al. Pichia pastoris-expressed dengue 2 envelope forms virus-like particles without pre-membrane protein and induces high titer neutralizing antibodies. PloS one, v. 8, n. 5, p. e64595, 2013.
MEDANA, I.; MARTINIC, M. A.; WEKERLE, H.; NEUMANN, H. Transection of major histocompatibility complex class I-induced neurites by cytotoxic T lymphocytes. The American journal of pathology, v. 159, n. 3, p. 809–815, 2001. MEN, R.; BRAY, M.; CLARK, D.; CHANOCK, R. M.; LAI, C. J. Dengue type 4 virus mutants containing deletions in the 3’ noncoding region of the RNA genome: analysis of growth restriction in cell culture and altered viremia pattern and immunogenicity in rhesus monkeys. Journal of virology, v. 70, n. 6, p. 3930–3937, 1996.
MLADINICH, K. M.; PIASKOWSKI, S. M.; RUDERSDORF, R.; et al. Dengue virus-specific CD4+ and CD8+ T lymphocytes target NS1, NS3 and NS5 in infected Indian rhesus macaques. Immunogenetics, v. 64, n. 2, p. 111–121, 2012.
MORRISON, D.; LEGG, T. J.; BILLINGS, C. W.; et al. A novel tetravalent dengue vaccine is well tolerated and immunogenic against all 4 serotypes in flavivirus-naive adults. The Journal of infectious diseases, v. 201, n. 3, p. 370–377, 2010.
MOSEMAN, E. A.; MCGAVERN, D. B. The great balancing act: regulation and fate of antiviral T-cell interactions. Immunological reviews, v. 255, n. 1, p. 110–124, 2013.
MOUTAFTSI, M.; PETERS, B.; PASQUETTO, V.; et al. A consensus epitope prediction approach identifies the breadth of murine T(CD8+)-cell responses to vaccinia virus. Nature biotechnology, v. 24, n. 7, p. 817–819, 2006.
MURALI-KRISHNA, K.; RAVI, V.; MANJUNATH, R. Protection of adult but not newborn mice against lethal intracerebral challenge with Japanese encephalitis virus by adoptively transferred virus-specific cytotoxic T lymphocytes: requirement for L3T4+ T cells. The Journal of general virology, v. 77 ( Pt 4), p. 705–714, 1996. MYERS, R. M.; CAREY, D. E.; RODRIGUES, F. M.; KLONTZ, C. E. THE ISOLATION OF DENGUE TYPE 4 VIRUS FROM HUMAN SERA IN SOUTH INDIA. The Indian journal of medical research, v. 52, p. 559–565, 1964.
NAGLER-ANDERSON, C.; LICHTENHELD, M.; EISEN, H. N.; PODACK, E. R. Perforin mRNA in primary peritoneal exudate cytotoxic T lymphocytes. Journal of immunology, v. 143, n. 11, p. 3440–3443, 1989.
NORDLY, P.; ROSE, F.; CHRISTENSEN, D.; et al. Immunity by formulation design: induction of high CD8+ T-cell responses by poly(I:C) incorporated into the CAF01 adjuvant via a double emulsion method. Journal of controlled release, v. 150, n. 3, p. 307–317, 2011.
OSORIO, J. E.; HUANG, C. Y.-H.; KINNEY, R. M.; STINCHCOMB, D. T. Development of DENVax: a chimeric dengue-2 PDK-53-based tetravalent vaccine for protection against dengue fever. Vaccine, v. 29, n. 42, p. 7251–7260, 2011. PONGSUMPUN, P.; GARCIA LOPEZ, D.; FAVIER, C.; et al. Dynamics of dengue epidemics in urban contexts. Tropical medicine & international health, v. 13, n. 9, p. 1180–1187, 2008.
PUTNAK, R.; BARVIR, D. A.; BURROUS, J. M.; et al. Development of a purified, inactivated, dengue-2 virus vaccine prototype in Vero cells: immunogenicity and protection in mice and rhesus monkeys. The Journal of infectious diseases, v. 174, n. 6, p. 1176–1184, 1996.
RAJA, N. U.; HOLMAN, D. H.; WANG, D.; et al. Induction of bivalent immune responses by expression of dengue virus type 1 and type 2 antigens from a single complex adenoviral vector. The American journal of tropical medicine and hygiene, v. 76, n. 4, p. 743–751, 2007.
RAVIPRAKASH, K.; APT, D.; BRINKMAN, A.; et al. A chimeric tetravalent dengue DNA vaccine elicits neutralizing antibody to all four virus serotypes in rhesus macaques. Virology, v. 353, n. 1, p. 166–173, 2006.
REMAKUS, S.; SIGAL, L. J. Memory CD8+ T cell protection. Advances in
experimental medicine and biology, v. 785, p. 77–86, 2013.
RIVINO, L.; KUMARAN, E. A. P.; JOVANOVIC, V.; et al. Differential targeting of viral components by CD4+ versus CD8+ T lymphocytes in dengue virus infection. Journal of virology, v. 87, n. 5, p. 2693–2706, 2013.
RIVINO, L.; KUMARAN, E. A.; THEIN, T.-L.; et al. Virus-specific T lymphocytes home to the skin during natural dengue infection. Science Translational Medicine, v. 7, n. 278, p. 27835–27842, 2015.
RODENHUIS-ZYBERT, I. A; WILSCHUT, J.; SMIT, J. M. Dengue virus life cycle: viral and host factors modulating infectivity. Cellular and molecular life sciences, v. 67, n. 16, p. 2773–2786, 2010.
SABIN, A. B. Research on dengue during World War II. The American journal of tropical medicine and hygiene, v. 1, n. 1, p. 30–50, 1952.
SALEM, M. L.; DIAZ-MONTERO, C. M.; EL-NAGGAR, S. A.; et al. The TLR3 agonist poly(I:C) targets CD8+ T cells and augments their antigen-specific responses upon their adoptive transfer into naïve recipient mice. Vaccine, v. 27, n. 4, p. 549– 557, 2009.
SAMBROOK, J.; RUSSELL, D. W. Molecular Cloning: A Laboratory Manual.. Cold Spring Harbor: Cold Spring Harbor Laboratory Press, 2001. v.1, 2344 p. SANCHEZ, V.; GIMENEZ, S.; TOMLINSON, B.; et al. Innate and adaptive cellular immunity in flavivirus-naïve human recipients of a live-attenuated dengue serotype 3 vaccine produced in Vero cells (VDV3). Vaccine, v. 24, n. 23, p. 4914–4926, 2006. SCHIJNS, V. E. J. C.; LAVELLE, E. C. Trends in vaccine adjuvants. Expert review of vaccines, v. 10, n. 4, p. 539–550, 2011.
SCHLOSSER, E.; MUELLER, M.; FISCHER, S.; et al. TLR ligands and antigen need to be coencapsulated into the same biodegradable microsphere for the generation of potent cytotoxic T lymphocyte responses. Vaccine, v. 26, n. 13, p. 1626–1637, 2008. SCHUCH, A.; HOH, A.; THIMME, R. The role of natural killer cells and CD8(+) T cells in hepatitis B virus infection. Frontiers in immunology, v. 5, p. 258-264, 2014. SCHWARZ, H.; SCHMITTNER, M.; DUSCHL, A.; HOREJS-HOECK, J. Residual endotoxin contaminations in recombinant proteins are sufficient to activate human CD1c+ dendritic cells. PloS one, v. 9, n. 12, p. e113840, 2014.
SHATZ, C. J. MHC class I: an unexpected role in neuronal plasticity. Neuron, v. 64, n. 1, p. 40–45, 2009.
SITATI, E. M.; DIAMOND, M. S. CD4+ T-cell responses are required for clearance of West Nile virus from the central nervous system. Journal of virology, v. 80, n. 24, p. 12060–12069, 2006.
SMITH, C. E. G. Isolation of three strains of type 1 dengue virus from a local outbreak of the disease in Malaya. The Journal of hygiene, v. 54, n. 4, p. 569–580, 1956. SPAULDING, A. C.; KURANE, I.; ENNIS, F. A.; ROTHMAN, A. L. Analysis of murine CD8(+) T-cell clones specific for the Dengue virus NS3 protein: flavivirus cross-reactivity and influence of infecting serotype. Journal of virology, v. 73, n. 1, p. 398–403, 1999a.
SPAULDING, A. C.; KURANE, I.; ENNIS, F. A.; ROTHMAN, A. L. Analysis of murine CD8(+) T-cell clones specific for the Dengue virus NS3 protein: flavivirus cross-reactivity and influence of infecting serotype. Journal of virology, v. 73, n. 1, p. 398–403, 1999b.
SRIKIATKHACHORN, A.; ROTHMAN, A. L.; GIBBONS, R. V; et al. Dengue--how best to classify it. Clinical infectious diseases : an official publication of the
Infectious Diseases Society of America, v. 53, n. 6, p. 563–567, 2011.
TAKAHASHI, H.; TAKAHASHI, C.; MORELAND, N. J.; et al. Establishment of a robust dengue virus NS3-NS5 binding assay for identification of protein-protein interaction inhibitors. Antiviral research, v. 96, n. 3, p. 305–314, 2012.
TAKEUCHI, O.; AKIRA, S. Pattern recognition receptors and inflammation. Cell, v. 140, n. 6, p. 805–820, 2010.
TAN, B. H.; FU, J.; SUGRUE, R. J.; et al. Recombinant dengue type 1 virus NS5 protein expressed in Escherichia coli exhibits RNA-dependent RNA polymerase activity. Virology, v. 216, n. 2, p. 317–325, 1996.
TANG, Y.-X.; JIANG, L.-F.; ZHOU, J.-M.; et al. Induction of virus-neutralizing antibodies and T cell responses by dengue virus type 1 virus-like particles prepared from Pichia pastoris. Chinese medical journal, v. 125, n. 11, p. 1986–1992, 2012. TAY, M. Y. F.; FRASER, J. E.; CHAN, W. K. K.; et al. Nuclear localization of dengue virus (DENV) 1-4 non-structural protein 5; protection against all 4 DENV serotypes by the inhibitor Ivermectin. Antiviral research, v. 99, n. 3, p. 301–306, 2013.
TROYER, J. M.; HANLEY, K. A.; WHITEHEAD, S. S.; et al. A live attenuated recombinant dengue-4 virus vaccine candidate with restricted capacity for dissemination in mosquitoes and lack of transmission from vaccinees to mosquitoes. The American journal of tropical medicine and hygiene, v. 65, n. 5, p. 414–419, 2001.
TUNG, J. W.; HEYDARI, K.; TIROUVANZIAM, R.; et al. Modern flow cytometry: a practical approach. Clinics in laboratory medicine, v. 27, n. 3, p. 453–468, v, 2007. VAUGHN, D. W.; HOKE, C. H.; YOKSAN, S.; et al. Testing of a dengue 2 live-attenuated vaccine (strain 16681 PDK 53) in ten American volunteers. Vaccine, v. 14, n. 4, p. 329–336, 1996.
VOULGARIDOU, G.-P.; MANTSO, T.; CHLICHLIA, K.; PANAYIOTIDIS, M. I.; PAPPA, A. Efficient E. coli expression strategies for production of soluble human crystallin ALDH3A1. PloS one, v. 8, n. 2, p. e56582, 2013.
WADA, T.; KOHARA, M.; YASUTOMI, Y. DNA vaccine expressing the non-structural proteins of hepatitis C virus diminishes the expression of HCV proteins in a mouse model. Vaccine, v. 31, n. 50, p. 5968–5974, 2013.
WAKELIN, S. J.; SABROE, I.; GREGORY, C. D.; et al. “Dirty little secrets” --endotoxin contamination of recombinant proteins. Immunology letters, v. 106, n. 1, p. 1–7, 2006.
WANG, P.; SIDNEY, J.; DOW, C.; et al. A systematic assessment of MHC class II peptide binding predictions and evaluation of a consensus approach. PLoS computational biology, v. 4, n. 4, p. e1000048, 2008.
WANG, P.; SIDNEY, J.; KIM, Y.; et al. Peptide binding predictions for HLA DR, DP and DQ molecules. BMC bioinformatics, v. 11, p. 568-572, 2010.
WEISKOPF, D.; ANGELO, M. A.; BANGS, D. J.; et al. The human CD8+ T cell responses induced by a live attenuated tetravalent dengue vaccine are directed against highly conserved epitopes. Journal of virology, v. 89, p. 120-128, 2014.
WHITE, L. J.; PARSONS, M. M.; WHITMORE, A. C.; et al. An immunogenic and protective alphavirus replicon particle-based dengue vaccine overcomes maternal antibody interference in weanling mice. Journal of virology, v. 81, n. 19, p. 10329– 10339, 2007.
WHITEHEAD, S. S.; BLANEY, J. E.; DURBIN, A. P.; MURPHY, B. R. Prospects for a dengue virus vaccine. Nature reviews. Microbiology, v. 5, n. 7, p. 518–528, 2007.
WHITEHEAD, S. S.; HANLEY, K. A.; BLANEY, J. E.; et al. Substitution of the structural genes of dengue virus type 4 with those of type 2 results in chimeric vaccine candidates which are attenuated for mosquitoes, mice, and rhesus monkeys. Vaccine, v. 21, n. 27-30, p. 4307–4316, 2003.
WHO. Dengue: guidelines for diagnosis, treatment, prevention and control - New
edition. Disponível em:
<http://whqlibdoc.who.int/publications/2009/9789241547871_eng.pdf?ua=1>. Acesso em: 15/8/2014.
WILLIAMS, N. S.; ENGELHARD, V. H. Identification of a population of CD4+ CTL that utilizes a perforin- rather than a Fas ligand-dependent cytotoxic mechanism. Journal of immunology, v. 156, n. 1, p. 153–159, 1996.
WOODLAND, D. L. Jump-starting the immune system: Prime-boosting comes of age. Trends in Immunology, v. 25, n. 2, p. 98–104, 2004.
WORTZMAN, M. E.; CLOUTHIER, D. L.; MCPHERSON, A. J.; LIN, G. H. Y.; WATTS, T. H. The contextual role of TNFR family members in CD8(+) T-cell control of viral infections. Immunological reviews, v. 255, n. 1, p. 125–148, 2013. WRIGHT, S.; RAMOS, R.; TOBIAS, P.; ULEVITCH, R.; MATHISON, J. CD14, a receptor for complexes of lipopolysaccharide (LPS) and LPS binding protein. Science, v. 249, n. 4975, p. 1431–1433, 1990.
WU, S.-F.; LIAO, C.-L.; LIN, Y.-L.; et al. Evaluation of protective efficacy and immune mechanisms of using a non-structural protein NS1 in DNA vaccine against dengue 2 virus in mice. Vaccine, v. 21, n. 25-26, p. 3919–3929, 2003a.
WU, S.-F.; LIAO, C.-L.; LIN, Y.-L.; et al. Evaluation of protective efficacy and immune mechanisms of using a non-structural protein NS1 in DNA vaccine against dengue 2 virus in mice. Vaccine, v. 21, n. 25-26, p. 3919–3929, 2003b.
YAP, T. L.; XU, T.; CHEN, Y.-L.; et al. Crystal structure of the dengue virus RNA-dependent RNA polymerase catalytic domain at 1.85-angstrom resolution. Journal of virology, v. 81, n. 9, p. 4753–4765, 2007.
YUN, N. E.; PENG, B.-H.; BERTKE, A. S.; et al. CD4+ T cells provide protection against acute lethal encephalitis caused by Venezuelan equine encephalitis virus. Vaccine, v. 27, n. 30, p. 4064–4073, 2009.
ZHANG, X.; SHENG, J.; AUSTIN, S. K.; et al. Structure of acidic pH dengue virus showing the fusogenic glycoprotein trimers. Journal of virology, v. 89, n. 1, p. 743– 750, 2015.