AVALIAÇÃO DAS CARACTERÍSTICAS SEMINAIS E CRIOPRESERVAÇÃO DO SÊMEN DE Pseudoplatystoma corruscans (Siluriforme Pimelodidae)
Johanna Maritza Cano Velarde
AVALIAÇÃO DAS CARACTERÍSTICAS SEMINAIS E CRIOPRESERVAÇÃO DO SÊMEN DE Pseudoplatystoma corruscans (Siluriforme Pimelodidae)
Mestranda: Johanna Maritza Cano Velarde Orientador: Prof. Dr. Alexandre Ninhaus Silveira
Dissertação de Mestrado, visando obtenção do Título de Mestre em Biologia Animal, junto ao Programa de Pós-Graduação em Biologia Animal do Instituto de Biociências, Letras e Ciências Exatas da Universidade Estadual Paulista “Júlio de Mesquita Filho”, Campus de São José do Rio Preto.
Cano, Johanna Maritza, Velarde
Avaliação das características seminais e criopreservação do sêmen de Pseudoplatystoma corruscans (Siluriforme Pimelodidae) /Johanna Maritza Cano Velarde. São José do Rio Preto: [s.n.], 2013.
77 f. : il. ; 30 cm.
Orientador: Alexandre Ninhaus Silveira
Dissertação (mestrado) - Universidade Estadual Paulista, Instituto de Biociências, Letras e Ciências Exatas
1. Bagre. 2. Pintado. 3. Fertilização. 4. Velocidades espermáticas. I. Silveira, Alexandre Ninhaus.II. Universidade Estadual Paulista, Instituto de Biociências, Letras e Ciências Exatas. III. Título.
CDU – 597
Ficha catalográfica elaborada pela Biblioteca do IBILCE Campus de São José do Rio Preto - UNESP
À Deus pela oportunidade de aprender cada dia coisas novas.
À minha mãe Doris, ao amor de minha vida Juan Felipe, minha irmã Marcela e meu irmão José Gregorio pela ajuda, carinho e compreensão.
Ao Prof. Dr. Alexandre Ninhaus Silveira, pela receptividade, orientação, ajuda, paciência, oportunidade oferecida e aos seus ensinamentos para minha formação profissional.
À CNPq, pela concessão de bolsa durante o desenvolvimento de meu mestrado. À Coordenação do Programa de Pós-graduação em Biologia Animal do Instituto de Biociências, Letras e Ciências Exatas UNESP. Campus São José do Rio Preto. Em especial, à Professora Doutora Lilian Casatti pela amizade e incentivo indispensável à condução do programa de Mestrado.
Aos Professores da UNESP pela contribuição intelectual e exemplo profissional. A professora Ana Viveiros e Marcelo Leal pela ajuda durante a realização dos analises do material espermático.
Aos professores Dr. Sergio Carvalho, e professora Dra. Flavia Rodrigues, pelas informações e correções que contribuíram na melhoria deste trabalho.
Aos professor Dr. Danilo Pedro Streit Jr e a professor Dr. José Augusto Senhorini pelas sugestões dadas para melhorar deste
Ao grupo de trabalho do Laboratório de Ictiologia Neotropical L.I.NEO e à Prof.Dra. Rosicleire Verissimo-Silveira, pela colaboração durante o desarrolho de meu trabalho.
À Cleusa, Meire, e Zeneide, secretárias do Departamento de Biologia e Zootecnia da Faculdade de Engenharia de Ilha Solteira – UNESP.
Ao técnico Sidival, do Laboratório de Bromatologia do Depto. de Biologia e Zootecnia da FE, UNESP, pela amizade e colaboração.
Ao Prof.Dr. José Augusto Senhorini, pela colaboração na obtenção do material. Ao Grupo de Trabalho do ICMBIO - CEPTA Pirassununga, pela ajuda com a obtenção do material.
Ao Grupo de Trabalho de Estação de Hidrobiologia e Aquicultura da Usina Hidroelétrica de Jupiá, pela ajuda com a obtenção do material.
paciência e grande amor.
A minha família em Ilha Solteira, Elís, Elizete, Fabiana, Gislayne que estiveram do meu lado em cada momento.
A minha amiga Lina Ramos, pela amizade, compreensão e grandes conselhos. A minha amiga e mãe Luz Estella Hincapie, pelo carinho, amizade, ajuda e amor incondicional.
Aos meus sogros, pela ajuda, carinho e amizade. À Elza Militão,pela amizade e ajuda.
América do Sul e de grande valor comercial. P. corruscans necessita migrar para reproduzir e, atualmente, apresenta seus estoques comprometidos devido às alterações dos rios, construção de barragens e pela sobre-pesca. Os objetivos são analisar as características espermáticas e desenvolver um método de congelamento para o sêmen de P. corruscans. Para isso, catorze machos maduros de pintado foram selecionados e induzidos hormonalmente à espermiação. Foram avaliadas as características seminais do sêmen fresco (cor, concentração espermática, motilidade subjetiva). Para o sêmen descongelado foi utilizado o sistema CASA (Computer Assisted Sperm Analisis), onde se fez a verificação da motilidade seminal. Para o desenvolvimento dos protocolos de criopreservação, utilizou-se uma solução diluidora composta de glucose (5,0g), gema de ovo (10%), crioprotetor (DMSO e DMA a 8% e 10%) e água destilada (a.d.q.s). O material espermático foi coletado em dois locais, na Estação de Hidrobiologia e Aquicultura da Usina Hidroelétrica de Jupiá, Castilho, SP, onde as análises do sêmen fresco apresentaram sêmen de cor branco, muito diluído com pouca viscosidade e um volume seminal 4,6±1,5 (mL); a motilidade total espermática média foi de 92,3±9,7%; a concentração espermática média de 85,7 x 106 ± 35,49 sptz/mL; e um tempo de ativação de 35 segundos. O material espermático coletado no CEPTA-ICMBIO apresentou uma cor branca com alta viscosidade e um volume seminal de 7±2,3 (mL); foi encontrada uma concentração espermática média de 111,458 x 106 ±6,71 espermatozoides/mL; uma motilidade total espermática média de 92,4±5,2%; e um tempo médio de ativação de 32,33±4,0 segundos. As análises da motilidade pós-descongelamento apresentaram uma diminuição da motilidade por prévia ativação espermática pela contaminação com urina dos peixes. Foram analisadas as velocidades espermáticas, onde a
mínima velocidade curvilínea (VCL) foi 87.34 ± 8.31m/se a máxima
89.25±11.28m/s. E a velocidade linear mínima 37.43 ± 12.72m/s e máxima 45.02 ±16.37m/s.Não foram encontradas diferenças estatísticas (P<0,05), com relação as velocidades espermáticas, na comparação entre os tratamentos com os dois crioprotetores, DMSO e DMA. Além disso, a maioria dos tratamentos mostrou baixas porcentagens de espermatozóides com velocidade circular ou retilínea. A prévia ativação leva a uma redução energética do material espermático, impedindo assim uma alta motilidade pós-descongelamento. Os resultados das análises de velocidade pós-descongelamento sugerem que a utilização do DMA como crioprotetor permite atingir resultados de qualidade espermática pós-descongelamento tão significantes quanto crioprotetorDMSO. Foi avaliada a taxa de fertilização com material espermático criopreservado, não sendo encontrada diferença estatística entre os tratamentos DMSO e DMA nem para as concentrações de 8% e 10% (P>0,05). Ao comparar os tratamentos com o controle, a análise da taxa de fertilização indicou diferença estatística (p<0,05), onde o tratamento controle diferiu estatisticamente dos demais tratamentos, onde a taxa de fertilização foi de 72.15±18.30%.Foi encontrada uma relação significativa entre a taxa de fertilização e a motilidade total espermática. A motilidade segue sendo uma boa variável de medição da qualidade espermática, assim como a taxa de fertilização. Ambas variáveis se correlacionam com níveis altamente significativos (p<0.0001).
South America and of great commercial value. P. corruscans need to migrate to reproduce, and currently has compromised their inventories due to changes in rivers, dams and overfishing. The goal, analyze the sperm characteristics and develop a method for freezing semen of P. corruscans. For this, fourteen of mature males were selected and painted to hormonally induced spermiation. We evaluated the seminal characteristics of fresh semen (color, sperm concentration, motility subjective). The thawed semen was used CASA system (Computer Assisted Sperm Analysis), where he made the seminal verification motility. For the development of cryopreservation protocols, we used a diluting solution consisting of glucose (5.0 g), egg yolk (10%), cryoprotectant (DMSO and DMA 8% and 10%) and distilled water (adqs). Spermatic material was collected at two sites in Hydrobiology and Aquaculture Station Hydroeletric Jupiá, Castilho, BC, where the fresh semen analysis showed semen color white, diluted with very little viscosity and a seminal volume 4.6 ± 1.5 (ml), sperm motility overall average was 92.3 ± 9.7%, the average sperm concentration of 85.7 ± 35.49 x 106 SPTZ / mL, and an activation time of 35 seconds. The material collected in the spermatic CEPTA-ICMBIO had a white color and light brown with high viscosity and a seminal volume of 7 ± 2.3 (ml), sperm concentration was found an average of 111.458 ± 6.71 x 106 sperm / mL; one sperm motility overall average of 92.4 ± 5.2%, and an average time of activation of 32.33 ± 4.0 seconds. Analysis of the motility after thawing showed a decrease in sperm motility by prior activation due to high level of urine in fish. And when you compare the two treatments with cryoprotectants DMSO and DMA were no statistical differences (P <0.05). We analyzed the sperm speeds, where the minimum curvilinear velocity (VCL) was 87.34 ± 8.31 m/s and the maximum 89.25 ± 11.28 m / s. And the minimum linear velocity 37.43 ± 12.72 m/s and maximum 45.02 ± 16:37 m/s In addition, most treatments showed low percentages of speed, which was possibly caused by the fact that the material was cryopreserved with prior activation. This prior activation energy leads to a reduction spermatic material, thereby preventing high post-thaw motility. The results of the analyzes of speed after thawing suggest that DMA can achieve results post-thaw sperm quality as significant as traditionally used in freshwater fish with the cryoprotectant DMSO. We evaluated the rate of fertilization with sperm cryopreserved materials where no statistical difference was found between treatments DMSO and DMA (P> 0.05). By comparing the treatments and the control treatment, the analysis of fertilization rate showed statistical difference (p <0.05), where the control treatment differed significantly from the other treatments where the fertilization rate was 72.15% ± 18:30. Was found a significant relationship between the rate of fertilization and sperm total mobility. The mobility is still a good measurement variable of sperm quality, as well as the fertilization rate. Both variables correlate with levels highly significant (p <0.0001).
Figura 1- Extração seminalBagre Pintado Pseudoplatystoma corruscans 27
Figura 2- Extração seminalBagre Pintado Pseudoplatystoma corruscans 27 Figura 3 - Botijão para manutenção de material congelado em nitrogênio
líquido (esquerda) e tanque do tipo Dry-shipper, utilizado
para o congelamento do sêmen (direita) 31
Figura 4 - Material seminal criopreservado de Pintado, Pseudoplatystoma
corruscans 31
Figura 5 - Imagem da Análise das velocidades do sêmen de Pintado (Pseudoplatystoma corruscans) com o software
Sperm Class Analyzer (SCA). 34
Figura 6 - Motilidade Total em sêmen de Pseudoplatystoma corruscans
pós-descongelamento por tratamento.Velocidade em µm/s no corpo
das barras 41
Figura 7 - Velocidade Média Espermática de deslocamento em sêmen de Pseudoplatystoma corruscans pós-descongelamento.
Velocidade em µm/s no corpo das barras 42
Figura 8 - Velocidade Linear espermática de Pseudoplatystoma corruscans Velocidade em µm/s no corpo das barras 43
Figura 9 - Velocidade espermática curvilínea de Pseudoplatystoma
corruscans pós-descongelamento. Velocidade em µm/s no corpo
das barras 44
Figura 10 - Porcentagem da Taxa de Fertilização de Pintado
Pseudoplatystoma corruscans 45
Figura 13- Análise morfológica sob microscopia eletrônica de varredura (MVE) de espermatozoides de Pseudoplatystoma corruscans 49
Tabela 1 - Delineamento Experimental 37
Tabela 2 - Características Seminais do Pintado Pseudoplatystoma corruscans.
Material espermático coletado do CEPTA – ICMBIO 38
Tabela 3 - Características Seminais do Pintado Pseudoplatystoma corruscans. Material espermático coletado da Usina Hidroelétrica de Jupiá. 39
Tabela 4 - Características Espermáticas (Média) dos Peixes Pseudoplatystoma
1 INTRODUÇÃO 7
1.1 Estrutura Espermática 10
1.2 Motilidade Espermática 10
1.3 Temperatura 12
1.4 Potencial Hidrogeniônico (pH) 13
1.5 Taxa de Fertilização 14
1.6 Volume Seminal 15
1.7 Coloração e Capacidade de Fertilização 15
1.8 Criopreservação de Material Espermático 16
1.9 Benefícios da Criopreservação Espermática 16
1.10 Alterações das Células Espermáticas pela Criopreservação
17
1.11 Congelamento das Células Espermáticas 19
1.12 Dimetilsulfóxido (DMSO) 21
1.13 Dimetilacetamida (DMA) 21
1.14 Microscopia Eletrônica de Varredura 22
2 OBJETIVOS 24
2.1 Objetivo Geral 24
2.2 Objetivos Específicos 24
3 MATERIAL E MÉTODOS 25
3.1 Localização da Área de Estudo 25
3.2 Indução de Reprodutores e Coleta de Sêmen 25
3.3.3 Volume Seminal médio 28
3.3.4 Cor do Sêmen 29
3.4 Criopreservação Seminal 29
3.4.1 Diluentes e Diluição 29
3.5 Tratamentos Utilizados 29
3.6 Empacotamento e Congelamento do Sêmen 30
3.7 Descongelamento do Sêmen 32
3.8 Análise Espermática Pós-descongelamento 32
3.8.1 Motilidade Total Pós-Descongelamento 32
3.8.2 Velocidade Espermática Pós-Descongelamento 32
3.9 Fertilização com Sêmen Criopreservado 35
3.10 Taxa de Fertilização 35
3.11 Análise de Microscopia Eletrônica de Varredura 36
3.12 Delineamento Experimental 36
3.13 Análise Estatística 37
4 RESULTADOS 38
4.1 Análise do Material Espermático Coletado no Centro Nacional de Pesquisa e Conservação de Peixes Continentais – CEPTA/ICMBIO
38
4.2 Análise do Material Espermático Coletado na Estação de Hidrobiologia da Usina Hidroelétrica de Jupiá
39
4.3 Análises da Velocidade Espermática do Sêmen Descongelado
41
4.4 Teste de Fertilização 45
5 DISCUSSÃO 51
5.1 Qualidade Espermática 51
5.2 Efeitos da Criopreservação sobre a Integridade das Células Espermática
53
5.3 Análises de Microscopia Eletrônica de Varredura 56
5.4 Avaliação da Taxa de Fertilização 57
6 CONCLUSÕES 60
1 INTRODUÇÃO
A aquicultura tem uma grande importância no setor da produção mundial de peixes, com um aumento na ultima década alcançando 52,5 milhões de toneladas em 2008, comparado aos 32,4 milhões de toneladas no ano 2000. Atualmente, este setor alimentício de rápido crescimento suporta quase a metade (45,6 por cento) de peixes para o consumo no mundo, comparado com 33,8 por cento no ano 2000 (FAO, 2010).
No Brasil, verificou-se que a produção da indústria da aquicultura no ano 2000 foi de aproximadamente 140 mil toneladas. O cultivo de peixes de água doce ocorre em todo o país, e corresponde a 80 por cento da produção aquícola nacional. As espécies mais cultivadas são as tilápias e as carpas, seguidas pelos tambaquis e surubins (EMBRAPA, 2002).
A intensificação da construção de barragens no Brasil durante os últimos 50 anos com o objetivo de atender a demanda de energia elétrica tem produzido grandes impactos negativos, como a separação de populações aquáticas o que impede o fluxo gênico e diminui a capacidade de sobrevivência destas espécies e os seus tamanhos efetivos populacionais, fato que vem acompanhado adicionalmente de pressão sobre o ecossistema a través da pesca (TUNDISI; MATSUMURA, 2003). Para afrontar este tipo de problema, a criopreservação poderia ser de grande auxilio, considerando a sua capacidade de armazenar por tempo indefinido material germinativo de espécies ameaçadas de extinção e sistemas aquáticos ecologicamente afeitados, com objetivo de realizar produção em massa para repovoamento (RAMÍREZ-MERLANO; MEDINA-ROBLES; CRUZ-CASALLAS, 2011).
Para diminuir os impactos gerados sobre as espécies e os ecossistemas é preciso aumentar e melhorar a produção em cativeiro garantindo sua sobrevivência (CREPALDI, 2006).
Queiroz (2002) fez uma pesquisa das espécies de peixes de água doce prioritárias e importantes para compor os novos projetos de pesquisa em aquicultura. As espécies são: Carpas, Salminus maxillosus, Rhandia quelen, Brycon cephalus, Piaractus mesopotamicus, Pseudoplatystoma corruscans, Brycon
orbignyanus, Brycon microlepis, Arapaima gigas, Colossoma macropomum, Tilapia
Dentro destes projetos em aquicultura, é necessário o desenvolvimento de ferramentas biotecnológicas que ajudem a melhorar processos como a produção em massa de juvenis e o melhoramento genético, através de melhoramento de parentais entre produtores. Para isso, ferramentas como a criopreservação de sêmen poderia gerar um grande aporte, considerando que a fertilização de milhões de ovos em grande escala só poderia ser possível com o uso de uma palheta de 2 mL, a qual poderia conter o mesmo volume de sêmen e bilhões de espermatozoides prontos para serem utilizados a qualquer momento, ao mesmo tempo que se garante qualidade genética e acrescimento genético, sem precisar de transportes custosos de reprodutores entre indústrias produtoras (WILDT; WEMMER, 1999; WATSON; HOLT, 2001). Em relação a esta nova tecnologia, diversas pesquisas vem sendo realizadas com diferentes espécies de peixes nativas para a implementação de protocolos de criopreservação de sêmen, entre as quais se encontra: curimbata Prochilodus lineatus; Piabanha, Brycon insignis (VIVEIROS et al., 2009, 2012); piracanjuba Brycon orbignyanus. (MARIA et al., 2006); pirapitinga do sul, Brycon opalinus, (ORFÃO et al., 2011), matrinxã, Brycon cephalus, matrinxã, Brycon amazonicus. (NINHAUS et al., 2006; PARDO-CARRASCO, et al. 2006);
cachama Blanca, Piaractus brachypomus (RAMIREZ-MERLANO et al., 2011); Bagre rajado Pseudoplatystoma fasciatum (PINZÓN-ARCINIEGAS; MOJICA RODRÍGUEZ;
CRUZ CASALLAS 2005); bagre rajado Pseudoplatystoma metaense, (RAMÍREZ-MERLANO; MEDINA-ROBLES; CRUZ-CASALLAS, 2011); yamú Brycon amazonicus, (VELASCO-SANTAMARÍA; MEDINA-ROBLES; CRUZ-CASALLAS,
2006); bagre amarelo Pelteobagrus fulvidraco, (PAN et al., 2008); Sparus aurata, (BEIRÃO et al., 2011); Pejerrey Odontesthes bonariensis, (LICHTENSTEIN; ELISIO; MIRANDA, 2010); truta arco Iris, (Oncorhynchus mykiss) (CABRITA; ANEL; HERRAEZ, 2001); entre outras espécies de peixes, especialmente de peixes ósseos.
relacionadas com a motilidade, genoma, proteoma e capacidade fertilizante. Assim, podem se avaliar variáveis como a concentração espermática, motilidade espermática, tempo de ativação, pH, cor, osmolaridade, viscosidade, morfologia e todos os fatores que possam afetar a estrutura celular espermática durante os processos de congelamento e descongelamento.
Uma das espécies para a implementação de protocolos de criopreservação é Pseudoplatystoma corruscans. Esta espécie de peixe pertence à ordem Siluriforme,
sendo um dos grupos mais diversos e amplamente distribuídos dos Ostariophysi. Este grupo é composto por 34 famílias, 412 gêneros e mais de 2405 espécies, sendo que 1440 espécies habitam a América do Sul (CORDIVIOLA et al., 2009).
As espécies de peixes pertencentes à família Pimelodidae, no qual o pintado P. corruscans está incluso, são encontradas nas principais bacias hidrográficas
sul-americanas. O ciclo de vida e a reprodução destes peixes ocorrem em ambientes lóticos, onde as mudanças e variações ambientais, como temperatura, fotoperíodo, oxigênio, pressão de predação e disponibilidade de alimento. Estes fatores exercem sobre o P.corruscans uma grande pressão em sua reprodução, já que esta espécie é de hábito reofílico, realizando grandes migrações através do rio para sua reprodução (VAZZOLER, 1996). Estas migrações reprodutivas podem ser afetadas por alterações do curso natural do rio, devido à construção de barragens, que exercem uma grande influência sobre esta espécie e sobre os ecossistemas aquáticos continentais, levando a uma grande perda da biodiversidade (AGOSTINHO; THOMAZ; GOMES, 2005).
Outra função que a criopreservação pode desempenhar seria o melhoramento genético na produção aquícola, através da troca genética entre produtores (CAROLSFELD et al. 2003).
se obter conhecimento básico sobre estas características, assim como avançar em outras biotecnologias relacionadas com a sua criopreservação.
1.1 Estrutura Espermática
Para conhecer sobre as células espermáticas e sua estrutura, Flesch e Gadella (2000) fazem uma descrição da estrutura e dos espermatozoides, dividindo-os em três regiões especializadas que, juntas, cumprem uma grande atividade no processo da fecundação. Este é composto por: (i) A cabeça, que participa da interação ovócito espermatozoides, (ii) peça intermediária com as mitocôndrias, que participam na produção de energia, (iii) flagelo, que atua na motilidade. A motilidade e gerada pela estrutura do cito esqueleto interno chamado axonema que é uma estrutura altamente organizada com microtúbulos. Com ajuda do flagelo o espermatozoide apresenta movimentos oscilatórios e uma alta velocidade, que permite ao espermatozoide a penetração no óvulo durante a fertilização (INABA 2003).
Para conhecer mais sobre estas estruturas, Quagio–grassiotto et al. (2001) realizou descrições mais detalhadas sobre os espermatozoides de Hoplias malabaricus, onde constatou que a cabeça é esférica e, mede entre 2-4 micras; a
peça intermediária,onde se encontram os centríolos, mitocôndrias, e estas se encontram próximas à posição inicial do axonema, e as vesículas se distribuem ao longo da parte intermediária; e o flagelo,que geralmente está constituído pelo axonema 9+2, em um arranjo de nove pares de microtúbulos periféricos e um par central. O flagelo está rodeado pela membrana flagelar e tem um aro membranoso. Estas estruturas conservam e protegem as células espermáticas, as quais não apresentam motilidade dentro dos testículos.
1.2 Motilidade Espermática
A motilidade espermática e uma variável utilizada para a avaliação da qualidade espermática (KIME et al. 2001).
aquoso, durante a reprodução natural, ou no diluente, durante a reprodução artificial. Existem relações claras entre a composição do plasma seminal e osmolaridade, e a duração da mobilidade dos espermatozoides de peixes. (ALAVI e COSSON. 2006). Em animais com fertilização externa a motilidade e influenciada por câmbios iônicos extracelulares o por sustâncias liberadas desde o ovo (INABA 2003).
Cosson (2004) reporta, em estudos com Acipenser persicus, que os espermatozoides são imóveis dentro do plasma seminal nos testículos. Durante o processo de reprodução natural, a motilidade é induzida depois de passar pelo trato masculino, chegando ao meio aquoso, onde os espermatozoides fazem frente a componentes solúveis da água no meio externo composto por íons. Em estudos de salmão (Oncorhynchus masou) Miura et al. (1992) encontrou também a mesma ativação espermática durante a passagem dos espermatozoides pelo ducto espermático.
A duração da motilidade no ambiente natural está limitada a períodos curtos (de 30 segundos para vários minutos), mas tem grande variação entre espécies de peixes e coincide, em geral, com o período fértil dos espermatozoides. (SCOTT e BAYNES1980).
Normalmente a ativação é irreversível e o tempo de motilidade é muito curto. Observou-se em espécies como salmão e truta que os espermatozoides nadam vigorosamente por menos de um minuto, ao passo que espécies como tilápias, dourado e piracanjuba produzem espermatozoides que apresentam motilidade de alguns minutos. Algumas espécies tropicais nativas de interesse econômico, como o pintado, o curimbatá, o matrinxã, o piauçu e o pacu, apresentam tempo muito curto de motilidade, excedendo pouco mais de um minuto (MARQUES, 2001).
Segundo Morisawa, Susuki, Morisawa (1983); Alavi et al, (2004), íons extracelulares como Na+, Ca2+, K+, Mg2+, Cl- influem sobre a motilidade e ativação espermática dos peixes, especialmente em esturjão Acipenser persicus, que quando apresenta um aumento de Na+, a motilidade espermática aumenta.
Durante o processo da criopreservação se podem observar vários tipos de danos aos espermatozoides e, no momento da ativação espermática, estes são mais visíveis, como a perda de integridade da membrana plasmática e a funcionalidade, a perda da motilidade e o conteúdo de ATP, gerando uma diminuição nas taxas de fecundidade. Em truta (Oncorhynchus mykiss), depois da criopreservação, se observa a fragmentação de DNA em uma grande proporção de espermatozoides (CABRITA et al. 2005)
São várias as características que fazem parte do processo de criopreservação. Características como a motilidade e capacidade de fertilização do espermatozoide são consideradas de grande importância, que permitindo medir o êxito ou fracasso do processo, pois são consideradas variáveis integradoras. A isso se soma que as características espermáticas podem sofrer danos na membrana (adenilato ciclase, canais iônicos, agrupamento de outras proteínas, entre outras) e sua implicação na rota de sinalização que permite a ativação espermática, degradação do ATP, fragmentação do DNA nuclear e mitocondrial (genoma), degradação de enzimas quinases e outras proteínas citosólicas (proteoma) são considerados hoje dia como algum dos fatores moleculares que mais são afetados durante a crioconservação, e que diminuem ostensivamente a capacidade fertilizante e a mobilidade do espermatozoide nos peixes. (MARTINEZ; PARDO, 2010).
1.3 Temperatura
gradual, para a diminuição de possíveis danos na estrutura celular (VINCENT et al. 1988). Além disso, toda alteração gerada tem grande impacto sobre a capacidade de motilidade e velocidade dos espermatozoides, bem como a duração do período de motilidade, que depende da temperatura do meio (ALAVI e COSSON, 2005). Em um trabalho com esturjão (Acipenser baeri Brandt), este apresentou uma diminuição da motilidade de 65% a 40% no momento em que se aumentou a temperatura da água durante o tratamento hormonal, o qual pode afetar o processo de fecundação (KOPEIKA; WILLIOT ; GONCHAROV, 2000).
Muchlisin; Hashim; Chong, (2004), em estudos preliminares com espermatozoides do bagre tropical (Mystus nemurus), encontraram que os íons que fazem parte da motilidade espermática e o pH podem apresentar uma alteração devido a uma variação da temperatura de armazenamento. Alem disso foi demonstrado como os espermatozoides podem ter um maior tempo de vida a baixas temperaturas, mostrando uma motilidade espermática de aproximadamente 150 minutos a uma temperatura de 23°C. Uma possível explicação encontrada para esta situação seria o fato de que as moléculas de fosfolipídios possuem um papel fundamental no processo de termo adaptação dos peixes, e certos tecidos podem responder a mudanças de temperatura, e a resposta pode aparecer durante a vida embrionária (FARKAS et al. 2001).
1.4 Potencial Hidrogeniônico (pH)
O Potencial Hidrogeniônico (pH) é uma característica importante do plasma seminal e pode influenciar o potencial de motilidade do esperma. O pH intracelular e extracelular, bem como a composição iônica da ativação da solução, influencia a iniciação e duração da motilidade espermática (MÀRIÀN et al. 1997).
Diferentes eventos acontecem durante a variação do pH, que pode ser observados em diferentes espécies de peixes como em Alburnus alburnus, que apresenta espermatozoides móveis linearmente e a velocidade de nado sem alterações, o qual mostra que pode ser uma característica importante em espermatozoides de ciprinidos (KRASZNAI et al. 1995).
espermática. E em outras espécies como salmão chum (Billar et al. 1995) reporta que durante o passagem dos espermatozoides pelo ducto espermático um aumento do pH externo é responsável pela movimentação da motilidade espermática.
Além disso, diferentes mudanças no pHi (pH interno), indica ser um possível mensageiro celular dos espermatozoides de carpas. Este valor de pH pode afetar a motilidade espermática pelo choque hipo-osmótico gerado por mudanças no choque ambiental, que desloca o pH para valores mais alcalinos, pela ativação da troca Na+/H+ através de canais iônicos (TRON et al. 1990).
Estas mudanças exercem uma influencia sobre a estrutura espermática que, por sua vez, influencia a motilidade, velocidade e fecundação. Conhecer estes mudanças sobre as células espermáticas são de grande ajuda para o desenvolvimento de protocolos de criopreservação permitindo assim o sucesso da conservação do material espermático e a qualidade do material a conservar.
1.5 Taxa de Fertilização
A taxa de fertilização é um parâmetro utilizado para a verificação da qualidade espermática do sêmen criopreservado. Sendo necessário conhecer os compostos dos diluentes espermáticos os quais podem ser tóxicos de acordo com a concentração e a diluição para ser descartados dos diluentes espermáticos e garantir assim o sucesso da fertilização (YASUI et al., 2012).
Em busca da melhor qualidade espermática e para lograr uma alta taxa de fertilização se há proposto que fatores como o metabolismo, as atividades da respiração, os níveis totais de lipídios, a temperatura, pH do fluido seminal, bD-glucuronidasa, a osmolaridade, sódio, potássio, cálcio, fosfatase, triglicerídeos, glicerol, forma de coletar o material espermático e o estado dos testículos sejam parâmetros importantes de avaliação. Alem disso estes parâmetros tem influência sobre a motilidade o qual leva a uma redução da motilidade reduzindo a probabilidade do esperma para alcançar a micrópila. Em truta Oncorhynchus mykiss estes dados revelaram correlações significativas com a taxa de fertilização (LAHNSTEINER et al.1998; WILLIOT; KOPEIKA; GONCHAROV, 2000).
Análises têm sido feitas encontrando bons resultados, como em Matrinxa (Brycon Amazonicus), onde altas taxas de fertilização e eclosão foram encontradas
1.6 Volume Seminal
Através do estudo do volume seminal nos peixes, são conhecidas as características da cor, concentração espermática e quantidade de sêmen para a fertilização, o qual pode determinar assim a qualidade espermática. Em varias espécies tem sido quantificada a produção espermática para obter uma visão geral da produção por indivíduo por espécie (BILLARD, 1995). Jamieson, (1991) reportam que existe um conhecimento geral das concentrações de espermatozoides dos teleósteos de 2x106 x1010 a 5,3 espermatozoides/ml.
Para garantir a qualidade espermática durante a coleta é necessário evitar a contaminação do sêmen com urina, fezes e sangue. Fatores como a falta de maturação gonadal e envelhecimento dos espermatozoides podem diminuir a qualidade espermática (SUQUET et al, 2000).
1.7 Coloração e Capacidade de Fertilização
A coloração seminal em machos e a coloração dos ovócitos em fêmeas pode variar de acordo a alimentação, habitat e desenvolvimento dos indivíduos. No pintado, Pseudoplatystoma corruscans, o sêmen tem uma coloração branca, os ovócitos apresentam uma coloração amarela e um diâmetro médio de 0,96 ± 0,11 mm. Os ovos de pintado são classificados como meroblásticos e discoidais do tipo telolécitos, com uma envoltura de uma camada gelatinosa. (LANDINES et al. (2003).
A capacidade de reprodução e fertilização depende dos habitat em espécies reofílicas, que realizam migrações reprodutivas, utilizando preferencialmente ambientes lóticos como habitat especiais. O pintado faz parte desta estratégia reprodutiva, realizando uma desova massiva e total (VAZZOLER, 1996). Em fêmeas de siluridos ariids encontrou-se que a fecundidade varia ao redor de 50 ovos por desova até o peso corporal de mais de 150.000 ovos/kg de peso, o diâmetro dos ovócitos variam de 0,8 e entre 15 – 20 mm. (LEGENDRE, LINHAR E BILLARD 1996).
27 e 29ºC, um diâmetro médio de 0,95 mm nos ovócitos e de 2,55 mm no momento da eclosão das larvas. O período de incubação de pintado estendeu-se de 13 a 14 horas nas temperaturas de 27 a 29ºC. O diâmetro médio dos ovócitos no momento da extrusão foi de 1,14 mm, e o comprimento médio das larvas na eclosão foi de 3,28 mm (FAUSTINO et al. 2007). Cardoso citado por (LEGENDRE, LINHAR E BILLARD 1996) reportou em uma observação pessoal que o diâmetro de ovócito que encontrou em pintado foi de 0,8 mm.
1.8 Criopreservação de Material Espermático
Durante o processo de criopreservação realiza-se a conservação do material celular em nitrogênio líquido a uma temperatura de -196°C, garantindo assim uma boa qualidade por um tempo indefinido (WORLD HEALTH ORGANIZATION, 2005 citado por DAY e STACEY 2007).
Neste processo de criopreservação, espera-se estender indefinidamente a vitalidade e as funções metabólicas normais das células a baixas temperaturas em que é realizada a criopreservação, conhecida como “temperatura criogênica”
(KARTKA, 1985).
Sheikhi et al. (2011) definem a temperatura criogênica como aquela que permite manter todas as reações químicas, processos biológicos, bem como as atividades intra e extracelulares que estão suspensas. Teoricamente, se pode pensar que uma célula, tecido ou material espermático podem ser mantidos criopreservados indefinidamente, sem nenhuma diminuição perceptível na qualidade. (KOPEIKA; KOPEIKA; ZHANG, 2007).
1.9 Benefícios da Criopreservação Espermática
sêmen é difícil de obter e são baixos os volumes de sêmen obtidos em cativeiro; (iii) a manutenção de reprodutores se faz mais fácil pelo fato que não são submetidos a estresse, fora da temporada de desova, e podem ser induzidas só as fêmeas, podendo utilizar os espermatozoides crio preservados para fertilizar os ovos; (iv) permite o fácil transporte de gametas para as diferentes fazendas de peixes, evitando o transporte de animais e os requisitos e custos que este processo tem; (v) permite o armazenamento de germoplasma que conserva as características desejadas para os peixes, o qual leva a formar cepas e seleção de material genético durante a domesticação para formar programas de seleção genética.
Chao e Liao (2001) mostram como a criopreservação permite ser aplicada na propagação artificial de muitos animais aquáticos, além de poder ser aplicada para plantas e animais terrestres, permitindo a conservação da biodiversidade aquática, a ecotoxicologia e a conservação do meio ambiente. Além do mais, a criopreservação de material espermático vem sendo estudada em muitas espécies de peixes, durante muitos anos, especialmente em espécies comerciais.
1.10 Alterações das Células Espermáticas pela Criopreservação
estrutura e funcionalidade celular, sem causar uma desidratação osmótica, e permitindo trocas de solutos na membrana e a livre difusão de solutos pelo processo de osmose durante a introdução dos crioprotetores, além da eliminação destes durante o processo de congelamento e descongelamento celular (PAN, 2008).
Por tal motivo, a utilização do crioprotetor deve permitir a célula uma saída da água e ocupar esse espaço para que a célula possa alcançar seu volume final. Além disso, busca-se uma taxa de congelamento e descongelamento que propicie os mínimos efeitos no momento da saída e entrada da água das células, sem desidratar e conservando sua estrutura e funcionalidade (CHAO; LIAO, 2001); Mazur (1963), citado por Pegg (2007) reporta que uma rápida saída da água das células permite manter o equilíbrio termodinâmico através da membrana celular, deixando que o citoplasma conserve sua temperatura e não se esfrie abaixo do ponto de congelamento. Se o esfriamento for muito rápido, a membrana pode congelar-se internamente em pouco tempo (PEGG, 2007). Watson (1995) sugere que, durante a criopreservação, as células espermáticas são submetidas a grandes alterações e tensões, como a diminuição da temperatura e formação de gelo intracelular, o que gera estresse e produz danos no interior celular. Além disso, pode ocasionar danos irreversíveis na membrana plasmática pela formação de cristais de gelo, ou pela despolarização da membrana, como consequência da troca iônica, levando a ativação e capacitação espermática espontânea (LAHNSTEINER et al., 2000)
Drokin, Stein e Bartscherer (1998) reportam que, durante o processo de criopreservação, pode-se levar a muitas alterações na estrutura da membrana celular, como dobras na superfície protoplasmática, observando-se assim, uma deformação de membranas e lesões celulares. Como em truta arco-íris (Oncorhynchus mykiss) e truta marrom (Salmo trutta f. fario) em que a técnica de fratura por congelamento permite conhecer visualmente as alterações que são submetidas às membranas espermáticas nos processos de resfriamento e criopreservação.
1.11 Congelamento das Células Espermáticas
Durante o congelamento das células espermáticas, ocorrem danos celulares causados pela formação de cristais de gelo, os quais tem uma estrutura que compreende grandes cristais, que se unem mediante o congelamento da amostra a uma velocidade lenta 0,2-1,0°C/min. Dentro do processo, se encontra o resfriamento lento, o qual pode induzir a cristalização de solutos. A cristalização se apresenta quando se utiliza maiores velocidades de resfriamento, observando assim uma estrutura menos estável termodinamicamente comparada a uma estrutura de menor quantidade de cristais de gelo. O equilíbrio termodinâmico é possível pela recristalização de pequenos e grandes cristais de gelo, que afetam a estrutura celular (MACKENZIE, 1977 citado por ADAMS, 2007).
Dentro deste processo Mizukami, Carrell e Peterson, (1998) qualificam a recristalização como parte do processo de criopreservação. Estes autores constataram que a recristalização e o choque osmótico têm efeitos durante o processo de descongelamento. E estes efeitos são dependentes da velocidade de descongelamento predeterminadas pela velocidade de resfriamento, além de depender do tamanho dos cristais de gelo formados durante o processo de resfriamento, de acordo com a quantidade de hidratação celular.
Holt (2000) também menciona os danos ocasionados na estrutura e funcionalidade do espermatozoide, e que estes danos podem levar a morte celular, e recomenda fazer a desidratação celular e controlar a concentração do citosol, para diminuir os danos durante a criopreservação e os efeitos da cristalização celular durante o resfriamento em nitrogênio liquido.
apresentam diversos danos, acompanhados de variação do pH. É possível que ocorra uma redução na atividade da mitocôndria e perda de ATP durante o processo de congelamento e descongelamento, o qual pode proporcionar graves danos à motilidade espermática (OGIER; LABBÉ; MAISSE, 1999). Outros danos são ocasionados pela formação de cristais de gelo e efeitos osmóticos da toxicidade do crioprotetor, que também afetam a motilidade espermática.
A estes danos se soma o aumento na tensão da membrana, tendo como resultado uma diminuição da temperatura, causando choque térmico. Uma possível vantagem é que as células são resistentes ao frio, permitindo assim uma tolerância a períodos de exposição a baixas temperaturas (CHAO; LIAO, 2001).
Esta exposição celular a baixas temperaturas, acompanhados de crioprotetores e de uma preparação a base de gema de ovo, permite aproveitar as propriedades da gema de ovo e suas atividades estabilizadoras da membrana, as quais frequentemente são usadas em combinação com a glucosa (VIVEIROS; GODINHO, 2009). Esta combinação de crioprotetor e diluentes permite conservar a qualidade espermática através de variáveis integradoras, pois não dependem de um só fator, mas dependem da estabilidade e integridade do conjunto de estruturas, enzimas e compostos funcionais subcelulares, que dão lugar a estas características espermáticas, permitindo determinar uma boa qualidade espermática, e um processo de criopreservação com êxito (MARTÍNEZ; PARDO, 2010).
Durante o processo de criopreservação se utilizam diversos crioprotetores que são definidos como os de Alto Peso Molecular e os de baixo peso molecular. Mizukami, Carrell e Peterson (1998) definem os crioprotetores como compostos que permitem dar uma proteção as células para que estas possam suportar as mínimas temperaturas as quais são submetidas.
rompimento de organelas e destruição celular. (MARTINEZ; PARDO, 2010; MIZUKAMI; CARRELL; PETERSON, 1998).
Suquet et al. (2000) citam os crioprotetores que tem baixo peso molecular: 1-2 Propanodiol, Glicerol, Dimetilsulfóxido, Etilenglicol, Propilenglicol, Dimetilacetamida e Metanol. Viveiros (2005) reporta que os crioprotetores Dimetilsulfoxido (DMSO) e Dimetilacetamida (DMA) oferecem melhores resultados para a criopreservação do sêmen de peixes, mostrando elevadas taxas de Motilidade pós-descongelamento e valores satisfatórios de percentuais de fecundação.
1.12 Dimetilsulfóxido (DMSO)
O uso de crioprotetores permite conservar a estrutura celular dos espermatozoides. Contudo, não existe uma padronização da concentração a ser utilizada, variando o seu valor ideal para cada espécie de peixe.
He e Woods (2004) reportam em um trabalho de criopreservação de Morone saxatilis a efetiva proteção de Dimetilsulfóxido (DMSO) a 5% e 10% e concentrações
de glicina, mostrando uma boa proteção das estruturas e membranas plasmáticas. Suquet et al.(2000) apresenta o DMSO como o crioprotetor que dá os melhores resultados devido a rápida penetração nos espermatozoides e por sua interação com os fosfolipídios da membrana espermática.
Horvárth e Urbányi (2000) falam sobre a importância dos açúcares como aqueles que participam no processo do congelamento. Durante a criopreservação, se utilizam de crioprotetores de baixo peso molecular, que são solúveis na água, proporcionando uma maior proteção das células, além de se utilizar extensores, como a gema de ovo, que proporcionam uma melhor proteção às células durante o processo a qual são submetidas. O uso da gema de ovo como extensor traz bons resultados, e foi utilizada na criopreservação das células espermáticas da truta arco íris, onde foram atingidos resultados de Motilidade pós–descongelamento de 42,2% (CABRITA; ANEL; HERRAÉZ, 2001).
1.13 Dimetilacetamida (DMA)
constataram que DMA a 10% proporciona uma alta viabilidade espermática e ótimas porcentagens na fertilidade pós-criopreservação.
Ogier; Labbé e Maisse (1999), em estudo com o bagre europeu (Silurus glanis) encontraram espermatozoides com membrana intacta utilizando os
crioprotetores DMA e Metanol a 10% e 15%. Ainda, DMA permitiu uma boa proteção espermática e uma alta porcentagem de Motilidade com DMA 10% e 15%. Os autores sugerem que este crioprotetor leva a um incremento no nível de ATP espermático e uma resistência da célula durante os processos de congelamento espermático.
Outras pesquisas de criopreservação em zebra fish têm sido estudadas e analisadas utilizando o crioprotetor DMA apresentando bons resultados. Morris, Hagen e Kanki (2009) determinaram que DMA a 10% e 15% proporcionam uma alta Motilidade espermática pós-descongelamento, e sua capacidade de fertilização espermática foi maior com DMA 15% em comparação com metanol.
O crioprotetor DMSO há sido utilizado por excelência mostrando bons resultados pero o DMA tem demonstrado eficiência equiparável e, em muitos casos, até melhores que o DMSO em várias espécies de peixes teleósteos, incluindo bagres (OGIER; LABBÉ; MAISSE, 1999). No caso do pintado, uma espécie de grande importância econômica e ecológica, faz-se necessária a experimentação em sua implementação em processos de criopreservação, os quais garantam o desenvolvimento de um protocolo eficiente, tanto para a aplicação na aquicultura como também para assuntos ambientais e de conservação da espécie através de bancos genéticos. Deste modo este trabalho visa o estudo das características espermáticas de Pseudoplatystoma corruscans e do desenvolvimento de protocolo para a criopreservação do sêmen desta espécie utilizando como crioprotetores internos o dimetilsulfóxifo (DMSO) e a dimetilacetamida (DMA) e crioprotetores externos como a glucose e a gema de ovo a qual permite aproveitar suas propriedades e atividades estabilizadoras da membrana (VIVEIROS; GODINHO, 2009).
1.14 Microscopia Eletrônica de Varredura
para determinar a efetividade do protocolo de criopreservação (HE; WOODS, 2004). Diversos estudos sobre microscopia eletrônica de varredura têm sido feitos em criopreservação espermática de peixes, como reportados por Martínez (2010), ao realizar análise de microscopia eletrônica em células espermáticas pós-descongelação de Prochilodus magdalenae, onde constatou um aglutinamento das células espermáticas, o qual impediu a visualização dos espermatozoides em todos os tratamentos feitos. Este aglutinamento foi formado principalmente pela união de cabeças e caudas dos espermatozoides. Nestas análises, foram determinados os danos como má formação na membrana (rachaduras), danos nas caudas e na peça intermediária, assim como foram encontrados espermatozoides sem danos em amostras de sêmen fresco.
2 OBJETIVOS
2.1 Objetivo Geral
Analisar as características seminais e desenvolver um método de congelamento para o sêmen de Pseudoplatystoma corruscans.
2.2 Objetivos Específicos
1. Conhecer as características seminais de Pseudoplatystoma corruscans no que se refere à concentração espermática, motilidade espermática e duração da motilidade, coloração e volume seminal médio.
2. Desenvolver um método de criopreservação para o sêmen de Pseudoplatystoma corruscans, que preserve a integridade e a viabilidade
das células espermáticas.
3. Determinar nível de viabilidade e grau de fertilidade dos espermatozoides criopreservados.
3 MATERIAL E MÉTODOS
3.1 Localização da Área de Estudo
O trabalho de pesquisa foi desenvolvido em duas instituições que distam cerca de 600 Km uma da outra.
A. Centro Nacional de Pesquisa e Conservação de Peixes Continentais - CEPTA/ICMBIO, localizado em Pirassununga/SP, distrito de Cachoeira de Emas às margens do rio Mogi-Guaçu. E uma localização geográfica de 21º55’55”S e 47º2’37”O.
B. Estação de Hidrobiologia da Usina Hidroelétrica de Jupiá, localizada na Rodovia Marechal Rondon, Km 666 em Castilho/SP, às margens do Rio Paraná, cuja localização geográfica é 20°46’51”S e 51°36’24”O.
3.2 Indução de Reprodutores e Coleta de Sêmen
No CEPTA/ICMBIO, foram utilizados 6 machos adultos e maduros de Pseudoplatystoma corruscans do plantel de reprodutores, para análise seminal e
experimentos de criopreservação. Os peixes mantidos sob condições de cativeiro foram selecionados de acordo com o grau de maturidade, e levados a um tanque retangular de 6m2 onde permaneceram 24 horas. Os peixes foram medidos o comprimento total e o peso de cada animal.
Para realizar a indução hormonal da maturação final das gônadas os peixes foram induzidos com Ovopel® (GnRHm associada ao inibidor da dopamina, o metoclopramide (Ovopel – D-Ala6,Pro9 Net-mGnRH))em dose única de 0.5 mg/kg de peso vivo.
Na Estação de Hidrobiologia da Usina Hidroelétrica de Jupiá, foi coletado material espermático de 8 machos maduros de P. corruscans, do plantel de reprodutores. Cada peixe foi levado a um tanque retangular de 4m2 para o desenvolvimento do processo de indução a reprodução. Para tal, cada exemplar foi medido o comprimento total e seu peso, para o calculo da dosagem hormonal. Para a maturação final das gônadas, os peixes foram submetidos à indução com extrato bruto de hipófise de carpa na dosagem 5mg/kg de peso vivo.
Figura 1- Extração seminalBagre Pintado Pseudoplatystoma corruscans
Fonte: Dados da pesquisa do autor
Figura 2- Extração seminalde Bagre Pintado Pseudoplatystoma corruscans
3.3 Avaliação das Características Seminais
3.3.1 Motilidade Espermática
Para determinar a qualidade do sêmen fresco, observou-se a possível Motilidade dos espermatozoides gerada pela contaminação com urina ou fezes. Assim, na presença de sêmen inativado, foram coletadas amostras de 2µL de sêmen, colocadas sobre lâmina histológica, ativada com uma gota de solução de bicarbonato de sódio a 1% e analisada sob microscópio ótico Olympus® com objetiva de 40x. O período de motilidade espermática foi tomado com auxílio de um cronômetro, considerando o início de ativação até a parada total das células.
3.3.2 Concentração Espermática
Para determinar a concentração espermática, foi utilizado 2l de sêmen fresco o qual foi misturado com 1998 l de solução formol salina composta por 0.9% Cloreto de sódio, 3% formalina e 100 ml de água destilada, em uma proporção de (1:1000). Depois, utilizou-se 10 microlitros da solução sêmen – solução formol salina e foi colocado sobre uma câmara de Neubauer, onde foi feita a avaliação e contagem das células espermáticas com ajuda de um microscópio Olympus® com uma objetiva de 40x. Este procedimento foi repetido três vezes para cada amostra de sêmen. O material coletado nas duas áreas foi levado para o Laboratório de Ictiologia Neotropical – Lineo, da Universidade Estadual Paulista “Júlio de Mesquita Filho”, em Ilha Solteira/SP, para medição da concentração espermática.
3.3.3 Volume Seminal Médio
3.3.4 Cor do sêmen
A observação subjetiva da cor do material espermático foi efetuada após sua coleta no tubo de ensaio. Aproveitando-se para determinar a presença de contaminantes, como fezes, bílis ou sangue.
3.4 Criopreservação Seminal
3.4.1 Diluentes e Diluição
A solução crioprotetora foi composta por: 8% ou 10% de substância crioprotetora (SCP), 5% de glucose, 10 mL de gema de ovo de galinha, completando-se a 100 ml com água destilada. Como SCPs foram testadas dimetil acetamida (DMA) e dimetil sulfóxido (DMSO).
Para a preparação da solução protetora foi utilizado um agitador magnético, onde colocou-se um erlenmeyer com 50 mL de água destilada e a SCP a 8% ou 10%, sendo feita a preparação de forma separada. Após 3 minutos, foi adicionado 5% de glucose e, lentamente, foi adicionado 10 mL de gema de ovo de galinha com auxílio de uma seringa e adicionada água destilada até completar o volume de 100 mL. O sêmen foi diluído na proporção de 1:4 (sêmen: diluente) e a diluição foi efetivada a temperatura ambiente (28ºC).
3.5 Tratamentos Utilizados
Para a realização do experimento foram considerados quatro tratamentos, baseados em dois crioprotetores internos, com duas concentrações cada e o tratamento controle. Como foram utilizados vários machos, cada macho foi considerado também como uma repetição.
3.6 Empacotamento e Congelamento do Sêmen
Figura 3 - Botijão para manutenção de material congelado em nitrogênio líquido (esquerda) e tanque do tipo Dry-shipper, utilizado para o congelamento do sêmen (direita).
Fonte: Dados da pesquisa do autor
Figura 4- Material seminal criopreservado de Pintado, Pseudoplatystoma corruscans
3.7 Descongelamento do Sêmen
Para fazer o descongelamento das palhetas com o material espermático após 30 dias, estas foram retiradas do nitrogênio líquido e foram submergidas por imersão direta em um banho sorológico a 37°C durante 10 segundos, conforme metodologia proposta por Ogier; Labbé e Maisse(1999). Depois, as palhetas foram retiradas, secas com toalhas de papel, cortada uma extremidade e retirar o material espermático (CRUZ- CASALLAS; VELASCO SANTAMARÍA, 2005).
3.8 Análise Espermática Pós-Descongelamento
3.8.1 Motilidade Total Pós-Descongelamento
Para determinar a Motilidade espermática total pós-descongelamento, diluiu-se 100 microlitros de sêmen em 400 microlitros de glicodiluiu-se em um ependorf, misturou-se com uma micropipeta e se tomou 10 microlitros. O sêmen foi ativado com solução de bicarbonato de sódio a 1% e, procedeu-se a analise espermática com o CASA (Computer Assisted Sperm Analisis, Medea Lab, Alemanha).
3.8.2 Velocidade Espermática Pós-Descongelamento
As velocidades espermáticas foram medidas de acordo com metodologia proposta por Cruz-Casallas e Velasco Santamaría (2005), por meio do sistema de análise espermática assistida por computador (CASA - Computer Assisted Sperm Analisis, Medea Lab, Alemanha), com Sperm Class Analyzer - Sistema automático de análise espermática por computador (SCA), que pertence a o laboratório de Zootecnia da Universidade Federal de Lavras (UFLA).
Os parâmetros avaliados foram os seguintes: Motilidade progressiva rápida, velocidade progressiva lenta não linear, movimentos não progressivos e espermatozoides imóveis, células com simples movimentação, Velocidade curvilínea (VCL), Velocidade em línea reta (VSL) e Velocidade Média (VAP). As velocidades foram calculadas em µm.s-1.
A Motilidade foi ativada em uma câmara de contagem Makler ® (Sefi-Medical Instruments Ltd., Haifa, Israel) colocada em um microscópio de contraste de fase (Nikon Eclipse E200™, Tokio, Japão) em uma ampliação de 100 x com um filtro verde e posição de pH 1. O microscópio estava conectado a uma câmera de vídeo (Basler Vision Technologies™ A602FC, Ahrensburg, Alemanha) que gerou 100 imagens/s, e a gravação do vídeo iniciou-se 10 segundos depois da ativação. Cada imagem foi analisada usando as opções standard para os peixes (SCA™ 2010, Microptics, S.L. versão 5.1, Barcelona, Spain). Os espermatozoides são considerados imóveis quando a velocidade for menor que 40 µm.s-1. Além disso, o SCA™ (Microptics) analisaram simultaneamente mais de 15 pontos finais de motilidade do esperma.
Figura 5 – Imagem da Análise das velocidades do sêmen de Pintado (Pseudoplatystoma corruscans) com o software Sperm Class Analyzer (SCA).
Fonte: Dados da pesquisa do autor
O software Sperm Class Analyzer (SCA), realiza as análises através da medição da trajetória que faz o espermatozoide em 1 segundo desde o ponto de partida ate o ponto de chegada e a medição do deslocamento total do espermatozoide.
* Rapid progressive motility (type a) * Non-progressive motility (type c)
3.9. Fertilização com Sêmen Criopreservado
Para obter os ovócitos e realizar as provas de fertilização e para obter o sêmen do pintado do grupo controle foi utilizado o mesmo protocolo de indução hormonal e maturação final utilizado por Ninhaus et al (2006).
Foram selecionados quatro machos (n=4) onde o sêmen fresco foi para utilizado para o grupo controle para a prova de fertilização (1 macho = replica). As fêmeas receberam na primeira dose 0,5mg/kg de OVOPEL®, sendo a aplicação da segunda dose de 5,0mg/kg 9 horas a após 1ª. A desova ocorreu com189 horas/ graus a uma temperatura de 27graus, os machos receberam uma única dose de 1,0 mg/kg de OVOPEL® junto com a segunda dose da fêmea.
Os ovócitos foram obtidos de duas fêmeas por massagem abdominal e extrusão em seco sobre uma vasilha plástica onde foi feito “pool” de ovócitos. Após, amostras de cerca de 1 grama de ovócitos (n=5900) foram dispostas em copos plásticos do tipo “café” e misturados com o sêmen, sendo, em seguida colocado
água do meio para ativação espermática e fertilização. A proporção espermatozoides por ovócito foi de 1,8x106
3.10 Taxa de Fertilização
Passadas 9 horas pós-fertilização (HPF), no estágio de Gástrula fase de fechamento do blastóporo, todas as amostras foram coletadas, fixadas em solução de glutaraldeido a 2,5% e levadas ao laboratório para determinação da taxa de fertilização. Para tal, foi contado o número de ovos totais por amostra e destes separados aqueles que estavam embrionados. O percentual de fertilização foi dado pela seguinte equação:
3.11 Análise de Microscopia Eletrônica de Varredura
A preparação do material seminal com fixador foi colocada em tubos tipo “eppendorf” e centrifugado (3 min./1000 rpm). Em seguida a parte líquida foi retirada, sendo o “pellet” ressuspenso em água destilada e lavado pelo período de 10 min. Ao
final deste tempo ocorrerá a repetição do processo de centrifugação (3 min.; 1000 rpm). Estes procedimentos serão repetidos por 3 vezes. Efetuada a etapa acima, o material foi transferido para uma lamínula de 13 mm de diâmetro recoberta com poli-L-lisina à 1% em água e pós-fixado em tetróxido de ósmio a 0,5%, em água destilada por 30 min. Em seguida procedera-se na desidratação do material em série crescente de etanol (7,5% a 100%). As secagens das peças foram feitas em aparelho de ponto crítico Balzers CPD-20, utilizando-se dióxido de carbono líquido. As amostras foram montadas em “stubs” e cobertas com película de ouro com espessura de 10 nm em Metalizador MED-010 da Balzers. O material assim preparado será observado e fotomicrografado em Microscópio Eletrônico de Varredura.
3.12 Delineamento Experimental
Foram gerados quatro tratamentos de interação entre o crioprotector e a concentração do mesmo (Tabela 1), introduzindo duas fontes variação estatística. Assim, cinco machos (n=5) foram escolhidos para serem aplicados os tratamentos em forma independente sobre o material espermático, sendo que para cada macho, obtiveram-se três subamostras, para um total de 60 unidades experimentais (palhetas).
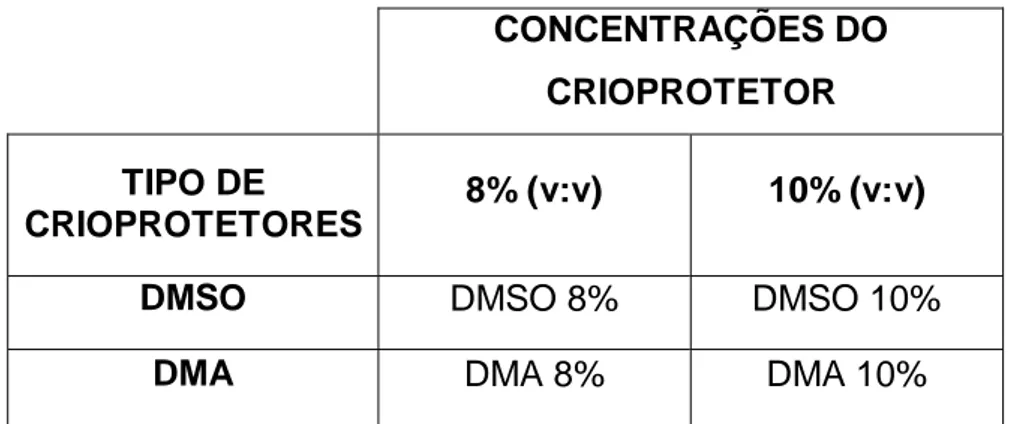
Tabela 1- Delineamento Experimental
CONCENTRAÇÕES DO CRIOPROTETOR TIPO DE
CRIOPROTETORES 8% (v:v) 10% (v:v)
DMSO DMSO 8% DMSO 10%
DMA DMA 8% DMA 10%
Velocidade de descongelamento a 37°C durante 10 segundos. Ogier; Labbé e Maisse(1999).
DMSO: Dimetilsulfóxido, DMA: Dimetilacetamida.
Fonte: Dados da pesquisa do autor
3.13 Análises Estatísticas
Os dados foram transformados raiz quadrada (2√) para assegurar a distribuição normal, por serem dados não paramétricos. Foi realizada a análise de variância de uma só via (ANOVA) e teste de comparação múltipla de médias, por meio do teste de Tukey e Fisher a 5% de probabilidade. Analisou-se o efeito do crioprotetor sobre qualidade espermática do sêmen criopreservado de P. corruscans. Dentro das análises foram avaliadas as velocidades espermáticas:
Motilidade Total, Motilidade média, Motilidade linear, Motilidade curvilínea e a porcentagem dos espermatozoides imóveis.
Antes de fazer as análises estatísticas dos resultados, foram feitas as provas de Brown e Forsythe para determinar a homogeneidade da variância e de Kolmogorov-Smirnov para a normalidade dos dados obtidos. Os resultados expressam que as porcentagens não foram submetidas a transformações para ser normalizados. O nível de significância foi de 0,05.
4. RESULTADOS
4.1. Análise do Material Espermático Coletado no Centro Nacional de Pesquisa e Conservação de Peixes Continentais - CEPTA/ICMBIO
A análise do material espermático coletado, teve como resultado uma motilidade espermática subjetiva após diluição com solução salina de NaCl 1%. Os seis machos de pintado apresentaram diferenças na coloração do sêmen, sendo que alguns machos tinham sêmen de cor branca. Além disso, o sêmen era denso.
No momento de coletar o sêmen, o material coletado tinha cor branca. Conseguiu-se coletar um volume seminal médio 9±3,33 ml e um volume máximo de 10 ml. A análise da concentração espermática obteve como resultado uma concentração média de 111,458 x 109 ± 6,71 espermatozoides/mL, a motilidade total de 92,4± 5,2 %, e um tempo de ativação de 32,33±4,0 segundos. Os resultados se encontram na tabela 2.
Tabela 2- Características Seminais do Pintado, Pseudoplatystoma corruscans. Material Espermático do CEPTA – ICMBIO
Características Machos
Cor (Sêmen) Branco
Volume seminal (mL) 9±3,33
Concentração Espermática sptz/mL
111,458 x 109 ± 6,71
Tempo de ativação (s)
32,33±4,0
Motilidade total (%) 92,4± 5,2
4.2 Análise do Material Espermático Coletado na Estação de Hidrobiologia da Usina Hidroelétrica de Jupiá
O material espermático coletado na estação de Hidrobiologia foi ativado com solução salina de NaCl 1%. Encontrou-se uma motilidade espermática superior a 80% de células móveis. Apresentou-se com uma coloração leitosa, e pouco viscosa, provavelmente pela diluição com a urina. No momento de coletar o sêmen, observou-se que o mesmo estava diluído. Os espermatozoides apresentaram prévia ativação. Nas amostras foi encontrada uma concentração espermática média de 85,7x109 espermatozoides/mL, uma motilidade total média de 92,3±9,7% e um volume seminal médio de 4,6±1,5 mL e um tempo de ativação 30±2,0 segundos. Os resultados se encontram na tabela 3.
Tabela 3- Características Seminais do Pintado Pseudoplatystoma corruscans. Material espermático da Estação de Hidrobiologia e Aquicultura da Usina Hidroelétrica de Jupiá.
Características Machos
Cor (Sêmen) Branco
Volume seminal (mL)
4,6±1,5
Concentração Espermática sptz/mL
85,7 x 109 ±35,49
Tempo de ativação (s)
30±2,0
Motilidade total (%) 92,3±9,7
Fonte: Dados da pesquisa do autor
Tabela 4- Concentração Espermática média determinada para Pseudoplatystoma corruscans.
Amostra Concentração (x109 sptz/mL)
1 116,92
2 105,80
3 100,62
4 115,20
5 113,42
6 116,77
7 166,15
8 89,20
9 70,45
10 91,35
11 48,82
12 65,20
13 85,77
14 68,65
Média 96,74 Desvio Padrão 29,51
4.3 Análises da Velocidade Espermática do Sêmen Descongelado
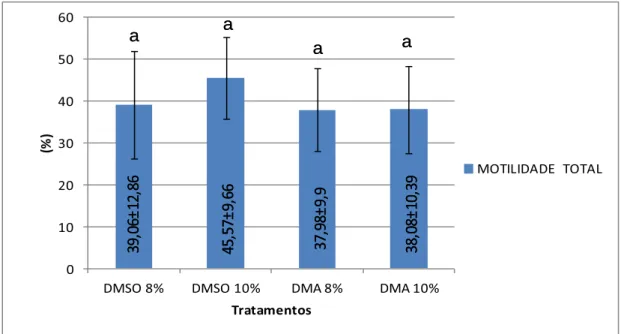
A analise da motilidade total registra todos os movimentos dos espermatozoides desde o momento de sua ativação até a redução total de sua motilidade. Foi encontrada uma maior porcentagem de motilidade na utilização do crioprotetor DMSO em uma concentração de 10%, com 45,57±9,66% de espermatozoides em movimento, e o valor mínimo para o crioprotetor DMA na concentração de 8%, com 37,98±9,9% de espermatozoides em movimento. Apesar das variações não foi verificada uma diferença significativa (p>0.05) para os tratamentos testados (Figura 6).
Figura 6 - Motilidade Total em sêmen de Pseudoplatystoma corruscans pós-descongelamento por tratamento.Velocidade em µm/s no corpo das barras.
0 10 20 30 40 50 60
DMSO 8% DMSO 10% DMA 8% DMA 10%
(%
)
Tratamentos
MOTILIDADE TOTAL a a a a 39, 06± 12, 86 45, 57± 9, 66 37, 98 ± 9, 9 38, 08± 10, 39 a a a a 39, 06± 12, 86 45, 57± 9, 66 37, 98 ± 9, 9 38, 08± 10, 39
Fonte: Dados da pesquisa do autor
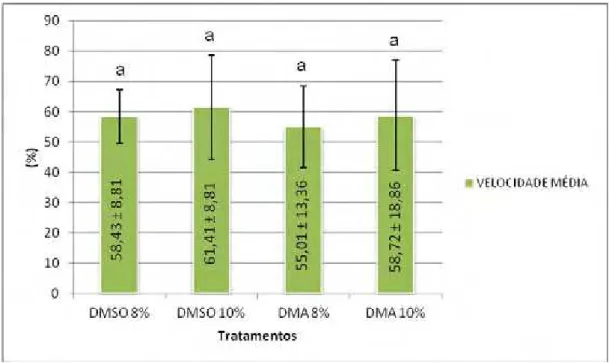
Figura 7 - Velocidade Média Espermática de deslocamento em sêmen de Pseudoplatystoma corruscans pós-descongelamento. Velocidade em µm/s no corpo
das barras.
Fonte: Dados da pesquisa do autor
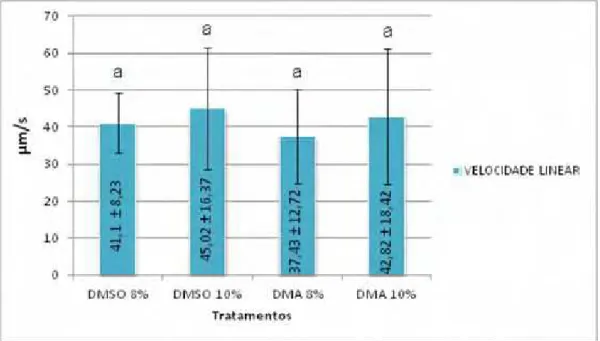
Figura 8 – Velocidade Linear espermática de Pseudoplatystoma corruscans pós-descongelamento. Velocidade em µm/s no corpo das barras.
Fonte: Dados da pesquisa do autor
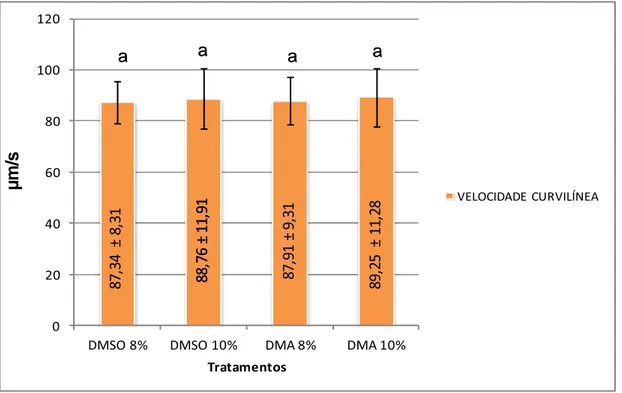
Figura 9 - Velocidade espermática curvilínea de Pseudoplatystoma corruscans pós-descongelamento. Velocidade em µm/s no corpo das barras.
0 20 40 60 80 100 120
DMSO 8% DMSO 10% DMA 8% DMA 10%
µ
m/
s
Tratamentos
VELOCIDADE CURVILÍNEA
a a a a
88,
76 ±
11,
91
a a a a
88, 76 ± 11, 91 87, 91 ± 9, 31 89, 25 ± 11, 28 87, 34 ± 8, 31
4.4. Teste de Fertilização
A análise estatística da taxa de fertilização comparou os ovócitos fertilizados com sêmen fresco (tratamento controle) e com sêmen descongelado, dos diferentes tratamentos (DMA 8%, DMA 10% e DMSO 8% e DMSO 10%). Não foi encontrada diferença estatística (p>0,05) entre os tratamentos, somente entre estes e o controle (Figura 10).
A análise de Correlação de Pearson indicou alta significância entre a taxa de fertilização e a motilidade total espermática, indicando que a motilidade é uma boa variável de medição da qualidade espermática, assim como a taxa de fertilização. Ambas variáveis se correlacionam com níveis altamente significativos (p<0.0001) (Figura 11).
Figura 10 - Porcentagem da Taxa de Fertilização de Pintado Pseudoplatystoma corruscans.
Figura 11- Análise de Correlação de Pearson entre os dados de motilidade total (%) e taxa de fertilização, para o sêmen descongelado de Pseudoplatystoma corruscans.
4.5 Análises de Microscopia Eletrônica de Varredura
4.5.1 Analise Morfológica do Sêmen Fresco
Na figura 12 se observa as características do espermatozoide Pseudoplatystoma corruscans. A cabeça tem um comprimento de 2 µm e o diâmetro
longitudinal de 2,32 µm. A peça intermediária tem um comprimento de 1,5 µm e o flagelo tem um comprimento de 32,6 µm.
Figura 12 - Características morfológicas do espermatozoide de Pseudoplatystoma corruscans.
4.5.2 Analise Morfológica de Sêmen Criopreservado
Diferentes análises foram feitas para determinar a influência dos crioprotetores sobre as células espermáticas de Pseudoplatystoma corruscans. Entre estas, foram feitas análises de Microscopia eletrônica de Varredura. Nas figuras seguintes, foi possível visualizar diferentes alterações nas células espermáticas de sêmen fresco. Na figura 13A é observado um espermatozoide com alterações na cabeça como rompimento da membrana e peça intermediária. Na figura 13B se observa um espermatozoide com alterações em a cabeça, sendo possível verificar um rompimento da membrana plasmática, o que dificulta a diferenciação entre a cabeça e a peça intermediária. O flagelo do espermatozoide está enrolado, o qual pode ter acontecido por danos genéticos ou por danos estruturais do flagelo. Na figura 13C pode-se ver um espermatozoide sem alterações em sua estrutura. A figura 13D demonstra um espermatozoide com danos na cabeça, a sua vez se observa um aumento de tamanho, e provavelmente esteja com rompimento na membrana plasmática. Por conta disto, se dificulta determinar a peça intermediária, além de verificar um menor comprimento do flagelo, o qual pode ser atribuído a danos genéticos. Na figura 13E os espermatozoides não apresentam danos estruturais e se podem observar espermatozoides com flagelos sem danos. Na figura 13F se observam muitos espermatozoides com perda do flagelo, que pode ser atribuída a fatores como danos genéticos, processamento do material no momento a ser analisado.
Figura 13 - Análise morfológica sob microscopia eletrônica de varredura (MVE) de espermatozoides de Pseudoplatystoma corruscans. Legendas: A: Cabeça de
espermatozoide com danos membrana, B: Espermatozoide com danos cabeça, rompimento
membrana, danos na peça intermediaria e flagelo enrolado. C:Espermátozoide sim
danos.D:Espermatozoide com danos em cabeça,peca media e quebra do flagelo. E:
Espermatozoides agrupados por médio dos flagelos onde não se registram danos em sua
estrutura. F: Espermatozoides agrupados; cabeças de espermatozoides sem flagelos.