UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS
PROGRAMA DE PÓS-GRADUAÇÃO EM ECOLOGIA
DIVERSIFICAÇÃO EVOLUTIVA DE GOBÍDEOS NO LITORAL BRASILEIRO: PADRÕES CITOGENÉTICOS E ECOMORFOLÓGICOS
Paulo Augusto de Lima Filho
Natal-RN
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS
PROGRAMA DE PÓS-GRADUAÇÃO EM ECOLOGIA
DIVERSIFICAÇÃO EVOLUTIVA DE GOBÍDEOS NO LITORAL BRASILEIRO: PADRÕES CITOGENÉTICOS E ECOMORFOLÓGICOS
Paulo Augusto de Lima Filho
Dissertação apresentada ao Programa de Pós-Graduação em Ecologia da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para a obtenção do título de mestre em Ecologia.
Orientador: Dr. Wagner Franco Molina
Natal-RN
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Lima Filho, Paulo Augusto de.
Diversificação evolutiva de gobídeos no litoral brasileiro: padrões citogenéticos e ecomorfológicos / Paulo Augusto de Lima Filho. – Natal, RN, 2011.
90 f. : Il.
Orientador: Prof. Dr. Wagner Franco Molina.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Ecologia
1. Gobiidae – Dissertação 2. Evolução cariotípica – Dissertação. 3. Morfometria geométrica –
Dissertação. I. Molina, Wagner Franco. II. Universidade Federal do Rio Grande do Norte. IV. Título.
RN/UF/BSE-CB CDU 597.556.33
“Aprender é uma coisa que nuca se cansa, nunca se tem medo e nunca se arrepende”
“Dedico aos meus pais, familiares,
amigos e colegas, pelo apoio,
Não só nesta trajetória, mas durante toda minha vida, agradeço a Deus, pois me presenteou com a vida, a força e a coragem.
Agradeço a minha família pelo apoio, compreensão, carinho e paciência demonstrado. Maior gratidão devo aos meus pais, Paulo Augusto de Lima, Maria da
Conceição Dutra de Andrade e minha “boa drasta” Geovana da Silva Nascimento, pela palavra sempre oportuna.
À meus tios e tias dedico gratidão adicional por ter me apoiado neste sonho, Dailva, Hugo, Dedé, Neide e Gracinete me acolhendo e auxiliando durante toda esta trajetória no Rio Grande do Norte.
Agradeço também aos meus irmãos, Henrique, Ricardo, Isaura e Tatiane que me deram forte base familiar, meus sobrinhos e primos.
A minha querida Dayse, agradeço pela ajuda neste projeto, pelo carinho, apoio e compreensão estando sempre presente ao meu lado.
Agradeço aos meus antigos amigos e aos novos, que conquistei nesta jornada, desde o Cursinho da Poli, CEDAP, graduação e pós-graduação na Universidade Federal do Rio Grande do Norte, colegas residentes das republicas que fiz parte, especialmente a Rogerson Rodrigues, grande amigo que me apoiou e incentivou durante toda minha peregrinação acadêmica.
Agradeço a todas as pessoas que realmente me ajudaram no desenvolvimento deste trabalho, os quais considero como amigos e colegas de ofício. A meu ver, verdadeiramente praticaram ciência, democratizando o conhecimento e trabalhando em equipe.
Sou grato aos meus amigos de trabalho no laboratório, pelo ambiente que promoveram e pelos ensinamentos que melhoraram decisivamente minha pesquisa: Clóvis, Pantera, Gideão, Amanda, Emanuel, Uedson, Calado, Pablo, Eurico, Washington, Layse, Alyson e Guinga.
Agradeço ao meu orientador, professor Dr. Wagner Franco Molina, por acompanhar e contribuir no meu desenvolvimento acadêmico, orientando-me com liberdade e exigência, permitindo o meu desenvolvimento científico e a realização deste trabalho.
Lista de Figuras VIII
Lista de Tabelas XI
Lista de Abreviaturas XII
Resumo XIII
Abstract XIV
1. INTRODUÇÃO 1
1.1. Principal componente vertebrado marinho 1
1.2. Aspectos citogenéticos da família Gobiidae 3
1.3. A evolução refletida na morfologia 5
2. OBJETIVOS 8
3. MATERIAL E MÉTODOS 9
3.1. Material 9
3.2. Métodos 11
3.2.1. Técnica de estimulação mitótica 11
3.2.2. Técnica de obtenção de cromossomos mitóticos 11
3.2.3. Preparação das lâminas 12
3.2.4. Análises cromossômicas 12
3.2.5. Detecção de regiões organizadoras de nucléolos (RONs) 12
3.2.6. Detecção da heterocromatina constitutiva (Banda-C) 14 3.2.7. Coloração com fluorocromos base-específico 14
3.2.8. Análises por morfometria geométrica (MG) 14
4. CAPÍTULOS 15
4.1. Caracterização da diversidade na família Gobiidae por meio da
citogenética e morfometria geométrica 15
4.2. Análises citogenéticas e morfométricas interpopulacionais no peixe marinho Bathygobius soporator (Gobiidae - Perciformes)
44
5. CONCLUSÕES 61
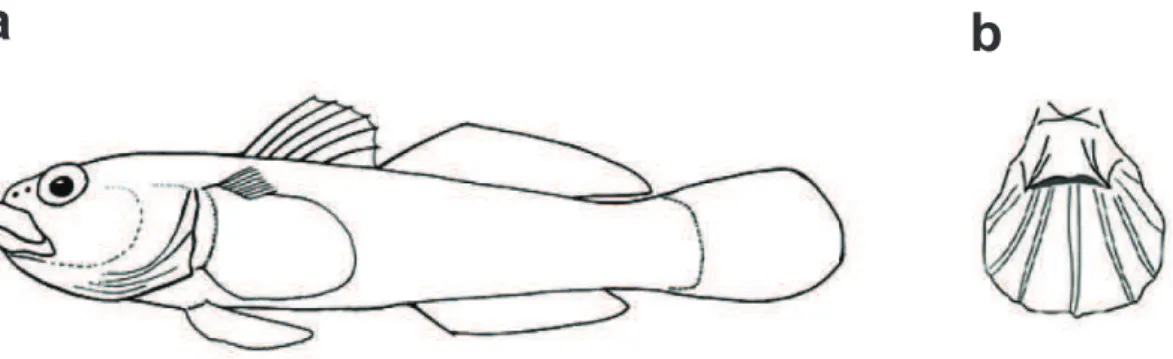
Figura 1. Desenho morfológico esquemático de Gobiidae (gênero Bathygobius). Em destaque (a) nadadeiras dorsais separadas, primeira nadadeira dorsal com raios, olhos grandes, ausência de linha lateral; (b) nadadeiras pélvicas fusionadas presentes na maioria das espécies
2
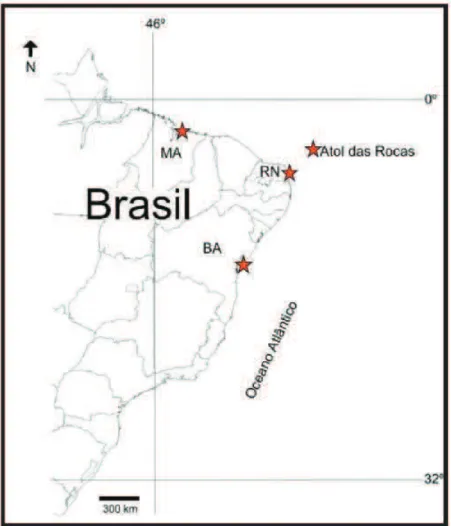
Figura 2. Mapa com pontos de coleta dos exemplares da família Gobiidae. Litoral do Maranhão (MA), Rio Grande do Norte (RN), Bahia (BA) e Atol das Rocas.
9
Figura 3. Espécies analisadas no presente estudo: a. Ctenogobius smaragdus, b. Ctenogobius boleosoma, c. Bathygobius soporator, d. Bathygobius mystacium, e. Coryphopterus glaucofraenum.
10
CAPÍTULO I
Figura 1. Imagem digitalizada de Coryphopterus glaucofraenum retratando os 11 landmarks utilizados nas análises morfológicas interespecífica em
Gobiidae. Descrição esquemática dos landmarks. 1. Ponto distal do osso
pré-maxilar; 2. Origem da primeira nadadeira dorsal; 3. Término da primeira nadadeira dorsal; 4. Origem da segunda nadadeira dorsal; 5. Término da segunda nadadeira dorsal; 6. Término da nadadeira anal; 7. Origem da nadadeira anal; 8. Origem da nadadeira pélvica; 9. Margem anterior ocular; 10. Margem posterior ocular; 11. Base superior da nadadeira peitoral. Barra=0,5cm.
20
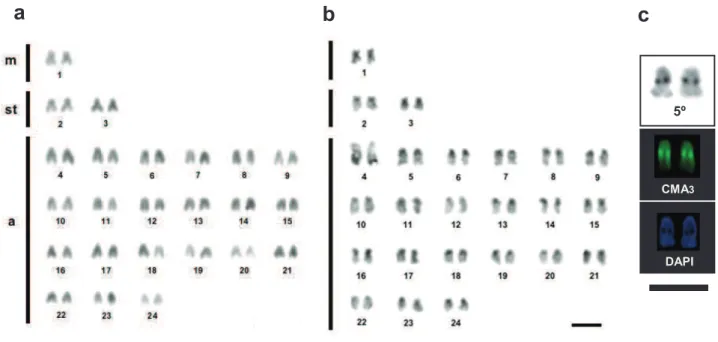
Figura 2. Cariótipo de Ctenogobius smaragdus a partir de coloração convencional (a) bandamento C (b). Em destaque (c) o par organizador nucleolar (1º) corado com impregnação argêntea, CMA3 e DAPI. Barra=5µm.
22
Figura 3. Cariótipo de Ctenogobius boleosoma a partir de coloração convencional
(a). Em destaque (b) o par organizador nucleolar (1º) corado com impregnação argêntea, CMA3 e DAPI. Barra=5µm.
22
Figura 4. Metáfase de C. smaragdus (a) e C. boleosoma (b), exibindo marcações
CMA3+ na maior parte dos cromossomos em posição centromérica e
terminal. Barra=5µm.
22
Figura 5. Cariótipo de Bathygobius soporator a partir de coloração convencional (a) e bandamento C (b). Em destaque (c) o par organizador nucleolar (4º) corado com impregnação argêntea, CMA3 e DAPI. Barra=5µm.
23
Figura 6. Cariótipo de Bathygobius mystacium a partir de coloração convencional
(a) e bandamento C (b). Em destaque (c) o par organizador nucleolar (5º) corado com impregnação argêntea, CMA3 e DAPI. Barra=5µm.
nucleolar (1º) corado com impregnação argêntea, CMA3 e DAPI.
Barra=5µm.
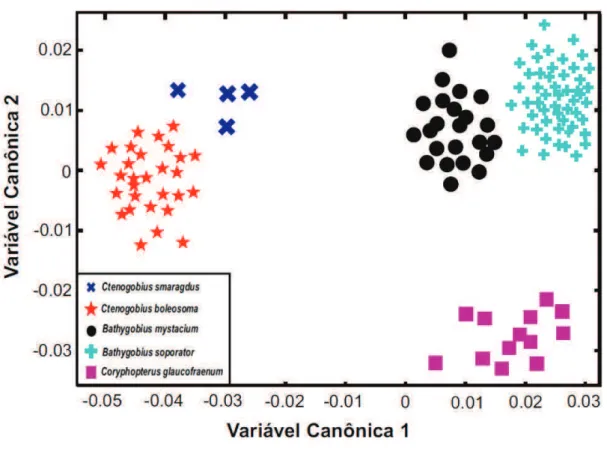
Figura 8. Distribuição dos padrões corporais das cinco espécies de Gobiidae analisadas ao longo da primeira e segunda Variável Canônica.
25
Figura 9. Gride de deformação a partir da primeira Variável Canônica, os vetores indicam a direção da deformação sofrida por cada landmark na
representação espacial comparativa das cinco espécies de Gobiidae analisadas.
26
Figura 10. Análise morfométrica comparativa entre B. mystacium e B. soporator, a partir da variável canônica 1. Ponto médio central representa B. mystacium e o desvio vetorial à espécie B. soporator.
26
Figura 11. Análise morfométrica comparativa, entre as espécies do gênero
Ctenogobius, à partir da variável canônica 1. Ponto médio central representa C. boleosoma e o desvio vetorial a espécie C. smaragdus.
26
CAPÍTULO II
Figura 1. Imagem digitalizada de B. soporator retratando os 09 landmarks definidos
para análises morfológicas interpopulacionais. Descrição esquemática dos landmarks. 1. Ponto distal do osso pré-maxilar; 2. Origem da primeira nadadeira dorsal; 3. Término da primeira nadadeira dorsal; 4. Origem da segunda nadadeira dorsal; 5. Término da segunda nadadeira dorsal; 6. Término da nadadeira anal; 7. Origem da nadadeira anal; 8. Origem da nadadeira pélvica; 9. Base infra-ocular medial. Barra=1,5cm.
49
Figura 2. Cariótipo de B. soporator para populações contientais (MA, RN e BA) à partir de coloração convencional (a) bandamento C (b). Em destaque (c) o par organizador nucleolar (4º) corado com impregnação argêntea, CMA3 e DAPI. Barra= 5µm.
50
Figura 3. Cariótipo de B. soporator população do Atol das Rocas, a partir de
coloração convencional (a) bandamento C (b). Em destaque (c) o par organizador nucleolar (1º) corado com impregnação argêntea, CMA3 e
DAPI. Barra= 5µm.
50
Figura 4. Distribuição das amostras de B. soporator ao longo da primeira e
segunda variável canônica (63,5% e 30,5% da variância respectivamente), a partir das variáveis morfométricas.
52
Figura 5. Distribuição das populações continentais amostradas de B. soporator ao longo da primeira e segunda variável canônica (76,2% e 23,5% da variância respectivamente). Os símbolos em destaque indicam a média morfométrica de cada população.
do RN e o desvio vetorial população do Atol das Rocas.
Figura 7. Gride comparativo entre populações continentais de B. soporator, a partir da variável canônica 1. Ponto médio central representa população do RN e o desvio vetorial população do Maranhão.
53
Figura 8. Gride comparativa entre populações continentaisde B. soporator, a partir
da variável canônica 1. Ponto médio central representa população do RN e o desvio vetorial população da Bahia.
CAPÍTULO I
Tabela 1. Número de indivíduos utilizados para estudos morfométricos e citogenéticos.
19
Tabela 2. Dados citogenéticos das cinco espécies de Gobiidae analisadas. 21
Tabela 3. Resultados post-hoc ANOVA a partir de procrustes, classificadas com a média do centróide, efeito individual, para todos os espécimes em estudo e espécies dos gêneros Bathygobius e Ctenogobius.
24
Tabela 4. Dados citogenéticos disponíveis da família Gobiidae (Perciformes). 28
CAPÍTULO II
Tabela 1. Número de indivíduos coletados, seus respectivos pontos de coleta e sua
utilização para estudos morfométricos e citogenéticos. 48
Tabela 2. Porcentagem de indivíduos alocados para cada população e suas interfaces baseados na CVA.
51
Tabela 3. Resultados post-hoc ANOVA a partir de procrustes, classificadas com a média do centróide, efeito individual, entre as populações continentais.
a – Acrocêntrico
AgNO3– Nitrato de prata
Ag-RONs – Regiões organizadoreas de nucléolo evidenciadas pela impregnação com nitrato de prata
ANOVA – Análise de variância AR – Atol das Rocas
AT – Adenina e Timina BA – Bahia
BC – Bandamento C BRA - Brasil
CMA3– Cromomicina A3
CVA – Análise de variáveis canônicas DAPI – 4`4’,6-diamidino-2-fenilindol DNA – Ácido desoxirribonucléico EUA – Estado Unidos da América GC - Guanina e Citosina
LGRM – Laboratório de Genética de Recursos Marinhos m – Metacêntrico
MA – Maranhão
MANOVA – Análise multivariada de variância MG – Morfometria geométrica
NE – Nordeste
NF – Número de braços cromossômicos N-S – Norte Sul
p – Probabilidade estatística do teste RN – Rio Grande do Norte
sm - Submetacêntrico st – Subtelocêntrico
Os peixes da ordem Perciformes caracterizam-se como um modelo importante para o entendimento da estrutura genética de populações marinhas, pois apresentam tanto exemplos de conservação cromossômica como de diversificação cariotípica para alguns grupos. Gobiidae é a família mais especiosa no ambiente marinho. Entre seus representantes, muitas espécies fazem parte de uma fauna críptica pouco percebida e estudada, apresentando ampla distribuição com características comportamentais e reprodutivas que as tornam propícias à ação de barreiras biogeográficas. Morfologicamente esta família apresenta estruturas corporais reduzidas através de simplificações e regressões. Dados citogenéticos, apesar da importância em inferências evolutivas, são incipientes frente sua diversidade de espécies, sobretudo para espécies do Atlântico Ocidental. Visando estimar a diversidade evolutiva em Gobiidae foram desenvolvidas análises citogenéticas e dos padrões corporais, através de morfometria geométrica, em cinco espécies presentes no litoral brasileiro, Coryphopterus glaucofraenum, Bathygobius mystacium, B. soporator, Ctenogobius smaragdus e C. Boleosoma. Os dados obtidos demonstram
marcante diversidade cariotípica e morfológica entre as espécies. As inversões pericêntricas e fusões desempenham papel importante na evolução cromossômica desta família, ocasionando diferenças cariotípicas estruturais e numéricas em todas as espécies. Comparações cariotípicas e morfológicas entre amostras geográficas de B. soporator provenientes do litoral do Maranhão, Rio Grande do Norte e Bahia
evidenciaram padrões citogenéticos comuns, mas padrões morfológicos diferentes. Uma amostra proveniente do Atol das Rocas revelou conspícua diferenciação cariotípica e morfológica das demais populações continentais, confirmando a presença de uma nova espécie insular. As abordagens empregadas revelam diversificações compatíveis com um grupo com características de baixa vagilidade e amplamente sujeito a seleção ambiental decorrente de exigências ecológicas peculiares.
Palavras-Chave: Gobiidae, evolução cariotípica, morfometria geométrica,
The fishes of the order Perciformes are characterized as an important model for understanding the genetic structure of marine populations, because besides they present examples of conservation chromosomal, also they present the karyotype diversification for some groups. Gobiidae family is the most specious in the marine environment. Among its representatives, many species are part of a cryptic fauna little noticed and studied, a wide distribution with behavioral and reproductive characteristics, that make them conducive to the action of biogeographical barriers. Morphologically this family presents reduced body structures through simplification and regressions. Despite their importance in evolutionary inferences, cytogenetics data are incipient facing their species diversity, especially with western Atlantic species. In order to estimate the evolutionary diversity in Gobiidae, it were developed cytogenetic analysis and the standards body, through geometric morphometrics in five species on the Brazilian coast, Coryphopterus glaucofraenum, Bathygobius mystacium, B. soporator, Ctenogobius smaragdus e C. Boleosoma. The data show
significant karyotype and morphological diversity among the species. The pericentric inversions and mergers play an important role in chromosomal evolution of this family, causing karyotypic structural and numerical differences in all species. Karyotypic and morphological comparisons among geographic samples of B. soporator from the coast of Maranhão, Rio Grande do Norte and Bahia showed cytogenetics patterns commons, but different morphological patterns. A sample from the Atol das Rocas revealed conspicuous morphological and karyotypic differentiation of another continental populations, confirming the presence of a new island species. The approaches done reveal diversification consistent with characteristics of a group of low vagile and largely able to environmental selection due from peculiar ecological requirements.
1. INTRODUÇÃO
1.1 Principal componente vertebrado marinho
Os peixes constituem um grupo polifilético com certa de 28.000 espécies, o que corresponde a mais da metade das formas vivas de vertebrados. Deste total, cerca de 60% vive no ambiente marinho e a sua maioria habita as zonas costeiras (Nelson, 2006). Representam o grupo de vertebrados com maior êxito em termos de diversificação devido à grande variabilidade de habitats presentes no meio marinho e dulcícola.
A ordem Perciformes com 10.033 espécies é a mais diversificada de todas as ordens de peixes, dominantes nos oceanos e em muitos ambientes dulcícolas tropicais e subtropicais. Dentre os Perciformes a subordem Gobioidei possui um número estimado de aproximadamente 2.211 espécies, distribuídas em 270 gêneros, correspondendo a aproximadamente 22% dos Perciformes (Pezold, 1984; Nelson, 2006). Nesta subordem, a família Gobiidae é a que apresenta maior número de espécies (Robertson, 1998; Nelson, 2006), considerada monofilética, possui 210 gêneros e um número estimado de 1.950 espécies (Pezold, 1984; Tracker, 2003; Nelson, 2006), o que corresponde a cerca de 88% da subordem Gobioidei (Pezold, 1993).
Gobiidae compartilha características crípticas, tanto morfológicas, biológicas e comportamentais, que aliadas a grande quantidade de espécies e ao número insuficiente de informações biológicas existentes, contribui para a imprecisão em algumas caracterizações taxonômicas.
1998; Tracker, 2003).
Quanto aos aspectos biogeográficos, este grupo demonstra-se amplamente distribuído podendo ser encontrado ao longo do Atlântico, Pacífico e Índico em áreas tropicais, subtropicais e temperadas (Menezes & Figueiredo, 1985; Mendes, 2000; Tracker, 2003; Nelson, 2006). Apresenta representante em habitats estuarinos e dulcícolas, freqüentemente sendo os mais abundantes
em água doce no interior de ilhas oceânicas (Nelson, 2006).
Figura 1. Desenho morfológico esquemático de Gobiidae (gênero Bathygobius). Em destaque (a) nadadeiras dorsais separadas, primeira nadadeira dorsal com raios, olhos grandes, ausência de linha lateral; (b) nadadeiras pélvicas fusionadas presentes na maioria das espécies (adaptado de Nelson, 2006).
Os Gobídeos representam elementos dominantes em habitats
bentônicos nos recifes tropicais, podendo ser morfologicamente crípticos em relação a membros da própria família e outras como Labrisomidae, Blenniidae (Sale, 1991; Galvão, 2006) e Eleotridae, em áreas estuarinas. A maior parte das espécies apresenta tamanho reduzido, não ultrapassando 10 cm de comprimento, seu maior representante Glossogobius giuris, atinge cerca de 50
cm e o menor Trimmatom nanus corresponde ao menor vertebrado existente,
uma fêmea madura atinge 8-10mm (Nelson, 2006).
Seus hábitos alimentares são diversos, sendo em sua maioria carnívoros e onívoros, com alguns representantes herbívoros. Muitas espécies que vivem próximas a costa, se alimentam principalmente de invertebrados bentônicos e algas. Em contraste a esta situação, espécies em habitats recifais podem
apresentar hábitos alimentares mais especializados. Diversas espécies são semi-pelágicas e se alimentam de copépodas planctônicos. Espécies
dulcícolas muitas vezes se alimentam de diatomáceas e microalgas (Emmanuel & Ajibola, 2010). É comum uma estreita associação entre diferentes espécies de gobídeos com outros animais, como esponjas, moréias, camarões e ouriços do mar. Espécies de pequeno porte podem estar associadas a peixes maiores, alimentando-se de ectoparasitas e realizando a limpeza destes (Colin, 1975).
Os representantes de Gobiidae apresentam considerável importância ecológica e comercial, sua elevada abundância em determinadas localidades os tornam um componente fundamental na cadeia alimentar (De Sylva, 1975). Várias espécies são pescadas e comercializadas de forma significativa, onde são utilizados como iscas na pesca de peixes de maior porte (Emmanuel & Ajibola, 2010). Em diversos países Ocidentais devido suas cores exuberantes, comportamentos peculiares e tamanhos apropriados, algumas espécies são intensamente comercializadas no segmento da aquariofilia, compondo de 5 a 7 % das vendas no mercado mundial de peixes ornamentais marinhos (Wabnitiz
et al., 2003). No Brasil a espécie Elacatinus figaro já foi uma das mais
importantes no comércio de exportação de peixes ornamentais marinhos do país (Gasparini et al., 2005), mas atualmente encontra-se na lista de espécies
ameaçadas de extinção, resguardada do extrativismo (IBAMA, 2004).
A diversidade de espécies, amplo padrão de distribuição, características ecológicas e comportamentais peculiares, evidenciadas por representes da família Gobiidae demonstram a grande capacidade adaptativa dos peixes que a compõe, cuja carência de informações existentes para o grupo, os torna importante modelo para análises evolutivas no ambiente marinho.
1.2 Aspectos citogenéticos da família Gobiidae
Os Perciformes apresentam tanto exemplos de conservação cromossômica, compartilhada por muitas espécies, quanto de diversificação cariotípica em alguns grupos (Brum & Galetti, 1997), dos quais, polimorfismos cromossômicos numéricos e estruturais, além de vários sistemas sexuais recorrentes (Galetti et al., 2000). Aproximadamente 8% das espécies de
Galetti et al., 2006; Molina & Bacurau, 2006). Apesar da maioria dos seus
representantes serem marinhos, neste ambiente apenas 2% das espécies apresentam dados citogenéticos (Almeida-Toledo et al., 1993; Brum, 1996).
Cerca de 60% dos Perciformes estudados até então, apresentam um cariótipo caracterizado por 48 cromossomos monobraquiais, o que faz acreditar que este seja um caráter plesiomórfico para o grupo (Galetti et al., 2000). As
informações cariotípicas disponíveis para Perciformes marinhos têm confirmado esta hipótese (Klinkhardt et al., 1995; Brum & Galetti, 1997), o que
demonstra para estas espécies que a especiação em alguns grupos, parece não ter sido seguida por diferenciação cariotípica significante.
A família Gobiidae destaca-se por apresentar grande diversidade cariotípica (Galetti et al., 2000), com cariótipos variando de 2n=30, em Neogobius euricephalus (Ene, 2003), a 2n=52, em Gobius niger (Vitturi &
Catalano, 1989). Apesar da grande diversidade cariotípica, a família exibe com maior freqüência espécies que apresentam valores diploides com 44, 46 e 48 cromossomos (Ene, 2003). Dados cromossômicos estão disponíveis para aproximadamente 4,5% das espécies da família Gobiidae (Klinkhardt et al.,
1995), sendo a sua maioria restrito a identificação dos valores diplóides e da macroestrutura cariotípica (Caputo, 1998). No litoral brasileiro são encontradas cerca de 40 espécies de Gobiidae (Menezes et al., 2003), destas apenas duas
possuem dados citogenéticos, Bathygobius soporator, com 2n=48 e Awaous strigatus, com 2n=46 (Brum et al.,1996; Souza et al., 1998; Cipriano et al.,
2002).
Para representantes da ordem Perciformes, um dos mecanismos que permite explicar a existência de diversificação cromossômica estrutural, é a ocorrência de inversões pericêntricas, que constituem os rearranjos cromossômicos mais frequentes nessa ordem (Cano et al., 1982; Galetti et al.,
2000; Ueno & Takai, 2000; Molina & Galetti, 2004). A variabilidade numérica derivada de processos de fissão e fusão tem sido relatada em algumas famílias como Pomacentridae, Labridae, Apogonidae, entre outras (Molina & Galetti, 2002; Sena & Molina, 2007; Araújo et al., 2010). Em Gobiidae rearranjos
A presença de variabilidade cariotípica intra e interpopulacional foram constatadas em algumas espécies da família como, por exemplo, Aphia minuta
que apresentou cinco citótipos distintos em uma população de onze indivíduos presentes na costa de Ortona, Itália (Caputo et al., 1999). Espécies do gênero Gobius, como G. niger e G. paganellus, exibem populações cariotipicamente
monomórficas (Klinkhardt, 1992; Vasil'ev & Grigoryan, 1992; Caputo et al.,
1997) e populações com polimorfismo acentuado, envolvendo vários tipos de rearranjos cromossômicos (Vitturi & Catalano, 1989; Amores et al., 1990;
Caputo et al., 1997).
As modificações frequentes e complexas na estrutura cariotípica dos Gobídeos parecem estar ligadas ao padrão evolutivo deste grupo (Caputo et al., 1997). Embora os estudos cromossômicos em gobídeos estejam longe de
ser completos, sua abrangência as espécies do oeste do Atlântico contribuirá substancialmente para o conhecimento da diversidade cariotípica e seus mecanismos regentes nesta região, o que até então é desconhecido.
1.3 A evolução refletida na morfologia
Pesquisas relacionadas ao formato corporal dos organismos assumem importante papel em estudos biológicos, uma vez que podem refletir experiências biológicas e evolutivas (Bookstein, 1991; Zelditch et al., 2004),
tendo como base o conceito de que o fenótipo apresentado por um organismo decorre da interação existente entre um dado genótipo e o meio ambiente em que se encontra (Ricklefs & Miles, 1994) e que a evolução de um mesmo fenótipo em populações naturais pode ser evidência de seleção natural e adaptação (Mcguigan et al., 2005).
Em contrapartida, variações morfológicas podem afetar o comportamento e interação ecológica dos organismos, principalmente se levarmos em conta características físicas e químicas do ambiente (Webb, 1984). Assim, o formato corporal pode ter relevância evolutiva e ecológica para um dado organismo (Klingenberg et al., 2003). Diante disto, análises de
(Schluter, 1993), sendo utilizada em distintas abordagens biológicas durante anos (Monteiro et al., 2002; Rosenberg, 2002).
A morfometria é a análise da forma do corpo em relação ao tamanho através de métodos numéricos, propiciando a interpretação e comparação dos padrões de variação de caracteres quantitativos (Blackith & Reyment, 1971; Cavalcanti & Lopes, 1993).
Historicamente, o estudo da variação corporal consistia em medidas relativas de estruturas anatômicas que eram analisadas por meio de arranjos canônicos, componentes principais e outros recursos estatísticos multivariados, configurando a técnica denominada de morfometria tradicional (Monteiro et al.,
2002).
A morfometria geométrica (MG) é um conjunto de técnicas computacionais e estatísticas, que no estudo da forma de estruturas biológicas possibilita, além de analisar e quantificar, visualizar graficamente a variação de forma da estrutura estudada, considerando simultaneamente várias características de uma estrutura corporal complexa, em que são utilizados marcos anatômicos ou landmarks (Rohlf, 1993; Monteiro & Reis, 1999). A
utilização de landmarks comuns às amostras analisadas permite identificar as
variações de forma entre as mesmas estruturas morfológicas nos diferentes exemplares em estudo.
Na superposição de marcos anatômicos, a variação de forma é estudada nas próprias coordenadas dos mesmos, após a retirada dos efeitos de tamanho, orientação e posição. Logo, se as configurações estão centradas em um ponto comum, proporcionalizadas de forma que tenham o mesmo tamanho e rotacionadas, as coordenadas encontradas localizam um ponto no espaço de forma (Shape Space), chamado de espaço da forma de Kendall (Kendall,
1984;1989; Dryden & Mardia, 1998; Rohlf, 1999).
Esta nova abordagem permite a descrição da variabilidade usando uma análise estatística robusta bem como a utilização de Thin-plate spline (TPS)
para ilustrar e descrever os resultados em termos de deformações. Uma das
O estudo da morfometria tem interessado diversas áreas do conhecimento mostrando-se de grande importância na compreensão da biologia evolutiva dos organismos (Blackith & Reyment, 1971). É considerada uma ferramenta muito útil na sistemática, descrição de estruturas populacionais, identificação de estoques pesqueiros, dimorfismo sexual e fornecimento de conhecimento sobre o grau de variação intra e interespecífico (Fonteles Filho,1989; Peres, et al., 1995; Ehliger, 1991; Vidales et al., 1997;
Fairbairn, 1997; Baras, 1999; Silva, 2000; Fulford & Rutherford, 2000; Rapp Py-Daniel & Cox Fernandes, 2005; Aguirre & Shervette, 2005).
2. OBJETIVOS
2.1 Objetivo geral
Diante das informações disponíveis o presente trabalho se propôs investigar aspectos de diversificação na família Gobiidae, analisando espécies do Atlântico, por meio de análises citogenéticas resolutivas, aliadas a análises dos padrões corporais existentes em níveis inter e intraespecíficos a fim de identificar a presença de processos evolutivos neste peculiar grupo de peixes.
2.2 Objetivos específicos
· Analisar citogeneticamente as espécies Bathygobius mystacium, B. soporator, Ctenogobius smaragdus, C. boleosoma e Coryphopterus glaucofraenum, utilizando coloração convencional, bandamento C,
impregnação por nitrato de prata e coloração com fluorocromos base-específicos (CMA3 e DAPI);
· Estabelecer uma comparação dos padrões morfológicos das espécies Bathygobius mystacium, B. soporator, Ctenogobius smaragdus, C. boleosoma e Coryphopterus glaucofraenum, por meio da técnica de
morfometria geométrica, com fins de aferição ecomorfológica, taxonômica e sistemática;
· Analisar possíveis estruturações populacionais na espécie Bathygobius soporator ao longo do litoral brasileiro (MA, RN e BA) e Atol das Rocas,
3. MATERIAL E MÉTODOS
3.1 Material
Os exemplares da família Gobiidae, foram coletados ao longo do litoral brasileiro no litoral dos estados do Rio Grande do Norte, praia de Búzios (5°41'57.41"S, 35°11'34.71"O) e Barra do Cunhaú (6°19'15.50"S, 35°2'29.31"O), da Bahia, cidade de Salvador (13° 0'39.61"S, 38°31'27.21"O), do Maranhão, cidade de São Luís (2°28'14.06"S, 44°15'49.15"O) e Atol das
Rocas (3º51’’S, 33º49’’W) (Figura 2), com o auxílio de rede de confecção própria e sacos plásticos.
As espécies utilizadas nas análises foram Bathygobius mystacium
(Ginsburg, 1947), n=23; Bathygobius soporator (Valenciennes, 1837), n=170; Ctenogobius smaragdus, (Valenciennes, 1837), n=04; Ctenogobius boleosoma,
(Jordan e Gilbert, 1882), n=29 e Coryphopterus glaucofraenum (Gill, 1863),
n=13 (Figura 2). As mesmas foram identificadas a partir da chave de classificação de Bohlke & Chaplin (1993) e Hoese & Murdy (2002).
Figura 3. Espécies analisadas no presente estudo. a. Ctenogobius smaragdus, b. Ctenogobius boleosoma, c. Bathygobius soporator, d. Bathygobius mystacium, e. Coryphopterus glaucofraenum. Barra=1 cm.
Os espécimes utilizados para estudos morfológicos e citogenéticos foram mantidos em aquários aerados até serem fotografados e submetidos ao processo de estimulação mitótica.
Exemplares testemunho de cada espécie se encontram preservados em formol 5% no Laboratório de Genética de Recursos Marinhos, para posterior depósito no Museu de Ciências Morfológicas da UFRN.
a
b
c
d
3.2 Métodos
3.2.1 Técnica de estimulação mitótica
Os exemplares foram estimulados mitoticamente através da técnica preconizada por Molina (2001) e Molina et al. (2010), que faz uso de complexos
de antígenos do ar, bacterianos e fúngicos (Munolan® e Aminovac®). Este procedimento consiste na inoculação intramuscular de solução do composto (2 comprimidos/1ml de água destilada); na proporção de 1ml/50g de peso corporal, por um período de 24 a 48 horas. Decorrido este tempo, os exemplares foram anestesiados com óleo extraído de cravo (Syzygium aromaticum) (Eugenol) e posteriormente sacrificados para extração do rim
cefálico.
3.2.2 Técnica de obtenção de cromossomos mitóticos
A técnica de obtenção de cromossomos mitóticos adotada seguiu o método preparação in vitro descrito por Gold et al. (1990). Os exemplares
tiveram o rim anterior (cefálico) e posterior removidos e utilizados para obtenção de suspensão celular. Estes foram colocados em 9 ml de meio de cultura RPMI 1640 e dissociados com ajuda de seringas de vidro, transferindo o material logo em seguida para tubos falcon de 15ml, completando o volume
3.2.3 Preparação das lâminas
Um total de três ou quatro gotas de suspensão celular foram gotejadas
sobre uma lâmina recoberta com um filme d’água destilada aquecida à 60oC, após secar ao ar, foi corada com solução Giemsa 5%, diluído em tampão fosfato pH 6,8, por um período de 08 minutos, posteriormente lavada com água destilada e seca ao ar.
3.2.4 Análises cromossômicas
Lâminas previamente preparadas com as suspensões celulares de cada indivíduo foram analisadas através de microscópio óptico, sob o aumento de 1000 vezes. Uma média de 30 metáfases foi analisada para cada exemplar, visando o estabelecimento do valor diploide modal para cada espécie e a definição dos tipos cromossômicos. As melhores metáfases foram fotografadas em fotomicroscópio de epifluorescência (OlympusTM BX50), sob aumento de 1000X, por meio de sistema digital de captura (DP70, Olympus), com o uso dos
software DPController, v. 1.2.1.108 (Olympus Optical Co. Ltd.) e utilizadas na
definição da fórmula cromossômica e construção do cariótipo. Os cromossomos foram definidos quanto à posição dos centrômeros em metacêntricos (m), com a razão entre o braço maior e menor (RB) variando de 1,00 a 1,70; submetacêntricos (sm), RB = 1,71 – 3,00; subtelocêntricos (st), RB = 3,01 – 7,00; e acrocêntricos (a), RB > 7,01 (Levan et al., 1964).
3.2.5 Detecção das Regiões Organizadoras de Nucléolos (RONs)
processo a lâmina foi lavada com água destilada, seca ao ar e analisada ao microscópio.
3.2.6 Detecção de Heterocromatina Constitutiva (Banda-C)
A observação de regiões de heterocromatina constitutiva foi realizada de acordo com o método desenvolvido por Summer (1972) com pequenas alterações, visando uma melhor qualidade das preparações. Inicialmente as lâminas foram imersas em HCl 0,2 N à temperatura ambiente, por 14 minutos, lavando-a logo em seguida em água destilada e seca ao ar. Após isto, as lâminas foram incubadas numa solução saturada de Ba(OH)2.8H2O, à 5%, durante um período de 1 à 2 minutos à 42ºC. Após incubação foram expostas à HCl 0,2N rapidamente, lavadas com água destilada e mantidas em solução de 2xSSC à 60ºC por uma hora, sendo posteriormente coradas com solução à 5% de Giemsa diluído em tampão fosfato, pH 6,8 por 6 minutos e visualizadas ao microscópio.
3.2.7 Coloração com Fluorocromos base-específicos
Para a dupla coloração com os fluorocromos CMA3 e DAPI, as lâminas foram envelhecidas por três dias, coradas com 30 µL de CMA3 0,5 mg/mL por 2 horas, e em seguida coradas com 30 µL de DAPI 2 µL/mL por 30 minutos, segundo metodologia preconizada por (Carvalho et al., 2005), com algumas
modificações. Posteriormente as lâminas foram montadas em tampão glicerol-McIlvaine pH 7,0 (1:1), preservadas em câmara escura, por três dias e então analisadas. As metáfases foram fotografadas em fotomicroscópio de epifluorescência (OlympusTM BX50) com filtros apropriados em aumento de 1000X.
3.2.8 Análises por Morfometria Geométrica
espécimes, com escala métrica, utilizando-se uma câmera digital Sony H10 (8,1 megapixels) acoplada a um tripé VF WT3540.
O programa tpsUtil foi utilizado para ordenar as imagens dos espécimes num único arquivo com o formato TPS, possibilitando o acesso às imagens pelos demais programas da série. O software tpsDig2 (Rohlf, 2006) foi utilizado
para localizar os landmarks ou marcos anatômicos nas imagens, que
posteriormente foram utilizadas nas análises morfométricas. Os landmarks
foram escolhidos segundo a classificação de Bookstein (1991), sendo nove utilizados para estudos interpopulacionais e onze para distinção de espécies. As coordenadas referentes ao posicionamento espacial de cada landmark
foram sobrepostas utilizando-se o software CoordGen6.
Com a utilização do software CVAGen6, análises das variáveis
canônicas (VC) e MANOVA permitiram comparações morfométricas entre as espécies, populações e testes de alocação. O programa MorphoJ 1.02b possibilitou a quantificação do discernimento morfológico através da distância de Mahalanobis, ANOVA e a formação dos grides de deformação à partir da
4.1 Capítulo I
Caracterização da diversidade na família Gobiidae por
meio da citogenética e morfometria geométrica
Lima Filho, P. A. & Molina, W. F.
Resumo
A família Gobiidae é a mais especiosa no ambiente marinho, apresenta características morfológicas com simplificações e perdas em estruturas corpóreas. Tamanha diversidade parece ter sido acompanhada por alterações cromossômicas significativas quando comparada a outros representantes da Ordem Perciformes com elevado conservadorismo cromossômico. Poucas informações citogenéticas estão disponíveis para espécies sul-americanas. Neste trabalho cinco espécies de gobídeos do Atlântico foram caracterizadas citogeneticamente por meio de coloração convencional com Giemsa, bandamento C, identificação de cístrons ribossomais pela técnica de Ag-RONs, coloração com os fluorocromos CMA3/DAPI e comparadas morfologicamente por meio da morfometria geométrica. Identificou-se uma marcante diversidade cariotípica entre as espécies Coryphopterus glaucofraenum (2n=40; 2sm+38a;
NF=42), Ctenogobius smaragdus (2n=48; 2sm+42a; NF=50), Ctenogobius boleosoma (2n=44; 2sm+42a; NF=46), Bathygobius mystacium (2n=48;
2m+4st+42a; NF=54) e Bathygobius soporator (2n=48; 2m+6st+40a; NF=56).
Quanto aos padrões morfológicos todas as cinco espécies apresentam perfis morfológicos distintos, contudo exibem maior proximidade morfológica entre espécies cogenéricas. Os dados cromossômicos ressaltam o papel das
inversões pericêntricas, fusões e fissão na evolução cariotípica do grupo. A diversidade cariotípica e morfológica presente nesta família sugerem uma dinâmica na evolução compatível com grupos dulcícolas sujeitos a intensas fragmentações populacionais, aliado a diversificações morfológicas adequadas a exploração de habitats peculiares.
Characterization of the diversity of Gobiidae family by
cytogenetics and geometric morphometrics
Lima Filho, P. A. & Molina, W. F.
Abstract
Gobiidae family is the most specious in the marine environment, it shows morphologic features with simplifications and losses on body structure. Such diversity seems to have been accompanied by chromosomal changes significantly when compared to others representatives of the order Perciformes with high chromosomal conservatism. Few cytogenetic informations are available for South American species. In this study five species of Atlantic gobídeos were characterized cytogenetically by conventional Giemsa staining, C banding, identification of ribosomal cistrons by the technique of Ag-NORs, staining with the fluorochromes CMA3/DAPI, and also compared morphologically and by means of geometric morphometry. It was identified a remarkable karyotypic diversity among species Coryphopterus glaucofraenum
(2n=40; 2sm+38a; NF=42), Ctenogobius smaragdus (2n=48; 2sm+42a;
NF=50), Ctenogobius boleosoma (2n=44; 2sm+42a; NF=46), Bathygobius mystacium (2n=48; 2m+4st+42a; NF=54) e Bathygobius soporator (2n=48;
2m+6st+40a; NF=56). Against to the morphologic patterns, all five species have distinct morphological profiles, but exhibit greater proximity among morphological species co-generics. Chromosomes data underscore the role of pericentric inversions, merges and fission in karyotype evolution of the group. The karyotypic and morphological diversity present in this family suggests a dynamic evolution compatible with freshwater groups vulnerable to intense population fragmentation, morphological diversification with appropriate exploration of peculiar habitats.
Introdução
Os peixes da família Gobiidae estão distribuídos nas regiões tropical, subtropical e temperada em habitats costeiros e dulcícolas. Com cerca de 1.950 espécies, representam a maior família de peixes marinhos (Nelson, 2006), componente importante e predominante da fauna de peixes em ambientes recifais. Devido à ocorrência de espécies morfologicamente crípticas e de difícil amostragem, a biologia deste grupo permanece pouco estudada (Thacker, 2003). Na costa brasileira existem cerca de 40 espécies (Menezes et al., 2003), sendo a sua maioria compartilhada com a fauna caribenha.
Contrastando com outros grupos de Perciformes marinhos, a família Gobiidae apresenta elevada diversidade cariotípica, o que a torna um modelo particularmente importante para o entendimento da estrutura genética de populações marinhas (Brum & Galetti, 1997). No que diz respeito aos aspectos citogenéticos, a maioria das informacões para este grupo estão resumidas prioritariamente a descrições numéricas e de morfologia cromossômica que apesar da pouca ajuda no esclarecimento de relações filogenéticas (Ene, 2003; Caputo et al., 1997), contribui substancialmente para o conhecimento da sua
diversidade para família (Vasil’ev & Grigoryan, 1993). Estudos citogenéticos demonstraram uma tendência à ocorrência de translocações Robertsonianas para a família, com demonstrações de variações cromossômicas intra e inter-populacionais (Ene, 2003).
A dificuldade em classificar e identificar representates da família Gobiidae, ocorre devido às características morfológicas escassas e marcante variação morfológica interpopulacional (Springer, 1983; Winterbottom, 1984), gerando para muitas espécies confusões taxonômicas e de nomenclatura (Kottelat, 1997). No entanto, o uso de análises por morfometria geométrica já utilizada com sucesso em diversos grupos de peixes (e. Ibañez et al., 2007;
Maderbacher et al., 2008; Chizinski et al., 2010), que permite identificar
variações geométricas da forma, com base numa configuração de pontos anatômicos com redução dos efeitos inerentes ao tamanho, a localização e a posição estrutural ocupada (Monteiro et al., 2002; Parsons et al., 2003), não foi
Em alguns grupos de peixes a estrutura cariotípica parece ter sofrido poucas mudanças evolutivas quando comparadas às mudanças morfológicas (Molina et al., 2002; Motta Neto & Molina, 2010). Não está claro se entre os
Gobiidae, diferentemente de inúmeras outras famílias de Perciformes (Molina, 2006), existem divergências nas taxas evolutivas entre os padrões cromossômicos e morfológicos.
Neste sentido, a fim de se obter melhor compreensão da diversificação cromossômica e mofológica desta família, aqui são apresentados os primeiros registros citogenéticos de cinco espécies do Oeste do Atlântico, cujos padrões são comparados citogeneticamente em associação com seus caracteres ecomorfométricos.
Material e métodos
Foi coletado um total de 119 exemplares de cinco diferentes espécies de Gobiidae (Tabela 1) provenientes do litoral do Estado do Rio Grande do Norte (RN) (Praia de Búzios - 5º 46’ S, 35º 12’ W) e estuário de Barra do Cunhaú (6°19'15.50"S, 35°2'29.31"O), NE do Brasil. Deste total apenas a espécie
Ctenogobius smaragdus foi coletada no estuário de Barra do Cunhaú e as
demais proveniente da praia de Búzios. Os espécimes foram capturados com uso de rede de confecção própria, transferidos às dependências do laboratório de Genética de Recursos Marinhos na UFRN e mantidos em aquários aerados até serem fotografados para análises morfológicas e se procedesse à realização de preparações cromossômicas.
Análises citogenéticas
Precedente aos métodos de obtenção de cromossomos metafásicos, os
exemplares foram submetidos à estimulação mitótica, “in vivo” com duas aplicações intramuscular/peritoneal de Aminovac® (complexo de antígenos bacterianos e fúngicos) na razão de um comprimido diluído em 0,5 ml de água na proporção de 100 g de peso do animal (Molina et al., 2010).
analisadas de cada exemplar para se estabelecer o número modal, sendo que, as melhores metáfases foram fotografadas em um microscópio OlympusTM BX50, (1000x), acoplado à uma câmera digital (Olympus, modelo DP70), e utilizadas na confecção do cariótipo. A morfologia cromossômica foi determinada de acordo com Levan et al. (1964). As regiões heterocromáticas
foram evidenciadas a partir da metodologia desenvolvida por Sumner (1972), enquanto que a detecção das Ag-RONs foi realizada conforme a técnica descrita por Howell & Black (1980). A coloração com os fluorocromos CMA3 e DAPI seguiu o protocolo de Carvalho et al. (2005).
Tabela 1. Número de indivíduos utilizados para estudos morfométricos e citogenéticos.
Espécies Análises
citogenéticas
Análises morfométricas
Coryphopterus glaucofraenum (05♀, 03♂) 13
Ctenogobius boleosoma (02♀, 03♂) 29
Ctenogobius smaragdus (02♀, 02♂) 04
Bathygobius mystacium (02♀, 02♂) 23
Bathygobius soporator (09♀, 11♂) 50
Total 41 109
Análises morfológicas
Para as análises por morfometria geométrica (MG), imagens no formato JPEG com dimensão 3264x2448, foram obtidas da face lateral esquerda dos espécimes, com escala de métrica, utilizando-se uma câmera digital Sony H10 (8,1 megapixels) acoplada a um tripé VF WT3540.
O programa tpsUtil foi utilizado para ordenar as imagens dos espécimes num único arquivo com o formato TPS. O software tpsDig2 (Rohlf, 2006) foi
utilizado para localizar 11 landmarks nas imagens (Figura 1), escolhidos
Com a utilização do software CVAGen6, análises das variáveis
canônicas (VC) e MANOVA permitiram comparações morfométricas entre as espécies, testes de alocação e agrupamentos. Para realizar o teste estatístico ANOVA, D2 (distância de Mahanalobis) e gerar matrizes (Gride) de deformação
comparativa, utilizou-se o programa MorphoJ 1.02b®.
Figura 1. Imagem digitalizada de Coryphopterus glaucofraenum retratando os 11 landmarks
utilizados nas análises morfológicas interespecífica em Gobiidae. Descrição esquemática dos
landmarks. 1. Ponto distal do osso pré-maxilar; 2. Origem da primeira nadadeira dorsal; 3.
Término da primeira nadadeira dorsal; 4. Origem da segunda nadadeira dorsal; 5. Término da segunda nadadeira dorsal; 6. Término da nadadeira anal; 7. Origem da nadadeira anal; 8. Origem da nadadeira pélvica; 9. Margem anterior ocular; 10. Margem posterior ocular; 11. Base superior da nadadeira peitoral.Barra=0,5cm.
Resultados
As análises citogenéticas realizadas nos gobídeos C. glaucofraenum, C. boleosoma, C. smaragdus, B. mystacium e B. soporator, indicaram um número
diplóide que variou de 40 a 48 cromossomos, com diferentes números fundamentais, e cariótipos constituídos por elementos metacêntricos, submetacêntricos, subtelocêntricos e na sua maioria acrocêntricos (Tabela 2).
Em todas as espécies analisadas pôde-se observar Ag-RONs simples em posição terminal no braço curto de um dos maiores pares do cariótipo. A única exceção foi observada em B. mystacium, cujos sítios ribossomais
estavam presentes na maioria dos cromossomos nas regiões centroméricas e terminais, das duas espécies do gênero Ctenogobius (Figura 4).
O bandamento C revelou a presença de blocos heterocromáticos evidentes nas espécies C. smaragdus, B. soporator e B. mystacium e
reduzidos em C. glaucofraenum, preferencialmente localizados na região
centromérica da maioria dos cromossomos, com a presença de alguns blocos em regiões terminais para todas as espécies e em posição pericentroméricas em alguns cromossomos de B. mystacium.
A espécie C. glaucoraenum apresentou seus primeiros pares
acrocêntricos com tamanhos relativamente superiores (Figura 7), que configura a seu cariótipo uma redução desequilibrada de tamanho cromossômico, diferente do padrão de redução proporcional apresentado pelas demais espécies analisadas.
Tabela 2. Dados citogenéticos das cinco espécies de Gobiidae analisadas.
Espécies 2n Cariotípica Fórmula NF Ag-RONs Banda C
CMA3+
DAPI
-Coryphopterus glaucofraenum 40 2sm+38a 42 Simples (1º T) C e T 1º T
Ctenogobius boleosoma 44 2sm+42a 46 Simples (1º T) - Múltiplas
Ctenogobius smaragdus 48 2sm+46a 50 Simples (1º T) C e T Múltiplas
Bathygobius mystacium 48 2m+4st+42a 54 Simples (5º I) C, T e I 5º I
Bathygobius soporator 48 2m+6st+40a 56 Simples (4º T) C e T 4º T
Figura 2. Cariótipo de Ctenogobius smaragdus a partir de coloração convencional (a) bandamento
C (b). Em destaque (c) o par organizador nucleolar (1º) corado com impregnação argêntea, CMA3 e
DAPI. Barra=5µm.
Figura 3. Cariótipo de Ctenogobius boleosoma a partir de coloração convencional (a). Em destaque
(b) o par organizador nucleolar (1º) corado com impregnação argêntea, CMA3 e DAPI. Barra=5µm.
Figura 4. Metáfase de C. smaragdus (a) e C. boleosoma (b), exibindo marcações CMA3+ na maioria
dos cromossomos em posição centromérica e terminal. Barra=5µm.
CMA3
1º
DAPI
a
b
c
a
b
1º
CMA3
DAPI
Figura 5. Cariótipo de Bathygobius soporator a partir de coloração convencional (a) e bandamento
C (b). Em destaque (c) o par organizador nucleolar (4º) corado com impregnação argêntea, CMA3 e DAPI. Barra=5µm.
Figura 6. Cariótipo de Bathygobius mystacium a partir de coloração convencional (a) e bandamento
C (b). Em destaque (c) o par organizador nucleolar (5º) corado com impregnação argêntea, CMA3 e DAPI. Barra=5µm.
a
b
c
DAPI CMA3
4º
a
b
c
DAPI CMA3
Figura 7. Cariótipo de Coryphopterus glaucofraenum a partir de coloração convencional (a) e
bandamento C (b). Em destaque (c) o par organizador nucleolar (1º) corado com impregnação argêntea, CMA3 e DAPI. Barra=5µm.
O teste de MANOVA utilizando as variáveis canônicas demonstraram alto poder discriminante onde as variáveis 1 e 2 explicaram a maior parte da variação morfológica observada (53%) para as espécies. A variação morfológica foi significante (Wilks’ Lambda=0.0002; X2=496.9974; df=72; p<0,001; distância de Mahalanobis >6.0) entre as espécies, permitindo ainda
agrupar com total precisão todos representantes das cinco espécies (Figura 8). Obteve-se maior proximidade morfológica entre as espécies cogenéricas pertencentes aos gêneros Bathygobius e Ctenogobius (Mahalanobis
equivalente a 8,36 e 14,24, respectivamente), no entanto, significativamente
distintas para Bathygobius. As espécies destes dois gêneros são discriminadas
entre si ao longo da variável canônica 1. Os exemplares de C. Glaucofraenum
são perfeitamente discriminados de B. soporator e B. mystacium pela variável
canônica 2.
Tabela 3. Resultados post-hoc ANOVA a partir de procrustes, classificadas com a média
do centróide, efeito individual, para todos os espécimes em estudo e espécies dos gêneros Bathygobius e Ctenogobius.
Grupos p F df
Todos os espécimes <0,0001 23,55 4
Bathygobius <0,0001 47,58 1
Ctenogobius 0,36* 0,88 1
* Valor não significativo.
a
b
c
CMA3 1º
O gride de deformação das cinco espécies (Figura 9) evidencia variações entre todos landmarks, com modificações mais expressivas quanto
ao posicionamento da boca e altura corporal. No gride referente as diferenças morfológicas entre espécies do gênero Bathygobius (Figura 10), verificamos
maiores modificações quanto ao posicionamento da boca, altura corporal e base superior da nadadeira peitoral. O gride comparativo entre espécies do gênero Ctenogobius (Figura 11), demonstrou variações quanto ao tamanho do
olho, posição da boca, altura corporal e tamanho da nadadeira anal.
Figura 9. Gride de deformação a partir da primeira Variável Canônica, os vetores indicam a direção da deformação sofrida por cada landmark na representação espacial comparativa das cinco espécies de Gobiidae analisadas.
Figura 10. Análise morfométrica comparativa entre B. mystacium e B. soporator, a partir da
variável canônica 1. Ponto médio central representa B. mystacium e o desvio vetorial à espécie B. soporator.
Figura 11. Análise morfométrica comparativa, entre as espécies do gênero Ctenogobius, á partir
da variável canônica 1. Ponto médio central representa C. boleosoma e o desvio vetorial a espécie
C. smaragdus. CV1
CV1
Discussão
Os gobídeos analisados demonstraram marcante diversidade cariotípica, tanto numérica exibido por C. boleosoma (2n=44) e C. glaucofraenum (2n=40),
quanto estrutural entre as espécies C. smaragdus, B. mystacium e B. soporator, que apresentam mesmo número cromossômico (2n=48), mas
divergências quanto ao número de elementos bibraquiais (NF=50, 54 e 56). As espécies já analisadas citogeneticamente da família Gobiidae demonstram cariótipos altamente variáveis (Galetti et al., 2000). Através do
levantamento de dados citogenéticos disponíveis para o grupo (Tabela 4), encontram-se descrições citogenéticas de 81 espécies, o que corresponde a 4,15%, referente ao total de espécies da família, destas os números diplóides mais frequentes correspondem a 2n=44 e 46, ambos com frequência aproximada de 33%, seguido por 2n=48, com cerca de 10%. Acompanhado da diversificação numérica, identifica-se notável variação na macroestrutura cariotípica identificada por largos valores de variação para o número de braços cromossômicos (NF= 38 a 98), com valor modal de 24,7% para espécies com NF=46.
Os estudos cromossômicos em gobídeos estiveram concentrados nas décadas de 70-90, desenvolvidos basicamente no continente europeu e asiático. Diante das metodologias vigentes na maioria dos casos se restringiram ao estabelecimento dos valores diplóides e macroestrutura cariotípica, oferecendo informações limitadas ao uso de abordagens filogenéticas (Caputo, 1998). Apesar disso, os dados disponíveis sugerem diferentes mecanismos envolvidos na diferenciação cariotípica deste peculiar grupo de peixes. Os principais mecanismos são as inversões pericêntricas, fissões e fusões cêntricas, comum a muitos grupos de peixes (Amores et al.,
1990; Phillips & Rab, 2001), estes últimos responsáveis pelas intensas divergências numéricas em Gobiidae (Cataudella et al., 1973; Thode et al.,
1985; Amores et al., 1990, Klinkhardt, 1992; Caputo et al., 1996, 1997).
Entre os rearranjos cromossômicos, as fusões robertsonianas têm sido apontadas como um dos mecanismos mais comuns envolvidos na diferenciação cariotípica deste táxon (Thode et al.,1988; Galetti et al., 2000),
para várias espécies de Gobiidae presentes no Mar Negro e Mediterrâneo (Ene, 2003).
Tabela 4. Dados citogenéticos disponíveis para a família Gobiidae (Perciformes).
Subfamília Espécie 2n Fórmula cariotípica NF Referências
Amblyopinae
Odontamblyopus rubicundus** (=Gobioides rubicundus)
46 2m+26sm+10st+8a 84 Manna & Prasad (1974)
O. rubicundus 46 4m+16sm+26st/a 66 Arai & Sawada (1975)
Trypauchen vagina 46 12m+6sm+10st+18a 74 Khuda-Bukhsh (1978)
Oxudercinae
Apocryptes bato 46 24m+10sm+12a 80 Nayak & Khuda-Bukhsh (1987)
Boleophthalmus boddarti 46 46m/sm 92 Subrahmanyan (1969)
B. glaucus 46 12m+20sm+2st+12a 80 Manna & Prasad (1974)
B. pectinirostris 46 46st/a 46 Arai & Sawada (1975)
Periophthalmus modestus**
(=Periophthalmus cantonensis) 46 18m+12sm+16st/a 76 “ Pseudapocryptes elongatus** (=Apocryptes
lanceolatus) 38 14m+22sm+2st 76
Nayak & Khuda-Bukhsh (1987)
Sicydiinae
Sicyopterus japonicus 44 10m+10sm+24a 64 Arai & Fujiki (1979)
Gobiinae
Acentrogobius pflaumi 50 48m/sm+2st/a 98 Nogusa (1960)
Amblygobius albimaculatus 44 2m+42st/a 46 Nishikawa et al. (1974)
Aphia minuta1 44 44a 44 Caputo et al. (1999)
“ 43 42a+1st 42 “
“ 42 1m+1st+40a 44 “
“ 42 1M+1m+40a 44 “
“ 41 2M+1st+38a 44 “
Bathygobius fuscus 48 48a 48 Arai & Sawada (1975)
B. mystacium 48 2m+4st+42a 54 Presente estudo
B. soporator 48 2m+46a 50 Brum et al. (1996)
“ “ 2m/sm+46a 50 Cipriano et al. (2002)
B. soporator 48 2m+6st+40a 56 Presente estudo
Coryphopterus glaucofraenum 40 2sm+38a 42 Presente estudo Elacatinus macrodon** (=Gobiosoma
macrodon) 38 38a 38 Musammil (1974)
E. zebrella** (=Gobiosoma zebrella) 38 38a 38 “
Glossogobius fasciatopunctatus 44 10m+28sm+2st+4a 84 Fei & Tao (1987)
G. giuris 46 46a 46 Rishi & Singh (1982)
Gobiodon citrinus 44 2m+42st/a 46 Arai & Sawada (1974)
“ 43 1m+42st/a 44 “
G. quinquestrigatus 44 44a 44 Arai & Fujiki (1979)
G. rivulatus 44 44a 44 “
Gobius bucchichi 44 2sm+42a 46 Thode & Alvarez (1983)
G. cobitis 46 46a 46 Caputo et al. (1997)
G. cruentatus 46 2st+44a 48 Thode & Alvarez (1983)
G. fallax1 38 8m/sm+30a 46 Thode et al. (1988)
“ 39 7m/sm+32a 46 “
“ 40 6m/sm+34a 46 “
“ 40 7m/sm+33a 47 “
“ 41 5m/sm+36a 46 “
“ 42 4m/sm+38a 46 “
“ 43 3m/sm+40a 46 “
G. niger1 52 2m+4sm+16st+30a 74 Vitturi & Catalano (1989)
“ 51 3m+4sm+16st+28a 74 Caputo et al. (1997)
“ 50 4m+4sm+16st+26a 74 “
“ 49 5m+4sm+16st+24a 74 “
G. paganellus1 48 2sm+46a 50 “
Gobiusculus flavescens 46 6m/sm+40a 52 Klinkhardt (1992)
Mesogobius batrachocephalus 30 16m+14a 46 Ivanov (1975)
Neogobius melanostomus** (=N.
cephalarges) 46 46a 46 Vasil’ev (1985)
N. fluviatilis 46 46a 46 “
N. gymnotrachelus1 46 46a 46 Vasil’ev & Grogoryan(1992)
N. melanostomus 46 46a 46 Vasil’ev (1985)
Padogobius bonelli** (= P. martensi) 46 1m+3sm+2st+40a 52 Cataudella
et al. (1973)
Pomatoschistus lozanoi 37 3m+12sm+10st+12a 62 Webb (1980)
P. microps 46 4m+16sm+20st+6a 86 Klinkhardt (1989)
P. minutus 46 4m+16sm+16st+10a 82 “
“ “ 18sm+18st+10a 82 “
P. norvegicus 32 10m+10sm+8st+4a 60 Webb (1980)
P. pictus 46 22m/sm+12st+12a 80 Klinkhardt (1992)
Ponticola constructor** (=Neogobius
constructor)1 42 4m/sm+38a 46 Vasil’ev & Vasilieva (1994)
P. cyrius** (=Neogobius cyrius)1
36 -- -- “
P. eurycephalus** (=Neogobius
eurycephalus)1 32 12m+2sm+18a 46 Ene (2003)
“ 31 13m+2sm+16a 46 Ene (2003)
“ 30 14m+2sm+14a 46 “
P. kessleri** (=Neogobius kessleri)
46 46a 46 Vasil’ev (1985)
Proterorhinus marmoratus 46 46a 46 Rab (1985)
Rhinogobiussimilis** (=Gobius similis) 44 -- -- Nogusa (1960)
Zosterisessor ophiocephalus (=Gobius
ophiocephalus)1 46 2m/sm+44a 48 Caputo et al. (1996)
Z. ophiocephalus
46 46a 46 Vasil’ev (1985)
“ 45 1st+45a 47 “
Gobionellinae
Acanthogobius lactipes** (=Aboma lactipes) 40 40a 40 Arai & Sawada (1974)
A. flavimanus 44 44st/a 44 “
“ “ 36st+8a 80 Arai & Kobayashi (1973)
“ “ 10m/sm/st+34a 54 Arai & Sawada (1975)
Awaous grammepomus 46 46st/a 46 Khuda-Bukhsh & Barat (1987)
A. strigatus 46 (♀) X1X1X2X2 -- Souza et al. (1998)
“ 45 (♂)X1X2Y -- “
A. tajasica 46 46a 46 Stange & Passamani (1986)
Chaenogobius annularis 44 18sm+26st/a 62 Arai & Sawada (1975)
“ “ 36m/sm+8a 80 Arai et al. (1974)
“ “ 44a 44 Nogusa (1960)
Gymnogobius castaneus**
(=Chaenogobius castaneus) 44 36m/sm/st+8a 80 Nishikawa et al. (1974)
G. isaza**(=Chaenogobius isaza) 44 12sm+32st/a 56 Arai & Sawada (1975)
G. urotaenia** (=Chaenogobius urotaenia) 44 -- -- Nogusa (1960)
“ 42 14sm+28a 56 Yamada (1967)
Chaenogobius annularis** (=Chasmichthys
dolichognatus) 44 44st/a 44 Arai & Sawada (1975)
Chasmichthys gulosus 44 44st/a 44 “
“ “ 16m/sm/st+28a 60 Nishikawa et al. (1974)
Ctenogobius boleosoma 44 2sm+42a 46 Presente estudo
C. smaragdus 48 2sm+46a 50 Presente estudo
C. shufeldti** (=Gobionellus shufeldti) 48
48a (♀) 48 Pezold (1984)
“ 47 46a+1m (♂) 48 “
Mugilogobius abei** (=Gobius abei) 46 -- -- Nogusa (1960)
Gillichthys mirabilis 44 12sm+32a 56 Chen & Ebeling (1971)
Luciogobius grandis 44 -- -- Arai (1981)
L. guttatus 44 -- -- Arai & Kobayashi (1973)
Pterogobius elapoides 44 14sm+30st 88 “
P. zonoleucus 44 14sm+30st 88 Arai & Sawada (1975)
Quietula guaymasiae 42 6m+4sm+32a 52 Cook (1978)
Q. y-cauda 42 42a 42 “
Rhinogobius brunneus 44 44a 44 Nishikawa et al. (1974)
R. flumineus 44 44a 44 Arai & Kobayashi (1973)
R. flumineus** (=Tukugobius
flumineus) 44 44a 44 Nadamitsu (1974)
R. giurinus 44 44a 44 Nishikawa et al. (1974)
Tridentiger obscurus 44 10m/sm+34a 54 Arai et al. (1974)