UNIVERSIDADE DE SÃO PAULO
INSTITUTO DE QUÍMICA
Programa de Pós-Graduação em Ciências Biológicas (Bioquímica)
KARINA HELENA MORAIS CARDOZO
Estudos de compostos fotoprotetores da radiação
ultravioleta em algas:
aminoácidos tipo micosporinas (MAAs)
São Paulo
KARINA HELENA MORAIS CARDOZO
Estudos de compostos fotoprotetores da radiação
ultravioleta em algas:
Aminoácidos tipo micosporinas (MAAs)
Tese apresentada ao Instituto de
Química da Universidade de São Paulo para
obtenção do Título de Doutor em Ciências
(Bioquímica)
Orientador: Prof. Dr. Pio Colepicolo
Karina Helena Morais Cardozo
Estudos de compostos fotoprotetores da radiação ultravioleta em algas: Aminoácidos tipo micosporinas (MAAs)
Tese apresentada ao Instituto de Química da
Universidade de São Paulo para obtenção do
Título de Doutor em Ciências (Bioquímica).
Aprovado em: ____________
Banca Examinadora
Prof. Dr. _______________________________________________________
Instituição: _______________________________________________________ Assinatura: _______________________________________________________
Prof. Dr. _______________________________________________________
Instituição: _______________________________________________________ Assinatura: _______________________________________________________
Prof. Dr. _______________________________________________________
Instituição: _______________________________________________________ Assinatura: _______________________________________________________
Prof. Dr. _______________________________________________________
Instituição: _______________________________________________________ Assinatura: _______________________________________________________
Prof. Dr. _______________________________________________________
A minha avó, meus pais e irmãos pelo amor, compreensão
AGRADECIMENTOS
Ao meu querido orientador Dr. Pio Colepicolo, cuja confiança, estímulo e carinho foram essenciais nestes anos para o meu amadurecimento científico.
Ao meu querido amigo Ernani por toda ajuda, suporte, carinho e apoio incondicional. Obrigada por ter estado ao meu lado em todos os momentos que precisei, sempre torcendo por mim. Seu incentivo durante minha carreira científica fez com que eu chegasse aqui.
Ao Betão pela colaboração, amizade e ajuda constante. Obrigada por ter me ensinado muito além da técnica de espectrometria de massas. Sua participação e dedicação foram importantíssimas para que este trabalho fosse concluído.
Ao Dr. Donat P. Häder, do Institut für Botanik und Pharmazeutische Biologie, Friedrich-Alexander-Universität, Erlangen, Alemanha pela colaboração científica e incentivo ao meu aprimoramento profissional.
A Profa. Dra. Eliane Marinho Soriano, da Universidade Federal do Rio Grande do Norte por ter coletado e identificado as macroalgas utilizadas neste trabalho.
A minha querida e grande amiga Thais pela amizade, estímulo e suporte. O mais legal de todo este trabalho foi ter colaborado com você. Nunca esqueça que sem você eu não teria conseguido.
A Van pela amizade, carinho e preciosos conselhos. Todos estes anos de convivência mostraram que poucas pessoas podem ser como você: sincera, amiga, bem humorada e com um coração enorme.
Ao Val por sua amizade e valiosa contribuição nos experimentos por espectrometria de massas.
As minhas amigas do coração Van, Tha, Angelita e Drica. Sinto-me lisonjeada em ter amigas como vocês. Obrigada por todos os momentos, felizes e tristes, em que passamos juntas.
Aos companheiros de laboratório de diferentes épocas: Paty Lopes, Tona, Teresa, Jac, Helô, Alcely, Keith, Marcelo, Sara, Maísa, Lígia, Ana Maria, Anderson, João, Diogo, Patrícia, Douglas, Paula, Faby, Vânia, Felipe, Meron, Sidney e Humberto pela convivência e amizade. Em especial a Faby que me ajudou muito na realização de vários experimentos.
Aos meus queridos amigos que fiz durante meu estágio na Alemanha que me acolheram tão bem e me ajudaram em tudo que fosse possível: Sebb, Jenny, Manfred, Martin e Peter. Obrigada também as minhas amigas Cyn, Julia, Birgit e aos amigos Sebb e Achim que tornaram minha vida na Alemanha muito mais fácil e inesquecível.
Ao Ed, pelo carinho e ajuda valiosa em todos os momentos.
Ao Diogo e Felipe pela amizade e discussões científicas que foram muito produtivas e importantes para o desenvolvimento desta tese.
Ao Marconi pela grande ajuda na parte estatística.
A Bruna Mohovic pela discussão e valiosos comentários nos experimentos de exposição ao UV;
A Lu do Instituto de Biologia pela colaboração e disposição para responder várias questões minhas sobre algas.
Ao meu mais recente colaborador Mario Carignan do Instituto Nacional de
Investigación y Desarrollo Pesquero (INIDEP), Mar de Plata, Argentina, que em
poucos dias tornou-se um amigo muito especial. Obrigada por toda ajuda e sugestões preciosas na etapa final deste trabalho.
Ao pessoal da pós-graduação pela disposição em atender bem e excelente trabalho;
A Tati pela revisão deste trabalho.
A minha avó, meus pais, meus irmãos e familiares pelo amor, compreensão e apoio de sempre. Obrigada por entenderem minha ausência.
Ao meu querido sogro Edmur pelo carinho, incentivo e por acreditar em mim. Ao David pelo amor, incentivo e compreensão. Sem sua ajuda eu não teria conseguido. A sua presença faz com que minha vida seja plena
Ao DAAD (Deutscher Akademischer Austausch Dienst) pelo auxílio financeiro que possibilitou o estágio na Alemanha.
RESUMO
Cardozo, K.H.M. Estudos de compostos fotoprotetores da radiação ultravioleta em algas: Aminoácidos tipo Micosporinas (MAAs). 2007. 168p. Tese (Doutorado) - Programa de Pós-Graduação em Ciências (Bioquímica). Instituto de Química, Universidade de São Paulo, São Paulo.
Aminoácidos tipo micosporinas (MAAs) são compostos responsáveis pela fotoproteção no ultravioleta de diversos organismos aquáticos. São sintetizados pela via do ácido chiquímico por algas, bactérias e fungos, de maneira similar à síntese de flavonóides em plantas superiores.
Neste trabalho foram conduzidos estudos relacionados a estes compostos em algas. Protocolos de extração de diferentes algas foram testados alterando-se parâmetros como solventes, temperatura e condições de incubação. Os resultados mostraram que dependendo da alga estudada, diferentes condições podem mudar a concentração de MAAs extraída, ressaltando a importância de se testar diversos parâmetros na extração, evitando assim valores sub- ou superestimados de concentrações. O desenvolvimento de um método por HPLC permitiu a separação de 6 MAAs com boa resolução. A caracterização estrutural foi realizada majoritariamente por espectrometria de massas utilizando diferentes tipos de analisadores. Estas análises permitiram a proposição de mecanismos de fragmentação descritos pela primeira vez para esta classe de compostos e possibilitaram a identificação de diferentes MAAs em algumas micro e macroalgas.
Ensaios in vitro foram realizados com o extrato obtido da macroalga Gracilaria
direcionadas à fotoproteção. Os testes de estabilidade quanto ao pH, temperatura e exposição à radiação ultravioleta bem como os ensaios de citotoxicidade, fototoxicidade e avaliação do fator de proteção solar sugeriram que este extrato pode ser promissor quando incorporado em formulações direcionadas para a fotoproteção. Este extrato não apresentou atividade antioxidante significativa.
Os estudos com o dinoflagelado Prorocentrum minimum isolado de duas regiões diferentes, quando exposto às radiações ultravioleta, mostraram que houve uma indução das MAAs em ambas linhagens em todos os tratamentos realizados no período de 72 h. A indução foi mais rápida e pronunciada na linhagem oriunda de Lisboa, em Portugal do que na linhagem proveniente de Kattegat, na Dinamarca. Estes dados estão de acordo com as características do local de origem das linhagens, uma vez que os dinoflagelados originários de Portugal em seu meio natural estavam sujeitos a maiores irradiações. Medidas do rendimento quântico do fotossistema II indicaram que a síntese e acúmulo de MAAs em P. minimum isolada de Lisboa ofereceu vantagens na proteção do sistema fotossintético e na supressão de espécies reativas de oxigênio desta microalga quando comparada aos indivíduos da mesma espécie de regiões com menores irradiações.
Palavras-chave: Aminoácidos tipo micosporinas, MAAs, Compostos Fotoprotetores,
ABSTRACT
Cardozo, K.H.M. Studies of ultraviolet sunscreen compounds in algae: Mycosporine-like amino acids (MAAs). 2007. 168p. PhD Thesis - Graduate Program in Biochemistry. Instituto de Química, Universidade de São Paulo, São Paulo.
Mycosporine-like amino acids (MAAs) are chemically related water soluble compounds responsible for UV photoprotection in many aquatic organisms. They are biosynthesized via the shikimate pathway by algae, bacteria and fungi in a similar manner to the biosynthesis of UV-screening flavonoids in terrestrial plants.
In this work, studies related to this class of compounds were performed with algae. Extraction protocols of some algae were tested using diverse solvents at different temperature. The results showed that depending on the organism examined, both solvent concentration and temperature affected extraction efficiency and final MAA concentration. The improvement of a HPLC method separated a mix of 6 MAAs with good resolution. The structural characterization was made by mass spectrometry using different analyzers. The analysis by mass spectrometry allowed the proposition of new mechanisms of fragmentation and identification of different MAAs in some micro and macroalgae.
In vitro preliminary assays were performed to evaluate the potential use of
Gracilaria domingensis extract in suncare products. The extract showed no
antioxidant activity, however the pH, temperature and UV exposure stability, as well the citotoxicity, phototoxicity and sun protection factor showed a potential commercial utilization for the extracts.
isolated from Lisbon, Portugal and Kattegat, Denmark, showed that MAAs were induced in all treatments during 72 h. The induction was faster in the species from Lisbon than the ones from Kattegat. These data are in agreement with local isolation place, since the dinoflagellates from Portugal are submitted to high irradiance regime in their natural environment. The quantum yield of photosystem II suggested that the over production of MAAs by P. minimum from Lisbon protects the photosynthetic apparatus, indicating that MAAs act as spectrally specific UV sunscreens in phytoplankton.
Keywords: Mycosporine-like amino acids, MAAs, Sunscreen Compounds, Algae
LISTA DE FIGURAS
Figura 1. Espectro da radiação ultravioleta. ...22
Figura 2. Vias de interconversão de diferentes MAAs propostas por Carreto e colaboradores (2005). Os retângulos tracejados indicam compostos ainda não caracterizados. Adaptado de Carreto et al., 2005. ...27
Figura 3. Conversão por bactérias de chinorina em micosporina-glicina (moderado antioxidante) e deoxigadusol (forte antioxidante) por bactérias (Dunlap & Shick, 1998). ...29
Figura 4. Intermediários e enzimas da via do ácido chiquímico. DAHP: 3-deoxi-arabino-heptulosonato-7-fosfato; EPCP: 5-enolpiruvilchiquimato-3-fosfato. Enzimas: (1) DAHP sintase; (2) DHQ sintase; (3) DHQ dehidratase; (4) chiquimato desidrogenase; (5) chiquimato quinase; (6) EPCP sintase; (7) corismato sintase. R2: aminoácidos e aminoálcools caracterizando diferentes MAAs (adaptado de Shick & Dunlap, 2002)...33
Figura 5. Esquema simplificado da absorção de luz por um fotoprotetor mostrando vias de dissipação por calor (indicada por ∆) e pela formação de espécies reativas. SOD: superóxido dismutase; LH: lipídio poliinsaturado (modificado de Dunlap et al., 1998b). ...39
Figura 6. Análogos sintéticos de MAAs para uso em fotoprotetores e respectivos comprimentos de onda máximos de absorção (λmax). ...41
Figura 7. Esquema simplificado dos componentes principais de um espectrômetro de massas que indicam os modos de introdução da amostra, ionização e analisadores utilizados neste trabalho...44
Figura 8. Esquema simplificado de uma fonte de ionização por electrospray. O analito é inserido no sistema por meio de um capilar (à esquerda). A diferença de potencial entre o capilar e o cone leva à formação de gotículas carregadas que sofrem evaporação. Adaptado de Gates et al., 2006. ...46
Figura 9. Esquema simplificado do analisador do tipo quadrupolo (adaptado de Gates, 2007)...47
Figura 10. Esquema de um analisador Ion trap (adpatado de Gates, 2007). ...49
Figura 11. Esquema de um analisador TOF (adaptado de Gates, 2007). ...51
Figura 12. Esquema simplificado de um analisador FT-ICR. ...52
Figura 13. Organismos escolhidos para os estudos das MAAs: Gracilaria tenuistipitata, Gracilaria domingensis (foto: Eliane Marinho-Soriano), Gracilaria birdiae (foto: Eliane Marinho-Soriano) e o dinoflagelado Prorocentrum minimum.....56
Figura 14. A) Espectro da radiação solar simulada e B) detalhe do espectro entre 250 e 400 nm. ...63
Figura 15. Passos gerais utilizados na extração das MAAs. ...64
Figura 16. Protocolo de extração das MAAs presentes em Gracilaria tenuistipitata. 66 Figura 17. Reação de DPPH com uma molécula antioxidante doadora de próton (LH). ...77
Figura 18. Medidas da fluorescência da clorofila utilizando o método do pulso de saturação. Detalhes das equações estão mostrados no texto. Extraído de Mohovic, 2005. ...84
espectros de absorção no UV das frações coletadas. TR (min) / λmax (nm): F1: 3,7 /
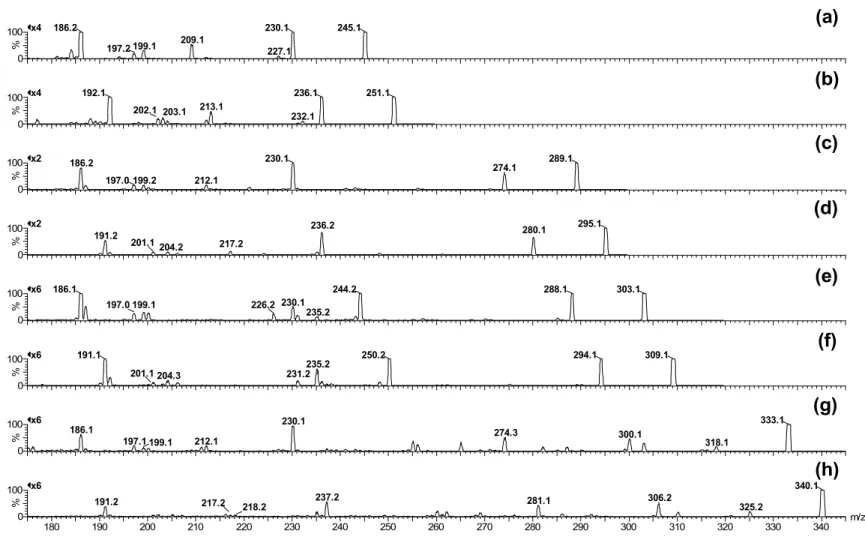
320; F2: 4,2 / 330; F3: 6,9 / 334; F4: 9,6 / 332; F5: 17,0 / 360. ...91 Figura 21. Análise da fração F1 por LC-UV-MS. A) Cromatograma com detecção no UV; B) Cromatograma obtido pela somatória dos íons totais (TIC); C) Espectro de massas para o pico com tempo de retenção igual a 4,4 min e D) Espectro de massa para o pico com tempo de retenção igual a 3,8 min. Energia de colisão: 20 eV. ...93 Figura 22. ESI-MS2 das MAAs (a) palitina, (b) palitina deuterada, (c) asterina, (d) asterina deuterada, (e) palitinol, (f) palitinol deuterado, (g) chinorina e (h) chinorina deuterada. A abundância relativa foi de 3 x 107 a 3 x 108. Energia de colisão: 20eV.
...94 Figura 23. Mecanismo proposto de fragmentação para as MAAs identificadas como palitina, chinorina, asterina e palitinol. A-M: principais íons produtos para as moléculas não marcadas (quando X=H) e para as moléculas marcadas (quando X=D). Y= H ou D dependendo da fragmentação inicial (ver detalhes no texto). ...97 Figura 24. A) espectro MS2 da fração F5 não deuterada e B) espectro MS2 do análogo deuterado. ...100 Figura 25. Mecanismo proposto de fragmentação para a fração F5 identificada como paliteno e/ou usujireno (PM = 284,3 g.mol-1). A) Molécula não deuterada com m/z
285 e B) molécula deuterada com m/z 290. ...101 Figura 26. Espectros de MS2 da nova MAA isolada de corais A) composto não deuterado e B) análogo deuterado...104 Figura 27. Estrutura provável da nova MAA identicada como palitina-treonina. ...104 Figura 28. Perfil cromatográfico das frações coletadas por Sephadex LH-20 contendo MAAs. A) frações 30-35; B) 36-39, pico 5 (TR=17min); C) 40-45, pico 5 (TR=17 min); D) 46-47, pico 2 (TR=4,2 min), pico 3 (TR=6,9 min), pico 4 (TR=9,6 min); E) 48-50, pico 1 (TR=3,7 min), pico 2 (TR=4,2 min), pico 3 (TR=6,9 min); F) 51-54, igual fração E; G) 55-62, pico 1 (TR=3,7 min), pico 2 (TR=4,2 min); H) 63-65; e I)
66-76 igual fração G; J) 77-85...106 Figura 29. Espectros MS2 e MS3 de alta resolução obtidos para o palitinol em FT-ICR-MSn. A) Espectro MS2 de m/z 303; B) espectro MS3 de m/z 288 proveniente de (A); C) espectro MS3 de m/z 244 proveniente de (A); D) espectro MS3 de m/z 230 proveniente de (A); e E) espectro MS3 de m/z 186 proveniente de (A). ...107 Figura 30. Mecanismo de fragmentação proposto para três MAAs analisadas por alta resolução mostrando a quebra homolítica que gera a perda inicial do radical metil. A ordem da rota A pode mudar dependendo da energia utilizada...108 Figura 31. A: Perfil cromatográfico das MAAs presentes no extrato GT-1 monitorado em 330 nm e espectros no UV. TR (min) / m/z [M+H]+ – pico 1 – chinorina: 6,9 / 333;
pico 2 –: palitina: 7,8 / 245; pico 3 – asterina: 8,8 / 289; pico4 – porphyra-334: 9,2 /
347; pico 5 – palitinol: 11,4 / 303; pico 6 – paliteno e/ou usujireno: 25,9 / 285. B:
Detalhe da separação entre 6 e 13 min. ...110 Figura 32. Perfil cromatográfico em 330 nm dos extratos de G. tenuistipitata, G.
domingensis, G. birdiae, P. minimum e da matéria-prima Helioguard 365® e
espectros de absorção no UV. TR (min): pico 1: 8,1; pico 2: 9,3; pico 3: 10,6; pico 4: 10,9; pico 5: 12,1; pico 6: 14,1; pico 7: 15,0; pico 8: 17,5; pico 9: 19,7; pico 10: 21,1; pico 11: 24,4; pico 12: 24,5; pico 13: 25,6. O espectro no UV do pico 10 (não identificado) não foi apresentado (λmax= 325 nm). ...115
Figura 33. Espectros MS2 obtidos das análises por LC-MS de P. minimum. A: m/z
333 (TR= 8,2 min); B: m/z 245 (TR= 9,4 min); C: m/z 347 (TR= 11,1 min) e D: m/z
Figura 34. Espectros MS2 obtidos das análises por LC-MS de P. minimum. A: m/z
246 (TR= 12,5 min); B: m/z 329 (TR= 15,2 min); C: m/z 347 (TR= 17,8 min), D: m/z
303 (TR= 21,7 min) e E: m/z 299 (TR= 25,9 min) presentes em P. minimum. Os losangos azuis indicam a molécula protonada. ...117 Figura 35. Perfil cromatográfico do extrato obtido a partir do produto Helioguard 365 e espectros no UV. TR (min): pico 1- chinorina: 5,8; pico 2 - palitina: 6,0 e pico 3 –
porphyra-334: 13,1. Detalhes das condições experimentais ver itens 3.4.1 e 3.5 ( 120 Figura 36. Espectros de MS2 por nanospray no modo negativo em analisador Q-TOF das MAAs A) chinorina (m/z 333) e B) Porphyra-334 (m/z 245)...121 Figura 37. Mecanismo de fragmentação proposto para a MAAs di-ácidas chinorina (m/z 332) e porphyra-334 (m/z 346). ...123 Figura 38. Estruturas analisadas por RMN 1H. R=H, chinorina e R=CH3,
porphyra-334. ...124 Figura 39. Variação diária das MAAs presentes em G. tenuistipitata. Os retângulos superiores em branco e preto indicam os períodos de claro e escuro, respectivamente. Os experimentos foram feitos em triplicatas e as barras indicam os desvios padrões. Os asteriscos indicam diferenças signficativas entre as últimas horas de claro e as primeiras de escuro (ANOVA p<0,01)...125 Figura 40. Perfil de absorção no UV das amostras GD-1, GD-2 e Helioguard 365. ...127 Figura 41. Dados de porcentagem de inibição da formação do radical DPPH A) pelos extratos contendo MAAs de G. tenuistipitata, G.domingensis e Helioguard 365® e B) pelos flavonóides rutina e a mistura quercetina e isoquercetrina. ...129 Figura 42. Espectros de absorção no UV do extrato GD-1 de G.domingensis em soluções de diferentes pHs a temperatura ambiente. ...131 Figura 43. Monitoramento da absorção no UV em 327 nm ao longo do tempo e em diferentes temperaturas do extrato aquoso de G. domingensis. ...133 Figura 44. Espectros de absorção no UV do extrato aquoso (pH= 6,8) de
G.domingensis. A: 20 °C e B: 70 °C. ...135 Figura 45. A) Citoxicidade do extrato GD-1 em função da concentração e B) Fotoxicidade. ...137 Figura 46. Espectros de absorção no UV do extrato GD-1, Helioguard 365 e dos filtros sintéticos MCX e ASB obtidas em espectrofotômetro com monitoramento entre 200-400 nm. As soluções do extrato GD-1 e do Helioguard 365 foram diluídas 10x, enquanto que dos filtros sintéticos MCX e ASB 1000x. ...140 Figura 47. Medidas do rendimento efetivo do PSII em Prorocentum minimum isolada de duas regiões diferentes e expostas às radiações PAR e PAR+UVR. Os retângulos superiores em branco e preto mostram os períodos de 12h claro: 12h escuro. * Diferença signficativa entre os controles e tratados (ANOVA p< 0,01). ...142 Figura 48. Medidas de fluorescência do DCF em culturas de Prorocentum minimum
(Liss) e P. minimum (Katt) após exposição às radiações PAR e PAR+UVR durante 72 h. Os retângulos superiores em branco e preto mostram os períodos de 12h claro: 12h escuro. * Diferença signficativa entre os controles e tratados (ANOVA p< 0,01). ...142 Figura 49. Espectros de absorção no VIS-UV das espécies expostas a PAR+UVR. A) Prorocentrum minimum isolado de Lisboa e B) P. minimum isolada de Kattegat.
...144 Figura 50. Perfil cromatográfico em λ igual a 330 nm das MAAs presentes em P.
minimum (Liss) após 48 h de experimento no tratamento com PAR+UVR. TR (min):
pico 8: 16,4...145 Figura 51. Espectros de absorção no UV dos picos obtidos por separação em HPLC.
λmax (nm): A) pico 1: 332, pico 3: 310, pico 5: 337, pico 6: 333 e B) pico 2:334, pico 4:
LISTA DE TABELAS
Tabela 1. Distribuição de MAAs* em algumas cianobactérias, microalgas e macroalgas...31 Tabela 2 – Diferentes métodos de ionização para análises por espectrometria de massas. ...45 Tabela 3 – Comprimento de onda máximo (λmax), coeficiente de extinção molar
(ε),massa molecular (MM) e principais fragmentos obtidos por ESI-MS2 de diferentes MAAs...53 Tabela 4 – Protocolos testados para a extração das MAAs. ...65 Tabela 5 – Métodos testados por HPLC para as análises das MAAs. Detalhes das colunas encontram-se descritos acima. ...72 Tabela 6 – Porcentagens relativas dos diferentes protocolos de extração para G. tenuistipitata. ...89 Tabela 7 – Rendimentos das diversas etapas de isolamento das MAAs em Gracilaria tenuitipitata....91 Tabela 8 – Íons precursores e principais íons produtos das frações F1 a F3 isoladas de G. tenuistipitata. As razões m/z correspondem às MAAs não deuteradas e m/z
D2O aos análogos deuterados. Detalhes de cada produto íon (A-M) serão discutidos
adiante...95 Tabela 9 – Dados de alta resolução para as moléculas não marcadas obtidos em Q-TOF. Condições experimentais estão descritas no item 3.6. ...102 Tabela 10 – Dados de alta resolução de MS2 e MS3 da fragmentação do palitinol obtido por ESI-FTICR-MSn. As fórmulas moleculares, massas teóricas e massas experimentais foram listadas para os íons produtos majoritários...109 Tabela 11 – Íon precursor e principais fragmentos das MAAs identificadas em G. tenuistipitata utilizando três espectrômetros diferentes. ...111 Tabela 12 – Identificação dos picos separados pelo método D (Tabela 5), valores calculados de resolução (Rs) entre dois picos adjacentes e de concentração (ng.mg extrato-1). ...112 Tabela 13 - MAAs identificadas pelo método E, Tabela 5 em espectrômetro com analisador Ion trap nas diferentes algas estudadas:. Gt: G. tenuistipitata, Gd: G. domingensis, Gb: G. birdiae, Pu: Porphyra umbilicalis e Pm: Prorocentrum minimum
LISTA DE ABREVIATURAS E SIGLAS
ABAP: 2,2’-azobis (2-amidinopropano) ACN: acetonitrila
ANOVA: análise de variância CFCs: clorofluorcarbonos CHCl3: clorofórmio
CID: dissociação induzida por colisão (collision-induced dissociation)
COLIPA: The European Cosmetic Toiletry and Perfumary Association
D2O: água deuterada
Da: daltons
DAD: detector de arranjo de diodos
DAHP: 3-deoxi-arabino-heptulosonato-7-fosfato DC: corrente direta
DCF: diclorofluoresceína
DCFA: 2,7,-diclorodihidrofluoresceína diacetato DCFH: 2,7-diclorodihidrofluoresceína
DCFH-DA: 2,7-diclorodihidrofluoresceína diacetato 3-DHQ: 3-dehidroquinato
DME: dose mínima de eritema
DMEM: Dulbecco´s Modified Eagles Medium
DNA: ácido desoribunucléico DPPH: 1,1-difenil-2-picril-hidrazil
λmax : comprimento de onda máximo
ε: coeficiente de extinção molar EtOH: etanol
EPCP: 5-enolpiruvilchiquimato-3-fosfato. EROs: espécies reativas de oxigênio ESI : ionização por electrospray
F: fluorescência mínima da clorofila-a medidas em amostras iluminadas
Fm: fluorescência máxima da clorofila-a em amostras adaptadas no escuro após a incidência de um pulso saturante de luz branca
Fm’: fluorescência máxima da clorofila-a obtida após a incidência de um pulso saturante de luz branca em amostras iluminadas
Fo: fluorescência mínima da clorofila-a em amostras adaptadas no escuro FDA: Food and Drugs Administration
FEP: fosfoenol piruvato
FPS: Fator de proteção Solar
FT-ICR: ressonância ciclotrônica de íons (Fourier Transform/Ion Cyclotron Resonance)
h: hora
HPLC: cromatografia líquida de alta eficiência (High performance liquid chromatography)
LC-MS: cromatografia líquida acoplada a espectrometria de massas
m/z: razão massa-carga M: mol.L-1
MAAs: Aminoácidos tipo micosporinas (mycosporine-like amino acids) MALDI: Ionização e dessorção por laser assistida por matriz
MHz: megahertz min: minuto
MM: massa molecular
MRM: monitoramento de reações múltiplas MS2: tandem MS
nanoESI: ionização por nanospray
PAM: fluorescência de pulso de amplitude modulada PAR: radiação fotossinteticamente ativa
PF: peso fresco
pH: potencial hidrogeniônico PIF: Fator de Foto-Irritação ppm: partes por milhão PS II: fotossistema II Q: quadrupolo
Q1: primeiro quadrupolo q2: câmara de colisão Q3: terceiro quadrupolo QA: plastoquinona A
QP: extinção fotoquímica da fluorescência da clorofila
qN: extinção não-fotoquímica da fluorescência da clorofila
Q-TOF: analisador quadruplo-tempo de vôo
ΦPSII: rendimento quântico efetivo do PS II
ΦP0: máximo rendimento quântico fotoquímico do PS II
RF: radiofreqüência
RMN 1H: ressonância nuclear magnética de próton RNA: ácido ribonucléico
rpm: rotações por minuto SDS: dodecil sulfato de sódio TFA: ácido trifluoracético
TIC:Cromatograma dos íons totais TMS: tetrametilsilano
TOF: tempo de vôo TR: tempo de retenção
u.m.a: unidade de massa atômica UV: ultravioleta
SUMÁRIO
RESUMO...7
ABSTRACT...9
SUMÁRIO ...18
1. INTRODUÇÃO ...21
1.1. A radiação ultravioleta e seus efeitos em organismos aquáticos ...22
1.2. Aminoácidos tipo micosporinas (MAAs)...24
1.2.1. Contexto histórico ...24
1.2.2. Estrutura e propriedades ...26
1.2.3. Ocorrência e Distribuição ...28
1.2.4. Modulação da Biossíntese...32
1.2.5. Funções ...37
1.2.6. Aplicação comercial...38
1.2.7. Métodos de análises de MAAs ...41
1.2.7.1. Cromatografia líquida de alta eficiência (HPLC)...41
1.2.7.2. Espectrometria de massas ...43
1.3. Algas versus estresse ambiental ...54
2. OBJETIVOS...57
3. MATERIAIS E MÉTODOS ...59
3.1. Reagentes e materiais...60
3.2. Cultivo e coleta das micro e macroalgas ...61
3.3. Condições experimentais ...62
3.3.1. Gracilaria tenuistipitata...62
3.3.2. Prorocentrum minimum...62
3.4. Extração das MAAs ...64
3.4.1. Gracilaria tenuistipitata...64
3.4.2. Gracilaria domingensis e Gracilaria birdiae...67
3.4.3. Prorocentrum minimum...69
3.4.5. Experimentos de variação diária das MAAs em G. tenuistipitata...70
3.5. Análises das MAAs por HPLC ...70
3.5.1. Gracilarias...70
3.5.2. Prorocentrum minimum...72
3.6. Análises das MAAs por espectrometria de massas...73
3.7. Ensaios in vitro...76
3.7.1. Testes antioxidantes...76
3.7.2. Ensaios de citotoxicidade e fototoxicidade ...78
3.7.3. Testes de estabilidade ...80
3.7.4. Fator de Proteção Solar (FPS) ...80
3.8. Medidas de fotossíntese...81
3.9. Medidas in vivo de EROs...85
3.10. Análises estatísticas ...86
4. RESULTADOS E DISCUSSÃO ...87
4.1. Extração e Análises das MAAs ...88
4.1.1. Gracilaria tenuistipitata...88
4.1.1.1. Experimentos em Triplo Quadrupolo ...92
4.1.1.2. Experimentos em FT-ICR...105
4.1.1.3. Experimentos em Ion Trap ...110
4.1.2. Gracilaria domingensis, Gracilaria birdiae e Prorocentrum minimum.113 4.2. Isolamento de chinorina e porphyra-334...120
4.3. Variação diária das MAAs presentes em G. tenuistipitata...125
4.4. Ensaios in vitro...127
4.4.1. Estimativa da concentração total das MAAs de G. domingensis...127
4.4.3. Testes de estabilidade ...130
4.4.4. Ensaios de citotoxicidade e fototoxicidade ...135
4.4.5. Fator de proteção solar...137
4.5. Experimentos de exposição à UVR de Prorocentrum minimum...141
4.5.1. Medidas de fotossíntese ...141
4.5.4. Análises das MAAs...143
5. CONSIDERAÇÕES FINAIS ...152
6. REFERÊNCIAS BIBLIOGRÁFICAS ...157
1.1. A radiação ultravioleta e seus efeitos em organismos aquáticos
A radiação solar que chega à superfície terrestre é constituída de radiações do tipo infravermelho (>800 nm), visível (radiação fotossinteticamente ativa, PAR, 400-750 nm), ultravioleta A (UVA, 320-400 nm) e ultravioleta B (UVB, 280-320 nm). A radiação ultravioleta C (UVC, 200-280 nm) é a mais energética entre as radiações ultravioleta (UVRs) emitidas pelo sol, porém é completamente absorvida pelo ozônio e o oxigênio, não atingindo a superfície terrestre (Figura 1). A UVR representa cerca de 6% da energia solar total que chega à superfície terrestre, sendo que aproximadamente 90% correspondem a UVA e o restante a UVB (Neale, 2005).
Figura 1. Espectro da radiação ultravioleta.
Os ambientes terrestre e marinho sempre estiveram sujeitos às radiações UV. Entretanto, a diminuição da camada de ozônio por origem antropogênica, pela emissão de poluentes atmosféricos como clorofluorcarbonos (CFCs), organo-clorados e organo-bromados, trouxe como conseqüência um aumento no fluxo das UVRs para a superfície da Terra (Kerr & McElroy, 1993; Lubin & Jensen 1995, Tabazadeh et al., 2000). Este aumento é extremamente maléfico para os organismos, em especial os fotossintetizantes. Danos em biomoléculas como ácidos
Radiação ultravioleta Raios X
UVC UVB UVA
100 150 200 250 300 350 400 Comprimentode
onda (nm) Luz
visível
Absorção de ozônio
Produz
ozônio Germicida Eritema
Radiação ultravioleta Raios X
UVC UVB UVA
100 150 200 250 300 350 400 Comprimentode
onda (nm) Luz
visível
Absorção de ozônio
Produz
nucléicos, lipídios e proteínas, alterações na mobilidade e na pigmentação celular, inibições da fotossíntese e de crescimento são alguns exemplos dos efeitos deste excesso de UVR que podem levar o organismo à morte (Franklin & Forster, 1997). Estes danos celulares podem ocorrer por reações fotoquímicas (efeitos diretos) ou via fotodinâmica (efeitos indiretos) pela formação de espécies reativas de oxigênio (EROs) (Vincent & Neali, 2005).
Como efeitos diretos das UVRs, moléculas que absorvem nesta região do espectro, como proteínas e ácidos nucléicos, são fotoquimicamente transformadas ou degradadas, resultando numa perda parcial ou mesmo total de suas funções biológicas. Assim, danos em RNA e DNA (e.g., dímeros de timina) podem ser observados pela grande sensibilidade destas biomoléculas à exposição ao UV (Vincent & Neali, 2005).
Nos efeitos indiretos, as UVRs podem ser absorvidas por componentes celulares dentro e fora da célula, produzindo assim as EROs tais como, oxigênio singlete (1O2), ânion superóxido (O2•-), radical hidroxila (•OH) e peróxido de
hidrogênio (H2O2). Estas espécies reativas podem também ser resultantes da
incompleta transferência de elétrons para o oxigênio (e.g., cadeia de transporte de elétrons) ou de reações de auto-oxidação que ocorrem normalmente na célula (Cadenas, 1989).
Os efeitos da radiação solar no ambiente aquático vêm sendo bastante estudados nos últimos anos (Hader & Worrest, 1997; Dunlap & Shick, 1998, Rozema
et al., 2002). Os diversos danos causados pela exposição excessiva ao UV, por
mecanismos diretos ou indiretos, podem levar a uma diminuição da biomassa fotossintetizante que pode ser refletida em toda cadeia trófica. Isto poderia resultar numa diminuição da biodiversidade aquática, na captação de dióxido de carbono da atmosfera (Takahashi et al., 1997) e nos produtos de consumo para o homem (Hader & Worrest, 1997; Hader et al., 1998), trazendo como conseqüência um desequilíbrio na composição e integridade do ecossistema (Rezanka et al., 2004).
Os organismos aquáticos desenvolveram diversas estratégias adaptativas para atenuar os efeitos maléficos das UVRs tais como movimentação vertical na coluna de água (Smith et al., 1992), reparo no DNA por fotoreativação e excisão (Britt, 1995) e acúmulo de antioxidantes (hidrossolúveis, lipossolúveis e sistema enzimático) (Dunlap & Yamamoto, 1995). Além destas estratégias, outro importante mecanismo de defesa desenvolvido por cianobactérias, micro e macroalgas é a síntese e o acúmulo de compostos que absorvem a radiação ultravioleta, conhecidos como “aminoácidos tipo micosporinas” (mycosporine-like amino acids, MAAs) (Shick & Dunlap, 2002, Carreto et al., 2007).
1.2. Aminoácidos tipo micosporinas (MAAs)
1.2.1. Contexto histórico
ano mais tarde, Tsujino observou em algas vermelhas (rodófitas) compostos com a mesma característica de forte absorção no UV (Tsujino, 1961). Já em 1969, Shibata observou que diversos extratos aquosos de corais e cianobactérias obtidos na Grande Barreira de Corais, na Austrália, possuíam forte absorção no UV (Shibata, 1969). Estas substâncias, denominadas S-320, mostraram uma banda larga de absorção com comprimento de onda máximo de absorção (λmax) entre 315-323 nm,
sugerindo que S-320 era um grupo de compostos similares e não uma substância pura. A primeira evidência do papel fotoprotetor de S-320 foi descoberta por Maragos em 1972, e mostrava que em colônias do coral Porites lobata a concentração de S-320 variava inversamente em relação à profundidade, provavelmente compensando os diferentes níveis de UV do ambiente (Shick & Dunlap, 2002). Uma década depois, foi demonstrado experimentalmente que S-320 diminuía em tecidos dos corais da espécie Pocillopora damicornis sem exposição ao UV por longo tempo, evidenciando que S-320 era produzido em resposta à exposição a UVR (Jokiel & York, 1982).
Em 1977, químicos de Nagoya, Japão, pesquisando a toxina palitoxina no coral Palythoa tuberculosa, observaram um composto solúvel em água com λmax em
310 nm (Ito & Hirata, 1977). Este metabólito possuía a estrutura-base idêntica à família de metabólitos primeiramente descritos em fungos terrestres (chamados de micosporinas) e foi identificado como micosporina-glicina. Após esta descoberta, Hirata e colaboradores isolaram diversos derivados iminos de micosporinas (iminomicosporinas), que foram então denominados de “aminoácidos tipo micosporinas” (MAAs), incluindo palitina, palitinol e paliteno isolados do coral
Palythoa tuberculosa (Hirata et al., 1979); asterina isolada da estrela-do-mar
isolados respectivamente das algas vermelhas Porphyra tenera, Chondrus yendoi e
Palmaria palmata (Takano et al., 1979; Tsujino et al., 1980; Sekikawa et al., 1980).
Desde então muitos outros compostos similares e com características de absorção no UV foram identificados em diferentes organismos aquáticos e genericamente classificados como MAAs (Carreto et al., 2007, Karentz, 2001).
1.2.2. Estrutura e propriedades
As MAAs, com duas exceções (micosporina-glicina e micosporina-taurina), são iminomicosporinas, caracterizados por um anel aminociclohexenimina ligado a um aminoácido, um aminoálcool ou grupo amino (Bandaranayake, 1998). São altamente polares, de baixo peso molecular (< 400 g.mol-1) e apresentam absorção máxima entre 310 e 360 nm com alto coeficiente de extinção molar (ε= 28100-50000 M-1 cm-1). As diferenças apresentadas nos espectros de absorção referem-se aos diferentes grupos no C1, além de diferentes substituintes no átomo de nitrogênio (Figura 2).
O OH HO HO O HO O OH HO HO O O NH HO HO O
SO3
-gadusol 4-deoxigadusol micosporina taurina HO HO O N N HO HO
CO2 -O CO2
--O 2C + N NH HO HO
CO2 -O CO2
-+ - valina
NH
CO2
-N
N HO HO
CO2 -O CO2
-+ micosporina glicina-ácido glutâmico micosporina glicina micosporina 2-glicina NH HO HO O + NH CO2
-HO
micosporina glicina-valina
+ valina
+ ácido glutâmico
- ácido glutâmico + taurina - taurina O + glicina - glicina chinorina HO HO O + NH CO2
-HO
CO2
-NH
CO2
-porphyra-334 HO HO O + NH CO2
-HO NH micosporina metilamino-treonina HO HO O + NH CO2
-NH NH HO HO O + NH CO2
-HO micosporina metilamino-serina NH HO HO O + NH HO palitinol
CO2
-HO HO
O + NH CO2
-NH
CO2
-ácido palitênico Z/E
HO HO
O + NH CO2
-NH2 HO -O 3SO O + NH CO2
-NH2 HO HO O + NH CO2
-HO HO -O 3SO O + NH CO2
-HO NH2 palitina treonina-sulfato HO HO O + NH NH
CO2
-usujireno (isômero cis) paliteno (isômero trans)
NH HO HO O + NH HO asterina-330
CO2
-NH2 NH2 HO HO O + NH HO palitina serina NH2 HO -O 3SO O + NH CO2
-HO
palitina serina-sulfato
palitina
+ HOSO3- + HOSO3- + HOSO3
-+ glicina - glicina
+ tre
on ina
- treo
nina
+ se rina
- ser ina
- H2O
+ H2
- CO2 - CO2 - CO2
- CO2
- CH3
- CH3 - CH3 - CH3
+ H2O (H+)
CH O -- NH3
+ NH3
1 2 3 4 5 6
Nas MAAs geralmente uma subunidade de glicina está presente no C3 do anel (Figura 2), embora em alguns corais a glicina possa ser substituída por metilamina (e.g., micosporina metilamino-serina) (Teai et al., 1997). Algumas MAAs podem ainda conter ésteres sulfatados (e.g., palitina serina-sulfato, Figura 2) (Wu Won et al., 1997), ligações covalentes com oligossacarídeos (Bohm et al., 1995) e até mesmo ligações entre elas (Carreto et al., 2001). Recentemente, uma nova MAA, euhalothece-362, contendo o aminoácido alanina, foi isolada da cianobactéria
Euhalothece sp. (Volkmann et al, 2006). Até hoje, aproximadamente 20 MAAs foram caracterizadas, mas este número vem crescendo nos últimos anos em conseqüência do aumento no número das espécies estudadas e do desenvolvimento de técnicas de análises mais eficientes e sensíveis (Carreto et al., 2006, Whitehead & Hedges, 2002, 2003).
1.2.3. Ocorrência e Distribuição
Apesar de as MAAs estarem presentes numa variedade enorme de organismos aquáticos, apenas bactérias, fungos e algas possuem a capacidade de sintetizar estas substâncias, uma vez que a via pela qual elas são sintetizadas (via do ácido chiquímico) está ausente em animais. Os demais organismos aquáticos adquirem estes compostos por meio de simbioses (como é o caso de corais e
zooxanthelae), dieta ou associações com bactérias (Shick et al., 1992; Carrol & Shick, 1996).
al., 1991), invertebrados (Carroll & Shick, 1996) e vertebrados (Dunlap et al., 1989) Em bactérias do gênero Micrococcus sp. foi identificada a MAA chinorina (Arai et al., 1992), mas sabe-se que diversas espécies do gênero Pseudoalteromonas e Vibrio
são capazes de converter as MAAs chinorina e porphyra-334 em micoporina-glicina e no intermediário 4-deoxigadusol, como apresentado na Figura 3 (Dunlap & Shick, 1998, Dunlap et al., 1998a).
Figura 3. Conversão por bactérias de chinorina em micosporina-glicina (moderado antioxidante) e deoxigadusol (forte antioxidante) por bactérias (Dunlap & Shick, 1998).
Na maioria das cianobactérias, as MAAs estão distribuídas de forma homogênea no citoplasma, sem associação à parede celular ou às membranas fotossintéticas (Garcia-Pinchel & Castenholz, 1993). Já nas microalgas, supõe-se que estes compostos encontrem-se ao redor de organelas sensíveis a UVR, aumentando a eficácia destas estruturas (Neale et al., 1998), embora outros fatores, como forma e distribuição destas organelas no citoplasma, também estejam envolvidos na proteção contra UV. Laurion e colaboradores mostraram que a maneira como as MAAs estão distribuídas em dois dinoflagelados aumenta a proteção de organelas específicas contra a radiação UV (Laurion et al., 2004).
Altos conteúdos de MAAs são encontrados em microalgas da divisão Cryptophyta, Dinophyta, Prymnesiophyta e Raphidophyta. Entretanto, espécies das divisões Bacillariophyta, Chlorophyta, Cyanophyta e Euglenophyta possuem baixos
Vibrio harveyi
95%
Vibrio sp N
NH
CO2H
HO HO
CO2H
O
O
NH
CO2H
HO
O
O
OH HO
O
Chinorina Micosporina
glicina
Pseudoalteromonas haloplanktis ou P. atlantica
Deoxigadusol (antioxidante)
HO HO
conteúdos de MAAs (Jeffrey et al., 1999). Em macroalgas, a divisão Rhodophyta é a mais rica nestes compostos (Karentz, 2001; Karsten et al., 1998a, 1998b). Nas espécies da divisão Rhodophyta são encontradas diversas MAAs em altas concentrações, diferentemente das dos gêneros Phaeophyta (algas pardas) e Chlorophyta (algas verdes), que provavelmente dependem de outros compostos absorvedores, como phlorotannins em algas pardas (Pavia et al., 1997). Fatores como posição geográfica e condições do ambiente influenciam na concentração e diversidade de MAAs em micro e macroalgas. Por esse motivo, em espécies tropicais estes compostos ocorrem em maiores concentrações, provavelmente pela exposição destes organismos a maiores quantidades de UVR (Shick & Dunlap, 2002).
Exemplos de MAAs identificadas em algumas cianobactérias, microalgas e macroalgas são apresentados na Tabela 1 (Groniger et al., 2000). A identificação de MAAs em diferentes organismos aquáticos encontra-se descrita na literatura (Sinha
Tabela 1. Distribuição de MAAs* em algumas cianobactérias, microalgas e macroalgas.
Espécies Coleta MG PT AS PL PR CH PE
Cianobactérias
Gloeocapsa sp. EUA + +
Nostoc commune China +
Microalgas
Lingulodinium polyedrum Cultura + + + +
Prorocentrum micans Portugal + +
Thalassiosira sp. Antártida + +
Macroalgas
Ulva lactuca Alemanha +
Sargassum oligocystum China + + +
Gracilaria changii China + + + + + +
*MAAs: MG-Micosporina-glicina; PT-palitina; AS-asterina; PL-palitinol; PR-porphyra-334; CH-chinorina; PE-paliteno.
Invertebrados vivendo em simbiose com microalgas (cianobactérias, dinoflagelados principalmente Symbiodinium spp.) possuem MAAs em diferentes concentrações, dependendo da profundidade do ambiente onde estes organismos se encontram (Dunlap & Shick, 1998; Shick et al., 1996). As microalgas simbiontes transferem as MAAs para os organismos em simbiose dada a incapacidade da síntese destes compostos por estes organismos. Em alguns recifes de corais que contêm de duas a dez espécies diferentes de microalgas, pelo menos 13 MAAs foram identificadas (Shick et al., 1999; Gleason & Wellington, 1995). As MAAs são geralmente mais concentradas nos tecidos do hospedeiro do que no simbionte isolado deles, provavelmente mostrando uma resposta adaptativa na proteção do tecido mais exposto a UVR (Ishikura et al., 1997; Shick et al., 1995).
discutidas as funções de agente filtrante de radiações de alta energia (como UV) e de amplificadores de contraste óptico no ambiente aquático. Como já foi mencionado, estes animais adquirem as MAAs por meio da dieta, possuindo a capacidade de concentrá-las nos diferentes tecidos (Dunlap & Shick, 2002).
As MAAs não são encontradas em plantas superiores, nas quais a proteção contra UVR é feita pelos flavonóides (Rozema et al., 1997; Pietta, 2000), nem em vertebrados superiores, nos quais a função protetora é assumida pela melanina.
1.2.4. Biossíntese
Embora diversos passos ainda precisem ser elucidados na biossíntese das MAAs, a hipótese de que estas substâncias são sintetizadas pela via do ácido chiquímico foi mostrada por Favre-Bonvin e colaboradores (Favre-Bovin et al., 1987). Os autores mostraram que o intermediário da via do ácido chiquímico, o 3-dehidroquinato (3-DHQ), é o precursor do anel de seis carbonos comum em micosporinas de fungos. A síntese de micosporinas fungais provavelmente ocorre a partir do intermediário 3-DHQ, via gadusol ou deoxigadusol (Figura 4), sendo estes dois últimos compostos os possíveis precursores da micosporina-glicina (Shick & Dunlap, 2002; Bandaranayake, 1998).
N-fosfometilglicina inibe a ação destas duas enzimas, além de inibir o sexto passo da via por competição com fosfoenolpiruvato (FEP), que é um cofator para a enzima EPCP sintase (Bentley, 1990). Com a inibição destas três enzimas, demonstrou-se que a síntese ocorre via 3-DHQ, o que não seria comprovado se este inibidor bloqueasse apenas o penúltimo passo, o qual não impediria a acumulação das MAAs (Figura 4).
O OH OH HO OH O
H2O3PO
O OH
OH
H2O3PO
OH O OH OH HO OH O O OH OH O OH O OH OH OH OH O OH OH OPO3H2
OH O OH O HO O HO O O HO OH HO O OH OPO3H2
OH O O OH O OH OH O O OH NH O HO O HO OH O NH O HO N HO OH O R 1 DAHP + Fosfoenolpiruvato (FEP) Eritrose-4-fosfato
3 4 5
ATP ADP
3-Dehidroquinato 3-Dehidrochiquimato Chiquimato Chiquimato-3-fosfato
+FEP EPSP Corismato glicina Fenilalanina Tirosina Triptofano Folato Cofatores Isopropanóides Quinonas Ressonânia Tautômeros Micosporina-glicina Imino-MAAs
XNH2 H2O3PO
2
6
7
Deoxygadusol R
R = H , Deoxigadusol R = OH, Gadusol
Em outros experimentos, o uso de aminoácidos isotopicamente marcados (14C-glicina e 14C-serina) foi incorporado nas cadeias das MAAs micosporina-glicina e chinorina, demonstrando que estes aminoácidos livres são seus precursores (Portwich & Garcia-Pichel, 2003). Estes mesmos autores mostraram que micosporina-glicina é o precursor direto da MAA chinorina.
Embora as MAAs possam ser induzidas e acumuladas em uma variedade enorme de organismos aquáticos, tais processos não se aplicam para todas as espécies (Jeffrey et al., 1999; Hannach & Sigleo, 1998). Mesmo dentro de uma mesma espécie, diferenças nos conteúdos e até mesmo na variedade das MAAs dependem do lugar de origem e do estágio de vida do organismo (Jeffrey et al., 1999). Espécies da microalga marinha Phaeocystis pouchetii possuem MAAs apenas nos seus estágios coloniais do ciclo de vida e a concentração destes compostos parecem ser maiores nas espécies isoladas da Antártica quando comparada a regiões de zonas temperadas (Riegger & Robinson, 1997).
A biossíntese pode ser influenciada por condições de irradiação como tempo de exposição e intensidade da radiação. No dinoflagelado Alexandrium excavatum
observou-se uma mudança na composição das MAAs e um aumento no espectro de absorção no UV em questão de horas, quando este organismo foi transferido de uma condição de baixa intensidade de radiação fotossinteticamente ativa (PAR) para uma de alta (Carreto et al., 1990). No dinoflagelado Prorocentrum micans, as concentrações de MAAs foram muito maiores nas culturas que cresceram durante 21 dias sob radiação UV quando comparadas às culturas que cresceram sem exposição ao UV (Lesser, 1996a, 1996b). Experimentos in situ com a macroalga
não foi observada indução de MAAs por exposição à UV ou UV+PAR, ainda que as MAAs presentes nesta alga tenham se mostrado bastante estáveis às UVRs e altas temperaturas (Sinha et al., 2000).
A composição da radiação à qual estes organismos são expostos é um importante fator a considerar, que também varia de espécie para espécie. Em geral, luz azul é mais efetiva na indução de MAAs do que luz verde e vermelha, e radiações UVA e UVB aumentam fortemente o acúmulo destes compostos (Carreto
et al., 1990). A indução da biossíntese na microalga Phaeocystis antarctica ocorre predominantemente no UVB e em comprimentos curtos do UVA, enquanto diatomáceas respondem principalmente a comprimentos de onda mais longos do UVA e a PAR (Riegger & Robinson, 1997). No dinoflagelado marinho Gyrodinium
dorsum, a biossíntese ocorre sobre moderada irradiação induzida
predominantemente por UVB, sendo que tanto UVA como PAR mostraram poucos efeitos biossintéticos (Klisch & Hader, 2002).
Além da quantidade e qualidade da irradiação, outros fatores de estresse, como nutrientes, também podem estimular ou inibir a síntese destes compostos (Korbee et al., 2005). Korbee e colaboradores mostraram que a síntese de MAAs foi estimulada quando duas espécies de Porphyra foram cultivadas em meio enriquecido de amônia (Korbee et al., 2005). Por outro lado, uma baixa concentração de nitrogênio no meio diminuiu a síntese de MAAs em alguns dinoflagelados, indicando que os níveis de nitrogênio nas células influenciam a síntese destes compostos (Litchman et al., 2002).
horas, como no caso do dinoflagelado Alexandrium tamarense (Callone et al., 2006) enquanto para outras a resposta pode levar de dias a semanas (Karsten et al., 1999; Hoyer et al., 2002).
1.2.5. Funções
A função mais importante e estudada das MAAs é a fotoprotetora contra a UVR, análoga à exercida por flavonóides em plantas terrestres. Esta função pode ser atribuída a estes compostos por possuírem eficientes propriedades de absorção, tanto no UVA quanto no UVB, e freqüente observação que a exposição a UVR, no ambiente natural ou em condições experimentais, induz a síntese e acúmulo destes compostos (Bandanarayake, 1998; Shick & Dunlap, 2002; Rezanka et al., 2004).
Entretanto, somente nas últimas décadas evidências diretas do seu papel fotoprotetor foram comprovadas, uma vez que altas quantidades destes compostos presentes em dinoflagelados inibiram os efeitos da UVR na fotossíntese (Neale et. al, 1998; Lesser, 1996a, 1996b) e na motilidade destes organismos (Klisch et al., 2001).
A função protetora oferecida pelas MAAs não é necessariamente restrita aos organismos que as produzem. As MAAs presentes no fitoplâncton podem oferecer proteção a outros organismos, atenuando a radiação UV na coluna de água (Vernet & Whitehead, 1996). Isto pode ser mais efetivo ainda se houver uma liberação de MAAs no meio. Na literatura, foi demonstrado que em florações do dinoflagelado
Lingulodinium polyedrum houve liberação de MAAs no meio quando da exposição
ao UVB. Entretanto, não é claro se a detecção destes compostos na água foi por processos ativos na célula ou por lise das mesmas (Vernet & Whitehead, 1996).
fitoplâncton. Em florações de dinoflagelados do gênero Gyrodinium, um pigmento similar a citonemina foi relatado, embora não tenha sido caracterizado quimicamente (Llewellyn & Mantoura, 1997). Analogamente, um biopolímero de composição variada denominado esporopolemina, que também pode ter funções fotoprotetoras contra UV, foi isolado de algas verdes (Xiong et al., 1997).
Além da função fotoprotetora, sugere-se que as MAAs também possuem funções osmóticas, principalmente em cianobactérias que vivem em ambientes hipersalinos (Oren, 1997), regulatórias da reprodução (Bandaranayake & Rocher, 1999) e antioxidantes (Dunlap & Yamamoto, 1995). Dunlap & Yamamoto demonstraram que as micosporinas marinhas (glicina e micosporina-taurina, Figura 2) possuem moderada atividade antioxidante, podendo funcionar como antioxidantes biológicos em organismos marinhos (Dunlap & Yamamoto, 1995). O suposto intermediário da biossíntese, 4-deoxigadusol (Figura 2), possui atividade antioxidante comparada ao ascorbato, diferentemente das iminomicosporinas como chinorina, porphyra-334, palitina, asterina e palitinol, que não apresentaram atividade antioxidante (Dunlap & Yamamoto, 1995). Suh e colaboradores demonstraram que micosporina-glicina suprime 1O2 com alta
eficiência (Suh et al., 2003).
1.2.6. Aplicação comercial
Para um composto ser um eficiente filtro solar, são necessárias duas características básicas além da absorção na região do UV: (i) ter um alto coeficiente de extinção molar na faixa de absorção do UV e (ii) dissipar a energia absorvida com o mínimo impacto para os tecidos da epiderme e derme, impedindo a formação de EROs como 1O2 e O2•-, conforme apresentado na Figura 5 (Torres et al., 2006,
Dunlap et al., 1998b). Além disso, fatores econômicos (baixo custo), estéticos (inodoro, incolor) e antialergênicos são importantes para sua aceitação comercial.
Radical Superóxido
Peróxido de Hidrogênio
Radical Hidroxila
Radical Alquil Hidroperóxido Radical
Peroxila Oxigênio
Singlete
[Fotoprotetor] Fotoprotetor
Figura 5. Esquema simplificado da absorção de luz por um fotoprotetor mostrando vias de dissipação por calor (indicada por ∆) e pela formação de espécies reativas. SOD: superóxido dismutase; LH: lipídio poliinsaturado (modificado de Dunlap et al., 1998b).
algas, cnidários e organismos planctônicos, é altamente fotoestável em soluções aquosas e que o decaimento desta molécula irradiada ocorre majoritariamente por formas não radiativas, conforme demonstrado anteriormente para a chinorina e porphyra-334 (Conde et al., 2007).
Além de testes de fotoestabilização, ensaios verificando a estabilidade das MAAs em diferentes pHs e temperaturas foram descritos (Zhang et al., 2005). Soluções contendo porphyra-334 mostraram ser estáveis em diferentes pHs (entre 1 e 11) à temperatura ambiente. Em pHs mais alcalinos (13 e 14), a absorção monitorada em 334 nm diminuiu drasticamente nas primeiras 4 horas. Com o aumento da temperatura, a absorvância diminui rapidamente, principalmente a 80
°C. No entanto, mesmo a 60 °C, a absorvância das soluções de porphyra-334 diminuiu vagarosamente, demonstrando que estes compostos são estáveis a temperaturas inferiores a 60 °C (Zhang et al., 2005). De fato, Sinha e colaboradores mostraram que soluções de porphyra-334 e chinorina foram estáveis a temperaturas de até 75 °C por cerca de 6 horas (Sinha et al., 2000).
As propriedades de absorção de extratos metanólicos da alga
Aphanizomenon flos-aquae na região do UV em comparação a dois filtros solares
comerciais demonstraram que o extrato apresentou uma alta proteção na região do UVA e com valores significativos de proteção no UVB (FPS=4) (Torres et al., 2006).
não foram suficientemente estáveis para aplicações comerciais em fotoprotetores (Dunlap & Chalker, 1985). Entretanto, derivados de tetrahidropiridina (Figura 6) mostraram baixa reatividade quando comparados a diversos fotoprotetores comerciais (Dunlap et al.,1998b, 1998c). O produto chamado Helioguard 365, que contém MAAs isoladas da macroalga vermelha Porphyra umbilicalis, encontra-se disponível comercialmente.
O
NH R
N R3
O
R2 R1
N R3
O
R1
λmax=309-314 nm λmax=305-309 nm λmax=307-311 nm
3-alquilamino-2-metoxiciclohex-2-enonas derivados de tetrahidropiridina
Figura 6. Análogos sintéticos de MAAs para uso em fotoprotetores e respectivos comprimentos de onda máximos de absorção (λmax).
Investigações têm sido conduzidas para a produção comercial do 4-deoxigadusol utilizando a via de retro-síntese, com o objetivo do uso deste antioxidante natural em indústria cosmética e alimentícia (Dunlap et al., 1998a).
1.2.7. Métodos de análises de MAAs
1.2.7.1. Cromatografia líquida de alta eficiência (HPLC)
O método mais aplicado para a separação e isolamento das MAAs é a cromatografia líquida de alta eficiência (HPLC) com detecção no UV-Visível (Nakamura et al., 1982; Dunlap & Chalker, 1986; Shick et al., 1999; Carreto et al., 2005). A caracterização geralmente é feita comparando-se o perfil dos espectros de absorção no UV e o tempo de retenção (TR) com padrões autênticos ou com padrões de algas que contenham específicas MAAs.
isocraticamente com ácido acético 0,02% em água a 15 οC (Nakamura et al., 1982). Este método separa entre 7 e 9 MAAs, possuindo a desvantagem de não eluir as MAAs mais hidrofóbicas, como paliteno e usujireno, e não separar as mais hidrofílicas recentemente isoladas de corais (Shick et al., 1999).
Dunlap & Chalker introduziram o uso de coluna C8 eluída isocraticamente com ácido acético (0,1% em água) contendo 10% de metanol. Nesta condição, as MAAs menos ácidas (micosporina-glicina, palitina, asterina, palitinol e paliteno) são resolvidas cromatograficamente, enquanto as mais ácidas (chinorina e porphyra-334) coeluem (Dunlap & Chalker , 1986). Entretanto, com o isolamento e a caracterização das MAAs micosporina-2-glicina e micosporina-taurina (Stochaj et al., 1994) houve a adição de um outro problema: separar micosporina-2-glicina de porphyra-334 e micosporina-taurina de micosporina-glicina. Foi mostrado que concentrações acima de 75% de metanol na fase móvel separam as MAAs altamente polares, apesar de não separarem em uma mesma corrida as MAAs mais ácidas das menos ácidas (Stochaj et al., 1994). Este tipo de separação foi alcançada utilizando-se diferentes sistemas isocráticos para o grupo das mais ácidas e outro para as menos ácidas (Adams & Shick, 2001; Shick & Dunlap, 2002).
Este último método descrito ainda não permitia a separação entre micosporina-glicina e micosporina-taurina e entre os isômeros usujireno e paliteno numa mesma corrida. Wu Won e colaboradores utilizaram cromatografia de troca iônica em coluna amino e conseguiram separar glicina de micosporina-taurina, além de resolver algumas misturas de micosporinas sulfatadas (Wu Won et al., 1997).
única corrida (Carreto et al., 2001). Este método permite ainda a separação do crítico par de isômeros usujireno e paliteno, além de ter revelado novas MAAs de baixa polaridade. Por outro lado, não é possível separar algumas MAAs de alta polaridade como chinorina de micosporina-2-glicina e palitina-serina. Recentemente, um método em fase reversa (C18) e gradiente com ácido trifluoracético (TFA) e hidróxido de amônio resolveu cromatograficamente uma mistura contendo 20 MAAs. Este método emprega duas colunas C18 em série a 35 °C com gradiente utilizando TFA (0.2% em água), metanol e acetonitrila. Com este método é possível separar as MAAs mais polares (chinorina de micosporina-2-glicina e palitina-serina), as de média polaridade e as de baixa polaridade, como os isômeros usujireno e paliteno. O trabalho desenvolvido por este grupo possui a vantagem de separar uma mistura de 20 MAAs e atualmente é o único método por HPLC que consegue resolver tantos compostos numa única corrida (Carreto et al., 2005).
Um grande problema relacionado a este tipo de análise é que muitas MAAs possuem espectros e tempos de retenção semelhantes, além de a técnica não fornecer muitos dados estruturais, limitando a caracterização de novas MAAs. O acoplamento desta técnica a espectrometria de massas vem ganhando espaço nos últimos anos por ser uma ferramenta muito útil na identificação e caracterização destes compostos.
1.2.7.2. Espectrometria de massas
métodos de ionização, como eletrospray e MALDI, que permitiram a análise de substâncias não-voláteis e termossensíveis como proteínas. Estas descobertas renderam aos seus pesquisadores, Jonh Bennett Fenn e Koichi Tanaka o prêmio Nobel de 2002 em Química.
A espectrometria de massas é uma técnica analítica muito poderosa na caracterização estrutural de biomoléculas, sobretudo quando a quantidade de material obtido é escassa, uma vez que este tipo de análise apresenta maior sensibilidade que outros métodos de caracterização estrutural.
A análise por espectrometria de massas pode ser dividida em três principais estágios. As análises iniciam com a introdução da amostra (sólida, líquida ou gasosa), que pode ser feita diretamente (inserção direta) ou por meio de um sistema cromatográfico. Os analitos são convertidos a íons na fonte de ionização, por meio da perda ou do ganho de carga, da protonação ou desprotonação, da formação de adutos ou da ejeção de elétrons. Estes íons gerados são então separados de acordo com suas relações massa/carga (m/z) no analisador e suas intensidades relativas medidas no detector. Por último, a aquisição e o processamento dos dados geram os espectros de massas que são produzidos em função da intensidade de cada íon
versus sua razão m/z. Um esquema simplificado dos principais componentes de um espectrômetro de massas é apresentado na Figura 7.
Figura 7. Esquema simplificado dos componentes principais de um espectrômetro de massas que indicam os modos de introdução da amostra, ionização e analisadores utilizados neste trabalho.
Introdução da amostra
Fonte
de ionização Analisador Detector
Controle e tratamento de dados
9HPLC
9Inserção direta 9Electrospray
9Triplo Quadrupolo 9FT-ICR 9Ion trap 9Q-TOF
Introdução da amostra
Fonte
de ionização Analisador Detector
Controle e tratamento de dados
9HPLC
9Inserção direta 9Electrospray
A análise por espectrometria de massas é baseada na relação massa-carga (m/z) e nas características físico-químicos das moléculas. Uma vez que este tipo de técnica permite apenas a detecção de moléculas eletronicamente carregadas, é necessária uma etapa de ionização dos analitos. Atualmente, existem diversos métodos de ionização, alguns apresentados na Tabela 2.
Tabela 2 – Diferentes métodos de ionização para análises por espectrometria de massas.
Métodos de ionização Sigla
Ionização por elétrons EI (electron ionization)
Ionização química CI (chemical ionization)
Ionização por electrospray ESI (electrospray ionization)
Ionização química à pressão atmosférica APCI (Atmospheric Pressure Chemical Ionization)
Ionização e dessorção por laser assistida por matriz
MALDI (matrix-assisted laser (desorption Ionization)
Fotoionizacao à pressão atmosférica APPI (atmospheric pressure photoionization)
Ionização e dessorção por electrospray DESI (desorption electrospray ionization)
Plasma acoplado indutivamente ICP (inductively coupled plasma)
Nos experimentos com as MAAs foi utilizado ionização por electrospray (ESI). A ionização por electrospray ocorre à pressão atmosférica e, embora seja considerada uma fonte de ionização, na verdade é um processo de transferência de íons já presentes na fase aquosa para a fase gasosa.
A extremidade do capilar passa a desprender gotículas carregadas que sofrem evaporação durante a trajetória até o analisador. O aumento da densidade de carga na superfície leva a um aumento na repulsão entre os íons, que são então ejetados para a fase gasosa. Os íons em fase gasosa são atraídos para o analisador auxiliados pelos gradientes de potencial e de pressão. Neste processo são gerados principalmente moléculas protonadas ou desprotonadas ([M+H]+ ou [M-H]-) dependendo do sinal do potencial elétrico aplicado e ainda adutos por coordenação com íons presentes na solução ([M+Na]+, [M+K]+, [M+Cl]- etc) (Crotti et al., 2006a). A Figura 8 apresenta um esquema simplificado dos componentes presentes em uma fonte de ESI.
Figura 8. Esquema simplificado de uma fonte de ionização por electrospray. O analito é inserido no sistema por meio de um capilar (à esquerda). A diferença de potencial entre o capilar e o cone leva à formação de gotículas carregadas que sofrem evaporação. Adaptado de Gates et al., 2006.
Os íons produzidos na fonte de ionização são acelerados em direção ao analisador no qual uma combinação de campos magnéticos, campos elétricos e/ou radiofreqüência (RF) operam para separar os íons de acordo com suas razões m/z
(Gates et al., 2006). Os analisadores podem ser de diversos tipos como setor magnético, quadrupolo (Q), tempo de vôo (TOF), IonTrap e ressonância ciclotrônica de íons (FT-ICR). Análises em tandem MS são possíveis pela combinação destes analisadores, como no caso do Q-TOF e triplo quadrupolo, e em equipamentos do tipo
fluxo de N2(g)
capilar
capilar de transferência
PRESSÃO ATMOSFÉRICA
Bombeamento gotículas
analito/solvente (spray)
Cone
para o analizador introdução
analito/eluente
fluxo de N2(g)
capilar
capilar de transferência
PRESSÃO ATMOSFÉRICA
Bombeamento gotículas
analito/solvente (spray)
Cone
para o analizador
fluxo de N2(g)
capilar
capilar de transferência
PRESSÃO ATMOSFÉRICA
Bombeamento gotículas
analito/solvente (spray)
Cone
para o analizador introdução
Ion trap e FT-ICR. Os analisadores podem ser de baixa e alta resolução, dependendo da capacidade de separação das m/z. Os de baixa resolução, como quadrupolo e Ion trap, conseguem detectar m/z com diferenças de 1 unidade de massa atômica (u.m.a), enquanto os de alta resolução, TOF e FT-ICR, permitem obter massas moleculares com exatidão.
O analisador do tipo quadrupolo consiste em quatro hastes paralelas nas
quais os íons produzidos na fonte passarão pelo seu centro (Figura 9). As hastes são conectadas em pares opostos; em um dos pares é aplicada uma voltagem de RF, e no outro, uma de corrente direta (DC). A movimentação dos íons dependerá do potencial elétrico, sendo que, para cada combinação de RF e DC, apenas íons de determinada
m/z entrarão em ressonância e passarão para o detector. Os demais íons gerados serão desviados da trajetória principal e eliminados durante o percurso até o detector. Além disto, ao variar o potencial elétrico em um quadrupolo, pode-se variar a faixa da relação m/z transmitida, possibilitando uma varredura espectral. A Figura 9 apresenta um esquema simplificado de um analisador do tipo quadrupolo.
Figura 9. Esquema simplificado do analisador do tipo quadrupolo (adaptado de Gates, 2007).
hastes do quadrupólo
íon ressonante (detectado)
íon não-ressonante (não detectado)
fenda de saída
fenda de entrada
ÍONS
DETECTOR
hastes do quadrupólo
íon ressonante (detectado)
íon não-ressonante (não detectado)
fenda de saída
fenda de entrada
ÍONS