UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS
PROGRAMA DE PÓS-GRADUAÇÃO EM PSICOBIOLOGIA
EFEITO ANTICONVULSIVANTE DE FRAÇÕES ISOLADAS DA PEÇONHA DA FORMIGA Dinoponera quadríceps (Formicidae: Ponerinae)
Aluna: Diana Aline Nôga Morais Ferreira
Orientadora: Profa. Dra. Alessandra Mussi Ribeiro
DIANA ALINE NÔGA MORAIS FERREIRA
EFEITO ANTICONVULSIVANTE DE FRAÇÕES ISOLADAS DA PEÇONHA DA FORMIGA Dinoponera quadríceps (Formicidae: Ponerinae)
Dissertação apresentada à
Universidade Federal do Rio Grande do Norte para obtenção do título de mestre em Psicobiologia.
Orientadora: Profa. Dra. Alessandra Mussi Ribeiro
Natal
Título: Efeito Anticonvulsivante de Frações Isoladas da Peçonha da Formiga Dinoponera quadríceps (Formicidae: Ponerinae)
Autora: Diana Aline Nôga Morais Ferreira
Data da defesa: 11/05/2015
Banca Examinadora:
Profª Dr. Alessandra Mussi Ribeiro
Universidade Federal de São Paulo, SP
Profª Dr. Regina Helena da Silva
Universidade Federal de São Paulo, SP
Prof. Dr. Wagner Ferreira dos Santos
AGRADECIMENTOS
Agradeço primeiramente a minha família. Aos meus pais, Sônia e
Ferreira, que investiram pessoal e financeiramente em mim, permitindo que
chegasse a esse momento. E ao meu irmão mais velho, David, pela amizade,
suporte e as inúmeras caronas.
Agradeço a todo grupo do LEME que sempre esteve presente para
ajudar, fosse nos experimentos ou apenas com aquele incentivo tão
necessário. Especialmente a Ramón Hypolito e Ywlliane Meurer que
seguraram as pontas no momento de maior necessidade, atuando como
administradores, pedreiros, pintores, mas principalmente como co-orientadores
e amigos, que não permitiram que nos deixássemos abater diante das
dificuldades.
A todos os meus amigos, que me apoiaram nos momentos de dúvida e
tristeza e proporcionaram diversos momentos de alegria. Especialmente a
Jéssica Damasceno, Alexandre Costa, Amanda Borges, Fernanda Cagni,
Ramón Hypolito e Ywlliane Meurer.
Ao meu namorado e grande companheiro, Luiz Eduardo, que me ajudou
em praticamente todos os experimentos e esteve sempre ao meu lado, me
apoiando e me fazendo uma pessoa melhor a cada dia.
Por fim, a minha orientadora, Alessandra Ribeiro, pela paciência, pelos
direcionamentos e ensinamentos durante esses cinco anos de orientação. E a
todos que de alguma forma contribuíram para minha formação e para
construção desse trabalho.
RESUMO
A epilepsia é uma patologia crônica do sistema nervoso central que afeta
cerca de 65 milhões de indivíduos no mundo. Aproximadamente 30% desses
indivíduos desenvolvem crises convulsivas que persistem apesar do tratamento
monitorado com drogas antiepilépticas. Assim, há uma evidente necessidade
do desenvolvimento de novos fármacos antiepilépticos e as peçonhas podem
ser uma excelente fonte de modelos. Nesse contexto, enquanto já vários
estudos sobre peçonhas de serpentes, escorpiões e aranhas, pouco se sabe
sobre as peçonhas de formigas. Estudos prévios do nosso laboratório
demonstraram que a peçonha desnaturada da formiga Dinoponera quadríceps
protegeu camundongos de crises convulsivas e morte induzidas por bicuculina
(BIC). Nesse contexto, o objetivo desse trabalho foi investigar o potencial
anticonvulsivante de frações isoladas da peçonha de D. quadríceps em crises
convulsivas induzidas pela BIC, bem como uma análise dos efeitos dessas
frações no comportamento natural dos camundongos no campo aberto. Os
animais foram divididos em grupos, os quais receberam injeções (1 mg/ml
i.c.v.) de seis frações distintas e tiveram seu comportamento geral observado
no campo aberto durante 30 min. No segundo experimento, os animais
receberam as mesmas frações 20 min antes da administração de bicuculina
(10 mg/ml). Em seguida, foi analisado o comportamento motor convulsivo
desses animais durante 30 minutos no campo aberto. No primeiro experimento,
não foram observadas alterações comportamentais. Já no segundo
experimento, a administração prévia de DqTx1, DqTx3, DqTx4 e DqTx6
aumentou a latência para o desenvolvimento de crises tônico-clônicas. Além
dos animais. Ainda, os melhores resultados foram obtidos com a fração DqTx6,
que protegeu 62,5% dos animais testados contra o desenvolvimento de crises
tônico-clônicas e 100% dos animais contra a morte.
Palavras-chave: Bicuculina, crises tônico-clônicas, design de fármacos,
ABSTRACT
Epilepsy affects at least 65 million people worldwide and the available
treatment is associated with various side effects. Approximately 20-30% of the
patients develop seizures that persist despite of careful monitored treatment
with antiepileptic drugs. Thus, there is a clear need for the development of new
antiepileptic drugs and the venoms can be an excellent source of probes. In this
context, while there are studies on venoms from snakes, scorpions and spiders,
little is known regarding venom from ants. Previous studies from our group
showed that denatured venom from ant Dinoponera quadriceps protected mice
from seizures and death induced by bicuculline (BIC). In this context, the aim of
this study was to investigate the anticonvulsant activity of compounds isolated
from D. quadriceps venom on seizures induced by BIC, as well as an analysis
of its effects on spontaneous behavior in mice. Animals were divided into
groups, which received injections (1 mg/ml; i.c.v.) of six distinct venom fractions
and had their general behavior analyzed for 30 min in the open field. In the
second experiment, we carried out the same fractions injection protocol 20 min
before the administration of bicuculline (10 mg/ml). Immediately after, we
analyzed animals’ seizures behavior during 30 min in open field. In the first
experiment we did not observe behavioral alterations. Conversely, in the
second experiment, previous administration of DqTx1, DqTx3, DqTx4 and
DqTx6 increased latency for onset of tonic-clonic seizures. Moreover, all
fractions, except DqTx5, increased latency to animals’ death. Yet, we obtained
our best result with DqTx6 fraction, which protected 62.5% of tested animals
from development of tonic-clonic seizures. Further, this fraction protected all
Keywords: bicuculline, tonic-clonic seizures, drug design, bioactive
SUMÁRIO
1. INTRODUÇÃO ... 11
1.1. Epilepsia ... 11
1.2. Breve histórico dos produtos naturais: Os venenos como fontes de fármacos .. 12
1.3. Venenos e peçonhas: uma visão geral ... 14
1.4. Peçonhas e toxinas de vertebrados ... 17
1.5. Peçonhas e toxinas de invertebrados ... 19
1.5.1 Dinoponera quadriceps... 24
2. REFERÊNCIAS ... 26
3. OBJETIVOS ... 33
3.1 Objetivo Geral ... 33
3.2 Objetivos Específicos ... 33
4. ARTIGO ... 34
Introduction ... 38
Material and Methods ... 40
Ants collection and fraction obtainment ... 40
Animals ... 41
Surgery ... 41
General Procedures ... 42
Behavioral analysis ... 42
Verification of the injection site ... 43
Statistical analysis ... 44
Results ... 44
HPLC purification ... 44
Primary screening ... 45
Anticonvulsant assay ... 46
Discussion ... 48
Acknowledgements ... 52
References ... 52
1. INTRODUÇÃO
1.1. Epilepsia
A Epilepsia é uma doença do cérebro caracterizada por uma contínua
predisposição para a geração de uma atividade neuronal excessiva ou
sincrônica, bem como pelas consequências neurobiológicas, cognitivas,
psicológicas e sociais resultantes dessa condição (Fisher et al., 2005, 2014).
As crises epilépticas podem ser classificadas como do tipo focal ou
generalizada. As crises focais são caracterizadas por se originarem e
permanecem em redes neurais limitadas a um hemisfério cerebral e pela
consistência com relação ao seu local de início. Já as crises generalizadas se
caracterizam por envolverem redes distribuídas nos dois hemisférios cerebrais,
sendo subclassificadas em ausência, ausência com características especiais,
mioclônica, clônica, tônica, atônica e tônico-clônica (Berg et al., 2010). Este
transtorno neurológico afeta aproximadamente 65 milhões de indivíduos no
mundo (Thurman et al., 2011) e aproximadamente 30% desses desenvolvem
uma epilepsia crônica que não responde a nenhum fármaco antiepiléptico
(Löscher, 1997; Rosillo-de la Torre, 2014).
No Brasil, são poucos os estudos que abordam o caráter epidemiológico
da epilepsia. O mais recente, que foi realizado por Kanashiro (2006) em
Campinas e São José do Rio Preto sugere que aproximadamente 0,88% da
população brasileira teria epilepsia e destes, aproximadamente 25,3% não
receberia o tratamento correto.
Os fármacos antiepilépticos atualmente utilizados atuam através de três
mediada pelo ácido gama-aminobutírico (GABA), tendo como exemplos os
benzodiazepínicos, os barbitúricos, a tiagabina, a vigabatrina, dentre outros. (2)
através da modulação de canais iônicos voltagem-dependente de sódio, cálcio
e potássio, tendo como exemplos a fenitoína, a pregabalina, a carbamazepina,
dentre outros. (3) através da atenuação da transmissão excitatória
glutamatérgica, tendo como representantes o felbamato e, de forma parcial, o
topiramato.
O grande problema é que estes fármacos precisam ser utilizados de
forma crônica e estão associados a efeitos colaterais negativos, como
desconforto gástrico, sedação, diplopia, ataxia, nistagmo, hipertrofia gengival,
osteomalacia, hirsutismo, neuropatia periférica, aumento paradoxal de crises,
prejuízos cognitivos, distúrbios comportamentais, bem como reações
idiossincráticas como agranulocitose, pseudolinfoma, falência hepática, falência
múltipla e anemia aplástica (Kwan, et. al., 2001; Macdonald & Kelly, 1995;
Mortari et al., 2007b; Rogawski, 2006). Nesse contexto, é clara a necessidade
do desenvolvimento de novos fármacos que possam tratar os pacientes
resistentes e/ou apresentar menos efeitos colaterais. Então, uma fonte
potencial de novos fármacos para o tratamento da epilepsia são os compostos
isolados de produtos naturais.
1.2. Breve histórico dos produtos naturais: Os venenos como fontes de fármacos
Os produtos naturais constituem uma fonte para obtenção de novas
remotos (Koehn & Carter, 2005). Por exemplo, desde o século VII a.C. povos
na Índia utilizavam venenos extraídos de serpentes para prolongar a vida e
para o tratamento de problemas gastrointestinais (Gomes et al., 2010). Na
medicina tradicional chinesa (desde a dinastia Song – 960 a 1279), tanto a
peçonha e/ou corpo do escorpião Buthus martensis são utilizados no
tratamento de doenças como epilepsia, acidente vascular cerebral e paralisia
facial (Zhao et al., 2008 and 2011). Ainda, em populações indígenas na
América Latina, as tarântulas são utilizadas no tratamento de diversas
doenças, como asma, câncer e erisipela (Machkour-M’Rabet et al., 2011).
As pesquisas na área de produtos naturais derivados de venenos
tiveram um aumento considerável entre os anos de 1970 a 1980, com o
desenvolvimento do anti-hipertensivo captopril a partir do veneno da serpente
Bothrops jararaca, porém passaram por um declínio durante os anos seguintes.
Esse declínio foi provavelmente resultado de diversos fatores, entre eles o
desenvolvimento da química combinatória e os avanços na biologia celular,
molecular e genômica, que aumentaram a quantidade de substâncias para
testes e de alvos moleculares, além de reduzirem o tempo para descoberta de
novos fármacos (Greene et al, 1972; King, 2011; Koehn & Carter, 2005).
Porém, com o desenvolvimento de técnicas mais eficientes para fracionamento
e caracterização de produtos naturais e o fato de técnicas concorrentes, como
a química combinatória, terem falhado na apresentação de novas substâncias
promissoras, a pesquisa baseada na prospecção de compostos bioativos
obtidos a partir de produtos naturais voltou a ganhar notoriedade, de forma
partir de substancias obtidas a partir de produtos naturais (King, 2011; Molinski
et al., 2009; Newman & Cragg, 2012).
Atualmente, dentre os diversos produtos naturais pesquisados, seja para
o desenvolvimento de novos fármacos utilizados na clínica ou como
ferramentas para a pesquisa científica, grande parte são princípios ativos
isolados a partir de peçonhas de serpentes. Isso se deve provavelmente ao
fato desses animais apresentarem maior quantidade de veneno quando
comparado com as quantidades obtidas de invertebrados como aranhas,
escorpiões, dentre outros. Esse quadro começou a mudar com o
desenvolvimento de técnicas sofisticadas de fracionamento, avanços em
espectrometria de massa, miniaturização dos testes funcionais e o advento das
bibliotecas de cDNA, que permitiram a análise direta dos transcritos dos
venenos (King, 2011).
1.3. Venenos e peçonhas: uma visão geral
Os venenos são secreções tóxicas, que contem moléculas que
interferem na fisiologia e em processos bioquímicos de outros animais e são
produzidas em uma glândula especializada (King, 2011). Alguns animais
desenvolveram sistemas complexos para aplicação dessas secreções em suas
vítimas, como dentes modificados, arpões, ferrões, presas, probóscides, entre
outros (Fry et al., 2009). Esses animais são denominados peçonhentos e seus
venenos, peçonhas. As composições dos venenos são resultado de um
processo evolutivo de milhões de anos, o qual permitiu o desenvolvimento e
objetivo de defesa, predação e de afastar indivíduos competidores (Fry et al.,
2009; Miijanich, 1997; Mortari et al., 2007b).
Em geral, os venenos são formados por uma combinação de proteínas,
peptídeos, poliaminas, sais, aminoácidos, minerais e alcaloides (Fry et al.,
2009; Gomes et al., 2010; Lewis & Garcia, 2003; Wong & Belov, 2012). As
proteínas presentes nesses compostos são resultantes de um processo de
recrutamento, o qual envolve a duplicação de um gene que codifica uma
proteína e a expressão seletiva desse gene na glândula (Fry et al., 2009).
Essas duplicações de genes podem promover o surgimento de novas funções
e a formação de “famílias multigênicas” (multigene family), que consistem numa
família de proteínas codificadas por genes similares, que são variações de um
gene ancestral. Dessa forma, essas proteínas preservam uma mesma estrutura
básica, que recebe alterações chaves, permitindo uma diversidade de funções
(Fry et al., 2009; Wong & Belov, 2012).
Apesar da diversidade na composição de venenos uma grande
diversidade de espécies apresenta proteínas como as cistatinas, defensinas,
hialuronidases, lectinas, peptidases, fosfolipases, proteínas secretórias ricas
em cisteína, esfingomielinases, dentre outras. Todas essas proteínas
apresentam precursores que possuem um peptídeo sinal na posição N-terminal
(Fry et al., 2009). Outra característica em comum, é que essas proteínas, bem
como os peptídeos que agem como toxinas, possuem uma maior quantidade
de cisteínas, o que permite a formação de pontes de sulfeto, as quais garantem
maior estabilidade e resistência à degradação por proteases. Essa estabilidade
é importante para permitir que as toxinas cheguem ainda ativas aos seus alvos
em que a via de administração seja oral (Fry et al., 2009; King, 2011; Miijanich,
1997).
Por ter uma composição diversificada, os venenos possuem alvos e
ações diversas no organismo humano. Eles podem agir nos sistemas nervoso,
cardiovascular, respiratório, gastrointestinal, além de poderem atingir pele,
músculos e rins, seja por uma ação tecido-específica ou por ações citotóxicas.
Como consequência, podem causar dor, inchaço, necrose tecidual, náuseas,
vômitos, paralisias, diarreia, febre, dores de cabeça, visão borrada, tonturas,
fraqueza ou falta de coordenação muscular, hipotensão, hemorragia, efeitos
trombóticos e podem levar até a morte, seja por ação direta ou por reações
anafiláticas (Sitprija & Suteparak, 2008; Wong & Belov, 2012). Quase todos
esses efeitos podem ser resultados de enzimas presentes no veneno, ou da
ação de suas toxinas sobre diversos alvos, como canais iônicos,
transportadores e os mais diversos receptores celulares.
Como mencionado, as toxinas de venenos sofrem constante pressão
seletiva, já que é de sua eficácia que depende a aquisição de alimento e
defesa de muitos animais que as produzem. Assim, geralmente possuem alta
potência e especificidade de ação para seu alvo molecular. Em suma, essas
características são difíceis de serem replicadas por outras fontes, e fazem das
toxinas animais uma fonte única para o desenvolvimento de novos modelos de
1.4. Peçonhas e toxinas de vertebrados
Os vertebrados peçonhentos incluem principalmente serpentes, outros
répteis, peixes e anfíbios. Dentre esses como já mencionados, os mais
estudados com relação ao potencial de suas peçonhas são as serpentes, as
quais são divididas em quatro famílias, Elapidae (najas, cobras-coral, etc),
Viperidae (cascavel, jararaca, etc), Atractaspidinae e Colubridae (Warrell,
2012).
Várias substâncias com grande potencial terapêutico já foram extraídas
de peçonhas de serpentes. Como já descrito anteriormente, uma das primeiras
foi a base para o desenvolvimento do anti-hipertensivo Captopril®, um inibidor
da enzima conversora de angiotensina II, largamente utilizado na clínica para
tratamento de hipertensão, alguns tipos de patologias cardíacas congestivas e
na preservação da função renal em indivíduos com neuropatia diabética
(Izidoro et al., 2014; Liu et al., 2014; Rodrigues & Santos, 2012; Vogel et al.,
2014)
Outros exemplos de substâncias promissoras extraídas de serpentes
são a eptifibatida (Integrilin®) e o tirofiban (Aggrastat®), dois anticoagulantes
que bloqueiam o receptor de glicoproteína IIb/IIIa, que são sintetizados a partir
de proteínas extraídas do veneno das serpentes Sistrurus miliarus barbouri e
Echis carinatus, respectivamente (Kereiakes et al., 1996; Earl et al., 2012).
Esses fármacos estão sendo testados como adjuvantes para recanalização
vascular em situações como infarto agudo do miocárdio, acidentes vasculares
isquêmicos e complicações cirúrgicas tromboembolíticas, uma vez que podem
impedir a ativação plaquetária, impedindo assim a reoclusão e facilitando uma
al., 1992; Sedat et al., 2014). Outra substância é o peptídeo TNP-c, isolado do
veneno da Oxyuranus microlepidotus, que apresenta similaridade com
peptídeos natriuréticos, possuindo atividade vasodilatadora e hipotensiva (Fry
et al., 2005); ou a textilinina-1 (Q8008), um inibidor de serina protease isolada
do veneno da Pseudonaja textilis, que é um potente e seletivo inibidor de
plasmina e tripsina e vem sendo testada como agente hemostático em cirurgias
cardiotorácicas (Earl et al., 2012; Flight et al., 2009).
Alguns peixes também podem possuir peçonhas, um exemplo é o
Thalassophryne nattereri, que possui dois espinhos laterais e dois espinhos
dorsais conectados a glândulas produtoras de peçonha. Essa peçonha quando
inoculada em humanos é capaz de causar edema e dor severa, seguida de
necrose tecidual (Lopes-Ferreira et al., 2001). Estudos prévios mostram que a
peçonha desse peixe pode causar dano a membrana de células musculares,
bem como alteração de todas as organelas dessas células, além de outras
propriedades miotóxicas (Lopes-Ferreira et al., 2001). Outras ações
relacionadas a essa peçonha são a alteração da estrutura da matriz
extracelular, do conteúdo de colágeno durante a fase de recuperação, da
organização do citoesqueleto e da formação de pseudópodes em células
epiteliais (Pareja-Santos et al., 2009). Algumas toxinas isoladas do veneno do
T. nattereri como as natterinas apresentam ação proteolítica sobre os
colágenos dos tipos I e IV e componentes da matriz extracelular, convertem
angiotensina I em angiotensina II, além de inibirem a adesão entre célula e
matriz extracelular e causarem morte celular. A nattectina é uma lectina do tipo
C, que apresenta a capacidade de aumentar a adesão celular mediada por
mediado por sua interação com integrinas (Komegae et al., 2011; Tenório et al.,
2015).
Um dos poucos, se não o único mamífero peçonhento é o
Ornithorhynchus anatinus, que injeta sua peçonha através de esporas nas
patas traseiras, as quais estão ligadas a uma glândula produtora da peçonha
que surge durante o período de reprodução. O envenenamento de humanos
causa inchaço e dor intensa, que não é amenizada pela administração de
morfina (Fenner et al., 1992). A peçonha bruta deste animal foi capaz de
causar edema na pata de ratos, com pico entre 20 a 30 minutos e relaxamento
do útero pré-contraídos de ratos (De Plater et al., 1995). O isolamento da
peçonha desse animal demonstrou a presença de peptídeos semelhantes à e
a -defensinas e peptídeos natriuréticos (Whittington et al., 2008).
Apesar dos vertebrados, especialmente as serpentes, terem sido os
principais alvos dos estudos iniciais com peçonhas, como já mencionado
anteriormente, os avanços técnicos recentes e o desenvolvimento de um maior
conhecimento sobre o sistema nervoso, permitiram que as peçonhas de
invertebrados também fossem alvo de novas pesquisas.
1.5. Peçonhas e toxinas de invertebrados
Os invertebrados peçonhentos incluem, entre outros, aranhas,
escorpiões, caramujos, águas-vivas, vespas, abelhas e formigas. As peçonhas
desses animais contêm componentes químicos de diversas classes, mas os
peptídeos e as poliaminas constituem os compostos neuroativos mais
As peçonhas de escorpiões podem provocar em humanos febre,
agitação psicomotora, salivação, lacrimejamento, aumento da mobilidade
intestinal, arritmias cardíacas e respiratórias, hipertensão seguida de
hipotensão, edema pulmonar e choque, dentre outros (Ossanai et al., 2012).
Dentre as várias espécies existentes, apenas algumas possuem importância
médica, sendo distribuídas principalmente entre os gêneros Centruroides,
Tityus, Buthus, Androctonus, Buthotus, Leiurus e Parabuthus (Nencioni et al.,
2009). Em relação ao gênero Tityus, a maioria dos estudos investigou a
peçonha do T. serrulatus, onde se observou que a injeção da peçonha bruta no
hipocampo de ratos é capaz de causar comportamentos convulsivos, como
mioclonias, automatismos faciais e sacudidela de cachorro (wet dog shakes), e,
além disso, a injeção intraperitoneal resulta na indução de descargas neuronais
epileptiformes (Dorce & Sandoval, 1994; Nencioni et al., 2009). Esses efeitos
se devem, pelo menos em parte, às toxinas TS-8F e TsTX-I, que isoladamente
causam descargas epileptiformes e wet dog shakes, quando injetadas no
hipocampo de ratos (Carvalho el al., 1998; Teixeira et al., 2010).
Outra espécie de escorpião bastante estudada é o Buthus martensis. A
peçonha desse escorpião é bastante interessante, pois contém tanto toxinas
com potencial convulsivante como com potencial anticonvulsivante. Assim, a
toxina convulsivante BmK I, é uma -toxina moduladora de canais de sódio
voltagem-dependente que, quando injetada no hipocampo dorsal de ratos em
doses baixas, promove crises límbicas, automatismos faciais, wet dog shakes e
mioclonias, enquanto que na dose de 2 g causa crises tônico-clônicas
seguidas de morte (Bai et al., 2006). Por outro lado, com relação ao potencial
primeira, quando injetada previamente no hipocampo, reduz de forma
dose-dependente a duração e o número de crises convulsivas induzidas pelo
pentilenotetrazol (PTZ) e aumenta a latência para o início do estado epiléptico
induzido pela pilocarpina (Zhao et al., 2011). Já a segunda toxina, quando
injetada previamente em CA1, protege os animais da morte e reduz a
intensidade das crises induzidas pelo PTZ (Zhao et al., 2008).
Entre os invertebrados também podemos destacar os estudos com
peçonhas de aranhas. As aranhas existem há pelo menos 300 milhões de
anos, representadas por aproximadamente 40.000 espécies já descritas (Rash
& Hodgson, 2002).
A grande maioria das neurotoxinas extraídas de aranhas são proteínas,
peptídeos ou acilpoliaminas (McCormick & Meinwald, 1993). Na literatura
existem vários exemplos de neurotoxinas extraídas de aranhas, dentre eles
está a Ph1, isolada da peçonha da Phoneutria nigriventer, que é capaz de
reduzir, de forma duradoura, a alodinia no modelo de incisão plantar, podendo
ter uso potencial no controle de dores persistentes (de Souza et al., 2011).
Outro exemplo, é a toxina JZTX-XIII isolada da peçonha da Chilobrachys
jingzhao, que apresenta a capacidade de bloquear canais de potássio
dependentes de voltagem dos tipos Kv2.1, Kv4.1 e Kv4.2, com maior afinidade
pelo primeiro (Yuan et al., 2012).
Ainda, a -latrotoxina e -latroinsetotoxina, isoladas da peçonha da
viúva negra (Latrodectus sp), atuam sobre a membrana pré-sináptica formando
poros que facilitam a passagem de íons como o cálcio, gerando uma liberação
atua em mamíferos e não em insetos, enquanto que para a -latroinsetotoxina
é ao contrário, apresentando assim potencial inseticida (Finkelstein et al., 1992;
McCormick & Meinwald, 1993).
A peçonha da aranha Scaptocosa raptoria quando administrada i.c.v.
promove alterações comportamentais em ratos, como crises pro-cursivas (wild
running), um comportamento que geralmente precede crises convulsivas
(Ribeiro et al., 2000). Entretanto, quando a peçonha é desnaturada e injetada
previamente na substância negra parte reticulada, é capaz de proteger ratos de
crises convulsivas induzidas pela injeção de bicuculina na Area tempestas.
Este efeito foi atribuído a toxina isolada SrTx 1.3 (Mussi-Ribeiro et al., 2004).
A aranha Parawixia bistriata, cuja peçonha bruta promove o surgimento
de crises convulsivas límbicas em ratos, com mioclonias e wet dog shakes
(Rodrigues et al., 2001), também quando desnaturada protege animais de
crises tônico-clônicas induzidas por bicuculina, picrotoxina e PTZ. A toxina
Parawixina 10, também apresentou potencial anticonvulsivante em modelos de
crises tônico-clônicas induzidas por ácido kaínico, NMDA e PTZ em ratos,
através de um mecanismo que envolve o aumento da recaptação de glutamato
e glicina (Fachim et al., 2011).
Outro grupo importante no estudo de venenos é o dos insetos
peçonhentos que fazem parte da ordem Hymenoptera, a qual compreende
abelhas, vespas e formigas. Esses insetos injetam suas peçonhas através de
um ovopositor modificado, que se encontra em seu abdômen (Fitzgerald &
As peçonhas das abelhas são mais conhecidas pelas reações
anafiláticas provocadas em mamíferos. No entanto, essas apresentam toxinas
com grande potencial terapêutico, por exemplo, na medicina oriental são
utilizadas para o tratamento de doenças imunológicas, como a artrite
reumatoide. Essa capacidade de modular a resposta imune vem sendo
investigada como forma de tratamento complementar em outros tipos de
patologias. Um exemplo é a doença de Parkinson, Chung et al., (2012)
demonstraram que, em camundongos com administrações intraperitoneais da
toxina MPTP, a aplicação intraperitoneal da peçonha de abelha foi capaz de
reduzir a morte de neurônios dopaminérgicos na substância negra, reduzir
citocinas pró-inflamatória como IL-1 e TNF-, além de diminuir a formação de
espécies reativas de oxigênio e o infiltrado de linfócitos TCD4.
Da mesma forma que as aranhas, as vespas possuem peçonhas com
potencial terapêutico. Um exemplo é a toxina AvTx8 isolada da peçonha da
vespa Agelaia vicina, que quando injetada previamente na Substância negra
parte reticulada, reduz os comportamentos defensivos gerados pela
estimulação química de camadas profundas do colículo superior (de Oliveira et
al., 2005).
A peçonha desnaturada da vespa Polybia occidentalis, quando injetada
previamente no ventrículo lateral direito de ratos, é capaz de proteger animais
de crises convulsivas causadas pela administração de bicuculina, picrotoxina e
ácido kaínico, além de aumentar a latência para o aparecimento de crises
induzidas por PTZ (Mortari et al., 2005). Além disso, o peptídeo Thr6-BK,
mais potente que a morfina no teste de retirada de cauda (tail-flick) em ratos
(Mortari et al., 2007a).
As formigas também possuem peçonhas com grande potencial
farmacológico, porém, apesar de existirem mais de 35.000 espécies descritas
(“Taxonomic List - Ants of All Antweb (Species) - AntWeb,” n.d.), o estudo de
suas peçonhas é bastante reduzido. Um dos poucos exemplos já descritos é da
poneratoxina, isolada do veneno da peçonha da formiga Paraponera clavata,
que é capaz de bloquear a transmissão sináptica no sistema nervoso central de
baratas (Piek et al., 1991) e aumentar a capacidade do baculovírus em matar a
larva da lagarta-do-cartucho Spodoptera frugiperda (Szolajska et al., 2004).
Outros exemplos são da ectamotina, isolada da peçonha da formiga
Ectatomma tuberculatum, que inibe a corrente de cálcio em miócitos
ventriculares de ratos (Pluzhnikov et al., 1999) e as mirmexinas, isoladas da
peçonha da Pseudomyrmex triplarinus, que possuem atividade antiinflamatória,
demonstrada pela inibição dose-dependente do edema de pata induzido por
carragenina em ratos (Pan & Hink, 2000).
1.5.1 Dinoponera quadriceps
A subfamília Ponerinae, que inclui o gênero Dinoponera, apresenta as
formigas com maior tamanho, com picadas dolorosas e capazes de provocar
manifestações sistêmicas como febre, tremores, suor frio, náusea, vômito,
linfadenopatia e arritmias cardíacas (Haddad Junior et al., 2005). A Dinoponera
quadriceps, possui uma organização social atípica, não possuindo rainha. É
atlântica, sendo endêmica no Nordeste brasileiro (Medeiros et al., 2012;
Vasconcellos et al., 2004).
Poucos são os estudos com a peçonha dessa formiga, Sousa e
colaboradores (2012) demonstraram o potencial antinociceptivo da peçonha em
teste com formalina, ácido acético e carragenina em ratos. Mais recentemente
Lopes e colaboradores (2013) demonstraram o efeito neuroprotetor da peçonha
quando injetada i.p. no modelo de crises convulsivas induzidas por PTZ. No
campo molecular, Cologna e colaboradores (2013) realizaram a identificação
dos peptídeos presentes na peçonha de formigas coletadas em quatro
diferentes regiões, demonstrando significativas diferenças entre as
composições dessas peçonhas, bem como a presença de peptídeos com ação
antimicrobiana de amplo espectro. Enquanto que Torres e colaboradores
(2014) realizaram uma análise de transcriptoma da glândula de veneno da D.
quadriceps, demonstrando a presença de polipeptídeos alergênicos, proteínas
tipo-letal, dinoponeratoxinas e esterases.
Um trabalho realizado no nosso laboratório demonstrou que a peçonha
bruta, quando injetada em altas doses no ventrículo lateral esquerdo de
camundongos Swiss, é capaz de promover alterações comportamentais,
caracterizadas por um período inicial de imobilidade, seguido de um intenso
comportamento motor semelhante a crises convulsivas tônico-clônicas. Por
outro lado, a injeção i.c.v. prévia da peçonha desnaturada é capaz de proteger
animais de crises tônico-clônicas e morte no modelo de crises induzidas pela
bicuculina (Nôga et al. 2015). Esses resultados fomentaram o fracionamento da
peçonha, através de cromatografia líquida de alto desempenho, na tentativa de
2. REFERÊNCIAS
Asadi, H., Yan, B., Dowling, R., Wong, S., & Mitchell, P. (2014). Advances in Medical Revascularisation Treatments in Acute Ischemic Stroke. Thrombosis, 2014, 1–14.
doi:10.1155/2014/714218
Bai, Z.-T., Zhao, R., Zhang, X.-Y., Chen, J., Liu, T., & Ji, Y.-H. (2006). The epileptic seizures induced by BmK I, a modulator of sodium channels. Experimental Neurology, 197(1), 167–76. doi:10.1016/j.expneurol.2005.09.006
Berg, A. T., Berkovic, S. F., Brodie, M. J., Buchhalter, J., Cross, J. H., Boas, V. E. W., Engel, J., French, J., Glauser, T. A., Mathern, G. W., Moshé, S. L., Nordli, D., Plouin, P., & Scheffer, I. E. (2010). Revised terminology and concepts for organization of seizures and epilepsies: Report of the ILAE Commission on Classification and Terminology, 2005-2009. Epilepsia, 51(4), 676–685.
doi:10.1111/j.1528-1167.2010.02522.x
Carvalho, F. F., Nencioni, A. L. A., Lebrun, I., Sandoval, M. R. L., & Dorce, V. A. C. (1998). Behavioral, Electroencephalographic, and Histoplathologic Effects of a Neuropeptide Isolated from Tityus serrulatus Scorpion Venom in rats.
Pharmacology Biochemistry and Behavior, 60(1), 7–14. doi:
10.1016/S0091-3057(97)00407-3
Chung, E. S., Kim, H., Lee, G., Park, S., Kim, H., & Bae, H. (2012). Neuro-protective effects of bee venom by suppression of neuroinflammatory responses in a mouse model of Parkinson’s disease: Role of regulatory T cells. Brain, Behavior, and Immunity, 26(8), 1322–30. doi:10.1016/j.bbi.2012.08.013
Cologna, C. T., Cardoso, J. D. S., Jourdan, E., Degueldre, M., Upert, G., Gilles, N., Uetanabaro, A. P. T, Costa Neto, E. M., Thonart, P., de Pauw, E., & Quinton, L. (2013). Peptidomic comparison and characterization of the major components of the venom of the giant ant Dinoponera quadriceps collected in four different areas
of Brazil. Journal of Proteomics, 94, 413–22. doi:10.1016/j.jprot.2013.10.017
De Oliveira, L., Cunha, A. O. S., Mortari, M. R., Pizzo, A. B., Miranda, A., Coimbra, N. C., & dos Santos, W. F. (2005). Effects of microinjections of neurotoxin AvTx8, isolated from the social wasp Agelaia vicina (Hymenoptera, Vespidae) venom, on
GABAergic nigrotectal pathways. Brain Research, 1031(1), 74–81.
doi:10.1016/j.brainres.2004.10.027
De Plater, G., Martin, R. L., & Milburn, P. J. (1995). A pharmacological and biochemical investigation of the venom from the platypus (Ornithorhynchus anatinus). Toxicon,
33 (2), 157-69. doi: 10.1016/0041-0101(94)00150-7
Dorce, V. A., & Sandoval, M. R. (1994). Effects of Tityus serrulatus crude venom on the
GABAergic and dopaminergic systems of the rat brain. Toxicon , 32(12), 1641–7.
doi:10.1016/j.lfs.2012.06.029
Earl, S. T. H., Masci, P. P., de Jersey, J., Lavin, M. F., & Dixon, J. (2012). Drug development from Australian elapid snake venoms and the Venomics pipeline of candidates for haemostasis: Textilinin-1 (Q8008), HaempatchTM (Q8009) and
CoVaseTM (V0801). Toxicon , 59(4), 456–63. doi:10.1016/j.toxicon.2010.12.010
Eisenberg, P. R., Sobel, B. E., & Jaffe, a S. (1992). Activation of prothrombin accompanying thrombolysis with recombinant tissue-type plasminogen activator.
Journal of the American College of Cardiology, 19(April), 1065–1069.
doi:10.1016/0735-1097(92)90296-Y
Fachim, H. A., Cunha, A. O. S., Pereira, A. C., Beleboni, R. O., Gobbo-Neto, L., Lopes, N. P., Coutinho-Neto, J., & dos Santos, W. F. (2011). Neurobiological activity of Parawixin 10, a novel anticonvulsant compound isolated from Parawixia bistriata
spider venom (Araneidae: Araneae). Epilepsy & Behavior : E&B, 22(2), 158–64.
doi:10.1016/j.yebeh.2011.05.008
Fenner, P. J., Williamson, J. A., & Myers, D. (1992). Platypus envenomation - a painful learning experience. The Medical Journal of Australia, 157, 829-832.
Finkelstein, A., Rubin, L. L., & Tzeng, M. C. (1992). Black widow spider venom: effect of purified toxin of lipid bilayer membranes. Science, 193, 1009-11. doi:
10.1126/science.948756
Fisher, R. S., Boas, W. V. E., Blume, W., Elger, C., Genton, P., Lee, P., & Engel, J. (2005). Epileptic seizures and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE).
Epilepsia, 46(4), 470–2. doi:10.1111/j.0013-9580.2005.66104.x
Fisher, R. S., Acevedo, C., Arzimanoglou, A., Bogacz, A., Cross, J. H., Elger, Engel, J., Forsgren, L., French, J. A., Glynn, M., Heddorffer, D. C, Lee, B. I., Mathern, G. W., Moshé, S. L., Perucca, E., Scheffer, I. E., Tomson, T., Watanabe, M., & Wiebe, S. (2014). ILAE Official Report: A practical clinical definition of epilepsy. Epilepsia, 55, 475–482. doi:10.1111/epi.12550
Fitzgerald, K. T., & Flood, A. a. (2006). Hymenoptera stings. Clinical Techniques in Small Animal Practice, 21(4), 194–204. doi:10.1053/j.ctsap.2006.10.002
Flight, S. M., Johnson, L. A, Du, Q. S., Warner, R. L., Trabi, M., Gaffney, P. J., Lavin, M. F., de Jersey, J., & Masci, P. P. (2009). Textilinin-1, an alternative anti-bleeding agent to aprotinin: Importance of plasmin inhibition in controlling blood loss. British Journal of Haematology, 145(2), 207–11. doi:10.1111/j.1365-2141.2009.07605.x
Fry, B. G., Wickramaratana, J. C., Lemme, S., Beuve, A., Garbers, D., Hodgson, W. C., & Alewood, P. Novel natriuretic peptides from the venom of the inland taipan (Oxyuranus microlepitidotus): isolation, chemical and biological characterization. Biochemical and Biophysical research communications, 327 (4), 1011-15. doi:
10.1016/j.bbrc.2004.11.171
Vega, R. C. R. (2009). The toxicogenomic multiverse: convergent recruitment of proteins into animal venoms. Annual Review of Genomics and Human Genetics, 10, 483–511. doi:10.1146/annurev.genom.9.081307.164356
Gomes, A., Bhattacharjee, P., Mishra, R., Biswas, A. K., Dasgupta, S. C., & Giri, B. (2010). Anticancer potential of animal venoms and toxins. Indian Journal of Experimental Biology, 48(2), 93–103. Retrieved from
http://www.ncbi.nlm.nih.gov/pubmed/20455317
Haddad Junior, V., Cardoso, J. L. C., & Moraes, R. H. P. (2005). Description of an injury in a human caused by false tocandira (Dinoponera gigantea, Perty, 1833) with revision on folkloric, pharmacological and clinical aspects of the giant ants of the genera Paraponera and Dinoponera (sub-family Ponerinae). Revista Do Instituto de Medicina Tropical de São Paulo, 47(4), 235–238.
doi:10.1590/S0036-46652005000400012
Izidoro, L. F. M., Sobrinho, J. C., Mendes, M. M., Costa, T. R., Grabner, A. N., Rodrigues, V. M., da Silva, S. L., Zanchi, F. B., Zuliani, J. P., Fernandes, C. F. C., Calderon L. A., Stábeli, R. G., & Soares, A. M. (2014). Snake venom L-amino acid oxidases: Trends in pharmacology and biochemistry. BioMed Research International, 2014. doi:10.1155/2014/196754
Kereiakes, J., Kleiman, N. S., & Ambrose, J. (1996). Randomized, double-blind, placebo-controlled dose-ranging study of tirofiban (MK-383) platelet IIb/IIIa blockade in high risk patients undergoing coronary angioplasty. Journal of the American College of Cardiology, 27(3), 536-42. doi:
10.1016/0735-1097(95)00500-5
King, G. F. (2011). Venoms as a platform for human drugs: translating toxins into therapeutics. Expert Opinion on Biological Therapy, 11(11), 1469–84.
doi:10.1517/14712598.2011.621940
Koehn, F. E., & Carter, G. T. (2005). The evolving role of natural products in drug discovery. Nature Reviews. Drug Discovery, 4(3), 206–20. doi:10.1038/nrd1657
Komegae, E. N., Ramos, A. D., Oliveira, A. K., Serrano, S. M. D. T., Lopes-Ferreira, M., & Lima, C. (2011). Insights into the local pathogenesis induced by fish toxins: role of natterins and nattectin in the disruption of cell-cell and cell-extracellular matrix interactions and modulation of cell migration. Toxicon, 58(6-7), 509–17.
doi:10.1016/j.toxicon.2011.08.012
Kwan, P., Sills, G. J., & Brodie, M. J. (2001). The mechanisms of action of commonly used antiepileptic drugs. Pharmacology & Therapeutics, 90(1), 21–34. doi:
10.1016/S0163-7258(01)00122-X
Lewis, R. J., & Garcia, M. L. (2003). Therapeutic potential of venom peptides. Nature Reviews. Drug Discovery, 2(10), 790–802. doi:10.1038/nrd1197
Liu, C. C., Yang, H., Zhang, L. L., Zhang, Q., Chen, B., & Wang, Y. (2014). Biotoxins for cancer therapy. Asian Pacific Journal of Cancer Prevention, 15, 4753–4758.
doi:10.7314/APJCP.2014.15.12.4753
regeneration after injection of Thalassophryne natteri (niquim) fish venom in mice. International Journal of Experimental Pathology, 82(1), 55-64.
Lopes, K. S., Rios, E. R. V., Lima, C. N. D. C., Linhares, M. I., Torres, A. F. C., Havt, A., Quinet, Y. P., Fonteles, M. M. de F., & Martins, A. M. C. (2013). The effects of the Brazilian ant Dinoponera quadriceps venom on chemically induced seizure
models. Neurochemistry International, 63(3), 141–5.
doi:10.1016/j.neuint.2013.06.001
Löscher, W. (1997). Animal models of intractable epilepsy. Progress in Neurobiology, 53(49), 239 – 248. doi: 10.1016/S0301-0082(97)00035-X
Macdonald, R. L., & Kelly, K. M. (1995). Antiepileptic drug mechanisms of action.
Epilepsia, 36 Suppl 5, S2–S8. doi: 10.1111/j.1528-1157.1993.tb05918.x
Machkour-M’Rabet, S., Hénaut, Y., Winterton, P., & Rojo, R. (2011). A case of zootherapy with the tarantula Brachypelma vagans Ausserer, 1875 in traditional
medicine of the Chol Mayan ethnic group in Mexico. Journal of Ethnobiology and Ethnomedicine, 7(1), 12. doi:10.1186/1746-4269-7-12
McCormick, K. D., & Meinwald, J. (1993). Neurotoxic acylpolyamines from spider venoms. Journal of Chemical Ecology, 19(10), 2411–2451.
doi:10.1007/BF00979674
Medeiros, J., Araújo, A., Araújo, H. F. P., Queiroz, J. P. C., & Vasconcellos, A. (2012). Seasonal activity of Dinoponera quadriceps Santschi (Formicidae, Ponerinae) in
the semi-arid Caatinga of northeastern Brazil. Revista Brasileira de Entomologia, 56(1), 81–85. doi:10.1590/S0085-56262012000100013
Miijanich, G. (1997). Venom peptides as human pharmaceuticals. Science and
Medicine, 4(5), 6–15. Retrieved from
https://www.sciandmed.com/sm/journalviewer.aspx?issue=1054&article=677
Molinski, T. F., Dalisay, D. S., Lievens, S. L., & Saludes, J. P. (2009). Drug development from marine natural products. Nature Reviews. Drug Discovery, 8(1),
69–85. doi:10.1038/nrd2487
Mortari, M. R., Cunha, A. O. S., de Oliveira, L., Vieira, E. B., Gelfuso, E. A., Coutinho-Netto, J., & Ferreira dos Santos, W. (2005). Anticonvulsant and behavioural effects of the denatured venom of the social wasp Polybia occidentalis (Polistinae,
Vespidae). Basic & Clinical Pharmacology & Toxicology, 97(5), 289–95.
doi:10.1111/j.1742-7843.2005.pto_137.x
Mortari, M. R., Cunha, a O. S., Carolino, R. O. G., Coutinho-Netto, J., Tomaz, J. C., Lopes, N. P., Coimbra, N. C., & dos Santos, W. F. (2007a). Inhibition of acute nociceptive responses in rats after i.c.v. injection of Thr6-bradykinin, isolated from the venom of the social wasp, Polybia occidentalis. British Journal of Pharmacology, 151(December 2006), 860–869. doi:10.1038/sj.bjp.0707275
Mortari, M. R., Cunha, A. O. S., Ferreira, L. B., & dos Santos, W. F. (2007b). Neurotoxins from invertebrates as anticonvulsants: from basic research to therapeutic application. Pharmacology & Therapeutics, 114(2), 171–83.
Mussi-Ribeiro, A., Miranda, A., Gobbo-Netto, L., Peporine Lopes, N., & dos Santos, W. F. (2004). A anticonvulsive fraction from Scaptocosa raptoria (Araneae:
Lycosidae) spider venom. Neuroscience Letters, 371(2-3), 171–5.
doi:10.1016/j.neulet.2004.08.064
Nencioni, A. L. a, Lourenço, G. A., Lebrun, I., Florio, J. C., & Dorce, V. A. C. (2009). Central effects of Tityus serrulatus and Tityus bahiensis scorpion venoms after
intraperitoneal injection in rats. Neuroscience Letters, 463(3), 234–8.
doi:10.1016/j.neulet.2009.08.006
Newman, D. J., & Cragg, G. M. (2012). Natural products as sources of new drugs over the 30 years from 1981 to 2010. Journal of Natural Products, 75(3), 311–35.
doi:10.1021/np200906s
Ossanai, L. T., Lourenço, G. A., Nencioni, A. L. a, Lebrun, I., Yamanouye, N., & Dorce, V. A. C. (2012). Effects of a toxin isolated from Tityus bahiensis scorpion venom
on the hippocampus of rats. Life Sciences, 91(7-8), 230–6.
doi:10.1016/j.lfs.2012.06.029
Pan, J., & Hink, W. F. (2000). Isolation and characterization of myrmexins, six isoforms of venom proteins with anti-inflammatory activity from the tropical ant,
Pseudomyrmex triplarinus. Toxicon, 38(10), 1403–13. doi:
10.1016/S0041-0101(99)00233-0
Pareja-Santos, A., Saraiva, T. C., Costa, E. P., Santos, M. F., Zorn, T. T., Souza, V. M. O., Lopes-Ferreira, M., & Lima, C. (2009). Delayed local inflammatory response induced by Thalassophryne nattereri venom is related to extracellular matrix
degeneration. International Journal of Experimental Pathology, 90(1), 34-43. doi:
10.1111/j.1365-2613.2008.00603.x
Piek, T., Duval, a, Hue, B., Karst, H., Lapied, B., Mantel, P., Nakajima, T., Pelhate, M., & Schmidt, J. O. (1991). Poneratoxin, a novel peptide neurotoxin from the venom of the ant, Paraponera clavata. Comparative Biochemistry and Physiology. C, Comparative Pharmacology and Toxicology, 99(3), 487–95. doi:
10.1016/0742-8413(91)90276-Y
Pluzhnikov, K., Nosyreva, E., Shevchenko, L., Kokoz, Y., Schmalz, D., Hucho, F., & Grishin, E. (1999). Analysis of ectatomin action on cell membranes. European Journal of Biochemistry / FEBS, 262(2), 501–6.
doi:10.1046/j.1432-1327.1999.00426.x
Rash, L. D., & Hodgson, W. C. (2002). Pharmacology and biochemistry of spider venoms. Toxicon, 40(3), 225–54. doi: 10.1016/S0041-0101(01)00199-4
Ribeiro, A. M., dos Santos, W. F., & Garcia-Cairasco, N. (2000). Neuroethological analysis of the effects of spider venom from Scaptocosa raptoria (Lycosidae:
Araneae) microinjected in the lateral ventricle of Wistar rats. Brain Research Bulletin, 52(6), 581–8. doi: 10.1016/S0361-9230(00)00300-2
Rodrigues, S. S. M., & Santos, J. L. M. (2012). Chemiluminometric determination of captopril in a multi-pumping flow system. Talanta, 96, 210–5.
Rogawski, M. A. (2006). Diverse mechanisms of antiepileptic drugs in the development pipeline. National Institute of Health, 69(3), 273–294. doi:
10.1016/j.eplepsyres.2006.02.004
Rosillo-de la Torre, A. (2014). Pharmacoresistant epilepsy and nanotechnology.
Frontiers in Bioscience, E6(2), 329. doi:10.2741/709
Sedat, J., Chau, Y., Mondot, L., Chemla, R., Lonjon, M., & Padovani, B. (2014). Is eptifibatide a safe and effective rescue therapy in thromboembolic events complicating cerebral aneurysm coil embolization? Single-center experience in 42 cases and review of the literature. Neuroradiology, 56, 145–153.
doi:10.1007/s00234-013-1301-3
Sitprija, V., & Suteparak, S. (2008). Animal toxins: an overview. Asian Biomedicine, 2(6), 451–457. Retrieved from http://imsear.hellis.org/handle/123456789/129885
Sousa, P. L., Quinet, Y., Ponte, E. L., do Vale, J. F., Torres, A. F. C., Pereira, M. G., & Assreuy, A. M. S. (2012). Venom’s antinociceptive property in the primitive ant
Dinoponera quadriceps. Journal of Ethnopharmacology, 8–11.
doi:10.1016/j.jep.2012.08.033
Szolajska, E., Poznanski, J., Ferber, M. L., Michalik, J., Gout, E., Fender, P., Baily, I., Dublet, B., & Chroboczek, J. (2004). Poneratoxin, a neurotoxin from ant venom. Structure and expression in insect cells and construction of a bio-insecticide.
European Journal of Biochemistry, 271(11), 2127–36.
doi:10.1111/j.1432-1033.2004.04128.x
Taxonomic List - Ants of All Antweb (Species) - AntWeb. (n.d.). Retrieved March 19,
2015, from
http://www.antweb.org/taxonomicPage.do?rank=species&project=allantwebants
Teixeira, V. F., Conceição, I. M., Lebrun, I., Nencioni, A. L. a, & Coronado Dorce, V. a. (2010). Intrahippocampal injection of TsTX-I, a beta-scorpion toxin, causes alterations in electroencephalographic recording and behavior in rats. Life Sciences, 87(15-16), 501–6. doi:10.1016/j.lfs.2010.09.007
Tenório, H. D. A., da Costa Marques, M. E., Machado, S. S., & Pereira, H. J. V. (2015). Angiotensin processing activities in the venom of Thalassophryne nattereri.
Toxicon, 98, 49–53. doi:10.1016/j.toxicon.2015.02.009
Thurman, D. J., Beghi, E., Begley, C. E., Berg, A. T., Buchhalter, J. R., Ding, D., Hesdorffer, D. C., Hauser, W. A., Kazis, L., Kobau, R., Kroner, B., Labiner, D., Liow, K., Logroscino, G., Medina, M. T., Newton, C. R., Parko, K., Paschal, A., Preux, P-M., Sander, J. W., Selassie, A., Theodore, W., Tomson, T., & Wiebe, S. (2011). Standards for epidemiologic studies and surveillance of epilepsy.
Epilepsia, 52 Suppl 7(1), 2–26. doi:10.1111/j.1528-1167.2011.03121.x
Torres, A. F. C., Huang, C., Chong, C.-M., Leung, S. W., Prieto-da-Silva, A. R. B., Havt, A., Quinet, Y. P., Martins, A. M. C., Lee, S. M. Y, & Rádis-Baptista, G. (2014). Transcriptome analysis in venom gland of the predatory giant ant
Dinoponera quadriceps: insights into the polypeptide toxin arsenal of
Vasconcellos, a, Santana, G. G., & Souza, a K. (2004). Nest spacing and architecture, and swarming of males of Dinoponera quadriceps (Hymenoptera, Formicidae) in a
remnant of the Atlantic forest in Northeast Brazil. Brazilian Journal of Biology = Revista Brasleira de Biologia, 64(2), 357–62. doi:
10.1590/S1519-69842004000200022
Vogel, C. W., Finnegan, P. W., & Fritzinger, D. C. (2014). Humanized cobra venom factor: Structure, activity, and therapeutic efficacy in preclinical disease models.
Molecular Immunology, 61(2), 191–203. doi:10.1016/j.molimm.2014.06.035
Warrell, D. A. (2012). Venomous bites, stings, and poisoning. Infeccious Disease Clinics of North America, 26(2), 207-23. doi: 10.1016/j.idc.2012.03.006
Whittington, C. M., Pepenfuss, A. T., Bansal, P., Torres, A. M., Wong, E. S. W., Deakin, J. E., Graves, T., Alsop, A., Schatzkamer, K., Kremitzki, C., Ponting, C. P., Temple-Smith, P., Warren, W. C., Kuchel, P. W., & Belov, Katherine (2008). Defensins and the convergent evolution of platypus and repitile venom genes.
Genome Research, 18(6), 986-94. doi: 10.1101/gr.7149808
Wong, E. S. W., & Belov, K. (2012). Venom evolution through gene duplications. Gene, 496(1), 1–7. doi:10.1016/j.gene.2012.01.009
Yuan, C., Liu, Z., Hu, W., Gao, T., & Liang, S. (2012). JZTX-XIII, a Kv channel gating modifier toxin from Chinese tarantula Chilobrachys jingzhao. Toxicon, 59(2), 265–
71. doi:10.1016/j.toxicon.2011.11.021
Zhao, R., Zhang, X.-Y., Yang, J., Weng, C.-C., Jiang, L.-L., Zhang, J.-W., Shu, X-Q., & Ji, Y.-H. (2008). Anticonvulsant effect of BmK IT2, a sodium channel-specific neurotoxin, in rat models of epilepsy. British Journal of Pharmacology, 154(5),
1116–24. doi:10.1038/bjp.2008.156
Zhao, R., Weng, C.-C., Feng, Q., Chen, L., Zhang, X.-Y., Zhu, H.-Y., Wang, Y., & Ji, Y.-H. (2011). Anticonvulsant activity of BmK AS, a sodium channel site 4-specific modulator. Epilepsy & Behavior : E&B, 20(2), 267–76.
3. OBJETIVOS
3.1 Objetivo Geral
O objetivo do presente trabalho foi verificar qual (is) fração (ões) isolada
(s) da peçonha da formiga Dinoponera quadriceps apresenta (m) potencial
efeito anticonvulsivante em modelo de crises induzidas por bicuculina quando
administrada em camundongos.
3.2 Objetivos Específicos
Verificar o efeito comportamental da administração intracerebral, em
camundongos, das frações isoladas da peçonha quando os animais são
expostos a um campo aberto.
Avaliar, em camundongos, o potencial efeito anticonvulsivante da
administração intracerebral das frações isoladas da peçonha através do
4. ARTIGO
Título: Pro and anticonvulsant effects of fractions isolated from Dinoponera quadriceps ant venom (Formicidae: Ponerinae)
Autores: Diana Aline Nôga Morais Ferreira1, Luiz Eduardo Mateus Brandão1, Fernanda Carvalho Cagni1, Delano Silva1, Dina Lília Oliveira Azevedo1, Arrilton Araújo1, Regina Helena da Silva2 e Alessandra Mussi Ribeiro3.
Filiações:
1Depto de Fisiologia, Universidade Federal do Rio Grande do Norte, Natal, RN,
Brasil.
2Depto de Farmacologia, 3Depto de Biociências, Universidade Federal de São
Paulo, São Paulo, SP, Brasil
Periódico: Journal of Ethnopharmacology – Qualis B1 (psicologia)
Pro and anticonvulsant effects of fractions isolated from Dinoponera quadriceps ant venom (Formicidae: Ponerinae)
DAMF Nôga1, LEM Brandão1, FC Cagni1, D Silva1, DLO. Azevedo1, A Araújo1,
RH Silva2, AM Ribeiro3
1Physiology Department, Federal University of Rio Grande do Norte, Natal, RN,
Brazil.
2Pharmacology Departament, 3Biosciences Department, Federal University of
São Paulo, São Paulo, SP, Brazil
Correspondence to: Alessandra M. Ribeiro, Departamento de Biociências,
UNIFESP, Rua Silva Jardim, 136, CEP 11015-020 - Santos, SP, Brasil. Tel.:
+55 13 38783700
Resumo
Relevância etnofarmacológica: As tocandiras são utilizadas em rituais de passagem para idade adulta na tribo indígena amazônica Sataré-Mawé
Objetivo do estudo: investigar o potencial anticonvulsivante de frações isoladas da peçonha de D. quadríceps em crises convulsivas induzidas pela BIC, bem como uma análise dos efeitos dessas frações no comportamento natural dos camundongos no campo aberto.
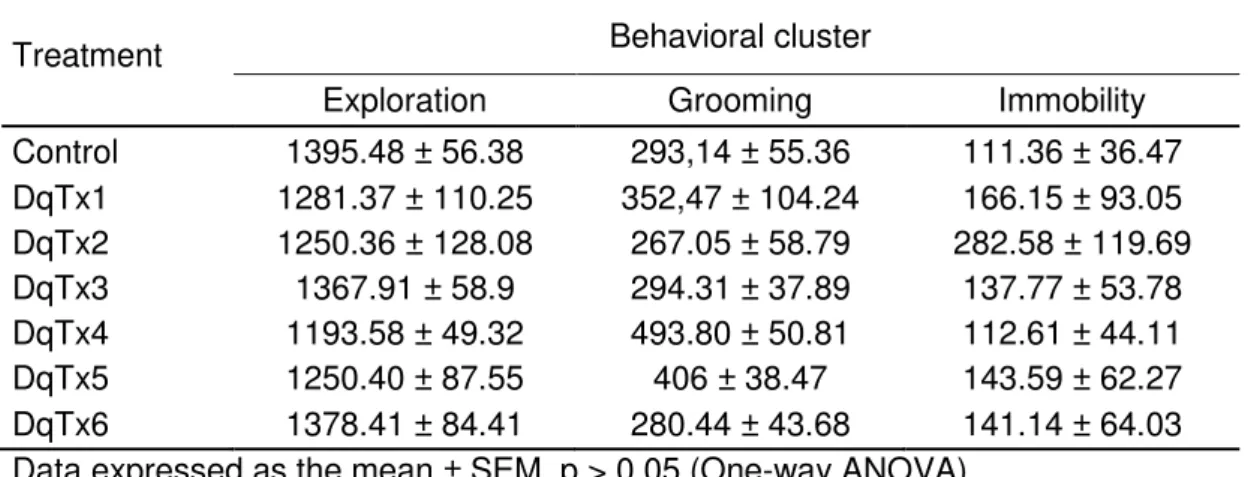
Materiais e Métodos: Os animais foram divididos em grupos, os quais receberam injeções (1 mg/ml i.c.v.) de seis frações distintas e tiveram seu comportamento geral observado no campo aberto durante 30 min. No segundo experimento, Os animais receberam as mesmas frações 20 min antes da administração de bicuculina (10 mg/ml). Em seguida, foi analisado o comportamento motor convulsivo desses animais durante 30 minutos no campo aberto.
Resultados: No primeiro experimento, não foram observadas alterações comportamentais. Já no segundo experimento, a administração prévia de DqTx1, DqTx3, DqTx4 e DqTx6 aumentou a latência para o desenvolvimento de crises tônico-clônicas. Além disso, todas as frações, exceto DqTx5, aumentaram a latência para a morte dos animais. Ainda, os melhores resultados foram obtidos com a fração DqTx6, que protegeu 62,5% dos animais testados contra o desenvolvimento de crises tônico-clônicas e 100% dos animais contra a morte.
Conclusões: As frações peptídicas isoladas da peçonha de D. quadríceps possuem um potencial terapêutico para o tratamento de convulsões. Porém, é necessária a determinação da estrutura e mecanismo de ação dos componentes ativos.
Abstract
Ethnophamacological relevance: The tocandiras ants are used in rituals of passage for adult age in the Sataré-Mawé tribe of Amazonian Indians.
Aim of the study: investigate the anticonvulsant activity of compounds isolated from D. quadriceps venom on seizures induced by BIC, as well as an analysis of its effects on spontaneous behavior in mice
Material and Methods: Animals were divided into groups, which received injections (1 mg/ml; i.c.v.) of six distinct venom fractions and had their general behavior analyzed for 30 min in the open field. In the second experiment, we carried out the same fractions injection protocol 20 min before the administration of bicuculline (10 mg/ml). immediately after, we analyzed
animals’ seizures behavior during 30 min in open field
Results: In the first experiment we did not observe behavioral alterations. Conversely, in the second experiment, previous administration of DqTx1, DqTx3, DqTx4 and DqTx6 increased latency for onset of tonic-clonic seizures. Moreover, all fractions, except DqTx5, increased latency to animals’ death. Yet, we obtained our best result with DqTx6 fraction, which protected 62,5% of tested animals from development of tonic-clonic seizures. Further, this fraction protected all tested animals from seizure episodes followed by death
Conclusions: Peptidic fractions isolated from D. quadriceps venom have an therapeutic potential for seizures treatment. However further work is needed to determine the structure and mechanism of action of the active compounds.
Introduction
Natural products comprise a immense chemical diversity and
architectural complexity that cannot be matched by synthetic molecules (Clardy
& Walsh, 2004; King, 2011). From this perspective the animals venoms stand
out because of the high specificity and potency of their toxins in relation to their
molecular targets of mammalian biological systems (King, 2011). These
venoms can exert noxious effects on several systems such as cardiovascular,
nervous, respiratory, renal, as well as skin and muscles. As consequence,
poisoning victims may experience pain, swelling, tissue necrosis, vomiting,
paralysis, fever, diarrhea, headaches, blurred sight, dizziness, hypotension,
hemorrhage and even death (Sitprija & Suteparak, 2008; Wong & Belov, 2012).
From another standpoint, these venoms can present benefic effects (de Souza
et al., 2014; Flight et al., 2009; Nunes et al., 2013; Ondetti et al., 1971;
Sheng-ming et al., 2014; T. Wang et al., 2014) or be used as pharmacological tools for
probing biochemical pathways and mechanisms (Mellor & Usherwood, 2004;
Morabito et al., 2014; Wang & Chi, 2004). Despite the remarkable potential of
the venoms their investigation and characterization remains underexplored.
Invertebrates through evolutionary process have incorporated a vast
range of neurotoxins in their venoms, and some compounds show high affinity
to receptors, ionic channels and transporters in the central nervous system
(CNS) (Beleboni et al., 2004; Mellor & Usherwood, 2004; Mortari et al., 2007;
Wang & Chi, 2004). Previous studies have demonstrated anticonvulsant effects
of toxin isolated from invertebrate venoms. Peptide fraction isolated from the
venom of the wasp Polybia paulista protected, at the dose of 350 g/animal,
pentylenotetrazol (PTZ) (do Couto et al., 2012). Further, the parawixin 2,
isolated from the venom of the spider Parawixia bistriata, when injected in the
right lateral ventricle, protected animals from seizures induced by PTZ,
picrotoxin, pilocarpine and kainic acid (Gelfuso et al., 2007), as well as inhibited
PTZ-induced kindling of rats when chronically administered for 27 days (Gelfuso
et al., 2013).
Seizures are the hallmark of epilepsy, a neurological disorder
characterized by an enduring predisposition to generate transient abnormal
excessive or synchronous neuronal activity, and by the neurobiologic, cognitive,
psychological, and social consequences of this condition (Fisher et al., 2005;
2014). This disorder affects about 65 million people worldwide (Thurman et al.,
2011) and approximately 30% of patients are resistant to pharmacotherapy
(Löscher, 1997; Rosillo-de la Torre, 2014). Furthermore, the patients who use
antiepileptic drugs frequently suffer from collateral effects ranging from gastric
discomfort to hepatic failure and aplastic anemia (Mortari et al., 2007). In this
context, invertebrate venoms appear as a possible source for new
anticonvulsant probes.
Recently, the venom from the giant ant Dinoponera quadriceps has
shown anticonvulsant effects. Lopes et al. (2013) demonstrated that
intraperitoneal administration of the crude venom increased the latency for
onset of seizures induced by PTZ in mice. Additionally, in our lab, after the
injection of the crude venom in the lateral ventricle of mice, we observed
procursive behavior and tonic-clonic seizures. Conversely, the prior
administration of the denatured venom protected the animals against
bicuculline. Taken together, the findings demonstrated that D. quadriceps
venom might be potential source of new pro- and anticonvulsants molecules. In
this context, the aim of present study was to investigate the anticonvulsant
activity of fractions isolated from D. quadriceps ant venom on seizures induced
by BIC, a GABAA antagonist, as well as an analysis of the effects on
spontaneous behavior in mice.
Material and Methods
Ants collection and fraction obtainment
D. quadriceps were collected in Nísia Floresta (6º5’S, 35º12’W), Rio Grande do Norte state, Brazil. Firstly, to collect the venom the specimens were
frozen at - 20 ºC and venom reservoirs were dissected. Content of two hundred
venom reservoirs were lyophilized and diluted in 0,1%TFA/H2O V/V. This
solution submitted to high performance liquid chromatography (HPLC - Hitachi)
purification using a Phenomenex C18 reverse phase column (2,6 x 25 cm, 12
m, 300 Å). Eluation was carried out with 0,1% TFA/H2O at a 100% gradient for
the first 10 minutes, followed by a linear gradient from 0 to 100% acetonitrile
(ACN) containing 0,1% TFA for 50 minutes. Eluates were monitored at 210 and
280 nm and the main fractions collected were lyophilized and resuspended in
1mL of distilled water. Six major fractions were obtained and named DqTx1,
Animals
Three-month-old male Swiss mice (30-50 g) were housed with free
access to food and water, in a number of 5-6 animals in plastic cages (20 x 30 x
13 cm), under conditions of controlled temperature (25 ± 1 ºC) and a 12 h
light/12 h dark cycle (lights on 6:30 a.m.). Animals were handled in accordance
to Brazilian law for the use of animals in research (Law Number 11.794), and all
the procedures were approved by the local ethics committee (protocol
035/2010). All efforts were made to minimize animal potential pain, suffering or
discomfort.
Surgery
Prior to surgery mice were anesthetized with intraperitoneal injection of
ketamine (100 mg/kg) plus xylazine (50 mg/kg). Afterwards, the animals were
positioned in the stereotaxic frame (Insight, Brazil) and the skull was exposed.
Stainless steel guide cannula (25 gauge, 8mm length) was implanted in the
lateral ventricle, and the stereotaxic coordinates were anterior-posterior = - 0.6
mm, medial-lateral = 1.1 mm, and dorsal-ventral = 1.0 mm from bregma
(Paxinos & Franklin, 2008). Guide cannula was anchored to the skull with dental
acrylic. At the end of the surgery the cannula was temporarily sealed with a
stainless-steel wire to avoid obstruction. Animals were given one week of