DINA LILLIA OLIVEIRA DE AZEVEDO
DECISÕES
COMPORTAMENTAIS EM
CONTEXTO DE
FORRAGEAMENTO DE
D
INOPONERA
QUADRICEPS
Natal/RN
DINA LILLIA OLIVEIRA DE AZEVEDO
DECISÕES COMPORTAMENTAIS EM CONTEXTO DE
FORRAGEAMENTO DE DINOPONERA QUADRICEPS
Natal/RN 2014
Tese apresentada ao Programa de Pós-graduação em Psicobiologia da Universidade Federal do Rio Grande do Norte para obtenção do título de Doutor.
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Azevedo, Dina Lillia Oliveira de.
Decisões comportamentais em contexto de forrageamento de
Dinoponera Quadriceps / Dina Lillia Oliveira de Azevedo. – Natal, RN, 2014.
80 f.: il.
Orientador: Prof. Dr. Arrilton Araújo.
Tese (Doutorado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Psicobiologia.
1. Formiga. – Tese. 2.Dinoponera quadriceps. – Tese. 3. Forrageio.– Tese. I. Araújo, Arrilton. II. Universidade Federal do Rio Grande do Norte. III. Título.
Título: Decisões comportamentais em contexto de forrageamento de Dinoponera
quadriceps
Autor(a): Dina Lillia Oliveira de Azevedo Data da defesa: 30 de setembro de 2014 Banca examinadora:
Jacques Hubert Charles Delabie Universidade Estadual de Santa Cruz – BA
Ana Maria Matoso Viana
Universidade Estadual do Norte Fluminense Darcy Ribeiro – RJ
Ronara de Souza Ferreira
Universidade Federal do Espírito Santo – ES
Wallisen Tadashi Hattori
Universidade Federal do Rio Grande do Norte – RN
Arrilton Araújo
AGRADECIMENTOS
À minha família. Ao professor Arrilton. Aos amigos.
Aos professores Fátima Arruda e Wallisen Hattori. Àqueles que colaboraram com a coleta de dados. Ao professor Gilberto Corso.
Ao Programa de pós-graduação em Psicobiologia À UFRN.
Ao ICMBio.
À FLONA de Nísia Floresta/RN. A Capes.
Ao CNPq e à FAPESB.
RESUMO
ABSTRACT
The behavioral decisions of animals do not occur randomly, because behaviors are adjusted to ensure the survival and reproduction of the animal. In this research, I examined behavioral decisions in the foraging context of the ant Dinoponera
quadriceps with regard to orientation, food avaliation and foraging dynamic to
SUMÁRIO
1. INTRODUÇÃO ... 10
2. OBJETIVOS ... 18
2.1- GERAL: ... 18
2.2- ESPECÍFICOS: ... 18
3.1.USO DE PISTAS QUÍMICA E VISUAL PELAS OPERÁRIAS DE DINOPONERAQUADRICEPS NA ORIENTAÇÃO PARA O NINHO E O ALIMENTO ... 19
3.2.SIZE, VOLUME AND WEIGHT EFFECTS ON FOOD DISCRIMINATION BY DINOPONERA QUADRICEPS WORKERS ... 39
3.3.FORAGING DECISIONS OF A SOLITARY FORAGER ANT ARE THE PRODUCT OF AUTOSTIMULATION, NOT SOCIAL FACILITATION ... 53
4. DISCUSSÃO GERAL E CONCLUSÕES ... 70
1. INTRODUÇÃO
Um animal não executa um comportamento de forma aleatória. Ele precisa fazer o comportamento no tempo e lugar certos. Por isso, a maioria dos comportamentos é adaptada para superar os acasos e ajudar os animais a sobreviver e reproduzir (Manning & Dawkins, 1992). As atividades diárias fora do local de abrigo trazem riscos como a predação, que comprometem a sobrevivência dos indivíduos que desempenham tais tarefas. Porém, em teoria, os benefícios devem superar os custos, uma vez que os indivíduos continuam enfrentando os riscos diariamente.
A fim de minimizar os riscos, os animais fazem uso de estratégias que os auxiliam no aproveitamento máximo de tempo e energia, principalmente na atividade de forrageio. A decisão de um forrageador, entre permanecer na atividade ou retornar ao abrigo, pode ser estruturada em relação ao tempo gasto na área de forrageio. Entretanto, esta hipótese induz ao erro, se não existir ligação entre tempo de permanência e quantidade de alimento adquirido (Stephens & Krebs, 1986).
A base do sucesso ecológico dos insetos sociais não é a inovação em seus métodos de obtenção de energia do ambiente, mas na escala de organização de suas tarefas (Oster & Wilson, 1978). Uma maneira dos insetos sociais enfrentarem a complexidade do ambiente é o uso de critérios de decisão inteligente ao nível individual. Estes critérios não requerem que uma formiga, por exemplo, faça alguma avaliação complexa e precisa de todos os parâmetros do ambiente (Detrain & Deneubourg, 2002).
estratégia adotada deve representar o melhor balanço executável de custos e benefícios, que maximizam o lucro energético líquido (Detrain & Deneubourg, 1997). Forrageadores solitários exploram uma proporção maior de áreas disponíveis do que forrageadores em grupo, porque várias áreas podem ser exploradas concomitantemente por forrageadores independentes (Beauchamp, 2005). A interdependência econômica mostra que a recompensa através de uma estratégia de forrageio depende, simultaneamente, do comportamento de todos os competidores (Giraldeau & Caraco, 2000).
Insetos sociais são muito utilizados como modelo para estudos sobre estratégias de forrageio. Geralmente, os escolhidos são os chamados eusociais, que incluem todas as formigas e algumas abelhas e vespas (Hymenoptera) e, todos os cupins (Blattodea, Isoptera). Os insetos eusociais podem ser distinguidos como um grupo por possuírem três características em comum: cooperação no cuidado dos jovens, sobreposição de pelo menos duas gerações capazes de contribuir para a colônia e divisão reprodutiva do trabalho (Wilson, 1971). Esta última característica é representada por castas especializadas que desempenham tarefas específicas dentro da colônia. Existem duas castas principais: rainhas, cuja função é a reprodução e, operárias, que realizam todas as tarefas da colônia (Wilson, 1971). As operárias executam apenas um número pequeno de tarefas por vez, o que minimiza os erros possíveis e organiza o trabalho da colônia (North, 1996).
ele, fornecem tais informações (Stephens, Brown & Ydenberg, 2007). Os indivíduos diferem em relação à informação individual e ao conhecimento da informação de outros
(Couzin, 2008). Em colônias de insetos sociais, os indivíduos constituiriam as ‘células
receptoras’ de um superorganismo e diferenças individuais na avaliação do ambiente poderiam contribuir para a tomada de decisão dentro do grupo (Chittka, Skorupski & Raine, 2009).
Os processos de orientação raramente são dependentes de uma única modalidade sensorial. As formigas podem reagir a vários odores e perceber as heterogeneidades olfativas do ambiente e usá-las para orientação (Ehmer, 1999). As marcas químicas podem ser importantes no auxílio ao retorno da operária à mesma área. Também podem ter importância na fidelidade da operária a partes da área de forrageio da colônia (Carroll & Janzen, 1973). A trilha de odor é um meio de estabilizar a rota de uma formiga sobre várias viagens (Collett & Collett, 2002). Já as pistas visuais são, em geral, utilizadas como pontos de referência. As formigas adquirem o conhecimento de seus pontos de referência nas proximidades do ninho ou ao longo de rotas fixas (Collett, Graham & Harris, 2007). Os pontos de referência aprendidos guiam a escolha da trilha a ser seguida (McLeman, Pratt & Franks, 2002).
Formigas do gênero Atta utilizam pistas visuais como um auxílio adicional na ausência da trilha química (Vilela, Jaffé & Howse, 1987). Cataglyphis fortis consegue associar a entrada do ninho e um odor do ambiente (Steck, Hansson & Knaden, 2009).
Melophorus bagoti é capaz de discriminar estímulos visuais diferentes e associá-los
experiência das operárias. As operárias inexperientes seguem trilha de feromônio, enquanto as operárias experientes usam preferencialmente pontos de referência visuais, mas as trilhas de feromônios são mais importantes (Harrison, Fewell, Stiller & Breed, 1989). Em Dinoponera gigantea, as pistas principais parecem ser dadas por pontos de referência e, as trilhas químicas são dispensáveis (Fourcassié, Henriques & Fontella, 1999).
Pontos de referência familiares não são desligados do contexto dentro do qual eles tenham sido adquiridos e não são unidos de forma generalizada. Assim, os pontos de referência servem como pistas para as formigas e não como informações iguais a um mapa (Wehner et al., 2006). As formigas que procuram alimento solitariamente podem ater-se exclusivamente na integração do caminho ou na memória espacial para se orientar em seu ambiente. Além de pontos de referências obtidos da configuração ambiental, a polarização da luz pode orientar através de informação sobre a posição espacial da superfície e revelar a presença de objetos cromaticamente bem camuflados (Shashar, Cronin, Wolff & Condon, 1998).
Seguir as mesmas rotas seria os resultados da aprendizagem sobre o local e a disponibilidade de alimento através do uso de pontos familiares na paisagem, que permitiriam às operárias reduzir a distância da viagem e tempo de procura por alimento (Collet 1996) e, todos eles permitem que as forrageadoras aperfeiçoem sua atividade extra-ninho. Processos de aprendizagem relacionados aos recursos podem também estar envolvidos na persistência da rota de fidelidade e memória (Traniello, 1989). Três atributos básicos de aprendizagem variam amplamente entre e dentro das espécies: a habilidade para aprender uma dada tarefa, a taxa de aprendizagem de uma tarefa e o melhor desempenho adquirido depois da prática extensiva (Dukas 2008). Acredita-se que a aprendizagem é uma adaptação para enfrentar a imprevisibilidade do ambiente (Alcock 2005).
Uma característica imprevisível do ambiente é a distribuição do recurso alimentar. No processo evolutivo, as formigas desenvolveram estratégias de forrageio, determinadas por qualidades individuais e características coletivas da colônia, como também por características dos itens alimentares explorados (Traniello, 1989). As formigas podem se especializar de forma diferente de acordo com o tamanho e a densidade de recursos (Kaspari, 2000). Considerando que presas maiores têm mais energia, o tamanho da presa é uma limitação à coleta qualquer que seja a estratégia (Cerdá, 1988). Na espécie Pheidole pallidula, o padrão de busca muda com o tamanho da presa, forrageio individual para presas pequenas e recrutamento para presas grandes (Detrain & Deneubourg, 1997), o mesmo padrão foi descrito para Gnamptogenys
sulcata (Daly-Schveitzer, Beugnon & Lachaud, 2007).
carregadoras de presa única, as forrageadoras devem estabelecer um tamanho mínimo de presa, quando estas são abundantes (Stephens et al., 2007). Dorymyrmex goetschi é capaz de transportar alimentos de peso equivalente a 3,5 vezes sua massa corpórea (Torres-Contreras & Vásquez, 2004). Por outro lado, a espécie Cataglyphis iberica limita o tamanho da presa a seu próprio tamanho (Cerdá, 1988).
Forrageadores individuais diferem na duração e no número de viagens de forrageio (Beverly, McLendon, Nacu, Holmes & Gordon (2009). O aumento na saída das operárias pode estar relacionado ao período de atividade das mesmas (Hölldobler & Wilson, 1990). Entretanto, se uma formiga retorna com um alimento volumoso para o padrão comumente coletado pode provocar uma taxa crescente de saída de forrageadoras do ninho (Carroll & Janzen, 1973). Em adição às mudanças no repertório comportamental, a regulação social pode também induzir um aumento no número de indivíduos ativos ou na intensidade da atividade individual (Sempo & Detrain, 2010). A facilitação social é a forma fundamental de um indivíduo influenciar no comportamento de outros (Zajonc, 1965).
Outra possibilidade na regulação da dinâmica de atividade de uma colônia é a autoestimulação, que é a possibilidade da formiga se comunicar com ela mesma, é como se a experiência da operária individual servisse de estímulo para continuar a atividade de forrageio, algo sugerido por Hölldobler e Wilson (1990). Estas duas estratégias de regulação da atividade estão relacionadas à questão da tomada de decisão. Em colônias grandes, as decisões individuais parecem ser baseadas na informação disseminada e cuidadosamente amostrada e, em colônias pequenas, as operárias tendem a serem tomadoras de decisão independentes (Franks, 1999). A formiga coletora de sementes,
estimulada pelo retorno de forrageadores bem sucedidos (Schafer, Holmes & Gordon 2006).
Dentro da família Formicidae, há a subfamília Ponerinae, que se distribui pelo mundo, porém, é mais abundante nas regiões tropicais (Caetano, Jaffé & Zara 2002). Ponerines são notáveis por combinar organização social, geralmente, simples com uma alta diversidade de características morfológica, ecológica e comportamental, derivadas (Schmidt & Shattuck 2014). As formigas desta subfamília possuem um ferrão funcional, com o qual paralisam ou matam a sua presa (Caetano et al. 2002). Em geral, elas são predadoras, mas pode também se alimentar de nectário extrafloral, honeydew, secreções de larvas de lepidópteros e sementes ricas em lipídios. Os modos de forrageio se estendem de solitário a grupo de caçadoras e, de predadores especialistas a generalistas (Fourcassié & Oliveira 2002).
As espécies do gênero Neotropical Dinoponera Roger (1861) estão entre as maiores formigas conhecidas. A distribuição do gênero está restrita à América do Sul. A espécie Dinoponera quadriceps é endêmica da área brasileira conhecida como
‘polígono das secas’ (Kempf 1971). Dinoponera quadriceps é uma formiga sem rainha, consequentemente todas as operárias são capazes de reproduzir. Todavia, sua reprodução está sob controle hierárquico, operárias com postos de dominância diferentes têm perfis comportamentais distintos e o posto se correlaciona com a atividade de postura de ovos (Monnin & Peeters 1999). A colônia se divide ou multiplica pelo processo de fissão (Medeiros & Araújo 2014).
Atlântica, a atividade de forrageio é predominantemente diurna (Medeiros, Azevedo, Santana, Lopes & Araújo 2014). As operárias deixam a colônia com a velocidade de deslocamento lenta e iniciam o forrageio logo após a saída. Quando encontram algum item alimentar retornam rapidamente para a colônia (Araújo & Rodrigues 2006, Azevedo, Medeiros & Araújo 2014). A duração da viagem da D. quadriceps indiretamente demonstra o nível de investimento de uma operária na atividade extra-ninho, especialmente naquelas relacionadas à busca e coleta de alimento (Araújo & Rodrigues 2006). Ainda, as operárias apresentam fidelidade direcional (Azevedo et al. 2014), como a espécie Neoponera apicalis (Fresneau 1985).
D. quadriceps é um bom modelo para estudos de decisões comportamentais,
2. OBJETIVOS
2.1- GERAL:
Examinar as decisões comportamentais no contexto de forrageamento em relação às pistas de orientação, discriminação do alimento e atividade individual das operárias, na formiga poneromorfa Dinoponera quadriceps.
2.2- ESPECÍFICOS:
Verificar quais pistas de orientação são utilizadas pela D. quadriceps em direção ao ninho e ao alimento. (Primeiro Manuscrito)
Hipótese: D. quadriceps utiliza pistas visual e química para localizar ambos, ninho e local do alimento.
Avaliar os efeitos das variáveis: tamanho, peso e volume, na discriminação do alimento. (Segundo Manuscrito)
Hipótese: Tamanho, peso e volume têm efeito na escolha do alimento pelas operárias.
Investigar se a atividade de forrageio individual de cada operária influencia na dinâmica de forrageio da colônia. (Terceiro Manuscrito)
Hipóteses: A atividade de forrageio de uma operária de D. quadriceps não influencia outras operárias a forragearem.
3. RESULTADOS
Manuscrito a ser submetido após a defesa ao periódico Myrmecological News, fator de impacto 1.582, qualis da CAPES – A1 (Biodiversidade).
3.1. USO DE PISTAS QUÍMICA E VISUAL PELAS OPERÁRIAS DE
DINOPONERA QUADRICEPS NA ORIENTAÇÃO PARA O NINHO E O
ALIMENTO
Dina L. O. Azevedo a, Pablo F. G. A. Santos a, Gilberto Corso b & Arrilton Araújo a,1
a
Laboratório de Biologia Comportamental, Programa de Pós-graduação em Psicobiologia, Universidade Federal do Rio Grande do Norte, Caixa Postal 1511, 59078-970, Natal-RN, Brasil.
b
Departamento de Biofísica e Farmacologia, Universidade Federal do Rio Grande do Norte.
1
Autor de correspondência
RESUMO
Em ambiente heterogêneo, a orientação é um problema que os animais precisam resolver. No deslocamento na área de uso, as formigas podem utilizar pistas química, visual, magnética e/ou solar. Neste estudo analisamos as pistas de orientação utilizadas pelas operárias de Dinoponera quadriceps. Utilizamos um labirinto branco com dezessete compartimentos. As formigas permaneciam dez minutos dentro do labirinto em cada sessão. Seis tratamentos foram realizados, manipulando pistas química e visual. Os resultados mostraram que esta espécie utiliza ambas as pistas de forma combinada, para chegar ao alimento e retornar ao ninho. As pistas são usadas em ordem de importância hierárquica. A pista primária é a química. As pistas visuais ajudam a melhorar o desempenho das operárias nas rotas.
INTRODUÇÃO
Todos os organismos móveis, quando interagem com seus ambientes, gastam parte do seu tempo se orientando (Jander 1975). Orientação num ambiente heterogêneo é um dos problemas básicos de sobrevivência que a maioria dos animais precisa resolver (Jaffé et al. 1990). A habilidade de orientação de muitos animais, capazes de evitar ou retornar a locais específicos na área de uso, envolve algum tipo de memória espacial (Benhamou et al. 1990). Contudo a escolha das rotas para um local de alimentação ou ninho, não necessariamente reflete a posse de um conhecimento espacial como mapa (Collett et al. 2007).
Para se deslocarem de um ponto a outro, as formigas podem seguir trilhas químicas ou heterogeneidades do substrato, ou usar a memória da configuração de pontos de referência terrestres ao redor do ninho (Hölldobler & Wilson 1990). Diversos estudos revelaram que as formigas podem usar variadas pistas de orientação. Um exemplo é a Cataglyphis noda que pode usar pistas magnéticas como referência para definir a localização do ninho (Buehlmann et al. 2012). A formiga C. fortis pode aprender a associar a entrada do ninho com um odor do ambiente (Steck et al. 2009).
Melophorus bagoti é capaz de discriminar estímulos visuais diferentes (Schwarz &
Cheng 2011). A formiga cortadeira Atta colombica pode seguir orientação magnética e solar na ausência de pistas química e visual (Banks & Srygley 2003). Grande parte dos estudos sobre orientação nas formigas é realizado com formigas do deserto e/ou formigas que fazem recrutamento.
das formigas, podem mostrar os caminhos aprendidos através das pistas de orientação (Nicholson et al. 1999). Desta forma, o uso de labirintos experimentais é um método apropriado para estudos sobre orientação (Jaffé et al. 1990; Macquart et al. 2008; Cammaerts & Lambert 2009).
Neste estudo, o objetivo foi analisar as pistas de orientação utilizadas pela formiga Dinoponera quadriceps em direção ao ninho e ao alimento. D. quadriceps é uma espécie que pode ser encontrada em Caatinga e Mata Atlântica (Kempf 1971), forrageia solitariamente e não apresenta qualquer evidência de usar recrutamento (Araújo & Rodrigues 2006; Azevedo et al. 2014). As operárias se movem devagar ao saírem do ninho, realizam um caminho em zigue-zague enquanto busca alimento e se encontrarem alimento elas retornam ao ninho quase em linha reta (Araújo & Rodrigues 2006; Azevedo et al. 2014); e elas apresentam fidelidade direcional (Azevedo et al. 2014). De acordo com estas características, trabalhamos com a hipótese que D.
quadriceps utiliza pistas visual e química para localizar ambos, ninho e local do
alimento. Nossa predição é que pista visual reforça o uso da pista química.
MATERIAL E MÉTODO
Sujeitos
Cinco colônias de Dinoponera quadriceps (Hymenoptera, Formicidae), coletadas no campus da Universidade Federal do Rio Grande do Norte (UFRN). A
coletados animais foi permitida pelo Instituto Chico Mendes de Biodiversidade (ICMBio), sob as licenças nº 10602-1 e 12547-1. As operárias foram marcadas individualmente, antes de iniciar o estudo, com uma etiqueta com um código alfanumérico, colada no tórax, utilizando cola à base de éster de cianoacrilato (Corbara et al. 1986). As etiquetas tinham cores distintas para cada colônia.
O estudo foi desenvolvido no Laboratório de Biologia Comportamental, na Universidade Federal do Rio Grande do Norte (UFRN), Natal, Brasil. O laboratório era mantido sob a temperatura de 25±2°C, umidade 67±3% e ciclo claro-escuro de 12:12 h. As colônias foram mantidas em ninhos feitos de acrílico (50x50x20 cm) e utilizado vermiculita como substrato. Os ninhos foram conectados a uma arena de forrageio (100x50 cm), onde era disponibilizado alimento três vezes por semana e água ad
libitum. A dieta era composta de larvas e adultos de Tenebrio molitor e frutos.
Registro comportamental
Inicialmente, nós observamos com o método ad libitum as cinco colônias durante uma semana na arena de forrageio, para identificar os indivíduos que saiam do ninho e realizavam atividade externa. Durante todos os tratamentos experimentais registramos os comportamentos:
Autolimpeza: o indivíduo passa o primeiro par de pernas na probóscide e em seguida este mesmo par de pernas é passado sobre as antenas, e/ou cabeça, e/ou abdômen, e/ou em todas as partes anteriormente citadas;
Marcação química: o indivíduo esfrega o abdômen no substrato com um movimento rápido semelhante a um zigue-zague, ou com um movimento contínuo e retilíneo.
(Martin & Bateson 1994). Também era registrada a sequência do caminho realizado e se as operárias chegavam até o compartimento do labirinto onde estava o alimento.
Coleta de dados
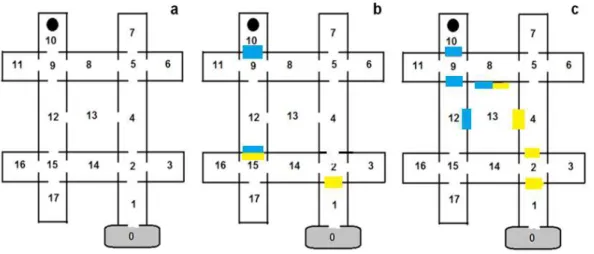
Os experimentos ocorreram de janeiro a março de 2013, após esse período, as gravações foram assistidas por um período de seis meses não consecutivos. O aparato experimental era um labirinto de madeira revestida com fórmica branca (80x80x15 cm) com dezessete compartimentos (Figura 1). No compartimento de entrada do labirinto havia uma caixa preta (20x10 cm), onde cada indivíduo ficava antes de ter acesso ao labirinto e para onde as operárias poderiam retornar a qualquer momento durante os testes. O labirinto foi coberto com tecido branco que impedia os indivíduos de visualizar qualquer área externa a ele. Para a filmagem dos testes acoplamos uma filmadora Sony ExmorR-HDR-AS10, a 1m de altura do centro do labirinto.
Os tratamentos realizados foram os seguintes:
Tratamento 1: o labirinto não recebia nenhum tipo de manipulação, e o odor das formigas testadas permaneciam no labirinto e não havia qualquer referência visual (Figura 1a).
Tratamento 2: o labirinto era limpo com álcool 70% após cada formiga ser retirada, impedindo a permanência dos odores das formigas e, novamente, sem pistas visuais (Figura 1a).
Tratamento 4: as pistas visuais na parte superior eram mantidas no mesmo local e o labirinto era limpo com álcool 70% após cada formiga ser retirada (Figura 1b).
Tratamento 5: neste tratamento as pistas visuais eram frontais e mantinha-se o odor das formigas. Os cartões coloridos foram colocados na parede dos compartimentos. Os cartões foram mantidos nos mesmos locais, escolhidos aleatoriamente, em todos os testes deste tratamento e do tratamento seguinte (Figura 1c).
Tratamento 6: os cartões coloridos continuaram na parede dos compartimentos como pistas visuais frontais e para retirar o odor das formigas, o labirinto era limpo com álcool 70% após cada formiga ser testada (Figura 1c).
Figura 1. Esquema do labirinto utilizado nos experimentos com a numeração dos compartimentos usada para descrever a sequência da localização das formigas. O círculo preto no compartimento 10 indica o local onde o alimento era disponibilizado. O compartimento 0 (cinza) representa a caixa preta conectada ao labirinto. As marcas retangulares azuis e amarelas indicam onde foram colocados os cartões coloridos que representavam as marcas visuais superiores (colocados na parte de cima das paredes indicadas) (b) e frontais (colocados nas paredes dos compartimentos indicados) (c), respectivamente.
durante seis dias e cada formiga era testada sozinha três vezes dentro dos seis dias, havendo um intervalo de dois dias entre as sessões de cada indivíduo em todos os tratamentos. Desta forma, considerando os seis dias, no 1º, 3º e 5º uma parte das formigas era testada, e no 2º, 4º e 6º outra parte das formigas passava pelo teste. A ordem em que as formigas eram testadas foi aleatória, bem como a ordem de liberação de cada formiga no labirinto. Cada sessão de teste tinha 10 min de duração e todas as sessões foram filmadas e o registro comportamental feito posteriormente. Ao final do teste a formiga era retirada do labirinto qualquer que fosse o compartimento em que ela se encontrasse.
Análise estatística
Todos os testes foram realizados comparando-se os tratamentos. Nós aplicamos a técnica de reamostragem do Monte Carlo para realizar as análises referentes aos comportamentos de autolimpeza e marcação química, a quantidade de vezes que as formigas chegaram ao compartimento do alimento (10), e o número de repetições das sequências específicas que segue: Sequências de ida para o alimento:
2→4→5→8→9→10, 2→4→13→12→9→10, 2→14→15→12→9→10; Sequências de
retorno ao ninho: 12→15→14→2→1→0, 8→5→4→2→1→0, 12→13→4→2→1→0.
comparação. O valor p associado a cada par de tratamentos é calculado comparando o intervalo de confiança dos tratamentos.
A probabilidade de entrar em um dado compartimento foi comparada com ANOVA One Way com pós-teste de Tukey HSD. O objetivo desta análise foi verificar a homogeneidade na ocupação dos compartimentos por parte das formigas. Para isso nós computamos a entropia de ocupação dos compartimentos (Feynman et al. 1964). A máxima entropia corresponde à situação na qual a formiga se encontraria uniforme, sem qualquer viés, em todos os compartimentos, ou seja, a probabilidade de se encontrar a formiga é a mesma para todos os casos. Além disto, computamos uma entropia mais realista que chamamos de entropia modelo, onde a probabilidade de ocupação dos compartimentos é proporcional ao seu número de acessos, por exemplo, para o cálculo da entropia modelo a probabilidade de uma formiga estar no compartimento 2 é quatro vezes mais do que no compartimento 3 que tem apenas um único acesso. Toda a avaliação estatística foi realizada com o programa R (R version 3.1.1, The R Foundation for Statistical Computing, 2014) e, nós consideramos o nível de significância de 5% bi-caudal.
RESULTADOS
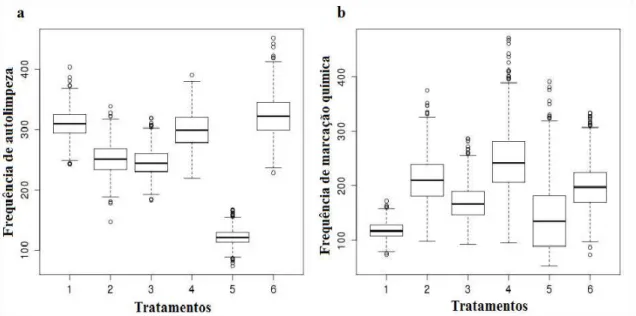
O registro do comportamento de marcação química também variou entre os tratamentos (Tabela 1). As formigas fizeram mais marcação química nos tratamentos em que ocorria a limpeza do labirinto com álcool (Figura 2b). Este resultado reforça o resultado da autolimpeza. As formigas se limpam mais na ausência do odor de outras formigas e aumentam a marcação para ativar o odor. Isto demonstra que o odor de outras formigas deve ser um fator importante para o deslocamento no ambiente natural.
Figura 2. Comparação da frequência de registro dos comportamentos de autolimpeza (a) e marcação química (b) nos tratamentos. Os tratamentos 1, 3 e 5 ocorreram na presença do odor; os tratamentos 2, 4 e 6 ocorreram na ausência do odor; os tratamentos 3 e 4 tinham as marcas visuais superiores e os tratamentos 5 e 6 tinham as marcas visuais frontais. A linha dentro do boxplot representa a mediana, o box representa os quartis e as linhas tracejadas representam os valores mínimo e máximo.
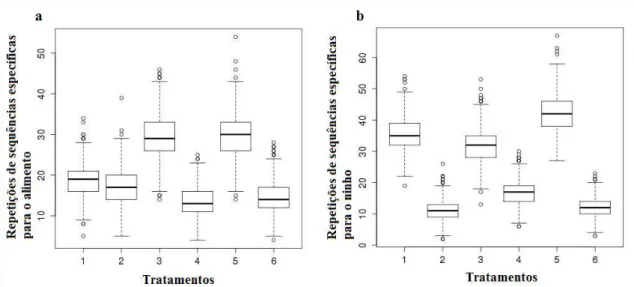
retorno ao ninho reforçaram o uso da pista química concomitante com pistas visuais frontais e superiores, respectivamente (Figura 3b).
Figura 3. Comparação entre os tratamentos das repetições de sequências específicas de ida ao alimento (a) e retorno ao ninho (b). Os tratamentos 1, 3 e 5 ocorreram na presença do odor; os tratamentos 2, 4 e 6 ocorreram na ausência do odor; os tratamentos 3 e 4 tinham as marcas visuais superiores e os tratamentos 5 e 6 tinham as marcas visuais frontais. A linha dentro do boxplot representa a mediana, o box representa os quartis e as linhas tracejadas representam os valores mínimo e máximo.
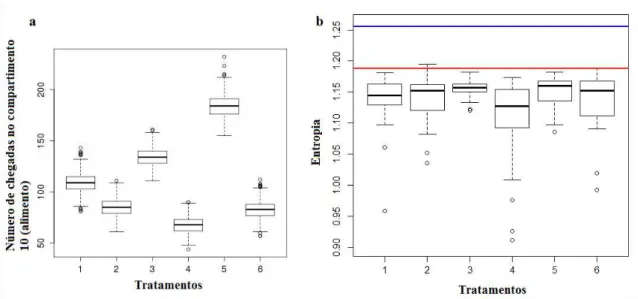
A entropia foi utilizada para verificarmos se a ocupação dos compartimentos ocorreu de uma forma uniforme ou apresentou tendência à ocupação de certos compartimentos em relação a outros. A análise revelou uma diferença entre os tratamentos (F=3,82, N=33, df=5, p=0,0025), especificamente entre os tratamentos 4 x 3 (p=0,0038) e 5 x 4 (p=0,0171) (Figura 4b). A entropia no tratamento 4 foi a menor. Ela indica que neste tratamento as formigas ou ocuparam menos compartimentos ou ficaram paradas dentro de um compartimento ou ocuparam mais vezes os mesmos compartimentos, ou seja, elas não se deslocaram muito dentro do labirinto. Este resultado corrobora os resultados encontrados na análise da repetição das sequências específicas. No geral todas as entropias foram menores à entropia modelo, demonstrando que o movimento das formigas não foi aleatório, que era um movimento ordenado.
Análises Tratamentos Valor-p
Frequência de Autolimpeza
1 x 2 1 x 3 1 x 5 2 x 5 3 x 5 4 x 5 6 x 2 6 x 3 6 x 5
0,047 0,024 < e-05 4e-05 < e-05 < e-05 0,045 0,026 < e-05 Frequência de Marcação química
2 x 1 4 x 1 6 x 1
0,014 0,006 0,021 Repetições de sequências específicas para o alimento
(compartimento 10)
3 x 1 3 x 2 3 x 4 3 x 6 5 x 1 5 x 2 5 x 4 5 x 6
0,047 0,029 0,004 0,008 0,040 0,024 0,003 0,007 Repetições de sequências específicas para o ninho
(compartimento 0)
1 x 2 1 x 4 1 x 6 3 x 2 3 x 4 3 x 6 5 x 2 5 x 4 5 x 6
1,4e-05 0,002 3,7e-05 0,000 0,009 0,000 < e-05 0,000 < e-05 Número de chegadas ao compartimento do alimento (10)
1 x 2 1 x 4 1 x 6 3 x 1 3 x 2 3 x 4 3 x 6 5 x 1 5 x 2 5 x 3 5 x 4 5 x 6
DISCUSSÃO
Os resultados mostraram que D. quadriceps faz uso de uma combinação de pistas para se deslocar. As pistas parecem seguir uma ordem hierárquica de importância. As decisões dos indivíduos em continuar se deslocando, seja na direção do alimento seja para o ninho, levam em consideração, primariamente, o odor e em seguida, as pistas visuais frontais e superiores.
A autolimpeza é um comportamento que pode ser observado a qualquer momento na atividade externa de D. quadriceps. Ele pode acontecer em diversos contextos, como após encontrar uma companheira de ninho, depois de uma interação agonística e em algumas paradas durante o forrageio (dados não publicados). Tanto a observação em ambiente natural como no labirinto demonstra que a percepção dos odores é importante nas decisões comportamentais durante o forrageio, pois, estes odores podem estar relacionados à orientação. Em geral, as formigas têm o sentido do olfato desenvolvido, então é possível assumir que elas percebem muitos odores do ambiente em adição aos feromônios (Ehmer 1999). O ambiente proporciona pontos de referência olfatórios eficazes (Steck et al. 2009).
de material químico pelas operárias de D. quadriceps tem a provável função de estabelecer trilhas individuais. Isto também foi sugerido para D. gigantea, apesar da pista química parecer dispensável nesta espécie (Fourcassié et al. 1999). Recentemente outro estudo com D. quadriceps sugeriu que o comportamento de marcação química esteja relacionado à delimitação de um território (Medeiros & Araújo 2014). Neste estudo, nós verificamos que a pista química parece ser indispensável e estabelecida de forma individual e persistente.
Em geral, estudos sobre orientação avaliam as pistas utilizadas pelas formigas para voltar ao ninho. Porém, um forrageador aprende a localizar pontos de referência ao longo da rota e seu caminho depende da familiarização com a área (McLeman et al. 2002). Dinoponera quadriceps alcançou o local do alimento com maior frequência, uma vez as pistas visuais incluídas. As pistas visuais localizadas à frente foram as que melhoraram o desempenho dos indivíduos. A visualização de objetos frontais pode ajudar os insetos, porque eles podem distinguir o que está próximo, sendo apropriados para guiá-los (Collett 1996). As operárias de D. quadriceps olham para frente, mais frequentemente, quando estão explorando o ambiente, embora em algumas ocasiões elas mudem a posição da cabeça em direção ao dossel (observação pessoal). O uso de pontos de referência frontais para guiar na direção do alimento já foi descrito para Formica
rufa (Nicholson et al. 1999). Ao contrário, operárias de Myrmica ruginodis usam
exclusivamente pontos de referência que estão acima delas (Cammaerts et al. 2012). Os caminhos percorridos dentro do labirinto pelas operárias de D. quadriceps mostraram que elas respondem diferente às pistas química e visual. Na presença de pistas visuais superiores ou frontais, mas na ausência da pista química, elas diminuíram o número de visitas aos compartimentos do labirinto. Desta forma sugerimos que D.
destas pistas. A pista química seria o suporte principal da orientação e, as pistas visuais frontais e superiores, respectivamente, aumentam a eficiência da orientação, mas como fontes secundárias de informação. A orientação baseada em pistas visuais pode ser mais estável ao longo do tempo e, provavelmente, aumenta a velocidade de forrageio (Harrison et al. 1988). Em Paraponera clavata o uso de pistas visual e de odor muda com a experiência das operárias (Harrison et al. 1988). As operárias das formigas cortadeiras Atta cephalotes, Atta laevigata e Acromyrmex octospinosus se orientam pelo odor com a ajuda adicional de pistas visuais (Vilela et al. 1987). Trilhas de feromônio e informação visual aprendida são importantes para guiar forrageadoras de Lasius niger aos locais de alimento previamente encontrado (Evison et al. 2008). Por sua vez, as operárias de Myrmica sabuleti respondem preferencialmente a odores do que a pistas visuais (Cammaerts & Rachidi 2009).
O ambiente natural de D. quadriceps fornece pontos de referência visual em abundância. As formigas, provavelmente, adquirem a maior parte do conhecimento sobre os pontos de referência, quando estão próximas do ninho ou em rotas fixas (Collett et al. 2007). Forrageadoras buscando o caminho correto podem mudar suas direções, brevemente, para checar a informação adquirida do ponto de referência (Cammaerts & Lambert 2009). Os resultados dos testes de comparação de sequências específicas e da entropia sugerem o aprendizado das pistas e, um movimento ordenado durante a exploração da área de uso individual, respectivamente. Já foi demonstrado que as operárias de D. quadriceps apresentam fidelidade direcional (Azevedo et al. 2014).
Neste estudo, foi possível colocar em evidência que as operárias de D.
quadriceps usam pistas química e visual de forma combinadas. Quando elas deixam o
as pistas química e visual frontal parecem ser mais importantes na orientação para o ninho. Uma trilha de odor é um meio de estabilizar a rota de uma formiga em várias viagens e, possivelmente, as formigas aprendem os pontos de referência enquanto podem detectar odores (Collett & Collett 2002). O processo de aprendizagem permite diminuir a aleatoriedade e aumentar a especialização (Deneubourg et al. 1987).
A entropia abaixo do modelo em todos os tratamentos sugere que, a imprevisibilidade do ambiente natural de D. quadriceps parece não interferir no deslocamento das operárias. Isso é, provavelmente, porque ao longo das rotas de fidelidade dos indivíduos há muito mais pistas disponíveis e, as operárias são capazes de utilizar apenas um subconjunto dos pontos de referência. Fourcassié et al. (1999) propuseram isso para explicar a flexibilidade na orientação de D. gigantea. Em Formica
rufa, o desempenho repetido de uma trajetória guiada visualmente capacita as formigas
a continuar a trajetória na ausência do principal ponto de referência visual (Lent et al. 2009). Neoponera apicalis memoriza uma ou várias trajetórias e seus arredores (Fresneau 1985). Por sua vez, Gigantiops destructor aprende a reconhecer e identificar pontos de referência, que usam durante a navegação nos fins da rota de forrageio, isto é, para localizar ninho e local do alimento (Macquart et al. 2006).
AGRADECIMENTOS
Agradecemos a Universidade Federal do Rio Grande do Norte pelo suporte logístico e ao Instituto Chico Mendes de Biodiversidade (ICMBio) pelas licenças de coleta. Também agradecemos ao Conselho Nacional de Desenvolvimento Cientifico e Tecnológico (CNPq) (Grant no 302012/2006-0 e 401738/2007-8), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), e Fundação de Apoio à Pesquisa do Estado da Bahia (FAPESB) (PRONEX FAPESB-CNPq PNX 0011-2009) pelo suporte financeiro.
REFERÊNCIAS
Araújo, A. & Rodrigues, Z. (2006). Foraging behavior of the queenless ant Dinoponera
quadriceps Santschi (Hymenoptera: Formicidae). Neotropical Entomology, 35,
159-164.
Azevedo, D.L.O., Medeiros, J.C. & Araújo, A. (2014). Adjustments in the time, distance and direction of foraging in Dinoponera quadriceps workers. Journal of Insect Behavior, 27, 177-191. doi: 10.1007/s10905-013-9412-6
Banks, A.N. & Srygley, R.B. (2003). Orientation by magnetic field in leaf-cutter ants,
Atta colombica (Hymenoptera: Formicidae). Ethology, 109, 835-846.
Benhamou, S. Sauvé, J.-P. & Bovet, P. (1990). Spatial memory in large scale movements: efficiency and limitation of the egocentric coding process. Journal of Theoretical Biology, 145, 1-12.
Buehlmann, C., Hansson, B.S. & Knaden, M. (2012). Desert ants learn vibration and magnetic landmarks. PLoS ONE, 7(3), 1-4.
Cammaerts, M.-C. & Rachidi, Z. (2009). Olfactive conditioning and use of visual and odorous cues for movement in the ant Myrmica sabuleti (Hymenoptera: Formicidae). Myrmecological News, 12, 117-127.
Cammaerts, M.-C., Rachidi, Z., Beke, S. & Essaadi, Y. (2012). Use of olfactory and visual cues for orientation by the ant Myrmica ruginodis (Hymenoptera: Formicidae). Myrmecological News, 16, 45-55.
Collett, T.S. (1996). Insect navigation en route to the goal: multiple strategies for the use of landmarks. Journal of Experimental Biology, 199, 227-235.
Collett, T.S. & Collett, M. (2002). Memory use in insect visual navigation. Nature, 3, 542-552.
Collett, T.S., Graham, P. & Harris, R.A. (2007). Novel landmark – guided routes in ants. Journal of Experimental Biology, 210, 2025-2032.
Corbara, B., Fresneau, D., Lachaud, J.-P., Leclerc, Y. & Goodall, G. (1986). An automated photographic technique for behavioural investigations of social insects. Behavioural Processes, 13, 237-249.
Deneubourg, J.-L., Goss, S., Pasteels, J.M., Fresneau, D. & Lachaud, J.P. (1987). Self-organization mechanisms in ant societies (II): learning in foraging and division of labor. Experientia Supplementum, 54, 177-196.
Ehmer, B. (1999). Orientation in the ant Paraponera clavata. Journal of Insect Behaviour, 12, 711-722.
Fourcassié, V., Henriques, A. & Fontella, C. (1999). Route fidelity and spatial orientation in the ant Dinoponera gigantea (Hymenoptera, Formicidae) in a primary forest: a preliminary study. Sociobiology, 34, 505-524.
Fresneau, D. (1985). Individual foraging and path fidelity in a ponerine ant. Insectes Sociaux, 32, 109-116. doi: 10.1007/bf02224226
Harrison, J.F., Fewell, J.H., Stiller, T.M. & Breed, M.D. (1988). Effects of experience on use of orientation cues in the giant tropical ant. Animal Behaviour, 37, 869-871. Hölldobler, B. & Wilson, E. O. (1990). The ants. Cambridge: Harvard University Press. Jaffé, K., Ramos, C., Lagalla, C. & Parra, L. (1990). Orientation cues used by ants. Insectes Sociaux, 37, 101-115.
Kempf, W.W. (1971). A preliminary review of the Ponerinae ant genus Dinoponera Roger (Hymenoptera: Formicidae). Studia Entomologica, 14, 369-394.
Lent, D.D., Graham, P. & Collett, T.S. (2009). A motor component to the memories of habitual foraging routes in wood ants? Current Biology, 19, 115-121. Doi: 10.1016/j.cub.2008.11.060
Macquart, D., Garnier, L., Combe, M. & Beugnon, G. (2006). Ant navigation en route to the goal: signature routes facilitate way-finding of Gigantiops destructor. J Comp Physiol A, 192, 221-234. doi: 10.1007/s00359-005-0064-7
Macquart, D., Latil, G. & Beugnon, G. (2008). Sensorimotor sequence learning in the ant Gigantiops destructor. Animal Behaviour, 75, 1693-1701.
Martin, P. & Bateson, P. (1994). Measuring behaviour: an introductory guide. Cambridge, Cambridge University Press.
Medeiros, J. & Araújo, A. (2014). Workers’ extra-nest behavioral changes during colony fission in Dinoponera quadriceps (Santschi). Neotropical Entomology, 43, 115-121.
Nicholson, D.J., Judd, S.P.D., Cartwright, B.A. & Collett, T.S. (1999). Learning walks and landmarks guidance in wood ants (Formica rufa). Journal of Experimental Biology, 202, 1831-1838.
Schwarz, S. & Cheng, K. (2011). Visual discrimination, sequential learning and memory retrieval in the Australian desert ant Melophorus bagoti. Animal Cognition, 14, 861-870. doi: 10.1007/s10071-011-0419-0
Steck, K., Hansson, B.S. & Knaden, M. (2009). Smells like home: Desert ants
Cataglyphis fortis, use olfactory landmarks to pinpoint the nest. Frontiers in Zoology,
6:5. doi: 10.1186/1742-9994-6-5
Manuscrito a ser submetido após a defesa ao periódico Ethology, fator de impacto 1.556, qualis da CAPES – A1 (Psicologia).
3.2. SIZE, VOLUME AND WEIGHT EFFECTS ON FOOD DISCRIMINATION
BY DINOPONERA QUADRICEPS WORKERS
Dina L. O. Azevedoa and Arrilton Araújoa
a
Laboratory of Behavioural Biology, P sychobiology Graduate Program, Department of Physiology, Universidade Federal do Rio Grande do Norte
Correspondence:
A. Araujo, Psychobiology Graduate Program, Department of Physiology, Universidade Federal do Rio Grande do Norte, P.O. Box 1511, 59078-970, Natal-RN, Brazil. Phone/Fax: +55(84) 3215-3409/3211-9206 E-mail: arrilton@gmail.com
ABSTRACT
Ants use individual decision-making criteria that allow them choosing among different foraging strategies according to prey characteristics. Some ant species do not vary their foraging strategy despite the probable ability to discriminate among preys. Here, our aim was to examine whether ants that forage individually, discriminate prey size, weight and/or volume. We conducted laboratory experiments with Dinoponera
quadriceps workers in which we manipulated food items to observe differentiation by
had no effect on choice. We can conclude that D. Quadriceps workers make an assessment of the food before catching it, and this is part of their strategy.
Key words: ants; foraging decision; individual foraging; Dinoponera quadriceps.
INTRODUCTION
Social insects have evolved foraging strategies according to characteristics of individuals and colonies, and features of the exploited food (e.g. size, weight, quality, abundance and accessibility) (Traniello 1989). Ants, like all social insects, are presented with nutritional challenges that are not experienced by solitary species. For example, small numbers of workers collect the food, which is shared among all members of the colony (Dussutour & Simpson 2008; Buczkowski & Van Weelden2010).
One way in which social insects manage the complexity of their environments is by using intelligent decision-making criteria at the individual level (Cassill 2003). These criteria do not require the ant to make complex assessments nor to discriminate among all parameters. Social insects consider cues that integrate multiple variables inside and outside of the nest (Cassill & Tschinkel1999; Detrain & Deneubourg2002). Colonies of Ectatomma ruidum can choose among strategies of solitary hunting, short-range recruitment and mass recruitment according to the weight of prey, the greater prey elicit mass recruitment (Schatz et al. 1997). Pheidole pallidula switches from searching for food individually to collectively depending on the resistance of the prey; this switch can occur at a critical prey size (Detrain & Deneubourg1997).
Assuming that larger preys contain more energy, prey size is an important limitation to collection in any foraging strategy (Cerdá 1988). The Argentine ant
Linepithema humile does not recruit helpers when it finds small, dispersed prey, but
foragers show an all-or-nothing response based on the ability of the scout to ingest a threshold volume of food (Mailleux et al. 2009). The leaf-cutting ant Atta colombica cuts leaves in smaller fragments to reduce exploration time and crowding during local foraging (Burd 1996). Ants can specialize to different degrees according to the size and density of resources (Kaspari 2000).
Dinoponera quadriceps (Ponerinae, Ponerini) begins individual foraging activity
when it leaves the nest (Araujo & Rodrigues 2006); each forager searches for and transports food individually (Beckers et al. 1989; Lanan 2014). Colonies of this species contain more than 50 workers on average (Paiva & Brandão 1995). Colony activity is primarily diurnal and may have two peaks, one in the morning another in the afternoon, with a decrease at midday (Medeiros et al. 2014). The collected food items are solid and items of animal origin are preferred (Araujo & Rodrigues 2006; Azevedo et al. 2014). After a successful trip, a worker leaves the nest almost immediately and returns to the site of its previous prey capture (Azevedo et al. 2014).
The studies mentioned above examined ant species in which foraging activity always involves recruitment or the foraging strategy can switch from individual to collective. Few studies have examined individual evaluation of food characteristics in species with solitary foraging only. The characteristics of D. quadriceps make this species appropriate for examining the effects of variable prey size, weight, and volume on food discrimination in ants with solitary foraging. We hypothesized that D.
quadriceps would distinguish food size, weight and volume. With control of proposed
METHODS
Study site and subject
Three colonies of D. quadriceps were collected in Central Campus of Universidade Federal do Rio Grande do Norte, Natal, Brazil. The study was conducted in the Laboratory of Behavioural Biology at the Universidade Federal do Rio Grande do Norte. The laboratory was maintained at 25 ± 2 °C, 67% ± 3% humidity, with a 12:12-h light-dark cycle. The colonies were maintained in acrylic boxes (50 × 50 × 20 cm) that served as nests, and were provided access to a foraging arena. Before starting the study, workers were individually marked with a numbered label affixed to the thorax with cyanoacrylate ester-based glue (Corbara et al. 1986).
Experimental procedures
day without food. After the three days fasting interval, we conducted the experiments for five consecutive days. The same observer realized all experiments in a colony by time. We kept number of food items constant in the cafeteria along each experiment.
First experiment: food items with different size, volume and weight
We offered five units of each of four food size classes in the cafeteria, which was 100 cm away from the entrance to the foraging arena (Table 1). Food availability was kept constant by adding another unit of the same size immediately after collection to prevent ants from stopping collection because of a lack of food. We repeated the three days fasting interval and five consecutive days test twice. This experiment included 11 workers from colony one, 20 from colony two, and 28 from colony three.
Second experiment: food items with same volume and different weight
The food size (unit A) that had the highest frequency of collection in the first experiment was provided in the second experiment. Ten units of food-item A, which were identical in size and volume but that differed in weight, were provided to the ants (Table 1). The weight was modified by introducing a 260-mg stainless-steel ball into half of the food units. We maintained constant availability of five units of each weight in the cafeteria. The added weight corresponded to 93% of the weight of an average worker (290 ± 20 mg) so that the final size of the heavier food units was approximately three-fold greater than that of the ants. We used 10 workers from colony one, 15 from colony two, and 24 from colony three in this experiment.
Third experiment: food items with same weight but different volume and size
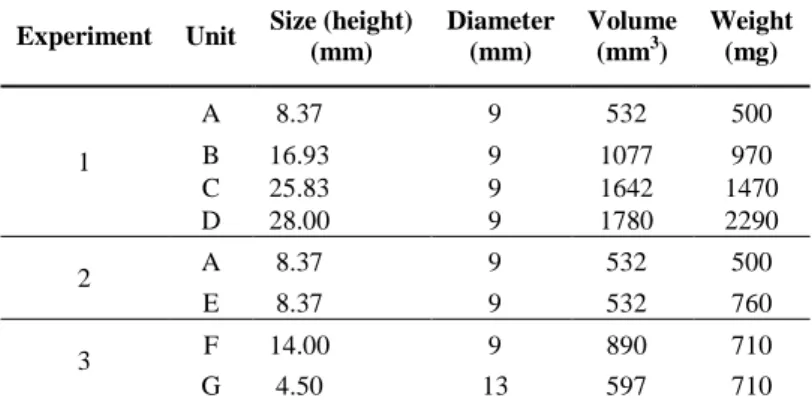
Table 1. Specifications of food units provided in each
experiment. Food size followed a previously defined scale (Azevedo & al., 2014).
Experiment Unit Size (height) (mm)
Diameter (mm)
Volume (mm3)
Weight (mg)
1
A 8.37 9 532 500
B 16.93 9 1077 970
C 25.83 9 1642 1470
D 28.00 9 1780 2290
2 A 8.37 9 532 500
E 8.37 9 532 760
3 F 14.00 9 890 710
G 4.50 13 597 710
Statistical analysis
All data were initially analysed to assess normality, before choosing the used tests. We chose independent tests, because neither all workers weighed entering in arena during all experimental sessions. Kruskal - Wallis (H) tests were then used to identify differences in the quantity of food collected among days and hours of observation, the return times of workers, and the size of food items collected. Where significant differences were found, we performed post hoc Games-Howell (GH) tests. Mann– Whitney (U) tests were performed to compare the numbers of workers arriving at the arena and their collected food weight and volume. Worker weight before and after food deprivation was performed a General Linear Model (GLM) (F) with repeated measures on these data. All tests were two-tailed significance level of 5%.
RESULTS AND DISCUSSION
The weight of worker ants before and after food deprivation was 334.05 ± 30.37 and 329.71 ± 30.12 mg, respectively (F1, 191 = 71.73, P < 0.05). Food deprivation
motivated the workers to forage; 39% of food was collected on the first day following the deprivation period. Similar behaviour has been recorded in Rhytidoponera
solution, but not to a diluted solution (Dussutour & Simpson 2008). The existence of a demand signal for food has been hypothesized to exist in ant larvae (Bourke & Franks 1995). Whatever signals are used, larvae attract feeders at a rate that is regulated by their size and hunger condition (Cassil & Tschinkel 1995). Because D. quadriceps does not recruit other workers, its foraging is solitary, the existence of signals from within the colony remains uncertain.
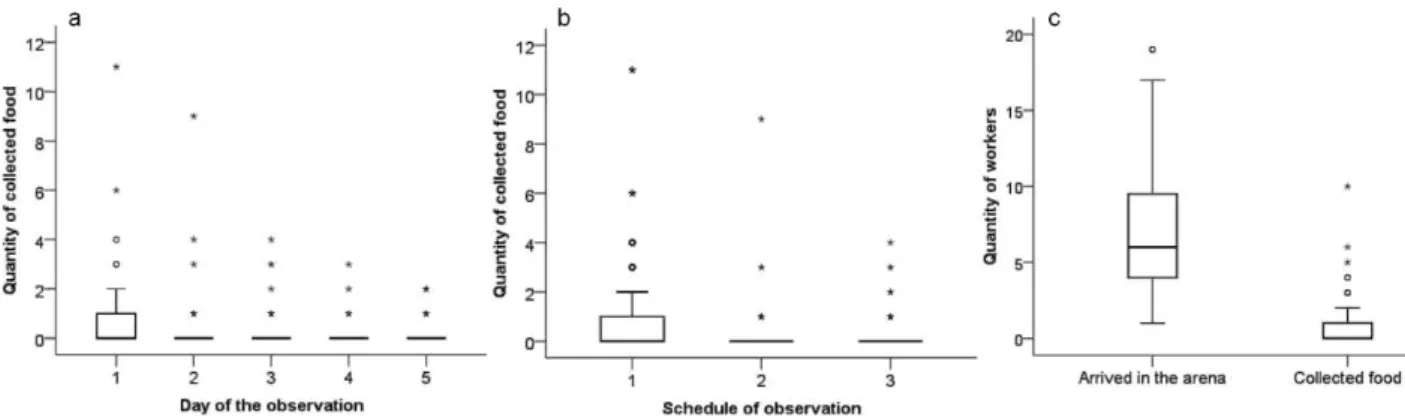
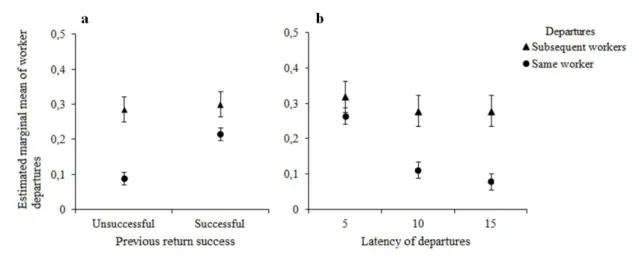
The amount of food collected on the first day after fasting was higher than that collected on any other day (H4 = 48.40, P <0.05) (Fig. 1a), and workers collected more
food immediately after food was first supplied (H2 = 21.58, P <0.05) (Fig. 1b). The time
until ants returned to the arena after gathering food was similar for the different food-item sizes (H3 = 6.79, P > 0.05). Individual ants often exhibit different choices; the
preferences of the colony are determined by the combined choices of individuals. Therefore, individual decisions about the collected food can be modulated by the nutritional state of the colony (Dussutour & Simpson 2008).
After entering the experimental arena, the ants walked freely and could enter the cafeteria at any time. The number of workers that entered the foraging arena was almost five-fold greater than the number that effectively captured food during the three experiments (U180= 974.50, P <0.05) (Fig. 1c). In L. niger, the number of individuals
Figure 1. Comparison of the quantity of food collected on each day (a) 1: N = 109; 2: N
= 107; 3–5: N = 108) (GH: 1 × 2, 3, 4, and 5, P <0.05); and at each observation time (b) 1–3: N = 180) (GH: 1 × 2, and 3, P<0.05); and the number of workers that entered the arena (N = 180) and that collected food (N = 180) during the 2-h observations (c). Open circles and asterisks represent outliers. Boxes represent quartiles and median.
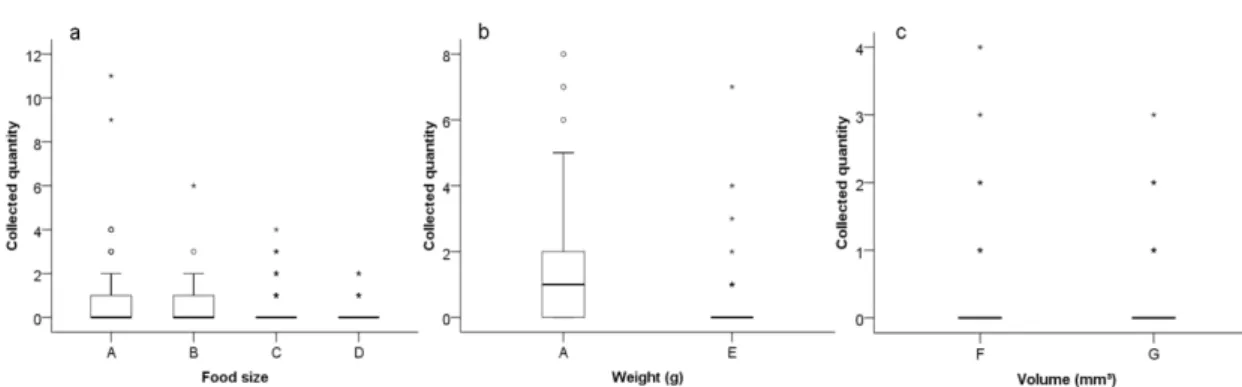
When given the choice of four different-sized cylindrical food items, D.
quadriceps workers chose smaller units. The size-D units, which weighed
approximately seven times as much as the workers, were sometimes cut by the ants into smaller fragments (similar to the size-A units) and then collected. Size-B and C units were also cut. This showed that the D. quadriceps workers discriminated among food sizes prior to choosing and that individual workers preferred to carry smaller units (H3 =
14.175, P<0.05) (Fig. 2a). In natural environment, larger units are more difficult to find but, if D. quadriceps worker finds one larger unit the transport to the nest did not affect their locomotory velocity (Azevedo et al. 2014). Plectroctena minor workers demonstrate behaviours that are adapted to catching tubular prey (Schatz et al. 2001), while individual Acromyrmex octospinosus foragers differ in the selection of leaf discs (Therrien 1988).
We used two different weights (0.50 and 0.76 g) of size-A food in the second experiment and found that the workers collected more of the lighter units (U45= 689.50,
P <0.05) (Fig. 2b). In leaf-cutting ants, lower feed loads could reduce the time spent by
smaller pieces in their foraging areas (Mailleux et al. 2006). D. quadriceps workers chose lighter food units. Some workers touched, caught and changed chosen food item. Load reduction might also help to explain their choice and, indicating that worker ants can discriminate weight. Because the transport distance was fixed, lightening the load may have allowed the ants to spend less time and energy transporting food, thus improving the cost/benefit ratio of the foraging activity.
In the third experiment, weight was unchanged in the two types of cylindrical food units offered, but the volumes were different. There was no difference in choice in this experiment (U45= 985.00, P > 0.05) (Fig. 2c). These results demonstrate that
workers discriminate food weight but not volume before collection. The volume of food ingested by L. niger foragers helps to determine whether these ants recruit nestmates (Mailleux et al. 2009). Parameters such as size and weight of prey determine food choice in Cataglyphis iberica (Cerdá 1988) and Dorymyrmex goetschi (Torres-Contreras & Vásquez 2004). The weight of prey also plays an important role in the choice between solitary or collective foraging strategy in Gnamptogenys sulcata (Schveitzer-Daly et al. 2007).
Figure 2. Number of food items collected according to (a) size (GH: 1, 2, and 3 × 4,
P<0.05); (b) weight; and (c) volume, along each experiment. Open circles and asterisks
During each of our experiments, several workers stopped briefly and placed their proboscis into an available food item that they did not then collect. On many occasions, a worker passed through the cafeteria several times and touched food items but did not collect it, even though it was continuously available. This may indicate that D.
quadriceps workers might leave the nest for different purposes in each trip in the same
day or in different days, suggesting individual choice. Cassill (2003) proposed that a number of ants of the fire ant Solenopsis invicta that found food, but did not ingest it were patrollers searching for potencial competitive invaders. In natural environments, workers appear to follow the win-stay lose-shift strategy, because they minimize their search time when the previous trip was successful (Azevedo et al. 2014). The unpredictability of food supports such a strategy. However, when patches that differ in the abundance and size of food are created, workers may stop collecting at any given time. This may occur because the needs of the colony have already been met, but no definitive explanation is yet available. In his experiment with the fire ant S. invicta, Cassill (2003) found that the number of foragers and their recruits declined significantly within an hour as individual became satiated. Other studies about food flow inside colony can explain the start and the stop of workers foraging of D. quadriceps.
CONCLUSIONS
especially if few foragers are involved (Therrien 1988). Our observation that D.
quadriceps workers preferentially collected the smallest, lightest food items showed that
these ants discriminate the size and weight of the prey, consistent with our hypothesis. In contrast, the volume of food items did not affect food choice. Azevedo and collaborators (2014) did not find effect of time, distance and locomotion velocity of prey transport, in any food size. In natural environment, the greater number of captured prey was small and consequently lighter. This way, we can suggest D. quadriceps workers evaluate size and weight when they find a prey in their natural environment.
ACKNOWLEDGEMENTS
We would like to thank Universidade Federal do Rio Grande do Norte and FLONA Nisia Floresta/RN for logistic support. We thank permission for data collection acquired from the Instituto Chico Mendes de Biodiversidade (ICMBio, Brazil), license numbers 10602-1 and 12547-1. We also thank Conselho Nacional de Desenvolvimento Cientifico e Tecnológico (CNPq) (Grant no. 302012/2006-0 and 401738/2007-8), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), and Fundação de Apoio à Pesquisa do Estado da Bahia (PRONEX FAPESB-CNPq PNX 0011/2009) for financial assistance.
REFERENCES
Araujo, A. & Rodrigues, Z. 2006: Foraging behaviour of the queenless ant Dinoponera
Beckers, R., Goss, S., Deneubourg, J.-L. & Pasteels, J. M. 1989: Colony size, communication and ant foraging strategy. Psyche 96, 239–256.
Bourke, A.F.G. & Franks, N.R. 1995: Social Evolution in Ants. New Jersey, Princeton University Press.
Buczkowski, G. & Van Weelden, M. 2010: Foraging arena size and structural complexity affect the dynamics of food distribution in ant colonies. Environ. Entomol.
39, 1936–1942.
Burd, M. 1996: Foraging performance by Atta colombica, a leaf-cutting ant. Am. Nat.
148, 597–612.
Cassill, D.L. & Tschinkel, W.R. 1995: Allocation of liquid food to larvae via trophallaxis in colonies of the fire ant, Solenopsis invicta. Anim. Behav. 50, 801–813. Cassill, D.L. & Tschinkel, W.R. 1999: Information flow during social feeding in ant societies. In: Information Processing in Social Insects.(Eds.: Detrain, C., Deneubourg, J.-L. and Pasteels, J.M.). Basel: Birkauser Verlag, ASIN: B000RL51BU (Kindle version).
Cassill, D.L. 2003: Rules of supply and demand regulate recruitment to food in the fire ant, Solenopsis invicta. Behav. Ecol. Sociobiol. 54, 441-450. Cerdá, X. 1988: Food collection by Cataglyphis iberica (EM.) (Hymenoptera, Formicidae). Ann. Zool. (Wars). 30, 515–525.
Corbara, B., Fresneau, D., Lachaud, J.-P., Leclerc, Y. & Goodall, G. 1986: An automated photographic technique for behavioural investigations of social insects. Behav. Process. 13, 237–249.
Gnamptogenys sulcata (F. Smith). Insect. Soc. 54, 319–328. doi 10.1007/s00040-007-0949-2
Detrain, C. & Deneubourg, J.-L. 1997: Scavenging by Pheidole pallidula: a key for understanding decision-making systems in ants. Anim. Behav. 53, 537–547.
Detrain, C. & Deneubourg, J.-L. 2002: Complexity of environment and parsimony of decision rules in insect societies. Biol. Bull. 202, 268–274.
Dussutour, A. & Simpson, S.J. 2008: Carbohydrate regulation in relation to colony growth in ants. J. Exp. Biol. 211, 2224–2232.
Kaspari, M. 2000: A primer on ant ecology. In: Agosti, D., Majer, J.D., Alonso, L.E. and Schultz, T.R. (Eds.), Ants: standard methods for measuring and monitoring biodiversity. Washington, Smithsonian Institution, pp. 9–24.
Lanan, M. 2014: Spatiotemporal resource distribution and foraging strategies of ants (Hymenoptera: Formicidae). Myrmecol. News 20, 53-70.
Mailleux, A.-C., Deneubourg, J.-L. & Detrain, C. 2009: Food transport in ants: Do
Lasius niger foragers maximize their individual load? C. R. Biologies. 332, 500–506. Mailleux, A.-C., Detrain, C. & Deneubourg, J.-L. 2006: Starvation drives a threshold triggering communication. J. Exp. Biol. 209, 4224–4229.
Medeiros, J., Azevedo, D. L. O., Santana, M. A. D., Lopes, T. R. P. & Araújo, A. 2014: Foraging activity rhythm of the queenless ant, Dinoponera quadriceps, in its natural environment. J. Insect Science. 14(220). doi 10.1093/jisesa/ieu082
Roulston, T.H. & Silverman, J. 2002: The effect of food size and dispersion pattern on retrieval rate by the Argentine ant, Linepithema humile (Hymenoptera: Formicidae). J. Insect Behav. 15, 633–648.
Schatz, B., Lachaud, J.-P. & Beugnon, G. 1997: Graded recruitment and hunting strategies linked to prey weight and size in the ponerine ant, Ectatomma ruidum. Behav. Ecol. Sociobiol. 40, 337–349.
Schatz, B., Suzzoni, J.-P., Corbara, B. & Dejean, A. 2001: Selection and capture of prey in the African ponerine ant Plectroctena minor (Hymenoptera: Formicidae). Acta Oecol. 22, 55–60.
Stephens, D.W., Brown, J. S. & Ydenberg, R.C. 2007: Foraging: Behavior and Ecology. Chicago, University of Chicago Press.
Therrien, P. 1988: Individual food choices by foragers from the species Acromyrmex
octospinosus (Reich), the leaf-cutting ant. Mem. Entomol. Soc. Can. 146, 123-130.
Torres-Contreras, H. & Vásquez, R.A. 2004: A field experiment on the influence of load transportation and patch distance on the locomotion velocity of Dorymyrmex
goetschi (Hymenoptera, Formicidae). Insect. Soc. 51, 265-270.
Manuscrito submetido ao periódico Journal of Insect Behavior, fator de impacto 1.105, qualis da CAPES – B1 (Psicologia).
3.3. FORAGING DECISIONS OF A SOLITARY FORAGER ANT ARE THE
PRODUCT OF AUTOSTIMULATION, NOT SOCIAL FACILITATION
Dina L. O. Azevedo, Waldemar A. Silva Neto and Arrilton Araújo
ABSTRACT
Keywords: decision making; foraging; efficiency; social interactions; Dinoponera
quadriceps
INTRODUCTION
The adaptive benefits of choice suggest that decision-making strategies are subject to natural selection (Robinson et al. 2011). Decision making is influenced by individual information, conflicts of interest, and time constraints (Adler and Gordon 2003). Social
facilitation is fundamental forms of an individual’s influence on the behaviour of other
individuals (Zajonc 1965). Social facilitation refers to communicative phenomena among social insects which are targeted neither in space nor in time, and these phenomena can promote changes in a species behaviour or physiology that increase responses (Wilson 1971).
In insects, social interactions have various beneficial effects. For instance, in termites, social interactions might increase group survival even if they do not generate food resources (Miramontes and DeSouza 1996). Social interaction stimulates the production of juvenile hormones in male Blattella germanica cockroaches and thereby facilitates the process of sexual maturation (Uzsák and Schal 2013). Western honey bee (Apis
mellifera) workers are more likely to begin fanning, a critical thermoregulatory
behaviour, when they are in groups than when they are alone, even if the group is small (Cook and Breed 2013).