AUDRA REGINA COLOMBO
USO DE ROTAS NA ÁREA DE USO E A
RELAÇÃO COM COMPORTAMENTO
ALIMENTAR EM Callithrix jacchus
AUDRA REGINA COLOMBO
USO DE ROTAS NA ÁREA DE USO E A
RELAÇÃO COM COMPORTAMENTO
ALIMENTAR EM Callithrix jacchus
Dissertação apresentada à
Universidade Federal do
Rio Grande do Norte para
obtenção do titulo de Mestre em Psicobiologia.
AUDRA REGINA COLOMBO
USO DE ROTAS NA ÁREA DE USO E A
RELAÇÃO COM COMPORTAMENTO
ALIMENTAR EM Callithrix jacchus
Dissertação apresentada à
Universidade Federal do
Rio Grande do Norte para obtenção do titulo de
Mestre em Psicobiologia.
Orientador: Prof. Arrilton Araujo
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN / Biblioteca Central Zila Mamede
Colombo, Audra Regina.
Uso de rotas na área de uso e a relação com comportamento alimentar em Callithrix jacchus / Audra Regina Colombo. – Natal, RN, 2009.
75 f.
Orientador: Arrilton Araújo.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Psicobiologia.
1. Callithrix jacchus – Dissertação. 2. Comportamento alimentar – Dissertação. 3. Rotas de deslocamento – Dissertação. I. Araújo, Arrilton. II. Universidade Federal do Rio Grande do Norte. III. Título.
TITULO: “USO DE ROTAS NA ÁREA DE USO E A RELAÇÃO COM COMPORTAMENTO ALIMENTAR EM Callithrix jacchus”
Autora: AUDRA REGINA COLOMBO
Data da defesa: 21 DE DEZEMBRO DE 2009
Banca Examinadora:
______________________________________ Profº Arrilton de Araújo
Universidade Federal do Rio Grande do Norte
_________________________________________ Profª. Maria de Fátima Arruda
Universidade Federal do Rio Grande do Norte
________________________________________ Profª. Silvia Corte
AGRADECIMENTOS
Agradeço a todos que participaram de alguma forma neste longo trajeto.
À minha família, em especial minha mãe e meu pai, acima de tudo e todos, Bia, Vó Katarina, tia Cecília, Tia Elena e todos Bagdzius e Colombo, que mesmo a distância estiveram acompanhando, cuidando, investindo e apostando no meu sucesso. Participaram tanto que até aprenderam o que é etologia e forrageio. Tenho certeza que a torcida de vocês fez toda diferença!!!
A Arrilton que com suas conversas, brincadeiras, broncas e conselhos, me deu oportunidade de conhecer e me apaixonar por Nísia. Permitiu-nos usar e abusar da salinha que acabou tornando nossa segunda casa (acho que primeira, já que Nísia era a segunda), sua competência e bom humor são um exemplo para todos. Obrigada pela confiança.
A Sylvia Corte e Fátima Arruda por aceitar compor a banca, e em especial a Fátima, aventureira, por estar sempre pronta a ajudar, com experiência no campo me deram importantíssimas dicas, sua preocupação na nossa segurança em Nísia, enfim, na atenção e carinho dado a todos;
Aos freqüentadores de Nísia, mesmo que por pouco tempo, foram companheiros
de casa, “de campo”, de miojo, de mosquitos e de Barros: Dina, Jennifer, Pollyana, Ana Carolina, Carol, pela ajuda na coleta dos dados, Danilo, Guilherme, Diego, Daniela,
Samuel, e Ana Karinne pelos primeiros ensinamentos “de mata”, ajuda na captura e
apresentação pessoal aos tão queridos macacos;
Ao instituto Chico Mendes por permitir a pesquisa e Nal por ajudar na abertura das trilhas;
A família Campos Cirne, Fátima, Milton, Anália, Victor, Laura e Madá (que até ajudou a digitar planilhas), pela atenção e muito carinho, sempre preocupados comigo;
As companheiras de casas Andréia, Aline, Karin e atualmente Luiza, pela amizade e apoio, duvidas conjuntas, boas conversas e cuidados com o mais feroz e lindo dos cachorros, Totó Chicão, durante as semanas que passava em Nísia;
Aos meus amigos da CEFET que quebraram muitos galhos nas aulas e trabalhos e especialmente a Robson (pipoca) por ter tanta paciência e disposição, instalando os programas e muitas dicas do arc gis;
A Andréia Presotto pelas precisas dicas, atenção e ajuda sempre que solicitada;
Aos colegas de turma, faz tempo, mas ainda lembro... E aos professores das disciplinas Arrilton, Fátima Arruda e Fátima Campos, Fívia, Fabíola, Helderes, Emilia, Daniel e Renata pela atenção, competência, conselhos e dedicação;
Em especial a Matheus, super companheiro, compreensivo e carinhoso, quem esteve sempre participando e me ajudando em todos os momentos importantes;
As minhas amigas mais que especiais:
Lorena, mais irmã que amiga, mesmo distante não deixou de cuidar de mim ou deixou alguém encarregado... Sinto muitas saudades!
E Priscila e Dina muito obrigada pelo companheirismo, risadas, aventuras, festas, discussões, cafés (vocês, eu não), almoços e PF(s) em Mariquinha, estudos, trabalhos, domingos, viagens, conselhos, TPMs compartilhadas, e tudo mais que boas amigas são...2010 vai ser O ANO!!!!
RESUMO
Callithrix jacchus são primatas com reduzido tamanho corporal que vivem em grupos
ABSTRACT
Callithrix jacchus are small primates that live in cooperative reproductive family
groups. They explore their home range in search of fruits, exudates and animal prey. In this study we investigate the existence of traveling routes and its relation with the feeding habits in a group of Callithrix jacchus. The group was followed for 6 months in an area of Atlantic secondary Forest at the FLONA-ICMBio of Nísia Floresta, Rio Grande do Norte. Two observers in alternated days collected data referring to the
SUMÁRIO
INTRODUÇÃO... 11
OBJETIVO GERAL ... 20
OBJETIVOS ESPECÍFICOS ... 20
METODOLOGIA ... 21
ÁREA DE ESTUDO ... 21
GRUPO DE ESTUDO ... 21
CAPTURA ... 24
REGISTRO COMPORTAMENTAL ... 25
Categorias comportamentais ... 25
REGISTRO DO DESLOCAMENTO DO GRUPO ... 26
ANÁLISE ... 27
RESULTADOS ... 29
ROTAS DE DESLOCAMENTO... 29
DIETA E ATIVIDADE DIÁRIA ... 31
LOCAIS DE DORMIDA ... 39
DISCUSSÃO ... 53
CONCLUSÃO ... 61
REFERÊNCIAS BIBLIOGRÁFICAS ... 62
11 INTRODUÇÃO
Segundo Darwin, em sua teoria de seleção natural, apenas uma pequena parcela de cada geração consegue sobreviver até atingir a maturidade, devido à competição por recursos, pressão de predação, dentre outros. Habilidades competitivas além da força física, também dependem das estratégias comportamentais escolhidas. A melhor estratégia a ser adotada depende, dentre outros fatores, do que seus competidores estão fazendo (Krebs & Davies, 1991).
A teoria do forrageio ótimo é baseada nas premissas: tomada de decisão de onde, quando, quanto tempo e o que forragear; e no balanço entre ganhos (entrada de alimento) e gastos (limitações) nas escolhas tomadas. A seleção natural irá favorecer animais que maximizem a taxa de ingestão de energia e de nutrientes essenciais com os menores gastos energéticos, e que os padrões da seleção de alimentos são adaptativos (Stephens & Krebs, 1986). Dentre outros fatores, a quantidade e qualidade do alimento ingerido por um animal refletem em sua aptidão (fitness) (Krebs & Davies, 1993).
A habilidade de lembrar a localização e viajar eficientemente entre os pontos, locais que contenham recursos imprescindíveis para a sobrevivência, deve ser importante para minimizar os gastos energéticos. Quando indivíduos competem por recursos, o grau de dispersão do alimento e a dificuldade de manipulação podem exercer efeito sobre a taxa de ingestão individual (Michels, 1998). Para entender essa relação, muitos pesquisadores estão se dedicando para descobrir as habilidades dos animais em navegar, bem como os processos mentais que envolvem as representações do espaço e do ambiente (Di Fiore et al,. 2007).
12 al., 2007; Stevenson, 2001). Este contexto pode levar a diferenças nos comportamentos
entre os sexos e respostas a eventos ambientais (Box et al., 1995). O padrão apresentado sugere que os membros do grupo são capazes de balancear os custos e benefícios do deslocamento dentro de sua área de atividade (Janson, 2007C; Stevens et al., 2005; Cowlishaw, 1997). Assim o grupo deve escolher adequadamente o quanto de tempo e energia deve investir nas atividades, otimizando-as (Ahlborn & Rothe, 1999). Porém os conflitos individuais dentro do grupo social, sobretudo quando fica evidente a hierarquia social sobre o sucesso alimentar, tendem a levar indivíduos de diferentes estratos na hierarquia a adotar diferentes táticas para assegurar os requerimentos nutricionais (Angelim, 2007).
Em diferentes espécies, a disposição em explorar novas fontes de alimento deve ser relacionada à sua estratégia alimentar. Espécies generalistas podem ser capazes de diferenciar novos itens dos já conhecidos, além de ter seus jovens demonstrando preferência por itens não conhecidos (Visalberghi et al., 2003; Fragaszy et al,. 1997).
A escolha dos itens alimentares deve-se a dois fatores principais: valor nutricional e a disponibilidade espacial e temporal (Laska, 2001). Animais, em geral, expressam marcada preferência por alimentos com alto conteúdo calórico, maior palatabilidade e por aqueles com conteúdos nutricionais indispensáveis (Laska, 2001; Laska et al., 2000; Fragaszy et al., 1997).
13 A extensão da área explorada pode estar relacionada com tipo de dieta, sendo em geral utilizadas extensas áreas, principalmente entre espécies frugívoras e insetívoras (Raboy et al., 2004). Dentro dessas áreas de uso, existem regiões menores de uso exclusivo, nucleares desses residentes, que são economicamente defensáveis (Mitani & Rodman, 1979). Áreas de uso podem sofrer alterações ao longo do ano de acordo com a variedade e diversidade de árvores para alimentação, e possíveis locais para dormida (Scalon et al., 1989), além de ser decisiva a disposição espacial de recursos e composição florística da área domiciliar (Cassimiro, 2003).
Disputas devem ocorrer na busca por recursos de boa qualidade que não estão disponíveis no meio ambiente de forma homogênea no tempo e no espaço. Assim, aprender e conhecer o ambiente em que está inserido é de extrema importância para aumentar as possibilidades de sobrevivência, já que uma navegação eficiente permite a economia de tempo e energia. A possibilidade de interações com outros animais mais velhos e experientes dentro do grupo permite que indivíduos imaturos possam aprender informações sobre forrageio e predação que podem ser cruciais para a sobrevivência (Visalberght et al., 2003).
Callitrichidae são primatas do Novo Mundo, que exibem características morfológicas particulares. Possui reduzido tamanho corporal, tendência ao nascimento de gêmeos, além de explorar florestas secundárias e os níveis mais baixos das copas das árvores, que tem média 4,5 m de altura. (Sussman & Kinzey, 1984; Maier et al., 1982; Cavalcanti, 2002). Vivem em grupos familiares de até 17 animais, possuem reprodução cooperativa, com infantes dependentes, ocasional reprodução extra-par em grupos monogâmicos e ovulação durante a lactação (Arruda et al., 2005).
14 generalista deve-se à ampla variedade de itens como frutos, flores, insetos, pequenos vertebrados, ovos e exsudado que a família pode se alimentar (Stevenson & Rylands, 1988). Em Callithrix, os membros são relativamente longos e todos os dígitos possuem garras (com exceção do hallux), adaptações que lhes permite escalar árvores, além de especializações morfológicas do intestino para a digestão de exsudado com eficiência (Caton et al., 1996; Feagle, 1999; Sussman et al., 1984; Stevenson & Rylands, 1988).
Callithrix jacchus é considerado exudatívoro-insetívoro (Castro & Araujo, 2007). A morfologia especializada do trato digestivo, especialmente na presença de microorganismos fermentadores e na primeira porção do intestino grosso (Caton et al., 1996), alem da dentição especializada e unhas em forma de garras (Carroll, 1997), permite à espécie a extração e digestão rápida de goma. Como a maioria das árvores apresenta sazonalidade na produção de frutos, a goma sendo permanente, representa elemento chave, contribuindo para ampla distribuição e excelente habilidade a se adaptar a novas condições pela espécie (Ahlborn et al., 1999).
Para navegar a um objetivo, os animais podem utilizar diferentes mecanismos que estão à sua disposição (Bennet, 1996). Através da complexidade de seus cérebros e da capacidade cognitiva é que os animais são capazes de representar os aspectos relevantes de seu ambiente, modificando seu comportamento para melhor adaptar-se. Armazenar de maneira que os permita posteriormente utilizar e integrar tais informações externas para um deslocamento preciso para o alcance dos recursos (Bennet, 1996).
15 constante renovação de informação sobre as relações espaciais e localização exata do animal, pela captação dos sinais existentes na natureza.
Pontos de referências são uma das formas em que a informação espacial oriunda de pistas visuais próximas ao objetivo, pode ser codificada e usada para lembrar a localização de uma meta (Mac Donald et al., 2004). São a principal fonte de informação de parâmetros ambientais que os primatas utilizam durante os seus deslocamentos. Baseando-se nestas pistas, os animais são capazes de criar várias rotas lineares e eficientes sob a forma de mapas mentais (Cunningham et al. 2007b; Janson, 2007). O animal pode retornar, assim, a um objetivo após processar a informação baseada na localização dada pelos pontos de referência conforme percebidos de seu local atual (Fourcassié & Oliveira, 2002).
Mapa cognitivo é a representação mental dos pontos posicionados no ambiente usado como referência para orientação no deslocamento (Noser & Byrne, 2007); ou seja, é a habilidade que um animal tem de unir dois pontos no ambiente de maneira econômica, encontrada em muitos táxons desde abelhas e pássaros a mamíferos (Shettleworth, 1998; Tolman, 1948). É o conceito relacionado com orientação mais controverso e sofisticado, cuja função é fazer com que os animais não se percam no ambiente sendo hábeis para identificar os diferentes locais em sua área de uso, principalmente se as rotas familiares ao animal forem bloqueadas (Presotto, 2009)
16 Outros autores discordam da definição de Galistell (1989) sobre mapas cognitivos como qualquer representação do espaço usado pelos animais, e exemplificam que para haver mapas cognitivos, o uso de novos caminhos deve ocorrer sem uso de atalhos ou através do uso de pontos de referência familiares sob novos ângulos para atingir objetivos (Bennett, 1996). Pesquisas realizadas por Noser & Byrne (2007) demonstraram que babuínos selvagens utilizam complexa representação mental e mapas cognitivos.
Janson (2007) demonstrou que macacos prego (Cebus apella nigristus) são capazes de integrar as distâncias percorridas e o tempo transcorrido em pelo menos dois últimos locais visitados, apresentando capacidade de integrar informação da localização espacial dos recursos. Cunningham & Janson (2007A) previram que os sakis viajam próximos ao recurso e devem retornar a locais previamente visitados. Com uso de memória espacial, minimizam os gastos com deslocamento.
Noser et al. (2007), analisando rotas alternativas em babuínos (Papio ursinus), encontraram que para evitar encontros com grupos rivais, macacos fazem uso de desvios. Aplicando uma regra simples, os desvios são úteis quando o ganho em alimento extra obtido com o desvio for maior que o custo energético do maior percurso. Cowlishaw (1997) constatou em outro grupo de babuínos, que os animais escolhem forragear em locais mais seguros ao risco de predação, sabendo representar os caminhos alternativos dos recursos.
17 reprodutivo, como os últimos períodos de gestação e lactação, o exsudado fornece o excedente necessário de cálcio quando o consumo de frutos e insetos, pobres em minerais, já não for suficiente (Smith et al., 2000).
Em pesquisa realizada, Castro & Araujo (2007) encontraram que a disponibilidade de insetos era maior nos meses úmidos, cigarras, borboletas, gafanhotos, coleópteras e grilos foram os mais encontrados. Mostraram que frutos eram consumidos de acordo com a disponibilidade, reduzindo o consumo de goma quando a de frutos aumentava. Caton et al. (1996) e Maier et al. (1982) descrevem que o consumo de exsudado se concentra no inicio da manhã e final da tarde, e no restante do dia os grupos se dedicam à procura de insetos ou frutos nas copas das árvores.
Embora não exista nenhuma evidência de dimorfismo sexual no peso em Callithrix jacchus (Araujo et al., 2000), diferenças comportamentais refletem nas
habilidades de procura e defesa de recursos entre os sexos. Uma variação na qualidade de fotorreceptores faz com que os machos tenham um déficit na percepção de cores, por serem dicromatas. Já entre as fêmeas, em média, metade da população é tricromata, possuindo os três tipos de cones, como na maioria dos Plathirrines (Jacob, 1996).
Além das diferenças morfológicas, as variações comportamentais são encontradas na acentuada diferença entre os sexos na aquisição e agressividade relacionada ao alimento (Michels, 1998; Box et al., 1995). Tardif et al. (1981) indicam que fêmeas freqüentemente defendem recursos dos machos adultos em Saguinus oedipus e Callithrix jacchus cativos. Independente do tipo de comida, as fêmeas
18 C. jacchus demonstram maior facilidade em resolver tarefas e menor latência de
resposta com uso mais freqüente de estratégias. Uma maior procura e defesa do recurso deve ser indicador do grau de motivação do animal. Fêmeas são motivadas para procurar o melhor alimento, pois o aumento da sua aptidão está diretamente ligado ao acesso ao alimento, principalmente para as dominantes que estão lactando ou grávidas, o que exige alta ingestão calórica (Michels, 1998).
Baseados em pistas de produtividade do ambiente, percorrer maiores distâncias à procura por recursos mais produtivos deve ser menos custoso ao grupo, pois esses recursos trazem vantagens em manter um grupo coeso e na redução da possível competição intra-grupo. A alta freqüência com que Callithrix jacchus selvagens emitem longos chamados nas primeiras horas da manhã, sugere que eles devem dar particular atenção à localização de outros grupos para, com essa informação, poder determinar os próprios movimentos durante o restante do dia (Scalon et al., 1989).
Maier et al.(1982) observaram intensa defesa das porções centrais das áreas de um grupo de sagüis no nordeste brasileiro. Hubrecht (1985) demonstrou que a espécie era agressiva com membros extra-grupo nas disputas onde havia sobreposições de áreas.
Para Scalon et al. (1989), os grupos de Callithrix jacchus ocupam áreas que variam de 2.5 a 6.5 ha. Porém, os animais gastam a maior parcela do tempo explorando áreas centrais de 1 a 1.5 ha, onde focam suas atividades de forrageio.
19 diferentes grupos, sugere que este tamanho de área está dentro da faixa de variação descrita para o gênero e que poderia atingir até 35,5ha.
Apesar de pesquisas indicarem que a memória espacial não é muito precisa em primatas do Novo Mundo, ela é particularmente usada em resolução de tarefas de forrageio. Callithrix jacchus foi testado quanto ao uso deste tipo de memória num experimento que testava a habilidade de procura entre os sexos, em fases que os animais deveriam permanecer ou avançar no forrageio. Resultados mostraram que adultos apresentaram excelente memória para encontrar alimentos-isca, voltavam em locais visitados nas fases anteriores, além de fêmeas serem capazes de minimizar a distância viajada (Mac Donald et al. 1994).
Assim, para animais selvagens, a sobrevivência depende da capacidade de navegar satisfatoriamente em suas áreas de atividade. Como a motivação de um animal pode ser mensurada pela disposição para percorrer determinadas distâncias e a velocidade que ele atinge (Krebs & Davies, 1997), a capacidade de percorrer essa distância de forma mais linear indica sua eficiência de forrageio e facilidade no deslocamento (Noser & Byrne, 2007; Hubrecht, 1985).
Animais gastam muito tempo movendo-se entre diferentes ambientes, e a habilidade de encontrar, aprender, e retornar a locais específicos pode resultar na capacidade de navegação (Trullier et al., 1996).
20 OBJETIVO GERAL
Demonstrar a existência de rotas de deslocamento de Callithrix jacchus e sua relação com a alimentação em sua área de uso.
OBJETIVOS ESPECÍFICOS
Mapear as rotas diárias utilizadas pelo grupo.
21 METODOLOGIA
ÁREA DE ESTUDO
O estudo foi realizado na Floresta Nacional de Nísia Floresta do Instituto Chico Mendes de Conservação e Biodiversidade em Nísia Floresta (6°5’S, 35°12’W), localizada a 2 km do centro de Nísia Floresta e 45 km de Natal (RN). A reserva possui um total de 180 ha, composta por 80 ha de floresta secundária, 40 ha de plantações experimentais e 5 ha de área edificada da sede (fig.1- ANEXO).
A floresta nacional é caracterizada por vegetação de mata atlântica secundária, com ampla variedade de pequenos mamíferos, aves, répteis e insetos. A grande diversidade de vegetação exótica inclui plantações de eucalipto, pinheiros, coqueiros e variedade de árvores frutíferas e madeiras de importância comercial. As árvores variam de 3 a 20 metros de altura e existem muitos arbustos. Outras variedades de vegetais incluem orquídeas, bromélias, cipós e gramíneas. A área explorada é constituída por partes florestais com mata fechada, áreas abertas de plantações de eucaliptos, árvores frutíferas e gramíneas arbóreo-arbustivas.
O clima da região é marcado por duas estações climáticas: uma estação seca que ocorre nos meses de setembro a fevereiro com temperaturas médias em torno de 30ºC e 50 mm de pluviosidade e uma estação chuvosa, de março a agosto, com pluviosidade média em torno de 300 mm e temperatura atingindo 33ºC (Santee e Arruda, 1994).
GRUPO DE ESTUDO
22 11 animais. Durante as observações ocorreram 5 migrações. A fêmea Egle foi capturada, mas não estava mais no grupo quando as observações comportamentais foram iniciadas. Foi registrado o nascimento de 2 indivíduos em 01 janeiro de 2009 (quadro 1).
No total, 9 animais foram capturados. A fêmea reprodutora (Eliane) já possuía marcação de captura anterior e um dos machos (Espeto), apesar de observado, não possuía marcação individual. Todos os animais marcados foram observados durante sua permanência no grupo, porém, em conseqüência a possíveis migrações e desaparecimentos, apenas 5 indivíduos foram observados durante todo o período de estudo (quadro 1).
23 Quadro 1 – Composição do grupo Esperança de Callithrix jacchus na Floresta Nacional de Nísia Floresta do Instituto Chico Mendes de Conservação e Biodiversidade em Nísia Floresta, Brasil.
Animal Sexo Classe de Idade
Eventos
D – desaparecimento, N – Nascimento
Eliane* # ♀ Adulto
Eugênio** # ♂ Adulto
Etevaldo ♂ Adulto dez/08 – D
Esteban ♂ Adulto jan/09 – D
Elvis ♂ Adulto abr/09 – D
Eustáquio ♂ Adulto abr/09 – D
Elke # ♀ Adulto
Elis ♀ Adulto mar/09 – D
Elton # ♂ Sub-adulto
Espeto # ♂ Sub-adulto
Indivíduo 1 ? Juvenil Indivíduo 2 ? Juvenil
Indivíduo 3 ? Infante jul 08 – N Indivíduo 4 ? Infante jul 08 – N Indivíduo 5 ? Infante jan 09 – N Indivíduo 6 ? Infante jan 09 – N
*fêmea reprodutora; ** macho reprodutor baseado em observação comportamental; # indivíduos observados em todo período de estudo
O grupo habita área de plantação com várias espécies de árvores utilizadas como fonte de recursos alimentares de frutos e exsudado, como o cajueiro (Anacardium occidentale), copiúba (Tapirira guianensis), seriguela (Spondias pupurea), embaúba
24 mangueira (Mangifera indica) e algumas espécies da família Mirtácea; e somente de exsudado como sabiá (Mimosa caesalpiniaefolia) e visgueira (Parkia pendula), além das árvores de dormida como o coqueiro (Cocos nucifera), eucalipto (Eucalyptus citriodora), Jacaranda sp, Gmelina arborea, Chorisia speciosa e a Bowdichia
virgilioides. As trilhas localizadas na área de uso do grupo foram marcadas com fitas
coloridas, e as árvores utilizadas como fonte de recursos e árvores de dormidas identificadas numericamente e localizadas com GPS.
CAPTURA
A primeira etapa de trabalho realizada foi a identificação da área de uso e habituação do grupo, para que os comportamentos fossem alterados pela presença do observador; a seguir, realizaram-se duas capturas segundo metodologia descrita por Araújo et al. (2008) para marcação dos animais, respectivamente em agosto e outubro de 2008, utilizando gaiolas manuais com compartimentos individuais. Os animais foram então transportados até a sede nas gaiolas, cobertas com pano para acalmá-los durante o transporte. Foram anestesiados com 0,03 mg/kg de hidrocloreto de ketamina, pesados e medidos, além de terem suas condições gerais avaliadas.
25 REGISTRO COMPORTAMENTAL
O grupo foi acompanhado do momento que acordava até o recolhimento na árvore de dormir. O registro comportamental foi feito de dezembro de 2008 a maio de 2009, por único observador em dias seguidos.
As atividades individuais foram registradas utilizando a técnica de observação animal focal instantâneo com amostragens de 15 minutos para cada indivíduo, com registro instantâneo a cada minuto e intervalos de 5 minutos entre cada focal (Altmann, 1974). As seqüências de observações foram definidas previamente por sorteio e os dados foram registrados em gravador de voz para posteriormente serem transferidos para planilhas eletrônicas. Em 65 dias de observação comportamental, o esforço amostral totalizou 570 horas. Registros anteriores por 30 dias de alguns dados, como árvores de dormida, totalizaram 95 dias de observações.
Categorias comportamentais
Durante as observações, as seguintes categorias comportamentais foram registradas, seguindo descrição de Stevenson et al. (1976):
Forrageio: procura ativa pelo alimento nos diferentes substratos, onde o animal pode
se deslocar lentamente vasculhando ou por saltos. Utiliza as mãos ou boca para a captura. O ato de fazer furos ou raspar os troncos para obter exsudado também é considerado como forrageio.
Ingestão: ato de lamber, morder, levar o alimento a boca, mastigar e engolir.
26 Deslocamento: locomoção entre dois pontos. Este percurso pode ser realizado
andando, correndo, escalando ou saltitando.
Descanso: parado, podendo estar em posição relaxada ou estacionado, mas alerta.
Pode estar com os membros relaxados, olhos fechados, cauda enrolada. Dois indivíduos podem estar em contato.
Catação: pode ser feita em si próprio (autogrooming), ou em outro individuo
(allogrooming), estando dois ou mais animais envolvidos na remoção de partículas da pelagem.
REGISTRO DO DESLOCAMENTO DO GRUPO
Paralelamente às observações comportamentais, o registro das rotas realizadas era feito acompanhando o deslocamento do grupo, de dezembro de 2008 a maio de 2009. Dois observadores se revezaram nos dias de coleta. Os pontos eram plotados a cada 5 minutos corridos, somando uma média de 140 pontos em dias inteiros. Os animais eram acompanhados do momento que saiam da árvore de dormida até seu retorno ao próximo local de dormida ao final do dia, constituindo assim rotas completas. Foram também considerados dias de observações parciais, com rotas incompletas, quando o grupo não era seguido desde a saída da árvore de dormida.
27 Durante a coleta, o pesquisador se posicionava mais central possível da distribuição dos indivíduos visíveis, ou utilizando como referência o último animal visível durante os deslocamentos. Se o grupo permanecesse fora do campo de visão, o primeiro animal localizado foi considerado como central. No instante de marcação do ponto no aparelho de GPS, informações quanto à data, hora, coordenadas UTM e elevação do terreno foram registradas. Os arquivos coletados do tipo Garmin GPS Database diários, eram transferidos para um computador e transformados em documentos necessário para aplicação no programa ARC GIS 9.2 (aplicativo arc map). Este software permitiu a construção dos traçados a partir dos pontos plotados e confecção dos mapas das rotas diárias. Assim, mapas de deslocamento mensal do grupo foram criados com introdução dos recursos utilizados naqueles meses.
ANÁLISE
Comparações entre meses, padrões comportamentais e classes de horas, permitiram saber se houve diferença entre indivíduos no grupo de Callithrix jacchus quanto aos itens consumidos, tempo gasto entre deslocamento, descanso, forrageio, como também o perfil alimentar de cada indivíduo.
As 12 horas diárias de observação foram divididas em três classes de horas a fim de compreender o perfil de atividade do grupo: classe 1- do despertar até as 9h 59min; classe 2- das 10h até as 13h59; classe 3- das 14h até o último focal do dia. Em casos onde a duração do focal se estendeu por mais de uma classe de hora, sua classificação foi definida pelo minuto inicial do respectivo focal.
29 RESULTADOS
ROTAS DE DESLOCAMENTO
As atividades do grupo Esperança iniciavam por volta das 5:00 h da manhã, com os indivíduos se deslocando para forrageio e alimentação com o retorno à árvore de dormida às 17:30 h. Embora todos os locais dentro de sua área de uso tenham sido explorados pelo grupo, a intensidade de uso das diferentes pequenas regiões de sua área de uso variou mês a mês. Essa variação na intensidade do uso pode ser observada pela concentração de pontos e linhas em determinadas regiões da área de uso, representadas nas figuras 8 e 9.
30 Analisando temporalmente o uso da área, encontramos o uso constante de várias áreas. Os círculos IV, presentes em todos os mapas (fig.9), indicam uma região com concentração de Anacardium occidentale, principal exsudado e importante ligação entre dois fragmentos de mata, visto que o exsudado é um recurso espacialmente fixo e temporalmente constante. Outro local de uso constante é representado pelo circulo II, ausente apenas em dezembro (fig.9). Essa área apresenta exemplares da família Myrtaceae (ainda não identificados taxonomicamente) numa região onde os animais utilizaram para descanso. A área VI refere-se ao local com maior permanência do grupo nos meses de fevereiro e março devido a frutificação de Syzygium jambolanum (fig.9). A longa permanência nestes meses na área VII concentrou o consumo de frutos da Mangifera indica. E as áreas I e V são representativas das regiões onde ocorreram as
concentrações do consumo de Tapirira guianensis.
31 DIETA E ATIVIDADE DIÁRIA
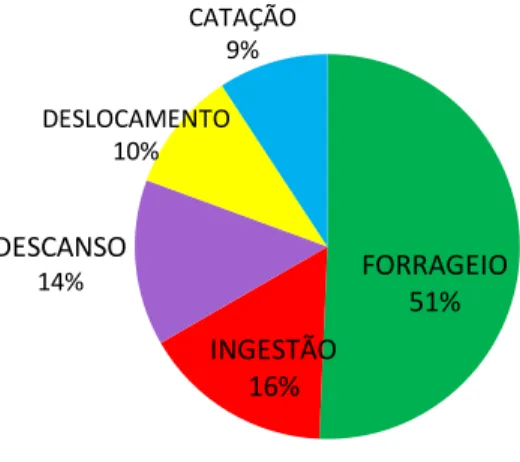
Durante os seis meses de observações do padrão de atividade do grupo, a categoria comportamental com a maior freqüência de registros foi o forrageio, seguido pela ingestão, descanso, deslocamento e catação (fig. 2).
Diferenças foram constatadas quando os diversos itens alimentares consumidos foram agrupados em três diferentes categorias: fruto, exsudado e presa animal, esta última incluindo insetos, aracnídeos, larvas e pequenos vertebrados (lagartixas). A freqüência de consumo das três categorias revela que os frutos representaram o principal item ingerido (50%), seguidos por 31% de presa animal e 19% de exsudado e isso se manteve ao longo dos meses, com exceção do mês de dezembro (fig.3) (tab.02- anexo). Os frutos variaram consideravelmente entre os meses quanto à disponibilidade e variedade, mesmo sendo um item consumido durante todo o estudo. Foram registrados o consumo de manga (Mangifera indica Anacardiaceae), caju (Anacardium occidentale Anacardiaceae), copiúba (Tapirira guianensis Anacardiaceae), seriguela (Spondias pupurea Anacardiaceae), embaúba (Cecropia adenopus Urticineae), azeitona (Syzygium
jambolanum Myrtaceae) e três outras espécies pertencentes à família Myrtaceae.
Figura 2 - Freqüência das categorias comportamentais do grupo de Callithrix jacchus ao longo do estudo.
FORRAGEIO 51% INGESTÃO
16% DESCANSO
14%
DESLOCAMENTO 10%
32 Figura 3 – Freqüência dos itens alimentares consumidos por Callithrix jacchus.
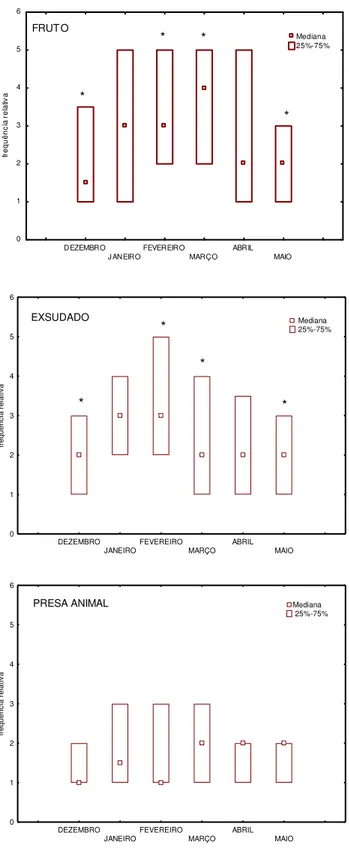
Os meses de fevereiro, março e maio tiveram os maiores percentuais de consumo de frutos, justificado pela intensa frutificação de azeitonas e mangas, nos dois primeiros meses, e de copiúbas em maio (54%, principal fonte de alimento neste mês). Dezembro apresentou a menor porcentagem de consumo de frutos com 28% (fig.03).
Através de testes estatísticos, podemos notar diferenças quanto a este item entre os meses [Kruskal-Wallis: H (5, N= 380)= 30,8 p= 0,001]. A análise comparativa, realizada com Mann-Whitney, demonstrou onde foi encontrada esta diferença (tab.2-3). Conforme podemos perceber na figura 4 (gráfico de frutos), as diferenças apareceram entre dezembro, fevereiro, março e maio, sendo maior nos três últimos citados, comprovando que o consumo está relacionado com a frutificação (tab. 3).
Apesar do baixo consumo de frutos no mês de dezembro, ainda assim, existiu registro de consumo do fruto da Anacardium occidentale. Além dos frutos desta espécie, seu exsudado esteve presente na dieta do grupo em todos os meses, com 55% dentro do total de exsudado consumido. As outras espécies de exsudado representaram 14% para Syzygium jambolanum, 12% Parkia pendula (Fabaceae), 11% para Mimosa
0% 10% 20% 30% 40% 50% 60% 70% 80% 90% 100%
PRESA
EXUDADO
33 caesalpiniaefolia (Fabaceae), e outros 8% divididos entre Tapirira guianensis, Cecropia
adenopus e Spondias pupurea.
Apesar do teste de Kruskal-Wallis não ter indicado diferenças significativas entre os meses [H (5, N= 169)= 8,4 p= 0,1], o resultado da analise comparativa de Mann-Whitney, apontou diferenças entre os meses de dezembro, fevereiro, março e maio, com predominância de consumo no mês de fevereiro, mostrando que o consumo de frutos e exsudados ocorre de maneira complementar (fig. 4 – exsudados) (tab.2-3). O mês de dezembro apresentou maior consumo de exsudados, e menor de frutos. Em contrapartida, maio teve maior consumo de frutos e menor de exsudados. Isso demonstra a alternância entre os consumos de frutos e exsudados.
34 DEZEMBRO J ANEIRO FEVEREIRO MARÇO ABRIL MAIO 0 1 2 3 4 5 6 fr e q u ê n c ia r e la tiv a Mediana 25%-75% FRUT O * * * * DEZEMBRO JANEIRO FEVEREIRO MARÇO ABRIL MAIO 0 1 2 3 4 5 6 fr e q u ê n c ia r e la ti v a
EXSUDADO Mediana
25%-75% * * * * DEZEMBRO JANEIRO FEVEREIRO MARÇO ABRIL MAIO 0 1 2 3 4 5 6 fr e q u ê n c ia r e la ti v a
PRESA ANIMAL Mediana
25%-75%
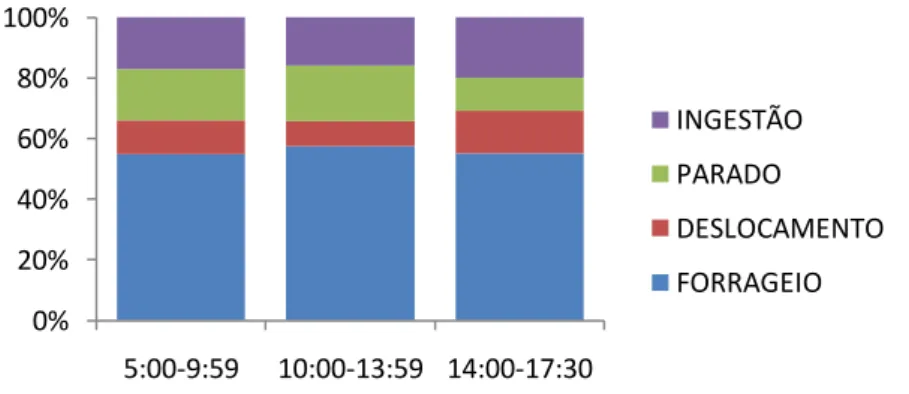
35 Se focarmos agora as atividades realizadas pelo grupo ao longo do dia, percebemos que os sagüis apresentaram variação no ritmo e tipo das atividades, com aumento da freqüência do comportamento descanso no período das 10 h até 13:59 h (classe 2), demonstrando redução das demais atividades nas horas mais quentes do dia. Na classe 3 (a partir das 14 h), o grupo apresentou maior freqüência quanto ao deslocamento e ingestão de alimento, devido a procura por alimentos e retorno aos locais de dormida (fig. 5).
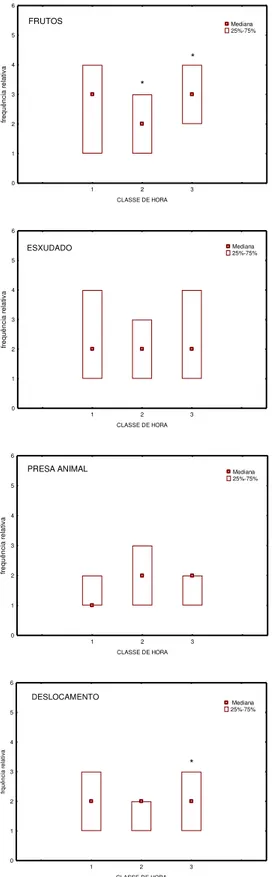
Quanto à ingestão de frutos, houve diferença significativa quanto às classes de hora (Kruskal-Wallis: H (2, N= 380)= 6,5 p= 0,03). Nas comparações realizadas entre a segunda e a terceira classe de hora, através do teste Mann- Whitney, houve maior concentração do comportamento na classe 3. Os outros itens alimentares, exsudado e presa animal, não apresentaram diferenças significativas (p > 0,05) entre os diferentes horários. Para deslocamento, os resultados encontrados apontaram diferenças em relação à terceira classe de hora, sendo maior que as demais classes (fig. 06) (tab. 2 e 6).
Fig. 05 – Orçamento de atividades de Callithrix jacchus entre os diferentes horários ao longo do dia.
0% 20% 40% 60% 80% 100%
5:00-9:59 10:00-13:59 14:00-17:30
INGESTÃO
PARADO
DESLOCAMENTO
36
1 2 3
CLASSE DE HORA 0 1 2 3 4 5 6 fr e q u ê n c ia r e la tiv a
FRUTOS Mediana
25%-75%
* *
1 2 3
CLASSE DE HORA 0 1 2 3 4 5 6 fr e q u ê n c ia r e la tiv a
ESXUDADO Mediana
25%-75%
1 2 3
CLASSE DE HORA 0 1 2 3 4 5 6 fr e q u ê n c ia r e la tiv a
PRESA ANIMAL Mediana
25%-75%
1 2 3
CLASSE DE HORA 0 1 2 3 4 5 6 fr q u ê n c ia r e la ti v a DESLOCAMENTO Mediana 25%-75% *
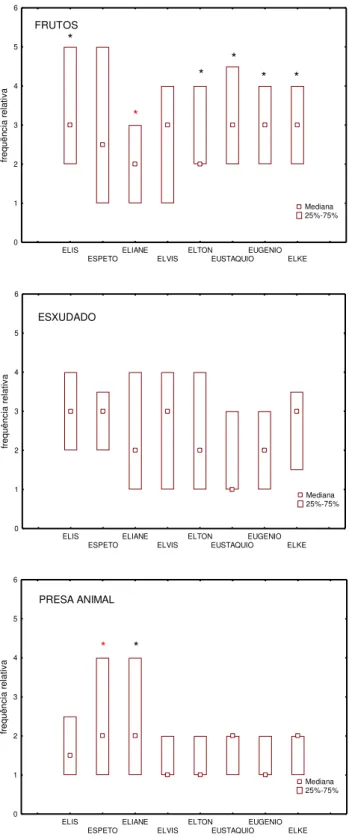
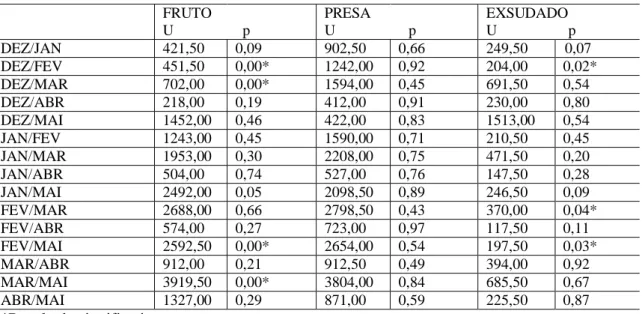
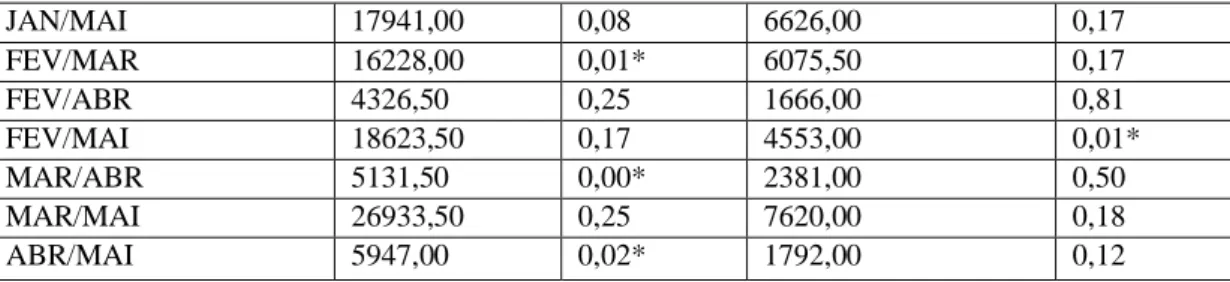
37 Analisando os indivíduos do grupo, notamos que a freqüência de forrageio não variou entre eles [Kruskal-Wallis: H (7, N= 965)= 10,2 p= 0,1761]. Considerando o fruto um recurso sazonal, quando presente é abundante e, até certo ponto, acessível a todos do grupo. Mesmo sendo consumido de forma homogênea entre os indivíduos [Kruskal-Wallis: H (7, N= 374)= 11,3 p= 0,1] a análise comparativa de Mann-Whitney entre os animais (dois a dois) mostrou que houve diferenças entre Eliane (fêmea reprodutora) e Elis, Elton, Eustáquio, Elke e Eugênio; todos com consumo superior à reprodutora (fig.7) (tab.5). Já o exsudado, estatisticamente não apresentou diferença entre os indivíduos [Kruskal-Wallis: H (7, N= 164)= 6,1 p= 0,5] (tab.2). Contudo, Elis e Elvis, percentualmente, foram identificados como maiores consumidores deste item.
38 ELIS ESPETO ELIANE ELVIS ELTON EUSTAQUIO EUGENIO ELKE 0 1 2 3 4 5 6 fr e q u ë n c ia r e la ti v a Mediana 25%-75% FRUTOS * * * * * * ELIS ESPETO ELIANE ELVIS ELTON EUSTAQUIO EUGENIO ELKE 0 1 2 3 4 5 6 fr eq uê nc ia rel at iv a ESXUDADO Mediana 25%-75% ELIS ESPETO ELIANE ELVIS ELTON EUSTAQUIO EUGENIO ELKE 0 1 2 3 4 5 6 fr e q u ê n c ia r e la ti v a PRESA ANIMAL Mediana 25%-75% * *
39 LOCAIS DE DORMIDA
Em 92 dias de observação foram utilizados 16 locais de dormida diferentes, constituídos por sete espécies diferentes de árvores. Entre elas, um exemplar de Gmelina arborea (Lamiaceae), Cocos nucifera (Palmae), Pinus sylvestris (Pinaceae),
Bowdichia virgiloides (Fabaceae), sete exemplares de Eucalyptus citriodora
(Myrtaceae), duas de Jacaranda sp (Bignoniaceae) e de Chorisia speciosa (Bombaceae). Quatro locais foram utilizados apenas uma vez (D2, D10, D14 e D16), e outros quatro locais foram repetidos pelo menos 14 vezes cada um deles. Para estes locais utilizados repetidas vezes, D03 (Cocos nucifera) mostrou a maior freqüência de uso para dormida com 22% do total, seguido por 18% na árvore D08 (Bowdichia virgilioides), 16% na árvore D04 (Jacaranda sp) e 15% na D01 (Gmelina arborea).
Sete árvores representaram apenas 10% dos locais de dormida utilizados.
Nas comparações entre os meses, março teve o menor número de árvores utilizadas, com apenas quatro, sendo 10 registros para árvore D03 (Cocos nucifera), e o maior número de dias observados, 19 no total. Em comparação, maio teve o mesmo número de observações, mas 10 árvores diferentes foram usadas neste mês. Quanto à diversidade de espécies, janeiro teve a menor, com apenas três utilizadas (Cocos nucifera, Eucalyptus citriodora, e Jacaranda sp) e todas as espécies foram utilizadas
40 Tabela 01- Relação das espécies de árvores de dormida
Espécie Árvore
Meses de Observação
Dezembro Janeiro Fevereiro Março Abril Maio
Gmelina arborea D1 25% 21% 11% 27%
Chorisia speciosa D2 11%
Cocos nucifera D3 7% 19% 53% 23% 21%
Jacaranda sp D4 29% 40% 12% 10% 11%
Eucalyptus citriodora D5 14% 6% 13%
Eucalyptus citriodora D7 22% 13% 6%
Bowdichia virgilioides D8 21% 27% 19% 16% 22% 5%
Eucalyptus citriodora D9 7% 11%
Eucalyptus citriodora D10 7%
Eucalyptus citriodora D11 7% 11% 5%
Jacaranda sp D12 6% 5%
Eucalyptus citriodora D13 11% 5%
Chorisia speciosa D14 5%
Pinus sylvestris D15 11%
53 DISCUSSÃO
Sob a perspectiva da seleção natural, a evolução de habilidades mentais deve ser o ponto chave para que diferentes espécies sejam capazes de sobreviver em ambientes que estão em contínua alteração. Para tanto, a procura por alimento deve ser uma das principais exigências para todos os animais, e alguns ambientes exigem uma maior complexidade destas habilidades mentais (Mc Lean, 2001).
A área de qualquer grupo de primatas possui provavelmente centenas de árvores que podem ser potenciais locais para alimentação, abrigo ou locais de dormida. Estes locais podem estar agrupados em manchas ou dispersos. De qualquer modo, o sucesso na obtenção de alguns desses recursos exige conhecimento da área e a habilidade para lembrar e retornar a estes locais já que, devido à sazonalidade, alguns itens não estão disponíveis ao mesmo tempo.
Entre os muitos ambientes freqüentados pelos animais, alguns fatores são primordiais na decisão de onde concentrar suas atividades. São eles os padrões de frutificação, distribuição espacial, variedade de frutos, abundância relativa de presas e defesa contra predadores (Hubrecht, 1985). Além dos fatores citados, para Callithrix jacchus a área de uso também deve conter árvores de exsudado já que sua dieta é
exudativa-insetívora (Rylands & de Faria, 1993).
54 atividades são de extrema importância para a sobrevivência, como proposto por Giraldeau & Caraco (2000).
Dentre os itens ingeridos, os frutos representaram metade de todo o consumo de alimento, apesar de C. jacchus ser considerado exudatívoro-insetívoro. A freqüência de ingestão para cada uma das espécies de plantas variou de acordo com a disponibilidade e duração da frutificação. Diferenças fundamentais no conteúdo nutricional, taxa de renovação, digestibilidade, abundância, distribuição e disponibilidade sazonal dos recursos são os principais fatores impactantes sobre os padrões de forrageio nos primatas (Garber, 1987). Mangifera indica, Tapirira guianensis e Syzygium jambolanum foram os frutos mais freqüentes na dieta do grupo. Entretanto, o baixo
consumo de fruto de Anacardium occidentale encontrado neste trabalho deve-se provavelmente ao fato que o início das observações foi posterior ao pico de frutificação e os frutos desprendiam-se facilmente das árvores ao toque dos animais.
Como a região Nordeste brasileira é caracterizada por florestas tropicais, existem diferentes regimes na produção de frutos ao longo do ano (Stevenson, 2001). Segundo Ahlborn & Rother (1999) a escolha da dieta de primatas do Novo Mundo está muito mais ligada à distribuição espacial e tamanho das árvores do que a cor, tamanho ou grau de maturação dos frutos. Além disso, o conteúdo nutricional de um item tem importante peso nas tomadas de decisão sobre o que forragear (Stephens & Krebs, 1986).
55 distância entre si, seria impossível para os animais, através da visão, identificar os frutos.
O exsudado foi o item menos consumido da dieta do grupo, sendo Anacardium occidentale a fonte mais explorada deste recurso, consumido ao longo de todo período
de estudo. A área com várias árvores desta espécie foi uma das poucas regiões visitadas em todos os meses de pesquisa. O grupo freqüentemente utilizava rotas que passavam por esta área ou mesmo realizava desvios para atingi-las. Esta alteração era uma modificação do caminho que acarretava num aumento do trajeto. Mesmo o grupo explorando outros ambientes, alguns animais se deslocavam afastando-se do grupo, para atingir tais árvores de exsudado. Desta forma, as maiores taxas de consumo de exsudado foram registradas naqueles meses quando a ingestão de frutos foi menor, demonstrando a alternância entre os dois itens, como forma de balancear a entrada de determinados conteúdos nutricionais. Estes resultados quanto ao balanço energético estão de acordo com o que já tem sido relatado para esta espécie (Garber, 1982; Rylands, 1984; Scanlon et al., 1991; Castro & Araújo, 2000).
56 quanto nas copas das árvores, com animais atingindo altura de até 12 metros na captura. A eficiência na captura de presas animais depende diretamente da habilidade (Castro & Araujo, 2007) e do tempo destinado à procura.
A fêmea reprodutora teve acesso diferenciado aos recursos alimentares, o que mostra o papel da hierarquia social dentro do grupo no seu sucesso alimentar, além da motivação desencadeada pela condição fisiológica da fêmea que estava no período de gravidez ou lactação (Angelim, 2007; Sterck & Steenbeek, 1997). Através do perfil alimentar foi possível mensurar o que claramente foi observado em campo: o consumo superior de presas de origem animal pela fêmea reprodutora. Sua posição hierárquica permitia adotar tática diferenciada, onde despendia muito mais tempo de forrageio direcionado à captura de presas, mesmo quando o grupo forrageava em árvores com frutos. Foram observados furtos e agressões por parte da reprodutora para qualquer outro animal do grupo que ela identificasse consumindo alguma presa. O sucesso na captura de presas registrado para os indivíduos Espeto e Eliane, deve-se ao forrageio intenso destes animais nas proximidades do solo, locais onde era muito provável a captura de insetos.
Tal diferenciação no acesso aos recursos por parte da reprodutora também foi observado no consumo de exsudado. A maioria dos cajueiros, principal fonte de exsudado do grupo, estava disposta em agrupamentos com cerca de 10 árvores, e Eliane tinha acesso preferencial a todas elas. Quando o grupo se dirigia à região dos cajueiros, ela liderava o deslocamento e visitava todas as árvores antes que qualquer outro animal pudesse se alimentar.
57 1,2 a 4,5 ha (Castro, 2003; Cassimiro, 2003). Mesmo assim, o tamanho de área utilizado pelo grupo Esperança está dentro do esperado para o gênero, que é descrito com uso de áreas de até 35,5 ha (Rylands & Faria, 1993; Castro, 2000). A utilização de áreas relativamente extensas exige dos animais capacidade de planejar rotas para minimizar distâncias entre recursos (Janson & Byrne, 2007). Assim, algum tipo de habilidade de memória espacial deve ser usado pelos sagüis para localizar e navegar eficientemente (MacDonald et al., 2004).
As observações demonstraram que distribuição dos frutos, exsudados e insetos levaram o grupo a explorar tamanha área, e a presença de grupos vizinhos foi o fator que poderia limitar tal expansão, conforme resultados também encontrados por Cassimiro (2003) e Castro (2000). As interações intergrupos ocorreram quase que diariamente, principalmente na periferia das áreas de uso. Nestas áreas localizadas nas bordas do território, existe sobreposição de áreas de uso com outros grupos de Callithrix jacchus. No mês de maio, quando ocorreu pico de frutificação de copiúbas que estão
dispostas nos limites da área, o grupo Esperança utilizou este recurso exaustivamente, acontecendo então a maioria dos encontros agonísticos. Isto sugere que a defesa territorial é importante função destes encontros, e que tais visitas eram usadas para monitoramento dos grupos vizinhos (Lazaro-Perera, 2000).
58 As árvores de dormida são locais que os animais escolhem para descanso e devem corresponder a determinados critérios que provavelmente trazem conseqüências para a aptidão (Day & Elwood, 1999; Smith et al., 2007). Conhecer os aspectos que influenciam na escolha destas árvores é decisivo na compreensão da rotina dos primatas (Araújo & Arruda, in press). Apesar da variação no uso das árvores de dormida, aquelas escolhidas estavam dispostas predominantemente nas proximidades das árvores em frutificação, o que resultou em elevado consumo de frutos ao final da tarde. Ao despertar, o grupo tinha frutos à disposição com um menor deslocamento. A redução do gasto energético com deslocamento para obtenção de recursos potencializa os ganhos, o que está relacionado à escolha de árvores de dormida próximas aos locais de alimentação (Stephens, 2007; Stephens & Krebs, 1986). Durante o período chuvoso, o critério de escolha das árvores de dormida mudava, quando o grupo dava preferência por árvores que ofereciam maior proteção. Mesmo estando a longas distâncias, os animais se dirigiam em grande velocidade para a região nuclear que continha Cocos nucifera. Contudo, a disposição espacial destas árvores se concentrava principalmente
na área nuclear.
Nossos dados estão de acordo com aqueles encontrados por Presotto (2007), no qual o retorno freqüente aos locais conhecidos para dormir por macacos-prego caracterizaram a maior utilização de uma parcela da área total de uso, a área nuclear, após os deslocamentos mais periféricos durante o forrageio.
59 de sua área de uso são utilizadas para uma navegação eficiente, construindo rotas que se repetem atingindo objetivos diferentes. O conhecimento da área de moradia permite aos animais economizar tempo e energia na busca de alimento, proteção para descanso ou defesa dos recursos. Para explorar seus ambientes, indivíduos devem apresentar capacidade de reconhecer a área onde vivem. Diferentes tipos de memória espacial são encontrados nas diferentes espécies, que lhes permite identificar, escolher, processar e armazenar todo tipo de informação, para posteriormente poder utilizá-la de maneira eficiente (Janson, 1998; Garber, 1989).
Como evidenciado por Garber (1989), em trabalho realizado com duas populações selvagens de Saguinus sp, os deslocamentos no forrageio pareciam ser adequadamente precisos para os locais de alimentação. As rotas eram diretas e menores distâncias eram percorridas na escolha de árvores mais próximas. Apesar dos sagüinos visitarem as mesmas árvores em dias sucessivos, estes animais foram capazes de atingir os objetivos usando diferentes caminhos.
60 animais reduziam custos nos deslocamentos, adquirindo informação no reconhecimento da área onde vivem.
Embora alguns deslocamentos aparentemente não levarem a locais com disponibilidade imediata de recursos, as rotas criadas pelo grupo, consideradas á priori como desvantajosas, levaram a regiões importantes no monitoramento de frutificação de espécies que posteriormente tornaram-se importante fonte de recurso alimentar. Como mostrado na pesquisa de Presotto (2007), o retorno a determinados locais pelos macacos-prego selvagens seguia um intervalo padrão no tempo, primeiramente para o consumo de néctar e posterior monitoramento da frutificação dos principais recursos alimentares.
A navegação por determinadas rotas que passavam por locais que continham frutos em processo de maturação, permitia aos babuínos incorporar em seu repertório a localização de potenciais futuras fontes de alimentação (Di Fiore & Suarez, 2007). Assim, ao invés de visitar freqüentemente todas as fontes de recursos para monitorar a fenologia, os primatas devem possuir alguma habilidade de representação mental, baseando-se na navegação por pontos de referência, atingindo de forma eficiente e econômica os locais planejados (Mc Lean, 2001; Janson, 2007; Noser, 2007).
61 CONCLUSÃO
62 REFERÊNCIAS BIBLIOGRÁFICAS
Ahlborn, S. & Rothe, H. 1999. Food selection of semi-free common marmoset
(Callithrix jacchus): indications for optimal foraging. Primates, 40 (3), 479-486.
Altmann, J. 1974. Observational study of behavior: sampling methods. Behaviour, 49,
227-265.
Angelim, D. 2007. Hierarquia Social e Sucesso Alimentar em Callithrix jacchus
(Primates, Callithrichidae), sob Condições Naturais. Dissertação de Mestrado, Universidade Federal do Rio Grande do Norte.
Araújo, A., Arruda, M. F. Sleeping sites’ use of free ranging in Callithrix jacchus (Primates, Callithrichidae), in press.
Araujo, A. & de Sousa, M.B.C. 2008. Testicular volume and reproductive status of
wild Callithrix jacchus. International Journal of Primatology, 29, 1355- 1364.
Araújo, A., Arruda, M.F., Alencar, A.I., Albuquerque, F., Nascimento, M.C. &
Yamamoto, M.E. 2000. Body weight of wild and captive Common Marmosets
(Callithrix jacchus). International Journal of Primatology, 21, 317-324.
Arruda, M.F., Araújo, A., Sousa, M.B.C., Albuquerque, F.S., Albuquerque,
A.C.S.R. & Yamamoto M.E. 2005. Two Breeding Females within Free-Living
Groups May Not Always Indicate Polygyny: Alternative Subordinate Female Strategies in Common Marmosets (Callithrix jacchus). Folia Primatol, 843, 1-11.
Bates, B.C. 1970. Territorial Behavior in primates: A review of recent field studies.
Primates, 11, 271-284.
Bennett, A.T.D. 1996. Do animals have cognitive maps? The journal of experimental
63 Box, H.O., Rohrhuber, B. & Smith, P. 1995. Female tamarins (Saguinus-
Callitrichidae) feed more successfully than males in unfamiliar foraging tasks. Behavioural Processes, 34, 3-12.
Brown, J. L. & Orians, G.H. 1970. Spacing patterns in mobile animals. Annu. Rev.
Ecol. Syst., 1, 239-262.
Carroll, B. J. 1997. A comparative Summary of the Nutritional Adaptation and Needs
of Callitrichids and Application to Captive Management. In: the European Marmoset Research Group (DSSD Imagery: Salisbury, United Kingdom), 70-77.
Cassimiro, R.F. 2003. Utilização da Área Domiciliar por Grupos de Sagüis.
Dissertação de Mestrado, Universidade Federal do Rio Grande do Norte.
Castro, C.S.S. & Araujo, A. 2007. Diet and feeding behavior of marmoset, Callithrix
jacchus. Brazilian Journal of Ecology, 07, 14-19.
Castro, C.S.S. 2003. Tamanho de área de vida e padrão de uso do espaço em grupos de
saguis, Callithrix jacchus (Linnaeus) (Primates, Callitrichidae). Revista brasileira de zoologia, 20 (1), 91-96.
Castro, C.S.S. Araujo, A., Alho, C. & Filho, M. M. D. 2000. Influencia da
distribuição e disponibilidade dos frutos, na dieta e uso do espaço em saguis-do-nordeste (Callithrix jacchus). A Priamatologia no Brasil, 7, 65-80.
Caton, J.M. Hill, D.M., Hume, I.D. & Crook, G.A. 1996. The digestive strategy of
the common marmoset, Callithrix jacchus. Comp. Biochem. Physiol., 114a no 1, 1-8. Cavalcanti, K.C.S. 2002. Comportamento alimentar de Callithrix jacchus
(Callithrichidae, Primates) em mata secundária e ambiente alterado. Dissertação de Mestrado, Universidade Federal do Rio Grande do Norte.
Cowlishaw, G. 1997. Trade-offs between foraging and predation risk determine habitat
64 Cunningham, E. & Janson, C. 2007A. Integration information about location and
value of resources by white-faced saki monkeys (Pithecia pithecia). Anim Cog, 10, 293-304. A
Cunningham, E. & Janson, C. 2007B. A sociecological perpective on primate
cognition, past and present. Anim Cog, 10, 273-281. B
Day, R.T. & Elwood, R.W. 1999. Sleeping site selection by the Golden-Handed
Tamarin Saguinus midas midas: The role of predation risk, proximity to feeding sites, and territorial defence. Ethology, 105, 1035-1051.
Di Fiore, A. & Suarez, S.A. 2007. Route-based travel and shared routes in sympatric
spider and woolly monkeys: cognitive and evolutionary implications. Anim. Cogn, 10, 317-329.
Domny, N.J., Garber, P.A., Bicca-Marques, J.C. & Azevedo-Lopes, M.A.O. 2003.
Do female tamarins use visual cues to detect fruit rewards more successfully than males? Animal Behaviour, 66, 829-837.
Feagle JG. 1999. New Word Arthropoids. In: Primate adaptation and evolution.
pp.133-184. New York. New York Academic.
Fourcassié, V. & Oliveira, P. S. 2002. Foraging ecology of the giant Amazonian ant
Dinoponera gigantea (Hymenoptera, Formicidae, Ponerinae): activity schedule, diet
and spatial foraging patterns. Journal of Natural History, 36, 2211-2227.
Fragaszy, D., Visalberghi, E. & Galloway, A. 1997. Infant tufted capuchin monkeys’ behaviour with novel foods: opportunism, not selectivity. Anim. Behav., 53, 1337–1343. Gallistel, C.R. 1989. Animal Cognition: the representation of space, time and number.
Ann. Rev. Psichol., 40, 155-89.
Garber, P.A. 1987. Foraging strategies among living primates. Ann. Rev. Anthropol.,
65 Garber, P.A. 1989. Role of Spatial Memory in Primate Foraging Patterns: Saguinus
mystax and Saguinus fuscicollis. American Journal of Primatology, 19, 203-216.
Giraldeau, L-A. and Caraco, T. 2000. Social Foraging Theory. Princeton University
Press, Princeton New Jersey. 362 pp
Hubrecht, R.C. 1985. Home-range size and use and territorial behavior in the common
marmoset, Callithrix jacchus jacchus, at the Tapicura field station, Recife, Brazil. International Journal of Primatology, vol 6, no 5, 533-550.
Jacobs, G.H. & Deegan II, J.F. 2001. Photopigments and colour vision in new word
monkeys from the family Atelidade. The Royal Society Lond., 268, 695-702.
Jacobs, G.H. 1996. Primate photopigments and primate color vision. Proc. Natl. Acad.
Sci. USA, 93, 577-581.
Janson, C.H. & Byrne, R. 2007. What wild primates know about resources: opening
up the black box. Anim. Cogn., 10, 357-367.
Janson, C.H. 1998. Experimental evidence for spatial memory in foraging wild
capuchin monkeys, Cebus apella. Anim. Behav., 55, 1229-1243.
Janson, C.H. 2007. Experimental evidence for route integration and strategic planning
in wild capuchin monkeys. Anim. Cog.,10, 341-356.
Krebs, J.R. & Davies, N. B. 1991. Decision-making. In: Behavioural Ecology: An
evolutionary approach. Pp.105-136. The University of Chicago Press, Oxford.
Krebs, J.R. & Davies, N.B. 1997. Managing time and energy. In: Behavioral Ecology
– An Evolutionary Approach. pp. 228-253. The University of Chicago Press, Chicago.
Laska, M. 2001. A comparison of food preferences and nutrient composition in captive
66 Laska, M., Salazar, L.T.H. & Luna, E.R. 2000. Food preferences and nutrient
composition in captive spider monkeys, Ateles geoffroyi. International Journal of Primatology , vol 21 no 4, 671-683.
Lazaro-Perea, C. 2001. Intergroup interactions in wild common marmosets, Callithrix
jacchus; territorial defense and assessment of neighbours. Animal Behavior, 62, 11-21.
MacDonald, S.E., Pang, J.C. & Gibeault, S. 1994. Marmoset (Callithrix jacchus
jacchus) spatial memory in a foraging task: win-shift strategies. Journal of Comparative Psychology, vol 108 no 4, 328-334.
MacDonald, S.E., Spetch, M.L., Kelly, D.M. & Cheng, K. 2004. Strategies in
landmark use by children, adults, and marmosets monkeys. Learning and Motivation, 35, 322-347.
Maier, W. Alonso, C. & Langguth, A. 1982. Fields observations on Callithrix jacchus
jacchus L. Z. Saugetierkunde, 47, 334-346.
McLean, A.N. 2001. Cognitive abilities – the result of selective pressures on food acquisition? Applied Animal Behaviour Science, 71, 241-258.
Michels, A.M. 1998. Sex differences in food acquisition and aggression in captive
common marmosets. Primates, 39 (4), 549-556.
Mitani, J.C. & Rodman, P.S. 1979. Territoriality: the relation of ranging pattern and
home range size to defendability, with an analysis of territoriality among primate species. Behavioral Ecology and Sociobiology, 5, 241-251.
Moura, A.C.A. 2007. Primate group size and abundance in the caatinga dry florest,
Northeastern Brazil. Int J Primatol, 28, 1279-1297.
Noser, R. & Byrne, R.W. 2007. Mental maps in chacma baboons (Papio ursinus):
67 Noser, R. & Byrne, R.W. 2007. Travel routes and planning of visits to out-of-sight
resources in wild chacma baboons, Papio ursinus. Animal Behaviour, 73, 257-266. A Osorio, D., Smith, A.C., Vorobyev, M. & Buchanan-Smith, H.M. 2004. Detection of
fruits and the selection of primate visual pigments for color vision. The American Naturalist, vol 164 no 6, 696- 708.
Poucet, B. 1993.Spatial cognitive maps in animals: new hypotheses on their structure
and neural mechanisms. Psychol Ver, 100,163–182.
Presotto, A. 2009. Mapas cognitivos de primatas: Análise de movimentos e rotas de
Cebus nigritus apoiada por sistemas de informação geográfica. Tese de Doutorado.
Universidade de São Paulo.
Raboy, B.E. & Dietz, J.M. 2004. Diet, foraging and use of space in Wild
Golden-Headed Lion Tamarins. American Journal of Primatology, 63, 1-15.
Rylands, A.B. & de Faria, D.S. 1993. Habitats, feeding ecology, and home range size
in the genus Callithrix .In: Rylands, A.B. Marmosets and Tamarins: Systematics, Behaviour and Ecology. pp. 262-272. New York: Oxford Science Publication.
Rylands, A.B. 1984. Exudate-eating and tree-gouging by marmosets (Callitrichidae,
primates). In: Charwick, A.C., Sutton, S.L (eds.). Tropical rain forest: the leeds symposium. pp. 155-168. Leeds: Leeds philosophical and literary society.
Santee, D.P. & Arruda, M.F. 1994. The Nisia Floresta common marmoset research
station. Neotropical Primates, 2(4), 8-11.
Scalon, C.E., Chalmers, N.R. & Monteiro da Cruz, M.A.O. 1989. Home range use
68 Scalon, C.E., Monteiro da Cruz, M.A.O. & Rylands, A.B. 1991. Exploração de
Exsudados Vegetais pelo Sagüi-comum, Callithrix jacchus. Primatologia no Brasil, 3, 197-205.
Shettleworth S.J. 1998. Getting around. In: Cognition, evolution, and behavior.
pp.279-317. New York: Oxford University Press.
Smith, A.C. 2000. Composition and propesed nutritional importance of exudates eaten
by saddleback (Saguinus fuscucollis) and mustached (Saguinus mystax) tamarins. International journal of Primatology. vol 1 no1, 69-83.
Smith, A.C., Buchanan-Smith, H.M., Surridge, A.K. & Mundy, N.I. 2005. Factors
affecting group spread with wild mixed-species troops of Saddleback and Mustached Tamarins. International Journal of Primatology, 26, 337-355.
Smith, A.C., Buchanan-Smith, H.M., Surridge, A.K., Osorio, D. & Mundy, N.I.
2000. The effect of colour vision on the detection and selection of fruts by tamarins (Saguinus spp.) The Journal of Experimental Biology, 206, 3159-3165.
Smith, A.C., Knogge, C., Huck, M., Lottker, P., Buchanan-Smith, H.M. &
Heymann, E.W. 2007. Long-term patterns of sleeping site use in wild Saddleback
(Saguinus fuscicollis) and Mustached Tamarins (S. mystax): Effects of foraging, thermoregulation, predation, and resource defence constraints. American Journal of Physical Anthropology, 134, 340-353.
Stephens, D.W.& Krebs, J.R. 1986. Foraging Economics: the logic of formal
modeling. In: Foraging theory. pp. 3-11. Princeton: Princeton University Press.
Stephens, D.W., Brown, J.S. & Ydenberg, R.C. 2007. Foraging: Behavior and