UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE DEPARTAMENTO DE FISIOLOGIA
CURSO DE PÓS-GRADUAÇÃO EM PSICOBIOLOGIA
CORRELATO HORMONAL DO COMPORTAMENTO REPRODUTIVO DE MACHOS DE SAGÜI COMUM (Callithrix jacchus) EM AMBIENTE NATURAL
MARIANA CHISTE PONTES
MARIANA CHISTE PONTES
CORRELATO HORMONAL DO COMPORTAMENTO REPRODUTIVO DE MACHOS DE SAGÜI COMUM (Callithrix jacchus) EM AMBIENTE NATURAL
Dissertação apresentada à Universidade Federal do Rio Grande do Norte, para obtenção do título de Mestre em Psicobiologia.
Orientadora: Profa. Dra.Maria Bernardete Cordeiro de Sousa
MARIANA CHISTE PONTES
CORRELATO HORMONAL DO COMPORTAMENTO REPRODUTIVO DE MACHOS DE SAGÜI COMUM (Callithrix jacchus ) EM AMBIENTE NATURAL
Dissertação apresentada à Universidade Federal do Rio Grande do Norte, para obtenção do título de Mestre em Psicobiologia
BANCA EXAMINADORA
__________________________________________ Profª Drª Maria Bernardete Cordeiro de Sousa Universidade Federal do Rio Grande do Norte
__________________________________________ Profª Drª Maria Teresa da Silva Mota
Universidade Federal do Rio Grande do Norte
__________________________________________ Profª Drª Ana Cláudia Sales Rocha Albuquerque Universidade do Estado do Rio Grande do Norte
AGRADECIMENTO
Agradeço àqueles que me auxiliaram direta e indiretamente na execução
deste trabalho. Obrigada pelos
ensinamentos, carinho e apoio
DEDICATÓRIA
SUMÁRIO
RESUMO... 2
ABSTRACT ... 3
1. INTRODUÇÃO ... 4
1.1. Aspectos biológicos de Callithrix jacchus ... 5
1.2. Comportamento reprodutivo de Callithrix jacchus ... 5
1.3. Hormônios relacionados ao comportamento reprodutivo... 8
1.4. Socioendocrinologia de machos de Callithrix jacchus ... 13
2. OBJETIVOS ... 15
2.1 Objetivo geral... 15
2.1 Objetivos específicos... 15
3. HIPÓTESES E PREDIÇÕES ... 16
4. MATERIAIS E MÉTODOS... 18
4.1. Local de estudo ... 18
4.2. Animais ... 19
4.2.1. Área de uso dos animais……… 20
4.2.2. Marcação dos animais……… 21
4.3. Materiais ... 21
4.4. Monitoramento dos animais... 21
4.5. Coleta de fezes e análise dos hormõnios esteróides nas fezes... 23
4.6. Análise estatística ... 26
5. RESULTADOS... 27
5.1. Análise comportamental... 27
5.1.1. Comportamentos afiliativos dos machos reprodutores e não reprodutores em relação às fêmeas reprodutoras... 27 5.1.2. Comportamentos de cuidado dos machos focais em relação aos infantes... 31 5.1.3. Comportamentos sexuais dos machos focais... 32
5.1.4. Comportamentos agonísticos dos machos focais ... 33
5.2. Análise hormonal ... 33
5.2.1. Concentração de esteróides fecais dos machos focais... 33
5.2.2. Correlação entre os esteróides fecais e os comportamentos agonísticos dos machos do grupo GR2... 36 5.2.3. Perfis hormonais individuais... 37
6. DISCUSSÃO... 40
7. CONCLUSÕES... 47
8. REFERÊNCIAS BIBLIOGRÁFICAS... 49
RESUMO
ABSTRACT
1. INTRODUÇÃO
1.1. Aspectos biológicos de Callithrix jacchus
Os animais da espécie Callithrix jacchus (LINNAEUS, 1758) são primatas Neotropicais que ocorrem naturalmente no Nordeste do Brasil, do Maranhão à Bahia (ÁVILA-PIRES, 1969; NAPIER-NAPIER, 1967), e recentemente foram introduzidos no sul e sudeste do país (CERQUEIRA et al, 1998). Estes animais são conhecidos como sagüi comum e habitam uma grande variedade de tipos florestais (HERSHKOVITZ, 1977), como matas secundárias e em processo de degradação (DIGBY & BARRETO, 1993). São animais de pequeno porte, pesando entre 270 a 390 gramas e que não possuem dimorfismo sexual (EPPLE, 1970; HERSHKOVITZ, 1977). Possuem ornamentos pilosos peri-auriculares de cor branca, coloração acinzentado-claro com reflexos castanhos e pretos. A cauda apresenta faixas transversais alternando-se duas tonalidades cinza (AURICCHIO, 1995).
exibe ovulação pós-parto (McNEILLY et al., 1981; DIGBY & BARRETO, 1993) e por isso, pode estar gestante, lactante e carregando a prole no mesmo período (HEARN, 1983).
A reprodução é, por este motivo, muito custosa para esta fêmea (DIGBY & BARRETO, 1993). Os custos energéticos são então distribuídos entre os membros do grupo que exibem um sistema cooperativo de cuidado ao infante (ABBOTT, 1984; DIGBY, 1995; SNOWDON, 1996; YAMAMOTO et al., 1996). Devido às características relacionadas ao seu pequeno porte, grande potencial reprodutivo e adaptabilidade ao ambiente de cativeiro, esta espécie é muito importante para a pesquisa biomédica, sendo de ampla utilização como modelo experimental (ROTHE, 1975; ZIEGLER et al., 1997; ABBOTT et al., 2003a).
1.2. Comportamento reprodutivo de Callithrix jacchus
outros machos do grupo não apresentarem comportamento reprodutivo, eles possuem competência sexual (CASTRO, 2000).
Embora na literatura estejam descritas as principais características das interações entre fêmeas, quer sejam relacionadas à hierarquia de dominância entre elas (ABBOTT, 1984; ALBUQUERQUE et al., 2001), à ovulação com periodicidade de 28 dias (HEARN, 1983), à inibição reprodutiva (ABBOTT, 1984; EVANS & HODGES, 1984; ABBOTT, 1987; SALTZMAN et al., 1997a,b), poucos estudos socioendocrinológicos foram realizados considerando-se como foco principal de investigação o macho. Estes não apresentam competição e agressão entre si tão evidente para a manutenção do posto de dominante quanto às fêmeas (ABBOTT, 1987; DIGBY & FERRARI, 1994) e, provavelmente, por esse motivo estes têm sido pouco estudados.
O comportamento reprodutivo dos machos de sagüi inclui as interações afiliativas e sexuais entre o par e o comportamento parental. Na maioria dos mamíferos, o comportamento sexual é expresso no período do estro da fêmea (YOUNG, 1937; DIAKOW, 1974; WALLEN, 1990). No caso dos sagüis e de alguns outros primatas, o comportamento sexual pode ocorrer fora deste período, embora a maior parte das cópulas ocorra no período fértil (KENDRICK & DIXSON, 1983; WALLEN, 2001).
Na fase peri-ovulatória da fêmea de C. jacchus há um aumento das interações afiliativas, que normalmente são exibidas entre o par reprodutor (DIGBY, 1995), elevando-se os índices de aproximação, seguir, cheirar a região genital, catação (EVANS & POOLE, 1983) e marcação de cheiro, principalmente pelo macho reprodutor. KENDRICK & DIXSON (1983) relataram nesta fase um aumento nos comportamentos de vai e vem da língua, monta e ejaculação pelo macho. Observa-se a formação de “pair bond”, uma ligação afiliativa entre o par reprodutor, caracterizada por aumento de interações sexuais e sociais, como cópula, tentativa de cópula, contato e catação (VOGT et al., 1978; EVANS & POOLE, 1983; SCHAFFNER et al., 1995; SILVA & SOUSA,
parece ser um componente da ligação entre o par, uma vez que foi demonstrado que este comportamento está implicado no sucesso reprodutivo do par (SILVA e SOUSA, 1997). Esta ligação possibilita a formação de grupos familiares estáveis e sugere fortemente que a estratégia de acasalamento do sagüi comum é, prioritariamente, a monogamia (BARBOSA, 2003).
A ligação entre o par reprodutor promove a ocorrência de uma reação agonista a intrusos do mesmo sexo, com as fêmeas mostrando-se mais agressivas em relação fêmeas intrusas, sendo esta resposta provavelmente associada à competição sexual (ARAÚJO & YAMAMOTO, 1993). Esta competição pode ser considerada uma forma de agonismo. Este termo (agonismo) provém da palavra agonia, que designa combate, luta, ansiedade e angústia. Os comportamentos agonísticos estão relacionados com o confronto entre indivíduos, que podem ou não ser comportamentos agressivos. Em C. jacchus são
considerados comportamentos agonísticos: exposição de genitália, piloereção,
vocalização, perseguição, marcação de cheiro e a agressão física como a mordedura (LAZARO-PEREA, 2001). O agonismo pode ocorrer entre indivíduos do mesmo grupo social ou entre animais de grupos sociais diferentes, em contexto de encontro entre grupos. O confronto está associado à defesa de recursos como: território, alimento, parceiro sexual e, no caso de C. jacchus, também cuidadores para o infante (LAZARO-PEREA, 2001).
O cuidado paterno é parte do comportamento reprodutivo e corresponde a um investimento parental provido somente pelo pai biológico. O investimento parental é todo investimento efetuado a um infante por um parente aumentando as chances de o filhote sobreviver e de se reproduzir (SNOWDON & SUOMI, 1982). Um exemplo de cuidado específico de machos é a defesa de território (SNOWDON & SUOMI, 1982). Em C. jacchus o cuidado se caracteriza principalmente pelo auxílio em carregar os infantes, além
Quando se estuda o comportamento dos animais deve-se também ter em mente que os mesmos podem ter diferentes distribuições temporais. Em sagüi comum, alguns comportamentos relacionados a contextos de territorialidade, como a competição, a sinalização do estado reprodutivo e o agonismo (marcação de cheiro) e de interação social (catação), foram estudados quanto ao seu perfil de distribuição ao longo do dia. Estes comportamentos fazem parte do repertório relacionado ao comportamento reprodutivo, indicando, como no caso da catação social, relações preferenciais de interação dentro do grupo social ou de aumento de agonismo, como no caso da marcação de cheiro. Para animais vivendo no ambiente natural, CASTRO et al., (1995) encontrou maior incidência de catação na fase da manhã, enquanto à tarde os animais passam mais tempo em forrageio, pois nesta fase, os indivíduos envolvem-se mais com a gomivoria (NOGUEIRA et al., 2001).
1.3. Hormônios relacionados ao comportamento reprodutivo
No animal adulto, este andrógeno é essencial para que as células de Sertoli dos testículos produzam espermatozóides (HADLEY, 1992). Está associado também a vários comportamentos relacionados à reprodução, incluindo competição e agressão entre machos (MONAGHAN & GLICKMAN, 1992, DIXSON, 1993), comportamento de corte (ADKINS-REGAN, 1998) e comportamento de cópula (DIXSON, 1993, MEISEL & SANCHS, 1994), em diferentes espécies.
Em primatas, a habilidade para efetuar a cópula recebe maior comando neural que hormonal. Em macaco rhesus (Macaca mulatta), a supressão da função testicular do adulto reduz, mas não elimina a monta, confirmando que os hormônios na fase adulta do indivíduo não regulam a habilidade de copular, mas estão intimamente relacionados com a motivação (WALLEN, 2001). Também as experiências sociais, armazenadas em áreas cerebrais envolvidas com a memória, como amígdala e hipocampo, parecem regular esta motivação. A freqüência de cópulas está relacionada ao período fértil das fêmeas e como em um grupo social, o sexo envolve risco, a motivação é um fator importante para a regulação da freqüência de cópulas (WALLEN, 2001).
No período após o nascimento dos filhotes, há um aumento de andrógenos (aves: TRAINOR & MARLER, 2002; sagüi comum: BARBOSA, 2003). Estes hormônios atuam nas áreas pré-óptica medial e amígdala medial, podendo ser convertidos em estradiol no interior dos neurônios, promovendo o comportamento de cuidado (TRAINOR & MARLER, 2002). Por este motivo, também os estrógenos estão relacionados à reprodução (NUNES et al., 2002). A conversão de testosterona a estradiol no sistema nervoso central é importante regulador do comportamento sexual de macacos machos (Macaca fascicularis: ZUMPE et al., 1993). Em Saguinus oedipus, sugere-se que a excreção de estradiol está relacionada com a variação da função gonadal, assim como a testosterona (ZIEGLER et al., 2000; BRANDE, 1987). Apesar de evidências de que a testosterona é convertida em estradiol nestas áreas, aumentando o cuidado aos infantes, NUNES et al., (2000) encontraram em C.kuhlii uma diminuição dos valores de testosterona e estradiol 3 a 4 semanas após ao parto, sugerindo ser necessário este declínio para ocorrer o cuidado nesta espécie.
Outro ponto interessante, relacionado ao comportamento reprodutivo do macho, é que na maior parte dos grupos de C. jacchus, somente um macho, o reprodutor, apresenta o comportamento de cópula no grupo social (BAKER et al., 1999). Os machos jovens quase não exibem esse comportamento, embora machos juvenis e adultos jovens sejam vistos em posturas de tentativas de cópulas com suas mães no grupo social (ABBOTT, 1984).
com fêmeas extra-grupo, uma vez que, em grupos no ambiente natural, os machos adultos não reprodutores, foram observados copulando com fêmeas de grupos vizinhos durante encontros inter-grupos (LAZARO-PEREA, 2001; ARRUDA et al., 2005; SOUSA et al., 2005).
Estes encontros inter-grupos são situações favoráveis para cópulas de indivíduos não dominantes, pois dentro do grupo social, existem graus variáveis de inibição do comportamento reprodutivo, através de mecanismos decorrentes da hierarquia de dominância (ABBOTT et al., 1998). Esta inibição é observada em algumas espécies animais, desde invertebrados até mamíferos superiores (ABBOTT et al., 1998). Na manutenção desta hierarquia, no contexto do estro pós-parto da fêmea de C. jacchus, o acesso preferencial à fêmea ovulando parece gerar um estresse a partir da competição intra-sexual (agonismo), gerando por parte dos machos o comportamento de guarda do parceiro (“mating guarding"), uma vez que o macho reprodutor necessita assegurar a exclusividade à cópula com a fêmea dominante (SILVA & SOUSA, 1997).
O estresse pode modificar a atividade reflexa, a percepção sensorial e a atividade locomotora dos primatas (METZ et al, 2001). Esta é uma resposta que pode estar relacionada, principalmente, com comportamentos agonísticos ou de competição e que vem sendo estudada em primatas pela avaliação dos níveis de cortisol (Saimiri sciureus: COE et al., 1978, Callicebus moloch: HENNESSY et al., 1995; Macaca mullata: GUST et al., 1993; C. jacchus: SALTZMAN, et al., 1994). O cortisol atua praticamente em
todos os órgãos do organismo, auxiliando na manutenção da homeostase (KATER, 1999). Além disso, segundo OITZL et al., (1997), existem receptores para o cortisol em todos os órgãos e tecidos, incluindo o cérebro, onde participa em processos de modulação do comportamento cognitivo.
C. jacchus possui um nível muito elevado de cortisol plasmático em condições
basais, com concentrações até 80 vezes maiores do que àquelas encontradas em humanos,
babuínos ou macacos rhesus (WHITEHOUSE & ABAYASEKARA, 2000;
YAMAMOTO et al., 1977; LIPSETT et al, 1984). A globulina ligante de cortisol, nesta espécie, possui a capacidade e a afinidade de ligação ao cortisol reduzida e por isso há maior fração de cortisol livre no plasma sangüíneo (KLOSTERMAN et al., 1986). Em Cebus apella nigritus foi encontrado um aumento do cortisol fecal nos machos após o
nascimento dos filhotes, bem como um aumento da testosterona fecal (LYNCH et al., 2002). ABBOTT et al., (2003b) verificaram que os animais subordinados apresentaram maiores níveis de cortisol em relação aos dominantes. Em C. kuhlii, foi testada a resposta do macho à presença de um animal não pertencente ao grupo, o que não causou alteração significativa nos níveis de excreção de cortisol, entretanto, ocorreu um aumento significativo na testosterona urinária após a exposição a machos de outros grupos (ROSS et al., 2004; NUNES et al., 2001), associado à exibição de comportamentos agonísticos.
técnicas foi bastante importante na verificação de padrões fisiológicos de produção hormonal, bem como para se estabelecerem relações entre estas e a expressão da atividade comportamental dos animais, com ênfase para o comportamento reprodutivo de machos e fêmeas (ZIEGLER et al., 1996; SOUSA & ZIEGLER, 1998).
Estudos em que foi realizada a dosagem de andrógenos em C. jacchus evidenciaram que o hormônio testosterona é quase ausente nas fezes de sagüi comum e o principal metabólito deste esteróide é a androsterona. Os principais andrógenos encontrados nas fezes são a androstenediona, dehidroepiandrosterona e epiandrosterona (CASTRO & SOUSA, 2005) e não parece haver alterações relacionadas ao fotoperíodo na excreção destes hormônios. Em relação ao cortisol fecal também não foram descritas diferenças na concentração deste esteróide em relação ao horário da coleta das fezes e também em relação ao status reprodutivo de machos de C. jacchus (RAMINELLI et al., 2001). Estas pesquisas revelam que é necessário atentar para as variações diurnas em estudos que envolvem a mensuração do perfil de excreção hormonal.
1.4. Socioendocrinologia de machos de C. jacchus
O estudo das relações e influências exercidas pelo ambiente social e hormônios na expressão do comportamento foi denominado de socioendocrinologia, discutida pela primeira vez para primatas por ZIEGLER e BERCOVITCH (1990). Estes autores realçam o papel da inter-relação entre estas variáveis na expressão final do comportamento e, nas duas últimas décadas, muitas informações a partir de estudos experimentais com primatas vivendo no campo e em cativeiro foram disponibilizadas na literatura.
Os estudos que contribuíram com informações mais detalhadas sobre a socioendocrinologia de machos de primatas foram realizados com machos de macacos rhesus (BERCOVITCH & ZIEGLER, 2002). Nesta espécie, embora não haja a inibição
espécies de primatas, as desvantagens reprodutivas decorrem do menor acesso dos subordinados às fêmeas receptivas, diminuindo suas habilidades de cuidado e, consequentemente, seu sucesso reprodutivo. De um modo geral, nos primatas, os machos dominantes apresentam níveis mais elevados de testosterona e testículos mais desenvolvidos que os subordinados (DIXSON & ANDERSON, 2004). Estudos sobre as inter-relações entre comportamento, componente endócrino e ambiente na dinâmica social entre machos de C. jacchus são ainda muito poucos, destacando-se os trabalhos de ABBOTT (1984), BAKER et al., (1999) e CASTRO & SOUSA (2005).
2. OBJETIVOS
2.1. Objetivo geral
Descrever o perfil comportamental e dos hormônios androgênicos e cortisol em machos de sagüi comum, Callithrix jacchus vivendo em grupos naturais.
2.2. Objetivos específicos
1. Determinar o perfil dos comportamentos afiliativos entre machos reprodutores e não reprodutores e entre estes e a fêmea reprodutora;
2. Estabelecer se a freqüência das interações afiliativas de machos reprodutores e não reprodutores com a fêmea reprodutora apresentam variação temporal diurna;
3. Investigar se a freqüência do comportamento de cuidado dispensada aos filhotes difere entre os machos reprodutores e não reprodutores;
4. Verificar se ocorre variação no perfil de excreção de andrógenos e cortisol no macho reprodutor e não reprodutor com o nascimento de filhotes.
5. Verificar se os níveis basais de andrógenos e cortisol diferem entre os machos reprodutores e não reprodutores;
3. HIPÓTESES E PREDIÇÕES
H1. A freqüência de comportamentos afiliativos entre os machos focais e destes em
relação à fêmea reprodutora será diferente para o macho reprodutor e o não reprodutor;
P1a. O macho reprodutor apresentará maior freqüência de comportamentos afiliativos
direcionados à fêmea reprodutora do que o não reprodutor em função da ligação entre o par;
P1b. O macho reprodutor apresentará maior freqüência de comportamentos afiliativos
direcionados ao não reprodutor, do que a fêmea reprodutora, em função do recrutamento de ajudantes.
H2. A freqüência dos comportamentos afiliativos dos animais focais variará ao longo do
dia;
P2. As exibições dos comportamentos afiliativos expressas pelos animais focais
apresentarão o padrão já descrito para a espécie, evidenciando um aumento da catação e proximidade no meio do dia e aumento do contato no final da fase de claro.
H3. O comportamento de cópula com a fêmea reprodutora é exclusivo do macho
reprodutor;
P3. A intensa relação afiliativa entre do par reprodutor e o comportamento de guarda da
parceira impedem o acesso de outros parceiros sexuais a fêmea reprodutora.
H4. Não há diferença em relação à participação dos machos MR e MnR no cuidado
parental;
P4. O cuidado parental será compartilhado entre os machos reprodutor e não reprodutor
H5. Os níveis de andrógenos e cortisol fecais dos machos focais se modificarão com o
nascimento dos filhotes;
P5. Os níveis de cortisol se elevarão nos machos reprodutores e não reprodutores em
função do cuidado à prole; adicionalmente, os andrógenos aumentarão nos machos reprodutores em função do estro pós-parto.
H6. Os machos reprodutores apresentarão níveis basais de excreção de andrógenos fecais
semelhantes em relação àqueles dos machos não reprodutores do mesmo grupo social;
P6. O perfil de excreção de andrógenos dos machos reprodutores e não reprodutores serão
semelhantes em condições basais, indicando competência sexual também do adulto não reprodutor.
H7. O perfil de excreção de cortisol fecal será diferente entre os machos reprodutores e
não reprodutores;
P7. Os níveis médios de excreção fecal de cortisol serão maiores nos machos não
reprodutores, pois animais subordinados estão sob condições de estresse agudo decorrente das relações de dominância.
H8. A expressão de comportamentos agonísticos apresentará correlação positiva com os
níveis de andrógenos e cortisol fecais dos machos;
P8. A emissão de comportamentos agonistas elevará os níveis de cortisol e andrógenos
4. MATERIAL E MÉTODOS
4.1 Local de Estudo
O presente estudo foi desenvolvido na Escola Agrícola de Jundiaí, localizada a 25 km do oceano Atlântico, altitude média de 40 metros, no município de Macaíba, Rio Grande do Norte, Brasil (5°53'S e 35°23'W) (Figura 1). O clima local é uma transição entre os tipos As' e BSh' da classificação de Kõppen, com temperaturas elevadas ao longo de todo ano e chuvas no outono e inverno. A precipitação média anual é de 1.227mm e a temperatura média anual do ar inferida para a área está em torno de 26°C. A temperatura média mensal é relativamente uniforme durante o ano (CESTARO & SOARES, 2004).
4.2. Animais
Foram selecionados e identificados dois grupos naturais de Callithrix jacchus que habitavam a área do Colégio Agrícola de Jundiaí, ambos com 6 indivíduos no início do estudo. A composição dos grupos é mostrada no Quadro I.
O grupo GC1 era formado inicialmente por 6 indivíduos, sendo 3 machos: 2 machos adultos e 1 macho subadulto (que emigrou durante o período do estudo) e 3 fêmeas sendo uma reprodutora, uma em fase de transição entre a idade juvenil e subadulta, uma no estágio infantil. Neste grupo, houve o nascimento de uma prole de dois filhotes, sobrevivendo apenas um, em agosto/2005, indicando, deste modo, que na maior parte do período de observação a fêmea reprodutora encontrava-se gestante. Neste mês também o macho focal não reprodutor emigrou (16/08/2005) de modo que, ao término do estudo o grupo era formado por 6 indivíduos.
O grupo GR2 era formado inicialmente por 5 indivíduos, sendo: 4 machos (2 adultos, 1 subadulto e 1 juvenil) e a fêmea reprodutora. Em julho de 2005, nasceram dois filhotes, indicando que a fêmea encontrava-se gestante durante 4 meses do período de observação. Ao longo do monitoramento, um macho subadulto emigrou também em julho de 2005, de modo que ao término do monitoramento o grupo era formado por 6 animais (Quadro I).
4.2.1. Área de uso dos animais
Na Figura 2 são detalhadas as informações sobre as áreas de uso dos dois grupos monitorados. Os dois grupos não possuíam áreas de uso em comum, e habitavam áreas distantes aproximadamente 500 metros uma da outra
.
F i g u r a 2 . A – V i s ã o g e r a l d a s á r e a s d e u s o
d o s d o i s g r u p o s ; B - O g r u p o G C 1 u t i l i z o u a á r e a c o n t o r n a d a e m a m a r e l o , q u e c o r r e s p o n d e a o r e d o r d a c u n i c u l t u r a ( c o n t o r n a d o d e a z u l ) , a v i á r i o ( i n d i c a d o p o r c o n t o r n o v e r d e ) , c o t o n i c u l t u r a ( c o n t o r n a d o d e v e r m e l h o ) , p a r t e d a e s t r a d a p a r a a p i s c i c u l t u r a ( e m r o x o ) e p i q u e t e m u r a d o ( r e a l ç a d o e m c i n z a ) . A á r e a h a c h u r a d a e m v e r m e l h o c o r r e s p o n d e a o s l o c a i s e m q u e o c o r r e r a m e n c o n t r o s c o m o u t r o g r u p o s o c i a l .
C - O G R 2 u t i l i z o u t o d a á r e a c o n t o r n a d a
d e a z u l , e m f r e n t e e a o l a d o d o r e f e i t ó r i o ( i n d i c a d o p e l o q u a d r a d o a z u l c l a r o ) , á r e a p r ó x i m a a c a s a e m r e f o r m a ( d e m o n s t r a d o p e l o q u a d r a d o v e r d e c l a r o ) , á r e a a t r á s e n a f r e n t e d a c o o r d e n a ç ã o d o t é c n i c o e m a g r o p e c u á r i a ( á r e a i n d i c a d a p o r u m q u a d r a d o v e r m e l h o ) . A á r e a h a c h u r a d a e m v e r m e l h o i n d i c a o s l o c a i s e m q u e o c o r r i a m e n c o n t r o s c o m o u t r o s g r u p o s .
B
A
4.2.2. Marcação dos animais
Todos os animais dos dois grupos escolhidos foram identificados individualmente. Aqueles com o peso acima de 250 g foram considerados adultos e receberam colares com 3 contas coloridas, a primeira conta caracterizando o grupo e as demais contas o indivíduo. Também foi realizada em alguns animais uma marcação complementar usando a pintura dos pêlos utilizando o ácido pícrico, tricotomia da cauda, ou ambos. Apenas um animal adulto do grupo GC1 não foi marcado. No Quadro I é apresentada a forma de marcação de todos os animais.
4.3 Materiais
Para o registro das observações dos animais foram utilizados cronômetro, planilhas impressas em papel, binóculo e gravador.
4.4. Monitoramento dos animais
Cada grupo foi monitorado uma vez por semana durante 5 meses e meio (165 dias), de 14 de abril a 26 de setembro de 2005. A coleta de dados comportamentais foi realizada pelo método focal instantâneo a cada 5 minutos (ALTMANN, 1974), alternando-se a observação dos focais em intervalos regulares de 2 e 3 minutos, durante uma média de 10 horas de observação a cada dia, correspondente a fase de atividade dos animais. Foi registrada a freqüência de todas as variáveis, em um total de observação de 11.563 registros focais. Os animais observados foram o macho reprodutor e um adulto não reprodutor de cada grupo. Foi utilizado o método de todas as ocorrências para os comportamentos de cópula e de agonismo. As categorias comportamentais que foram consideradas para registro estão descritas no Quadro II.
Quadro I. Composição dos grupos durante o estudo, identificação e dados adicionais dos animais do estudo.
COMPOSIÇÃO DOS GRUPOS
MARCAÇÃO DADOS ADICIONAIS
Colar Cauda Tufos
GRUPO GC1 (Cunicultura) Macho reprodutor
MR*(Charles)
Azul, preto, amarelo Porção final pintada
Nascimento set/2003
Macho não reprodutor MnR*(Caio)
Azul, vermelho, azul
Dois pintados
Filho de Cibele(&). Nascimento: jan/2004 Emigração: 16/08/05 Fêmea reprodutora (Catarina) Azul, vermelho, branco Uma tricotomia meio Pintura lado direito
Imigrou como adulta em 17/10/04
Macho adulto (Clóvis) Sem marcação Imigração como adulto em
23/10/04
Fêmea subadulta (Clara)
Pintura braços e pernas
Filha de Cibele(&) Nascimento: jun/04
Fêmea infanto-juvenil (Cecília)
Filha de Catarina Nascimento: jan/05 Infante**
(F1)
Filho de Catarina Nascimento: ago/05
GRUPO GR2 (Informática) Macho reprodutor MR*
(Itamar)
Vermelho, preto, branco
Porção final pintada
1ª Captura abr/2005
Macho não reprodutor MnR* (Ivan)
Vermelho, azul, azul
Dois pintados
1ª Captura abr/2005
Fêmea reprodutora (Ismênia) Vermelho, vermelho, vermelho Uma tricotomia meio
1ª Captura abr/2005
Macho subadulto (Iuri)
Vermelho, branco, branco
Duas tricotomias 1ª Captura abr/2005 Emigrou em jul/2005
Macho juvenil (Israel)
Pintura completa 1ª Captura abr/2005
Dois infantes (F1 e F2)
Filhos de Ismênia Nascimento: 07/2005
(*) Animais focais do estudo; (**) Um dos infantes desapareceu nos primeiros dias após o nascimento; (&) Fêmea reprodutora que antecedeu Catarina.
Quadro II. Categorias comportamentais registradas para os animais focais (macho reprodutor e não reprodutor) de cada grupo e suas definições.
Categorias comportamentais Definições
Comportamentos afiliativos Contato - freqüência registrada em que os animais permaneceram em contato físico
Proximidade - ato de manter-se próximo ao outro até uma distância de 2 m
Catação social - manipular, abrir ou mexer o pelo do outro animal utilizando as mãos ou a boca
Comportamento de cuidado com o filhote(*)
Carregar – transportar o filhote em deslocamento ou parado
Comportamentos agonísticos (**)
Piloereção – ato de eriçar o pelo do corpo e cauda
Perseguição – seguir o animal se deslocando conjuntamente
Marcação de cheiro – esfregar a região genital em algum substrato com ou sem a eliminação de urina
Exposição de genitália – levantamento da cauda e exposição da região genital em direção ao outro animal
Comportamento sexual Cópula - o macho monta a fêmea pelo dorso e apresenta movimentos de vai-e-vem pélvico
Tentativa de cópula - o macho monta a fêmea sem apresentar vai-e-vem pélvico
Deslocamento Ato de movimentar-se em alguma direção, excluindo-se a procura de alimento
(*) Para análise estatística foi considerada a soma dos comportamentos de carregar, catação social do filhote e contato. (**) Os comportamentos agonísticos foram contabilizados pela soma da categoria.
4.5. Coleta de fezes e análise de hormônios esteróides nas fezes
Coleta
novembro a dezembro de 2004 em um estudo piloto. As fezes foram coletadas pela manhã, logo após os animais acordarem, nas proximidades da árvore de dormida seguindo as informações de SOUSA et al., (2002a). Após coletadas, as fezes foram colocadas em tubos eppendorf, devidamente etiquetados com as informações sobre a identidade do animal, horário e data da coleta e estocadas à - 20°C.
Extração
Para a extração, o material foi retirado do freezer e após cerca de 10 minutos em temperatura ambiente, foi homogeneizado com ajuda de espátula, para em seguida ser pesado 0,1 g de fezes úmidas em balança de precisão.
A hidrólise é a primeira etapa da extração, que se constituiu na separação inicial dos esteróides que estavam na forma livre e os que eram solúveis em água, pela presença de conjugação simples. O processo foi realizado como se segue:
1 - Adição à amostra de 2,5 ml de etanol e 2,5 ml de água destilada; 2 – Agitação do material durante 5 minutos;
3 – Centrifugação durante 10 minutos a 3000 rpm;
4 – Decantação da fase líquida da amostra em tubo de vidro de 7 ml com tampa; 5 – Estocagem das amostras no freezer a –20 ºC.
Após a hidrólise segue-se uma segunda etapa, a solvólise, técnica que consiste na separação dos esteróides que estão sob dupla conjugação. Esta etapa foi realizada de acordo com a seguinte seqüência:
1 – As amostras hidrolisadas foram retiradas do freezer, e esperou-se 10 minutos até que atingissem temperatura ambiente; em seguida foram agitadas durante 10 segundos e pipetados 500 l de cada amostra em tubos de vidro de extração/pirex/15 ml, devidamente marcados;
2 – Foram adicionados 100 l da solução de cloreto de sódio (NaCl saturada), 50 l de ácido sulfúrico (H2SO4) e 5 ml de acetato de etila (C4H8O2, solvente orgânico);
4 – Na manhã seguinte os tubos foram retirados do banho-maria e foram adicionados mais 4 ml de acetato de etila e foram agitados durante 5 minutos;
5 – Os tubos foram centrifugados durante 3 minutos a 1.000 rpm;
6 – Em seguida os tubos foram novamente abertos e o sobrenadante foi pipetado com auxilio de pipetas Pauster, sendo transferido para tubos de extração limpos e devidamente numerados;
7 – Foi adicionado 2,5 ml de água filtrada e destilada;
8 - Os tubos foram fechados mais uma vez e agitados durante 5 minutos e centrifugados durante 3 minutos;
9 - A fase superior da amostra foi transferida novamente, utilizando-se pipeta Pauster, desta vez para tubos de vidro (12 x 75 mm), os quais foram levados para secar em fluxo de ar, em banho-maria a 40 ºC;
10 – Após todo volume evaporar, o volume inicial das amostras de 500 l foi refeito utilizando o etanol (C3CH2OH).
Imunoensaio enzimático (ELISA)
obtidos da Sigma Chemical Co (padrões). Para preparação da curva padrão foram utilizadas diferentes concentrações dos padrões, que cobrissem a faixa de variação das concentrações dos hormônios nas fezes do animal. Os coeficientes de variação intra e inter-ensaios para o cortisol foram respectivamente: pool baixo = 2.77% e 7.82%; pool alto= 2,84% e 4,14%; para os andrógenos: pool baixo = 0,95% e 5,72%; pool alto= 1,08 e 5,60%, respectivamente.
4.6. Análise estatística
Considerando o pequeno tamanho da amostra, de apenas quatro animais focais, dois reprodutores e dois não reprodutores, nos resultados foram apresentados os dados individuais dos animais focais analisados com a estatística descritiva usando as médias diárias ou totais e os desvios padrões dos comportamentos e erro padrão para os dados hormonais uma vez que estes últimos apresentaram uma variância grande.
Quando a análise envolveu os dois animais conjuntamente, por grupo (GC1 x GR2) ou por status no grupo social (comparação entre os machos reprodutores (MR) e não reprodutores (MnR) foi usado o teste de Mann-Whitney para determinar as diferenças entre eles.
O teste de Friedman foi usado para analisar a distribuição dos comportamentos afiliativos dos machos com a fêmea reprodutora a cada duas horas, e o teste de Duncan para estabelecer as diferenças entre cada pareamento de dois horários. O teste de Wilcoxon foi utilizado para avaliar as diferenças entre a fase da manhã e da tarde.
O teste de correlação de Sperman foi usado para testar a existência de correlação entre a expressão de comportamentos agonísticos pelos animais focais do GR2 e os níveis de cortisol e andrógenos. Não foi realizado o teste de correlação para o grupo GC1, pois para este grupo, foram registradas poucas interações agonísticas.
5. RESULTADOS
5.1 Análise comportamental
5.1.1. Comportamentos afiliativos dos machos reprodutores e não reprodutores em relação às fêmeas reprodutoras
A análise das freqüências de contato, proximidade e catação social dos machos reprodutores e dos não reprodutores em relação às fêmeas reprodutoras, em ambos os grupos estudados, é mostrada na Figura 3. Como pode ser observada, a freqüênc ia dos comportamentos afiliativos dos machos reprodutores com a fêmea reprodutora foi significativamente maior em relação àquela dos machos não reprodutores (contato: U=611,5, p<0,0001; catação social: U=163,5, p<0,0001; proximidade: U=796,0 p<0,001).
0 2 4 6 8 10 12
Contato Catação Proximidade
C
o
mp
o
rt
a
me
n
to
s
A
filia
ti
v
o
s
MR MnR
*
*
*
*
Figura 3. Freqüência média diária (+DP) de episódios de contato, catação social e proximidade direcionados às fêmeas reprodutoras pelos machos reprodutores (MR, n=2) e não reprodutores (MnR, n=2). * Diferenças significativas, teste U de Mann-Whitney.
A análise da distribuição dos comportamentos afiliativos durante a manhã e a tarde é mostrada na Figura 4. Foram verificadas diferenças significativas em relação à freqüência dos episódios de todos os parâmetros sociais analisados nestes dois intervalos. O contato foi mais
Freqüência
freqüente à tarde e a catação social e a proximidade pela manhã (contato p<0,0001; catação social p<0,0001; proximidade p<0,05).
Figura 4. Freqüência média diária (+DP) dos episódios de contato, catação e proximidade dos machos focais (n=4), direcionados à fêmea reprodutora, durante a manhã (06:00-12:00h) e tarde (12:05 – 18:00h). Teste de Wilcoxon; **p<0,0001, * p< 0,05.
As Figuras 5A, B e C ilustram a distribuição diurna dos três comportamentos afiliativos estudados durante 12 horas da fase de claro. A freqüência de ocorrência de catação social foi mais elevada nos intervalos de 08:00-10:00h e de 10:00-12:00 horas. Para o comportamento de contato, a maior freqüência foi registrada no final da fase de claro (16:00-18:00 horas), enquanto para proximidade, as freqüências significativamente menores também foram registradas neste intervalo. As diferenças estatísticas significativas entre os intervalos de duas horas, para as três variáveis estudadas são mostradas na Figura 5.
0 1 2 3 4 5 6
Contato Catação Proximidade
Freqüência
Manhã Tarde
**
**
0 0.5 1 1.5 2 2.5 3 6:00 às 8:00 8:00 às 10:00 10:00 às 12:00 12:00 às 14:00 14:00 às 16:00 16:00 às 18:00 C ontato d a,c a,b a,c a,c a,b,c 0 0.5 1 1.5 2 2.5 3 6:00 às 8:00 8:00 às 10:00 10:00 às 12:00 12:00 às 14:00 14:00 às 16:00 16:00 às 18:00 Pr ox im ida d e a b b b b a,c 0 0.5 1 1.5 2 2.5 3 6:00 às 8:00 8:00 às 10:00 10:00 às 12:00 12:00 às 14:00 14:00 às 16:00 16:00 às 18:00 Ca ta ç ã o s o c ia l a a a,b a,b,c a,b a,b,c
Figura 5. A – Perfil de distribuição da freqüência média diária (+DP), a cada duas horas dos episódios de contato (A), catação social (B) e proximidade (C), entre os machos focais (n=4) e as fêmeas reprodutoras (n=2) durante 12 horas da fase de claro. As letras diferentes acima das barras indicam as diferenças, teste de Friedman, Duncan (p< 0,05).
A comparação entre a freqüência de comportamentos afiliativos entre os machos reprodutores e as fêmeas reprodutoras (FR) e entre os machos reprodutores e os machos não reprodutores (MnR), dos dois grupos experimentais, é amostrada na Figura 6A. Como pode ser observado os machos reprodutores interagiram afiliativamente de modo semelhante com os dois tipos de parceiros sociais, pois não foram encontradas diferenças estatísticas entre as interações (Mann-Whitney, p > 0,05). Os comportamentos afiliativos foram mais freqüentes entre os machos focais no grupo GR2 do que no grupo GC1, como ilustrado na Figura 6B.
0 4 8 12 16 20
Contato Catação Proximidade
Fr
eq
uenci
a
FR MnR
A
0 4 8 12 16 20
Contato Catação Proximidade
F
re
que
nc
ia
GC1 GR2
B A
5.1.2. Comportamentos de cuidado dos machos focais em relação aos infantes
Na Figura 7A são mostrados os valores individuais de cuidado com os infantes, que no presente estudo incluíram as interações de contato, carregar e catação social dos machos focais em relação aos infantes. De acordo com este perfil, é possível verificar que no grupo 2 foi registrada maior freqüência de cuidado que no grupo 1.
0 4 8 12 16 20
MR MnR
E
pi
s
ódi
os
de
c
u
id
a
d
o
GC1 GR2
Figura 7. A - Freqüência média diária individual de episódios de cuidado com os infantes (+ DP) dos machos reprodutores (MR) e machos não–reprodutores (MnR) nos dois grupos estudados; B- Valores médios de episódios de cuidado dos MRs (n=2) e MnRs (n=2) dos dois grupos.
Foi verificado também (Figura 7B) que não houve diferenças significativas para os valores de freqüência de episódios de cuidado ao infante entre o macho reprodutor e o não
0 2 4 6 8 10 12 20
MR MnR
Epi
s
ódi
os
de
cui
d
ado
reprodutor, para os dois grupos conjuntamente (teste Mann Whitney, U= 119,5, p= 0,6571; n=2).
5.1.3. Comportamentos sexuais dos machos focais
O comportamento de cópula dentro do grupo e em contextos extra-grupo, além das tentativas de cópula registrados nos dois grupos estão apresentados na Tabela 1. De acordo com os valores registrados observa-se que apenas o macho reprodutor do grupo GC1 copulou com a fêmea reprodutora, embora, no grupo GR2 o macho reprodutor tenha copulado também com fêmeas extra-grupo. Ambos os machos não reprodutores tentaram copular com a fêmea reprodutora.
Tabela 1. Ocorrência de cópulas e tentativas de cópulas dos machos reprodutores e não
reprodutores nos dois grupos observados.
Grupo GC1 Datas
MR MnR Cópula FR Tentativa
cópula FR
Cópula extra– grupo
23.10.2004 X 2 0 0
24.10.2004 X 0 3 0
30.05.2005 X 0 0 1
31.06.2005 X 2 0 0
22.08.2005 X 2 0 0
Total 6 3 1
Grupo GR2 Datas
MR MnR Cópula FR Tentativa
cópula FR
Cópula extra– grupo
29.04.2005 X 0 0 1
03.06.2005 X 2 0 0
12.06.2005 X 0 0 1
26.08.2005 X 0 0 2
18.09.2005 X 0 0 1
22.06.2005 X 0 0 2
06.09.2005 X 0 1 0
5.1.4. Comportamentos agonísticos dos machos focais
Foi evidenciada diferença estatisticamente significativa (Mann-Whitney, U=55,39; p<0,001) para a expressão de comportamentos agonísticos entre os dois grupos (Figura 8) quando os dados dos animais focais foram analisados conjuntamente nos contextos de interações agonísticas totais (intra e extra-grupos).
Figura 8. Freqüência média registrada de comportamentos agonistas nos dois grupos estudados. Teste U de Mann-Whitney, * p <0,001.
5.2. Análises hormonais
5.2.1. Concentração de esteróides fecais dos machos focais
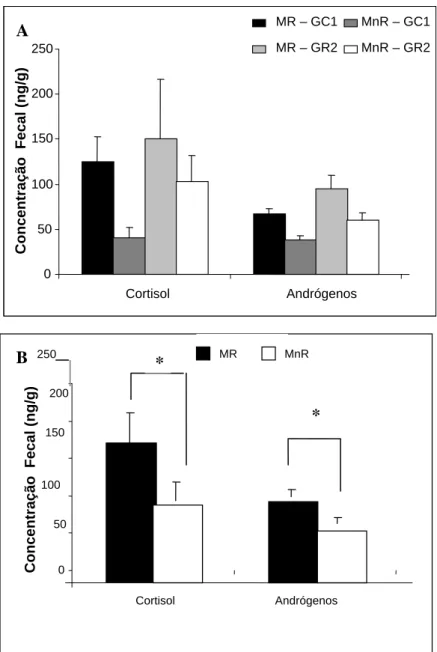
As concentrações médias (+ erro padrão da média) de cortisol e andrógenos excretados nas fezes pelo macho reprodutor e não reprodutor do grupo CG1 foram respectivamente de 137,35 + 40,42 e 62,99 + 24,9 e de 39,96 + 7,7 e 48,65 + 11,89. Para o grupo GR2, a média das concentrações fecais de cortisol para o reprodutor e não reprodutor foram de 145,33 + 84,16 e 105,38 + 38,45 enquanto de andrógenos foram de 87,32 + 17,55 e 68,44 + 9,38, respectivamente. Os perfis médios individuais dos 4 animais focais são mostrados na Figura 9A. De acordo com estes resultados, observa-se que houve uma maior variação no nível de
0 20 40 60 80 100
GC1 GR2
Freqüê
nc
ia
cortisol entre o macho reprodutor e o não reprodutor do grupo GC1, mostrando-se cerca de 50% mais elevado no reprodutor. As demais variações observadas incluíram a diferença de 27% a mais para os níveis médios de cortisol do macho reprodutor em relação ao não reprodutor do grupo GR2 e a de 16% e 22% comparando-se os níveis médios de andrógenos do reprodutor e do não reprodutor dos grupos GC1 e GR2, respectivamente (Figura 9A).
A comparação dos níveis de andrógenos e cortisol entre os grupos, mostrou que há uma diferença significativa nas duas análises (Teste de Mann-Whitney, U=1299, p< 0,05 e U=946, p< 0,05, respectivamente). Pode-se observar que os níveis de ambos os hormônios foram mais elevados no grupo GR2 quando comparou-se os machos reprodutores entre si. Também verifica-se a elevação dos valores médios hormonais do MnR do grupo GR2 em relação ao MnR do grupo GC1 ( Fig 9A).
Figura 9. A - Níveis médios (+ EPM) individuais de excreção fecal, durante todo o período do estudo, de cortisol e andrógenos dos machos reprodutores (MR) e não reprodutores (MnR), nos dois grupos experimentais; B- Níveis médios (+ EPM) de excreção fecal, durante todo o período do estudo, de cortisol e andrógenos dos dois machos reprodutores (MR) e dois não reprodutores (MnR). Teste de Wilcoxon (Cortisol, p= 0,0353; Andrógenos, p= 0,0033).
0 50 100 150 200 250
Cortisol Andrógenos
MR – GC1 MnR – GC1
MR – GR2 MnR – GR2
0 50 100
150 200 250
Cortisol Andrógenos
MR MnR
*
*
Conc
entraçã
o
F
ecal
(ng/
g)
A
B
Conc
entraçã
o
F
ecal
(ng/
5.2.2. Correlação entre os esteróides fecais e os comportamentos agonísticos dos machos do
grupo GR2
Ao ser aplicado o teste de Correlação de Spearman, foi constatada correlação positiva significativa muito alta entre a freqüência de agonismo e a excreção de cortisol fecal (rs= 0,9244; p< 0,0001) e entre o agonismo e a excreção de andrógenos fecais (rs=0,844, p<0,01) para os machos do grupo GR2, como representado nas Figuras 10A e 10B respectivamente.
0 500 1000 1500 2000
0.0 2.5 5.0 7.5
CORTISOL FECAL (ng/g)
F R E Q ÜÊN C IA DE CO M P O R T A M E NT O S AG O N ÍS T IC O S
F i g u r a 1 0 . A - C o r r el a ç ã o e n t r e a s v a r i áv e i s f r e q ü ê n cia d e a g o n i smo e e x c r e ç ã o d e co r t i s o l f e c a l p a r a o s d o i s an i ma i s f o c a i s d o g r u p o G R 2 , S p e a r ma n , p <0 , 0 0 1 .
0 50 100 150 200
0 1 2 3 4 5
Cortisol fecal (ng/g)
Fr eq üê nci a d e C om p o rt am ent os a goni st as
F i g u r a 1 0 . B - c o r r e l aç ã o e n t r e as v a r i áv e i s f r e q ü ên c i a d e ag o n i smo e mé d i a d e ex c r e çã o d e a n d r ó g en o s f e c a i s p a r a o s me s m o s d o i s an i ma i s d o g r u p o G R 2 , S p e a r ma n , p < 0 , 0 1 .
Freqüência de Comportame n tos Agonís tic os 2.5 5.0
ANDROGENOS FECAIS (ng/g)
5.2.3. Perfis hormonais individuais
O perfil individual de excreção fecal de cortisol e andrógenos no período de 14 de abril a 26 de setembro de 2005 são mostrados nas Figuras 11 e 12, para os grupos GC1 e GR2, respectivamente.
0 200 400 600 800 0 5 .nov . 2 1 .nov . 1 0 .dez 1 7 .dez 1 4 .abr 2 4 .abr 2 9 .abr 04 .m a i 13 .m a i 14 .m a i 20 .m a i 24 .m a i 05.j u n 17.j u n 22.j u n 01.j u l 6.j u l 17.j u l 23.j u l 31.j u l 0 3 .ago 1 0 .ago 1 6 .ago 2 2 .ago 2 9 .ago 06.s e t 22.s e t 23.s e t 26.s e t C o rtis ol fe c a l (ng/g) 0 50 100 150 200 250 300 350 A n dr ó g e n o s fecais (n g /g ) Cortisol Andrógenos MR CG1
*
& &*
1600 0 200 400 600 800 05.nov . 21.nov 05.nov .21.nov 14.abr 24.abr 29.abr 05.mai 13.mai 19.mai 20.mai 24.mai
30.mai o 07.j u n 14.j u n 22.j u n 28.j u n 6.j u l 13.j u l 23.j u l 30.j u l 03.ago 10.ago C o rt iso l fecal (n g/g ) 0 50 100 150 200 250 300 350 A n dó g e n o s fecais (ng /g ) Cortisol Andrógenos MnR CG1 & 1600
Figura 11. Perfil de excreção cortisol e andrógenos fecais do macho reprodutor (MR, acima) e não reprodutor (MnR, abaixo) do grupo GC1, durante os meses do estudo. A seta indica o registro de cópulas e o asterisco a ocorrência do comportamento de guarda do parceiro; & = episódios de agonismo; linha preta pontilhada= nascimento de filhotes e linha cheia cinza = separação entre as fases correspondentes aos dados hormonais do estudo piloto e os dados do estudo experimental; linha pontilhada cinza= emigração do macho não reprodutor.
0 400 800 1200 1600 1 5. abr 2 5. abr 01 .m a i 09 .m a i 10 .m a i 21 .m a i 29 .m a i 06. jun 15. jun 23. jun 02. jul 08. jul 12. jul 19. jul 27. jul 09 .a go 16 .a go 27 .a go 07. s et 08. s et 19. s et 24. s et 26. s et C o rt is o l fe cal (ng/ g) 0 50 100 150 200 250 300 350 A n dó geno s fecai s (n g /g) Cortisol Andrógenos MR
GR 2 &
& & & & & & & & & & & & & & & 0 400 800 1200 1600 15. ab r 25. ab r 01. m ai 09. m ai 10. m ai 21. m ai 25. m ai 06. jun 11. jun 15. jun 25. jun 02 .j u l 06 .j u l 19 .j u l 24 .j u l 31 .j u l 03. a go 16. a go 18. a go 19. a go 27. a go 04. s et 08. s et 19. s et 24. s et 26. s et Co rt is o l fe cal (ng /g ) 0 50 100 150 200 250 300 350 An dr óg en os fe c a is (n g /g ) Cortisol Andrógenos MnR GR2 & & & & & & & & & & & & & & & & &
Figura 12. Perfil de excreção de cortisol e andrógenos fecais do macho reprodutor (MR, acima) e não reprodutor (MnR, abaixo) do grupo GR2, durante os meses do estudo. A seta indica o registro de cópulas e o asterisco a ocorrência do comportamento de guarda do parceiro; & = episódios de agonismo; linha preta pontilhada= nascimento de filhotes e linha cheia cinza = separação entre as fases correspondentes aos dados hormonais do estudo piloto e os dados do estudo experimental; linha pontilhada cinza= emigração do macho não reprodutor.
6. DISCUSSÃO
De acordo com os resultados apresentados, destaca-se a relação afiliativa mais intensa dos machos reprodutores com as fêmeas reprodutoras associada aos perfis hormonais diferenciados dos machos reprodutores e não reprodutores dos dois grupos. Outros estudos mostram que o macho reprodutor de Callithrix jacchus apresenta uma relação preferencial com a fêmea reprodutora quando comparada com àquelas desenvolvidas entre os demais componentes do grupo social, representada por maior afiliação, que no presente estudo se expressa nos comportamentos de contato, catação social, proximidade e comportamento sexual de cópulas. Estas interações são evidenciadas principalmente naqueles animais de pares que apresentam maior sucesso reprodutivo (EPPLE, 1970; ROTHE, 1975, EVANS & POOLE, 1983; WOODCOCK, 1982; KENDRICK & DIXSON, 1983; ABBOTT, 1984).
Neste estudo os machos reprodutores apresentaram maior freqüência de
comportamentos afiliativos direcionados às fêmeas reprodutoras, sendo este critério, inclusive, utilizado para definir qual seria o par reprodutor no estudo piloto do grupo GC1 e para a caracterização posterior do par reprodutor no grupo GR2. Estes resultados confirmam a primeira predição da primeira hipótese deste trabalho e são convergentes com os demais relatos da literatura que estudaram casais de C. jacchus vivendo tanto no ambiente de cativeiro
(KENDRICK & DIXSON, 1983; MOTA, 1992) como no ambiente natural
(ALBUQUERQUE, 1998; ALBUQUERQUE et al., 2001).
A constatação de que houve variação diurna nos comportamentos afiliativos durante a manhã e a tarde e nos intervalos a cada duas horas distribuídos ao longo da fase de claro, confirma a segunda hipótese deste estudo. Observou-se que o contato ocorreu com mais freqüência durante a tarde. A análise complementar observando a distribuição a cada duas horas permitiu observar que é no final do período de atividade que os animais intensificam este tipo de interação. Segundo o estudo de CAMAROTTI e MONTEIRO DA CRUZ (1997) o padrão comportamental de “ficar parado” é um dos predominantes para C. jacchus vivendo em grupos naturais, nas duas horas que antecedem o recolhimento dos grupos aos locais de pernoite (cerca de 30% do tempo total), ficando apenas atrás do “andar lento” (cerca de 50%). Neste contexto, como a catação ocupa menos de 10% deste tempo, os animais devem ocupar o restante deste período em contato físico, provavelmente para o reencontro e identificação dos membros do grupo, principalmente próximo ao local de dormida.
A variação diurna na catação social acompanhou o perfil anteriormente relatado por CASTRO et al., (1995), tendo sido mais freqüente no turno matutino, principalmente nos horários entre 08:00 e 12:00 horas. A proximidade, embora não tenha apresentado diferenças no padrão de ocorrência entre a manhã e a tarde, se elevou de modo significativo ao redor do meio-dia, coincidindo com os horários de elevação da catação social e são similares aos relatados por MENEZES et al., (1994) e MOTA et al. (1993) e também por SOUSA & MOISÉS (1997). Esta resposta parece decorrer de uma diminuição da atividade motora dos animais durante a fase mais quente do dia (ALONSO & LANGUTH, 1989).
descrito por LAZARO-PEREA (2001). Além disso, pode-se também supor o papel funcional de redutor de tensão, relacionado à catação social, pois este comportamento foi o que mais aumentou no grupo GR2.
Além das relações afiliativas entre o par reprodutor, os comportamentos afiliativos são utilizados para estabelecer ligações entre os membros do grupo social em geral (LAZARO-PEREA, 2001), incluindo a relação mãe-filhote e entre animais adultos do grupo social. Em C. jacchus os machos parecem formar uma relação menos competitiva entre eles do que aquela
registrada para as fêmeas (BAKER et al., 1999; CASTRO e SOUSA, 2005). RYLANDS (1996) sugere que a poliandria registrada para C. flaviceps pode ser uma estratégia evolutivamente estável quando os machos não dispõem de condições satisfatórias para emigrar. Ao mesmo tempo haveria o favorecimento das fêmeas, pois mais de um macho adulto no grupo social aumentaria a disponibilidade de ajudantes para os infantes. Para que machos adultos co-habitem em um mesmo grupo, se pressupõe que mecanismos de tolerância e afiliação entre os machos devem ter evoluído. SOUSA et al., (2002b) encontraram que os machos alteram mais seus níveis de cortisol diante da separação do parceiro sexual do que as fêmeas, indicando que os machos estão menos adaptados para abandonar o grupo social e por isso são o sexo que emigram menos freqüentemente. Vale a pena salientar, entretanto, que a despeito de evidências de ocorrência de poliandria (RYLANDS, 1996) e poliginia (DIGBY & FERRARI, 1994) nos calitriquídeos, uma revisão recente sobre o sistema de acasalamento para C. jacchus, a partir do monitoramento de longo prazo de grupos silvestres, descreve que este é principalmente monogâmico podendo, eventualmente, ser poligínico (ARRUDA et al., 2005).
Em relação à freqüência de cópulas, os machos reprodutores foram os únicos que copularam com as fêmeas reprodutoras, confirmando a predição da terceira hipótese, e em acordo com dados registrados em estudos de grupos na Estação de Nísia Floresta (ALBUQUERQUE et al., 2001; ALBUQUERQUE, 2003; ARRUDA et al., 2005) em ambiente natural. Entretanto, ao contrário do que foi registrado por outros autores, neste estudo foram registradas cópulas extra-grupo do macho reprodutor.
O comportamento de cuidado parental que neste estudo incluiu o carregar, a catação social e o contato com os filhotes foi semelhante para machos reprodutores e não reprodutores. O sagüi comum apresenta cuidado cooperativo e além da mãe e do pai outros animais do grupo auxiliam nesta função (INGRAM, 1977; YAMAMOTO, 1990; ARRUDA, 1992). FERRARI (1987, 1992) também não encontrou diferenças no tempo de carregar os filhotes de C. flaviceps, entre o macho reprodutor e outros machos adultos do grupo social. As vantagens
da participação dos ajudantes no cuidado é discutida na literatura em termos de aquisição de habilidades no cuidado que aumentam o sucesso reprodutivo do cuidador, além de aumentar a aptidão inclusiva, naqueles casos onde o infante é seu parente (SNOWDON, 1996). Neste caso, a quarta hipótese foi também confirmada.
A modulação hormonal do cuidado parental parece envolver a prolactina. O cortisol se eleva significativamente apenas em pais experientes após o nascimento dos filhotes (MOTA et al., 2006). Neste estudo observou-se que elevações nos perfis individuais de cortisol foram
registradas em todos os animais focais, principalmente nos animais reprodutores após o nascimento dos filhotes e que estes potencialmente eram experientes no cuidado de filhotes nascidos no grupo social pois em ambos existiam filhotes na idade infantil, juvenil ou subadulta. Nesta fase também foram registradas cópulas entre os pares reprodutores dos dois grupos, provavelmente em função do estro pós-parto.
estudos realizados com pais e filhos de C. jacchus. CASTRO & SOUSA (2005), observaram uma excreção maior de andrógenos fecais em filhos adultos em relação aos seus pais, cujas mães encontravam-se grávidas. BAKER et al, (1999) não evidenciaram diferenças nos níveis de testosterona entre pais e filhos. Esta diferença pode estar associada ao grau de parentesco, pois no presente estudo, provavelmente, os machos não são pais e filhos. Outro fato é que os machos reprodutores vivendo em ambiente natural estão sob influência de outras variáveis ausentes do ambiente de cativeiro, como outras oportunidades para o acasalamento. Neste caso, os machos reprodutores apresentaram níveis mais elevados de andrógenos que os não reprodutores podendo também estar associado aos encontros entre grupos.
No grupo GR2 ocorreu maior freqüência de comportamentos agonísticos que no grupo GC1. Segundo DIGBY (1995), a expressão do comportamento agonístico dentro de grupos sociais estáveis é rara, como está evidenciado na relação entre os focais observados.
Alguns fatores particulares do ambiente natural podem estar diferenciando o perfil de excreção de hormônios encontrado em machos de cativeiro, como, por exemplo, a desconhecida relação de parentesco entre os membros do grupo e assim, não se poderá levar em consideração a sugestão de evitação de incesto sugerida por BAKER et al, (1999). Os freqüentes encontros entre grupos registrados para o grupo GR2 adicionam ao macho a preocupação de guarda da fêmea, que fica mais vulnerável a cópulas com outros machos do que em ambiente de cativeiro. Portanto, as predições relacionada às hipóteses 5, 6 e 7 devem ser discutidas conjuntamente, uma vez que a dinâmica da vida no ambiente natural não permite separar os diferentes fatores envolvidos no perfil de secreção de cortisol e andrógenos. Pode-se supor, portanto que os níveis mais elevados de andrógenos observados para os machos reprodutores refletem o papel de liderança do macho, na defesa do território e monopolização da parceira reprodutiva.
do que os níveis de cortisol. A variação nos andrógenos também esteve relacionada à ocorrência de cópulas.
Não foram encontrados perfis basais de cortisol diferentes entre machos reprodutores e não reprodutores o que de certo modo era esperado uma vez que o agonismo intra-grupo é baixo (DIGBY & BARRETO, 1993; LAZARO-PEREA, 2001). Todavia, restava a constatação se havia de algum modo uma resposta de estresse apresentada pelos machos não reprodutores em relação aos reprodutores. Tem-se a indicação, portanto, que isto não parece ocorrer, reforçando que as relações de dominância entre machos não envolve inibição nos mecanismos de regulação da reprodução e aponta para mecanismos de inibição do comportamento sexual ou evitação de incesto, como sugerido por BAKER et al., (1999).
As alianças desenvolvidas entre os machos do mesmo grupo social, geram uma estabilidade para o mesmo. Deste modo, a emigração do macho MnR do grupo GC1 pode ter promovido uma instabilidade, que levou ao aumento dos níveis hormonais do MR. Esta elevação indica prontidão a eventuais disputas pela manutenção do posto de dominante. Associe-se a este fato a condição da fêmea reprodutora na ocasião, pois esta se encontrava no período fértil, o que deve redobrar a necessidade de sua guarda.
Na comparação efetuada entre grupos em relação ao perfil de excreção de hormônios, o GR2 apresentou maior perfil de excreção, principalmente, pela presença de encontros entre grupos, evidenciada na correlação positiva entre os comportamentos agonísticos e ambos os hormônios, cortisol e andrógenos. Estes resultados corroboram a oitava hipótese do presente estudo, sugerindo que ambos os hormônios respondem com elevação em contextos de agonismo.
interações agressivas em sagüis. Uma outra justificativa para os níveis de andrógenos aumentarem quando ocorrem encontros entre grupos está no fato de que durante estas situações há a oportunidade dos machos copularem (ARAUJO, 1996; LAZARO-PEREA et al., 2001), como foi observado tanto para os machos reprodutores como não reprodutores
7. CONCLUSÕES
a) As interações afiliativas e sexuais entre o macho e a fêmea reprodutores são mais intensas do que aquelas do macho não reprodutor com a fêmea reprodutora, relacionadas à ligação afiliativa entre o par;
b) Os níveis de interação afiliativa de machos reprodutores com as fêmeas reprodutoras e destes com os machos não reprodutores são semelhantes, sugerindo, respectivamente, a ligação entre o par e recrutamento de ajudantes para defesa de território, para o cuidado com os infantes, ou ambos; pode ainda estar associado aos mecanismos de redução de tensão pós-encontros agonistas;
c) As interações afiliativas entre os machos reprodutores e não reprodutores com as fêmeas reprodutoras apresentam variação diurna, associadas a temporizarão da atividade comportamental;
d) A ocorrência de cópulas das fêmeas reprodutoras foram exclusivas com os machos reprodutores embora estes tenham também copulado com fêmeas extra-grupo, levantando a possibilidade de cópulas;
e) O cuidado com os infantes aferido pela somatória dos comportamentos de carregar, catação social e contato é semelhante para os machos reprodutores e não reprodutores provavelmente decorrentes dos mecanismos da aptidão abrangente;
g) Os níveis basais médios de cortisol e andrógenos são significativamente mais elevados nos machos reprodutores do que nos não reprodutores, provavelmente relacionados à dinâmica de atuação do macho reprodutor em grupos naturais, que inclui ficar à frente da defesa de território, atividades de vigilância, guarda da parceira entre outros;
h) A concentração fecal de andrógenos e cortisol se correlacionam positivamente com a expressão de comportamentos agonistas pelos machos, sugerindo que estas elevações são conseqüentes aos confrontos entre co-específicos de grupos sociais diferentes.
8. REFERÊNCIAS BIBLIOGRÁFICAS
ABBOTT, D.H. & HEARN, J.P. (1978). Physical, hormonal and behavioural aspects of sexual development in the marmoset monkey, Callithrix jacchus . Journal of Reproduction and Fertlity, 63, 335-345.
ABBOTTT, D.H. (1984). Behaviour and physiological suppression of fertility in subordinate marmoset monkeys. American Journal of Primatology, 6, 169-186.
ABBOTT, D.H. (1987). Behaviourally mediated suppression of reproduction in female primates. Journal of Zoology London, 213, 455-470.
ABBOTT, D. H.; SALTZMAN, W.; SCHULTZ-DARKEN, N. J. & TANNENBAUM, P. L. (1998). Adaptations to subordinate status in female marmoset monkeys. Comparative Biochemistry and Physiology, 119, 261-274.
ABBOTT, D.H.; KEVERNE, E.B.; BERCOVITCH, F.B.; SHIVELY, C.A.; MENDOZA, S.P.; SALTZMAN, W.; SNOWDON, C.T.; ZIEGLER, T.E.; GARLAND JR, T. & SAPOLSKY, R.M. (2003a). Are subordinates always stressed? A comparative analysis of rank differences in cortisol levels among primates. Hormones and Behaviour, 43, 67-82.
ABBOTT, D.H.; BARNETT, D.K.; COLMAN, R.J.; YAMAMOTO, M.E & SCHULTZ-DARKEN, N.J. (2003b). Aspects of common marmoset basic biology and life history important for biomedical research, overview. Comparative Medicine, 53, 339-350.
ADKINS-REGAN, E. (1998). Hormonal mechanisms of mate choice. American Zoologist, 38, 166-178.
ALBUQUERQUE, A.C.R.S. (1998). Interações sociais e concentrações de esteróides fecais de fêmeas adultas e sua repercussão sobre o sistema de acasalamento em grupo silvestre do sagüi, (Callithrix jacchus). Dissertação de Mestrado em Psicobiologia, Natal: UFRN, 81 p.
ALBUQUERQUE, A.C.S.R.; SOUSA, M.B.C.S.; SANTOS, H.M. & ZIEGLER, T.E. (2001). Behavioral and hormonal analysis of social relationships between oldest females in a wild monogamous group of common marmosets (Callithrix jacchus ). International Journal of Primatology,22, 631-645.
ALONSO, C. & LANGUTH, A. (1989). Ecologia e Comportamento de Callithrix jacchus (Primates: Callitrichidae) numa ilha de floresta Atlântica. Revista Nordestina de Biologia, 6, 105-137.
ALTMANN, J. (1974). Observational study of behavior: sampling methods. Behaviour, 49, 227-267.
ARAUJO, A. & YAMAMOTO, M.E. (1993). Reação a intrusos da mesma espécie em Callithrix jacchus : Influência no status social. Em: M.E. Yamammoto & M.B.C. Sousa (Orgs.), A Primatologia no Brasil, 4 (pp. 15-34). Natal: Edurfn.
ARAÚJO, A. 1996. Influence des facteurs écologiques, comportementaux et démografhiques sur la dispersion de Callithrix jacchus. Tese de Doutorado. Paris: Université Paris-Nord (Paris XIII). 234 p.
ARRUDA, M. F. (1992). Separação do pai e da mãe em filhotes de sagüi comum (Callithrix jacchus em idade precoce. Tese de Doutorado. São Paulo: EPM.
ARRUDA, M. F.; ARAUJO, A.; SOUSA, M.B.C.S.; ALBUQUERQUE, A.C.S.R. & YAMAMOTO, M.E. (2005). Two breeding females within free-living groups may not always indicate polygyny: Alternative subordinate female strategies in common marmosets (Callithrix jacchus). Folia Primatologica, 76, 10-20.
AURICCHIO, P. (1995) Primatas do Brasil, Projeto Editorial: UnG, Goiânia,Goiás.
ÁVILA-PIRES, F.D. (1969). Taxonomia e zoogeografia do gênero Callithrix ERXLEBEN, 1777 (Primates, Callithrichidae). Revista Brasileira de Biologia, 29, 49-64.
BARBOSA, M.F.P.P. (2003). Níveis de esteróides e comportamentos sócio-sexuais do par reprodutor de Callithrix jacchus durante os períodos de gestação e pós-parto. Tese de doutorado, Universidade Federal do Rio Grande do Norte, Natal.
BERCOVITCH, F.R. & ZIEGLER, T.E. (2002). Current topics in primate
socioendocrinology. Annual Review of Anthropology, 31, 45-67.
BRAND, H.M. (1987). Urinary oestrogen excretion in the adult male cotton-topped tamarin (Saguinus oedipus oedipus). International Journal of Primatology, 8, 545- 458.
CAMAROTTI, F.L.M. & MONTEIRO DA CRUZ, M.A.O. (1997). Fatores ecológicos e comportamentais implicados na seleção e uso dos locais de pernoite de grupos de Callithrix jacchus em ambiente natural. Em: M.B.C. Sousa & A.A.L. Menezes (Orgs.), A Primatologia no Brasil, 6 (pp. 27-42). Natal: Edufrn.
CASTRO, D.C., (2000), Estudo do perfil da excreção fecal de testosterona em sagüi comum, Callithrix jacchus Primate:Callitrichidae) vivendo em cativeiro. Dissertação de Mestrado em Psicobiologia, Natal: UFRN, 65p.
CASTRO, C.S.S.; MENEZES, A.A.L.; QUEIROZ, J.W. & MOREIRA, L.F.S. (1995). Estudos dos ritmos biológicos da catação no sagüi comum (Callithrix jacchus ) em ambiente natural. Em: S.F. Ferrari & H. Schneider (Orgs.), A Primatologia no Brasil 5, (pp. 59-70). Belém: Editora Universitária UFPA.
CASTRO, D.C. & SOUSA, M.B.C. (2005). Fecal androgen levels in common marmoset (Callithrix jacchus ) male living in captive family groups. Brazilian Journal of Medical and Biological Research, 38, 65-72.
CERQUEIRA, R.; G. MARROIG & PINDER, L. (1998). Marmosets and Lion-tamarins distribution (Callitrichidae, Primates) in Rio de Janeiro State, South-eastern Brazil. Mammalia, 62, 213-226.