Roberto Martins Gonçalves
Avaliação do perfil de quimiocinas e sua correlação
com a intensidade do processo inflamatório nas
retinocoroidites supostamente toxoplásmicas.
Belo Horizonte
Faculdade de Medicina da UFMG
Roberto Martins Gonçalves
Avaliação do perfil de quimiocinas e sua correlação
com a intensidade do processo inflamatório nas
retinocoroidites supostamente toxoplásmicas.
Tese apresentada ao Curso de Doutorado da Faculdade de Medicina da Universidade Federal de Minas Gerais, como requisito parcial à obtenção do título de Doutor em Medicina.
Área de concentração: Oftalmologia. Orientador: Prof. Dr. Fernando Oréfice.
Co-orientador: Prof. Dr. Antônio Lúcio Teixeira. Universidade Federal de Minas Gerais.
Faculdade de Medicina da UFMG
Belo Horizonte – Minas Gerais – Brasil
2006
Gonçalves, Roberto Martins
G635a Avaliação do perfil de quimiocinas e sua correlação com a intensidade do processo inflamatório nas retinocoroidites supostamente toxoplásmicas/Roberto Martins Gonçalves. Belo Horizonte, 2006.
122f., il.
Tese.(doutorado) – Universidade Federal de Minas Gerais. Faculdade de Medicina.
Área de concentração: Oftalmologia Orientador: Fernando Oréfice
Co-orientador: Antônio Lúcio Teixeira
1.Toxoplasmose ocular/complicações 2.Uveíte posterior/etiologia 3.Coriorretinite/etiologia 4.Quimiocinas CXC/sangue 5.Retina/ imunologia I.Título
Magnífico Reitor
Prof. Ronaldo Tadêu Pena
Pró-Reitor de Pós-Graduação
Prof. Jaime Arturo Ramirez
Pró-Reitor de Pesquisa
Prof. Carlos Alberto Pereira Tavares
Diretor da Faculdade de Medicina
Prof. Francisco José Penna
Diretora do Hospital das Clínicas
Profa. Tânia Mara Assis Lima
Coordenador do Centro de Pós-Graduação da Faculdade de Medicina
Prof. Carlos Faria Santos Amaral
Coordenador do Curso de Pós-Graduação em Oftalmologia
Prof. Joel Edmur Boteon
Chefe do Departamento de Oftalmologia, Otorrinolaringologia e Fonoaudiologia
Profa. Ana Rosa Pimentel de Figueiredo
Membros do Colegiado do Curso de Pós-Graduação em Oftalmologia
Prof. Joel Edmur Boteon Prof. Márcio Bittar Nehemy Prof. Marco Aurélio Lana Peixoto
Prof. Sebastião Cronemberger Sobrinho Prof. Evaldo Nascimento
Prof. Fernando Oréfice
Prof. Henderson Celestino de Almeida Prof. Homero Gusmão de Almeida
COM A INTENSIDADE DO PROCESSO INFLAMATÓRIO NAS RETINOCOROIDITES SUPOSTAMENTE TOXOPLÁSMICAS”, apresentada e defendida, em sessão pública, por ROBERTO MARTINS GONÇALVES, para a obtenção do Grau de Doutor em Medicina, pelo programa de Pós-Graduação em Oftalmologia da Faculdade de Medicina da Universidade Federal de Minas Gerais.
___________________________________ Prof. Fernando Oréfice Orientador Universidade Federal de Minas Gerais
___________________________________ Prof. Antônio Lúcio Teixeira Co-orientador Universidade Federal de Minas Gerais
___________________________________ Prof. Wesley Ribeiro Campos Universidade Federal de Minas Gerais
___________________________________ Dr. Décio Costa Lima Júnior
___________________________________ Prof. André Luiz Land Curi FIOCRUZ
___________________________________ Prof. Joel Edmur Boteon Universidade Federal de Minas Gerais
___________________________________ Prof. Carlos Eduardo Hirata
Universidade de São Paulo
Aos meus queridos pais: exemplos de amor, dedicação, humildade, perseverança e cumplicidade com os filhos. Nos quais procuro me espelhar em todos os momentos da minha vida.
À minha esposa Alinne, companheira que me motiva sempre e que compreendeu bem os esforços exigidos para a concretização deste sonho.
A Rodrigo, Rogério e Rachel, pelo estímulo e companheirismo.
Ao Professor Dr. Fernando Oréfice, Titular do Departamento de Oftalmologia da Faculdade de Medicina de Minas Gerais, pela disponibilidade e dedicação dispensadas à orientação deste trabalho; pelo carinho e orientação indispensáveis à minha formação médica. Exemplo de profissional dedicado ao estudo das Uveítes e ao ensino da Oftalmologia.
Ao Professor Dr. Antônio Lúcio Teixeira Júnior, co-orientador deste trabalho, pela valiosa ajuda e orientação na difícil área da Imunologia. Tornei-me um admirador da sua imensa capacidade científica e sabedoria na área médica.
Ao Professor Dr. Wesley Ribeiro Campos, Chefe do Serviço de Uveítes do Hospital São Geraldo, pelos ensinamentos muitas vezes despretensiosos, mas sempre profundos, que é peculiar ao seu jeito de transmitir conhecimento. Exemplo de sabedoria abrangente em Oftalmologia.
Ao Professor Dr. Mauro Martins Teixeira, Chefe do Laboratório de Imunofarmacologia, Departamento de Bioquímica e Imunologia, Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais, pela disponibilização de toda infra-estrutura necessária para a realização da parte laboratorial deste trabalho.
À Bernadete e Adriana, funcionárias do Serviço de Uveítes do Hospital São Geraldo, pela intensa colaboração no acompanhamento dos pacientes envolvidos no estudo e na coleta de sangue para análise das quimiocinas.
Ao Antônio Lúcio França, Rosélia Maria, Inayana Barbosa, Eluzia Castro, funcionários do Laboratório Imunolab, que me receberam com o maior carinho nos seus ambientes de trabalho, orientando-me na preparação do soro para análise das quimiocinas e colocando toda a estrutura do laboratório à minha disposição.
Introdução: As quimiocinas representam um grupo específico de citocinas que exercem um papel fundamental na modulação da angiogênese e na migração
de leucócitos para os tecidos oculares durante os quadros de inflamação
intra-ocular.
Objetivo: Avaliar as concentrações séricas das quimiocinas CCL2, CCL11, CXCL8, CXCL9 e CXCL10 nos pacientes com retinocoroidite de etiologia
supostamente toxoplásmica (RCST) comparado-as ao grupo de pacientes sem
história de uveíte e correlacionando-as aos achados oftalmológicos.
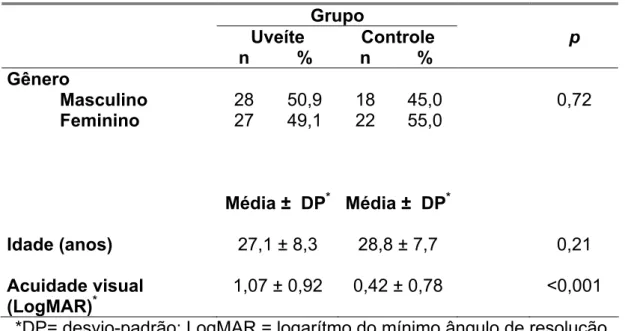
Metodologia: Cinqüenta e cinco pacientes com RCST (Grupo Uveíte) e 40 pacientes sem uveíte (Grupo Controle) foram incluídos neste estudo. Avaliação
oftalmológica foi realizada em todos os indivíduos, incluindo: medida da
acuidade visual (LogMAR), biomicroscopia do segmento anterior, oftalmoscopia
binocular indireta ou direta e medida da pressão ocular. Coleta de sangue foi
realizada após o exame oftalmológico. Os pacientes do Grupo Uveíte
receberam tratamento específico e, após a resolução do processo inflamatório,
nova coleta de sangue foi realizada em 18 sujeitos. Para a análise das
concentrações séricas das quimiocinas, foi utilizado o ensaio imunoenzimático
ELISA.
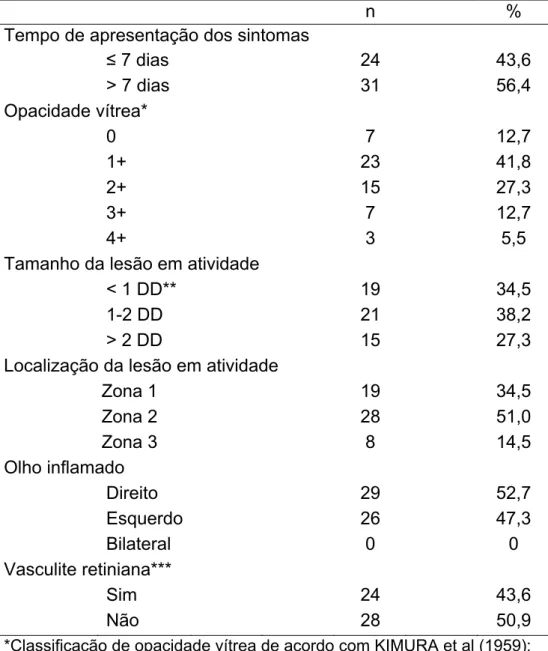
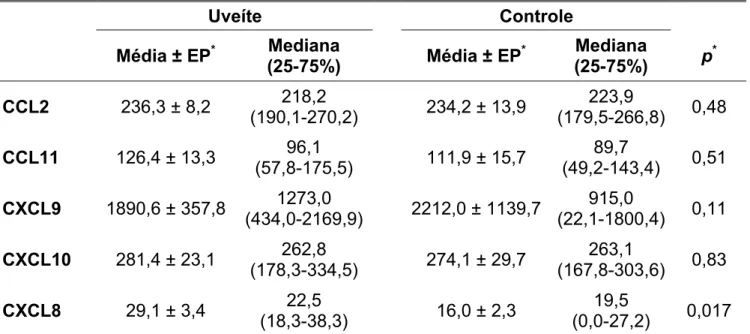
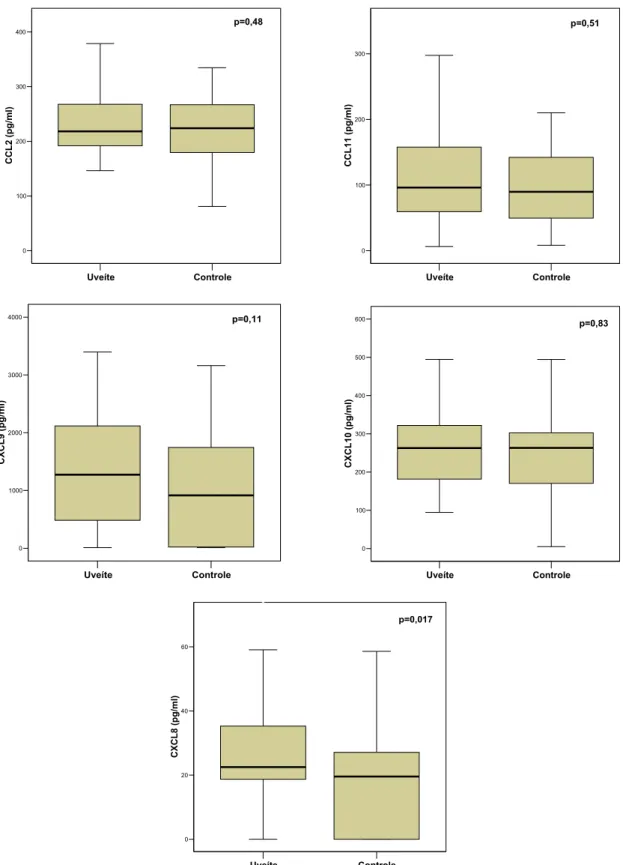
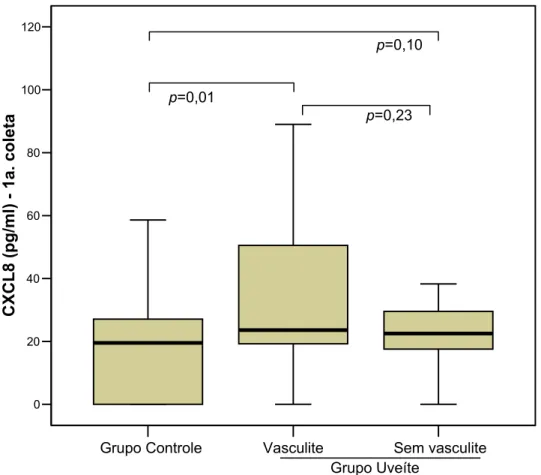
Resultados: A concentração sérica da quimiocina CXCL8 foi maior no Grupo Uveíte quando comparado ao Grupo Controle. Vasculite retiniana ocorreu em
43,6% dos pacientes do Grupo Uveíte e esteve relacionada a uma maior
concentração sérica da CXCL8. Não houve correlação entre a intensidade das
disco óptico apresentaram níveis mais elevados de CXCL8. Houve também
correlação positiva entre o tamanho da lesão e os níveis de CXCL9. Houve
uma queda estatisticamente significativa dos níveis de CXCL8 após o
tratamento específico e a cicatrização da lesão de retinocoroidite.
Conclusões: Os níveis séricos da quimiocina CXCL8 estão aumentados nos pacientes com RCST ativa, correlacionando-se com a presença de vasculite
retiniana e lesões de maiores dimensões. Os níveis de CXCL8 diminuem com o
Introduction: chemokines are a specific group of cytokines that has an important role in the angiogenesis and in leucocyte migration into the eye during
intraocular inflammation.
Purpose: to evaluate serum levels of the chemokines CCL2, CCL11, CXCL8, CXCL9 and CXCL10 in patients with presumed acute toxoplasmic
retinochoroiditis, compare them to the patients without history of uveitis and to
correlate them to ophthalmic findings.
Methods: 55 patients with presumed toxoplasmic retinochoroiditis (Uveitis Group) and 40 patients without history of uveitis (Control Group) were selected
to this study. Ophthalmic evaluation was made in all patients and included:
visual acuity measure (LogMAR), anterior segment biomicroscopy, direct or
indirect binocular opthalmoscopy and ocular pressure measure. Blood sample
was collected in all patients after the ophthalmic evaluation. The patients of
Uveitis Group received specific treatment and after resolution of the
inflammatory process, new blood sample was collected in 18 subjects. To
evaluate serum concentrations of the chemokines was used ELISA
immunoassay.
Results: the serum concentration of the CXCL8 chemokine was higher in the Uveitis Group when compared to the Control Group. The presence of retinal
vasculitis was one finding in 43.6% to patients of the Uveitis Group and was
correlated with a higher serum concentration of CXCL8. There was not
correlation between intensity of vitreous opacities and serum concentrations of
There was one positive correlation between the size of lesion and the levels of
CXCL9. There was statistically decrease in the serum levels of CXCL8 after
treatment and healing of active retinochoroiditis.
Conclusions: levels of CXCL8 are increased in serum of patients with presumed acute toxoplasmic retinochoroiditis and correlates with the presence
of retinal vasculitis and major ocular lesions. Levels of CXCL8 decrease with
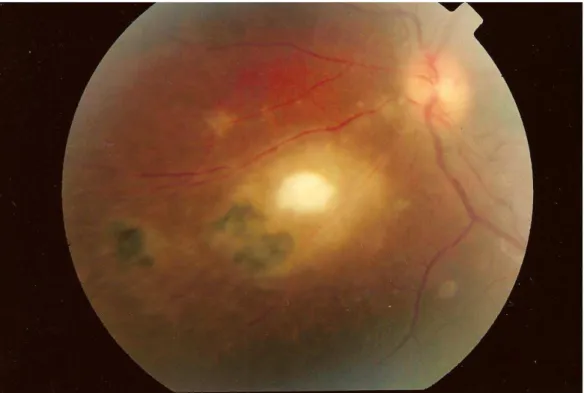
Figura 1 – Retinografia de paciente do Grupo Uveíte evidenciando lesão de retinocoroidite em atividade e opacidade vítrea classificada como 1+/4+ ... 63
Figura 2 – Retinografia de paciente do Grupo Uveíte evidenciando lesão de retinocoroidite em atividade e opacidade vítrea classificada como 2+/4+... 64
Figura 3 – Retinografia de paciente do Grupo Uveíte evidenciando lesão de retinocoroidite em atividade e opacidade vítrea classificada como 3+/4+... 64
Figura 4 – Retinografia de paciente do Grupo Uveíte evidenciando lesão de retinocoroidite em atividade e opacidade vítrea classificada como 4+/4+... 65
Figura 5 – Retinografia de paciente do Grupo Uveíte evidenciando presença de vasculite retiniana... 65
Gráfico 1 – Representação em box-plot dos níveis séricos (pg/ml) de todas as quimiocinas estudadas, tanto no Grupo Uveíte quanto no Grupo Controle... 74
Gráfico 2 – Níveis séricos de CXCL8 (pg/ml) nos pacientes do Grupo Controle e nos pacientes que apresentavam ou não vasculite retiniana no Grupo Uveíte... 77
Gráfico 3 – Representação em box-plot dos níveis séricos (pg/ml) de CXCL8 de acordo com o tamanho da lesão de RCST em atividade... 80
Gráfico 4 – Representação em box-plot dos níveis séricos (pg/ml) de CXCL9 de acordo com o tamanho da lesão de RCST em atividade... 80
Tabela1 – Quimiocinas humanas identificadas... 44
Tabela 2 – Características quanto à idade, gênero e acuidade visual dos pacientes envolvidos no estudo... 71
Tabela 3 – Características do primeiro exame oftalmológico nos pacientes com RCST aguda (Grupo Uveíte)... 72
Tabela 4 – Níveis séricos (pg/ml) das quimiocinas estudadas nos dois grupos... 73
Tabela 5 – Coeficiente de correlação de Pearson para avaliar a influência da idade nas concentrações séricas das quimiocinas estudadas.... 75
Tabela 6 – Coeficiente de correlação de Pearson para avaliar a influência do sexo dos pacientes nas concentrações séricas das quimiocinas estudadas... 75
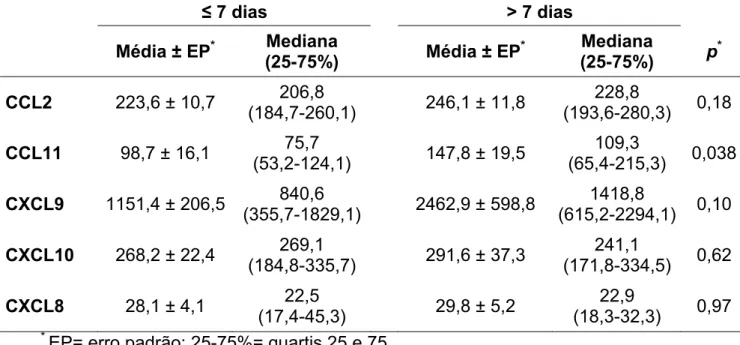
Tabela 7 – Níveis séricos (pg/ml) das quimiocinas divididas de acordo com o intervalo de tempo entre os primeiros sintomas relatados pelos pacientes do Grupo Uveíte e a primeira coleta de sangue... 76
Tabela 8 – Níveis séricos (pg/ml) das quimiocinas nos pacientes que apresentavam ou não vasculite retiniana associada ao quadro de RCST ativa (Grupo Uveíte) e no Grupo Controle... 78
Tabela 9 – Níveis séricos (pg/ml) das quimiocinas de acordo com a intensidade das opacidades vítreas no Grupo Uveíte... 79
APC Antigen-presenting cell – célula apresentadora de antígenos
CC família de quimiocinas com resíduo de cisteína adjacente
CCR, CXCR, CX3CR,
XCR receptores de quimiocinas
COEP Comitê de Ética em Pesquisa
CTL Células T CD8+ efetoras citotóxicas ou citolíticas
CX3C família de quimiocina com resíduos de quimiocinas separadas por três aminoácidos
CXC família de quimiocinas com resíduos de quimiocinas separadas por um aminoácido
DD diâmetro do disco óptico
ELISA Enzyme-Linked Immunoabsorbent Assay – Ensaio Enzimático de Imunoabsorção
EPR estrato pigmentoso da retina
G-CSF granulocyte-colony-stimulating factor – fator estimulador de colônia de granulócitos
GM-CSF granulocyte-monocyte-colony-stimulating factor – fator estimulador de colônia de granulócitos-macrófagos
HLA Human leucocyte antigens – antígenos leucocitários humanos
ICB Instituto de Ciências Biológicas
Ig imunoglobulina
IL interleucina
kDa quilodaltons
Kg quilograma
LogMAR logarítmo do mínimo ângulo de resolução
M molar
M-CSF macrophage-colony-stimulating factor – fator estimulador de colônia de monócitos-macrófagos
mg miligrama
ml mililitros
NK natural-killer cells – células natural killers o
C grau centígrado
RCST retinocoroidite supostamente toxoplásmica
RNAm ácido ribonucléico mensageiro
RPM rotações por minuto
TCR T Cell Receptor – Receptor de células T
Th Linfócitos T auxiliares (helper), ou padrão de resposta imunológica
TNF-α Tumor Necrosis Factor-α– fator de necrose tumoral alfa
UEA uveíte experimental auto-imune
UFMG Universidade Federal de Minas Gerais
VEGF vascular-endothelial growth factor – fator de crescimento do endotélio vascular
XCL família de quimiocina com apenas um resíduo de cisteína
µm micrômetro
1 – INTRODUÇÃO E JUSTIFICATIVA... 18
2 – REVISÃO DA LITERATURA... 21
2.1 – Agente etiológico da toxoplasmose e histórico ...22
2.2 – Manifestações oculares da toxoplasmose ...24
2.2.1 – Prevalência e manifestações ... 24
2.2.2 – Patogênese ... 29
2.2.3 – Toxoplasmose ocular congênita ou adquirida ... 30
2.3 – Resposta imune ao Toxoplasma gondii ...31
2.3.1 – Imunidade inespecífica... 31
2.3.2 – Imunidade específica ao T. gondii... 33
2.3.3 – Rede de citocinas na infecção por T. gondii... 38
2.4 – Quimiocinas ...42
2.4.1 – Estrutura e função ... 42
2.4.2 – O papel das quimiocinas nas doenças oculares ... 48
2.5 – O papel das quimiocinas nas uveítes ...50
2.5.1 – Estudos experimentais ... 50
2.5.2 – Estudos em humanos... 51
3 – OBJETIVOS... 57
4 – MATERIAL E MÉTODO... 59
4.2 – Avaliação dos pacientes participantes ...61
4.3 – Processamento do soro para a análise das quimiocinas ...66
4.4 – Escolha das quimiocinas a serem avaliadas ...66
4.5 – Análise estatística ...68
5 – RESULTADOS... 70
6 – DISCUSSÃO... 83
7 – CONCLUSÕES... 96
8 – REFERÊNCIAS BIBIOGRÁFICAS... 98
9 – ANEXOS... 116
9.1 – Parecer do COEP referente ao Projeto...117
1 – INTRODUÇÃO E JUSTIFICATIVA
As quimiocinas pertencem a um restrito grupo de citocinas de 8 a 12
kDa, que foram inicialmente identificadas devido à sua habilidade em atrair
leucócitos. Essas moléculas protéicas induzem migração celular contra
gradientes de concentração, exercendo papel fundamental no acúmulo de
leucócitos nos tecidos inflamados e na interação com as células residentes do
tecido envolvido (WALLACE et al., 2004).
As quimiocinas e seus receptores têm sido amplamente estudados nas
doenças oculares. Observou-se que estas substâncias possuem um papel na
homeostase do tecido ocular, não estando envolvidos apenas em processos
inflamatórios (FOXMAN et al., 2002). Estudos em modelos animais e em
humanos têm identificado várias quimiocinas em diferentes formas de uveítes,
sendo produzidas tanto por células residentes quanto por células inflamatórias,
o que sugere um papel importante dessas proteínas e seus receptores na
patogênese das mesmas. Além disso, a compreensão das vias envolvidas na
atuação das quimiocinas e seus receptores nas doenças oculares pode criar
uma nova possibilidade terapêutica, atuando de forma específica nestes
mecanismos que envolvem a migração, ativação e retenção de células
inflamatórias nos tecidos oculares.
Estudos mostram que algumas quimiocinas são expressas
abundantemente nos tecidos oculares durante o pico do processo inflamatório
da uveíte experimental auto-imune (UEA) (CRANE et al., 2001) e que a
neutralização de determinadas quimiocinas através de anticorpos específicos
trabalho, a administração destes anticorpos foi capaz de suprimir o
desenvolvimento da uveíte anterior recorrente (MANCZAK et al., 2002).
Nas uveítes em humanos, vários estudos têm realçado a importância
das quimiocinas nas uveítes de etiologia não-infecciosa (WALLACE et al.,
2004). Por outro lado, o perfil dessas proteínas e dos seus receptores nas
uveítes infecciosas é pouco estudado. O perfil das quimiocinas na infecção
pelo Toxoplasma gondii é relatado na doença sistêmica ou em estudos
experimentais (DENNEY et al., 1999), mas sem abordar as características do
perfil dessas proteínas na retinocoroidite supostamente toxoplásmica (RCST).
Como a coleta do humor aquoso não é um procedimento realizado de
rotina na avaliação dos pacientes com uveíte, este estudo foi realizado com os
objetivos de avaliar se há alteração no perfil das quimiocinas séricas na RCST.
Avaliou-se, também, se houve correlação entre os níveis séricos das
quimiocinas com as características do quadro de uveíte nos pacientes
acometidos, entre elas a presença de vasculite retiniana, tamanho da lesão de
retinocoroidite em atividade e a intensidade das opacidades vítreas. As
quimiocinas avaliadas neste trabalho foram: CCL2, CCL11, CXCL8, CXCL9 e
CXCL10. Esse é o primeiro trabalho a investigar o perfil sérico das quimiocinas
2 – REVISÃO DA LITERATURA
2.1 – Agente etiológico da toxoplasmose e histórico
Reino: protista; Subreino: Protozoa; Filo: Apicomplexa; Classe:
Sporozoea (Sporozoa); Subclasse: Coccidia; Ordem: Eucoccidiida;
Subordem: Eimeriidae; Família: Sarcocystidae: Gênero: Toxoplasma;
Espécie:Toxoplasma gondii.
Os organismos hoje pertencentes ao gênero Toxoplasma foram
descritos independentemente, em 1908, por SPLENDORE (Brasil), em coelhos
e por NICOLLE E MANCUEAX, no “gondi” (Ctenodactylus gondi), roedor
norte-africano. No ano seguinte, NICOLLE E MANCUEAX (1909), criaram o novo
gênero Toxoplasma, com a espécie Toxoplasma gondii.
A primeira descrição de toxoplasmose em humanos foi feita pelo
oftalmologista Janku, em 1923, na cidade de Praga, e tratava-se de um caso
de toxoplasmose congênita. Ao realizar a necrópsia de uma criança de 11
meses de idade que foi ao óbito em decorrência de uma doença disseminada e
grave (hidrocefalia, microftalmia e coloboma na região macular), notou que o
organismo que estava presente no bulbo ocular constituindo um cisto
parasitário era, possivelmente, o Toxoplasma gondii (JANKU, 1923). No Brasil,
o primeiro caso de toxoplasmose foi diagnosticado em 1926 por Margarino
Torres, em um recém-nascido (ORÉFICE & BAHIA-OLIVEIRA, 2005).
Porém, somente após 1937, com os estudos de WOLF & COWEN
(1939), a toxoplasmose passou a ser reconhecida por sua importância médica.
Esses autores descreveram nos Estados Unidos da América, um caso fatal de
encefalite granulomatosa infantil. A forma adquirida desta parasitose foi
com doença generalizada e fatal. Em 1941, PINKERTON & HENDERSON
descreveram dois casos fatais de uma doença exantemática febril em adultos
e, no mesmo ano, Sabin relatou casos de encefalite pelo Toxoplasma gondii
em crianças (SABIN, 1941).
A introdução do teste do corante (Reação de Sabin e Feldman ou
“dye-test”), em 1948, facilitou o diagnóstico e possibilitou a realização de
investigações epidemiológicas (SABIN & FELDMAN, 1948).
O gênero Toxoplasma gondii é membro da família Sarcocystidae, que
tem com hospedeiro definitivo membros da família Felidae, sendo o gato
doméstico (Felis catus) o de maior importância epidemiológica (KAWAZOE,
1995). Tem como hospedeiros intermediários animais homeotérmicos incluindo
o homem. Por ser um parasita obrigatoriamente intracelular, o T. gondii pode
ser encontrado em vários tecidos, células (exceto hemácias) e líquidos
orgânicos, tais como a saliva, o leite, o esperma e o líquido peritoneal
(FRENKEL, 1971) Apresenta morfologias múltiplas dependendo do habitat e do
estado evolutivo. As principais formas que pode apresentar durante o seu ciclo
evolutivo são:
Taquizoíto (endozoíto): foi a primeira forma descrita e o seu aspecto morfológico, ou seja, em forma de arco (toxon = arco), deu o nome ao gênero.
Quando corado pelo Giemsa, apresenta-se com o citoplasma azulado e o
núcleo vermelho. É um estágio de rápida multiplicação do parasita, com
capacidade para invadir ativamente uma célula e se multiplicar em vacúolos
citoplasmáticos, denominados vacúolos parasitófagos. A proliferação
taquizoítos que, livres, penetram em células contíguas ou caem na circulação.
É a principal forma encontrada na fase aguda da doença.
Bradizoítos (cistozoítos): forma parasitária com multiplicação lenta encontrada no interior das células do hospedeiro e que resulta na formação dos
cistos teciduais. É a principal forma encontrada na fase crônica da doença.
Esporozoítos: forma do T. gondii presente nos oocistos maduros, os quais são produzidos no intestino de felinos e eliminados em suas fezes. Os
oocistos apresentam no seu interior dois esporocistos, cada qual formado por
quatro esporozoítos. Em contato com o ambiente, os oocistos passam a ser
infectantes.
2.2 – Manifestações oculares da toxoplasmose
2.2.1 – Prevalência e manifestações
Estima-se que o parasita T. gondii infecte aproximadamente 13% a 50%
da população mundial (JONES et al., 2001). Em 1972, estimava-se que
aproximadamente 500 milhões de pessoas no mundo estariam infectadas pelo
T.gondii, representando cerca de 1/8 da população mundial (HOLLAND, 2003).
A prevalência da sorologia positiva para a toxoplasmose varia amplamente no
mundo e depende de fatores como hábitos alimentares, higiene e clima
(ROTHOVA, 2003). O estudo mais confiável sobre a prevalência da sorologia
positiva nos Estados Unidos foi derivado do terceiro National Health and
dosagem de IgG anti-toxoplasma foi positiva em 23% das amostras séricas de
17.658 pacientes (ROTHOVA, 2003). Em algumas áreas da região sul do Brasil
a prevalência da sorologia positiva para toxoplasmose entre crianças de 10-15
anos é muito alta, chegando a atingir 98% dessa população estudada
(SILVEIRA et al., 1988)
Em relação ao envolvimento ocular, sabe-se que a RCST é a
causa mais comum de uveíte posterior em várias partes do mundo, incluindo a
América do Norte, América do Sul e regiões da Europa (HOLLAND, 2003). A
prevalência da doença ocular em pacientes infectados pelo T. gondii é ainda
incerta; sendo que, o envolvimento é mais comum e mais grave nos pacientes
com sistema imune deficiente ou comprometido, ou seja, neonatos ou adultos
imunocomprometidos (BOSCH-DRIESSEN et al., 2002; SMITH &
CUNNINGHAM, 2002; HOVAKIMYAN & CUNNINGHAM, 2002). O
envolvimento ocular na toxoplasmose congênita pode alcançar até 80% dos
pacientes com acompanhamento superior a 20 anos. Por outro lado, a
prevalência do envolvimento ocular na toxoplasmose adquirida ainda não é
bem estabelecida (WILSON et al., 1980; KOPPE & ROTHOVA, 1989). Dois
estudos de prevalência da toxoplasmose ocular realizados nos Estados Unidos
da América encontraram resultados semelhantes (0,6%) (SMITH & GANLEY,
1972; MAETZ et al., 1987). Baseado na prevalência sorológica da época
desses estudos, a proporção de pacientes infectados pelo T. gondii com
envolvimento ocular seria aproximadamente de 2% (HOLLAND, 2003). Estudo
realizado no Brasil avaliou um total de 1042 pessoas, observando a presença
de lesões de RCST em 17,7% dos indivíduos examinados (GLASNER et al.,
Poucos estudos abordam a incidência da toxoplasmose ocular. A
estimativa de incidência de retinocoroidite aguda sintomática para todas as
pessoas nascidas no Reino Unido era de 0,4/100.000/ano, e para negros
nascidos no oeste da África foi de 57/100.000/ano (GILBERT et al., 1995).
A RCST ocorre em 70-90% dos casos de infecção congênita. O
acometimento ocular é mais freqüente em associação apenas à doença
neurológica (95%) do que à doença disseminada (66%). Como única
manifestação da toxoplasmose congênita, o acometimento ocular ocorre em
10% dos casos. A RCST em pacientes com infecção adquirida pelo T. gondii
apresenta índices variando de 2% a 30% (GILBERT & STANFORDT, 2000).
Estudo nacional observou que de um total de 7.680 casos de uveítes
avaliados, 43,1% foram diagnosticados como RCST, e de um total de 1.955
uveítes posteriores, 72,9% foram diagnosticadas como RCST (FERNANDES &
ORÉFICE, 1996). Esse estudo confirmou a toxoplasmose como a principal
causa de uveíte posterior no nosso meio.
A manifestação ocular típica da toxoplasmose consiste em uma
retinocoroidite focal necrosante acompanhada de reação vítrea,
freqüentemente associada com uma lesão cicatrizada satélite indicativa de
ataque recorrente. Em uma série de 154 pacientes, as lesões satélites
ocorreram em 80% dos pacientes comparada com 20% de lesões únicas
(BOSCH-DRIESSEN et al., 2002).
Gravidade da toxoplasmose ocular parece ser influenciada por uma
combinação de diversos fatores; muitas vezes, sem nenhuma correlação entre
eles. Isto tem dificultado retirar conclusões a respeito desses fatores na
de forma não-controlada e a gravidade da doença não ser definida de forma
consistente e de maneira quantitativa (HOLLAND, 2004). A avaliação da
gravidade da doença é feita de forma heterogênea pelos diversos trabalhos,
sendo que, alguns autores a avaliam pela presença de complicações, outros
pela piora da acuidade visual, tamanho da lesão em atividade ou cicatrizada,
intensidade da reação inflamatória na câmara anterior ou no corpo vítreo,
envolvimento da retina macular ou periférica, número de recorrências
(HOLLAND, 2003, 2004; VALLOCHI et al., 2005).
O tamanho da lesão varia de 1/10 de diâmetro de disco óptico (DD) até
dois quadrantes da retina. ASSIS et al. (1997) obervaram que, em 52 pacientes
avaliados, as lesões eram menores ou iguais a 1 DD em 69% dos casos na
fase inicial e em 80% dos casos na fase final, e maiores que 1 DD em 31% na
fase inicial e 20% na fase final. Alguns estudos observaram uma relação
positiva entre o tamanho da lesão, o risco aumentado de complicações e um
maior tempo de duração da doença ativa (HOLLAND, 2004).
O acometimento do corpo vítreo é constante na toxoplasmose ocular e
responsável por seqüelas importantes da doença. Ocorrem opacidades difusas
ou localizadas, hemorragias, pigmentos e zonas de rarefação. A opacificação
vítrea tem resolução lenta, podendo, nos casos graves, demorar, às vezes,
mais de um ano após total cicatrização da lesão. Pode haver contração e
descolamento do corpo vítreo posterior (ORÉFICE & BAHIA-OLIVEIRA, 2005).
Manifestações atípicas compreendem lesões largas, eventualmente
múltiplas e/ou bilaterais; forma punctata externa; neurorretinite; neurite; forma
pseudomúltipla; esclerite; reação vítrea intensa sem lesão focal em atividade
& CUNNINGHAM, 2002; HOVAKIMYAN & CUNNINGHAM, 2002; FARDUEA et
al., 2002; LABALLETTE et al., 2002). Complicações como irite granulomatosa,
pressão intra-ocular elevada, vasculite retiniana, oclusões vasculares,
descolamento de retina seroso ou regmatogênico, entre outras, podem
dificultar o diagnóstico correto da toxoplasmose ocular (FARDUEA et al., 2002;
ROTHOVA, 2003).
A vasculite retiniana é comum em pacientes com toxoplasmose ocular e
pode ocorrer na vizinhança ou distante do foco ativo de retinocoroidite
(THEODOSSIADIS et al., 1995). Esse achado usualmente se apresenta como
um embainhamento perivascular difuso ou segmentar. Em alguns casos, a
oclusão de ramos arteriais ou venosos pode ocorrer, resultando em infartos
retinianos com conseqüente perda de campo visual. A neovascularização
retiniana ou sub-retiniana já foram relatadas como uma complicação possível
da toxoplasmose ocular (SMITH & CUNNINGHAM, 2002).
A redução da acuidade visual na RCST ativa pode resultar da turvação
ou opacificação dos meios e do acometimento foveal diretamente causado pela
lesão ou conseqüente ao edema retiniano secundário às lesões retinianas
distantes da região macular (ORÉFICE & BAHIA-OLIVEIRA, 2005).
O processo evolutivo da RCST revela que a cicatrização da lesão ocorre
da periferia para o centro, ou seja, de maneira centrípeta. Nesses casos,
observa-se que, progressivamente, as margens da lesão vão ficando mais
nítidas, o exsudato e a vitreíte diminuem, até que resta uma zona central
amorfa, elevada, de cor cinza ou marrom. Depois de um período variável de
tempo, ocorre a pigmentação, sobretudo nas margens da lesão (ORÉFICE &
lesão pode refletir a extensão do dano ao estrato pigmentoso da retina (EPR)
durante a forma ativa da doença (HOLLAND, 2004). Lesões cicatriciais com
pouca pigmentação podem estar associadas a lesões com pouca reação
inflamatória na fase ativa (MATTHEWS & WEITHER, 1988).
2.2.2 – Patogênese
A aquisição da infecção em humanos ocorre principalmente por três
vias: (1) ingestão de oocistos liberados juntamente com as fezes dos felídeos;
(2) ingestão de cistos teciduais presentes em carne crua ou mal cozidas; (3)
infecção transplacentária.
A transmissão dos oocistos pela água tem sido evidenciada, mostrando
ser esta uma importante forma de transmissão da doença (BAHIA-OLIVEIRA et
al., 2003). Outras vias de infecção foram descritas, como, através de leite ou
saliva contaminada, perdigotos ou lambedura, acidentes de laboratório,
pós-transplante de órgãos (ORÉFICE & BAHIA-OLIVEIRA, 2005).
Durante o estágio agudo da doença, o parasita atravessa a parede
intestinal e cai na circulação sanguínea levando a uma parasitemia. O T. gondii
atinge o olho através do sangue como parasitas livres ou dentro de leucócitos
circulantes. Os ataques recorrentes são decorrentes de uma multiplicação dos
parasitas e sua liberação dos cistos retinianos (ROBERTS et al., 2001).
A RCST é uma doença de caráter recidivante. Alguns pesquisadores
observaram que o risco de recorrência foi maior no primeiro ano após o
episódio de atividade do que nos anos subseqüentes (HOLLAND, 2003).
superior a cinco anos tiveram recorrência da doença, e tal recorrência ocorreu
predominantemente no olho acometido previamente (BOSCH-DRIESSEN et
al., 2002). Vários fatores relacionados tanto com o hospedeiro, quanto com o
parasita já foram propostos para explicar as causas de recorrência da
retinocoroidite toxoplásmica, mas nenhum tem sido amplamente aceito
(ROTHOVA, 2003). Reinfecções com outras cepas do parasita podem ocorrer,
mas a importância clínica desse fato ainda não foi bem estabelecida
(ASPINALL et al., 2003), apesar de alguns autores sugerirem que a
variabilidade das manifestações clínicas pode estar relacionada à cepa do
parasita que causa a infecção (BOOTHROYD & GRIGG, 2002).
2.2.3 – Toxoplasmose ocular congênita ou adquirida
A RCST pode ser dividida em congênita ou adquirida. A exata
contribuição de cada uma dessas formas na prevalência da doença não é bem
estabelecida. BURNETT et al. (1998) relataram a primeira série de casos de
RCST ocorrida durante uma epidemia de infecção no Canadá. Outro estudo
envolvendo uma série de casos consecutivos de RCST observou que 8% dos
casos foram de toxoplasmose congênita e 11% de toxoplasmose adquirida;
para a maioria dos casos (81%) o exato momento da infecção não foi possível
ser determinado (BOSCH-DRIESSEN et al., 2002). Muitos estudos recentes
têm discutido que a infecção adquirida pode ser uma importante causa de
RCST (BAHIA-OLIVEIRA et al., 2003; BOWIE et al., 1997; ROSS et al., 2001;
RCST nas formas congênita ou adquirida não são bem definidas. Em estudo já
citado, a lesão macular e desenvolvimento de cegueira foram mais freqüentes
nas formas congênitas da doença (BOSCH-DRIESSEN et al., 2002). Na
infecção adquirida, uma inflamação intra-ocular transitória sem sinais de retinite
na fase aguda foi relatada e pode representar a infestação intra-ocular inicial do
parasita, que pode ser acompanhada posteriormente de acometimento
retiniano (HOLLAND et al., 1999). As taxas de recorrência da RCST congênita
ou adquirida parecem ser similares (BOSCH-DRIESSEN et al., 2002;
BOSCH-DRIESSEN & ROTHOVA, 1999)
2.3 – Resposta imune ao Toxoplasma gondii
2.3.1 – Imunidade inespecífica
As respostas imunes de um hospedeiro ao T. gondii são complexas e
envolvem precocemente a ativação de mecanismos da imunidade inespecífica.
Estudos em camundongos sugerem que o controle da infecção aguda causada
pelo Toxoplasma, deflagra inicialmente uma resposta inata, seguida por uma
resposta adquirida antígeno-específica, que é particularmente crítica para a
resolução da infecção por taquizoítos (JOHNSON & SAYLES, 1997;
ALEXANDER & HUNTER, 1998).
As células dendríticas, derivadas de células da medula óssea, são as
mais eficientes células apresentadoras de antígenos (APC: “Antigen-presenting
1997). Para tal, expressam moléculas dos antígenos leucocitários humanos
(HLA: “Human leucocyte antigens”) tanto de classe I, quanto de classe II. As
células dendríticas se encontram nos epitélios superficiais e, uma vez captado
o antígeno, se movem em direção aos órgãos linfóides regionais de forma a
entrar em contato com células capazes de reconhecerem o antígeno que
transportam (HART, 1997).
Os macrófagos humanos, por sua vez, são fagócitos com função, não só
de apresentação de antígenos, através do HLA classe II, mas também de
secretar mediadores pró-inflamatórios como o interferon-gama (INF- ), o fator
de necrose tumoral alfa (TNF-α, “Tumor Necrosis Factor-α”), o fator estimulador
de colônia de granulócitos-macrófagos (GM-CSF
“granulocyte-monocyte-colony-stimulating factor”), a interleucina-12 (IL-12) e a interleucina-15 (IL-15).
Já as células “natural-killer” (NK) representam um subconjunto de
células derivadas da linhagem linfocitária com função citotóxica que secretam
citocinas, principalmente o INF- , sendo de grande importância na defesa
contra vírus e outros patógenos intracelulares. A ativação inicial das células NK
e dos macrófagos pelo T. gondii é importante para o estabelecimento da
resistência inespecífica que atuará rapidamente no sentido de reduzir o número
de taquizoítos, mesmo antes do desenvolvimento da resposta imune
específica. Ao mesmo tempo, a ativação das células NK une a atividade dos
mecanismos imunes inatos com os mecanismos anígeno-específicos (BLISS et
al., 1999), pelo estabelecimento de uma rede de citocinas necessárias para
antígenos, a ser realizada pelas células dendríticas, macrófagos e células
hospedeiras infectadas (LEWIS & WILSON, 2001).
2.3.2 – Imunidade específica ao T. gondii
Tem sido demonstrado que os mecanismos específicos imunes
mediados por células desempenham um papel de destaque na resistência à
infecção pelo T. gondii (REYES & FRENKEL, 1987). Assim, a transferência de
soro de camundongos cronicamente infectados pelo T. gondii não protege
outros camundongos não infectados de uma infecção primária, enquanto que,
camundongos com supressão na produção de linfócitos B responsáveis pela
imunidade humoral conseguem controlar a infecção primária pelo T. gondii
(REYES & FRENKEL, 1987). Por outro lado, camundongos atímicos são muito
susceptíveis à infecção pelo T. gondii (LINDBERG & FRENKEL, 1977). Essas
observações têm sugerido que, na imunidade específica, a imunidade celular
tem um papel preponderante no controle da infecção pelo T. gondii
(GAZZINELLI et al., 1993a).
Sob ação da imunidade celular, os T. gondii, que na fase aguda da
toxoplasmose se encontram principalmente na forma de taquizoítos, são
destruídos, enquanto outros, na forma de bradizoítos, formam os cistos
teciduais. Nesses cistos localizados dentro das células hospedeiras ficam
protegidos da ação do sistema imune durante a fase crônica da doença
prontamente eliminados pela imunidade do hospedeiro (GAZZINELLI et al.,
1993a). A elucidação dos mecanismos pelos quais os hospedeiros
imunocompetentes resolvem uma infecção aguda causada pelo Toxoplasma
gondii e controlam a infecção crônica é fundamental para o entendimento da
patogenia da toxoplasmose.
2.3.2.1 – Imunidade celular
A imunidade mediada por células ou imunidade específica é
desenvolvida pelos linfócitos T originados no timo, responsáveis principalmente
pela defesa contra patógenos intracelulares obrigatórios, com função de
promover a sua destruição ou a lise das células infectadas (HAYNES &
HEINLY, 1995). Essas ações são exercidas tanto por ação direta, quanto
indiretamente através da secreção de citocinas. Para tal, os linfócitos T
reconhecem antígenos peptídeos restritos às moléculas de HLA, através de
seu complexo TCR (T Cell Receptor – Receptor de células T). Pela natureza
das cadeias protéicas da molécula de TCR, os linfócitos T se subdividem em
linfócito T alfa-beta (Tα – cadeia α associada à cadeia ) e linfócitos T
gama-delta (T δ – cadeia associada à cadeia δ) (ROBEY & FOWLKES, 1998).
Os linfócitos Tα são os mais numerosos, representando cerca de 95%
do total de linfócitos e seus receptores estão envolvidos no reconhecimento
dos antígenos (TANCHOT et al., 1997). Para a sua ativação, outros sinais são
requeridos, envolvendo as moléculas acessórias que facilitam as interações
com as APCs ou com as células alvo. Duas dessas moléculas se associam
co-receptoras, sendo elas o CD4 e o CD8, que subdividem, respectivamente, os
linfócitos T em dois conjuntos: as células T CD4+ que representam 65% dos
linfócitos Tα ; e as células T CD8+, que representam 35% dos linfócitos Tα
(TANCHOT et al., 1997).
Ambos os linfócitos Tα CD4+ e Tα CD8+ participam de forma
associativa e complementar na imunidade celular específica contra os
patógenos intracelulares incluindo o T. gondii e outros (DE PAOLI et al., 1992).
Células T CD8+ efetoras citotóxicas (CTL) são capazes de lisar células alvo
infectadas, mas, para a geração destas células T CD8+ efetoras é requerida a
participação da sub-população de células T CD4+ h (auxiliares ou “helper”)
(GAZZINELLI et al., 1991). Dessa reação específica, formam-se células de
memórias, tanto para células T CD4+, quanto para as células T CD8+.
De acordo com o ambiente propiciado por citocinas produzidas logo
após o contato com o antígeno, os linfócitos T CD4+ ainda não estimulados
são influenciados pelas citocinas, diferenciando-se em células Th1 (T
“helper”-1) ou em células Th2 (T “helper”-2), com cada subconjunto passando a produzir
um perfil diferente de citocinas (MOSMANN et al., 1986). A IL-12 estimula a
diferenciação de linfócitos T CD4+ em linfócitos T CD4+ Th1 (TRINCHIERI,
1993). Além disso, foi observado que o IFN- é um potente inibidor da
diferenciação de linfócitos T CD4+ em linfócitos T CD4+ Th2 (GAJEWSKI &
FITCH, 1988). Dessa forma, os patógenos, como o T. gondii, que estimulam os
macrófagos e células NK a produzirem IFN- induzem respostas dominadas
pelos linfócitos T CD4+ Th1 tendendo, portanto, para uma imunidade
estimulam a diferenciação em direção aos linfócitos T CD4+ Th2 e, portanto,
para a imunidade predominantemente do tipo humoral (MOSMANN, 1991).
Cada subconjunto de linfócitos T CD4+ Th1 ou T CD4+ Th2, através da
produção de citocinas é capaz de inibir reciprocamente a diferenciação e o
crescimento das células e da produção de citocinas específicas do outro
subconjunto. Essa regulação cruzada provê a base para o entendimento das
inter-relações entre resposta imune celular e resposta imune humoral
(GAZZINELLI et al., 1993a; TRINCHIERI, 1993).
Os linfócitos T CD4+ Th1 induzem a imunidade celular protetora contra
patógenos intracelulares e produzem principalmente as citocinas IL-12 e IFN- ,
importantes para a diferenciação e proliferação de macrófagos e células NK,
mas também para estimular o aumento da produção das imunoglobulinas
IgG2a/IgG em camundongos. Os linfócitos T CD4+ Th2 são mais eficientes em
induzir a imunidade humoral (MOSMANN, 1991) e produzem principalmente as
citocinas IL-4, IL-5, IL-6 e IL-10, que irão coordenar funções como a regulação
da produção de Ig E, da eosinofilia e da mastocitose (TOELLNER et al., 1998;
LEWIS & WILSON, 2001).
Os 5% restantes do total de linfócitos T no organismo são representados
pelos linfócitos T δ que são encontrados em maior concentração em algumas
regiões específicas, como a mucosa intestinal e placenta (SCALISE et al.,
1992). Uma hipótese bem fundamentada para a ação dos linfócitos T δ propõe
que eles poderiam reconhecer os antígenos encontrados nos limites epiteliais,
entre o hospedeiro e o ambiente externo. Nesse caso, eles iniciariam uma
recrutamento dos linfócitos Tα mais específicos. A resposta das células T δ,
observadas em certas infecções, inclusive as desenvolvidas contra patógenos
intracelulares, como o T. gondii, em humanos e em camundongos poderiam
acontecer independentemente do reconhecimento dos patógenos (LEWIS &
WILSON, 2001).
2.3.2.2 – Imunidade humoral
Para as células B serem ativadas para a produção de anticorpos contra
antígenos protéicos é necessária a participação das células T CD4+ Th2
através da produção de citocinas tais como IL-4. São necessários ainda, sinais
acessórios de moléculas de superfície, como o ligante CD40 expresso nas
células T, o qual se liga ao CD40 constitutivamente expresso pelas células B.
Este caminho também é importante na sinalização da troca isotípica para a
produção de anticorpos (revisado por LEWIS & WILSON, 2001).
Células B humanas produzem cinco isotipos de anticorpos: IgM, IgD,
IgG, IgA e IgE. O IgG e o IgA podem ser subdivididos em subclassses: IgG1,
IgG2, IgG3 e IgG4, IgA1 e IgA2. Todas as classes, com exceção de IgG4,
podem ativar a via clássica do complemento.
Os anticorpos são a primeira linha de defesa contra o T. gondii. Eles
atuam nos taquizoítos extracelulares que são liberados após a lise de uma
célula infectada. Eles limitam a multiplicação dos toxoplasmas através da lise
opsonização dos parasitas ou aumentando a ação fagocitária dos macrófagos
(FILISETTI & CANDOLFI, 2004).
2.3.3 – Rede de citocinas na infecção por T. gondii
Na fase inicial da toxoplasmose aguda sitêmica são necessários uma
resposta imune inata e o início do estabelecimento de uma rede de citocinas
com a função de fazer a ligação com a imunidade específica que é importante
para o controle da toxoplasmose aguda e crônica (JOHNSON E SAYLES,
1997; ALEXANDER & HUNTER, 1998).
Na fase inicial da infecção, com a entrada do T. gondii, os parasitas
ainda livres, seus antígenos e seus produtos de secreção induzem as células
dendríticas e macrófagos a produzirem citocinas, tais como a IL-1, IL-12, o
TNF-α (GAZZINELLI et al., 1993b, 1994; PELOUX et al., 1996) e,
possivelmente, IL-15 (KHAN & KASPER, 1996). Essas citocinas e os produtos
derivados dos T. gondii ativam diretamente as células NK que passam a
destruir as células infectadas com o T.gondii (ALEXANDER & HUNTER, 1998).
Ao mesmo tempo, passam a produzir grande quantidade de INF- para
intensificar a ativação dos macrófagos infectados (GAZZINELLI et al., 1993a,
1996). Essa ativação estimulada pelo INF- aumenta o metabolismo oxidativo
do macrófago, com conseqüente produção da enzima induzível óxido nítrico
sintetase (iNOS – “inducible Nitric Oxide Sintetase”) e do peróxido de
mas não estimulados (MURRAY & COHN, 1979). Isso inibe a replicação e
causa a destruição dos taquizoítos fagocitados, reafirmando o efeito
parasiticida do peróxido de hidrogênio produzido por macrófagos (MURRAY et
al., 1985).
A ligação da imunidade inespecífica com a resposta imune específica é
feita pelo IFN- e IL-12 que passam a favorecer a diferenciação das células Tα
CD4+ não estimuladas, em uma população efetora do tipo T CD4+ Th1 que,
por sua vez, passa a produzir altos níveis de IFN- (ALEXANDER & HUNTER,
1998). Essa é a fonte de IFN- capaz de conter o parasita durante a fase inicial
da infecção aguda e que ajuda a limitar a disseminação da infecção para
tecidos onde poderiam formar cistos reativos de taquizoítos.
Uma grande variedade de citocinas participa dessa rede de ativação e é
produzida em conseqüência da resposta imune específica do hospedeiro
contra o T. gondii. Assim, a IL-12 produzida pelas células T CD4+ Th1 ativadas
age como um potente fator de crescimento autócrino para o aumento da
ativação das células T CD4+ Th1 e como um ativador parácrino, ativando e
aumentando a função tanto de células NK, como de células T CD8+ efetoras
em seus efeitos citotóxicos (CARSON et al., 1994). Em contraste, a citocina
IL-5 é predominantemente produzida por células T CD4+ Th2 ativadas e tem
alguns efeitos sobre linfócitos B, tais como aumentar a expressão de
receptores de IL-2 e promover a proliferação e diferenciação destas células.
Por outro lado, a IL-6, uma citocina produzida por macrófagos, parece
participar do equilíbrio na resposta pró-inflamatória estimulada por IFN-
A regulação da resposta imune é um processo complexo e necessário
para que a resposta inflamatória seja restrita à área de infecção. Para tal se
desenvolve um mecanismo de controle, positivo e negativo, envolvendo,
respectivamente, o estímulo ou a inibição da produção das citocinas. Por
exemplo, TNF-α e IL-1 induzem diretamente a produção pelos macrófagos e
células endoteliais de mais TNF-α e IL-1, mas também de IL-6, GM-CSF,
M-CSF e G-CSF. Para a modulação, outros macrófagos passam a produzir
citocinas que atenuam a produção das citocinas pró-inflamatórias e do tipo
Th1. Essas citocinas moduladoras, denominadas antiinflamatórias, incluem a
IL-10 (MOSMANN, 1994), TGF- (LETTERIO & ROBERTS, 1998) e
antagonista do receptor de IL-1 (IL-1ra) (DINARELLO, 1994). A IL-6, IL-10 e a
IL-1ra são expressas poucas horas após o TNF-α e a IL-1 serem produzidos,
inibindo a produção do TNF-α e IL-1 (DINARELLO, 1991). Por sua vez,
citocinas produzidas por células Th1, principalmente IFN- , atenuam a
produção de IL-10 (CHOMARAT et al., 1993). A produção dessas citocinas
antiinflamatórias é também incrementada pela exposição dos macrófagos a
citocinas produzidas por células Th2 incluindo IL-4, IL-10, IL-13 e
TGF-(CHOMARAT et al., 1993).
A IL-10 é outra importante citocina moduladora deste sistema de
regulação, pois além de inibir a produção de IL-1 , IL-12 e TNF-α por
macrófagos, bloqueia ainda a produção de IFN- por células NK (FIORENTINO
et al., 1991a, b). A IL-10 também diminui a expressão de antígenos do MHC de
classe II e de moléculas B7, ambos na superfície dos macrófagos, impedindo a
apresentação de antígenos e o desenvolvimento das funções co-estimulatórias
de óxido nítrico nos macrófagos, incapacitando-os de destruir os organismos
intracelulares como o T. gondii (NEYER et al., 1997). Uma função fundamental
da IL-10 na infecção pelo T. gondii é diminuir a produção de citocinas pelas
células NK, linfócitos e macrófagos, especialmente a IL-12, por este último
(FIORENTINO et al., 1991b). A produção da IL-10 pelos macrófagos, ao menos
em helmintos, favorece o estabelecimento da fase crônica no hospedeiro
(SHER et al., 1991).
O IFN- produzido pelas células NK na presença das frações antigênicas
do T.gondii (GAZZINELLI et al., 1998) aumenta a síntese de IL-12 pelos
macrófagos. Além disso, foram demonstrados os efeitos do TNF-α, IL-1 e IL-15
sobre a IL-12 potencializando sua ação indutora da produção de IFN- pelas
células NK (SHER et al., 1993). Assim também ocorre com o efeito inibidor da
IL-10 e do óxido nítrico sobre a síntese de IFN- pelas células T CD4+. Ao
mesmo tempo em que os macrófagos induzem a imunidade mediada por
células, regulam também a resposta imune pela produção da IL-10 e do óxido
nítrico (GAZZINELLI et al., 1996).
Estudo realizado em pacientes com RCST observou que aqueles que
possuíam altos níveis séricos de IL-13 e IFN- possuíam lesões de
retinocoroidite com um menor grau de destruição tecidual. Esse dado sugere
que essas citocinas possam estar atuando em conjunto na eliminação dos
parasitas e, ao mesmo tempo, na diminuição da resposta inflamatória na retina
2.4 – Quimiocinas
2.4.1 – Estrutura e função
As quimiocinas constituem uma grande família de citocinas
estruturalmente homólogas responsáveis pela movimentação dos leucócitos,
incluindo sua migração para locais de inflamação tecidual a partir do sangue.
As quimiocinas são pequenos polipeptídeos de 8 a 12 kDa que contêm
duas alças dissulfeto internas. Cerca de 50 quimiocinas diferentes já foram
identificadas, sendo classificadas em famílias com base no número e na
localização dos resíduos de cisteína N-terminais (ROLLINS, 1997). As duas
principais famílias são a das quimiocinas CC, nas quais resíduos de cisteína
são adjacentes, e a família CXC, na qual esses resíduos são separados por um
aminoácido. Uma terceira família tem como única representante a fractalkina
(CX3CL1), em que a característica estrutural é a presença de duas cisteínas
separadas por três aminoácidos (CX3C). Finalmente, a quarta família, que
também possui apenas um representante, a linfotactina (XCL1), possui uma
única cisteína (família C). A nomenclatura das quimiocinas e seus receptores
foi recentemente revisada com o objetivo de uniformizar o modo como eram
citadas (IUIS/WHO, 2003) (Tabela 1).
Essas proteínas, as quimiocinas, podem ainda ser separadas em duas
categorias dependendo da forma como são expressas: 1) constitutivas ou, 2)
induzidas. As quimiocinas constitutivas são produzidas normalmente em vários
ausência de inflamação. As quimiocinas induzidas (ou inflamatórias) são
produzidas por várias células em resposta a estímulos inflamatórios e recrutam
leucócitos para locais de inflamação (MOSER & LOETSCHER, 2001).
Quimiocinas atuam através de receptores trans-membranas de alta
afinidade expostas na superfície de células circulantes. Onze receptores
diferentes para quimiocinas CC (chamadas CCR1 a CCR11) e seis para
quimiocinas CXC (chamadas CXCR1 a CXCR6) já foram identificados
(MURPHY ET AL., 2000; MURPHY, 2002). Os receptores de quimiocinas
possuem sítios de ligação que podem ser específicos (CCR9, CXCR6), mas,
comumente, o mesmo receptor pode ser alvo de ligação de várias quimiocinas
do mesmo grupo (Tabela 1). Os receptores de quimiocinas são expressos em
leucócitos, com o maior número de receptores diferentes vistos em linfócitos T.
A expressão dos receptores de quimiocinas pode definir subtipos de linfócitos
T. Além disso, linfócitos T periféricos maduros expressam diferentes receptores
de quimiocinas dependendo do seu fenótipo funcional. Por exemplo, células T
helper 1 (Th1), que sintetizam IL-2 e IFN- , e mediam a ativação de fagócitos,
expressam CXCR3, CCR2 e CCR5. Linfócitos T helper 2 (Th2), que produzem
IL-4, IL-5 e são mediadores da produção de anticorpos pelos linfócitos B,
expressam CCR3, CCR4 e CCR2 Estas diferenças determinam, em parte, o
tipo de resposta imune que irá se desenvolver em um sítio de inflamação
(SALLUSTO et al., 1998; WALLACE et al., 2004).
Tabela1 – Quimiocinas humanas identificadas.
Família Quimiocina Nome original Receptores Localização
do gene
CXCL1 GROα/MIP-2 CXCR2 24q21
CXCL2 GRO CXCR2 4q21
CXCL3 GRO CXCR2 4q21
CXCL4 PF-4 ? 4q21
CXCL5 ENA-78 CXCR2 4q21
CXCL6 GCP-2 CXCR2 24q21
CXCL7 NAP-2 CXCR2 4q21
CXCL8 IL-8 CXCR2, CXCR1 24q21
CXCL9 MIG CXCR3 4q21
CXCL10 IP-10 CXCR3 4q21
CXCL11 I-TAC CXCR3 4q21
CXCL12 SDF-1 CXCR4 10q11.21
CXCL13 BCA-1 CXCR5 4q21
CXCL14 BRAK ? 5q31.1
CXCL15 Lungkine ? ?
CXCL16 CXCL16 CXCR6 17p13
CXC
CCL1 I-309 CCR8 17q11
CCL2 MCP-1 CCR2 17q12
CCL3 MIP-1α CCR1, CCR5 17q12
CCL4 MIP-1 CCR5 17q12
CCL5 RANTES CCR5 ?
CCL6 C10 ? ?
CCL7 MCP-3 CCR1, CCR2, CCR3 17q11
CCL8 MCP-2 CCR3, CCR5 17q11
CCL9 MIP-1 ? ?
CCL10 CCL10 ? ?
CCL11 Eotaxin CCR3 17q11
CCL12 MCP-5 CCR2 ?
CCL13 MCP-4 CCR2, CCR3 17q11
CCL14 HCC-1 CCR1, CCR5 17q12
CCL15
HCC-2/MIP-1δ/Leukotactin-1
CCR1, CCR3 17q12
CCL16 HCC-4/LEC CCR1, CCR2 17q12
CCL17 TARC CCR4 16q13
CCL18 PARC/DC-CK1 ? 17q12
CCL19 MIP-3 /ELC CCR7 9p13.3
CCL20 LARC/MIP-3α CCR6 2q36.3
CCL21 SLC/6Ckine CCR7 9p13.3
CCL22 MDC CCR4 16q13
CCL23 MPIF-1 CCR1 17q12
CCL24 Eotaxin-2/MPIF-2 CCR3, CCR5 7q11
CCL25 TECK CCR9 19q13.3
CCL26 Eotaxin-3 CCR3 7q11
CCL27 ESkine/MCC/Ctack CCR10 9p13.3
CCL28 MEC CCR3, CCR10 5p12
CC
XCL1 Lymphotactin α XCR1 1q24
XCL2 Lymphotactin XCR1 1q24
XC
Originalmente as quimiocinas foram estudadas devido ao seu importante
papel nos processos inflamatórios; mas atualmente, sabe-se do papel crucial
exercida por essas moléculas na estimulação do movimento das células
mononucleares pelo corpo e na migração destas do sangue periférico para os
tecidos, contribuindo na resposta imune adaptativa e/ou na patogênese de
várias doenças (CHARO & RANSOHOFF, 2006).
Além das funções como agente quimiotático de linfócitos, os estudos
com as quimiocinas e seus receptores estão revelando outros importantes
papéis para essas moléculas. Alguns receptores de quimiocinas, entre eles o
CCR5, são os principais co-receptores para certas cepas do vírus da
imunodeficiência humana (HIV) (CHOE et al., 1996; DRAGIC et al., 1996).
Estudos recentes têm identificado polimorfismos em genes que codificam as
quimiocinas, o que poderia interferir na sua função. Os estudos mais
aprofundados abordam a deleção do CCR5∆32 e a infecção pelo HIV.
Pacientes com essa mutação são protegidos da infecção pelo vírus (O’BRIEN
& MOORE, 2000).
Algumas quimiocinas estão envolvidas na angiogênese por exercerem
efeito quimiotático em células endoteliais (por exemplo, CXCL8, CXCL5,
CXCL6, CXCL1, CXCL2, CXCL3), enquanto outras podem exercer um efeito
antiangiogênico (CXCL4, CXCL10 e CXCL9) (ROLLINS, 1997). Outro efeito
atribuído às quimiocinas é a sua interferência, tanto estimulando quanto
inibindo, a hematopoiese. Esses efeitos na hematopoiese vão depender da
maturidade das células progenitoras envolvidas (ROLLINS, 1997).
Quimiocinas têm sido relacionadas a metástases tumorais e,
doenças auto-imunes, como a artrite reumatóide e a esclerose múltipla (WANG
et al., 1996; RANSOHOFF, 2002; VICARI & CAUX, 2002; DONG et al., 2003;
LOETSCHER & MOSER, 2002). Níveis elevados de CCL2, CCL3, CCL4, CCL5
e CXCL10 têm sido encontrados no sistema nervoso central de pacientes com
esclerose múltipla e em modelos experimentais dessa doença (BAGGIOLINI et
al., 1997; SORENSON et al., 1999). Em um trabalho recente, pacientes com
esclerose múltipla ativa apresentaram níveis elevados de CXCL10 no líquor,
enquanto que os níveis de CCL2 foram significativamente menores quando
comparados a controles assintomáticos (MOREIRA et al., 2006). Em pacientes
com a forma aguda da coréia de Sydenham, observou-se elevação dos níveis
séricos de CXCL9 e CXCL10 (TEIXEIRA-JR et al., 2004). Níveis elevados de
CXCL8 têm sido relatados em várias doenças inflamatórias sistêmicas como na
sarcoidose e na sepse (HACK et al., 1992; YOKOYAMA et al., 1995). Níveis
teciduais aumentados de CXCL8 e anticorpos séricos contra essa quimiocina
parecem estar elevados na colite ulcerativa em atividade (MAHIDA et al.,
1992).
Vários estudos realçam a importância das quimiocinas na patogênese
das doenças pulmonares obstrutivas crônicas e o papel dos antagonistas dos
receptores de quimiocinas como uma possibilidade terapêutica possível
(TRAVES et al., 2002). No diabetes mellitus, estudos revelaram que as
quimiocinas podem interferir no acúmulo de células adiposas, aumentado
assim a resistência periférica à insulina (GERHARDT et al., 2001). Estudo
experimental mostrou que animais geneticamente modificados, que não
expressam a quimiocina CCL2 e o receptor CCR2, possuem a gravidade
revelaram que a produção de quimiocinas pelas células do tecido renal estaria
envolvida tanto na homeostase do órgão, quanto na gênese de doenças
inflamatórias glomerulares ou túbulo-intersticiais (SCHLONDORFF et al., 1997;
SEGERER et al., 2000). Portanto, as quimiocinas estão envolvidas em vários
processos fisiológicos e patológicos do organismo.
As citocinas e quimiocinas são expressas no olho não apenas durante
os períodos de inflamação. Olhos não inflamados expressam quimocinas e
citocinas que exercem funções regulatórias e constitutivas. O fator de
transformação e crescimento (TGF ) está envolvido na regulação da resposta
imune e na reparação tecidual. O humor aquoso de olhos normais contém altos
níveis de TGF 2 na forma ativa, sendo que esta citocina está envolvida na
manutenção de um micro-ambiente de imunossupressão dentro do olho,
prevenindo quadros de inflamação indesejáveis (CURNOW & MURRAY, 2006).
Poucos estudos têm sido feitos para avaliar a expressão constitutiva das
quimiocinas dentro do olho. CCL2 está presente em níveis significativos e pode
ser responsável pelo recrutamento de monócitos para os tecidos oculares para
formar a população residente de células apresentadoras de antígenos
(CURNOW & MURRAY, 2006). Parece haver uma alta expressão de CX3CL1
nos tecidos oculares, embora a significância desse achado necessite ainda ser
compreendida (FANG et al., 2005; SILVERMAN et al., 2003).
Células do EPR humano têm mostrado, in vitro, uma produção de várias
quimiocinas, incluindo CXCL8, CCL2 e CCL5 em resposta à citocinas
pró-inflamatórias, como o TNF e o IFN- (CRANE et al., 1998). A produção in vitro
de CXCL8 e CCL2 pelas células do EPR humano tem sido inibida pela
tratamento das uveítes (KURTZ et al., 1997). Além disso, a CCL2 tem se
mostrado capaz de induzir migração de células do EPR, um mecanismo que é
inibido pela dexametasona (HAN et al., 2001). Ácido ribonucléico mensageiro
(RNAm) da quimiocina CXCL12 tem sido expressa de forma constitutiva pelas
células do EPR humano (WALLACE et al,, 2004). Estes dados realçam o
importante papel das quimiocinas não apenas nos quadros inflamatórios, mas
também na manutenção da homeostase dos tecidos oculares.
2.4.2 – O papel das quimiocinas nas doenças oculares
As quimiocinas estão envolvidas em várias doenças oculares, tanto
inflamatórias, quanto proliferativas e degenerativas. Embora essas categorias
de doenças oculares sejam diferentes, muitos dos mecanismos e das
quimiocinas envolvidas são semelhantes (WALLACE et al., 2004).
Na síndrome do olho seco, recente trabalho observou, através da
citometria de fluxo de células coletadas em amostras conjuntivais, um aumento
de expressão de receptores CCR5 tanto nos casos de olho seco evaporativo
quanto nas formas hipossecretoras (GULATI et al., 2006).
Em biópsias conjuntivais de pacientes com ceratoconjuntivite vernal,
CCL5 e CCL11 foram fortemente expressas no epitélio e endotélio, e ocorreu
um aumento do número de células positivas para CCL2, CCL5, CCL7 e CCL11.
A maioria destas células eram macrófagos (EL-ASRAR et al., 2000). Além
disso, essas células expressaram CCL1, CCL18 e CCL22, que são potentes
agentes quimiotáticos para células T, o que poderia explicar a grande
análise dos receptores de quimiocinas na conjuntivite alérgica mostrou que o
CXCR3 foi expresso numa maior quantidade nos linfócitos T da conjuntiva
quando comparado com tecidos normais (EL-ASRAR et al., 2001). Além dos
linfócitos e dos macrófagos, os eosinófilos têm sido implicados na patogênese
das doenças alérgicas oculares. Altos níveis de CCL11 e CCL24, ambos
potentes agentes quimiotáticos para eosinófilos, foram encontrados no muco e
nas lágrimas dos pacientes com ceratoconjuntivite vernal e ceratocojuntivite
atópica (LEONARDI et al., 2003).
Como as quimiocinas possuem um importante papel na angiogênese em
diversos órgãos, alguns estudos verificaram o seu papel na retinopatia
diabética. CXCL8 e CXCL10 foram encontrados em níveis elevados no corpo
vítreo de pacientes com retinopatia diabética quando comparado a indivíduos
com buraco macular (ELNER et al., 1995). Interessantemente, os níveis de
CXCL8 foram maiores nos pacientes com a forma ativa da doença, enquanto
os níveis de CXCL10 foram maiores nos pacientes com a forma controlada da
doença (ELNER et al., 1998; YUUKI et al., 2001). Na vasculite retiniana de
causa idiopática foi observada correlação entre atividade da doença e os níveis
de CCL4 e CCL2 no soro (WALLACE et al., 2003).
A principal causa de cegueira em pacientes com degeneração macular
relacionada à idade é a formação de membrana neovascular sub-retiniana. As
células do EPR têm mostrado serem capazes de produzir quimiocinas, in vitro,
incluindo CXCL8, CCL2 e CCL5 em resposta ao estímulo de citocinas
pró-inflamatórias como o TNF-α e o IFN- (CRANE et al., 1998; ELNER et al.,
1997). Recente estudo demonstrou que células do EPR presentes nas
quimiocina estar envolvida na formação das membranas juntamente com
outros fatores, como o VEGF (vascular endothelial growth factor) e o fator
tecidual derivado de macrófagos (GROSSNIKLAUS et al., 2002).
2.5 – O papel das quimiocinas nas uveítes
2.5.1 – Estudos experimentais
A uveíte experimental auto-imune (UEA) é considerada um modelo
representativo de diversas doenças inflamatórias oculares humanas de
presumível origem auto-imune, sendo útil, portanto, para o estudo
histopatológico e imunológico dessas entidades (FAURE, 1980; GERY et al.,
1986).
Estudo em UEA mostrou que CCL2, CCL3 e CCL5, detectados através
do ensaio enzimático de imunoabsorção (ELISA), foram expressos
abundantemente nos tecidos retinianos durante o pico do processo
inflamatório. CCL3 foi produzido por células do tecido retiniano, sendo
detectado em células da coróide antes do início da doença, sugerindo que a
sua presença está muito relacionada com o desenvolvimento da UEA (CRANE
et al., 2001). Interessantemente, a neutralização da quimiocina CCL5 através
de anticorpo específico faz com que ocorra uma exacerbação da UEA,
mediada por um aumento na infiltração de linfócitos CD4+. Portanto, CCL5
poderia suprimir UEA através da alteração na migração de subtipos de