UNIVERSIDADE ESTADUAL PAULISTA “JÚLIO DE MESQUITA FILHO”
Faculdade de Medicina Veterinária e Zootecnia Campus de Botucatu - SP
AVALIAÇÃO HISTOQUÍMICA DO COLÁGENO E EXPRESSÃO
IMUNOISTOQUÍMICA DE METALOPROTEINASES E
ALFA-ACTINA DE MÚSCULO LISO NO SARCOIDE EQUINO.
SARAH PASCHOAL SCARELLI
UNIVERSIDADE ESTADUAL PAULISTA “JÚLIO DE MESQUITA FILHO”
Faculdade de Medicina Veterinária e Zootecnia Campus de Botucatu - SP
AVALIAÇÃO HISTOQUÍMICA DO COLÁGENO E EXPRESSÃO
IMUNOISTOQUÍMICA DE METALOPROTEINASES E
ALFA-ACTINA DE MÚSCULO LISO NO SARCOIDE EQUINO.
SARAH PASCHOAL SCARELLI
Dissertação apresentada à Faculdade de Medicina Veterinária e Zootecnia da Universidade Estadual Paulista “Julio de Mesquita Filho” – UNESP, Campus de Botucatu, para obtenção do título de Mestre em Medicina Veterinária, área de Patologia Veterinária.
Palavras-chave: Alfa-SMA; Colágeno; Equino; Metaloproteinase; Sarcoide.
Scarelli, Sarah Paschoal.
Avaliação histoquímica do colágeno e expressão imunoistoquímica de metaloproteinases e alfa-actina de músculo liso no sarcoide equino / Sarah Paschoal Scarelli. - Botucatu, 2015
Dissertação (mestrado) - Universidade Estadual Paulista "Júlio de Mesquita Filho", Faculdade de Medicina
Veterinária e Zootecnia
Orientador: Julio Lopes Sequeira Capes: 50503006
SARAH PASCHOAL SCARELLI
Título: AVALIAÇÃO HISTOQUÍMICA DO COLÁGENO E EXPRESSÃO IMUNOISTOQUÍMICA DE METALOPROTEINASES E ALFA-ACTINA DE MÚSCULO LISO NO SARCOIDE EQUINO.
COMISSÃO EXAMINADORA:
_______________________________________________________ Prof. Dr. Julio Lopes Sequeira
Departamento de clínica veterinária FMVZ - UNESP – Botucatu
Orientador
_______________________________________________________ Profa. Dra. Noeme Sousa Rocha
Departamento de clínica veterinária FMVZ- Unesp – Botucatu
______________________________________________________ Prof. Dr. Osimar Carvalho Sanches
CENTRO DE DIAGNÓSTICO VETERINÁRIO CDAPVET
UNISA – Campus I – Presidente Prudente
ESTA PESQUISA FOI FINANCIADA PELAS SEGUINTES INSTITUIÇÕES
Universidade Estadual Paulista – UNESP
AGRADECIMENTOS
Ao orientador e à pessoa que me concedeu a oportunidade de elevar os conhecimentos, Prof. Dr. Julio Lopes Sequeira, pela disposição, pelos ensinamentos, paciência e apoio para a realização desse trabalho.
A todos os professores, médicos veterinários residentes e funcionários do Setor de Patologia Veterinária da FMVZ- UNESP- Botucatu. Cada um é único e essencial para a Patologia Veterinária como um todo e pessoas especiais que serão sempre importantes para mim.
Agradeço aos todos os colegas pós graduandos da Patologia veterinária, em especial a Priscila, Claudenice, Carlos Eduardo e Claudia pela ajuda, pelos ensinamentos e a amizade.
A FAPESP, pela concessão da bolsa, assim, permitindo a execução do projeto. A todos os amigos e familiares que acompanharam todo o processo.
Á Médica Veterinária Mestre Arita Cremasco, quem iniciou a linha de pesquisa com Sarcoide e quem deixou muito aprendizado.
LISTA DE TABELAS
Tabela 1 - Critérios morfológicos utilizados na análise histopatológica de
sarcoide equino, de acordo com Martens et al. (2000)...17 Tabela 2 - Anticorpos primários e suas respectivas diluições para marcação imuno-histoquímica nas amostras de sarcoide equino...18 Tabela 3 - Frequência e Percentual de Animais Acometidos por Sarcoide
Equino Segundo a Raça...21 Tabela 4 - Frequência e Percentual de Animais Acometidos por Sarcoide
Equino Segundo o Sexo...22 Tabela 5 - Frequência e Percentual de Animais Acometidos por Sarcoide
Equino Segundo a Idade...22 Tabela 6 - Frequência e Percentual de Animais Acometidos por Sarcoide
Equino Segundo a Pelagem...23 Tabela 7 - Frequência e Percentual de Animais Acometidos por Sarcoide
Equino Segundo a Localização...23 Tabela 8 - Frequência e Percentual de Animais Acometidos por Sarcoide
LISTA DE FIGURAS
Figura 1. Sarcoide equino do tipo clínico fibroblástico. obj, 10x, HE. Proliferação de fibroblastos neoplásicos em arranjo fasciculado na derme...28 Figura 2. Sarcoide equino do tipo clínico nodular, obj 40x. Detalhe da figura anterior. Hematoxilina e Eosina...29 Figura 3. Sarcoide equino do tipo clínico fibroblástico, obj. 40x. Os fibroblastos localizados na junção dermo- epidérmica mostram orientação perpendicular à
membrana basal, chamado de arranjo em “Picket-fence”. Hematoxilina e
LISTA DE ABREVIATURAS
MMP: metaloproteinase MEC: Matrix extra celular MB: Membrana basal
Alfa-SMA: alfa-actina de músculo liso PR: Picrosirius Red
Rete peg: atividade dermoepidérmica
Picket fence: formação de e orientação perpendicular dos fibroblastos em relação à membrana basal ou junção dermoepidérmica.
SUMÁRIO
RESUMO...xiii
ABSTRACT...xv
1. INTRODUÇÃO...1
2. REVISÃO DE LITERATURA...3
3. OBJETIVOS...15
4. MATERIAL E MÉTODOS...16
4.1. Estudo retrospectivo e prospectivo...16
4.2. Avaliação histológica...17
4.3. Método histoquímico...17
4.4. Método imunoistoquímico...18
4.5. Avaliação imuno e histoquímica...20
4.6. Análise estatística...20
5. RESULTADOS...21
a. Dados clínicos...21
b. Avaliação histológica...27
c. Avaliação histoquímica do colágeno...34
d. Avaliação Imunohistoquímica...38
i. Expressão de Alfa Actina de Músculo Liso (Alfa SMA)...38
ii. Metaloproteinase 1 (MMP-1)...44
iii. Metaloproteinase 2 (MMP-2)...49
iv. Metaloproteinase 9 (MMP-9)...54
6. DISCUSSÃO...60
7. CONCLUSÕES...70
8. REFERÊNCIAS...71
RESUMO
SCARELLI, S. P. Avaliação histoquímica do colágeno e expressão imunoistoquímica de metaloproteinases e alfa-actina de músculo liso no sarcoide equino. Botucatu, 2015. 81p. Dissertação (Mestrado) Faculdade de Medicina Veterinária, Campus de Botucatu, Universidade Estadual Paulista –
UNESP.
O sarcoide equino é a neoplasia de pele mais prevalente na espécie equina, possuindo seis tipos clínicos descritos: verrucoso, misto, maligno, nodular, oculto, fibroblástico e o misto. Evidências demonstram uma importante influência do estroma no desenvolvimento e progressão dos tumores malignos. O arranjo e a quantidade de colágeno, a presença de miofibroblastos no estroma ou como componentes da neoplasia, assim como a expressão de metaloproteinases (MMPs) pelas células tumorais, tem sido apontados como elementos que podem indicar o comportamento da neoplasia. Os objetivos do presente trabalho foram associar aos diferentes tipos clínicos de sarcoide equino as expressões de MMP-1, MMP-2 e MMP-9, identificar a presença ou
estas diferenças não sejam perceptíveis no exame histológico de rotina, é possível a observação de características importantes da neoplasia quando são utilizadas outras técnicas histoquímicas e imunistoquímicas.
ABSTRACT
SCARELLI, S. P. Histochemical evaluation of collagen and immunohistochemical expression of metalloproteinases and alpha-smooth muscle actin in equine sarcoid. Botucatu, 2015. 81p. Dissertação– Faculdade de Medicina Veterinária, Campus de Botucatu, Universidade Estadual Paulista
– UNESP.
The equine sarcoid is the most prevalent skin cancer in equine, having six clinical types described: warty, mixed, malignant, nodular, hidden, fibroblast and mixed. Evidence has shown an important influence on stromal development and progression of malignant tumors. The arrangement and quantity of collagen, the presence of myofibroblasts in the stroma or as a tumor component as well as the expression of matrix metalloproteinases (MMPs) by tumor cells, have been identified as factors that may indicate the behavior of the tumor. The objectives of this study were associate the different clinical types of equine sarcoid to expressions of MMP-1, MMP-2 and MMP-9, to the presence or absence of myofibroblasts by α-SMA expression and the characteristics and distribution of collagen, in order to determine possible markers of the biological behavior of the tumor. Typical microscopic morphological characteristics of equine sarcoid were present in the samples evaluated, but these alone can’t characterize a
especific clinical type. In sections stained with picrosirius red method and examined under polarized light the tumor stroma in fibroblastic and verrucous clinical types, was composed of loose and delicate collagen fibers, compatible with immature fibers in less stable lesions. Myofibroblasts were identified in equine sarcoid and the variation in distribution and intensity of alpha-SMA expression was observed even within the same clinical type. The neoplastic fibroblasts in equine sarcoid demonstrate expression MMP-1, MMP-2 and MMP-9. The verrucous and mixed types have higher MMP-2 expression than nodular clinical type, and this finding is consistent with the more aggressive potential. So there are differences between the clinical types of equine sarcoid that can be seen by the use of histochemical and immunohistochemical techniques.
1. INTRODUÇÃO
As neoplasias de origem mesenquimal frequentemente acometem os equinos (RAMOS et al., 2008). Dentre estas o sarcoide equino é o de maior prevalência (SCOTT & MILLER Jr., 2003). Esta neoplasia é definida morfologicamente como um tumor fibroblástico, com envolvimento epidérmico e dérmico (WHITE et al.,2002).
Suas características permitem a identificação de seis diferentes formas clínicas, mais especificamente o tipo verrucoso, o maligno, o nodular, o oculto, o fibroblástico e o misto (SCOTT & MILLER Jr., 2003). Sua etiologia é viral, sendo os papilomavírus bovino PVB-1 e PVB-2 (YUAN et al., 2010), implicados no seu surgimento. O diagnóstico da lesão só é confirmado pelo exame histológico de amostras da lesão, obtidas pela retirada radical do tumor ou por biopsia (WHITE et al., 2002).
Os diagnósticos diferenciais do tumor variam de acordo com as suas formas clínicas, mas geralmente pode-se citar a papilomatose, o carcinoma de células escamosas, tecido de granulação exuberante, granuloma eosinofílico, habronemose, fibroma, fibrossarcoma, além de processos parasitários (SCOTT & MILLER Jr., 2003).
A escolha terapêutica deve ser adotada a depender de alguns fatores, tais como o tamanho da lesão, quantidade, localização e extensão, podendo-se utilizar da excisão cirúrgica, crioterapia, imunoterapia, radioterapia e quimioterapia (KNOTTENBELT, 2005). O prognóstico varia de acordo com o tipo, localização e o tipo de tratamento utilizado (SCOTT & MILLER Jr., 2003).
Entre os objetivos da análise morfológica de uma neoplasia estão não só o diagnóstico, mas também a identificação de elementos que possam servir para a previsão do comportamento biológico da neoplasia e também como alvos terapêuticos.
(KELLERMAN et al., 2007; WONG et al., 2013). Da mesma forma, o arranjo e a quantidade de colágeno produzida pela neoplasia, permite estabelecer uma relação com o grau de agressividade (COLEMAN, 2011). A presença de miofibroblastos já foi observada no estroma de inúmeras neoplasias malignas humanas, sendo esta presença frequentemente associada a um pior prognóstico, porém a sua influência na tumorigênese não está totalmente elucidada (SWIETLICKI et al., 2012). Neoplasias que expressam MMPs possuem maior capacidade invasiva, sendo que estas enzimas ainda influenciam na progressão neoplásica (VIHINEN & KAHARI, 2002).
2. REVISÃO DE LITERATURA
Sarcoide equino é a neoplasia cutânea mais frequente entre os equídeos e costuma acometer animais com idade inferior a quatro anos, independentemente da raça, sexo ou mesmo característica de pelagem. O aparecimento deste tipo de lesão não sofre influência sazonal, tendo sido relatada a sua ocorrência em várias regiões do mundo. (RAGLAND et al., 1970; MARTI et al., 1993; SCOTT, 2000; GOLDSCHMIDT & HENDRICK, 2002; RINN et al., 2007). Seu comportamento clínico é localmente agressivo devido à sua capacidade infiltrativa, além de ser refratário a diferentes formas de terapias (PLUMMER, 2005).
Os diagnósticos diferenciais do tumor variam de acordo com as suas apresentações clínicas, mas geralmente pode-se citar a papilomatose, o carcinoma de células escamosas, tecido de granulação exuberante, granuloma eosinofílico, habronemose, fibroma, fibrossarcoma, além de processos parasitários (SCOTT & MILLER Jr., 2003).
Este processo foi primeiramente caracterizado por Jackson em 1936, que o definiu
como uma “neoplasia benigna única da pele, localmente invasiva, com componente epidérmico variável e propensão à recorrência.” À aparência sarcomatosa maligna das
lesões se deve a denominação da lesão (KNOTTENBELT, 2005), não havendo nenhuma relação com a sarcoidose dos seres humanos (ACKERMANN, 2007). Qualquer região do corpo pode ser acometida, ocorrendo com maior frequência na cabeça, região cervical, membros e região ventral. Podem surgir lesões múltiplas repentinamente e estas podem desaparecer espontaneamente ou não (SCOTT & MILLER Jr., 2003).
O sarcóide equino, do ponto de vista morfológico, é uma neoplasia de tecido conjuntivo, com origem fibroblástica, não metastatizante, que mostra muito frequentemente o envolvimento da epiderme (KNOTTENBELT, 2005; RINN et al., 2007), sendo caracterizado por possuírem bordos indistintos e serem constituídos por células fusiformes ou estreladas, frequentemente hipercromáticas e atípicas, com número de mitoses baixo (SCOTT & MILLER Jr., 2003).
2010). Deve-se ressaltar, que estes dados provavelmente têm relação direta com a composição racial da população equina nas regiões estudadas (CREMASCO, 2011).
Embora não haja predileção por sexo, animais castrados parecem ser mais acometidos pelo sarcóide equino (MARTI, 1993; BROSTOM, 1995; ANGELOS, 1998; PLUMMER, 2005). Já a faixa etária varia entre três e sete anos (SCOTT & MILLER Jr., 2003; RAMOS et al. 2008), porém a neoplasia também é diagnosticada em animais muito jovens, com até um ano de idade (MARTI, 1993; BROSTOM, 1995).
Existem seis tipos de apresentação clínica reconhecidos, que estão representados na tabela 1.
Tabela 1. Características dos diferentes tipos clínicos de sarcoide equino. Tipo clínico Características
Oculto ou superficial
Áreas circulares alopécicas e rugosas na pele;
Verrucoso Aparência semelhante a uma verruga;
Nodular Subtipo A - lesões únicas ou os agregados lobulados de massas subcutâneas esféricas;
Subtipo B - nódulos múltiplos com envolvimento cutâneo e não aderidos ao tecido subjacente.
Fibroblástico Aparência exofítica fibrovascular, lembrando tecido de granulação: Subtipo 1 - pedunculado;
Subtipo 2 - base localmente invasiva.
Maligno Forma agressiva e localmente invasiva com infiltração linfática, resultando em múltiplos cordões de massas tumorais estendendo-se à pele e ao tecido subcutâneo adjacente.
Mistos Lesões que possuem características pertencentes a dois ou mais tipos descritos anteriormente.
fibroblástico, seguido do misto e do verrucosso, sendo os tipos oculto e nodular os menos frequentes (BRUM et al., 2010).
Estes tipos clínicos podem mostrar predileção por determinadas regiões do corpo do equino. Assim, na região da cabeça todos os tipos clínicos podem ocorrer, porém com localizações bem específicas para o tipo nodular na região palpebral, para o tipo fibroblástico na região periocular e para o tipo maligno para a região mandibular. Na região cervical predominam os tipos oculto e verrucoso, enquanto que na região escapular o tipo oculto. Na axila são mais frequentemente observados os tipos verrucoso e fibroblástico, e na virilha além destes dois tipos junta-se o tipo nodular. Existem ainda localizações onde predomina um único tip clínico como o tipo maligno no codilho, o tipo coulto na face medial da coxa, o tipo nodular no prepúcio e o tipo fibroblástico nos membros. Deve-se acrescentar que o tipo fibroblástico pode ocorrer em regiões com histórico anterior de trauma ou mesmo nos casos em que o sarcóide apresentava tipo clínico diverso e foi traumatizado (KNOTTENBELT, 1995; SCOTT & MILLER Jr., 2003).
As características histopatológicas apresentadas pelo sarcóide equino não são definidoras de um tipo clínico específico (SCOTT & MILLER Jr., 2003). Porém determinados achados microscópicos, como a hiperplasia epidérmica e hiperceratose,
além da atividade dermoepidérmica constatada pela formação de “rete ridges” e pela
orientação perpendicular dos fibroblastos em relação à membrana basal ou junção
dermoepidérmica (“picket fence”), estão presentes nos tipos verrucoso e misto, e ausentes nos tipos oculto e nodular (MARTENS et al., 2000). Assim, embora este conjunto de alterações não estabeleça o diagnóstico definitivo de um tipo clínico específico de sarcóide, pode permitir a exclusão de um dos tipos. Desta forma, a hiperplasia epidérmica focal e a hiperceratose associadas a proliferação de fibroblastos juncionais excluem o diagnóstico de sarcoide do tipo nodular (SCOTT & MILLER Jr., 2003). Portanto, considera-se que a histologia não permite a subclassificação, já que todas as características morfológicas relevantes são observadas em todos os tipos clínicos e que os riscos de invasão não são significativamente diferentes em nenhum tipo clinico particular (MOSSERI et al., 2014).
SCOTT & MILLER Jr., 2003; TORRONTEGUI & REID, 1994). Evidências circunstanciais incriminam insetos na patogênese e epidemiologia do sarcoide (TORRONTEGUI & REID, 1994; SCOTT & MILLER Jr., 2003), relevante consideração, pois se acredita mostrar potencial risco de desenvolvimento do sarcoide pela capacidade de deslocamento das células cancerígenas (PLUMMER, 2005).
O sarcoide equino tem como características comuns a ausência de crescimento metastático, alto índice de recorrência, transformação de tumores solitários em múltiplos e ou de um tipo clínico inicial em outro sua apresentação clínica inicial pode se transformar em outra. Estas transformações podem ocorrer como consequência de traumas, que muitas vezes têm sua origem nos próprios procedimentos utilizados para o diagnóstico (SCOTT & MILER Jr., 2003; KNOTTENBELT, 2005; PLUMMER, 2005).
A escolha terapêutica deve ser adotada a depender de alguns fatores, tais como o tamanho da lesão, quantidade, localização e extensão, podendo-se utilizar da excisão cirúrgica, crioterapia, imunoterapia, radioterapia e quimioterapia (KNOTTENBELT, 2005). O prognóstico varia de acordo com o tipo, localização e o tipo de tratamento utilizado (SCOTT & MILLER Jr., 2003).
Já foi constatada a associação do sarcoide equino com a infecção pelo papilomavírus bovino (PVB) (ANGELOS et al., 1991; REID et al., 1994, NASIR et al., 1997), já que foi identificado o DNA deste vírus neste tipo de tumor (MARTENS et al., 2000; CHAMBERS et al., 2003). De acordo com Bogaert et al., 2010 e Hartl et al., 2011, os sarcoides se desenvolvem após a inoculação dos fibroblastos com papilomavirus bovino tipo 1 e 2 e transcrição viral. O PVB altera a expressão de vários genes após modificar os fibroblastos (Yuan et al., 2010a). O sarcoide equino origina-se dos fibroblastos transformados pelo PVB, que adquirem a capacidade de invadir a matriz extracelular (MEC) através da expressão das MMPs (Yuan et al., 2008b, 2010b; Hartl et al., 2011). As metaloproteinases podem ser responsáveis pela invasão tumoral desde que sua expressão e a infecção pelo PVB-1 suportem a invasão dos fibroblastos (Yuan et al., 2010b).
Entre os objetivos da análise morfológica de uma neoplasia estão não só o diagnóstico, mas também a identificação de elementos que possam servir para a previsão do comportamento biológico da neoplasia e também como alvos terapêuticos.
persistência do vírus e reduz a expressão de MHC I (NASIR et al., 1997), favorecendo a
progressão maligna da neoplasia (O’Brien & Campo, 2002).
Além disso, foi demonstrada a forte associação entre o risco de desenvolvimento do sarcoide e determinados alelos do MHC classe II, sugerindo a predisposição genética ao desenvolvimento deste tipo de neoplasia (Meredith et al., 1986).
No entanto, a etiologia do sarcóide equino é multifatorial e deve ser considerado como um tumor induzido por vírus com uma variedade ampla de manifestações, que são resultado de interações entre o agente etiológico, o ambiente e o genoma do hospedeiro (BROSTOM, 1995).
Atualmente, as pesquisas na área de oncologia tem se voltado para o estudo dos componentes do estroma tumoral e suas relações com as células neoplásicas e a própria progressão tumoral. A influência do estroma no desenvolvimento e progressão dos tumores malignos já foi constatada, sendo um pré requisito para a progressão tumoral (OLBRYT, 2013). O estroma tumoral é composto por células inflamatórias, células endoteliais, macromoléculas da matriz extracelular, fibroblastos e um subtipo específico de fibroblasto, denominado de miofibroblasto, que possuem um aparato contrátil formado por actina associada a outras proteínas contráteis, sendo diferentes morfologicamente e funcionalmente do fibroblasto no tecido conjuntivo (TOMASEK et al., 2002; SRIDHARA et al., 2013). A proliferação e crescimento invasivo da neoplasia em desenvolvimento pode ser facilitada pelos miofibroblastos, já que eles são capazes de estimular a angiogênese e suprimir a resposta imune (OLBRYT, 2013).
(MEC) e com a contração, o que resulta em reorganização da MEC e contração da ferida durante o processo reparativo (EYDEN et al., 2009).
A presença de miofibroblastos já foi observada no estroma de inúmeras neoplasias malignas humanas, incluindo as de mama, rim, fígado, bexiga, cólon e próstata, sendo a presença destas células frequentemente associada a um pior prognóstico (KELLERMAN et al., 2007; SUROWIAK et al., 2007; SWIETLICKI et al., 2012).
Ao que tudo indica, os miofibroblastos são particularmente numerosos dentro do estroma de carcinomas metastáticos e invasivos (SWIETLICKI et al., 2012). Quando a sua disposição espacial em relação aos outros componentes do estroma dos carcinomas é analisada, eles são mais evidentes no estroma mesenquimal “jovem”, em áreas que
correspondem a uma invasão primária do estroma, ou mais consistentemente, na periferia da lesão, sendo pouco desenvolvidos ou ausentes no centro da área esclerótica destas neoplasias (SCHÜRCH et al, 1981). Embora o estroma normal contenha apenas alguns fibroblastos, no estroma tumoral ocorre um aumento no número de miofibroblastos reativos (GIBBONS et al., 2013).
Os miofibroblastos também estão presentes em sarcomas, geralmente constituindo uma pequena fração da população celular. Eles são identificados em grande número em todos os casos de sarcomas histiocíticos e lipossarcomas esclerosantes bem diferenciados, porém sem nunca contituírem o elemento dominante (GHADIALLY et al, 1983). Estas células têm sido identificadas com menor frequência e em menor número em fibrossarcomas, sarcomas sinoviais, hemangiopericitoma maligno, neuroblastoma e Doença de Hodgkin esclerosante nodular (SEEMAIER et al, 1980), que apresenta uma reação estromal nodular altamente colagenizada (FERREIRA, 2008).
Miofibroblastos são também caracterizados pela expressão de níveis elevados de fatores de crescimento, proteases e proteínas da matriz extracelular, que podem influenciar a progressão tumoral (BHOWMICK et al., 2004).
A interação entre o tumor e o estroma é um pré-requisito para a progressão tumoral e assim, um passo crítico neste sentido é a transição dos fibroblastos associados ao tumor para miofibroblastos e a detecção deste tipo celular no estroma nos indica um pior prognóstico (ALILI et al. 2013).
fibroblastos do tecido normal (POTOCKI et al., 2013). Ainda não existem dados sobre a
expressão de α-sma pelas células do sarcoide equino. Assim sendo, a caracterização mais detalhada dos fibroblastos que compõem esta neoplasia permitirá compor um perfil mais completo destas células, principalmente quando associado ao arranjo do colágeno e às características clínicas do tumor.
O colágeno desempenha uma função essencial na manutenção da integridade estrutural e funcional dos diversos órgãos, portanto métodos para detectar, quantificar e avaliar o colágeno são valiosos no entendimento de vários processos fisiológicos e patológicos (RICH and WHITTAKER, 2005), e, através dessa análise, pode-se obter dados referentes a relação entre o parênquima e o estroma tanto nos processos fibróticos quanto neoplásicos.
Tradicionalmente, colorações como as de Van Gieson e as várias formas de tricrômico tem sido utilizadas para detectar as fibras de colágeno em cortes de tecido (RICH e WHITTAKER, 2005). No entanto, estas colorações podem não ser as ideais por não conseguirem revelar fibras muito finas, uma desvantagem que, em certas circunstâncias, leva a subestimar a quantidade de colágeno (RICH e WHITTAKER, 2005).
O picrosirius red em combinação com o ácido pícrico é um método de coloração histológica seletivo para o tecido conjuntivo descrito pela primeira vez por Sweat et al. (1964). O principal uso de coloração Picrosirius Red tem sido para diferenciar as formas diferentes de fibras de colágeno (WEATHERFORD, 1972).
As moléculas das fibras de colágeno são ordenadamente dispostas em uma orientação paralela resultando na característica clássica de birrefringência destas fibras. Moléculas de colágeno são ricas em aminoácidos básicos que reagem fortemente com corantes ácidos. O corante sirius red é uma molécula alongada que reage com o colágeno e que realça a birrefringência normal destas fibras, uma vez que numerosas moléculas de corante alinham-se paralelamente com o eixo longitudinal de cada molécula de colágeno (ALLON et al., 2006)
As cores e a intensidade da birrefringência das fibras de colágeno dependem da sua espessura (SZENDROI et al., 1984) e do seu arranjo molecular (DAYAN et al., 1989). Geralmente, sob polarização as cores exibidas pelas fibras delgadas variam entre o verde e o amarelo-esverdeado, e pelas fibras espessas variam entre o alaranjado e o vermelho (DAYAN et al., 1989). A predominância do primeiro tipo indica que as moléculas de colágeno são levemente comprimidas, sendo compostas por procolagenos, ou por fibras patológicas, ao invés daquelas normais de arranjo compacto (DAYAN et al., 1989).
O método do pricrosirus red associado a microcospia de polarização tem sido utilizado em estudos na medicina humana, relacionados a diversos tipos de fibrose (CAMPBELL et al., 2011; COLEMAN, 2011) e de condições patológicas (KOREN et al. 2001; ALLON et al., 2011), tais como nevus e lesões odontogênicas (TRAU et al, 1991; HIRSHBERG et al, 1996; HIRSHBERG et al, 1999). Neste último caso, o método do picrosirius red auxiliou na distinção entre tumores odontogênicos e processos reativos hiperplásicos do alvéolo dentário (HIRSHBERG et al., 1996) assim como na diferenciação entre os ceratocistos e os outros tipos de cistos odontogênicos (HIRSHBERG et al., 1999). Além disso, os tumores benignos e malignos mostram ocasionalmente características histomorfológicas sobrepostas que exigem um exame meticuloso. O método do picrosirius red associado à microscopia de polarização poderia ajudar a diferenciar os tumores malignos dos benignos em casos duvidosos. Como foi demonstrado em relação as neoplasias lipomatosas, o predomínio das fibras espessas, de birrefringência dentro do espectro verde-amarelo nos tumores malignos pode ser considerado como um modo físico aberrante de agregação, seja no arranjo ou na espessura, das fibras de colágeno nestas lesões, o que auxilia na diferenciação entre lesões benignas e malignas (ALLON et al., 2011). O método do picrosirius red é também útil para o diagnóstico diferencial de neoplasias que envolvem fibrose, tais como neoplasias foliculares de tireóide, onde há invasão capsular, e também em alguns tumores de glândulas salivares (COLEMAN, 2011).
Nos animais este tipo de método tem sido utilizado principalmente para a avaliaçào de processos fibróticos em diversos órgãos (GANJAMA & EVANS, 2006; WILLIAMS et al. 2013).
Segundo Scott e Miller (2011), nenhuma diferença importante foi encontrada entre a composição e a organização do tecido conjuntivo no sarcoide equino e na pele de equinos adultos, porém as células neoplásicas do sarcoide exibem um aumento na síntese de colágeno. No entanto, estes autores não relatam como foi feita esta avaliação. Não existem dados sobre a utilização do método do Picrosirius Red na avaliação da conformação e arranjo do colágeno em processos neoplásicos nos animais domésticos, inclusive no sarcoide equino, sendo que essa avaliação no sarcoide possibilitaria a evidenciação mais detalhada da distribuição do colágeno, seu arranjo e conformação, permitindo correlacionar estes achados com os diferentes tipos clínicos da neoplasia, e também com seu comportamento biológico.
As células tumorais estão em contato com um microambiente que consiste de uma matriz extracelular tridimensional (MEC) e células estromais, tais como fibroblastos e células endoteliais (JUNTTILA and SAUVAGE, 2013). Os constituintes deste microambiente podem afetar significamente o comportamento das células malignas (FANG and DECLERCK, 2013).
Muitas propriedades das células, tais como a migração, aderência, proliferação, grau de diferenciação e predisposição a apoptose, são influenciadas pelos constituintes da MEC e pelos fatores bioativos nela armazenadas (MUELLER et al. 2004).
A matriz extracelular consiste de uma rede complexa de macromoléculas que preenchem os espaços intercelulares (HADLER-OLSEN et al., 2013). As macromoléculas são constituídas por proteínas fibrosas (como o colágeno e a elastina, têm função principalmente estrutural) e não fibrosas (como laminina, fibronectina, tenascina, entactina, entre outras, são importantes na adesividade celular), imersas em uma substância fundamental formada por glicosaminoglicanas e proteoglicanas (BARROS, 2006).
Entretanto, em situações em que não há o controle de sua ação, ocorrendo a degração excessivamente a MEC, estas enzimas estão envolvidas em doenças, como artrites, osteoartrites, periodontite, doenças enfizematosas autoimunes, além de serem participantes dos mecanismos de invasão e metástases de tumores (VIHINEN & KAHARI, 2002).
Todos os membros da família das MMPs são secretados como proenzimas. Estas são liberadas por neutrófilos, monócitos, macrófagos, fibroblastos e também podem ser secretadas pelas células tumorais em resposta a uma variedade de estímulos (ARAÚJO et al., 2010). A sua expressão é induzida por citoqueratinas, fatores de crescimento, promotores de tumor, stresse psicológico, transformação oncogênica e pela interação célula-matriz e célula a célula (SIASOS et al., 2012).
MMP-1 é uma colagenase intersticial que degrada priciplamente colágeno tipo III e é expressa por vários tipos de células, incluindo fibroblastos, queratinócitos e macrófagos. Sua expressão é induzida por citocinas e fatores de crescimento (Westermarck and Kahari, 1999; Fields, 2013). Produzida em forma inativa, a MMP-1 é ativada por várias enzimas (Kahari, 1997; Westermarck and Kahari, 1999).
No sarcoide equino, MMP-1 esta presente na forma ativa (Yuan et al., 2010b) e sua liberação pelas células neoplásicas pode ser responsável pelo crescimento tumoral infiltrativo na derme, através da destruição parcial da MEC, ou seja, a quebra do colágeno III (Williams et al., 1982).
A MMP-2 e MMP-9 pertencem ao grupo das gelatinases, sendo responsáveis pela digestão rápida do colágeno desnaturado ou gelatinas (CHEN et al., 2013). A MMP-2, mas não a MMP-9, cliva os colágenos tipo I, II e III, porém ambas digerem o colágeno tipo IV, e são secretadas por fibroblastos e células endoteliais e epiteliais (VISSE & NAGASE, 2003).
A expressão das MMPs pelas neoplasias pode ser identificada por marcadores imuno-histoquímicos, técnicas moleculares, tais como Wertern blotting, Northern blotting ou PCR (VIHINEN & KAHARI, 2002).
geralmente na pele em volta do sarcoide. Entretanto, a expressão epitelial de MMP-2 foi variável, desde pouco expressiva até mais intensa do que na pele controle.
O grupo demonstrou a correlação entre a expressão de MMP-1 pelas células neoplásicas e epiteliais e o comportamento local dos sarcoides. Eles concluíram que a liberação de MMP-1 pode ser responsável pela invasão dérmica pelas células neoplásicas, por meio da degradação do colágeno III e, pela destruição parcial da membrana basal, mediar a formação do arranjo em ¨picket fence” (Mosseri et al., 2014).
O comportamento local do sarcoide difere de outros tumores malignos que invadem a epiderme, tais como o melanoma cutâneo humano, onde as MMP-2 e 9 são expressas pelas células neoplásicas e degradam o colágeno IV, assim destruindo a membrana basal (Chen et al., 2012; Breitkreutz et al., 2013). Isso não é encontrado em sarcoides. Entretanto, a MMP-2 também é expressa por queratinócitos hiperproliferativos (Krengel et al., 2002), que são encontrados na epiderme sobrejacente ao sarcoide equino (Martens et al., 2000).
Isso poderia explicar o ligeiro aumento da expressão de MMP-2 em alguns dos casos do estudo de Mosseri et al.,2014, que verificou que a expressão aumentada de MMP-2 foi particularmente evidente em associação com “picket fence”, sugerindo que o contato direto entre a epiderme e os fibroblastos é um pré-requisito da proliferação (Martens et al., 2000).
Alternativamente, o PVB-1, encontrado produtivamente infectando a epiderme sobrejacente do sarcoide (Brandt et al., 2011), poderia induzir a hiperproliferação dos queratinócitos. Em contraste, a forte expressão de MMP-2 que foi observada nos queratinócitos em ulcerações precoces pode ser resultado de citocinas e de MMP-1 liberadas por células inflamatórias (Kahari, 1997). De maneira parecida, a expressão de MMP-1 bem pronunciada pelas células neoplásicas podem resultar do aumento das citocinas locais com ulceração, formação de tecido de granulação e picket fence (Westermarck and Kahari, 1999).
Drogas que tem como alvo a inibição das MMPs, já foram testadas como uma nova alternativa no tratamento do câncer como uma alternativa às drogas citotóxicas, por poderem inibir a invasão tecidual e a indução tumoral de angiogênese e induzir a apoptose das células tumorais (WONG et al., 2013). Assim, as MMPs tem demonstrado eficiência contra tumores malignos em alguns estudos clínicos no homem (VIHINEN and KÄHÄRI, 2002), porém com alguns efeitos adversos (WONG et al., 2013).
O uso de medicações que podem alterar a tendência invasiva manifestada pela expressão de MMP-1 pode fornecer melhores resultados quando é realizado após o tratamento cirúrgico ou clínico (Mosseri et al.,2014).
No que diz respeito aos equinos, o estudo das MMPs tem sido limitado as pesquisas no campo do reparo tecidual (Perches et al., 2012) e das lesões fibróticas endometriais (Porto et al., 2011). Poucos estudos tem se dedicado a determinação da função destas enzimas nos processos neoplásicos na espécie equina (Yuan et al., 2010a; Yuan et al., 2008b, 2010b; Hartl et al., 2011).
3. OBJETIVOS
4. MATERIAL E MÉTODOS
4.1. Estudo retrospectivo e prospectivo
Nesta pesquisa foi realizado o estudo retrospectivo de todos os casos de afecções cutâneas de equinos diagnosticado, no Serviço de Patologia do Hospital Veterinária da Faculdade de Medicina Veterinária e Zootecnia – UNESP, Campus de Botucatu – SP, no período de 1985 a 2014.
Este material é oriundo de biopsias ou intervenções cirúrgicas encaminhadas como peças cirúrgicas enviadas ao Serviço para diagnóstico por serviços do próprio Hospital da unidade ou por hospitais e clínicas particulares, e também provenientes de profissionais autônomos da região que utilizam o Serviço de Patologia para diagnóstico histopatológico. Desta forma, foram incluídos tanto os casos que constam no arquivo do serviço, quanto os casos diagnosticados durante o período de desenvolvimento deste projeto.
O levantamento de dados iniciou-se pelo arquivo de fichas de registro de diagnóstico, e posteriormente, os blocos e as lâminas correspondentes a cada caso, foram recuperados dos arquivos de Serviço de Patologia. Dos prontuários de registro referentes às fichas de diagnostico foram obtidas informações sobre a raça, sexo, idade, pelagem, localização, o tamanho da neoplasia e ao número de lesões, descrição dos dados clínicos cirúrgicos de cada animal, assim como a descrição macroscópica das lesões colhidas, na data de sua apresentação clínica.
Embora tenham sido considerados os diagnósticos morfológicos que constavam das fichas originais, todos os casos levantados foram reavaliados do ponto de vista histopatológico, sendo estabelecidos os diagnósticos. A partir do nosso levantamento foram utilizadas amostras consideradas adequadas e apropriadas para a realização deste projeto, dos quais foram confeccionadas novas lâminas para descrição morfológica, para a análise imuno-histoquímica e a histoquímica.
Os dados clínicos foram recolhidos dos prontuários de registro e utilizados para a observação do histórico clínico e para a classificação clínica por meio de sua forma de apresentação baseado na descrição de clínicos e cirurgiões.
O material de arquivo é proveniente da rotina de diagnóstico do Serviço de Patologia que foi recebido durante o período de desenvolvimento do projeto foram submetidos aos procedimentos de rotina para inclusão em parafina e cortados em micrótomo rotativo. Os cortes foram corados pelo método de Hematoxilina-Eosina para descrição dos achados histopatológicos. Cortes das mesmas amostras foram submetidos às técnicas de imuno-histoquímica e histoquímica.
O projeto foi aprovado pelo conselho de ética e experimentação animal da FMVZ –
UNESP, Campus de Botucatu, SP.
4.2. Avaliação histológica
Para cada caso, utilizou-se os critérios histopatológicos utilizados por Martens et al. (2000), sendo considerados em relação a sua ausência ou presença. Eles são apresentados na tabela 1.
Tabela 2. Critérios morfológicos utilizados na análise histopatológica de sarcoide equino, de acordo com Martens et al. (2000).
Epiderme Derme
Hiperceratose Densidade dos fibroblastos
Atrofia da epiderme Arranjo dos fibroblastos
Hiperplasia Cistos foliculares
Rete ridges (atividade dermo-epidérmica)
Picket fence
Úlcera parcial
4.3. Método histoquímico
I,II e III e 95% e 80%, por três minutos e dez lavagens rápidas em água destilada. Os cortes foram imersos em ácido fosfomolibídico 0,2% por 2 minutos, seguido de 3 lavagens rápidas em água destilada. A coloração com o Picrosirius Red foi feita por 110 minutos, seguida do uso de ácido clorídrico por 2 minutos. Hidratação em soluções de álcool 70% e absolutos I, II e III, seguido de 3 passagens no xilol e montagem das lâminas.
4.4. Método imunohistoquímico
As técnias imuno-histoquímicas foram padronizadas no Laboratório de Pesquisa do Serviço de Patologia da Faculdade de Medicina Veterinária e Zootecnia da UNESP.
A tabela 2 mostra as diluições em albumina sérica bovina a 1% de cada anticorpo utilizado e os anticorpos primários utilizados neste trabalho.
Tabela 3. Anticorpos primários e suas respectivas diluições para marcação imuno-histoquímica nas amostras de sarcoide equino.
Anticorpo Marca Clone Descrição Diluição
MMP-1 RDI 41-1ES Anticorpo monoclonal produzido camundongo contra a
proteína, de origem humana.
1:100
MMP-2 RDI 42-5D11 1:200
MMP-9 Sta
Cruz Biotech
GE-213 1:100
α-SMA Dako 1A4 1:1250
Durante a padronização da técnica, foi utilizado como controle positivo uma amostra de endométrio normal equino para o anticorpo α-SMA e MMP-9 e fígado cirrótico equino para os anticorpos MMP-1 e 2
Os cortes histológicos com quatro micrômetros de espessura realizados em micrótomo foram posicionados sobre lâminas eletrostáticas (ImmunoSlide, EasyPath®), por conferirem uma melhor fixação deste material nas lâminas e mantidos em estufa a 56ºC por 18 horas.
hidratação em soluções de álcool absoluto I,II e III e 95% e 80%, por três minutos e dez lavagens rápidas em água destilada.
A recuperação antigênica foi realizado utilizando-se de calor úmido sob pressão em câmara Pascal (DakoCytomationDenmark S/A) empregando-se solução de ácido cítrico a 10 mM, pH 6,0, a 127ºC durante trinta segundos. As amostras fixadas em formalina requerem recuperação antigênica para os epítopos a serem pesquisados. A utilização deste fixador é prejudicial por originar ligações entre as cadeias proteicas ao redor dos sítios antigênicos, produzindo assim o mascaramento dos antígenos e interferindo na ligação com os anticorpos.
Em seguida, o material foi submetido ao resfriamento por vinte minutos em temperatura ambiente. Posteriormente, as lâminas foram lavadas em água destilada rapidamente por 10 vezes. O bloqueio da peroxidase endógena foi realizado utilizando-se de solução de peróxido de hidrogênio (Merck®) a 3%, por vinte minutos. Após este procedimento, para a remoção do peróxido do tecido, as lâminas foram submetidas a duas três lavagens em solução tampão TRIZMA base (D5637, Sigma Chemical CO, St. Louis, EUA, peso molecular 121.14), tris – pH 7,5 de cinco minutos cada.
Com a finalidade de evitar reações inespecíficas com proteínas teciduais, para o bloqueio da proteína inespecífica, os cortes foram imersos em solução de leite em pó desnatado (Molico, Nestlé®) a 3% diluído em solução tris – pH 7,5, permanecendo por uma hora em temperatura ambiente.
A incubação com os anticorpos primários por 18 horas a 4ºC, conforme as diluições descritas na Tabela 3 foi efetuada após os cortes serem delimitados com caneta hidrofóbica (Dako Pen, S2002, Dako) em bandeja com tampa e lacrada com fita adesiva, precedida da remoção do excesso de leite das lâminas com água destilada. Seguiu-se de três lavagens com tris pH 7,5 por cinco minutos nos cortes.
Para a detecção da reação imuno-histoquímica dos anticorpos foi empregado o sistema Histofine, conforme instruções do fabricante, com incubação única da solução por 30 minutos, seguido de lavagem das lâminas com solução tris pH 7,5.
Para visualização da reação, as lâminas foram tratadas com solução de 3,3’
Em cada bateria de reação, foram acrescidos controles positivos e negativo. O controle negativo constitui de um corte de sarcoide equino, sendo incubado somente o diluente.
A avaliação imunohistoquímica foi realizada na totalidade de casos (44) para o anticorpo alfa-SMA, porém, em apenas 36 amostras para os anticorpos MMP-1 e 2 e 35 para MMP-9.
Para avaliar a imunoreatividade dos anticorpos alfa-SMA, MMP-1, MMP-2 e MMP-9, atribuiu-se dois escores, de distribuição e de intensidade. No escore de distribuição, avaliou-se a quantidade de células positivas em cada amostra, sendo classificadas da seguinte maneira: de 0 a 25% de células marcadas (1), mais que 25% até 50% (2), mais que 50% até 75% (3) e mais que 75% de células marcadas (4). O escore de intensidade avalia e diferencia a intensidade de marcação em cada amostra, sendo: ausência de marcação (0), marcação de intensidade discreta (1), moderada (2) e acentuada (3). Essas avaliações foram aplicadas apenas nas células neoplásicas e não no tecido ao redor.
4.5. Avaliação imuno e histoquímica
As avaliações histoquímica e imuno-histoquímica foram realizadas por meio de microscopia óptica modelo AxioImager A1 (Carl Zeiss, Alemanha), câmera digital modelo Axiocam MRC (Zeiss Vision, Alemanha) acoplada a um microcomputador. As imagens foram processadas pelo programa computacional Axiovision Software Rel. Versão 4.6.1 (Zeiss Vision, Alemanha), do Serviço de Patologia da Faculdade de Medicina Veterinária e Zootecnia da UNESP. A objetiva utilizada foi a de 40x.
Para a análise do colágeno, as lâminas coradas pelo Picrosirius Red foram observadas no mesmo microscópio já descrito, sob a perspectiva de luz polarizada.
4.6. Análise estatística
5. RESULTADOS
5.1. Dados clínicos
Dos 44 casos de sarcoide equino utilizados neste estudo, somente em um caso não foi possível a identificação da raça. Sendo assim, sete animais eram da raça Quarto de Milha, sete Mangalarga, cinco Puro Sangue Inglês, quatro Minihorse, três Puro Sangue Árabe, dois Trakenner, um American Troter, um Campolina e 13 Sem Raça Definida (SRD) (Tabela 4).
Tabela 4. Frequência e Percentual de Animais Acometidos por Sarcoide Equino Segundo a Raça.
Raça Frequência Porcentagem (%)
Quarto-de-Milha 7 15,9
Mangalarga 7 15,9
Puro Sangue Inglês 5 11,4
Minihorse 4 9,0
Puro Sangue Árabe 3 6,8
Trakenner 2 4,5
American Troter 1 2,3
Campolina 1 2,3
Sem dados 1 2,3
SRD 13 29,6
Total 44 100%
SRD - Sem Raça Definida.
Tabela 5. Frequência e Percentual de Animais Acometidos por Sarcoide Equino Segundo o Sexo.
Sexo Frequência Porcentagem (%)
Machos 25 56,8
Fêmeas 19 43,2
Total 44 100%
Em relação à idade, cinco animais tinham até um ano de idade, 16 entre um e cinco anos, 11 entre cinco e 10 anos, seis animais com idade acima de 10 anos. Em seis casos não foi possível determinar a idade (Tabela 6).
Tabela 6. Frequência e Percentual de Animais Acometidos por Sarcoide Equino Segundo a Idade.
Idade (em anos) Frequência Porcentagem (%)
Até 1 5 11,4
Entre 1 e 10 27 61,4
Acima de 10 6 13,6
Sem dados 6 13,3
Total 44 100
Tabela 7. Frequência e Percentual de Animais Acometidos por Sarcoide Equino Segundo a Pelagem.
Pelagem Frequência Porcentagem
Castanho 8 18,8
Tordilho 7 15,9
Pampa 6 13,6
Alazã 4 9,1
Preto 1 2,3
Sem dados 18 40,9
Total 44 100%
No que diz respeito à localização, 14 casos acometeram a região da cabeça, dois em região cervical, nove na região dos membros, dois em região torácica, um em região abdominal, um em região inguinal, 13 casos multifocais. Em dois animais não foi possível obter este dado (tabela 8). Os casos classificados como multifocais foram de quatro animais, separados assim por apresentarem mais de uma lesão (três animais com três lesões e um com duas). Todos foram incluídos na classificação do tipo clínico misto, uma vez que as lesões apresentavam características de mais de um tipo clínico.
Tabela 8. Frequência e Percentual de Animais Acometidos por Sarcoide Equino Segundo a Localização.
Localização Frequência Porcentagem (%)
Cabeça 14 31,9
Multifocais 13 29,6
Membros 9 20,4
Região torácica 2 4,5
Região cervical 2 4,5
Região abdominal 1 2,3
Região inguinal 1 2,3
Sem dados 2 4,5
De acordo com a classificação clínica do sarcoide equino, dentre as 44 amostras utilizadas, obtivemos 18 fibroblásticos, 12 mistos, nove nodulares e cinco verrucosos (Tabela 9). Contudo, não foi observado o tipo clínico maligno e nem o oculto.
Tabela 9. Frequência e Percentual de Animais Acometidos por Sarcoide Equino Segundo o Tipo Clínico.
Tipo clínico Frequência Porcentagem (%)
Fibroblástico 18 40,9
Misto 12 27,3
Nodular 9 20,5
Verrucoso 5 11,4
Total 44 100,0
Na Tabela 10 estão apresentados os dados sobre a frequência dos tipos clínicos de sarcoide equino em relação com a raça dos animais.
Tabela 10 – Frequência e Percentual (%) dos Tipos Clínicos de Sarcoide Equino de Acordo com a Raça dos Equinos Acometidos.
Raça Fibroblástico Misto Nodular Verrucoso Total
American Troter - - 1 (2,3) - 1 (2,3) Puro Sangue Árabe 1 (2,3) - - 2 (4,5) 3 (6,8)
Campolina - - - 1 (2,3) 1 (2,3)
Mangalarga 2 (4,5) 3 (6,9) 2 (4,5) - 7 (15,9)
Minihorse 4 (9,0) - - - 4 (9,0)
Puro Sangue Inglês 1 (2,3) 2 (4,5) 1 (2,3) 1 (2,3) 5 (11,4) Quarto de Milha 3 (6,9) 2 (4,5) 2 (4,5) - 7 (15,9)
SRD 6 (13,6) 3 (6,9) 3 (6,9) 1 (2,3) 13 (29,6)
Trakenner - 2 (4,5) - - 2 (4,5)
Sem dados 1 (2,3) - - - 1 (2,3)
Total 18
(40,9) 12 (27,3) 9 (20,5) 5 (11,4) 44 (100%)
Enquanto que nove animais machos apresentaram o tipo clínico fibroblástico, sete o nodular, cinco o verrucoso e quatro o misto (tabela 11).
Tabela 11 – Frequência e Percentual dos Tipos Clínicos de Sarcoide Equino de Acordo com Sexo dos Animais Acometidos.
Fibroblástico Misto Nodular Verrucoso Total Sexo
Fêmea 9 (20,45%) 8 (18,2%) 2 (4,5%) - 19 (43,2) Macho 9 (20,45%) 4 (9,1%) 7 (16%) 5 (11,4) 25 (56,8) Total 18 (40,9) 12 (27,3) 9 (20,5) 5 (11,4) 44 (100%)
O tipo clínico fibroblástico predominou nos animais com idade abaixo de um ano. Na faixa etária entre um ano e cinco anos, foram seis animais com o tipo fibroblástico, cinco com o tipo nodular, quatro do tipo misto e um verrucoso. Na faixa etária acima de cinco anos e até 10 anos, foram quatro animais com o tipo clinico misto, três verrucosos, dois do tipo fibroblástico e dois nodulares. Já nos animais acima de 10 anos, foram cinco fibroblásticos e apenas um verrucoso (tabela 12).
Tabela 12. Frequência e Percentual dos Tipos Clínicos de Sarcoide Equino de Acordo com a Faixa Etária dos Animais Acometidos.
Fibroblástico Misto Nodular Verrucoso Total Idade (ano)
Até 1 4 (9,1) - 1 (2,3) - 5 (11,4) Mais de 1 a 5 6 (13,6) 4 (9,1) 5 (11,4) 1 (2,3) 16 (36,4) Mais de 5 a 10 2 (4,5) 4 (9,1) 2 (4,5) 3 (6,8) 11 (25) Mais que 10 5 (11,4) - - 1 (2,3) 6 (13,6) Sem dados 1 (2,3) 4 (9,1) 1 (2,3) - 6 (13,6) Total 18 (40,9) 12 (27,3) 9 (20,5) 5 (11,4) 44
Tabela 13. Frequência e Percentual dos Tipos Clínicos de Sarcoide Equino de Acordo com a Pelagem dos Animais Acometidos.
Fibroblástico Misto Nodular Verrucoso Total Pelagem
Alazã 1 (2,3) - 3 (6,8) - 4 (9,0) Castanha 2 (4,5) 1 (2,3) 4 (9,0) 1 (2,3) 8 (18,3) Pampa 5 (11,4) - - 1 (2,3) 6 (13,6)
Preta 1 (2,3) - - - 1 (2,3)
Tordilha 4 (9,0) - - 3 (6,8) 7 (15,9) Sem dados 5 (11,4) 11 (25) 2 (4,5) - 18 (40,9) Total 18 (40,9) 12 (27,3) 9 (20,5) 5 (11,4) 44 (100)
Quanto à localização, a apresentação preferencial do tipo clínico fibroblástico foi a multifocal com sete casos, seguida da cabeça com cinco casos. O tipo misto também apresentou cinco casos na cabeça e três multifocais. O tipo nodular apresentou três casos localizados na cabeça e três em membros. Já o tipo clínico verrucoso apresentou localização variável, sendo um caso por região, mais especificamente, cabeça, membros, região cervical, torácica, além de um multifocal (tabela 14).
Tabela 14 – Frequência e Percentual dos Tipos Clínicos de Sarcoide Equino de Acordo com a Localização Anatômica.
Fibroblástico Misto Nodular Verrucoso Total Localização
Cabeça 5 (11,4) 5 (11,4) 3 (6,8) 1 (2,3) 14 (31,9) Membros 4 (9,0) 1 (2,3) 3 (6,8) 1 (2,3 9
(20,5) Multifocal 7 (15,9) 3 (6,8) 2 (4,5) 1 (2,3) 13
(29,5) Região abdominal - 1 (2,3) - - 1 (2,3) Região cervical - - 1 (2,3) 1 (2,3) 2 (4,5) Região inguinal 1 (2,3) - - - 1 (2,3) Região torácica - 1 (2,3) - 1 (2,3) 2 (4,5) Sem dados 1 (2,3) 1 (2,3) - - 2 (4,5) Total 18 (40,9) 12 (27,3) 9 (20,5) 5 (11,4) 44
5.2. Avaliação Histológica
Todos os tipos clínicos apresentaram as alterações típicas em seus componentes epidérmicos e dérmicos (tabela 15). Quatro casos fibroblásticos, três nodulares, cinco mistos e três verrucosos apresentaram áreas de ulceração total (tabela 15).
Os tipos clínicos fibroblástico e nodular apresentaram 8 casos em que a epiderme mostrou simultaneamente sinais de atrofia e hiperplasia, em áreas distintas do corte (tabela 14). A formação de “rete ridges” estava
frequentemente associada à hiperplasia epidérmica, independentemente do tipo clínico (figura 4).
No tipo clínico nodular especificamente, apenas um caso apresentou atrofia da epiderme, enquanto cinco possuíam hiperplasia e três ulceração (tabela 14).
Nenhum dos tipos verrucosos que possuíam epiderme apresentou atrofia. Dez casos do tipo clínico fibroblástico apresentaram hiperplasia e oito atrofia de epiderme.
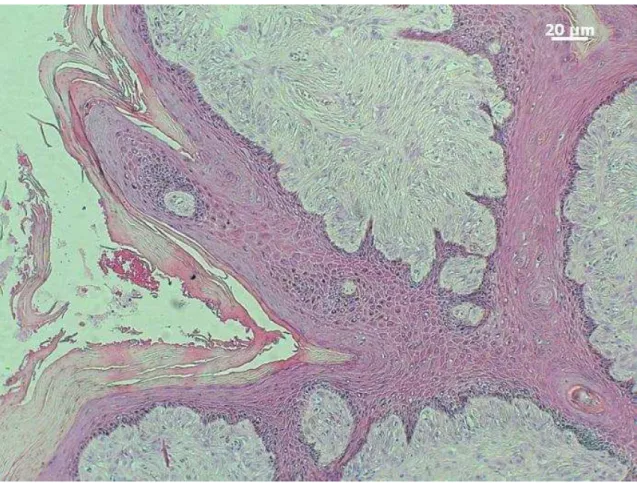
A proliferação dos fibroblastos neoplásicos mostrou-se densa em todos os casos analisados, com arranjo predominantemente fasciculado (figura 1 e 2) e em região de derme superficial e profunda. Por vezes, o crescimento tumoral era infiltrativo, invadindo principalmente a musculatura esquelética adjacente (figura 6). A presença ou ausência de estruturas dérmicas não pode ser associada à alguma tipo clínico específico (figura 5).
Tabela 15 – Alterações morfológicas na epiderme dos casos de sarcoide equino, entre os diferentes tipos clínicos, de acordo com Martens, et al. (2000).
Fibroblástico Misto Nodular Verrucoso Total
Hiperceratose 6 3 3 3 15
Atrofia 8 4 1 - 13
Hiperplasia 10 2 5 2 19
Rete ridges 12 4 5 3 24
Picket Fence 9 4 5 3 21
Úlcera parcial 7 3 4 1 15
Úlcera total 4 5 3 3 15
5.3. Avaliação histoquímica do colágeno
Picrosirius Red sob luz polarizada
De uma forma geral, em qualquer região onde apareçam fibras de colágeno de coloração verde (figura 7), estas sempre tem padrão frouxo e delicado, estando presentes mais frequentemente em regiões superficiais da derme. Já as fibras que mostram coloração entre o amarelo e o vermelho (figura 8), sempre mostram padrão mais grosseiro e mais denso, presentes predominantemente em regiões mais profundas das amostras.
Em todos os casos dos tipos clínicos fibroblástico e verrucoso, tanto o limite entre o tumor e o tecido adjacente quanto a região da neoplasia tiveram predomínio de fibras de coloração verde (figura 7).
Já o tipo clínico nodular, foi o mais heterogêneo, apresentando, em região de limite entre a lesão e o tecido adjacente e na neoplasia, tanto amostras com predominância de fibras verdes quanto amareladas ou alaranjadas, e amostras em que a distribuição mostrava uma mescla entre os dois tipos de colágeno (figura 9).
Os casos do tipo misto predominaram a mescla de ambos os tipos de fibras de colágeno. O arranjo das fibras se mostrou mais denso e em padrão mais grosseiro.
O tipo verrucoso não demonstrou predominância de nenhum dos dois tipos de fibras colágena.
Nos tipos clínicos mistos predominaram fibras de colágeno de coloração verde ou a associação destas com fibras de coloração amarelada, alaranjadas ou vermelhas, em nenhuma das amostras este último tipo de fibra colágena predominou.
5.4. Avaliação Imunohistoquímica
Expressão de Alfa Actina de Músculo Liso (Alfa SMA)
Houve expressão de alfa-SMA em 75% das amostras de sarcoide equino das 44 amostras analisadas. Cinco casos fibroblásticos foram negativos, quatro mistos, um nodular e um verrucoso (figura 10).
A imunomarcação da Alfa-SMA mostrou-se heterogênea. A expressão positiva foi observada nas células neoplásicas e na parede dos vasos sanguíneos. A expressão de Alfa-SMA pelos fibroblastos neoplásicos, quando presente, era citoplasmática. Porém, a distribuição das células positivas na neoplasia variava de focal (figura 11) a difusa (figura 12).
A marcação positiva em até 25% das células da neoplasia ocorreu em 59% das amostras, independentemente do tipo clínico considerado. Em 20,5% das mostras o número de células positivas esteve acima de 25% até 50% (tabela 15).
A intensidade de expressão de alfa-SMA moderada predominou nos tipos clínicos nodular, misto e verrucoso, com 55,6%, 50% e 40%, respectivamente. Já a intensidade de expressão fraca (figura 13) foi predominante no tipo clínico fibroblástico em 33,3% dos casos (Tabela 16).
Não houve diferença estatisticamente significativa entre os diferentes tipos clínicos de sarcoide analisados no que diz respeito a expressão de alfa-SMA (tabela 15 e 16).
Figura 13. Sarcoide equino do tipo clínico fibroblástico, obj. 40x – Alfa-SMA. Imunomarcação de intensidade fraca (escore 1) no citoplasma dos fibroblastos neoplásicos. Histofine, DAB, contracoloração com hematoxilina de Harris.
Tabela 15 – Número de casos por escore de distribuição nos diferentes tipos clínicos de sarcoide equino do anticorpo Alfa-SMA.
1+ 2+ 3+ 4+ Total
Fibroblástico 7 2 2 2 13
Misto 4 2 2 0 8
Nodular 2 3 1 2 8
Verrucoso 2 2 0 0 4
Total 15 9 5 4 33
Tabela 16 - Número de casos por escore de intensidade nos diferentes tipos clínicos de sarcoide equino do anticorpo Alfa-SMA.
0 1+ 2+ 3+ Total
Fibroblástico 5 6 5 2 18
Misto 4 2 6 0 12
Nodular 1 2 5 1 9
Verrucoso 1 1 2 1 5
Total 11 11 18 4 44
A ausência de letras minúsculas na coluna ou maiúsculas na linha implica que o teste de Kruskal Wallis não foi significativo.
Metaloproteinase 1 (MMP-1)
A expressão de MMP-1 foi observada nas células tumorais localizadas em região de derme superficial (figura 15) e profunda (figura 16), e também em células inflamatórias polimorfonucleares e em células epiteliais dos anexos cutâneos (figura 17).
Todas as amostras de sarcoide equino apresentaram expressão de MMP-1. Para tal avaliação, foram utilizadas 36 amostras. O percentual de células positivas foi alto em todos os tipos clínicos, sendo de 92,2 % para o tipo clínico fibroblástico, 90% para os mistos, 88,9% para os nodulares e 100% para os verrucosos (tabela 17).
Em relação à intensidade da marcação para MMP-1, para tipo clínico fibroblástico, 50% das amostras mostraram intensidade de marcação moderada e 50%, intensa. Já para as amostras do tipo clínico misto observamos 70% de marcação intensa, 20% moderada e 10% fraca. As amostras do tipo clínico nodular apresentaram 44,4% das amostras com intensidade moderada, 44,4% intensa e 11,1% fraca. Para o tipo clínico verrucoso, 66,7% das amostras exibiram marcação intensa e 33,3% moderada (tabela 18).
Não houve diferença estatisticamente significativa entre os diferentes tipos clínicos de sarcoide analisados no que diz respeito a expressão de MMP-1 (tabela ).
Figura 17 – Sarcoide equino do tipo clínico verrucoso, obj. 20x - MMP- 1. Imunomarcação citoplasmática em células da epiderme, das glândulas sebáceas e leucócitos. Histofine, DAB, contracoloração com hematoxilina de Harris.
Tabela 17 – Número de casos por escore de distribuição nos diferentes tipos clínicos de sarcoide equino do anticorpo MMP1.
3+ 4+ Total
Fibroblástico 1 13 14
Misto 1 9 10
Nodular 1 8 9
Verrucoso 0 3 3
Total 3 33 36
Tabela 18 - Número de casos por escore de intensidade nos diferentes tipos clínicos de sarcoide equino do anticorpo MMP1.
1+ 2+ 3+ Total
Fibroblástico 0 7 7 14
Misto 1 2 7 10
Nodular 1 4 4 9
Verrucoso 0 1 2 3
Total 2 14 20 36
A ausência de letras minúsculas na coluna ou maiúsculas na linha implica que o teste de Kruskal Wallis não foi significativo.
Metaloproteinase 2 (MMP-2)
Foram utilizadas 36 amostras e em todas elas, foi observada imunomarcação positiva para MMP-2. Esta marcação estava presente não só nos fibroblastos neoplásicos, mas também nas células epiteliais da epiderme (figura 19), na maioria das amostras. No entanto, não foi detectada expressão de MMP-2 nos anexos cutâneos.
Em 64,3% das amostras do tipo clínico fibroblástico mais de 75% de células apresentaram imunomarcação positiva para MMP-2, na faixa entre 50% e 75% foram 28,6% das amostras, e 7,1% das amostras com menos de 50% de células positivas. Para o tipo clínico misto observou-se que em 60% das amostras, mais de 75% de células apresentaram marcação positiva, 30% entre 50% e 75% e 10% com menos de 25% de células com marcação positiva. Já nos casos verrucosos, 66,7% apresentaram mais de 75% de células marcadas e 33,3% das amostras encontravam-se na faixa entre 25% e 50% de células positivas para MMP-2 (tabela 19).
Em relação à intensidade de marcação, 60% das amostras do tipo clínico misto apresentaram grau intenso, 30% grau moderado e 10% fraco. As amostras do tipo clínico verrucoso apresentaram resultados semelhantes, sendo intensa em 66,7% e em 33,3% moderada. Já para as amostras do tipo clínico nodular, 55,6% apresentaram marcação fraca, 33,3% moderada e 11,1% intensa. Em 35,7% das amostras do tipo clínico fibroblástico mostraram marcação fraca, 35,7% moderada e 28,6% intensa (tabela 20; figura 21).
Em 50% das amostras do tipo clínico fibroblástico em que a epiderme estava presente, houve marcação positiva para MMP-2 nas células epiteliais (figura 20). Já para os outros tipos clínicos este percentual de positividade era de 100%.
Estatisticamente, houve diferença dentre os tipos clínicos quanto à intensidade de marcação das MMP2 (p=0,033). Realizando avaliação estatística especificamente nessa variável, encontrou-se que a expressão da intensidade de MMP2 diferiu significativamente entre os tipos nodular e misto (p=0,0190) e nodular e verrucoso (p=0,0577).
Figura 21. Sarcoide equino do tipo clínico fibroblástico, obj. 40x - MMP-2. Imunomarcação citoplasmática intensa (escore 3) nos fibroblastos neoplásicos. Histofine, DAB, contracoloração com hematoxilina de Harris.
Tabela 19 – Número de casos por escore de distribuição nos diferentes tipos clínicos de sarcoide equino do anticorpo MMP2.
1+ 2+ 3+ 4+ Total
Fibroblástico 0 1 4 9 14
Misto 1 0 3 6 10
Nodular 0 0 5 4 9
Verrucoso 0 1 0 2 3
Total 1 2 12 21 36
Tabela 20 – Número de casos por escore de intensidade nos diferentes tipos clínicos de sarcoide equino do anticorpo MMP2.
1+ 2+ 3+ Total
Fibroblástico 5ab 5ab 4ab 14
Misto 1a 3a 6a 10
Nodular 5b 3b 1b 9
Verrucoso 0a 1a 2a 3
Total 11 12 13 36
Números de casos seguidos pela mesma letra minúscula na coluna e maiúscula na linha não diferem significativamente a 5% de probabilidade. A ausência de letras minúsculas na coluna ou maiúsculas na linha implica que o teste de Kruskal Wallis não foi significativo. Onde houve diferença p=0,033.