UNIVERSIDADE
DE
sAO
PAULO
I N S T I T U T O
DE
QUIMICA
DETERMINAC~O
DE
DI~XIOODE
CARBONO
POR
TITULAC~OPOTENCIOM~TRICA
<GRAN)
AP~SABSORC~O
EM
HIDR~XIDODE
S~DIOLUIZA
MARIA
NUNES
CARDOSO
D155ERT~Ç~O
DE
HE5TR~DOJ A I "
L I C H T I G
ORIENT~DQR
S~O
PAULO
Sr. ~nt6nio e
Una
Helena, pelo sacrificio e esforço demonstrado durante todo~o meu irmilo,
~o Ruberval,
percurso da minha vida.
IsmaeL, peLo carinh..o.
~gradecimentos
~o Professor Jaim, pela orientaç~o, confiança e
otimismo que contribuiram na minha formaç~o e realizaç~o
deste trabalho.
~ Gricia e a Silvia pela grande amizade.
~ todos amlgos e coleg~s que me apOlaram direta ou indiretamente.
~ 5ilvete pelo esforço incessante, e
paciêncla na digitaç~o deste trabalho.
Departamento de
~o
Experimental do
Laborat6rio de ~tmosférica
Patologia em nome do Prof.
Dr. Gy~rgy ~. 8~hm.
pâgina
I
1 1
I I . 1
OBJET 1 Vo .
lNTRODUÇ.~O .
Metodo Grâfico de Gran de ~valiaç~o do Ponto
1
2
Final da litulaç~o 2
11 .2 11 .~
11.3.1
11 .3.2
~r ~tmosferico e o CO2 • • • • . • • . • • • • • . . • • • . • • •
Determinaç~o de DiÓxido de Carbono . . . . Qnâlise de DiÓxido de Carbono no ~r
~tmosférico .
~nalise de DiÓxido de Carbono em Qm-biente de Trabalho
5
11
12
11 .4 Metodos de Geraç~o de Gases e Vapores de Con
-centraç~o Conhecida e Sistemas de Diluiç~o .. 14 11.4.1
11.4.2
Sistema de Diluiç~o de Gases . Metodos de Geraç~o de Gases e Vapo
-14
11.4.2.1
res de Concentraç~o Conhecida... 17
Sistemas Estâticos 17
11.4.2.1.1
11.4.L.1.2
11.4.2.1.3 11.4.2.2 11.4.2.2.1
11.4.2.2.1.1
Recipientes flexiveis .
Recipientes Rigidos .
Cilindro Calibrado com Pist~ó . . .
Sistemas Dinâmicos .
Geraç~o de Vapores e Gases de Concentraç~o
Conhecida .
lnjeç~o com Bomba lnfusora . . . . .
17
19
21 22
22
11.4.2.2.'1.2 Press'~o de Vapor 24
11.4.2.2.1.3 Tubos de Permeaçilo 25
11.4.2.2.1.4 Celas de Difus~o 26
11.4.2.2.1.5 Eletr6lise 2E:i
11.4.2.2.1.6 Reaçilo Quimica 27
11.5 Metodos de Coleta de ~mostra 28
11.5.1 i=lmostra Total 30
11.5.1.1 ~mostra Instantânea 30
11.5.1.2 i=lmostra lntregada peLo Tempo 30
11.5.2 i=lmostra Seletiva 31
11.5.2.1 ~mostra Instantânea 32
11.5.2.2 i=lmostra Integrada pelo Tempo 32
11.5.2.2.1 "Scrubling" de Solventes 32 11.5.2.2.2 "Trapping" de um Reagente QuimicoEspecifico 33 11.5.2.2.3 Coleta de ~mostra por Condensaçilo 33 11.5.2.2.4 Coleta de i=lmostra em Qdsorventes S6lidos 33
I I I
1 lI. 1
111.1.1 111.1.2 111.1.3 111.1.4
P~RTE EXPERIMENT~L 36
Titulaç~o Potenciométrica de Neutralizaç~o de uma Base com ~cido CLoridrico, Imporificada com
o La rbona to 36
In t roduç~o ',' 36
Material e Vidraria 38
SoluçêSes 39
Metodologia de Preparaç~o da ~mo5tra e
111.1.5.1
I I 1 . 1 . 5 . 2
CaLcuLo do VoLume da SoLuç~o TituLante no Ponto de EquivaLência que Corres~onte a Concentração de Carbonato ~dicionado a Mistura (~mostra). 42 CaLcuLo da Funç~o de Gran II e do VoLume da SoLução TituLante no Ponto de EquivaLência .. 46 111.1.6 Dados Experimentais e Discussão dos
ResuLtados o • • • • • o 50
111.1.7 111. 2
ConcLusões 71
~mostras de Dióxido de Carbono absorvida por uma SoLução ~bsorvedora de Hidróxido de
SoLuções e Gases . . . .
Sódio o • •
lntroduç;:jo .
CoLeta da ~mostra em Frascos ~bsorvedores.
Introdução .
Preparação do Gas Padrão . Preparação da 50Luç~o ~mostradora . CoLeta de ~mostra e ~naLise de Dióxido de
73 73 74 74 76 76 77 78 e Vidraria.
MateriaL 111.2.1
111.2.2 111.2.2.1 111.2.2.2 111.2.2.3 111.2.2.4 111.2.2.5 111.2.2.6
78 80 86
Ca rbono o • •
CaLcuLos o • • • • • • •
Dados Experimentais . . . . o o o • • • • • • • o • • • • • • • • • • • o
CoLeta de ~mostra com Seringa Hipodérmica e
~bsorç~o em Frascos Fechados 90
Introdução... . 80
Ma t e r i a L e Vi d r a r i a . . . .. 81 111.2.2.7
111.2.2.8 111.3.1
111.3.1.3 111.3.1.4 Il1.3.1.5 111.3.1.6
Il1.3.1.7 111.3.1.8
IV
V
VI
VI I
VI I I
Soluçêles e Gases 92
Preparação do Gàs Padrão 92
Preparação da Solução ~bsol·vedora 93 Coleta da Rmostra e ~nàlise do Dióxido de
Carbono 94
làLcuLos 85
Dados Experimentais e Discussão dos
Resul tados 99
CONCLUSClES F 1 NR 1 S 102
RE.SUMO 105
RElSfRRCT 106
RNEXOS 107
o
objetivo deste trabalho é o desenvolvimento deum método rápido de análise de dióxido de carbono, através de uma técnica simples e de baixo custo, com boa precis~o
11 - INTRODUÇRO
11.1 - Método Grafico de Gran de ~valiaç~o do Ponto Final da 2
Em 1950, Gran (2), publicou o seu primeiro metodo
para avaliaç~o do ponto final em titulações potenciométricas ou simplesmente colocou VI
pV
vsV
ouE
vsV
(Gran 1 ) . Com isto, obteve retas, ao invés de curvas, como nos métodos gràficos das derivadas primeira e segunda. Neste método, os
ponto final.
pontos a serem considerados s~o os próximos ao
Gran (1) publicou seu segundo método (Gran 11).
Por este método, n~o hà necessidade de se ob te,· pontos próximo ao ponto de equivalência, jà que o método utiliza diretamente a Nernst que é valida em toda a extens~o da titulaç~o.
~lguns autores começaram a verificar que a
proposiç~o de Gran baseada na equaç~o de Nernst, nem sempre apresentava os resultados desejados e em vez de procurarem a
explicaç~o, resoLveram desenvolver expressões que
corrigissem este método gràfico (3, 4, 5 e ô).
em Gran I e a utilizar microprocessadores para o càlculo do ponto final da titulaç~o.
Muitos trabalhos têm aparecido nos 6ltimos anos, aplicando o método grâfico de Gran 11. Godinho e ~leixo (8)
idealizaram uma das correç~es na titulaç~o de âcidos presentes na albumina do ovo.
Pressinotti ( 9 ) ,
desenvolvimento hist6rico
equivalência
e o
sobre Gran de
do metodo grafico ponto final de
fez um estudo critico
do desvios os
estudou
relacionando-os com a força iônica do meio.
respeitadas, certas condições original
Verifica-se que o (e mesmo o Gran I),
método grâf ico de Gran II
de força iônica, pode ser aplicado com segurança na
resoluç~o de in6meros problemas em quimica analitica, n~o
necessitando de correções suplementares.
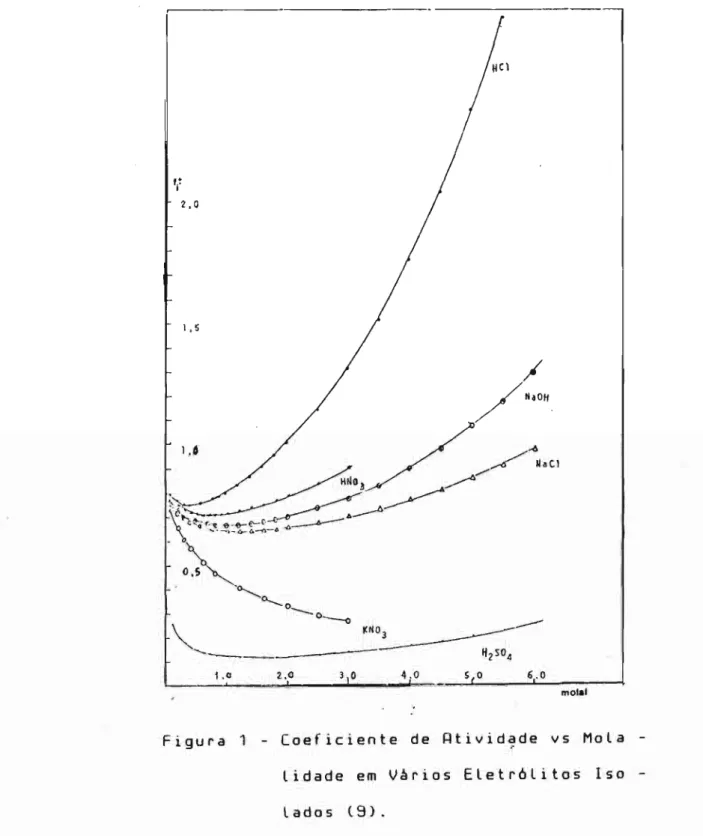
Pressinotti (9), também estudou a titulaç~o de hidr6xido de s6dio com acido cloridrico em varios ajustes de força iônica com NaCl (2,Oj 1,5j 1,OM).
Nas Titulações de hidr6xido âcido cloridrico O, 1M, em NaCl 2,0
de e
s6dio
1, 5M,
O,1M
as
com retas correspondentes ao lado basico, forneceram um ponto final antes do ponto de equivalência te6rico previsto, enquanto que as retas âcidas apresentavam o ponto final coincidente com o ponto de equivalência.
mesmo ponto sobre o eixo da abcissa, mostrando concordância
4
com o ponto de equivalência te6ricamente previsto.
1,0 2..0 3 o 4.0 s o 6.0
molal
~ explicaç~o para este fenômeno graficos de Huckel, isto
e
na relaç~o dose encontram nos coeficiente de atividade vs a raiz quadrada da força iônica.
~inda, segundo Pressinotti (9), nas titulações de acidos fortes com bases fortes, e vice-versa, à avaliaç~o do
0,03; para a avaliaç~o
menor que força lônlca
ponto final soluções em
pela reta acida s6 pode ser efetuada para
pela reta basica, em força iônica menor ou igual 1 , O ,
Podemos ver a figura 1 a variaç~o de fj~ e vsfji'
Por este motivo em nosso trabalho adotou-se o ajuste de força iônica com 1,OM em Na[l na soluç~o final de NaOH, antes da titulaç~o com acido cloridrico.
~ composiç~o gasosa do ar troposférico n~o poluido
composiç~o deveria ser, se
poluido dado pela tabela 1 ,
o homem e seu
é aquele trabalho
cuja
n~o
existissem sobre a terra (10), N6s nunca conheceremos essa
anos. Porém em locais
composiç~o,
milhares de
pOlS temos f ei to por
remotos, no
milhares mar,
e
nos palas, e ainda nos desertos e montanhas, o ar pode ser descrito como um ar diluido de poLuiç~o, ou seja se aproxima muito de um ar n~o poluido.
o
di6xido de Carbono um dos gases mais[omposiç~o do ar
blr
Ne
He
[H ....
Kr
NO
Xe
ppm(vol)
756.500 202.900 31.200 9.000 305
0,97 - '1,116 0,97 0,49 0,49 0,08
6
Vapores Org~nicos c.a 0,02
..
,..
.
.
. .. .
. . . .. .
.. .
. .. . . .
.. .
.. . . .
.
.. .. ... .
.. .. ...
. .
.. .. .. .. ...
.
. . . . .
Tabela 1 - [omposi~~o do blr n~o poluido (Baseado no ar
naturaL, o
vegetativo e
[02 entrou na atmosfera da terra peLo decaimento
a oxidaç~o do metano atmosférico, e é removido peLa fotossintese e peLa sua dissoluç~o na H~O. Essas fontes e sorvedouros naturais de [02 balancearam, este, em milhares
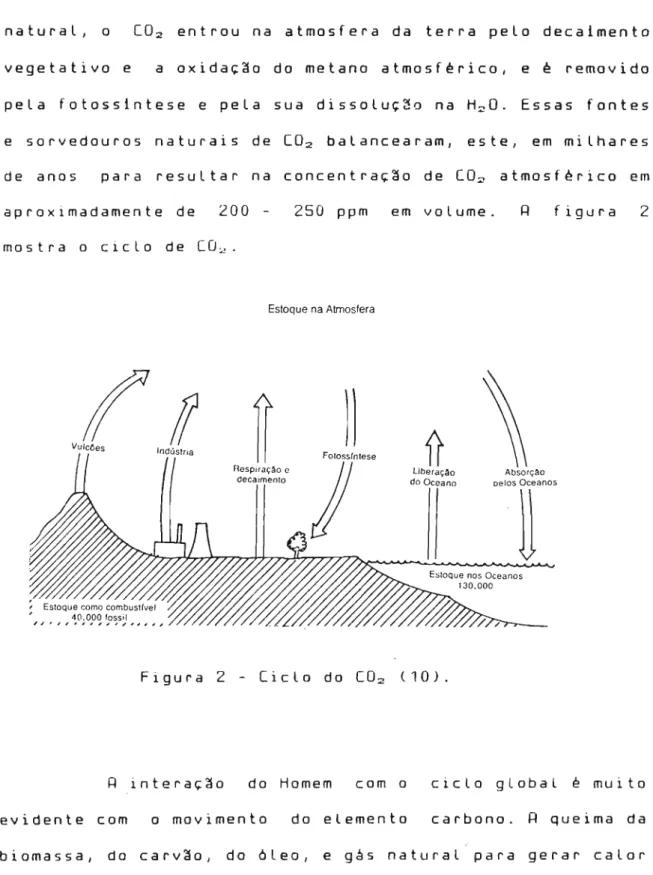
de anos para resuLtar na concentraç~o de [O~ atmosférico em aproximadamente de 200 250 ppm em volume. figura 2 mostra o cicLo de [02 •
Estoque na Atmosfera
ir
'"'~
rr
J1....
Respiração c / /
decaimento do OceanoLiberação
ir
~
Delas OceanosAbsorção~
Figura 2 - Ciclo do [02 (10).
Por causa da baixa velocidade de reaç~o e remoç~o
8
a sua concentraç~o tem aumentado nestes óltimos 200 anos, chegando aproximadamente a 335ppm em volume, com concentrações projetadas
de 400 - 500 ppm.
Segundo alguns
para os
autores o
próximos 50 anos na faixa
aumento da concentraç~o
de [O~ na atmosfera acarretaria em um
éd . d t l f "
do.
f . tm la a erra pe o enomeno e el o
e 15).
aumento da temperatura estufa" (11,12,13,14
O fenomeno~ ~o I/e elto estu a,f . f ,I que é provocado pelo aumento do teor médio de diÓxido de carbono, na atmosfera, causa maior absorç~o de energia radiante no infra-vermelho. Da energia solar que atinge a Terra, uma parte é refletida por esta, voltando ao espaçoj outra absorvida pela atmosfera (gases, poeira, agua) e o restante é absorvido na superficie da Terra, aquecendo-a. Por sua vez a Terra irradia (reflete), para o espaço, através do infra-vermelho a energia recebida. O [02 e H20 da atmosfera absorvem parte
desta energia irradiada da superficie e a reemitem de volta. Este fato é chamado de efeito estufa, explicando o por quê do aumento da temperatura da superficie da Terra pelo aumento da éoncentração de (02 atmosférico.
Mas, esta explicaç~o é muito si~plista, j
a
que existem outros fenômenos de ordem antropogênica, uns que a reforçariam e hc!l outros que se oporiam neste aumento de temperatura (particulado, diminuiç~o da camada desendo feitos, e muitas teorias est~o sendo levantadas e
est~o ainda em discus~o sobre au~ento de te~peratura da
terra Dados experimentais do aumento de concentraç~o de e do aumento de temperatura na lerra, est~o
constantemente colocadas em discus~o e checados.
11.3 - Determinaç~o de Di6xido de Carbono
A an.Hise de dióxido de Carbono esta relacionada com uma variedade enorme de objetivos e, dependendo destes, temos uma faixa muito grande de concentrações a serem determinadas
determinações.
e, consequentemente, de métodos de
Segundo os métodos oficiais de anàlise da A O A C (Association of Official Analytical Chemists)(15) e Meites (16) encontramos os métodos de determinaçilo de dióxido de carbono resumidos na tabela
l.
Os métodos citados na tabela 2, s~o utilizados para determinaç~o de dióxido de carbono em macro escala, ou variações de volume e massa na faixa de percentagem, e
titulações v?lumétricas com titulantes com concentrações da ordem de 10-1 M.
Além disso, existem muitos outros.- trabalhos na literatura para a determinaç~o de diÓxido de carbono com uma infinidade de objetivos; temos entilo, por titulaç~o de
Produto
materiais aLcaLinos Ca.O
formuLaç~o
de pesticida "Bordeaux"
fermento em pó
vinho
misturas de gases conhecidos
anaLise cLinica
anaLise de minérios que contenham carbonato
petróLeo lique-feito
Hétodo
~nalitico
aLcaLimetro de Knorr
absorç~o em ascarite
( 9r a vi met r i a )
absorç~o em "soda-Lime" (gravimetria)
gasometria
manométrica
tituLaç~o
voLumétrica
Orsat (voLume)
manométrica
absorção em ascarite (gravimetria) tituLação voLumétrica
tituLação voLumétrica
Faixa de Concentraç::!lo
10
Referência
16
16
16,20
16;17,18,19
15
15
15
15
analise de H;õ!O e esgoto
..." .. absorç~o em
Ba(OH);õ! 15
.. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. ..
Tabela 2-Determinaç:~o de dióxido de carbono, segundo ~ O ~ C
potenciometria (22, 23, 24 e 25); coulometria (26); absorç~o
no infra-vermelho (27) ; e s p e c t r o me t " i a de massa (28);
cromatograf ia gasosa (29) ; turbidiometria ( 30 ) ; condutometria e outros (31, 32 e 33).
~ importáncia malor na determinaç~o de dióxido de carbono esta nas analises ambientais.
Mesmo em analise ambientaL temos uma faixa muito grande de concentrações. Podemos ter, ent~o, dois tipos de analise ambiental: ~nalise de ar atmosférico e analise do ar de ambiente de trabalho.
11.3.1 -~nalise de Dióxido de Carbono no ~r ~tmosférico
o
dióxido de carbono n~o é identificado como umpoluente (34), a necessidade de sua monitoraç~o ocorre primeiramente como uma medida suporte para determinar a
relaç~o de emiss~o ou como um acompanhamento do processo.
Sistemas comerciais para avaliaç~o de s~o o inf ra-vermelho n~o dispersivo (35).
Existem poucas publicaçêles sobre medidas de dióxido de carbono em areas urbanas (34).
o
analisador infravermelho n~o dispersivo f oi(Ohio) (34). Rs contribuiç~es de fontes naturais de di6xido 12
de Carbono s~o significantes em areas urbanas.
11.3.2 -Trabalho
Rnalise de
R analise
Di6xido
de dióxido
de Carbono
de carbono
em Rmbiente
em ambiente de
de trabalho é muito importante, por ser este um gas asfixiante.
o
dióxido de carbono é sub-produto da combust~o completa desubstâncias orgânicas. Ele é usado principalmente na manufatura de outros produtos quimicos, tais como metanol e uréia. O dióxido de carbono é encontrado na fabricaç~o e
preservaç~o de bens pereciveis, na fabricaç~o de bebidas, na indústria de petróleo, no arco de solda e em aerossóis.
Efeitos agudos por inalaç~o de altas concentrações de di6xido de carbono podem causar um aumento na frequência respirat6ria, dispnéia, dor de cabeça, e pode chegar à perda de consciência e, eventualmente, à morte por asfixia (36). Exposições crônicas a baixas concentrações podem causar "stress" e mudanças emocionais, tais como aumento de irritabilidade, dor de cabeça, problemas de vis~o, etc. Exercicios fisicos podem também contribuir para piorar os sintomas, pOiS aumentam a frequência respiratória, a qual por sua
inalado.
Por este motivo existem limites de exposiç~o, TLV
"Rmerican Conference of (Threshold Limit
recomendados pela
Value) , para dióxido de carbono, Governmental
i-lverage)
Industrial Higienists (RCGIH)" que s~o:
TLV - TWR (Threshold Limit Value - 1ime Weighted 5.000 ppm (9.000 mg/m3 ) ; limite de tolerância da
concentraç~o maxima permitida, dada pela media ponderada em um intervalo de tempo de 8 horas.
TLV - STEL (Thereshold Limit Value - Short 1erm Exposure Limit) 15.000ppm (27.000 mg/m3): limite de tolerância da concentraç~o dada pela média ponderada por um intervalo de tempo de 15 minutos, o qual n~o devera ser excedido nenhuma vez durante o periodo de trabalho, quando a
concentraç~o estiver no TLV - TWR e n~o devera se repetir mais do que quatro vezes por dia,
minutos.
em um intervalo de 60
1oler~ncia), para 48 horas/semana
e
dePela legislaç:~o brasileira o Lf (Limite de
3.900 ppm ou 7.020 mg/m3 , este valor
e
calculado a partir do 5.000 ppm que vema ser o limite para 40 horas semanais (37).
O método recomendado para analise de dióxido de carbono em ambientes de trabalho pela NIOSH (National Institute for Ocupational Safety and Health) (38), vem a ser a coleta de amostras em sacos e sua post~rior analise em
laboratório por cromatografia condutividade térmica. R faixa
a gas e de trabalho
detector
é de 2.270 de
a
Outro método
avaliaç~o, e que possui
também utilizado para uma primeira uma menor precis~o e exatid~o, s~o
14
os tubos de amostragem colorimétricos (39), que podem ser
adaptados a uma bomba manual, individual.
ou bomba de amostragem
Para uma faixa de 0.01 a 0,3 \ , o fabricante recomenda para a bomba manual, 10 bombadas com erro relativo de 10 a 15\j para concentraç~es de 0,1 a 1,2\ com 5 bombadas o erro relativo é de 0,5 a 6\.
O principio de medida é o comprimento que ocorre a mudança de cor de branco para violeta de um tubo calibrado para concentrações. ~ reaç~o envolvida é:
c r l _ t : . . _ t ... I o l . t .
c o m I n d t c a d o r d . r . d O H
NH2 _ NH.COOH
11. 4 -~ETOD02_-º-UER~ç:RO DE G~SES E V~PORES DE Cº~~EN.l.R~RO
(Q.~(t:!~(..I D~ E SI STEH~S DE DILUI ç:RO.
11.4.1 - Sistema de Di~~o de Gases
mostrado na Um
laboratório é
esquema simples que pode figura 3.
ser montado
O
ar e oAr
Válvula
Gás
Válvula
Controle de Pressão
Oriflcio
Figura 3 - Diluiç~o de Gases, Utilizando Orificios Criticos ( 4 0 ) .
Saltzman (40) descreveu vàrios sistemas de
diluiç~o entre eles o da figura 4.
t
Cotabish (40), montou um sistema como mostrado na 16
figura 5 para compensar a press~o que mais tarde foi patenteado por Mase.
Medidor de Fluxo do Ar
Medidor de Fluxo de Ar
Ar - - .
GAs
Compensador Pressão
_ Amoslra Mistura
Garrafa MiSiuradora
Figura 5 - Sistema de Diluiç~o de Cotabish (40)
Outros sistemas como bombas misturadoras e diluidoras podem ser encontradas no comércio, e cobrem uma
grande faixa de diluiç~o (40).
de Vapores e
de Gases
=----==----'-....::.J=-=---==-=-_-=..;=_
deMétodos 11.4.2
11.4.2.1 - Sistemas Estáticos
-Os sistemas estáticos de produç~o de atmosféras
padr~es, consistem na introduç~o de uma pequena quantidade conhecida de contaminante em um recipiente de volume conhecido. O gás ou o vapor, se difundem homogeneamente no interior do recipiente e se conhecermos condições de
operaç~o (press~o e temperatura) e as caracteristicas do composto (peso molecular e densidade), temos uma
concentraç~o conhecida do contaminante.
O recipiente poderá ser rigido, flexivel ou cilindro calibrado de pist~o.
11.4.2.1.1 - Recipientes Flexiveis
• "o.m..
m~
;;I
-~
",",,"
\~./
\
/ Í
L,)Gá~
Diluente
Figura 6 - Sistema Est~tico para Geração de Gases ou Vapores de Concentração Conhecida - Recipiente Flexivel (41)
18
Ih misturas podem ser preparadas em sacos
pl~sticos, geralmente aluminizado.
em "TeflonR ", e "MylarRII
vezes para é, então, "wet" ou
o
saco plàsticoe,
então, cheio e esvaziado variasremover contaminantes residuais.
O
saco plastico conectado a um medidor de fluxo ou de volume como "dry gas meter". Enquanto o balão esta enchendo, o contaminante éfigura 6.
introduzido, por um dos metodos mostrados na
mistura de calibração deve ser usada imediatamente, pOlS a concentração inicial frequentemente decai com o tempo, (permeação)j o decaimento sera menor se o saco plastico
descrito.
11.4.2.1.2 - ~~cipientes Rigidos
GeraLmente s~o utiLizados ~arrafões ou frascos de vidro, podendo ser tambêm recipientes de plasticos ou metal desde que as interações com os gases contaminantes sejam negLigenciaveis.
o
voLume do frasco é obtido voLumetricamente por enchimento com agua. O tamanho usuaL do recipiente é da ordem de 20 a 40 Litros, o quaL é suficiente para que n~o haja excesso de diLuiç~o peLa retirada de uma pequena amostra de gas ou vapor (41).O
frasco é mostrado na figura 7; iniciaLmente épurgado com ar puro, para remover qualquer residuo de contaminante; a seguir, este é injetado; diretamente no frasco através de um septo de borracha.
Injetor de Conlaminante
Válvula
Gás Diluente
rv_--L...-'-,o:.Mistura
Gasosa
Recipiente de Volume Conhecido
Figura· Recipiento R(gido
Figura 7 - Sistema Estatico para Geraç~o de Gases e Vapores de Concentraç~o
Conhecida - Recipiente Rigido com
Os gases e vapores s~o misturados por um agitador
20
mecânico ou barra magnética (41).
Rlgumas modificaç~es foram feitas para remover amostras sem que haja um grande efeito de ou
variaç~o de press~o dentro do frasco.
Na figura 6, tem-se frascos e~ série para reduzir o efeito da diluiç~o quando a amostra é retirada.
Gás Diluenle
Figura 8 - Sistema Estatico para Geraç~o de Gases e Vapores de Concentraç~o
Conhecida - Recipientes Rigidos em Série (41)
Para se retirar uma mostra de um recipiente rigido sem causar efeito de diluiç~o ou queda de press~o interna, pode-se usar também um artificio, coloca-se um bal~o dentro do recipiente
figura 9.
Antes de
Remover Durante
Figura 9 - Sistema Estático para Geraç~o de de Gases e Vapores de Concentraç~o
Conhecida - Recipiente Rigido com BaLilo (41)
11.4.2.1.3 - Çi~~ndf~ Calibrado com Pist~o
~ figura 10, ilustra um frasco com pist~oj o
contaminante é introduzido através da abertura, e o pist~o é acionado até o volume desejado, e espera-se cerca de 15 minutos para a mistura se compLetar.
CIlindro Calibrado
Figura 10 - Cilindro de Pist~o para Geraç~o de Gases e Vapores
Conhecida (41)
11.4.2.2 - Sistemas Dinâmicos
22
Nos sistemas dinâmicos, o fluxo de ar e o ·fluxo dos contaminantes s~o cuidadosamente controlados para produzir uma raz~o de diluiç~o conhecida. Sistemas dinâmicos oferecem uma continua produç~oda mistura.
Os
gases .e liquidos podem ser usados nestes tipos de sistema com os liquidos porem,vapo r.
e
necessario a convers~o para o estado de11.4.2.2.1 Conhecida-_.._._._0 __._ _
Quando o contaminante
e
um liquido à temperatura ambiente, ha necessidade de se incluir um sistema devaporizaç~o, e a quantidade de liquido a ser vaporizada precisa ser constante e conhecida. \.
Entre os sistemas mais utilizados temos;
injeç~o com bomba infusora - press~o de vapor
tubo de permeaç~o
- celas de difus~o
- eletrólise
11.4.2.2.1.1
Os gases e os liquidas, podem ser introduzidos em uma corrente continua de gas por dosificador mecânico, injetores e bombas de injeç~o.
c
sistema mals utilizado em laboratório parageraç~o de atmosferas dinâmicas s~o as bombas de
continuas. Podem ser utilizadas para gases ou liquidas. Na figura
bomba infusora.
1'1, temos um sistema de com
11.4.2.2.1.2 - Press~o de Vapor (41.L__~~-l_
24
R
press~o de vapor tambéme
um dos métodos mais utilizados em atmosferas dinâmicas, sendo o liquido contaminante vaporizado pelo ar ou gas diluente.R
corrente de gás pode ser saturada de contamlnante e posteriormente diluida para12.
se obter a concentraç~o desejada, veja figura
FILTRO
Banho de Temperatura Constante
Figura 12 - Sistema dinâmico de Geraç~o de Vapor de Concentraç~o
conhecida-Press~o de Vapor (41).
R quantidade de liquido evaporado dependera de varios fatores: a temperatura do liquido, seu ponto de
o
tubo de permeaç~o é um dos malS recentes métodosde de atmosfera controLada para baixas
concentrações. Consiste em um p e queri o r:i Li n d r o construido geraLmente de "TefLonR " de diferentes espessuras e
comprimentos, fechados em ambas as extremidades por esferas de vidro ou tampas do mesmo materiaL; dentro desses tubos estâ encerrado um gâs Liquefeito ou Liquido que pode ser introduzido por esfriamento, por press~o ou os dois métodos combinados e podem ser construidos em Laboratório ou comprados no comércio. Na figura 13, temos um sistema de
geraç~o ce atmosfera usando tubo de permeaç~o.
Sarda
Ar diluente
Serpentina de Resfriamento
Tubo de Permeação
l:lanho de Temperatura Constante
Rotametrc
11.4.2.2.1.4 - Celas de Difus~o (42, 44, 45 e 46)
26
Os
gases e vapores têm a propriedade de se difundir através de tubos a um3 velocidade uniforme, se a temperatura, os gradientes de concentraç~o e a geometria do tubo permenecem constantes. O fenômeno de difus~o é apLicado para a geraç~o de atmosferas de bai xas concentrações de gases e vapores. Na figura 14, temos uma ceLa de difus~o.Sarda de
Ar
Entrada de Ar
Figura 14 - Sistema Dinâmico de Geraç~o de Vapor de Concentraç~o Conhecida-CeLa de Difus~o (41)
Muitos gases como a arsenamlna, ozônio, cloro, dióxido de nitrogênio, etano, etc, podem ser produzidos em laboratório por procedimentos eletroliticos. ~ eletrólise de
potencial entre eletrodos mergulhados nesta soluç~o. Esta diferença de potencial diretamente proporcional à
quantidade de gàs liberado em cada eletrodo, que pode ser
misturado com um gàs de produzindo uma
concentraç~o conhecida da mistura. Na figura 15 encontra-se um esquema para a geraç~o de gàs por eletr6lise.
Vidro Poroso
· o o·
.. ' . • o .
· o a"'
• . - o .
. . o ~:.
· o <>-'
• • • •Q o.· ...-.- - - - r i n - - - '
..
', ',Mistura TestA
Figura 15 - Sistema Dinâmico de Geraç~o de Vapor de [oncentaç~o Conhecida-Eletr6lise (42)
I I . 4 . 2 . 2 . 1 . 6 - Rea_lt..~o Quimi c a (42)
Em um sistema de geraç~o de gas por reaç~o quimica
é necessàrio que esta seja quantitativa e que os produtos da
Método
estatica
faixa de
concent.
10ppm -5\
VoLume da
mistura teste
10\ do
volume da
Press~o de
operaç~o
( 1
CompLexidade do sistema e
custo de
inst aLaç'~ o
Baixo
.~plicaçeles
gases e
vapores
...
,..
...
.
...
.. .. ...
.
.
...
.
dinâmica
difus~o 0,1-500ppm muito grande :: 1 Médio
liquidas
muito volãteis
...
' '.
injeç::Jo 1ppm-0,1\ grande ) 1
Médio a alto
liquidas volâ~eis e gases
.
.
.
.
,.
muito
permeaç::Jo 50ppm-200ppm grande ::: 1 Médio'
gases
liquefeitos
...
".
" " " "," " " " .. "" " .. " .. ".
" .. " " " .press~o
de vapor 5ppm-10\ grande ) 1
Baixo médio
,liquidas em geral
" " " " " " " " " " " .. " .. " " " .. " " " "
.
" " .. " .. " " " " ".
".
" ".
. .
"..
"..
"..
".
" ".
" " " " " ".
".
" ".
".
".
".
"..
" ".
" " ".
" " " " " " ".
" " " " " " ".
" " " " " ~ " " " " " " " " " " " ".
Tabela 3 - Resumo das caracteristicas principais de sistemas de atmosféras controladas ~7)
N
tabela 3 que resume as características principais dos sistemas de atmosferas controladas.
11.5 - METODOS DE
[OLET~DE
~MOSTR~Quando, por algum motivo, n~o é possivel se fazer a medida de concentraç~o atmosférica de um contaminante diretamente no local contaminado, uma amostra da atmosfera pode ser colhida e analisada em laboratório. ~ escoLha do método para
probLema e
uma apLicaç~o particuLar depende da natureza do das faciLidades tecnicas encontradas. Dois tipos de procedimento de coLeta de amostras s~o usados. Uma amostra totaL, na quaL a amostra coLetada incLui o ar, e uma amostra seLetiva, na quaL aLgum procedimento é usado para separar e se reter uma parte da amostra, a quaL contém a substância que se tem interesse em anaLisar.
~s amostras totais ou seLetivas também podem ser cLassif icadas em instantâneas e integradas no tempo. Ih
amostras instantâneas s~o aqueLas que representam a
concentraç~o do contaminante naqueLe exato momento e
I I . 5 . 1 - J:lmo st r a To tal
11.5.1.1 - J:lmostra Instantânea
~mostras instantaneas de gases podem ser coletadas em frascos rigid05 de vidro ou metaL ou sacos de plâstico
30
que podem ser poLietileno, SaranR , e
revestidas com aluminio,em voLumes de até 120 Litros. ~
amostra é introduzida em um baL~o, manualmente ou com uma bomba movida a bateria, e tubos coLetores de pyrexR de até
300 ml de capacidade, os quais podem ser despressurizados em Laborat6rio e abertos no LocaL a ser amostrado.
Frascos de vidro ou metaL que n~o possam ser despressurizados, podem ser preenchidos com uma bomba ou um sistema de vasos comunicantes através de uma solução não interferente do contaminante a ser analisado.
~ aparelhagem descrita para amostras instantâneas podem ser utiLizadas, se o f Luxo for Limitado a vaLores
t~o pequenos, que a coleta da amostra ocorre continuamente durante um intervalo de até 8 horas. ~ veLocidade de fluxo da amostra em um frasco despressurizado depende da diferença
integradas no tempo em longos periodos, v~lvulas especiais
s~o utilizadas para manter o fluxo constante. Dois métodos para manter a velocidade de coLeta de amostra constante foram descritos: um que depende das caracteristicas do orificio critico (47), e o outro que usa uma v~lvula de controle de f Luxo variavel (47).
11.5.2 - i=lmostra
Em uma
Seletiva
coleta de amostra seLetiva somente uma parte dos contaminantes s~o coletados, ou seja, parte que inclui os componentes que se quer medir. Certos sistemas coletam todos os componentes atmosféricos que têm alguma propriedade em comum, como condensaç~o em uma certa temperatura ou absorç~o em certas substâncias. Os sistemas de • t raps H quimicos s~o usados para absorver aqueles
componentes que possuam alguma reaç~o qulmica em comum.
O método de coleta de amostra seletiva pOSSUl
algumas vantagens, como a reduç~o dr~stica do volume retido, ia que os gases encontrad~s na atmosfera n~o s~o coletados e
o contaminante interessado concentrado, o que é
interessante para a determinaç~o analitica.
Porém, estas técnicas introduzem um nqmero de fontes de erros como: reações quimicas nos sistemas de
quantidades, interessados.
retenç~o incompleta dos contaminantes
32
11.5.2.1 - Rmostra Instantânea
Neste caso, pode se usar um frasco rigido de vidro despressurizado, com um reagente quimico ou absorvente que interage com um contaminante de interesse que deve ser analisado em Laboratório pela técnica analítica mais recomendada.
Rs amostras integradas pelo tempo de um gâs ou vapor s~o coletadas em frascos lavadores, absorvedores ou
condensaç~oj
"impinger"j por sólidos (carv~o
etclo
"trapping" de
ativo, carbosieve 8, silica
em adsorventes gel, alumina,
pela press~o do vapor do solvente e da substância que está sendo coletada. R eficiência de absorç~o é também dependente da concentraç~o do contaminante a ser analisado na mistura.
Ro invés de um soLvente em um "impinger" ou frasco
soluç~o a qual reagirá com um lavador, pode-se
contaminante de
colocar uma
interesse. R possibi Lidade de perda por
evaporaç~o é menor, pois frequentemente o produto da reaç~o
e
menos volátiL que o reagente.Çj coleta de amostra por condensaç~o envolve a
passagem de gàs atmosférico através de um "trapping" mantido a baixa temperatura, na qual substâncias orgânicas dever~o
condensar e serem retidas. Porém, a eficiência de coleta de um unico "trap" geralmente pobre e depende das propriedad,es
interessados.
34
R adsorç~o de gases em s6lido é um fenômeno hâ
mui to tempo conhecido. Durante a 1a. Gerra Mundial filtros de carv~o ativo eram utilizados como proteç~o para gases de guerra.
Existem dois processos principais pelos quais 05 gases s~o retidos em um s6lido. O primeiro é adsorç~o fisica por forças de "Van der Waals", e a
valência. Um número muito a quemiosorç~o,
grande de adsorventes por seguros
s~o
eles na qual
é preso um gâs
na qual segunda é
forças de
s6lidos s~o usados. Os tubos de adsorç~o mais utilizados s~o
os de carv~o ativo, para uma infinidade de compostos
orgânicos.
Substância
a ser determinada
a c rl'Lo ní t ri La
amlnas aromáticas
Rdsorvente
carbosleve 8
siLíca geL
Eluente
metanoL
etanol
formaLdeido
dióxido de enxofre
nitrogLicerina
aLumina
peneIra moLecuLar
tenax GC
1\ de metanol em água
etanoL
..... .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .... ....
111 -
P~RTE EXPERIHENT~L36
111.1 -
IJ.J.!!!..~~~o Potenciometrica de Neutrali~~o de umaPlguns estudos da titulaç~o potenciometrica de NaOH e carbonato com âcido cloridrico foram publicados. Rossotti-Rossotti (48) ao publicar um trabalho sobre titulações potenciometricas usando o metodo grâfico de Gran, discutiu os devios de linearidade e n~o coincidência dos dois ramos da curva de Gran
11.
Para o caso da titulação potenciometrica do NaOH com Hel a não coincidência dosramos, segundo ele, ocorria devido à impurificaç~o do NaOH. Rlmgren (49) determinou a impureza de carbonato em hidrÓxido de niquel em baterias Ni-Fe que possulam aproximadamente 80\ em hidróxido de niquel com grafite e como impureza sufato de bârio e carbonato de niquelo Com um eletrodo de membrana para dióxido de carbono, utilizando a extrapolação do metodo grafico de Gran em comparação com o metodo gravimetrico, foram feitas analises entre 3,7\ de carbonato com um desvio de 0,1\ a 1,8\ com um desvio de
publicou um carbonato
[onvington em
potenciométrica
trabalho de hidr6xido de
neutralizaç~o,
de presença na
1978 (50)
titulaç~o
de
determinaç~o
utilizando a
usando o método gráfico da primeira derivada; o estudo foi concentrações iguais de OH- e carbonato e foram feito para
encontrados t rês máximos: o 10. cor respondendo a
neutralizaç~o do o 20. cor respondendo à conversão de
concentrações menores
a H~~ [O~~
M, o "o.
Que 0,01 conversão do
30. à
e o
máximo desaparece e o 20. é independente da concentração e da constante de dissociação.
E:.m outro trabaLho, Convington, em 1981 (51) efetuou a titulação potenciométrica diferenciaL de uma mistura de NaOH e Na:;>[O:5 com H[L, usando-se eletrodo de vidro, encontrando um terceiro máximo, Que não é detectado se adicionado etanoL ( f ração molar 0,2) ou terc-butanoL (fração moLar 0,1) , ou quando a temperatura for maior Que quando o gás hidrogênio é borbuLhado através da solução; ou quando usado eletrodo de gás hidrogênio ao invés de eletrodo de vidro. Ele concluiu que havia a formação das
espécies, formados em solução peLa baixa
velocidade de reação, e esse pico também não desaparece em titulações de 0,1 mol/l de NaOH + Na2 [03 na relação de
abaixo de 10\.
Roolvinsk em 1980 (52) utilizou um método por computador para determinação de carbonato lO-3M ) e
com erro 1\. pode ser aplicado para sais de
constantes de equilibrio desconhecidas
ácido dibásicos com
38
o
metodo desenvolvido no presente trabalhoe
aanálise de di6xido de carbono, após sua absorç~o em NaOH e correspondente titulaç~o potenciometrica de neutralização com Hll utilizando-se o método gráfico de Gran 11. Mas antes de iniciarmos as análises de dióxido de carbono, resolvemos estudar melhor o sistema qulmico, carbonato e hidr6xido. Foram fei tas
uma mistura
várias titulações de NaOH
em várias contra H(l
concentrações de de concentraç~o
conhecida, tais que simulassem as concentrações obtidas com de carbono em hidróxido de s6dio; a soluç~o
também
de di6xido
titulações de NaOH isentas de carbonato
e
que simulassem o branco.
I I I . 1 . 2 - tLa_t~..!.._t~_L.!!
__
~t~'-!'~-E.-La._- frasco de polietiLeno de 80 mL - pipetas de 1,5,20,25 ml
- baLões volumétricos de 100,250,200,1000 ml - barra magnética de tefLonR
- agitador magnético
- pHmetro B 375 - micronal
- eletrodo de vidro combinado (eletr6lito K[l
3 , 0M)
- calxa de lsopor
- hidrÓxido de sódio 0,1M ( estoque) - acido cloridrico O/1M ( padronizado com
Na2CO:.~ (53))
- cloreto de s6dio SM (estoque) - carbonato de sÓdio 0,1M (estoque - cilindro de nitrogênio
R
- padrões de calibraç~o para pHmetro, de hidrogenoftalato O,OSM, pH 4,01 (25o ( ) , e de bÓrax O,01M, pH 9,18 (2So [ ) .
Foram preparadas soLuções de NaOH em torno de 10-;;", 10--4M a partir de uma soluç~o estoque aproximadamente O,1M. Uma aLiquota de 20,00 mL de cada uma dessas soLuções foi pipetada para um frasco de polietileno de aproximadamente 80 mL, contendo uma barra magnética de teflonR , a seguir adicionou-se também 5,00 ml de NaCl (S,OM)
com uma pipeta, perfazendo um voLume total de 25,00 ml. Portanto temos como concentrações finais de hidrÓxido de sódio aproximadamente O,8.10-:.l, O,8.10<~, O,8.10-4 M
40
brancos, que s~o titulados, sob uma atmosfera de nitrogênio, contra HCl de concentrações, respectivamente 0,9700.10-1 ,
0,9700.10-2 , O,9700.10-3 M.
Foram preparadas, da mesma maneira, soluções de NaOH em torno de 0,8.10-2 , 0,8.10-3 , O,8.10-4
M
a partir deuma soluç~o estoque de aproximadamente O,lM impurificadas com carbonato de s6dio.
Em um frasco de polietileno de aproximadamente 80
ml s~o pipetados 20,00 ml destas soluções juntamente com
( 5,OM ), perfazendo o volume
de sódio 5,00 ml de cloreto
total de 25,00 ml.
~s concentrações finais em NaOH s~o as mesmas que as do "branco", descritas acima, só que impurificadas com o
para l,OM em cloreto de s6dio; HCl, 0,9700.10-1 , 0,9700.10-2 ,
força iônica titulados com
concentrações da tabela 5 e ajustado a foram também O,9700.10'--3 M,
experi-ência H
[OH-)
H H
[OH-)/(CO~~-)
...
3.3 3.2 3.1 3.0
0,9700.10-3
2,110.10-6
0,80.10-4 3,840.10-6
2, " "O. 1 O-:s
3,840.10-:s
38 21
3,8 2,1
2.4 3,840.10-6- 211
2.3 2,110.10-:s 38
2.2 0,9700.10-2 0,80.10-~ 3,840.10-:s 21
2.1 2,110.10-4 3,8
2.0 3,840.10-4 2,1
1.4
1 .3
1 .2
1 . 1
0,9700.10-1
3,840.10-:s 2,110.10-4
0,80.10-2 3,840.10-4
2,110.10-3
211 38 21
3,8
..." ..
.. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. ..
Tabela 5 Experiências realizadas. Titulaçêles de
neutralizaç~o da mistura OH- + C03~- com HCL e seus
111.1.5 - Câlculos
42
adicionado a mistura•..• .. _ .• _ . •.•. _ •• __ _ .. _ . _ ..• _ _ F ' __ ' _ _ " ' _ '(amostra) .' _ " ' _ " _ ' _ ' _ " ' _ ' _ '
R concentrac;~o de NaOH do branco e de NaOH da
mistura (NaOH + Na2 (03 )
e
a mesma. Portanto na titulac;~o comH[ l , o volume da soluc;~o titulante do lado basico (V • . h • h )
do branco e da amostra (V •.h _ . ) no ponto de equivalência,
dever~o apresentar o mesmo valor, desde que haja
interferência do carbonato, como na figura 16.
Titulac;~o potenciomêtrica de neutr.alizac;~o do branco (NaOH) e da amostra (NaOH e carbonato) contra H[L.
~ concentrac;~o
IguaIs aonde:
de NaOH do branco e da amostra s~o
V•. h • • : voLume da soLuC;~o titulante do Lado
basico da amostra no ponto de equivaLência (mL)
V._h_h: voLume da soluC;~o tituLante do Lado basico
do branco no ponto de equivaLência (mL).
V., •. h: vo\ume da soLuC;~o tituLante do Lado acido do branco no ponto de equivalência (mL).
branco
o Amostra
\
O
\
O
\
O
\
O
\
O
\
O
\
O\0
\ O\
O
\
O
\
/ / / 0
/0 /0 /0
/0 /
/0
/0
/0
/
F' 9
Figura 16 - Titulaç~o potenciometrica de
Neutralizaç~o do Branco (NaOH) e da Rmostra (NaOH + C03 2 - ) com
HCl. Rs Concentrações de OH- da Rmostra e do Branco s~o iguais. R diferença entre os volumes da soluç~o titulante
do lado acido do branco e da amostra no ponto de equivalência,
v•.•.•
b _ . )e
proporcional a concentraç~o docarbonato dissolvido na mistura, (48).
segundo Rossotti-Rossotti
o
volume de soluç~o titulante doponto de equivalência
e:
- [ OH- ): concentra~~o de ion hidróxido (M) - [ [03 - 2 ) : concentraç~o de ion carbonato (M)
- [ H+ ): concentraç~o de ion hidrogênio (M) - V: voLume do tituLado tmL)
[amo se tituLou um branco e uma mistura de OH-+ temos para o branco:
V...b
=
[ OH- )b + 2 [ [ Q~·~.~_-.!.tt.L.:.
.Y-.
[ H"· )
- [ OH- Jb : concentraç~o do ion hidróxido (M) do
branco
- [ [03 - 2 )b: concentraç~o do ion carbonato (M) do
branco (como impureza da soLuç~o de NaOH)
e para a amostra:
acido da
amostra.
- [ C03 - 2 l.: concentraç~o do lon carbonato eM)
da amostra.
~ variaç~o entre o voLume da soLuç~o tituLante do amostra e do branco no ponto de equivaLência proporcionaL a concentraç~o dos lons carbonato da amostra:
- ([ OH- lti + 2 [ C03 2.- ~_~
( H+ l
considerando-se [ OH- l .. = [ OH- ]b temos
V•.•.• -
bv
_:...IIL&-fL&.. _ _= - ~ __.._._.[
H+._l 2 Vvariaç~o do voLume titulante da reta âcida da amostra e do branco no ponto de
111.1.5.2 - Calculo da Funç~o de Gran
titulante no ponto de equivalência.
II e do Volume 46
~ funç~o de Gran 11 (1), foi desenvolvida a partir da equaç~o de Nernst, que pode ser simplificada da seguinte maneira:
E = E'o + EJ +
onde:
RT log [H"'J nF
E'o
potencial normal do sistema considerado (mV) .EJ : potencial de junç~o liquida (mV).
R
constante dos gases perfeitos.T temperatura absoLuta (K).
n: número de eLétrons envolvidos no equilibrio.
F : constante de Faraday.
Se
E'o
= k, e tomarmos o Logbase deéimaL e levarmos em conta os valores numéricos de R
e F e considerando-se como padr~o à temperatura chega-se a equaç~o:
E = k +
º__
L.9_§~J_ pHn
pH = E - k
O,0581/n
No método grafico de Gran 11, é feito a correç~o
de volume. Para o lado basico temos:
Fg
=
10·p hV
Vo + V
e para o lado acido temos:
F'g
=
10-pH .v
= volume do titulante (HCl CmL) ).Vo = volume inicial titulado (mL)
Esta express~o foi por nós calculada com uma
màquina calculadora HP 11 passos que se seguem:
9 PIR
f CLEI=lR PRGM UfL I=l
25
+
25
X ~ ~ y
10"
X
9 RTN
g PIR
48
~p6s o câLcuLo da funç~o de Gran 11; para cada par
de pontos ( voLume do tituLante adicionado e pH},é traçada a "reta bàsica" e a "reta àcida" a partir dos pontos que est~o
dispostos Linearmente por observaç~o do gráfico (Fg X VoLume tituLado); ou através do càLcuLo do voLume da soLuç~o
tituLante no ponto do equivaLente a cada par de pontos (Fg X VoLume tituLado), como pode ser visto na tabeLa 6. Quando os
faciLmente notado peLa tabeLa 6, pois n~o
repetibiLidade do voLume da soLuç~o tituLante equivaLência.
pontos começam a se afastar da Linearidade, pode ser se tem mals no ponto de
càLcuLo de correLaç~o Linear
~p6s a escoLha dos Linearmente é ent~o feito o
pontos que est~o dispostos
por um programa da HP11c, e por dois partir deLe, é traçada a reta.
Volume do Titulante
(mL)
PH V••b • •
(mL) e .. 0,000 0,100 0,200 0,300 0,400 0,500 0,600 0,700 0,800 0,900 1,000 1,100 1,200 1,300 1,400 1,500 1,600 1 ,700 1,800 2,000 2,200 2,400 2,600 2,800 3,000 3,200 3,400 3,600 3,800 3,900 4,000 4,100 4,200 4,300 4,400 4,500 4,600 4,700 4,800 4,900 5,000 11,851 11,830 11,807 11,782 11,755 11,728 11,697 11,664 11,630 11,592 11,550 11,503 11,452 11,395 11,326 11,248 11 ,153 11,034 10,878 10,427 9,945 9,561 9,138 8,287 6,781 6,257 5,838 5,250 3,439 3,129 2,950 2,821 2,726 2,696 2,581 2,524 2,474 2,430 2,390 2,353 2,321 7,096 6,788 6,463 6,126 5,780 5,453 5,097 4,742 4,402 4,049 3,690 3,324 2,967 2,612 2,237 1,876 1,513 1 ,157 0,8095 0,2886 0,0958 F'g 0,0016 0,0064 0,4192 0,8589 1,305 1,757 2,195 2,648 3,086 3,530 3,975 4,444 4,856 5,306 5,730 2,30 2,24 2,20 2,16 2,15 2,13 2,11 2,10 2,10 2,09 2,08 2,07 2,06 2,06 2,05 2,04 2,04 2,04 2,09 2,08 V... (mL) 3,68 3,70 3,70 3,70 3,70 3,70 3,70 3,70 3,70 3,70 3,70 3,69 3,65 ... .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. .. ..
....
.. .. .. .. .. .. .. .. .. .. .. .. .. .. ..Tabela 6 - Calculo da funç~o de Gran lI, do volume da
soluç~o titulante do lado basico da amostra (V •.b . . . ) e do
volume da soluça~ titulante do lado acido da amostra(V ... ).
Fg = 10+1 1+p H • ~j F'g = 10+3 - p H ~
Vo Vo
[OH-) = O,80.10-2 M; [H+)= O,9700.10-1 M; [C0
3 2-)=
111.1.6 - Dados Experimentais e Discuss~o dos Resultados
50
~s tabelas 7, 8 e 8, resumem os dados das titulações feitas para as amostras e brancos, em diversas concentrações de NaOH, de carbonato e de ~cido clor1drico, e faz uma comparaç~o entre os volumes da soluç~o titulante da reta basica e da reta ~cida do branco e da amostra no ponto de equivalência.
Como podemos verificar pelas tabelas 7, 8 e 9,
gráficos 3, 4, 7, 8 e 11, as experiências 1.4 e 1.3; 2.4 e
2.3; e 3.3, o volume da soluç~o titulante do lado b~sico no ponto de equivalência da amostra e do branco s~o iguais, n~o
existindo portanto nenhuma interferência de 10ns carbonato na avaliaç~o da concentraç:~o de OH- livre. Isto se deve a relativa baixa concentraç~o de em relaç~o a concentraç~o de OH Quanto ao volume da soluç~o titulante do lado acido no ponto de equivalência, com relaç~o ao branco e
além dos
à amostra, estes s~o diferentes, ja que a amostra, 10ns hidroxila em igual concentraç~o ao do branco, também possui uma pequena concentraç~o de 10ns carbonato.
R
variaç~o do volume da soluç~o titulante do lado acido, em
relaç~o ao branco e ~ amostra, muito pequena como
de detecç~o,
hidróxido e
mantendo-se as carbonato ,tabelas
relações
7, 8
de concentrações de e 9. Percebe-se pelos valores encontrados, que qualquer de5vio em relaç~o a média, também fornece um coeficiente de variaç~o muito grande.
Nas experiências 1.1; 2.0 e 2.1; 3.0 e 3.'1, tabela realações de hidrÓxido e carbonato s~o 3,8; 2,' e
'lO, cUjas
3,8; 2,1 respectivamente, o volume da de
ficar mais claro, construiu-se a tabela 10 que titulante no
branco. Para
ponto de equivalencia n~o coincide com o do
resume estas observações.
Como se percebe pela tabela 10, a diferença entre os voLumes da soluç~o titulante no ponto equivalente da reta bàsica, do branco e da amostra ( V•.b • b - • • ) , é maior com a
diminuiç~o da concentraçilo de hidróxido de O,8.10-~M para
0,8.10-:3M e, finalmente,para O,8.10-4 M,
tabela 10.
EXPERIENCUl 1.4 [CO:»-2] v... s (to (.L) 2,01 3,640.10-" 0,02
V...b • b
5
l.L)
2,02 0,02
.. V...b ...
s (.L) 0,01 0,03 v... 5 (.L) 2,03 0,01 v... s l.L) 2,02 0,01
.. V... _II
experill. s l.L> 0,01 0,01 .v ... c.lc. l.L) 0,02 , erro - 50 1 .3 1.2
1 . 1
2,110.10-"
3,640.10-"
2, 110 . 10- '" 2,33 0,01 2,40 0,01 2,03 0,01 2,33 O, 01 2,39 O,01 1,99 0,01 0,01 0,01 0,04 0,01 2,43 O,01 2,65 0,01 2,93 0,01 2,33 0,02 2,64 0,01 1,97 0,02 0,10 0,02 0,21 0,01 0,96 0,02 0,11 0,20 1,09 9,0 5,0 • 12 Tabela 7 amostra solul;lIo de NaCl ... ... ..
Comparaçllo dos volulles equivalentes da "reta bAsic." e d. "reta Acida" do branco e da
para uma mistura de 20,00 mL de NaOH (0,8.10-2 ) e carbonato, em vArias concentraç8es e uma
de 20,00 mL de NaOH (0,8.10-2 ) titulada com HCl (0,9700.10-'). Rjuste de força iônica com 5,0 mL
S,OM (concentraçllo na soluçlo final 1.JH).
Para cada experiência foram realizados 6 amostras e 6 brancos, os valores tabelados slo a
média aritmética desses 6 valores e o desvio padrlo da média (s).
... 2.4 3,84.10-" 1,91 O, 01 1,87 0,02 0,04 0,02 2,28 0,03 2,27 0,01 0,01 0,03
0,02 - 50
. . . o . . . .
2.3 2,11.10-0
1,94 0,03 1,95 0,01 0,01 0,03 2,38 0,01 2,30 0,01 0,08 0,01
O, 11 - 27
...
2.2 3,84.10-0
1,96 0,01 1,95 0,01 0,01 0,01 2,47 0,02 2,30 0,01 0,17 0,02
0,20 - 15
2. 1 2,11.10-"
2,00 0,01 1,89 0,01 O,11 0,01 3,18 0,01 2,21 0,04 0,97 0,04
1,09 - 11
2.0 3,84.10-" 2,37 0,03 2,26 0,02 O, 11 0,04 4,52 0,04 2,66 0,04 1,86 0,06
'1,98 - 6
: : : :: : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : :: : : : : : : : : : : : : : : : : : : : : : : : : : : : : : : :
'reta àcida' do branco e da
vàrias concentraç3es e uma
de força iônica COIn 5 mL de
Tabela 8
a",ostra solur;::lo NaC l 5/1
Comparaç:lo dos volumes equivalentes da 'reta bàsica' e da
para uma mistura de 20,00 mL de NaOH (0,8.10-3 ) e carbonato, em
de 20,00 mL de NaOH (0,8.10-3 ) titulada com HCl (O,9700.10-"l. ~iu~te
(concentraç:lo na soluç:lo final 1.0/'11.
Para cada experiência foram realizadas 6 amostras e 6 brancos, os valores tebelados s:lo a
media aritmetica desses 6 valores e o desvia padr:lo da media (s).
EXPERIENCIR 3.3 [CO,,-:lJ v... s (M) (mL) 1,19 2,110.10-· 0,03
V•.b .. _
S
( IILl
1,25
0,04
.. V...b . . . . .tio
s (IIL) 0,06 0,05 v... s (IILl 2,07 0,07 v...b s (mL) 2,14 0,01
. V b
expe rim. s (mL)
0,07
0,07
.. V b
cólIlc. (mLl 0,11 " erra - 36 3.2 3.1 3.0 3,840.10-" 2,110.10-:5 3,840.10-" 1,23 0,07 1,60 0,03 1,88 0,06 1,25 0,02 1,33 0,06 1,33 0,06 0,27 0,04 0,55 0,08 2,10 0,01 2,95 0,03 3,66 0,05 1,88 0,07 2,15 0,02 2,15 0,02 0,22 0,07 0,80 0,04 1,51 0,05 0,20 1,09 1,98 + 10 - 27 - 24 Tabela 9 amostra soluç:lo de NaCl ...
. . . .. o ..
Comparaç:lo dos volumes equivalentes da "reta b~sica" e da "reta ~cida" do branco e da
para uma mistura de 20,00 mL de NaOH (0,8.10-4 ) e carbonato, em v~rias concentraçees e uma
de 20,00 mL de NaOH (0,8.10-4 ) titulada com H[l (0,9700.10-3 ) . ~iuste de força iônica com 5,0 mL
S,OM (concentraç:lo na soluç:lo final 1.0M).
Para cada experiência foram realizadas 6 amostras e 6 brancas, as valores tabelados s:lo a
lIédia aritmética desses 6 valores e o desvia padr:lo da média (s).
0,0 e,o o· ·.m~tr.1.1 obranco 8,0 7,0 !l,0 4,0 3,0 2,0 o o 000
0 0 ° 0 0 . . . .
0 0 0 0 0 0 0 0 0 0 . . . . • .' o• •
1,0 o F'O 1000 900 800 700 600 500 400 '300 200 100 10,OVlmU 9,0 7,0 8,0 6,0 0,0
"'0
o o . 3,0 o o 2.0 1,0 o o FgI
100 I loor 100 i 10011001~ ~o
o. o
, , o
. o o •. o ' 0 · 0 . o ' 0 '0 '9
.
.
"o', o
100-Graf ICO 1 Experiência 1.1 [OH-]
=
O,B.1ü-~M; [H+]=
O, 9 7 OO. 1 O" ~ Mi [ l O:5~! - ] = 2I 1 1 O. 1 O".5M.
Branco [OH-]
=
O,8.10-~Mi [H+]=
Ü,9700.10-~M.Rjuste da força i6nica a
iJOM
de Na[l na solução finaL.~
....
~....YCJ..
i=
F I 9=
1 O'P 11 - ipH
12,0
...
11,0
10,0
9,0
I
8,01
I
I
7,0,
6,0'
I
!l,O'I 4,0,
1
3,01
2,0
1,0
I
°
Fg·600
•
...
•
.branco .amostral.2
•
F'g
600
~OO o
I
o
400
o
•
o
300 o
200
!l00
400
300
200
100
o 1,0
•
2,0
o
o •
3,0 4,0 V(mU
100
o
Gràfico 2 Experiência 1.2 [OH-]
=
O,8.10-~M; [H+]=
O,9700.10-1 M; [[03 2 - ) = 3,840.10-4 M.
Branco [OH-)
=
O,8.10-2 M; lH+)=
O/9700.10-1 M.~juste da força iônica a 1 , 0M de NaCl na soLução final.
Fg
=
10PH+ 8 '!_'~-Y_'2....; = F' 9 = 10 ..'p H - ; "
o 10.0
g,O
8,0 obranco
. amost ra1.3 7,0 6,01 i o 1,0 800 100 eoo F'O gOO 800 700 800 500 400 300 200 100
8,0 9,0 10,0 V(mLI
1,0 e,o 5,0
•
ó 4,0 ••
Q • 9 o o .5,0 o o' o Q o' Q Do O· 2P .0 • o ' 0 ' 0 1,0 o 100 o FO 900 o.
11 00 . ·0
. o . o o o o • o . o • o • o
• • 0
. 0
Gràfico 3 - Experiência 1.3 (OH-) = OI8.10-~M; (H+)
=
O,9700.10-~M; (C03~-) = 21110.10-4 M.
Branco (OH-)
=
OI8.10-2 M; (H+)=
O,9700.10-1M.~juste da força iônica a 110M de NaCl na soluç~o
final.
Fg = 1ÜPH+8 ~_~~g_;
=
FI g = 10-p H - :258 pH 10,0 •••••••• •••••• 00 O O ·amostra1.4 obranco tO 8,0 7,0. 6,0, , 5,01 3,0\ 2,01
I,O!
01
I
'0 rtooj
800 b 6 00..
...
....
...
o o o o F'O tOO 800700 o 700
200 400 500 300 600 10,OV(.lI 9,0 8,0 7,0 6,0 o o o
•
• ~ o q q•
•
o oo
•
• q
o
•
•
ó ~1,0 2,0 3,0 4,0 5,0
o
I
400j
200
1
lool...
.
~
100o
&00 . 0
• o ' 0 ' 0 . o ' 0 '0 500 300j
Grâfico 4 - Experiência 1.4 (OH-)
=
O,B.l0-2M; (H+)=
O,9700.10-1 M; (C03~-]
=
3,840.10-5 M.Branco lOH-)
=
O,8.10-~M; [H+)=
O,9700.10-~M.Rjuste da força iônica a 1,OM de Na[L na soLuç~o
finaL.
~_ ...!....Y_<,!..;
=
FI 9=
1 O...p H -~,Vo
V t~.!~
..
,
....
"
....
,
....
""'i
,';..
..
,
•
.-.""
....
--,,,,,
"
....
" ' : : ! """"'"
..
.
"
••
••
••
• 0 "
•• ••
••
••
••
••
"
"
••
••••
••
••
•
•
•
•
•
."
.,
""
..".
•
•
.
..
.
"
...
••
• •L_-,'--"'··~~"~-~'--"~-';Õ--".-.,,--",-"I
j LO U &0 ~ •• '0 M ... .~ '~'M_'
fi,"' " . 5 bO.'ióo, . . 1 . 0 , IOH-) • ~.8 lU-'H; '~'J
O.91"O.'O->~, [CO,'-I ""a<0.10 _M.
bo.n.~'" 2.1 101<-)' Ú.8,'O
'M,
1~'J0.9700.10 -~; ICU,'-] • ~,1)O.10 ."
S . .
n," ,
l0" ) • 0.ê,10 'M, IH"] • 0.9700.10 "M,~j".,"
d. '0'<'
,ao,c..
1,OM.'No"' ". '.'",10
f
,".l
,_._~; • "O • lO -" ,
...
"I
"o
",
•
,,-o
,-•
•
..
".
o o
,
"
.
-••
••
••
o.
..
...
o.
••••
. . o
0.0
"O
o
••
O,
..
..
o.
6,>1;,.6 . <'o.'i~n". l 2 , IOH , , O,~,10··", IH']
O.~!OO_'O-·", IlO,--J • :l,MO.'O-·"
~'.nco 10H J . o,e,10 'H, Iwl • ".~'OO,10 "N.
Oju." ao
,,,
..
,
"'<0
'&"'0' •
l,OH.' H.(' n. '.'u,Jo
,
"-.~~, • ~' • • 10-," ,
pH
10,0
9,0
8,0
7.0. I
4,0
3,0
2,0
1,0
o
Fg
600 00 • • • • •
···.0 ...
••
oamos! ra2.3
. branco
P ?o.. P.
0 · 0
. . o. o· o . o . o'0'00o o o000 00
F'g
1200
o
500~ o
I
, ' 0
•
lo
I· •
400
•
.
'.
3001
?
I
I
~ •..
200 1
• .
.
q
! ~
I ,o
I
1001 •
I
L
•O 1,0 2,0 3,0 4P tI,O 61J 1,0 8,0
1000
800
600
400
200
9pV(mL)
Graf ico 7 Experiência 2,3 [OH-)
=
O,8.10-3 M; lH+)=
O,S700.1ü-~M; [C03~-) = 3,840.10-~M,
Branco lOH-) = O,8.'10-3M; lH"]
=
O,9/OO.10~!M,~juste da força iônica a 1 , 0M de NaLl na soluç~o fInaL,
10"H·'"
\J__
.~_._\"Ip;
= F- J 9 = 1 O·'P H " 2V
u•
.
...
~'u
...
..
.._
....
..
. 0-....
..
..
o".
..
-._-
..
-u
•
o .
,
o ...
..
00
•
o
O. O
-o
O o O .
o
o o
O
,,
O. .•
..
Oo
,
..
,
,
O O. .O.
•
'.
oo
..
•
O. .O
•
o
•
"
..
..
.. .. ..
O, U..
- " ,...
,
6.Ulco e · (op . .
;t"'i.
l . ' , 10fl-] • 0 ••.• 0·· .. , 11") •0."00.'0-· .. , '(0,'-1 • :1.&40 .• 0-· ...
I t u c . , IOH-] .0.11.10"'" " " ) • 0.'700 .•• ··".
AIU"
dO . . . 'Ini<. ,
'.0" . . . . .
0
u
",u,a.
',n.'.
..
'I •
.0····
~, • f'O •. branco
10,0
9,0
~
...
'0O:::',•O °
° 8,0 7,0 6,0 5,0 4,0
o o o
~
, I I I •• , ••••' . ' •••, '
3,0 2,0 1,0 o Fg Fb 500 500 400 400 300.
'.
I • ~a e•• ,0 •'.0 _ .
200 , \ ...
',°0 ~
'o°'b ",
, °'. °0 •
'.\
.
100 ' o •". o e. O, ° o o o o o o • o •
•
o • •••
•
oo ° •
•
° •
°
o •
o •
o o • •
10,0 V(mL) 100 300 200 9,0 00 0 0 000° 0 ° 0
o·tI'
..
.
..
••'
..
.
.
..
' 8,0 7,0 6,0 5,0 '1,0 o o"
:.
...
3,0
2,0
1,0
o
Gràf ico 9 Experiência 3.0 [OH-]
=
O,8.10-4 M; [H+)=
O,9700.10-3Mj [(0
3 2 - ] = 3/840.10-~M.
Experiência 3.1 [OH-)
=
O,8.10-4 M; (H+]=
O,9700.10-3 M; [C0
3 2 - ] = 2,110.10-5 M.
Branco [OH-] = O,8.10-4 M; [H+) = O,9700.10-3 M.
~juste da força Iônica a 1,OM de NaCl na soluç~o
final.
Fg = 10·>I~~7 ~_.o_~ __.~or.L; = FI9 = 10-"ti-~,
64
pH
10,0
·branco ·amoatra3,2
8,0
7,0
6.0
!l,O
I
4,0 ~
..
.
.
....
.
.
.
..
.
.
.
.
..
...
...
3,0
2,0
Ip
o
Fg F'V
1100 600
400
" 00
300
• • •
.
..
..
..
....
300
•
100
10,0 V( ..u 200
gp
8,0 7,0
•
•
6,0
•
•
5,0
•
• •
•
4,0
3,0 2,0
1,0
'.
'~'\
"0
L:
~o_4_6
_ _/)_6_. _o
100 200
Grâfico 10 -Experiência 3.2 [OH-)
=
0,8.10-~M; [H+]0,9700.10-~M; [C03~-] = 3,B40.10-6M.
Br a n c o [OH --]
=
OI 8 . -, O--- '. Mj [ H .)=
OI 9 7 OO . 1 0--;sM .~juste da força lonIca a 1 ,0M de NaCL na soLução
finaL.
Fg