Eduardo Carlos da Silveira Mendes Júnior
ANÁLISE HISTOLÓGICA E MORFOMÉTRICA DE
ÁREA CRUENTA TRATADA COM MEMBRANA
DE SILICONE. ESTUDO EM RATOS.
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Bases Gerais da Cirurgia – Área: Reparação, Regeneração e Transplante de tecidos e de Órgãos da Faculdade de Medicina de Botucatu - Universidade Estadual Paulista “Julio Mesquita Filho”, UNESP.
Orientador: Prof. Dr. Fausto Viterbo
FICHA CATALOGRÁFICA ELABORADA PELA SEÇÃO TÉCNICA DE AQUISIÇÃO E TRATAMENTO DA INFORMAÇÃO
DIVISÃO TÉCNICA DE BIBLIOTECA E DOCUMENTAÇÃO - CAMPUS DE BOTUCATU - UNESP BIBLIOTECÁRIA RESPONSÁVEL: SELMA MARIA DE JESUS
Mendes Junior, Eduardo Carlos da Silveira.
Análise histológica e morfométrica de área cruenta tratada com membrana de silicone. Estudo em ratos = Histolologic and morphometric analysis of the would healing after treatment with silicone membrane. Study in rats. / Eduardo Carlos da Silveira Mendes Junior. – Botucatu, 2005.
Dissertação (mestrado) – Universidade Estadual Paulista, Faculdade de Medicina de Botucatu, 2005.
Orientador: Fausto Viterbo Assunto CAPES: 40101029
1. Queimaduras - Tratamento - Estudos experimentais 2. Silicones em cirurgia – Estudos experimentais
CDD 617.11 CDD 611.018
DEDICATÓRIAS
Ao mestre e amigo Dr. Celso Charuri, retaguarda sólida e eterna,
À minha esposa, Silvia, ao seu amor e apoio incondicional,
AGRADECIMENTO ESPECIAL
Ao Prof. Dr. Fausto Viterbo, que ao abraçar a missão de
ensinar, não se limitou a compartilhar seus conhecimentos,
preocupando sempre em transmitir sua experiência e apoio nas
dificuldades. Nas suas preleções incluíram compreensão,
amizade e a esperança de que um dia eu seria capaz.
AGRADECIMENTOS
Em face às dificuldades que tive ao elaborar este trabalho
científico ficou difícil privilegiar qual a parte mais importante. Nesta jornada,
tive o prazer de confirmar que tudo é essencial e necessário para a
realização deste sonho. Portanto, a todos os que fizeram parte deste
processo, recebam minhas homenagens e os meus sinceros
agradecimentos.
Entretanto, cumpre-me destacar particulares agradecimentos
ao Departamento de Cirurgia e Ortopedia da FMB-UNESP, pela
acolhida como mestrando;
à secretária Simone Barroso Corrino Camargo, da Pós-graduação
de Bases Gerais da Cirurgia, pela atenção e prontidão;
à funcionária Regina Célia Spadim, da Seção de Pós-graduação
da FMB-UNESP, pela gentileza a mim dispensada enquanto aluno de
Departamento de Cirurgia e Ortopedia da FMB-UNESP, pela gentileza e
atenção;
ao Laboratório de Técnica Cirúrgica e Cirúrgica e Ortopedia
Experimental da FMB-UNESP, onde foram realizadas as cirurgias dos
animais;
à funcionária Irene Spagno, do Laboratório de Técnica Cirúrgica e
Cirurgia e Ortopedia Experimental da FMB-UNESP, pelo esmero na prática
com os animais durante a fase experimental;
à Faculdade de Medicina de Catanduva (FAMECA), mais
precisamente à Disciplina de Patologia, onde foram realizados os estudos
histológicos e morfométricos;
à Profª. Drª. Celina Santaella Rosa, responsável pelas Disciplinas
de Patologia Geral e de Anatomia Patológica da FAMECA, pela constância,
entusiasmo e competência nos estudos histológicos e morfométricos;
ao Prof. Ms. Alexandre Teso, responsável pela Disciplina de
Bioestatística da FAMECA, pela análise estatística dos dados coletados;
ao Prof. Dr. Silvio Antônio Coelho, professor da Disciplina de
Clínica Cirúrgica II da FAMECA, pelo incentivo e colaboração no
desenvolvimento dos trabalhos;
ao professor Sidnei Stuchi, secretário geral da FAMECA, pela
Histo-Patologia da FAMECA, pela dedicação e preparo do material para
estudo histológico;
ao funcionário Juliano Lázaro Villa, técnico responsável pelo Setor
de Vídeo-Documentação da FAMECA, pela atenção, dedicação e prontidão
na documentação do trabalho científico realizado;
às funcionárias Solange Dotti Rossi e Cristiane Stuchi Maria, da
Biblioteca “Cheddi Gattaz” da FAMECA, pela dedicação e apuro na pesquisa
bibliográfica e pela revisão e correção das referências bibliográficas; e
à funcionária Fátima Aparecida Ferreira, pela atenção e dedicação
no preenchimento e encaminhamento de toda documentação no período do
RESUMO
Objetivo: o estudo avaliou o efeito da membrana de silicone no tratamento
de área cruenta de ferimento. Método: O estudo experimental foi realizado
com 30 ratos Wistar, machos, divididos igualmente em três grupos: no grupo
GG a área cruenta foi tratada com gazes, no grupo GH com homoenxerto e
no grupo GS com membrana de silicone. Após quatorze dias de
pós-operatório, os animais foram sacrificados. Os atributos estudados foram a
variação da massa corporal dos animais; o estudo histológico quantificado
por análise morfométrica avaliando o número de neovasos, fibroblastos,
fibras colágenas, leucócitos, monócitos; e a medida da espessura da área
cruenta através de régua micrométrica. Os dados foram submetidos à
análise estatística. Resultados: Não houve diferença significativa entre as
massas dos animais. Observou-se um predomínio de neovasos, fibroblastos
e a espessura de área cruenta nos animais do grupo GS. Houve predomínio
de leucócitos e monócitos nos animais do grupo GH. Também foi observado
que não houve diferença significativa entre os grupos quanto às fibras
colágenas. Conclusão: A membrana de silicone proporcionou tecido de
granulação com maior número de neovasos, fibroblastos e maior espessura.
Palavras chave: ratos, área cruenta, queimaduras, curativo oclusivo,
ABSTRACT
The purpose of this study was to evaluate effects of the silicone membrane
on treatment of wound healing base. Methods: The experimental study was
with thirty Wistar male rats equally divided into three groups. Group GG the
would healing base was treatment with rayon gauz, group GH with homograft
and group GS with silicone membrane. The animals were sacrificed 14
postoperative day. This study evaluated weigh of rats; histological and
morphometric analysis of the number of neovessels, fibroblasts, collagen
fibers, leucocytes and monocytes; and measurement of wound healing base
thickness was done with micrometer straight edge . The data were submitted
to statistical analysis. Results: The weight of rats was similar among groups.
The analysis showed considerable increased number of neovessels,
fibroblasts and the measurement of would healing base thickness on the
group GS; considerable increased number of leucocytes and height
increased number of monocytes on the group GH. Similar pattern was
observed in number of collagen fibers among three groups. Conclusion: The
silicone membrane supportered wound healing base with considerable
increased number of neovessels, fibroblasts and enlarging measurement of
thickness. Key words: rats, wound healing, burns, closure dressing, silicone
LISTA DE ABREVIATURAS E SÍMBOLOS
ºC = graus Celsius cm = centímetros Com. = Comércio
EUA = Estados Unidos da América FDA = “Food and Drugs Administration” FMB = Faculdade de Medicina de Botucatu FAMECA = Faculdade de Medicina de Catanduva FPA = Fundação “ Padre Albino”
g = gramas h = horas
HE = Hematoxilina-Eosina Ind. = Indústria
Ltda. = Limitada
µm = micrômetro min = minutos mm = milímetros
MS = membro superior % = porcentagem MI = massa inicial MF = massa final
(MF – MI) = diferença entre a massa final e a massa inicial PO = pós-operatório
Q = quartil Quim. = Química
S.A. = Sociedade Anônima SUS = Sistema Único de Saúde UNESP = Universidade Estadual Paulista
SUMÁRIO
1 INTRODUÇÃO ...1
1.1 A Pele Humana ...4
1.2 Reparação dos Tecidos ...9
1.3 Reparação das Feridas Extensas ...12
1.4 Curativos...14
1.5 Biomateriais ...16
2 OBJETIVO ...24
3 MÉTODO ...25
3.1 Animais Utilizados...25
3.2 Grupos Experimentais...26
3.3 Técnica Cirúrgica ...26
3.3.1 Grupo Gazes (GG) ...28
3.3.2 Grupo Homoenxerto (GH) ...30
3.3.3 Grupo Membrana de Silicone (GS) ...31
3.4 Cuidados do Pós-Operatório...32
3.5 Sacrifício dos Animais... ..33
3.6 Preparo dos Tecidos para Estudo...34
3.7 Atributos Estudados ...38
3.7.1 Massa dos animais...38
3.7.2 Avaliação Histológica e Morfométrica...38
3.7.3 Medida da espessura de Área Cruenta ...46
3.8 Métodos Estatísticos ...48
4 RESULTADOS ...49
4.1 Massa dos Animais ...49
4.2 Análise Histológica e Morfométrica dos Neovasos ...54
4.3 Análise Histológica e Morfométrica dos Fibroblastos...57
4.4 Análise Histológica e Morfométrica das Fibras Colágenas ...60
4.7 Medida da Espessura das Áreas Cruentas...69
5 DISCUSSÃO ...72
5.1 Método ...72
5.1.1 Amostra ...72
5.1.2 Procedimentos Cirúrgicos e Curativos ...74
5.1.3 Definição do Momento Experimental...79
5.1.4 Métodos Quantitativos...81
5.2 Massa dos Animais ...86
5.3 Avaliação Histotológica e Morfométrica das Áreas Cruentas ...88
5.4 Avaliação da Medida da Espessura de Área Cruenta ...101
5.5 Possibilidades Futuras ...102
6 CONCLUSÕES ...105
7 REFERÊNCIAS BIBLIOGRÁFICAS ...106
1 INTRODUÇÃO
Quando há ferimentos graves e extensos, sejam eles provocados
por queimaduras, abrasões da pele, avulsões de tecidos, úlceras ou perdas
pós-necróticas de tecidos cutâneos, defronta-se com a necessidade de
instituir-se tratamento adequado até que se produza a cicatrização das
lesões mais superficiais e a formação de tecido de granulação das áreas
mais profundas (Hilário et al., 1988).
Estima-se que em torno de um milhão de pessoas sofram algum
grau de queimaduras no Brasil a cada ano, sendo que 100.000 pacientes
procuram atendimento hospitalar e, destes, cerca de 2.500 morrem por razão
direta ou indireta de suas lesões. Deste universo, 75% dos acidentes
acontecem em ambiente domiciliar, sendo o líquido superaquecido e os
líquidos combustíveis os principais agentes. Destaca-se o álcool como a
causa mais freqüente de acidentes em nosso país, estatística única mundial,
responsável por quase 20% de todas as queimaduras, por ser barato, de fácil
acesso e sem restrição de compra (Lopes et al. 2004).
As queimaduras são feridas traumáticas, na maioria das vezes,
causadas por agentes térmicos, químicos, elétricos ou radioativos. Atuam
nos tecidos de revestimento do corpo humano, determinando destruição
parcial ou total da pele e seus anexos, podendo atingir camadas mais
Dependendo da gravidade do trauma, a ferida apresentará grande área de
tecido desvitalizado, que será rapidamente colonizada por bactérias e levará
algum tempo para cicatrizar, ou, em casos mais graves, necessitará de
enxertia de pele. A manifestação clínica de uma lesão térmica vai variar
desde uma bolha (flictema), até formas mais graves, capazes de
desencadear respostas sistêmicas proporcionais à extensão e profundidade
destas lesões (Figura 1).
Figura 1: Paciente queimado, decorrente de líquido aquecido,
apresentando queimaduras de 2º e 3º graus em 80% da
área corpórea, durante curativo na fase aguda.
O principal objetivo do tratamento da injúria térmica é a
restauração dos tecidos lesados, seja por cicatrização em segunda intenção
ou por auto-enxertia. Infelizmente estes dois processos não ocorrem com a
atenção e empenho para que o sucesso terapêutico seja alcançado (Serra et
al., 2004).
É do conhecimento dos profissionais da área de saúde, que
trabalham em Unidades de Tratamento de Queimados (UTQ), que a
cobertura cutânea dos pacientes com grande área corpórea comprometida
com queimaduras de segundo grau profunda e/ou do terceiro grau é
certamente a maior dificuldade. Observa-se que a retirada do tecido
desvitalizado, deixando extensa área cruenta exposta que, por si só, já é um
excelente meio de cultura, exacerba uma série de alterações fisiológicas e
propicia a infecção. O fechamento destas áreas é, portanto, uma condição
primordial na recuperação destes pacientes e, quanto mais precoce a sua
realização, maior a chance de sobrevida do paciente (Tang et al., 1999).
Vários fatores influenciam na escolha do material a ser utilizado
para reparação destas áreas cruentas, mas o principal em nosso país
continua sendo o custo-benefício. Estudos com culturas de células epiteliais
autólogas, homólogas, substitutos de pele resultantes da bioengenharia e
membranas biológicas e sintéticas podem trazer resultados satisfatórios,
porém, de custo extremamente elevado para a realidade atual do nosso país.
As pesquisas no campo da bioengenharia tecidual e cultivo de
células, em busca de materiais que ofereçam substitutos definitivos com
segurança e rapidez, continuam muito estimulantes. À medida que são
obtidos resultados clínicos satisfatórios, a preocupação com os resultados
Esta é, sem sombra de dúvida, a tendência universal em nossos
dias, que visa não somente a recuperação funcional mais precoce, como
também melhor resultado estético (Barret, 2001).
1.1
A PELE HUMANA
A pele humana é a cobertura externa do corpo e equivale a mais
de 15% do peso corporal; é flexível, elástica e rígida em algumas regiões
(Sampaio & Rivitti, 2001). Faz a proteção contra lesões físicas, químicas e
biológicas. Impede a evaporação de água, serve como receptora para as
sensações (dor, pressão, temperatura e tato), protege contra radiação
ultravioleta, funciona na regulação térmica e na excreção de substâncias
através das glândulas sudoríparas (Ross et al., 1993; Sampaio & Rivitti,
2001).
O uso da pele humana in vivo para tratamento de extensa perda
do revestimento cutâneo é difícil em todo o mundo. Especialmente no Brasil,
a falta de banco de pele e de maior incentivo às pesquisas, somada à
dificuldade de aquisição de materiais sintéticos estrangeiros em decorrência
do seu alto custo, estimulou a busca de meios alternativos para reposição de
grandes áreas teciduais (Cabral et al., 1987).
A pele é constituída por duas camadas principais, a epiderme,
tem a função de manter a resistência, a elasticidade e a durabilidade do
tecido (Wainwright, 1995). Abaixo da derme, encontra-se a hipoderme ou
tecido subcutâneo, uma camada de tecido conjuntivo mais frouxo que
contém quantidade variável de tecido adiposo (Ross et al., 1993) (Figura 2).
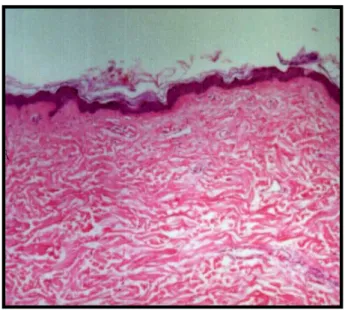
Figura 2: Foto mostrando corte histológico da pele humana,
enfocando a epiderme queratinizada e a derme (HE
40X).
A epiderme tem espessura que varia desde 0,06 milímetros (mm),
nas pálpebras até 1,0 mm, na região palmo-plantar. É constituída de epitélio
pavimentoso estratificado, formado por cinco camadas, o estrato basal, o
espinhoso, o granuloso, o lúcido e o córneo. O estrato lúcido encontra-se
Há quatro tipos de células na epiderme, queratinócitos,
melanócitos, células de Langerhans e de Merkel (Ross et al., 1993).
Os queratinócitos são os mais numerosos e sintetizam a barreira
impermeável à água, que evita a perda líquida pelo organismo. Melaninas
são pigmentos produzidos pelos melanócitos, que se localizam no estrato
basal e têm relação com a pigmentação do tegumento (Ross et al., 1993).
As células de Langerhans são produzidas na medula óssea
(Murphy, 1997) e estão localizadas no estrato espinhoso, sendo
responsáveis pela resposta imunológica, constituindo o sistema fagocitário
mononuclear (Ross et al., 1993).
As células de Meckel são células epidérmicas modificadas do
estrato basal; contém numerosos grânulos ricos em catecolaminas e estão
em contato com as terminações nervosas (Ross et al., 1993).
Para que a pele resista à constante tensão a que é submetida, a
matriz dérmica é formada por uma sofisticada arquitetura, composta pelo
complexo de membrana basal na junção dermo-epidérmica, colágeno,
elastina, proteoglicanos e um plexo vascular diferenciado (Livesey et al.,
1995).
O colágeno e a elastina conferem flexibilidade (Reichley, 1995),
enquanto que, nos proteoglicanos, encontram-se os fatores de crescimento
envolvidos na formação do colágeno, da angiogênese e da regulação das
funções celulares (Livesey et al., 1995).
Histologicamente, a derme é dividida em duas camadas, a papilar,
epiderme, contendo prolongamentos nervosos e vasos sangüíneos que
irrigam a epiderme, mas não penetram nela, e a reticular, mais profunda e
espessa, constituída por tecido conjuntivo denso. Esta contém fibras
colágenas mais espessas e menor quantidade de células que a camada
papilar (Ross et al., 1993).
As proteínas do colágeno formam fibras resistentes, inelásticas e
flexíveis que conferem resistência às forças de tensão (Gartner & Hiatt,
1999b).
A ligação entre os glicoaminoglicanos e as proteínas forma os
proteoglicanos, macromoléculas de alto peso molecular que, por ocuparem
grandes volumes, resistem à compressão e retardam o movimento rápido de
microorganismos e substâncias, células exógenas ou endógenas (Murphy,
1997; Gartner & Hiatt, 1999a).
As glândulas sudoríparas écrinas, sebáceas e os folículos pilosos
são projeções descendentes da epiderme. As glândulas sudoríparas e os
folículos pilosos estendem-se da epiderme e vão para a hipoderme,
enquanto as glândulas sebáceas desembocam no terço superior do folículo
piloso, na derme (Ross et al., 1993).
As fibras nervosas eferentes autonômicas, derivadas do sistema
nervoso simpático, inervam os vasos sangüíneos, as glândulas sudoríparas
écrinas e apócrinas e os músculos lisos associados a estas glândulas e aos
folículos pilosos. As glândulas sebáceas não possuem inervação
autonômica, sendo sua função dependente de estímulos endócrinos
Existem também as terminações nervosas encapsuladas como os
corpúsculos de Vater-Pacini (pressorreceptores) na derme e hipoderme, os
de Meissner (tatorreceptores) na derme papilar e os de Ruffini na derme
(Ross et al., 1993; Murphy, 1997).
Apesar de serem estruturalmente dois sistemas distintos, o
sistema vascular sangüíneo e o linfático estão funcionalmente
interconectados, agindo simultaneamente para assegurar o balanço líquido e
protéico nos tecidos, a nutrição celular e as funções imunológicas. O sistema
linfático atua de forma a complementar o sistema vascular sangüíneo (Skobe
& Detmar, 2000).
A unidade microvascular dérmica é responsável, não só pela
nutrição cutânea, como também pelo tráfego de células do sistema
imunológico, pela regulação do tônus vascular e pela homeostase local. As
arteríolas e vênulas dérmicas formam dois importantes plexos: o superficial,
entre a derme papilar e a reticular, que se estende como um manto
envolvendo os anexos dermo-epidérmicos, e o plexo vascular profundo,
entre a derme reticular e a hipoderme, composto por vasos de maior calibre
(Murphy, 1997).
O sistema linfático também está dividido em dois plexos: o
superficial, que se estende até a derme papilar, formado por canais sem
válvulas, e o profundo, formado por canais valvulados. Os vasos linfáticos
restringem-se à região dérmica, não sendo encontrados no tecido adiposo
As fibras reticulares são consideradas como um tipo de
pré-colágeno, sendo abundantes nos processos onde há formação de tecido
conjuntivo, como na cicatrização de feridas (Sampaio & Rivitti, 2001).
As fibras elásticas são constituídas por elastina e responsáveis
pelo retorno da pele à posição normal após extensão (Sampaio & Rivitti,
2001), podendo ser estiradas até cerca de 150% de seu comprimento em
repouso, antes de romperem-se. São formadas pelos fibroblastos e pelas
fibras musculares lisas dos vasos sangüíneos, apresentando-se como fibras
delgadas, longas e ramificadas no tecido conjuntivo (Gartner & Riatt, 1999b).
1.2
REPARAÇÃO DOS TECIDOS
A ferida é a perda de solução de continuidade do tecido. A
cicatrização é o recurso que o organismo utiliza para manter sua integridade
(Modolin & Bevilacqua, 1985).
O objetivo do tratamento de lesões cutâneas é o fechamento
rápido dos ferimentos, obtendo assim uma cicatriz funcional e esteticamente
tolerável (Tonnesen et al., 2000).
Têm-se várias formas de feridas cutâneas. A mais comum é a
ferida incisional, que representa a situação onde há pouca ou nenhuma
perda de substância tecidual e o suprimento sangüíneo está preservado. A
grande proporção, podendo ocorrer perda tecidual secundária às forças
físicas aplicadas contra a pele, sem contudo, haver insuficiência no
suprimento vascular do local. E, finalmente, a ferida abrasiva que é
fisiologicamente mais complicada, porque compromete uma área tecidual
substancial, sem que a pele seja perdida, mas o suprimento vascular pode
ou não estar preservado (Shakespeare, 2001).
Cicatrização é um processo que age no sentido de restaurar a
integridade dos tecidos lesados, utilizando substituição ou reparo do tecido
perdido (Shakespeare, 2001).
O mecanismo de cicatrização tem três fases, inflamação (fase
aguda e tardia), fibroplasia e remodelação (Cotran et al., 2000).
Na fase inflamatória aguda, a lesão dos vasos permite o
extravasamento dos elementos plasmáticos, havendo a hemostasia através
da agregação plaquetária e coagulação sangüínea, além da liberação de
substâncias que promovem a migração e crescimento celular no local (Clark,
1985; Cotran et al., 2000).
Os neutrófilos são os primeiros leucócitos a infiltrarem-se na área
lesada e sua principal função é evitar a contaminação por bactérias. A
migração dos monócitos da corrente sangüínea ocorre conjuntamente à dos
neutrófilos; assim que o infiltrado neutrofílico se resolve, o influxo de
monócitos e sua conversão em macrófagos continuam, iniciando a fase
tardia da inflamação. Os macrófagos, além de sua atividade de fagocitose,
liberação de fatores de crescimento que levam à formação do tecido de
granulação (Clark, 1985; Cotran et al., 2000).
O tecido de granulação assim é chamado por ter aparência
granular quando analisado macroscopicamente (Tonnesen et al., 2000). Tem
uma densa quantidade de macrófagos, fibroblastos e neovasos, permeado a
uma matriz colágena frouxa, fibronectina e ácido hialurônico. Durante a
proliferação dos fibroblastos, há migração para o interior da ferida; nesta
fase, sofrem alterações fenotípicas que permitem sua motilidade e deposição
de matriz extracelular. Estas células, ligadas entre si e com matriz gerando
tensão, resultam na contração da ferida (Cotran et al., 2000).
Durante a formação do tecido de granulação, muitos fibroblastos
adquirem características morfológicas e bioquímicas de células contráteis, os
chamados miofibroblastos, responsáveis pela contração do tecido. A
presença destas células na ferida é transitória, uma vez que, assim que se
observa a cessação da contração do tecido, os miofibroblastos também não
são mais detectados no local (Desmoulière et al., 1995).
O reparo dos tecidos envolve dois processos distintos, a
regeneração, que se refere à substituição das células lesadas por células do
mesmo tipo, e a substituição por tecido conjuntivo (fibroplasia ou fibrose),
que deixa uma cicatriz permanente (Cotran et al., 2000).
A forma mais simples de reparo tecidual é a primária ou por
primeira intenção, que é a cicatrização de uma incisão cirúrgica limpa, não
Quando ocorre perda extensa de tecido, formando uma grande
ferida, há cicatrização por segunda intenção (Cotran et al., 2000). Em lesões
extensas e ou profundas, onde não há possibilidade de cicatrização por
primeira intenção, é importante manter a área livre de processos infecciosos
e reparar ou substituir o tecido perdido (Ruszczak & Schwartz, 2000).
A cicatrização por segunda intenção é um procedimento comum
do organismo quando o fechamento cirúrgico não é possível. Mas isto pode
levar a resultados estéticos desfavoráveis, tempo prolongado de cicatrização
e risco de infecção (Tarlow et al., 2001).
1.3
REPARAÇÃO DAS FERIDAS EXTENSAS
Quando o trauma cutâneo é grave e a perda tecidual é extensa, o
processo de cicatrização pode não ser suficiente para a cura (Cotran et al.,
2000).
Clinicamente, o processo de cicatrização tem duas considerações
importantes, a primeira, representada pelas propriedades inatas do processo
cicatricial do organismo que atuam no sentido de reparar ou substituir os
tecidos lesados, e a segunda, representada pela ação de terceiros que leva a
um processo ativo de acelerar ou modificar o curso natural da cicatrização,
com objetivo de cura do ferimento. Neste caso, entende-se por ação de
terceiros, qualquer procedimento cirúrgico necessário que ofereça melhores
biológicos ou biocompatíveis que promovam aceleração do processo
(Shakespeare, 2001).
Para reparação de perda significativa do revestimento cutâneo,
consideram-se, os enxertos e os retalhos. Enxertos são transplantes feitos
com tecidos migrados para outras áreas, desprovidos de pedículo vascular,
e assim têm sua integração independente da área de origem (doadora). Os
retalhos mantêm dependência da área doadora (pedículo vascular) por um
certo período, excetuando os retalhos transferidos por técnica microcirúrgica
(Pigossi et al.,1971).
Dentre as muitas classificações dos enxertos, pode-se
classificá-los quando à origem, ou seja, aqueles retirados do próprio paciente
(autólogos), os enxertos realizados entre pessoas diferentes, mas sendo o
doador e o receptor indivíduos geneticamente idênticos, como ocorrem em
gêmeos idênticos (isólogos), os enxertos entre indivíduos geneticamente
distintos, porém da mesma espécie (homólogos), e os enxertos provenientes
de organismos diferentes e de espécies distintas (heterólogos) (Bennett,
1988; Davis & Arpey, 2000; Jones at al., 1996; Ruszczak & Schwartz,
2000).
Tem-se procurado a utilização tanto dos enxertos autólogos,
quanto dos homólogos e heterólogos; estes dois últimos podem representar
medidas temporárias, já que não fornecem substituição dérmica permanente
por estarem sujeitos à rejeição ou falta de vascularização (Livesey et al.,
Outras desvantagens dos enxertos homólogos seriam a
necessidade de triagem dos doadores, utilização de meios de conservação e
acondicionamento de amostra de forma adequada (Backere, 1994; Kearney,
1998). A utilização destes enxertos diminuiu em face de enfermidades
infecciosas como a hepatite C e a AIDS, apesar do avanço técnico para se
detectar o genoma do vírus no soro.
Há estudos dos enxertos heterólogos com a intenção de utilizar
meios de transformação dos tecidos, havendo a possibilidade de torná-los
menos ou até não antigênicos, reduzindo as desvantagens destes materiais
(Kearney, 1998).
1.4 CURATIVOS
Os curativos no tratamento de tecidos cutâneos lesados sempre
foram pesquisados e as novidades aparecem de tempos em tempos. Os
primeiros relatos de utilização de materiais de oclusão no tratamento de
ferimentos cutâneos estão presentes nos Papiros Cirúrgicos de Edwin Smith,
que descrevem o uso de tiras de linho banhadas em mel com propriedade de
promover aderência e ação antimicrobiana à lesão (Breasted, 1930 apud
Benett, 1988).
Com o desenvolvimento tecnológico da tecelagem, em 1871,
dificuldade na utilização das gazes de algodão era a sua facilidade de aderir
ao ferimento, que foi resolvido com a impregnação das mesmas em óleo de
origem mineral ou vegetal e também a inclusão de substâncias
anti-bacterianas para a prevenção de infecções (Bennett, 1988).
As principais funções dos curativos oclusivos são: absorção das
substâncias drenadas; proteção de traumas diretos e de contaminação por
microorganismos e corpos estranhos; promoção da hemostasia por
compressão; eliminação de espaços mortos; aceleração do processo de
epitelização da ferida. Além disto a de prover a comodidade psicológica ao
paciente, isto porque, estando o ferimento fechado, permite sua reintegração
à vida, sem interferência. Assume, então, a função da pele íntegra perdida
durante a lesão (Bennett, 1988).
Foi traçado um paralelo entre feridas tratadas com e sem
curativos, através de biópsias de pele, que mostraram diferença significativa
na cicatrização. As áreas ocluídas apresentaram epiderme madura, derme
compacta e ausência de infiltrado inflamatório, enquanto as áreas tratadas
sem curativo evidenciaram epiderme desorganizada, derme edemaciada e
pálida e infiltrado inflamatório ativo (Suarez & Fulton, 1998).
O material ideal para o curativo oclusivo é aquele com as
seguintes propriedades, ter poros, que permitem a troca de líquidos e gases,
promovendo a “respiração” da ferida; fazer compressão sem aderir ao
ferimento; absorver o material exsudado; funcionar como barreira de agentes
contaminados; ser de fácil manipulação, confortável e resistente; não ser
adaptado à pele normal adjacente, de fácil esterilização e obtenção (Bennett,
1988; Shakespeare, 2001).
1.5 BIOMATERIAIS
Atualmente têm-se utilizado, para reparação de perdas cutâneas,
produtos constituídos de material orgânico ou sintético, denominados
biomateriais, que tentam substituir ou preencher as funções naturais da área
tratada, com finalidade de restaurar e melhorar as funções fisiológicas do
organismo (Schimidt & Von Recum, 1991).
A membrana amniótica obtida da placenta, após o parto, foi
utilizada durante várias décadas no tratamento de feridas abrasivas com
vantagem de baixa imunogenecidade, diminuição da dor, estimulação da
cicatrização e, sendo translúcida, permite a inspeção da ferida. Dentre as
desvantagens, tem-se a dissolução com o tempo e a necessidade de
mantê-la ocluída para evitar o ressecamento (Bennett, 1988; Ramakrishnan &
Jayaraman, 1997).
A utilização da pele homóloga fornecida por bancos de tecidos foi
amplamente difundida para uso como curativo biológico (Cuono et al., 1987;
Prunieras, 1990; Hettich et al., 1994) e, sabendo-se que a crio-conservação
métodos de preservação foram desenvolvidos com a finalidade de diminuir a
resposta imunogênica (Ruszczak & Schwartz, 2000).
Entre os tecidos heterólogos, a pele porcina tem uso freqüente
devido à sua grande semelhança com a pele humana, sendo utilizada na
forma natural ou crio-consevada, como curativo biológico, para tratamento de
perda do revestimento cutâneo. Contudo, a pele porcina acaba sendo
rejeitada em decorrência da formação de anti-corpos contra as células do
enxerto (Ruszczak& Schwartz, 2000).
Dentre os materiais heterólogos desenvolvidos e utilizados como
substitutos da pele, destaca-se a esponja de colágeno. É uma matriz
colágena bovina liofilizada, constituída de gel de colágeno desnaturado,
composto de colágeno bovino tipo I, associado ou não com
condroitina-sulfato de tubarão (Bell et al., 1983), e/ou fibroblastos e queratinócitos
humanos (Eaglstein et al., 1995). Este material não apresenta evidência de
reatividade imune, mas o gel implantado rapidamente degrada-se e os
espaços por ele deixados não são preenchidos por derme neoformada (Orgill
et al., 1998).
No mercado de biomateriais, estão sendo comercializados alguns
produtos que empregam, na sua fabricação, processo de engenharia tecidual
de alta tecnologia (Moiemen et al., 2001).
Dentre esses tecidos, encontra-se o GraftsKin® (Organogenesis,
Canton, MA - Estados Unidos da América - EUA), um equivalente à pele,
matriz de colágeno bovino tipo 1 purificada e condensada, associado à
suspensão de fibroblastos dérmicos (Muhart et al., 1999; Tarlow et al., 2001).
Outro produto é o CollatampFacie® (Syntacoll, Herisau, Suíça), membrana
de colágeno tipo 1, derivada de tendão de Aquiles de bovinos associado a
um equivalente epidérmico temporário (Ruszczak & Schuwartz, 2000). Há o
Dermagraft® (Advanced Tissue Sciences, La Lolla, Los Angeles – USA),
uma tela dérmica, metabolicamente ativa, que contém proteínas da matriz
(colágenos tipo I, III, V e VII, elastina, fibronectina e tenascina), fatores de
crescimento presentes na derme humana e glicosaminoglicanos. É substituto
temporário, que necessita ser trocado ou removido no curso do processo de
cicatrização (Ruszczak & Schuartz, 2000). O Biofill® (Indústria e Comércio
de Produtos Biotecnológicos, Paraná, Brasil) é uma película microfibrilar de
celulose pura, constituída por uma rede de fibras de celulose dispostas ao
acaso (De Paola et al., 1987; Hilário et al., 1988). O Biobrane® (Sugarland,
Texas – USA), membrana de silicone com nylon ligado a peptídios do
colágeno dérmico, é um substituto temporário de curto prazo, semipermeável
e com boa aderência e flexibilidade (Young-Ho et al., 1989; Robson at al.,
1992). Por fim, o Duoderm® (Convatec, A. Bristol-Myers Squibb Company,
USA) que é uma membrana impermeável com camada profunda de
partículas hidroativas agregadas em polímero inerte, funcionando como um
Nos EUA já está em uso um tecido dérmico acelular (TDA)
homólogo, processado a partir da pele humana de cadáver, o AlloDerm®
(LifeCell Corporation, Texas, EUA).
As novas pesquisas apontam para a elaboração de uma matriz
acelular, com a finalidade de proporcionar às células normais do tecido
adjacente condições de migrarem em direção a ela, integrando-se no local,
e, então, de desempenharem as suas funções como se fossem tecidos
normais (Reichley, 1995).
O enxerto de TDA humano (AlloDerm®) tem sido utilizado desde
1992, em tratamento de queimados (Wainwright et al., 1996) e em cirurgias
reconstrutivas desde 1994 (Jones et al., 1996).Jones
A dificuldade de obtenção do TDA humano e o alto custo
incentivaram pesquisadores brasileiros a desenvolver um tecido dérmico
acelular de origem porcina, o Xenoderma® (Mackron Biopolímero Indústria e
Comércio Limitada, Mogi das Cruzes, Brasil), com tecnologia genuinamente
nacional.
O estudo experimental, utilizando o Xenoderma® como implante
no subcutâneo de ratos, mostrou que ele é integrado aos tecidos do
hospedeiro, permanecendo como material inerte e provocando uma pequena
reação inflamatória (Hoyama et al., 2001).
A membrana de silicone é elástica, durável, inerte e pode ser
fabricada de maneira que a permeabilidade ao vapor de água seja controlada
ainda que o material pode se tornar permeável a substâncias de ação
antibacteriana, úteis na prevenção de infecção local (Wainwright et al., 1996;
Morgan et al., 1997; Pandya et al., 1998; Scheridan et al., 1998).
A membrana de silicone Silimed® (Industria Brasileira, Rio de
Janeiro, Brasil), segundo o fabricante, é constituída de elastômero básico e
polidimetil-siloxano com carga de sílica pura, amorfa, micropulverizada e
catalisada por compostos de platina; de pigmentos que são constituídos por
uma solução contendo óxido de ferro e dióxido de titânio; e de reforço que é
formado através de tecido de fio de poliéster. Posicionada diretamente sobre
a área cruenta de ferimentos, proporciona uma camada protetora fisiológica
da área cruenta controlando a redução de perdas hidroeletrolíticas e
protéicas, redução da contaminação e proliferação bacteriana. É
impermeável, mas a drenagem de secreções de exudação da área cruenta,
bem como a troca de gases da ferida, podem ser feitas através de fenestras
na sua superfície. Apresenta facilidade de aplicação com oclusão e proteção
mecânica do leito da ferida, proporcionado condições favoráveis para a neo
formação vascular, a reepitelização e melhores resultados estéticos. A
remoção da membrana de silicone, se necessária, costuma ser fácil e pode
haver aplicação única ou ser re-esterilizada, levando à diminuição
Figura 3: Membrana de silicone Silimed®.
A pele artificial IntegraTM (Integra Life Sciences Corporation, San
Diego, EUA), que foi idealizada por Burke e Yannas, tem o estudo clínico
mais controlado e prolongado encontrado na literatura. O IntegraTM é um
material artificial, composto por duas camadas. A primeira, externa, é
composta de uma membrana de silicone. A camada interna é altamente
porosa e é composta por colágeno de origem bovina e glicosaminoglicano
(condroitina-6-sulfato). A camada interna permite que as células endoteliais e
fibroblastos do leito receptor migrem para o interior da mesma. As células do
hospedeiro vão provocar uma neo-vascularização e a substituição da matriz
por uma nova matriz dérmica produzida pelos fibroblastos. A partir do
vigésimo primeiro dia da aplicação da matriz, poderemos remover a camada
de silicone e substituí-la por autoenxerto ultrafino em malha ou semeadura
de queratinócitos autólogos cultivados (King et al., 1997; Kremer et al., 2000;
Figura 4: Curativo onde se utilizou IntegraTM e, no 28º dia, retirou-se a lâmina de silicone do produto.
Há muitas dúvidas quanto à utilização deste produto por período
de 21 dias ou mais, para a preparação da nova derme. Inicialmente, vem a
preocupação no aumento do risco de infecção bacteriana e com isso um
tempo maior de hospitalização. Se houver infecção, o produto pode ser
utilizado? Esse tempo prolongado, devido à proliferação de fibroblastos, não
poderá resultar em cicatrizes de padrão estético não favorável? Curativos
diários e cuidados extremosos para que a membrana não se rompa não
perturba a tranqüilidade emocional do paciente? O alto custo do produto,
mais todos os cuidados já relatados não seriam de se ponderar o custo
benefício para o paciente? Valeria o risco do uso do produto perante as
respostas imunológicas e alergênicas? O colágeno bovino, um de seus
componentes, não poderia aumentar o risco da Doença de
realidade nacional? Usando-se somente a membrana de silicone, sem o
colágeno heterólogo, poder-se-ia obter resultados semelhantes?
Estas dúvidas nos estimularam a estudar a membrana de silicone
2 OBJETIVO
O objetivo deste estudo foi avaliar os efeitos da membrana de
3 MÉTODO
3.1 ANIMAIS
UTILIZADOS
Foram utilizados 30 ratos albinos, da raça “Wistar”, machos, com
massa corporal variando de 285 g a 315 g, média de 299,13 g, fornecidos
pelo Biotério Central da FMB - UNESP (Figura 5).
3.2 GRUPOS
EXPERIMENTAIS
Os animais foram distribuídos aleatoriamente em três grupos:
Grupo GG: 10 animais submetidos à área cruenta no dorso e
tratados com gazes rayon, considerados grupo
controle.
Grupo GH: 10 animais submetidos à área cruenta no dorso e
tratados com homoenxerto.
Grupo GS: 10 animais submetidos à área cruenta no dorso e
tratados com membrana de silicone.
3.3 TÉCNICA
CIRÚRGICA
Todos os procedimentos foram realizados pelo mesmo cirurgião, o
autor.
Os animais foram anestesiados pela via intraperitoneal, recebendo
a dose de 30 mg/kg de massa corporal de Pentobarbital Sódico 3% (Cristália
Produtos Químicos Farmacêuticos Ltda., São Paulo, Brasil) injetável no
ponto médio do abdome.
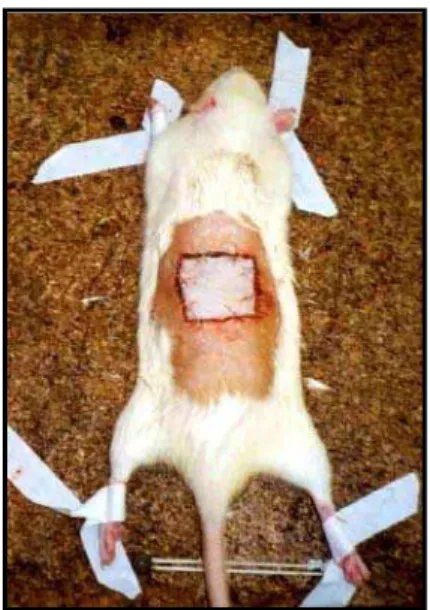
Após a anestesia, foi aferida a massa dos animais e, logo após,
dorsal, numa área quadrada com seis cm de lado. Cada animal foi colocado
em decúbito ventral e imobilizado pelas quatro patas com fita adesiva. A
seguir delimitou-se, com caneta própria para marcação de pele, na pele
tonsilotomizada uma área quadrada de três cm de lado. Foi feita antissepsia
do local com solução de gluconato de clorhexedine a 4% (Rioex Bioquímica,
Marion Industrial, Ltda., Barretos, SP, Brasil) (Figura 6).
Figura 6: Demarcação da área quadrada de três cm de lado na
pele dorsal tonsilotomizada do rato.
A pele foi incisada com bisturi de lâmina número 15 na área
demarcada. A ressecção da pele, do tecido subcutâneo e o panículo carnoso
foi realizada com tesoura curva de Metzenbaum, deixando exposta a
compressão e após alguns minutos com eletrocautério, nos pontos que ainda
continuavam sangrando (Figura 7).
Figura 7: Área cruenta na região dorsal do rato.
3.3.1 Grupo Gazes (GG)
A área cruenta foi coberta com gaze rayon embebida em
solução fisiológica. O curativo oclusivo foi realizado com gazes de algodão
secas e fixado na pele do animal com fio de mononylon 5.0 (Prolene,
Johnson & Johnson, São José dos Campos, SP, Brasil) em oito pontos
Figura 8: Área cruenta coberta com gazes rayon no animal do
grupo GG.
Figura 9: Curativo oclusivo fixado na pele, realizado em todos
3.3.2 Grupo Homoenxerto (GH)
Os fragmentos de pele e tecido celular subcutâneo dos animais do
grupo GG foram preparadas com ressecção do tecido gorduroso e, assim,
obteve-se o homoenxerto de pele total. As áreas cruentas dos animais do
grupo GH foram cobertas com este homoenxerto de pele total, que foi fixado
na pele do animal com oito pontos simples de fio mononylon 5.0 (Prolene,
Johnson & Johnson, São José dos Campos, SP, Brasil), e então, sobre ele,
colocou-se gaze rayon embebida em solução fisiológica. O curativo oclusivo
com gazes de algodão secas foi feito da mesma forma que nos animais do
grupo GG (Figura 10).
Figura 10: Homoenxerto de pele total aplicado sobre a área
3.3.3 Grupo Membrana de Silicone (GS)
A área cruenta foi coberta com membrana de silicone Silimed®
(Industria Brasileira, Rio de Janeiro, Brasil) de espessura de 0,13 mm e
fixada na pele do animal com oito pontos simples de mononylon (Prolene,
5.0, Johnson & Johnson, São José dos Campos, SP, Brasil). Logo após,
foram realizadas 4 fenestras na membrana de silicone de aproximadamente
7 mm de extensão cada uma, com tesoura reta, nos quatro pontos cardeais,
e então, sobre ela colocou-se gaze rayon embebida em solução
fisiológica. O curativo oclusivo, com gazes de algodão secas, foi feito da
mesma forma utilizada para os animais dos grupos GG e GH (Figura 11).
Figura 11: Membrana de silicone após sofrer fenestração nos
3.4 CUIDADOS DO PÓS-OPERATÓRIO
Após os procedimentos cirúrgicos, os animais foram mantidos em
gaiolas individuais, recebendo água e ração própria para animais de
laboratório ad libitum.
As condições de temperatura e umidade do ambiente foram
mantidas estáveis, com iluminação alternando entre claro e escuro em
períodos de 12 horas.
Coleiras especiais de material plástico endurecido foram
confeccionadas e colocadas ao redor do pescoço dos animais, sendo
mantidas durante todo o período experimental.
Durante o período das primeiras 72 horas todos os animais foram
submetidos a analgesia por via oral com Dipirona Sódica (Neo Química Com.
e Ind. Ltda., Anápolis, GO, Brasil), com uma ampola de 2 ml (500 mg/ml)
diluída no frasco de água de 500 ml.
Houve uma troca de curativo no 7º dia de pós-operatório, sob
sedação pela via intraperitoneal, na dose de 20 mg/kg de massa corporal de
Pentobarbital Sódico 3% (Cristália Produtos Químicos Farmacêuticos Ltda.,
São Paulo, Brasil) injetável, no ponto médio do abdome. O curativo constou
na troca das gazes secas deixando intactos a gaze rayon nos animais do
grupo GG, o homenxerto nos animais do grupo GH e a membrana de silicone
Com exceção do pós-operatório imediato, nas primeiras 72 horas
e no momento do curativo, não foram administradas drogas sistêmicas ou
tópicas durante o experimento.
3.5 SACRIFÍCIO DOS ANIMAIS
No 14º dia, os animais foram sacrificados usando-se sobredose de
Pentobarbital Sódico 3% (Cristália Produtos Químicos Farmacêuticos Ltda.,
São Paulo, Brasil) injetável, via intraperitoneal, no ponto médio do abdome.
Após o sacrifício foi removida a gaze rayon e o curativo de gazes
secas, nos animais do grupo GG, o homoenxerto, que já estava
desprendendo, e o curativo de gases secas nos animais do grupo GH e a
membrana de silicone e o curativo de gazes secas nos animais do grupo GS.
Observou-se que as gazes rayon e a membrana de silicone não estavam
aderidas na área cruenta dos animais nos três grupos. Após aferida a massa
dos animais, foi revisada a tonsilotomia no terço médio do dorso dos
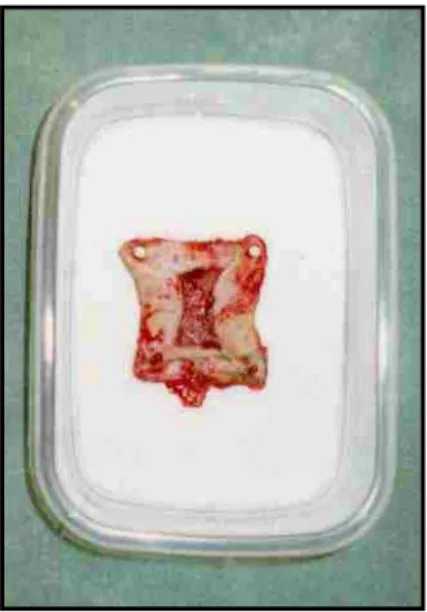
animais, utilizando-se lâmina de barbear. Então, posicionou-se cada animal
em decúbito ventral, demarcou-se na pele o fragmento a ser ressecado,
abrangendo a área cruenta tratada e o rebordo de pele normal adjacente,
perfazendo uma área quadrada de cinco cm de lado. Logo após, realizou-se
incisão da pele na área demarcada com bisturi de lâmina número 15,
tecido subcutâneo, com tesoura curva de Metzenbaum, abrangendo, na
profundidade, a musculatura dorsal. Este procedimento foi realizado em
todos os animais dos diferentes grupos (Figura 12).
Figura 12: Área quadrada de cinco cm de lado, contendo a área
cruenta tratada rodeada de pele normal, após sacrifício
em animal do grupo GH.
3.6 PREPARO DOS TECIDOS PARA ESTUDO
A amostra em bloco único foi espraiada e fixada com alfinetes nos
quatro pontos cardeais em placa de isopor dentro de recipiente de plástico e
Figura 13: Peça espraiada e fixada na placa de isopor dentro de
recipiente plástico.
O material permaneceu em solução de formalina tamponada a
10% durante 48 horas. Após este período, dividiu-se a peça em três
segmentos, sendo utilizado somente o segmento central, o qual foi
processado para exame histopatológico, segundo a rotina do Laboratório de
Figura 14: Peça dividida em três partes tendo sido utilizado
somente o segmento central.
Para a desidratação e diafanização o material foi lavado em água
corrente por três horas e depois mergulhado em cinco soluções de álcool
(Miyako do Brasil, Indústria e Comércio Ltda., Guarulhos, SP, Brasil), sendo
uma solução deálcool a 70%, outra de álcool a 80% e três de álcool absoluto
por uma hora. Os fragmentos foram colocados em quatro soluções de Xilol
(Miyako do Brasil, Indústria e Comércio Ltda., Guarulhos, SP, Brasil). Nas
duas primeiras soluções permaneceram imersos por um minuto e nas duas
últimas por uma hora.
Foi feita inclusão do material em dois banhos de parafina líquida
(Synth, Labsynth Produtos para Laboratório Ltda., Diadema, SP, Brasil) a
Foram realizados cortes laminares seriados, de cinco µm de
espessura, abrangendo a área cruenta com rebordo de pele normal.
Realizou-se quatro cortes histológicos da amostra, com distância de 50 µm
entre os mesmos. Estes cortes foram mergulhados em água, à temperatura
de 40 a 50 ºC e então levados à estufa para desparafinar, onde
permaneceram por 6 horas.
A seguir foram submetidos a coloração de Hematoxilina-Eosina
(HE). Para tal os fragmentos sofreram desparafinização e hidratação em
água corrente por cinco minutos. Foram mergulhados em água destilada e
ficaram em solução de Hematoxilina de Doles (Doles Reagentes e
Equipamentos para Laboratório Ltda., Goiânia, GO, Brasil) por dez minutos,
sendo lavados a seguir em água corrente por um minuto para remoção do
excesso do corante. Logo após realizou-se a diferenciação dos núcleos em
solução de álcool ácido clorídrico a 1%, por menos de um minuto. Seguiu-se
nova lavagem em água corrente e inclusão na solução de Eosina-Floxina
(Synth, Labsynth Produtos para laboratório Ltda., Diadema, SP, Brasil) por
um minuto. O material sofreu desidratação por soluções de álcool (Miyako do
Brasil) a 70% e a 80% e, por três vezes, no álcool absoluto (Miyako do
Brasil), com duração de cinco minutos cada sessão. Depois, houve inclusão
em mais três soluções de Xilol (Miyako do Brasil) pelo mesmo tempo. A
montagem das lâminas ocorreu com uma gota de meio de montagem
Entelan da Merck (Merck Sociedade Anônima (S.A.) Indústrias (Ind.)
amostra entre lâmina e lamínula (Bioglass Ind. Com. Imp. Exp. Ltda.,
Guarulhos, SP, Brasil).
3.7 ATRIBUTOS
ESTUDADOS
3.7.1 Massa dos Animais
Os animais foram pesados após o ato anestésico, no período pré
operatório, e após o sacrifício dos mesmos, no décimo quarto dia. A aferição
da massa dos animais foi feita pelo mesmo observador, o cirurgião e autor
do estudo, utilizando balança eletrônica Bel Brasil modelo Mark 8000.
3.7.2 Avaliação Histológica e Morfométrica
Os campos estudados continham, no centro, o tecido de
granulação da área cruenta tratada, circundados por pele normal. Das quatro
lâminas preparadas, somente uma delas foi selecionada aleatoriamente para
Nesta lâmina foram marcados os seguintes pontos:
Ponto 1 - início da área cruenta, transição entre a pele íntegra e o tecido de
granulação;
Ponto 2 - distância média entre os pontos 1 e 3;
Ponto 3 - distância média entre os pontos 1 e 5;
Ponto 4 - distância média entre os pontos 3 e 5;
Ponto 5 - término da área cruenta, transição entre o tecido de granulação e
a pele íntegra.
Após a marcação dos pontos descritos, foi preconizada a
padronização de dois campos de observação diferentes em profundidade
para cada um desses pontos, distribuídos da seguinte forma:
A - campo de observação mais superficial na reação inflamatória do tecido
de granulação da área cruenta.
B - campo de observação adjacente e menos superficial na reação
Figura 15: Foto histológica exemplificando os pontos em que foram
realizados o exame histológico e morfométrico da área cruenta (HE X10).
O estudo histológico e morfométrico no processo inflamatório da
área cruenta do ferimento enfocou a proliferação de neovasos, fibroblastos,
fibras colágenas, leucócitos e macrófagos nos animais dos grupos GG, GH e
GS. Adotou-se, como valor final, a média em 10 campos analisados por
animal de cada grupo, utilizando-se aumento óptico de 40 vezes.
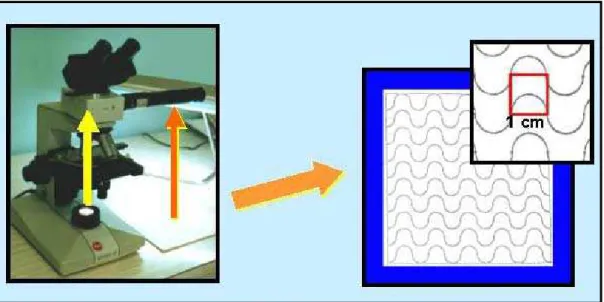
Para observação histológica e morfométrica da proliferação dos
neovasos, foi utilizado microscópio óptico convencional, com adaptação de
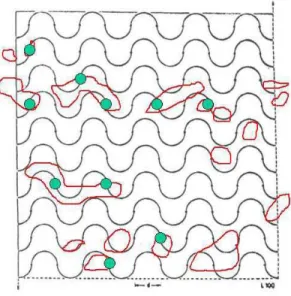
câmara clara (Leitz, Microlab) que permite, pela superposição de imagens, o
desenho de diversas estruturas em papel. Utilizou-se também o desenho da
grade padronizada por Merz, com semicírculos alternados formando linhas
sinuosas paralelas com pontos eqüidistantes e modificada para 100 pontos de
Figura 16: Microscópio óptico convencional com adaptação de câmera
clara e a grade de Merz modificada (100 pontos).
Em grande aumento (40 X), o contorno das estruturas vasculares
dos neovasos foi desenhado sobre papel com grade modificada de Merz e
foram marcadas e contadas as interseções das linhas sinuosas com o
contorno externo dos vasos. Considerando a existência de cem pontos em
cada campo, foram estudados mil pontos por animal. A medida da variável foi
Figura 17: Foto histológica exemplificando o exame histológico e
morfométrico do número de neovasos na área cruenta no animal de número oito do grupo GH (HE X40).
Figura 18: Desenho do campo histológico do animal do grupo GH
Calculou-se a quantidade de pontos necessários para um erro
padrão relativo, que é proporcional à densidade de volume da estrutura em
análise e inversamente proporcional ao número de pontos que foram
contados (Hally, 1964).
Foi calculada a quantidade de pontos necessária para um erro
máximo de 5% , de acordo com a fórmula de Hally:
EPR =
n
Vv)
1
(
−
Onde: EPR = erro padrão relativo
Vv = densidade de volume da estrutura em análise
n = número de pontos a serem contados
O cálculo do volume relativo das estruturas foi obtido mediante a
fórmula de Weibel (Weibel et al., 1963; Weibel et al., 1966):
Pe
VR = ---
Pt
Onde: VR = volume relativo da estrutura;
Pe = número de pontos sobre a estrutura;
Para a análise histológica e morfométrica dos fibroblastos, das
fibras colágenas, dos leucócitos e dos macrófagos, considerou-se o campo
microscópico contido na área quadrada da grade de Merz, de onde foi
quantificada cada estrutura por unidade. A medida da variável foi expressa
pela média dos dez campos de cada animal (Figura 19, 20 e 21).
Figura 19: Foto histológica exemplificando o exame morfométrico do
número de fibroblastos, fibras colágenas, leucócitos e
macrófagos do animal de número três do grupo GG (HE
Figura 20: Foto histológica exemplificando o exame morfométrico do
número de fibroblastos, fibras colágenas, leucócitos e macrófagos do animal de número seis do grupo GH (HE X40).
Figura 21: Foto histológica exemplificando o exame morfométrico do
número de fibroblastos, fibras colágenas, leucócitos e
O estudo histológico e morfométrico das amostras foi realizado por
uma única observadora, a patologista, que as analisou de modo aleatório,
sem identificação do grupo a que pertencia cada animal.
3.7.3 Medida da Espessura da Área Cruenta
O estudo da espessura da área cruenta engloba o processo
inflamatório da área cruenta do ferimento, desde a superfície até a
aponeurose profunda da musculatura dorsal de todos animais. Esta medida
foi realizada através da utilização de régua microscópica de Breslow, que é
graduada com divisões de dezenas de milímetros (0,1 mm), usada para
medir a espessura de Breslow nos melanomas cutâneos (Breslow, 1970;
Breslow, 1978). De cada lâmina, escolhida aleatoriamente, foram aferidas
três medidas distintas: no ponto 1 (área de transição da pele íntegra e tecido
de granulação); no ponto 3 (ponto médio entre os pontos 1 e 5); e no ponto 5
(área de transição entre o tecido de granulação e a pele íntegra). Adotou-se
como valor final, a média dos três campos analisados, por animal de cada
grupo. A aferição desta medida foi feita através de microscópio óptico
Figura 22: Foto histológica exemplificando a medida da espessura da
área cruenta tratada utilizando-se a régua microscópica de Breslow (HE X40).
O estudo das amostras, enfocando a espessura do processo
inflamatório, foi realizado por uma única observadora, a patologista, que as
analisou de modo aleatório e não sendo identificado o grupo a que pertencia
cada animal.
3.8 MÉTODOS
ESTATÍSTICOS
As médias das medidas, avaliando a massa corpórea dos
leucócitos, de macrófagos e a medida da espessura da área cruenta tratada
de todos animais dos diferentes grupos, foram submetidas ao procedimento
analítico estatístico.
As análises estatísticas dos resultados obtidos utilizaram o
programa Excel versão 2002 e foram realizadas por meio de Análise de
Variância não paramétrica (Streiner et al., 2000), envolvendo:
• Teste de Cohran (avaliar a homogeneidade das variâncias);
• Método de Turkey (comparação múltipla entre as médias);
• Teste de Mann-Withney (comparação entre os grupos);
• Teste de Kruskal-Wallis (comparação entre os pontos de
observação);
• Teste de Dunn (comparação múltipla);
• Teste de Wilcoxon (comparação entre médias).
4 RESULTADOS
4.1 MASSA DOS ANIMAIS
Nas Tabelas 1, 2 e 3 estão relacionados valores da massa
corporal de cada animal, aferidos antes do procedimento cirúrgico (MI) e
quatorze dias após (MF), as diferenças entre as massas (MF – MI) e a
variação porcentual entre MF e MI.
A variação de MF nos animais do grupo GG foi 313 g (± 16) do
grupo GH foi de 312 g (± 13) e, do grupo GS foi de 312,5 g (± 27,5).
A média da variação porcentual entre MF e MI foi de 4,2% nos
animais do grupo GG, do grupo GH foi de 4,7% e do grupo GS foi de 4,6%.
Tabela 1 - Valores em gramas de MI, de MF, da diferença entre MF e MI e
da variação porcentual entre MF e MI nos animais do grupo GG.
Ratos (MI) (MF) (MF - MI)
Variação Porcentual
1 292 306 14 4,8
2 301 318 17 5,6
3 286 297 11 3,8
4 302 311 9 3,0
5 297 312 15 5,1
6 298 310 12 4,0
7 312 318 6 1,9
8 315 329 14 4,4
9 291 301 10 3,4
10 298 316 18 6,0
Média 299,2 311,8 12,6 4,2
Desvio-padrão 9,0 9,2 3,7 1
Valor Máximo 315 329 18 6
Valor Mínimo 286 297 6 2
Tabela 2 - Valores em gramas de MI, de MF, da diferença entre MF e MI e
da variação porcentual entre MF e MI nos animais do grupo GH.
Massas
(MI) (MF) (MF - MI) Variação Porcentual
1 306 319 13 4,2
2 289 313 24 8,3
3 295 317 22 7,5
4 299 310 11 3,7
5 303 312 9 3,0
6 297 315 18 6,1
7 296 304 8 2,7
8 310 325 15 4,8
9 305 313 8 2,6
10 286 299 13 4,5
Média 298,6 312,7 14,1 4,7
Desvio-padrão 7,6 7,3 5,7 2,0
Valor Máximo 310 325 24 8,3
Valor Mínimo 286 299 8 2,6
Quartil 1 295,3 310,5 9,5 3,1
Tabela 3 - Valores em gramas de MI, de MF, da diferença entre MF e MI e
da variação porcentual entre MF e MI nos animais do grupo GS.
Massas
(MI) (MF) (MF - MI) Variação Porcentual
1 290 305 15 5,2
2 305 323 18 5,9
3 287 296 9 3,1
4 320 340 20 6,3
5 296 310 14 4,7
6 288 295 7 2,4
7 306 318 12 3,9
8 310 328 18 5,8
9 285 296 11 3,9
10 309 324 15 4,9
Média 299,6 313,5 13,9 4,6
Desvio-padrão 12,0 15,5 4,2 1,3
Valor Máximo 320 340 20 6,3
Valor Mínimo 285 295 7 2,4
MASSA CORPORAL
Gráfico 1: Valor Máximo, Q3, Média, Q1 e Valor Mínimo para variação
porcentual de massa entre MF e MI.
Resultado dos Testes Estatísticos: Não há diferença
significativa entre as médias da variação porcentual entre MF e MI (Teste de Kruskal-Wallis), sendo GG = GH =GS (p = 0,0685).
Varia
ç
ão
p
orcentual entre MF e MI
Grupos Q1 Q1 Q1 Q3 Q3 Q3 0 1 2 3 4 5 6 7 8 9
GG GH GS
X X
X
4.2 ANÁLISE HISTOLÓGICA E MORFOMÉTRICA DOS
NEOVASOS
Na Tabela 4 estão relacionados os valores médios de neovasos de cada animal dos três grupos. Esses valores expressos em pontos contados na projeção dos vasos desenhados na grade de Merz, representam a média obtida dos dez campos histológicos analisados (1A, 1B, 2A, 2B, 3A, 3B, 4A, 4B, 5A, 5B).
A média de neovasos nos animais do grupo GS (21,3) foi
significamente maior que a média dos neovasos do grupo GG (19,6). Da
Tabela 4 - Valores médios dos neovasos presentes no campo histológico da
grade de Merz, nos animais dos grupos GG, GH e GS, em
unidades.
Grupos GG GH GS
1 24,8 19,2 20,2
2 17,1 13,5 17,2
3 17,9 9,7 18,6
4 18,4 12,7 21
5 17,7 18,1 23,9
6 19,1 19,9 28,4
7 17,1 18,6 21,3
8 23,8 8 24,3
9 22,6 18 19,9
10 17,6 13,1 18,1
Média 19,6 15,1 21,3
Desvio-Padrão 3,0 4,2 3,4 Valor Máximo 24,8 19,9 28,4 Valor Mínimo 17,1 8 17,2
Q1 17,6 12,8 18,9
Q3 21,7 18,5 23,3
NEOVASOS
Q1
Q1
Q1 Q3
Q3
Q3
0 5 10 15 20 25 30
G1 G2 G3
X
X
X
Gráfico 2: Valor Máximo, Q3, Média, Q1 e Valor Mínimo para osneovasos.
Resultado dos Testes Estatísticos: Há diferença entre as
médias (Teste de Kruskal-Wallis) e observa-se diferença significativa (Teste de Dunn), sendo GS > GG > GH (p<0,01).
Número de Pontos
4.3 ANÁLISE HISTOLÓGICA E MORFOMÉTRICA DOS
FIBROBLASTOS
Na Tabela 5 estão relacionados os valores médios dos fibroblastos de cada animal dos três grupos. Esses valores, contados no campo histológico da grade de Merz, e expressos em unidades representam a média obtida dos dez campos histológicos analisados (1A, 1B, 2A, 2B, 3A, 3B, 4A, 4B, 5A, 5B).
A média dos fibroblastos nos animais do grupo GS (9,06) foi
Tabela 5 - Valores médios dos fibroblastos presentes no campo histológico
da grade de Merz, nos animais dos grupos GG, GH e GS, em
unidades.
Grupos G
G GH GS
1 5,2 7 9,8
2 6,3 6,3 9,8 3 6,7 6,1 8,4
4 7,2 6,3 8,9
5 5,9 6,6 5,2
6 5,1 5,9 6,9
7 4,9 5,9 7,5
8 6,5 7,1 9,5
9 5,4 8 11,2
10 4,1 7,1 13,4
Média 5,73 6,63 9,06
Desvio-padrão 0,95 0,67 2,29 Valor Máximo 7,2 8,0 13,4 Valor Mínimo 4,1 5,9 5,2
Q1 5,1 6,2 7,7
Q3 6,5 7,1 9,8
FIBROBLASTOS
Gráfico 3: Valor Máximo, Q3, Média, Q1 e Valor Mínimo para os
fibroblastos.
Resultados dos Testes Estatísticos: Há diferença entre as
médias (Teste de Kruskal-Wallis) e observa-se diferença significativa (Teste de Dunn) sendo GS > GH > GG (p<0,001).
Q1 Q1 Q1 Q3 Q3 Q3 0 2 4 6 8 10 12 14 16
GG GH GS
Unidades
GG GH GS Grupos
x
x