i
MINISTÉRIO DA EDUCAÇÃO E CULTURA
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
ZINCO SÉRICO E PARÂMETROS FARMACOCINÉTICOS NA DETERMINAÇÃO DO
ESTADO CORPORAL DE ZINCO EM CRIANÇAS
SANCHA HELENA DE LIMA VALE
Natal – RN
i
SANCHA HELENA DE LIMA VALE
ZINCO SÉRICO E PARÂMETROS FARMACOCINÉTICOS NA DETERMINAÇÃO DO ESTADO CORPORAL DE ZINCO EM CRIANÇAS
Tese apresentada ao Programa de Pós-graduação em Ciências da Saúde da Universidade Federal do Rio Grande do Norte como requisito para a obtenção do título de Doutor em Ciências da Saúde.
Orientador: Prof. Dr. José Brandão Neto Coorientadora: Profa. Dra. Lúcia Dantas Leite
NATAL/RN
ii
CATALOGAÇÃO NA FONTE V149z
Vale, Sancha Helena de Lima.
Zinco sérico e parâmetros farmacocinéticos na determinação do estado corporal de zinco em crianças / Sancha Helena de Lima Vale. – Natal, 2013.
45f. : il.
Orientador: Prof. Dr. José Brandão Neto. Coorientadora: Prof.ª Dr.ª Lúcia Dantas Leite.
Tese (Doutorado) – Programa de Pós-Graduação em Ciências da Saúde. Centro de Ciências da Saúde. Universidade Federal do Rio Grande do Norte.
1. Zinco – Tese. 2. Suplementação oral de zinco – Crianças – Tese. 3. Administração venosa de zinco – Tese. 4. Clearance de zinco – Tese. I. Brandão Neto, José. II. Título.
iii
MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS DA SAÚDE
Coordenadora do Programa de pós-graduação em Ciências da Saúde: Profa. Dra. Ivonete Batista de Araújo
iv
SANCHA HELENA DE LIMA VALE
ZINCO SÉRICO E PARÂMETROS FARMACOCINÉTICOS NA DETERMINAÇÃO DO ESTADO CORPORAL DE ZINCO EM CRIANÇAS
Aprovada em 13/06/2013
Banca examinadora:
Presidente da Banca:
Prof. Dr. José Brandão-Neto Membros da Banca:
Prof. Dr. Alcides da Silva Diniz (UFPE)
Profa. Dra. Maria José de Carvalho Costa (UFPB) Profa. Dra. Severina Carla Vieira Cunha Lima (UFRN)
v
vi
AGRADECIMENTOS
À Roberto, por ser meu grande incentivador.
A Odete e Joaquim, meus pais, que me legaram a educação. À Érico, Sancha Adélia, Márcio e Adriana, minha pequena família com grande capacidade de me apoiar em todos os momentos. À Daniela, Sofia, Camila, Raquel, Larissa, Pedro e Gabriel, por me fazerem sorrir e esperar o futuro.
Aos meus amigos Bruna e Saulo que compartilharam suas experiências recentes de pós-graduação e escutaram as minhas, e Camila que me acompanhou de perto nesta empreitada. À Marília e Karina que tiveram paciência e entenderam minha objetividade. À Profa. Dra. Lúcia Leite pelos seus ensinamentos tão valiosos, pela sua amizade e por ter me inserido no grupo do Professor Dr. José Brandão-Neto a quem agradeço especialmente pela confiança, pelo estímulo, pela presença na minha vida acadêmica e por sempre tentar me ensinar a fazer ciência (espero um dia aprender!).
À Célia Márcia, Clélia, Nely, Ângela, Sandra, Larissa e Silvano pela torcida. Às Profas. Severina Carla e Karine Sena pela valiosa contribuição e arguição na minha qualificação, aos demais membros da banca Profa. Maria José Costa e Prof. Alcides Diniz, que se dispuseram a participar da finalização desta etapa.
À Betinho, Lariça e Marcelo que me ensinaram a correr e superar os meus limites.
vii
“É preciso ser leve como um pássaro, e não como a pluma”.
viii RESUMO
O zinco é um micronutriente fundamental para as funções vitais de qualquer organismo vivo e sua deficiência em humanos pode causar alterações na expressão gênica, crescimento e desenvolvimento infantil, e proteção antioxidante. Devido à sua importância, as concentrações corporais de zinco são estritamente controladas por processos homeostáticos complexos. Este controle reflete no fato da deficiência grave de zinco ser detectada apenas após privação crônica. Embora se estime que a deficiência leve seja comum, os métodos existentes para avaliação individual do estado corporal de zinco são limitados e pouco eficazes. O objetivo deste trabalho foi avaliar o zinco sérico basal e os parâmetros farmacocinéticos na determinação do estado corporal de zinco em crianças, estabelecendo relação entre esses índices. O estudo foi aprovado pelo Comitê de Ética em pesquisa do Hospital Universitário Onofre Lopes (CEP-HUOL) e 129 crianças, eutróficas e aparentemente saudáveis, entre 6 e 9 anos de idade, foram avaliadas antes e após a suplementação oral de zinco (5 mg Zn/dia) durante 3 meses. No início e fim do período houve a administração venosa de zinco (0,06537 mg de Zn/kg de peso) em 40 destas crianças para avaliação dos parâmetros farmacocinéticos por meio de três diferentes fórmulas de clearance de zinco. Os limites do CI (95%) para o zinco sérico basal variaram entre 0,94 – 1,00 e 0,91 – 0,98 μg/mL em meninas e meninos, respectivamente. Em relação aos parâmetros farmacocinéticos, a fórmula específica para um compartimento apresentou correlação positiva com o zinco sérico após a suplementação e foi efetiva em detectar mudanças no estado corporal de zinco.
ix
LISTA DE ABREVIATURAS E SIGLAS
ƶ, constante de eliminação;
ANOVA, analysis of variance (ánalise de variância); AUC, area under curve (área sob a curva);
CCr, clearance de creatinina; Cn, intercepto Y;
Co, concentração basal de zinco sérico; Cp, concentração teórica de zinco sérico; CZn, clearance de zinco;
D, quantidade da dose;
DNA, deoxyribonucleic acid (ácido desoxirribonucleico); F, fração da dose absorvida;
GFR, glomerular filtration rate (taxa de filtração glomerular); IMC, índice de massa corporal;
i.v., intravenoso;
Kel, constante de eliminação do zinco sérico;
OZnS, oral zinc supplementation (suplementação oral de zinco); RNA, ribonucleic acid (ácido ribonucleico);
SCr, serum creatinine (creatinina sérica); SZn, serum zinc (zinco sérico);
T1/2, tempo de meia-vida do zinco sérico;
x UCr, urinary creatinine (creatinina urinária);
UFRN, Universidade Federal do Rio Grande do Norte; UZn, urinary zinc (zinco urinário);
V, fluxo de urina;
Vd, volume de distribuição;
xi
LISTA DE FIGURAS
Figura 1 – Ilustração da filtração glomerular, secreção, reabsorção, e excreção renal de zinco em crianças, sob condições fisiológicas.
Figura 2 – Desenho experimental da suplementação oral de zinco.
xii SUMÁRIO
RESUMO ... viii
LISTA DE ABREVIATURAS E SIGLAS ... ix
LISTA DE FIGURAS ... xi
1 INTRODUÇÃO ... 14
2 OBJETIVOS ... 17
2.1 Objetivo geral ... 17
2.2 Objetivos específicos ... 17
3 JUSTIFICATIVA ... 18
4 MÉTODOS ... 19
4.1 Sujeitos ... 19
4.2 Critérios de inclusão e exclusão ... 19
4.3 Desenho experimental ... 19
4.4 Avaliação antropométrica... 20
4.5 Suplementação oral de zinco ... 20
4.6 Administração venosa de zinco ... 21
4.7 Abordagem renal ... 21
4.8 Aplicação de fórmulas ... 22
4.8 Materiais biológicos ... 24
4.9 Procedimentos biológicos e análises ... 25
4.10 Análise estatística ... 25
5 ARTIGOS PRODUZIDOS ... 27
5.1 Zinc pharmacokinetics parameters in the detection of body zinc state in children ... 27
5.2 Reference ranges for the concentration of zinc in serum in Brazilian children ... 29
6 COMENTÁRIOS, CRÍTICAS E CONCLUSÕES ... 31
REFERÊNCIAS ... 34
APÊNDICES ... 37
Apêndice 1 – Different Methods of clearance for diagnosing zinc deficiency in prepubertal children. ... 38
Apêndice 2 – Zinc supplementations on growth and hormonal secretion of GH, IGF1 and IGFBP3 in prepubertal children. ... 39
Apêndice 3 – Cognitive function of elementary school children improved by oral zinc suplementation. ... 40
xiii
1 INTRODUÇÃO
O zinco é um micronutriente essencial à vida humana por atuar na síntese e degradação de DNA e RNA, expressão gênica, proliferação e diferenciação celular, apoptose, estabilização de membranas e componentes celulares, sistema imunológico e hormonal, crescimento e desenvolvimento, entre outros1,2. Além disso, é constituinte estrutural, regulador e catalítico de várias enzimas e proteínas. Possui ação antioxidante, protegendo estruturas biológicas da ação de radicais livres3. Considerando sua multiplicidade de funções vitais, sua deficiência pode causar sérios problemas à saúde humana4.
No organismo humano, o zinco sofre um forte controle homeostático envolvendo processos de absorção e excreção. Sua taxa de excreção renal é relativamente baixa. Como está amplamente ligado à proteínas plasmáticas, sua passagem através dos glomérulos é ínfima5. Desse modo, o zinco urinário é oriundo quase exclusivamente da porção ultra filtrável do zinco plasmático, e aproximadamente 95% a 99% da amostra filtrável é reabsorvida pelos túbulos distais6-8 (Fig. 1).
Fig. 1 Ilustração da filtração glomerular, secreção, reabsorção, e excreção renal de zinco em criança, sob condição fisiológica.
esses valores para 140 µg/24h10. Nesse sentido, percebe-se que o estado corporal de zinco influencia proporcionalmente sua excreção. Esse fato é comprovado pela influência da administração venosa de zinco sobre a excreção urinária deste mineral. A administração venosa de zinco aumenta tanto a excreção urinária como o clearance de zinco. Esse fato foi observado em pessoas saudáveis11-13, e também, em crianças com diabetes mellitus tipo 113,14.
Em populações mundiais, a deficiência primária grave de zinco não é comum, embora, a deficiência leve desse mineral seja bastante prevalente15,16. A deficiência leve de zinco ainda não possui um método diagnóstico fidedigno. Alterações fisiológicas ou teciduais não são evidentes com o declínio da concentração sérica de zinco.
Apesar das limitações, o zinco sérico é o marcador bioquímico mais utilizado para avaliar o estado corporal de zinco, principalmente em nível populacional17,18. A esse respeito, há propostas do uso da cinética de zinco14,19,20 e marcadores moleculares18.
Existem relatos da relação entre os testes de clearance urinário e a concentração plasmática de zinco21. Outros estudos realizados posteriormente comparando crianças com baixa estatura versus controles, também demonstraram correlação entre esses dados19,22.
O clearance de uma determinada substância é o volume de plasma completamente removido da substância por unidade de tempo, e é um dos principais fatores que influenciam o perfil farmacocinético idade-dependente23. Existem diversas fórmulas matemáticas para quantificar o clearance corporal de zinco, e podemos citar a descrita por Nakamura et al. (1993) que considera o produto entre a constante de eliminação do zinco e o seu volume de distribuição, e a utilizada em um programa computacional que considera a área sob a curva dos valores de zinco determinados em momentos sequenciados24. O clearance de zinco também pode ser determinado considerando apenas a passagem renal, e vem sendo calculado considerando o zinco sérico e o zinco urinário em um período de tempo conhecido25.
zinco/clearance de creatinina indicam hiperzincúria em pacientes diabéticos, embora os valores da reabsorção tubular não tenham exibido variações biológicas significativas entre doentes diabéticos e controles8,12.
2 OBJETIVOS
2.1 Objetivo geral
Avaliar as concentrações de zinco sérico e a relação com os parâmetros farmacocinéticos na determinação do estado corporal de zinco em crianças eutróficas e saudáveis, submetidas à suplementação de zinco.
2.2 Objetivos específicos
Estabelecer os valores de referência de zinco sérico basal para a população estudada;
Avaliar os parâmetros farmacocinéticos relacionados ao estado corporal de zinco;
Relacionar as concentrações séricas de zinco com os parâmetros farmacocinéticos;
3 JUSTIFICATIVA
4 MÉTODOS
4.1 Sujeitos
Foram selecionadas por amostragem não probabilística de conveniência 215 crianças de ambos os sexos, com idades entre 6 a 9 anos, em três escolas municipais da Cidade de Natal – Brasil, entre os anos 2008 e 2011. Após aplicação dos critérios de inclusão/exclusão e tentativas de contatos com os pais ou responsáveis, foram avaliadas 129 crianças para determinação do zinco sérico basal. As 45 crianças selecionadas no ano de 2011, iniciaram a etapa de administração venosa de zinco no estudo de avaliação dos parâmetros farmacocinéticos, e após 5 desistências o estudo foi finalizado com 40 crianças.
O consentimento escrito foi obtido de todos os pais ou responsáveis, além da concordância da criança em participar do estudo. Os protocolos (nº 005/06 e 542/11) foram aprovados pelo Comitê de Ética em Pesquisa do Hospital Universitário Onofre Lopes (CEP-HUOL) da Universidade Federal do Rio Grande do Norte (UFRN), Brasil.
4.2 Critérios de inclusão e exclusão
Foram incluídas no estudo crianças aparentemente saudáveis (sem doenças agudas ou crônicas), entre 6 e 9 anos de ambos os sexos e que após avaliação médica foram categorizadas no estágio I de Tanner27,28. Quanto ao estado nutricional, foram incluídas crianças classificadas como eutróficas para o índice IMC/idade. Foram excluídas aquelas que tiveram pubarca precoce, telarca ou menarca, doenças infecciosas ou inflamatórias agudas, submetidos à cirurgia, utilizando qualquer suplemento vitamínico e mineral ou que desistiram de participar do estudo.
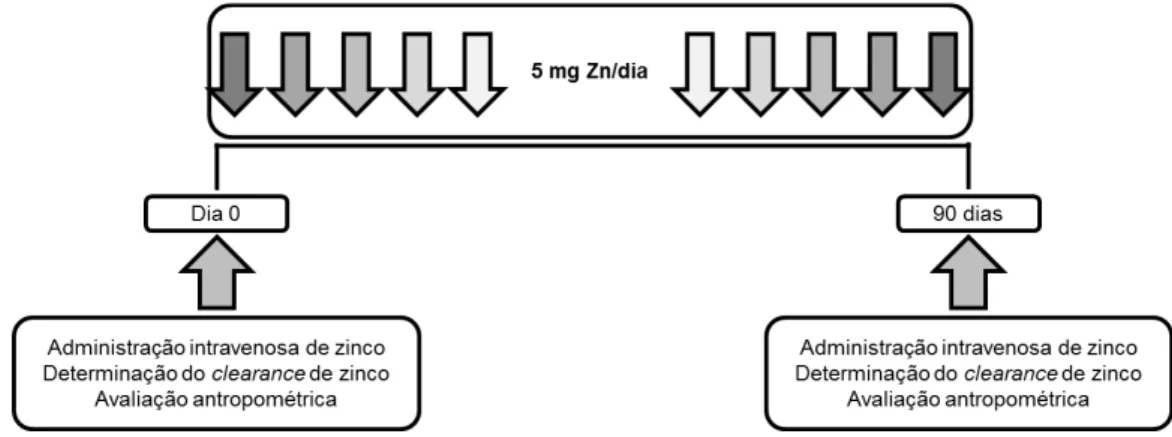
4.3 Desenho experimental
avaliação antropométrica. Foram determinadas as concentrações bioquímicas de zinco sérico, creatinina sérica, zinco urinário e de creatinina urinária.
Fig. 2. Desenho experimental da suplementação oral de zinco.
4.4 Avaliação antropométrica
O peso corporal (kg) e a altura (cm) foram aferidos utilizando-se uma balança eletrônica (Balmak, BK50F, São Paulo, Brasil) e um estadiômetro (Estadiômetro Professional Sanny, American Medical do Brasil, São Paulo, Brasil), respectivamente. Para aferição do peso, a criança permaneceu em pé sobre a balança vestindo roupas leves e sem calçados. Para aferição da altura, a criança permaneceu em pé, sem calçados, com os calcanhares juntos e o corpo o mais reto possível. Os calcanhares, glúteo, ombros e cabeça tocaram a superfície vertical do equipamento de medida. Os procedimentos foram realizados pela mesma nutricionista.
4.5 Suplementação oral de zinco
A dose suplementada (5 mg de Zn/dia) ultrapassou em 1 mg a EAR (4 mg de Zn/dia) para a faixa etária entre 6 e 8 anos, mas dentro dos limites da RDA (5 mg de Zn/dia) para esta faixa. Para as crianças com 9 anos completos, a dose ficou aquém da EAR e da RDA (7 e 8 mg de Zn/dia, respectivamente). Para todas as crianças o somatório entre zinco suplementado e o zinco proveniente da alimentação29 (dados publicados anteriormente) não ultrapassou a UL (12 e 23 mg de Zn/dia, para crianças entre 6 e 8 anos e crianças com 9 anos, respectivamente)30. Portanto, a dose escolhida foi considerada segura e fisiológica.
4.6 Administração venosa de zinco
O teste foi iniciado às 7 da manhã, após um jejum de 12 h, e concluído às 10 horas. Cada criança foi mantida em decúbito dorsal durante o procedimento. Uma veia antecubital do antebraço foi puncionada e foi infundida solução salina (livre de zinco) durante todo o ensaio. Uma dose de 0,06537 mg de Zn/kg de peso corporal (1 μmol ZnSO4.7H2O) foi injetado no tempo 0 min, em bolus. Cada ampola continha 5 mL = 40
mol ZnSO4.7H2O. Essas ampolas foram preparadas pela Injectcenter (Manipulação de Injetáveis, Ribeirão Preto, Brasil). As amostras de sangue foram colhidas aos tempos 0 (antes da administração de zinco), 30, 60, 90, e 120 minutos (após a administração de zinco), como mostrado na Figura 3. Seringas de plástico polipropileno foram utilizadas em todas as coletas de sangue.
4.7 Abordagem renal
Fig. 3. Esquema da administração intravenosa de zinco para avaliar os parâmetros de clearance de zinco em crianças com idade entre 6 e 9 anos.
4.8 Aplicação de fórmulas
Os métodos cinéticos de clearance de zinco foram:
1) CZn-Fórmula A. Clearance do zinco corporal total baseada na área trapezoidal sob a curva (AUC), considerando aplicação i.v. Usamos as fases de eliminação e de distribuição24. Esta é a fórmula geral usada para todos os modelos farmacocinéticos de compartimentos:
Onde,
CZn = Clearance de zinco,
F = fração da dose absorvida, para doses i.v. F=1. D = quantidade da dose,
AUC (∞) = AUC total calculado a partir da combinação de AUC(0-t), com um valor extrapolado. AUC (∞) = AUC(0-t) + Cn/ƶ, Cn, Cn representa o intercepto Y e ƶ a constante da taxa de eliminação.
2) CZn-Fórmula B. Clearance de zinco corporal total. Fórmula usada para modelos farmacocinéticos de um compartimento, calculada a partir da seguinte equação31:
Onde,
Kel = constante de eliminação do zinco sérico, Vd = volume de distribuição.
Kel e Vd foram calculados da seguinte forma: Kel = 0.693/ T1/2
Vd = dose i.v./ ΔCo,
Onde, ΔCo = diferença entre Cp e Co. Cp = concentração teórica de zinco imediatamente depois da injeção de zinco, calculado a partir da concentração sérica versus período de tempo. Co = concentração basal de zinco. T1/2 = tempo de meia-vida do zinco sérico calculado diretamente a partir da concentração de zinco sérico versus período de tempo. Dose i.v. = quantidade de zinco administrada.
3) CZn-Fórmula C. Clearance renal de zinco, determinado a partir da equação25:
Onde,
CZn = clearance renal de zinco UZn = zinco urinário (μg/mL)
CZn = Kel x Vd
V = fluxo de urina (mL/min) SZn = zinco sérico (μg/mL)
Também foram determinados o clearance renal de creatinina e a reabsorção tubular de zinco, calculadas como segue25:
Onde,
CCr = clearance de creatinina Ucr = creatinina urinária (mg/mL) V = fluxo de urina (mL/min) SCr = creatinina sérica (mg%)
Onde,
TRZn = reabsorção tubular de zinco
GFR = taxa de filtração glomerular (mL/min) SZn = zinco sérico
UZn = zinco urinário (μg/mL) V = fluxo de zinco (mL/min) m2 = área da superfície corporal
4.8 Materiais biológicos
As amostras de sangue para análises de zinco foram coletados em tubos Vacutainer Becton Dinckson (Trace Element, Soro, BD Franklin Lakes, NJ, EUA), e as de sangue para análises bioquímicas foram coletados em tubos Vacuette Z com soro ativador coágulo (Greiner Bio-One, Monroe, NC, EUA). As amostras de zinco foram armazenados
CCr = [Ucr x V]/ SCr
em uma estufa de aço inoxidável adequada para metais (Orion, Fanem, São Paulo, SP, Brasil). As amostras de urina foram colhidas em provetas livres de metais e cubas de plástico (Nalgon, Itupeva, SP, Brasil). As soluções salinas (livres de metais) foram adquiridas de Gaspar Viana S/A (Fortaleza, CE, Brasil) e seringas de polipropileno de Becton Dinckson (Hercules, CA, EUA). Ponteiras de plástico e tubos (livres de metal) foram obtidos de BioRad Laboratories (Hercules, CA, EUA).
4.9 Procedimentos biológicos e análises
As amostras de sangue foram colhidas por punção de uma veia do antebraço sem uso de torniquete. As amostras de zinco foram armazenadas à temperatura ambiente em uma estufa para metais durante 2 horas e em seguida foram centrifugadas a 2500 rpm por 6 minutos a fim de se obter soro. Amostras hemolisadas foram descartadas, uma vez que os eritrócitos são ricos em zinco32. As amostras de soro e urina foram armazenadas a -20 ºC, para posterior mensuração.
O zinco sérico e urinário foi medido por espectrofotometria de absorção atômica (SpectrAA-200, Varian, Victoria, Austrália). O aparelho foi previamente calibrado, após estabelecimento de uma curva de linearidade (r²>0,999) a partir de concentrações crescentes (0–1,0 mg/L em ppm) solução-padrão versus absorbância. A solução-padrão de zinco (1000 mg/mL) foi obtida por diluição de Titrisol Zinc Standard (Merck, Darmstadt, Germany) em água ultra pura. A sensibilidade foi de 0,01 μg/mL, o coeficiente de variação intra-ensaio foi de 2,37%, e os valores de referência foram 70-110 μg/dL16. Creatinina sérica e urinária foi determinada, usando métodos padrão do laboratório clínico e as análises realizadas por meio do analisador semiautomático RA-50 (Bayer Diagnostics, Dublin, Irlanda). Todos os procedimentos relacionados com a manipulação de amostras de zinco foram realizados de acordo com normas internacionais17.
4.10 Análise estatística
5 ARTIGOS PRODUZIDOS
5.1 Zinc pharmacokinetics parameters in the detection of body zinc state in children
5.2 Reference ranges for the concentration of zinc in serum in Brazilian children
Sancha Helena de Lima Vale, Camila Xavier Alves, Karina Marques Vermeulen, Márcia Marília Gomes Dantas, Lúcia Dantas Leite, José Brandão-Neto
Abstract
Background: Zinc is considered an essential micronutrient for the development and maintenance of life, and its deficiency can cause many problems in humans. This micronutrient has diverse biological functions in enzymatic catalysis, redox regulation, cellular signal transduction, the immune system, and neurons. The global prevalence of zinc deficiency is variable and depends on the feeding and nutrition of the population. For this reason, it is important that different countries and regions establish its own reference values for a healthy population. Objectives: To determine the reference values for basal serum zinc concentration in apparently health Brazilian children aged 6–9 years, both sexes, from municipal schools in Natal between 2008 and 2012. Design and methods: Blood samples were collected in fasting and basal serum zinc concentration was measured by flame atomic absorption spectrometry in 129 children. Reference values for serum zinc were determined according to the International Federation of Clinical Chemistry guidelines. The normality of data was assessed using the Kolmogorov–Smirnov test and reference intervals were based on the central 95% of the data considering 95% confidence intervals. Results: The distribution of serum zinc concentrations was normal in both sexes, and CI (95%) reference values for serum zinc concentrations were 0.94–1.00 and 0.91–0.98 μg/mL in girls and boys, respectively. These concentrations were not significant different between the sexes (p=0.884). Conclusions: This study provides pediatric reference values of the order of 0.91-1.0 μg/mL, which can guide the diagnosis and follow up of children with zinc deficiency.
6 COMENTÁRIOS, CRÍTICAS E CONCLUSÕES
O anteprojeto inicial tinha como finalidade a comparação entre três métodos cinéticos de medida do zinco quanto à sensibilidade analítica, precisão, acurácia e mensuração. A metodologia não pôde ser realizada tal como planejado, pois ao iniciar estudos mais aprofundados sobre o tema, surgiu a necessidade de relacionar os parâmetros cinéticos aos valores de zinco sérico. Esta nova situação se mostrou desafiadora à medida que houve a necessidade de estabelecer valores de referência de zinco sérico para a população de crianças que vem sendo estudada nos últimos anos pelo nosso grupo.
Esta foi a primeira vez que um novo desenho metodológico, com a participação multi e interdisciplinar de nutricionistas, médicos e farmacêuticos, foi aplicado para observar o estado de zinco corpóreo, avaliando o zinco sérico e utilizando métodos de depuração de zinco em crianças. A este respeito, estes resultados proporcionaram novas informações para compreender os marcadores de zinco bem como a cinética deste micronutriente, e sua publicação, certamente, será muito importante para a comunidade científica.
Ao ingressar no Programa de Pós-graduação em Ciências da Saúde, tinha como meta não só a obtenção do título de Doutor, mas o fortalecimento e divulgação científica das pesquisas realizadas pelo nosso grupo. Com este intento, tivemos os seguintes trabalhos publicados em congressos científicos:
Vale SHL; Dantas MMG, Alves CX, Brito NJN, Leite LD, Brandão-Neto J. Different methods of clearance for diagnosing zinc deficiency in prepubertal children. In: International Conference on Growth and Nutrition, 2012, Paris. International Conference on Growth and Nutrition, 2012. (Apêndice 1)
Alves CX, Vale SHL, Brito NJN, Dantas MMG, Maia AA, Leite LD, Brandão-Neto J. Zinc supplementations on growth and hormonal secretion of GH, IGF1 and IGFBP3 in prepubertal children. In: International Conference on Growth and Nutrition, 2012, Paris. International Conference on Growth and Nutrition, 2012. (Apêndice 2)
Baracho MFP, Leite LD, Vale SHL, Aalves CX, Santos MGN, Farjado CM, Hirata MH, Brandão-Neto J. Association of PPAR-gamma2 polymorphism on lipid profile in Berardinelli-Seip syndrome. In: 6th Congress of the International Society of Nutrigenetics / Nutrigenomics, 2012, São Paulo. 6th Congress of the International Society of Nutrigenetics / Nutrigenomics, 2012. (Apêndice 4)
Também foram publicados e submetido para publicação artigos em jornais de circulação internacional categorizadas no Qualis B da CAPES, como:
Alves CX, Vale SHL, Dantas MMG, Maia AA, França MC, Marchini JS, Leite LD, Brandão-Neto J. Positive effects of zinc supplementation on growth, GH, IGF1, and IGFBP3 in eutrophic children. Journal of Pediatric Endocrinology & Metabolism, v. 9-10, p. 813-1049, 2012. (Apêndice 5);
Santos MGN, Baracho MFP, Vale SHL, Leite LD, Rocha EDM, Brito NJN, França MC, Almeida MG, Chiquetti SC, Marchini JS, Brandão-Neto, José. Kinetics of zinc status and zinc deficiency in Berardinelli-Seip syndrome. Journal of Trace Elements in Medicine and Biology, v. 26, p. 7-12, 2012. (Apêndice 6);
Quirino MAB, Modesto-Filho J, Vale SHL, Alves CX, Leite LD, Brandão-Neto, José. Influence of basal energy expenditure and body composition on bone mineral density in postmenopausal women. International Journal of General Medicine, p. 909-915, 2012. (Apêndice 7);
Moura JE, Moura ENO, Alves CX, Vale SHLV, Dantas MMG, Silva AA, Almeida MG, Leite LD, Brandão-Neto J. Oral zinc supplementation may improve cognitive function in schoolchildren. Biological Trace Elements Research. (submetido para publicação – Apêndice 8).
Foi recém-finalizada a etapa experimental da pesquisa desenvolvida por nosso grupo “Efeito do zinco sobre o crescimento e marcadores ósseos de crianças eutróficas”, com abordagem de composição corporal, avaliação hormonal e expressão de proteínas relacionadas ao metabolismo ósseo, que em breve, após avaliação dos resultados, será elaborado o texto para divulgação científica.
Além da minha inserção no grupo de pesquisa como aluna, durante o primeiro semestre do doutorado fui aprovada no concurso para professora substituta na área de Nutrição do Departamento de Nutrição da UFRN assumindo no semestre letivo 2011.2 os componentes curriculares: Nutrição Aplicada à Saúde (para o curso de Medicina), Nutrição Aplicada à Educação Física (para o curso de Educação Física) e Processos e Interações Nutricionais (para o curso de Enfermagem). Experiências que se somaram à minha atuação anterior ao ingresso no doutorado como professora substituta, da área de Nutrição Clínica nos componentes curriculares: Dietoterapia e Estágio Supervisionado em Nutrição Clínica (nos períodos letivos 2008.1 a 2010.1) no Departamento e Instituição supracitados, as quais me propiciaram coorientações de trabalhos de conclusão de curso e participação em bancas de defesa.
Tive ainda a oportunidade de ser bolsista do Programa CAPES/REUNI, ação que me proporcionou a participação do curso de Formação para a Docência e três semestres de Estágio à Docência, sendo dois no componente curricular Genética para a Nutrição e outro em Dietoterapia II, ambos oferecidos pelo curso de graduação em Nutrição da UFRN.
Em relação à docência, esta me permitiu a participação como professora no Curso de Especialização em Nutrição Clínica, oferecido pela Universidade Potiguar, resultando na orientação de dois trabalhos de conclusão nesta área, e ainda a participação como palestrante em cursos e congressos regionais na área de Nutrição.
Atuando como Nutricionista voluntária do Ambulatório Multidisciplinar de Esclerose Lateral Amiotrófica do Hospital Universitário Onofre Lopes (ELA/HUOL), pude me envolver no projeto de extensão: “Ambulatório multidisciplinar para atendimento de portadores de DNM/ELA” que tem a participação de professores e alunos da UFRN, além de profissionais voluntários de várias outras áreas da saúde, visando dar suporte aos pacientes com esta doença.
REFERÊNCIAS
1. Mafra D, Cozzolino SMF. The importance of zinc in human nutrition. Rev Nutr. 2004; 17(1):79-87.
2. Stefanidou M, Maravelias C, Dona A, Spiliopoulou C. Zinc: a multipurpose trace element. Arch Toxicol. 2006; 80(1):1-9.
3. Person OC, Botti AS, Feres MCLC. Clinical repercussions of zinc deficiency in human beings. Arq Med ABC. 2006; 31(1):46-52.
4. Saper RB, Rash R. Zinc: an essential micronutrient. Am Fam Physician. 2009; 79(9):768-778.
5. Giroux EL, Henkin RI. Competition for the zinc among serum albumin and amino acids. Biochem Biophys Acta. 1972; 273(1):64-73.
6. Yunice AA, King RW Jr, Kraikitpanitch S, Haygood CC, Lindeman RD. Urinary zinc excretion following infusions of zinc sulfate, cysteine, histidine or glycine. Am J Physiol. 1978; 235(1):F40-F45.
7. Victery W, Smith JM, Vander AJ. Renal tubular handling of zinc in the dog. Am J Physiol. 1981; 241(5):F532-F539.
8. Brandão-Neto J, Silva CAB, Rezende AA, Almeida MG, Sales VSP, Marchini JS. Zinc pharmacokinetics in insulin-dependent diabetes mellitus patients after oral zinc tolerance test. Nutr Res. 2003; 23(2):141-150.
9. Delves HT. Assessment of trace element status. In: Taylor A (ed). Clinics in endocrinology and metabolism – trace elements in human disease. 3 ed. Eastbourne: WB Saunders Co., 1965. p.725-760.
10. Baer MI, King JC. Tissue zinc levels and zinc excretion during experimental zinc depletion in young men. Am J Clin Nutr. 1984; 39(4):556-570.
11. Brandão-Neto J, Shuhama T, Pimenta WP, Piesco RV, Castro AVB, Mazeto GMGS, Chung JS, Franco RJS, Curi PR. Renal excretion of zinc in normal individuals during zinc tolerance-test and glucose-tolerance test. Trace Elem Eletrol. 1995; 12(2):62-67. 12. Brandão-Neto J, Silva CAB, Figueiredo NB, Shuhama T, Holanda MBS, Diniz JMM.
Zinc kinetics in insulin-dependent diabetes mellitus patients. BioMetals. 2000; 13(2):141-145.
13. Brandão-Neto J, Silva CAB, Shuhama T, Silva JA, Oba L. Renal handling of zinc in insulin-dependent diabetes mellitus patients. BioMetals. 2001; 14(1):75-80.
15. International Zinc Nutrition Consultative Group (IZiNCG), Brown KH, Rivera JA, Bhutta Z, Gibson RS, King JC et al. Assessment of the risk of zinc deficiency in populations and options for its control. Food Nutr Bull. 2004;25(1):S99-203.
16. Gibson RS, Hess SY, Hotz C, Brown KH. Indicators of zinc status at the population level: a review of the evidence. Br J Nutr. 2008;99(3):S14-23.
17. Lowe NM, Fekete K, Decsi T. Methods of assessment of zinc status in humans: a systematic review. Am J Clin Nutr. 2009;89(6):2040S-51S.
18. Ryu MS, Langkamp-Henken B, Chang SH, Shankar MN, Cousins RJ. Genomic analysis, cytokine expression, and microRNA profiling reveal biomarkers of human dietary zinc depletion and homeostasis. Proc Natl Acad Sci USA. 2011;108(52):20970-5.
19. Leite LD, Rocha EDM, Almeida MG, Rezende AA, da Silva CA, França MC et al. Sensitivity of zinc kinetics and nutritional assessment of children submitted to venous zinc tolerance test. J Am Coll Nutr. 2009;28(4):405-12.
20. Santos MG, Baracho MD, Vale SH, Leite LD, Rocha ED, de Brito NJ, et al. Kinetics of zinc status and zinc deficiency in Berardinelli-Seip syndrome. J Trace Elem Med Biol. 2012;26(1):7-12.
21. Nakamura T, Nishiyama S, Futagoishi Y, Matsuda I, Higashi A. Mild to moderate zinc deficiency in short children: effect of zinc supplementation on growth velocity. J Pediatr. 1993;123(1):65-9.
22. Kaji M, Gotoh M, Tagaki Y, Masuda H, Kimura Y, Uenoyama Y. Studies to determine the usefulness of the zinc clearance test to diagnose marginal zinc deficiency and the effects of oral zinc supplementation for short children. J Am Coll Nutr. 1998;17(4):388-91.
23. Edginton AN, Schmitt W, Voith B, Willmann S. A mechanistic approach for the scaling of clearance in children. Clin Pharmacokinet. 2006;45(7):683-704.
24. PK Solutions 2.0TM Summit Research Services. Pharmacokinetics and Metabolism Software. Internet: http://www.summitpk.com/ 2012.
25. Ritschel WA, Kearns GL. Handbook of basic pharmacokinetics... including clinical applications. 7th ed. Washington: American Pharmacists Association; 2009.
26. King JC, Shames DM, Woodhouse LR. Zinc homeostasis in humans. J Nutr. 2000;130(5):1360S-6S.
28. Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in boys. Arch Dis Child.1970; 45(239):13–23.
29. Xavier CA, Vale SHL, Dantas MMG, Maia AA, Franca MC, Marchini JS, Leite LD, Brandao-Neto J. Positive effects of zinc supplementation on growth, GH, IGF1, and IGFBP3 in eutrophic children. J Pediatr Endocr Met 2012; 25(9-10): 881–887
30. Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc. Washington, DC: National Academy Press, 2001.
Apêndice 1 –Different Methods of clearance for diagnosing zinc deficiency in
Apêndice 2 –Zinc supplementations on growth and hormonal secretion of GH, IGF1
Apêndice 3 –Cognitive function of elementary school children improved by oral
Apêndice 4 –Association of PPAR-Gamma2 Polymorphism on Lipid Profile in
Apêndice 5 –Positive effects of zinc supplementation on growth, GH, IGF1, and
Apêndice 6 –Kinetics of zinc status and zinc deficiency in Berardinelli-Seip
Apêndice 7 –Influence of basal energy expenditure and body composition on bone
Apêndice 8 –Oral zinc supplementation may improve cognitive function in