UNIVERSIDADE ESTADUAL PAULISTA “JÚLIO DE MESQUITA FILHO”
FACULDADE DE CIÊNCIAS AGRONÔMICAS
CÂMPUS DE BOTUCATU
AVALIAÇÃO DO ARMAZENAMENTO DE PLÂNTULAS COMO
ALTERNATIVA NA PROPAGAÇÃO DE PALMITEIRO Euterpe
edulis Martius
GISELAINE DE SOUZA E SILVA
Orientadora: Profa. Dra. Ana Catarina Cataneo Co-orientador: Prof. Dr. Edson Seizo Mori
Dissertação apresentada à Faculdade de Ciências Agronômicas da UNESP – Câmpus de Botucatu, para a obtenção de título de Mestre em Ciência Florestal
FICHA CATALOGRÁFICA ELABORADA PELA SEÇÃO TÉCNICA DE AQUISIÇÃO E TRATAMENTO DA INFORMAÇÃO – SERVIÇO TÉCNICO DE BIBLIOTECA E DOCUMENTAÇÃO - UNESP - FCA - LAGEADO - BOTUCATU (SP)
Souza e Silva, Giselaine, 1965-
S729a Avaliação do armazenamento de plântulas como
alternativa na propagação de palmiteiro Euterpe edulis
Martius / Giselaine de Souza e Silva. – Botucatu : [s.n.], 2010
xiv, 55 f. : il. color., gráfs. color., tabs. Dissertação (Mestrado) – Universidade Estadual
Paulista, Faculdade de Ciências Agronômicas, Botucatu, 2010
Orientador: Ana Catarina Cataneo Co-orientador: Edson Seizo Mori Inclui bibliografia
1. Armazenamento. 2. Câmara fria. 3. Euterpe edulis. 4. Plântulas. I. Cataneo, Ana Catarina. II. Mori, Edson Seizo. III. Universidade Estadual Paulista “Júlio de Mesquita Filho” (Campus de Botucatu). Faculdade de Ciências Agronômicas. IV. Título.
A Deus
Dedico
Epígrafe
Sementes são promessas de vida e de futuro. Não há nada mais lindo, nem mais importante.
Desvendar seus mistérios é aventurar-se nos meandros da criação.
Agradeço
A água, riqueza maior que mantém toda a vida.
Ao solo brasileiro que respondeu prontamente aos anseios daqueles que vieram de longe a procura de sustento.
A diversidade animal e vegetal que nos faz sentir apenas um elo nessa cadeia, tão vulnerável, tão dependente dela e no entanto responsável pela sua continuidade.
Aos meus antepassados, com quem aprendi muito cedo a lição mais
valiosa: "O amor a terra porque ela é a mãe generosa de onde provem toda a vida".
A minha orientadora, Profª Dra. Ana Catarina, pela imensa doçura com que me acolheu, pela paciência nos momentos que eu não correspondi as expectativas, pelo exemplo de profissionalismo, dedicação e amor ao trabalho e a família. Por todo o aprendizado, meu mais profundo agradecimento.
Ao co-orientador e idealizador desta pesquisa, o Prof. Dr. Edson Seizo Mori, pela oportunidade, pela amizade e inúmeras lições de generosidade, doação e amor a ciência.
A minha filha Lamis, a semente mais preciosa que recebi, germinou em mim, acompanhei seu crescimento a cada dia e agora vejo florescer.
Ao Jose Aidar Salle (in memorian) pela alegria da partilha do tempo em que estivemos juntos, porque o amor permanece.
A minha irmã Simone, fonte de compreensão e sabedoria, por ter sempre resposta a minhas indagações e pelo amor e apoio incondicional.
Ao meu irmão Giovani pela amizade, carinho, generosidade e pela disponibilidade, sempre de seu tempo, pela paciência e desprendimento.
Ao meu cunhado e irmão Ademilson (in memorian) pela compreensão, apoio, carinho, pela ajuda nos momentos difíceis pela causa animal, pelo exemplo e saudade que nos deixou.
A minha cunhada Juliana, aos meus sobrinhos: Jordão, Beatriz, Flávia e Daniel pelo carinho hoje e sempre.
A minha irmã Márcia, pelo amor, companheirismo e solidariedade nos momentos mais difíceis, pela generosidade e imenso coração acolhedor, com quem posso contar sempre em qualquer situação.
A amiga Roseli Versegnossi, pela ajuda e apoio em momentos muito difíceis.
Ao coordenador do programa de pós graduação em Ciência Florestal, o Prof. Dr. Iraê Amaral Guerrini, pela dedicação, comprometimento e doação ao programa, e por procurar desenvolver o potencial de cada um a sua volta.
A professora Magali pela disponibilidade, amizade e pela preciosa ajuda no desenvolvimento desse trabalho.
A minha grande amiga Neide Mori, minha família em Botucatu.
As grandes amigas Maíra e Gisely pela ajuda inestimável nas análises laboratoriais desse trabalho,
A todos os amigos e colegas que fiz durante o andamento dessa pesquisa, em especial a Thalita, Regininha, Juliana Rosa e ao Danilo pela indispensável ajuda com a estatística.
A bibliotecária Janaína Celoto Guerrero, pela simpatia e grande auxilio na revisão das referências bibliográficas.
A todos os amigos do viveiro da FCA Edson, Claudinho, Sr. João, Martinelli, Dicão e Chiquinho com quem sempre pude contar, agradeço pela amizade, pela ajuda e principalmente pelo cuidado com minhas plantas da pesquisa.
A Faculdade de Ciências Agronômicas UNESP/Botucatu, ao Programa da Ciência Florestal e a Capes pela bolsa de mestrado.
Finalmente quero agradecer a todos que de alguma forma contribuíram para a conclusão
SUMÁRIO
Página
LISTA DE TABELAS ………... XII
LISTA DE FIGURAS ………. XIII
1 RESUMO ………. 1
2 SUMMARY ……… 3
3 INTRODUÇÃO ……… 5
4 REVISÃO DA LITERATURA ……… 6
4.1 Características botânicas e distribuição geográfica de palmeiras ... 6
4.2 Importância ecológica das palmeiras ... 7
4.3 Importância econômica das palmeiras ... 8
4.4 Palmeira Juçara (Euterpe edulis Martius) ... 9
4.4.1 Ontogenia da palmeira juçara ... 11
4.5 Germinação de sementes de palmeiras ... 13
4.6 O armazenamento de sementes ... 15
4.7 Aspectos bioquímicos em germinação de sementes ... 16
5 MATERIAL E MÉTODOS ... 17
5.1 Material vegetal ... 17
5.2 Condução do experimento ... 17
5.3 Análises de desenvolvimento ... 23
5.4 Delineamento experimental ... 24
5.5 Análises bioquímicas ... 25
5.5.1 Coleta das amostras ... 25
5.5.3 Determinação da atividade da peroxidase ... 26
5.5.4.Determinação do teor de proteínas solúveis totais nos extratos enzimáticos... 27
5.6 Análises Estatísticas ... 28
6 RESULTADOS E DISCUSSÃO ... 29
6.1 Análise da taxa de sucesso de plântulas ... 29
6.2 Avaliação dos fatores CG e CF nas variáveis contínuas: diâmetro do coleto, comprimento da parte aérea, comprimento da parte aérea total, comprimento de raiz, massa de matéria fresca e massa de matéria seca... 35
6.3 Análise da atividade da peroxidase ... 41
7 CONCLUSÕES ... 47
LISTA DE TABELAS
Página
1. Períodos de armazenamento das sementes de Euterpe edulis em câmara de
germinação e em câmara fria ... 21
2. Critérios de classificação das sementes e/ou plântulas de Euterpe edulis, de acordo com seu estádio germinativo ... 22
3. Construção do modelo logístico ... 28
4. Número de sementes e/ou plântulas de Euterpe edulis no momento de transferência para o viveiro e Número de plântulas com desenvolvimento normal e Porcentagem de sucesso de sementes e/ou plântulas após o período de permanência de 6 meses em viveiro, baseado em seu estádio germinativo(*)... 30
5. Valores de significância do ajuste coeficiente de determinação do modelo para as diferentes variáveis analisadas ... 38
6. Análise de variância da regressão para a variável comprimento de raiz ... 39
7.Estatística descritiva da atividade da peroxidase (POD) ... 42
8. Análise de variância do log POD ... 44
LISTA DE FIGURAS
Página
1. Aspecto geral da palmeira Juçara ....………... 10
2. Aspecto geral dos frutos e das sementes de Euterpe edulis ... 19
3. Tubetes contendo as plântulas e/ou sementes de Euterpe edulis, durante a permanência no viveiro ... 20
4. Temperaturas médias durante o período de desenvolvimento vegetativo das plântulas no viveiro ... 22
5. Plântula de Euterpe edulis e desenho esquemático dos parâmetros avaliados ... 24
6. Esquema da técnica da extração enzimática ... 25
7. Esquema da técnica de determinação da peroxidase ... 26
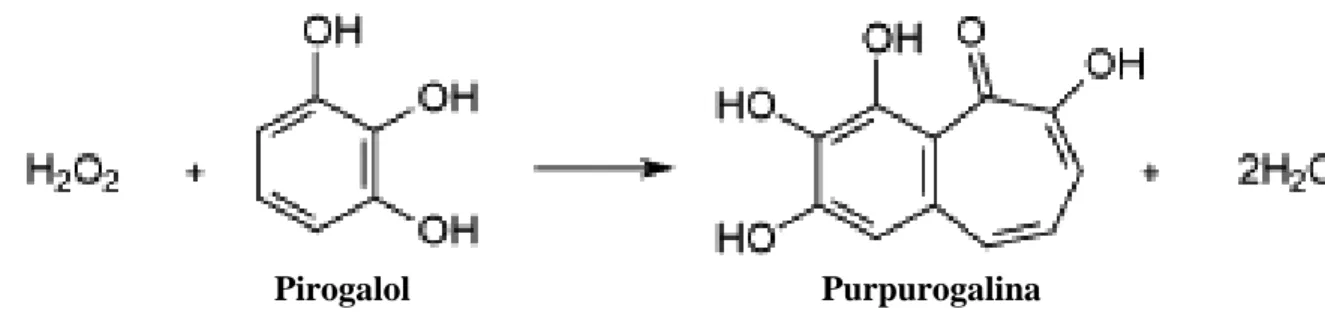
8. Reação catalisada pela peroxidase, com a utilização de pirogalol como substrato ... 26
9. Esquema da técnica de quantificação de proteínas solúveis nos extratos enzimáticos ... 27
10. Relação da Porcentagem de sucesso de plântulas de Euterpe edulis obtidas no final do experimento a partir de sementes/plântulas em diferentes estádios germinativos e os tratamentos em câmara de germinação, sem tratamento de câmara fria ... 31
11. Relação da Porcentagem de sucesso de plântulas de Euterpe edulis obtidas no final do experimento a partir de sementes/plântulas em diferentes estádios germinativos e os tratamentos em câmara de germinação e câmara fria por período de 3 meses ... 31
12. Relação da Porcentagem de sucesso de plântulas de Euterpe edulis obtidas no final do experimento a partir de sementes/plântulas em diferentes estádios germinativos e os tratamentos em câmara de germinação e câmara fria por período de 6 meses ... 32
14. Relação entre a taxa de sucesso da plântula (em termos relativos) e os fatores CG (período em câmara de germinação) e CF (período em câmara fria) ... 33
15. Relação entre o comprimento da parte aérea e os fatores período na câmara de germinação (CG) e período na câmara fria (CF) ... 35
16. Relação entre o comprimento total da parte aérea e os fatores período na câmara de germinação (CG) e período na câmara fria (CF) ... 35
17. Relação entre o diâmetro do coleto e os fatores período na câmara de germinação (CG) e período na câmara fria (CF) ... 36
18. Relação entre a massa de matéria fresca e os fatores período na câmara de germinação (CG) e período na câmara fria (CF) ... 36
19. Relação entre a massa de matéria seca e os fatores período na câmara de germinação (CG) e período na câmara fria (CF) ... 37
20. Relação entre o comprimento de raiz e os fatores período em Câmara de Germinação (CG) e período em câmara fria (CF) ... 37
21. Relação entre Atividade de Peroxidase e os tratamentos em Câmara de Germinação (CG) e Câmara Fria (CF) ... 43
1. RESUMO
raiz) analisados das sementes/plântulas, portanto, o armazenamento em câmara fria é um instrumento viável para prolongar o período de uso das sementes de Euterpe edulis, para propagação desta espécie.
EVALUATION OF SEEDLING STORAGE AS AN ALTERNATIVE IN THE PROPAGATION OF THE PALM TREE Euterpe edulis Martius. Botucatu, 2010. 58p. Dissertation (Master’s in Forest Science) – Faculty of Agronomical Sciences, São Paulo State University.
Author: GISELAINE DE SOUZA E SILVA Adviser: ANA CATARINA CATANEO Co-adviser: EDSON SEIZO MORI
2. SUMMARY
and storage in cold chamber. Among the morphological traits of development analyzed at the end of the experiment (shoot length, total shoot length, root length, stem diameter, fresh matter and dry matter), only root length decreased under such conditions. Peroxidase activity increased due to the longer period of storage in cold chamber, which was related to the senescence of seedlings. Despite the reduction in the success rate of seedlings, there was no decrease of vegetative developmental traits (except root length) analyzed in seeds/seedlings. Therefore, the storage in cold chamber is a viable instrument to extend the use of seeds for propagation of Euterpe edulis.
3. INTRODUÇÃO
No Brasil, várias palmeiras produzem palmito comestível, mas as do gênero
Euterpe são mais exploradas comercialmente. Entre elas, a espécie mais conhecida e apreciada é a Euterpe edulis Mart., conhecida como Palmiteiro Juçara que é uma palmeira nativa do domínio da Floresta Tropical Atlântica do Brasil, encontrada originalmente desde o sul da Bahia, até o norte do Rio Grande do Sul (REIS & KAGEYAMA, 2000).
A redução da cobertura florestal na Mata Atlântica e a superexploração do palmiteiro, vem reduzindo a densidade de populações naturais da espécie, comprometendo sua regeneração natural, principalmente nas regiões sul e sudeste do país, tornando-a uma espécie vulnerável à extinção (DRANSFIELD et al., 1988).
A propagação do palmiteiro é feita através de sementes. Sua germinação é geralmente lenta e desuniforme (TSUKAMOTO FILHO, 1999); as sementes perdem o poder germinativo rapidamente após o ponto de maturidade fisiológica, não tolerando armazenamento por longos períodos, portanto, dificultando a produção de mudas (BOVI & CARDOSO, 1978).
Segundo Reis (1995), a estratégia típica reprodutiva da espécie envolve a manutenção de um banco de plântulas, com média de 12.000 plântulas por hectare.
4. REVISÃO DA LITERATURA
4.1. Características botânicas e distribuição geográfica das palmeiras
As palmeiras consideradas como símbolo de florestas tropicais estão entre as plantas mais antigas do globo, seus vestígios remontam a mais de 120 milhões de anos (LORENZI 1996). Constituem um dos mais importantes grupos da flora brasileira, não só pela abundância de espécies, mas pelas inúmeras interações com outros organismos, além do fato de ser uma espécie de uso múltiplo pelo homem (MENDONÇA, 1996).
Sua longa história na floresta neotropical tem permitido as palmeiras adaptarem-se as condições particulares existentes e a outros componentes do ecossistema da floresta adaptarem-se a elas. (SVENNING, 2001). Padrões de diversidade e abundância de palmeiras nos trópicos estão primariamente relacionados com o total e a sazonalidade da precipitação pluvial e temperatura, e secundariamente com condições edáficas (SVENNING, 2001).
São plantas da família Arecaceae (Palmae), com cerca de 2600 espécies em mais de 240 gêneros distribuídos pelo mundo e a maior diversidade de gêneros e espécies são encontradas nas regiões tropicais da Ásia, Indonésia, ilhas do Pacífico e Américas (LORENZI, 1996).
único, vários em forma de touceiras ou caule subterrâneo, mas não ramificados e as folhas são formadas por bainha, pecíolo e lâmina foliar (LORENZI, 1996).
Suas inflorescências são formadas por brácteas pedunculares, raques e ramos florais, elas podem ser monóicas ou dióicas e suas flores podem ser hermafroditas ou unissexuadas (LORENZI, 1996).
Os frutos são formados geralmente por três camadas distintas, epicarpo, mesocarpo e endocarpo. Quando envolvidas por endocarpo duro os frutos são denominados drupa, como no caso do gênero Euterpe e podem ser considerados baga, quando envolvidas por endocarpo mole (LORENZI, 1996).
As sementes de palmeiras apresentam endosperma ou albúmen duro que é uma massa de tecido nutritivo onde está embutido o embrião pequeno e mole (LORENZI, 1996).
4.2. Importância ecológica das palmeiras
As palmeiras são produtoras de frutos, que devido a grande quantidade de óleos e carboidratos (ZONA & HENDERSON, 1989) são importantes como fonte alimentar para a fauna ao longo do ano, já que apresentam pouca sincronia de frutificação quando comparada a outras espécies vegetais do mesmo bioma (GALETTI, 1996), sendo por isso chamadas com freqüência de “espécies chave” (PERES, 2000), podendo causar colapso na comunidade animal se estiverem ausentes. Neste sentido é importante ressaltar que a perda significativa das interações entre os animais e as plantas é um dos principais fatores de extinção das espécies
(GALETTI, 2001).
A dispersão de sementes, processo pelo qual as sementes são removidas das imediações da planta-mãe para distâncias “seguras”, onde a predação e competição são mais baixas, é um processo-chave dentro do ciclo de vida da maioria das plantas, especialmente em ambientes tropicais (HOWE & MIRITI, 2004).
4.3. Importância econômica das palmeiras
Grande número de palmeiras é explorado comercialmente na produção de óleo, amido, palmito, cera e fibras. São ainda utilizadas como fonte de alimento, bebidas e como matéria-prima na construção de barcos, pontes, casas e outros objetos. Pela exuberância e beleza são apreciadas também na ornamentação de praças, jardins e ambientes internos (SANTELLI, 2005).
Algumas palmeiras, como o buriti (Mauritia flexuosa L.), apresentam um alto potencial de exploração econômica e são denominadas pelos indígenas de árvore da vida, pois dela se obtém o necessário para viver, construção de casas, objetos, artesanatos e alimento (HUMBOLDT, 1852 apud STORTI, 1993).
O palmito, produto comercial mais cobiçado das palmeiras, é conhecido e usado como alimento desde épocas remotas, sendo atualmente utilizado não só na culinária brasileira, como também na internacional. Denomina-se palmito o produto comestível, o qual é constituído por folhas ainda não desenvolvidas e imbricadas que saem a partir do meristema apical de palmeiras (TSUKAMOTO FILHO, 1999).
Várias palmeiras são usadas para a produção de palmito, sendo mais comuns aquelas do gênero Euterpe (BOVI, 2000), mas rapidamente cresce a participação de outros gêneros, quer seja em extração, ou cultivo tecnicamente realizado. Dessa forma, é expressiva atualmente a participação da pupunheira (Bactris gasipaes Kunth) no agronegócio do palmito (BOVI, 2000), bem como tem aumentado o cultivo da palmeira real australiana (Archontophoenix alexandrae H. Wendl. & Drude) para essa mesma atividade.
Os frutos de algumas palmeiras nativas são elementos fundamentais na alimentação humana em determinadas comunidades, como exemplo o uso de frutos da pupunheira (Bactris gasipaes), e dos frutos do tucumã (Astrocaryum aculeatum), que fazem parte da dieta nutricional de comunidades da região norte brasileira (CLEMENT et al., 2005). Entretanto, são os frutos da palmeira Euterpe oleraceae (açaí) na forma de polpa que são consumidos principalmente pela população da região amazônica, e que ganhou fama e espaço comercial no sudeste brasileiro e sua importância econômica na produção de polpa de fruta vem crescendo anualmente (SILVA et al., 2004).
4.4. Palmeira Juçara (Euterpe edulis Martius)
De acordo com a classificação botânica, a palmeira Euterpe edulis, pertence à divisão Magnoliophyta, classe Liliopsida, subclasse Arecidae, ordem Arecales, família Araceceae e subfamília Arecoidae.
Esta palmeira também é conhecida como palmeira Juçara, espécie característica da Mata Atlântica, muito conhecida pela produção de palmito. É uma espécie de ampla distribuição geográfica, ocorrendo desde o sul da Bahia, até o norte do Rio Grande do Sul (REIS
Figura 1. Aspecto geral da palmeira Juçara (A); detalhe da floração (B); detalhe da frutificação (C). Fonte: Lorenzi (1995) adaptado pelo autor.
Palmeira de grande beleza apresenta caule solitário, liso, com 5 a 12 m de altura e 10 a 15 cm de diâmetro e contem de 8 a 15 folhas pinadas (Figura 1).
Seu crescimento é lento e seu ciclo é longo, já que o período entre a germinação e o florescimento é de 6 a 8 anos segundo Tsukamoto Filho (1999), e as flores são em grupos de três, sendo duas masculinas e uma feminina.
A frutificação é abundante, sendo que uma planta pode produzir até 3000 frutos por inflorescência (BOVI & DIAS, 1986) e produz em média três inflorescências por ano (TSUKAMOTO FILHO, 1999). Nas sementes de Euterpe edulis o endosperma, assegura-lhe sobrevida em bancos de plântulas, até o surgimento da terceira folha fotossintetizante, ou seja, aproximadamente seis meses após a embebição (SILVA, 1991).
Suas sementes são envoltas em mesocarpo carnoso e suculento de polpa escura, violácea, muito rica em carboidratos, proteínas e lipídios (REIS, 1995), sendo muito apreciadas pela fauna, favorecendo a chegada de sementes, através das fezes dos animais que se alimentam destes frutos, o que faz desta palmeira um centro de dispersão em paisagens abertas e fragmentadas, contribuindo para o aumento da riqueza em fragmentos florestais. Outras palmeiras podem ter papel semelhante, mas o Euterpe edulis se destaca pela grande variedade de
visitantes dispersores, podendo ser utilizada com sucesso em projetos de reflorestamento em fragmentos de Mata Atlântica (REIS et al., 2000).
A demanda pela polpa de açaí, e a sua semelhança com a polpa extraída dos frutos de palmeira juçara, quanto ao valor nutritivo, composição química e aspecto visual (SILVA et al., 2004), está possibilitando a exploração econômica da palmeira juçara para fins de produção de polpa de fruta, uma vez que o valor comercial dos frutos supera o valor comercial do palmito, com a vantagem de preservar a palmeira, e conseqüentemente, essa nova forma de exploração pode redesenhar a história e exploração desta palmeira da Mata Atlântica.
4.4.1. Ontogenia da Palmeira Juçara
A ontogenia descreve os estádios de desenvolvimento de um organismo, desde sua origem até sua morte. Assim como qualquer organismo vivo a palmeira Juçara, passa por diversos estádios de desenvolvimento, desde a fecundação para a formação da semente, a germinação, seu desenvolvimento vegetativo até sua morte.
A ontogenia de plantas pode ser dividida em períodos ou estádios, baseados no aparecimento de novas estruturas ou na extinção de estruturas existentes anteriormente, e pelo desenvolvimento de estruturas com funções reprodutivas.
Gatsuk et al. (1980) classificaram os estádios ontogênicos de um individuo em 4 períodos:
Latente: esse estádio compreende as sementes;
Pré-reprodutivo: Compreende os indivíduos em estádios germinante, juvenil, imaturo e virgem;
Reprodutivo: compreende os estádios jovem, maduro e velho; Pós reprodutivo: sub senil e senil.
A classificação de uma espécie em estádios facilita os estudos sobre a dinâmica populacioal dos indivíduos nas várias fases de desenvolvimento da espécie, principalmente nos aspectos relacionados à sobrevivência e reprodução.
A primeira classificação ontológica da palmeira Euterpe edulis Mart. foi proposta por Silva (1991) em estudos realizados na Reserva de Santa Genebra, na qual a autora levou em consideração as distribuições de frequência de altura, de diâmetro e do número de folhas para classificar os indivíduos em: Plântulas, Jovens, Imaturos e Adultos. Sendo que encontrou para o estádio denominado Plântulas uma variação de zero a 3 folhas e diâmetro de 1 a 6 mm e para o estádio denominado Jovens de zero a 11 folhas, diâmetro de 2 a 52 mm e altura até o ponto de emissão da folha mais nova de 2 a 122 cm.
Em 1995 Reis estudando uma população de Euterpe edulis no estado de Santa Catarina, adaptaram a classificação proposta por Silva (1991), considerando como parâmetros básicos para a distinção dos estádios, a altura, o número e a forma das folhas, classificando a população em seis estádios de tamanho:
a) Plântula: indivíduos com até 10cm de inserção da folha flecha, tendo apenas uma folha de forma flabeliforme, na maioria ainda possuem reservas endospermáticas. b) Planta Jovem I: indivíduos maiores de 10 cm de altura de inserção e menores de 30 cm, independentes das reservas das sementes e com número variável de folhas, maioria entre 2 e 4.
c) Planta Jovem II: plantas entre 30 cm e um metro de altura de inserção da folha flecha, sem estipe exposto e com 4 a 5 folhas pinadas.
d) Imaturo I: plantas com estipe exposto com altura inferior a 1,3 m.
e) Imaturo II: plantas com estipe exposto maior que 1,3 metros, mas sem evidencias de emissão de inflorescência.
f) Adulto: Plantas de palmiteiro com sinais evidentes de já terem se reproduzido.
Baseado nas classificação proposta por Silva (1991) e Reis et al. (1996), Silva
et al. (2009) definiram seis estádios de desenvolvimento baseado em diversas características: Plântula, Jovem I, Jovem II, Imaturo I, Imaturo II e Adulto.
i) Estádio Plântula: palmeiras com até uma folha aberta de cor verde ou carminácea, tipo palmada, apresentando semente com reserva endospermática.
ii) Estádio Jovem I: palmeiras menores que 0,15 m de altura de inserção, apresentando duas a quatro folhas na maioria palmada, ou as mais novas pinadas.
iii) Estádio Jovem II: palmeiras que apresentaram altura de inserção entre 0,15 e 1,00 m, sem estipe aparente, apresentando folhas claramente pinadas.
iv) Estádio Imaturo I: palmeiras que apresentaram estipe exposto com altura de inserção inferior a 1,30 m.
v) Estádio Imaturo II: palmeiras com altura de inserção superior a 1,30 m sem qualquer sinal de florescimento ou frutificação.
vi) Estádio Adulto: palmeiras com sinais evidentes de floração ou frutificação, como presença de inflorescências aderidas à planta, frutos ou sementes germinando sob as palmeiras ou cicatrizes das inflorescências na parte superior do estipe. Este último critério não é muito preciso, pela impossibilidade de acompanhamento da frutificação em anos anteriores, podendo subestimar o número real de adultos.
4.5. Germinação de sementes de palmeiras
Pouco se sabe sobre o processo germinativo de sementes de palmeiras, apenas alguns gêneros de maior importância econômica ou maior ocorrência têm sido estudados (LORENZI, 1996). A exploração sustentável de espécies da família Arecaceae depende da regeneração por sementes, portanto o conhecimento da ecologia de sementes e plântulas dessas espécies é essencial para seu manejo e sobrevivência (MATOS & WATKINSON, 1998).
pode substituir e adotar a forma do mesmo, assumir considerável tamanho e ocupar espaços. As substâncias de reserva das sementes são solubilizadas através de enzimas secretadas pelas camadas superiores do haustório para nutrição da plântula (PINHEIRO, 1986).
As sementes de Euterpe edulis são caracterizadas como recalcitrantes, deste modo, não apresentam dormência e perdem o poder germinativo rapidamente, não tolerando o dessecamento e a conservação por longos períodos (LORENZI, 1996), sendo, portanto dispersas em situações de elevado nível de água nas sementes (FARRANT et al., 1988).
As espécies que produzem sementes recalcitrantes adotaram no decorrer do processo evolutivo essa estratégia de reprodução, como um recurso de adaptação ao ambiente em que vivem, geralmente com temperaturas elevadas e alta umidade no solo, dispersando as sementes com alto teor de umidade, sem necessidade de repouso pós-maturidade, liberadas as sementes da planta mãe, estas germinam rapidamente, conferindo vantagem na competição com outras espécies (MARCOS FILHO, 2005).
De acordo com Nascimento & Silva (2004), sementes de Euterpe oleracea
Mart. (açaí) durante processo de secagem até 37,4% de teor água não tem a germinação prejudicada, mas, abaixo de 30,3% de teor de água há redução progressiva na germinação, sendo que abaixo de 15,1% de teor de água as sementes não germinam.
O despolpamento dos frutos maduros de algumas espécies de palmeiras pode ser indicado para acelerar e aumentar a germinação das sementes, como no caso da palmeira Inajá (Maximiliana regia Mart.), embora no caso de armazenamento, o despolpamento dos frutos afeta negativamente sua posterior germinação (MARTINS et al., 1996).
Outra técnica usada para aumentar a velocidade de germinação é a pré-embebição de sementes de palmeiras, como na espécie Astrocaryum aculeatum Meyer, popularmente conhecida como palmeira tucumã (GENTIL & FERREIRA, 2005)
Gomes (2003) constatou que sementes de palmeiras são sensíveis a falta de oxigênio, cuja condição causou diminuição de germinação em Geonoma brevispatha e também em Euterpe edulis.
4.6. O armazenamento de sementes
O armazenamento tem por objetivo principal conservar as sementes de plantas, preservando a qualidade física, fisiológica e sanitária, para posterior semeadura, reduzindo o processo de deterioração a nível mínimo, já que a deterioração das sementes é inevitável, porém sua velocidade pode ser controlada até certo ponto pelo emprego de técnicas adequadas.
A deterioração de sementes pode ser vista como um complexo de mudanças bioquímicas, físicas e biológicas, que ocorrem com o passar do tempo, resultando na diminuição da capacidade e desempenho da semente em formar uma plântula normal (KRZYZANOWISK & FRANÇA NETO, 2001).
Segundo Delouche (1963), a deterioração começa a partir da maturidade fisiológica (deterioração zero) até a total perda da capacidade de germinar, tendo assim, papel determinante na qualidade da semente. A deterioração é determinada principalmente pela interação entre herança genética e fatores ambientais relacionados ao manejo pós colheita das sementes (DELOUCHE & BASKIN, 1973).
A perda da germinação é o ultimo efeito ou consequência da deterioração. Assim, a natureza progressiva da deterioração e seus efeitos iniciais não são levados em conta ao analisar-se apenas a germinação das sementes (DELOUCHE, 1963; MARCOS FILHO, 2005).
Durante o armazenamento é indispensável o uso de embalagem adequada para as sementes, que deve observar as condições climáticas do local de armazenamento e as necessidades da espécie (CARVALHO & NAKAGAWA, 2000), assim como observar a temperatura do local, baixas temperaturas evitam o aparecimento de fungos, é necessário o conhecimento de tolerância da amplitude térmica da espécie.
4.7. Aspectos bioquímicos em germinação de sementes
A viabilidade de plântulas e sementes pode ser observada pela mensuração de diversos parâmetros bioquímicos indicadores de senescência, condição geradora de espécies reativas do metabolismo de oxigênio (ERO), representadas pelos radicais superóxido (O2-*),
radicais hidroxila (OH*), peróxido de hidrogênio (H2O2) e oxigênio singleto (1O2)
(SCANDALIOS, 1993; BELIGNI & LAMATTINA, 1999).
Assim, o controle dos níveis endógenos de ERO tem aberto ampla possibilidade de serem usadas como moléculas sinalizadoras no crescimento, desenvolvimento, respostas a estresses e interações bióticas (RYTER & TYRREL, 1998; MITLER et al., 2004), além de indicadora do nível de senescência (KAWANO et al., 1998; ABARCA et al., 2001; PASSARDI
et al., 2004).
As peroxidases (POD, EC 1.11.1.7) desempenham função na proteção contra o estresse oxidativo, onde catalisam a reação entre um agente redutor e o H2O2, para produzir um
composto oxidado e água (IUBMB, 2007), como representado abaixo:
Agente redutor + H2O2 Produto oxidado + H2O
Estas enzimas possuem uma variedade de isoformas, que usam diferentes redutores e estão localizadas em diferentes compartimentos celulares (CAMPA, 1991). Estas enzimas, além de apresentarem ação antioxidante, elas desempenham importante papel na biossíntese da parede celular (PASSARDI et al., 2004).
5. MATERIAL E MÉTODOS
5.1. Material vegetal
No presente experimento foram utilizadas sementes de Euterpe edulis obtidas de frutos coletados manualmente das palmeiras em 10 de julho de 2008, em propriedade localizada em Botucatu a 22º53'09" de latitude sul, 48º26'42" de longitude oeste, Para a coleta foi determinado a presença de agrupamento de plantas (12 indivíduos) para assegurar a qualidade da semente uma vez que sementes oriundas de polinização cruzada apresentam um vigor maior, como sugerido por Bovi (1978). Foram selecionadas sementes com tamanhos próximos a 1 cm. Para cada tratamento foram separadas 70 sementes, sendo que 10 seriam utilizadas para coleta de material para análises bioquímicas e 60 para análise do desenvolvimento vegetativo.
5.2. Condução do experimento
Os ensaios foram conduzidos no Laboratório de Xenobióticos do Departamento de Química e Bioquímica do Instituto de Biociências, UNESP, Botucatu-SP.
Os frutos foram imersos em água por um período de 3 horas, a fim de facilitar o despolpamento. Procedeu-se então a lavagem em água corrente, esfregando os frutos em peneira de malha de aço. Os frutos que ainda apresentavam resíduos do mesocarpo e epicarpo, assim como as sementes de menor tamanho, foram descartados.
As sementes foram então higienizadas em solução de hipoclorito de sódio a 1% por 15 minutos e depois lavadas com água destilada.
Após esse procedimento as sementes foram acondicionadas em caixas plásticas (10,6cm X 10,6 cm X 8,0 cm) revestidas internamente por duas folhas de papel filtro com pH neutro, densidade de 80g.m-2, espessura de 205 µm umedecidas com água destilada na quantidade (em mL) equivalente a duas vezes e meia a massa (em g) do papel seco. As sementes foram então cobertas por uma folha do mesmo papel, umedecida com água destilada da maneira anterior, então as caixas foram fechadas com tampas, contendo cinco perfurações de 3 mm de diâmetro, para trocas gasosas. As caixas plásticas contendo as sementes foram então colocadas em duas condições seqüenciais, iniciando-se em câmara de germinação (CG) a temperatura de 24,5 ± 2ºC, seguido pelo armazenamento em Câmara fria (CF) a temperatura de 10ºC. Ambas as condições foram realizadas na ausência de luz. Os períodos de cada condição estão descritos na Tabela 1.
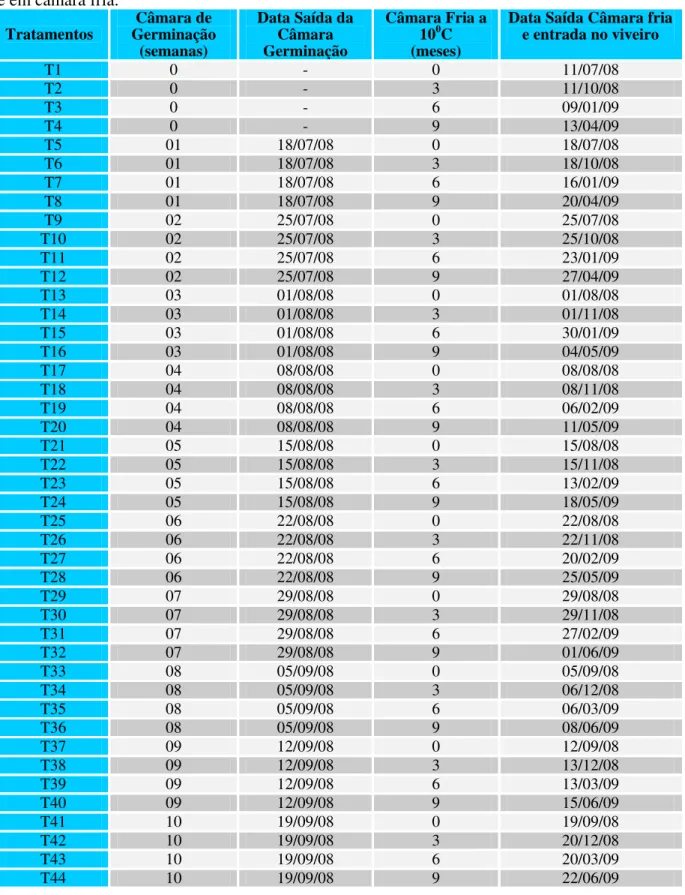
Tabela 1. Períodos de armazenamento das sementes de Euterpe edulis em câmara de germinação e em câmara fria.
Tratamentos
Câmara de Germinação
(semanas)
Data Saída da Câmara Germinação
Câmara Fria a 100C (meses)
Data Saída Câmara fria e entrada no viveiro
T1 0 - 0 11/07/08
T2 0 - 3 11/10/08
T3 0 - 6 09/01/09
T4 0 - 9 13/04/09
T5 01 18/07/08 0 18/07/08
T6 01 18/07/08 3 18/10/08
T7 01 18/07/08 6 16/01/09
T8 01 18/07/08 9 20/04/09
T9 02 25/07/08 0 25/07/08
T10 02 25/07/08 3 25/10/08
T11 02 25/07/08 6 23/01/09
T12 02 25/07/08 9 27/04/09
T13 03 01/08/08 0 01/08/08
T14 03 01/08/08 3 01/11/08
T15 03 01/08/08 6 30/01/09
T16 03 01/08/08 9 04/05/09
T17 04 08/08/08 0 08/08/08
T18 04 08/08/08 3 08/11/08
T19 04 08/08/08 6 06/02/09
T20 04 08/08/08 9 11/05/09
T21 05 15/08/08 0 15/08/08
T22 05 15/08/08 3 15/11/08
T23 05 15/08/08 6 13/02/09
T24 05 15/08/08 9 18/05/09
T25 06 22/08/08 0 22/08/08
T26 06 22/08/08 3 22/11/08
T27 06 22/08/08 6 20/02/09
T28 06 22/08/08 9 25/05/09
T29 07 29/08/08 0 29/08/08
T30 07 29/08/08 3 29/11/08
T31 07 29/08/08 6 27/02/09
T32 07 29/08/08 9 01/06/09
T33 08 05/09/08 0 05/09/08
T34 08 05/09/08 3 06/12/08
T35 08 05/09/08 6 06/03/09
T36 08 05/09/08 9 08/06/09
T37 09 12/09/08 0 12/09/08
T38 09 12/09/08 3 13/12/08
T39 09 12/09/08 6 13/03/09
T40 09 12/09/08 9 15/06/09
T41 10 19/09/08 0 19/09/08
T42 10 19/09/08 3 20/12/08
T43 10 19/09/08 6 20/03/09
Tabela 2. Critérios de classificação das sementes e/ou plântulas de Euterpe edulis, de acordo com seu estádio germinativo.
Estádio Critérios
A sementes que ainda não iniciaram o processo germinativo aparentemente B sementes que apresentavam o botão germinativo já formado, externamente C sementes já germinadas com emissão de raiz e/ou parte aérea até 6 cm D sementes já germinadas com formação de raiz ou parte aérea maior que 6 cm
As sementes e ou plântulas foram em seguida colocadas individualmente em tubetes com capacidade de 180 mL, com 18 cm de comprimento, contendo substrato comercial a base de casca de pinus bioestabilizada (Mecplant florestal 3 composta de casca de pinus, vermiculita, calcáreo, micronutriente e tricoderma). Os tubetes foram acondicionados em bandejas e mantidos no viveiro do Departamento de Ciência Florestal da Faculdade de Ciências Agronômicas, UNESP, Botucatu (Figura 3).
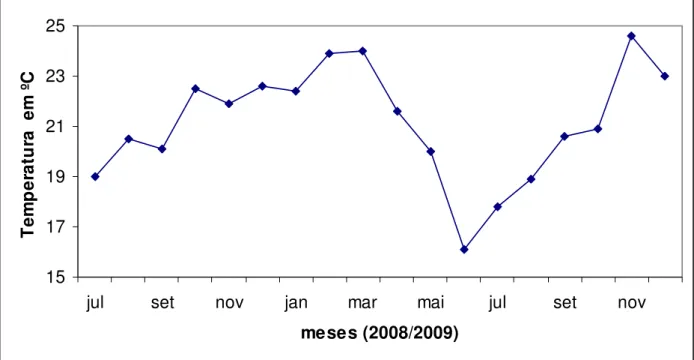
As bandejas contendo os tubetes foram mantidas por período de 6 meses para desenvolvimento das plântulas em ambiente de casa de vegetação com umidade controlada e nebulização constante, mas sujeitas a variação de temperatura de acordo com a variação das estações do ano, onde as temperaturas médias mensais variaram de acordo com a figura 4.
15 17 19 21 23 25
jul set nov jan mar mai jul set nov
meses (2008/2009) T em p er at u ra em º C
Já as sementes e/ou plântulas que seriam utilizadas para análises bioquímicas, após decorridos os períodos dos tratamentos, foram acondicionadas em embalagem plástica e embrulhadas em papel alumínio, devidamente etiquetados, depois colocados em outra embalagem plástica e mergulhadas em nitrogênio líquido para que cessassem as atividades metabólicas, e por fim foram armazenadas em câmara fria a temperatura de -20ºC até o final do experimento, para que todas as amostras fossem processadas juntas.
5.3. Análises de desenvolvimento
A germinação e desenvolvimento das plântulas foram acompanhados durante seis meses (período escolhido aleatóriamente) e ao final do experimento, as plântulas foram retiradas dos tubetes e tiveram suas raízes lavadas, as sementes que não germinaram ou plântulas que morreram foram descartadas. Após este procedimento, foram realizadas em cada uma das plântulas vivas, medidas das seguintes variáveis:
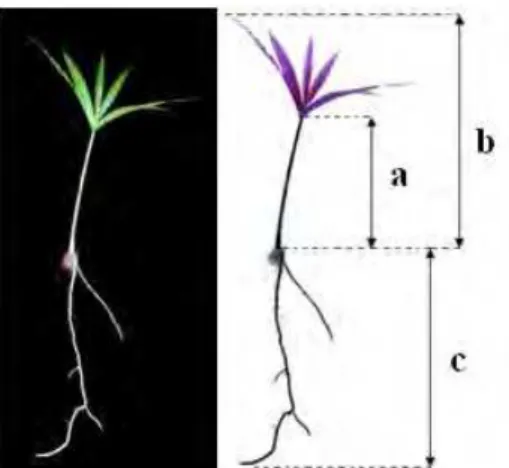
a) comprimento da parte aérea – medida da distância (cm) da parte aérea emergida até a base de inserção do limbo foliar (Figura 5 a);
b) comprimento da parte aérea total – medida da distância (cm) do coleto até a extremidade do limbo foliar (Figura 5 b);
c) comprimento da raiz – medida da distância (cm) do coleto até a extremidade da raiz (Figura 5 c).
d) diâmetro do coleto (mm);
e) massa da matéria fresca total (g);
Figura 5. Plântula de Euterpe edulis e desenho esquemático dos parâmetros avaliados. Comprimento da parte aérea emergida até a base de inserção do limbo foliar (a), comprimento da parte aérea total (b) e comprimento de raiz (c).
5.4. Delineamento experimental
5.5. Análises bioquímicas
5.5.1. Coleta das amostras
As dez sementes e/ou plântulas coletadas após cada tratamento foram primeiramente congeladas em nitrogênio líquido e em seguida armazenadas em freezer a – 20ºC para posterior obtenção do extrato enzimático e determinação da atividade da enzima peroxidase.
5.5.2. Extração enzimática
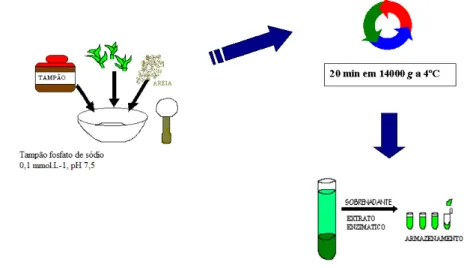
Na obtenção do extrato enzimático para a determinação da atividade das enzimas foi utilizado tampão fosfato de sódio 0,1 mmol.L-1, pH 7,5 contendo
polivinilpolipirrolidona (PVPP) na proporção de 7,5% (peso/volume), como descrito por Sharma & Sengupta (1987).
As sementes e/ou plântulas (somente os embriões) foram homogeneizadas em 10 mL do tampão de extração gelado, utilizando-se almofariz gelado, contendo pequena quantidade de areia lavada e esterilizada. O homogeneizado obtido foi então centrifugado a 14000g a 4ºC durante 30 minutos e o sobrenadante utilizado como extrato enzimático (Figura 6).
5.5.3. Determinação da atividade da peroxidase
A atividade da peroxidase foi determinada de acordo com as condições citadas no trabalho de Teisseire & Guy (2000). O sistema de reação foi composto de 30 µL de extrato enzimático diluído (1:10 em tampão de extração), tampão fosfato de potássio 50 mmol.L-1 pH 6,5, pirogalol (1,2,3-benzenotriol) 20 mmol.L-1 e peróxido de hidrogênio (H2O2) 5 mmol.L-1,
totalizando um volume de 1,0 mL (Figura 7). A reação foi conduzida a temperatura ambiente por 5 minutos. A formação de purpurogalina (Figura 8) foi medida em espectrofotômetro UV-visível a 430 nm e seu coeficiente de extinção molar (2,5 mmol.L-1.cm-1) foi usado para calcular a atividade específica da enzima, expressa em µmol de purpurogalina.min-1.mg-1 de proteína.
Figura 7. Esquema da técnica de determinação da peroxidase
Pirogalol Purpurogalina
5.5.4. Determinação do teor de proteínas solúveis totais nos extratos
enzimáticos
A determinação de proteínas solúveis nos extratos enzimáticos foi realizada de acordo com Lowry et al. (1951) (Figura 9), utilizando a albumina sérica bovina (BSA) como proteína padrão.
5.6. Análises estatísticas
As análises estatísticas utilizadas foram:
a) Regressão logística para avaliar a influência dos fatores Câmara de Germinação (CG) e Câmara Fria (CF) na taxa de sucesso da germinação (variável Bernoulli). De acordo com a variável Bernoulli referente a Germinação, foi considerado 1 a obtenção de uma plântula no final de todo o processo (período em câmara de germinação, período em câmara fria e período em viveiro) e considerado 0 a morte da plântula ou fracasso na germinação da semente.
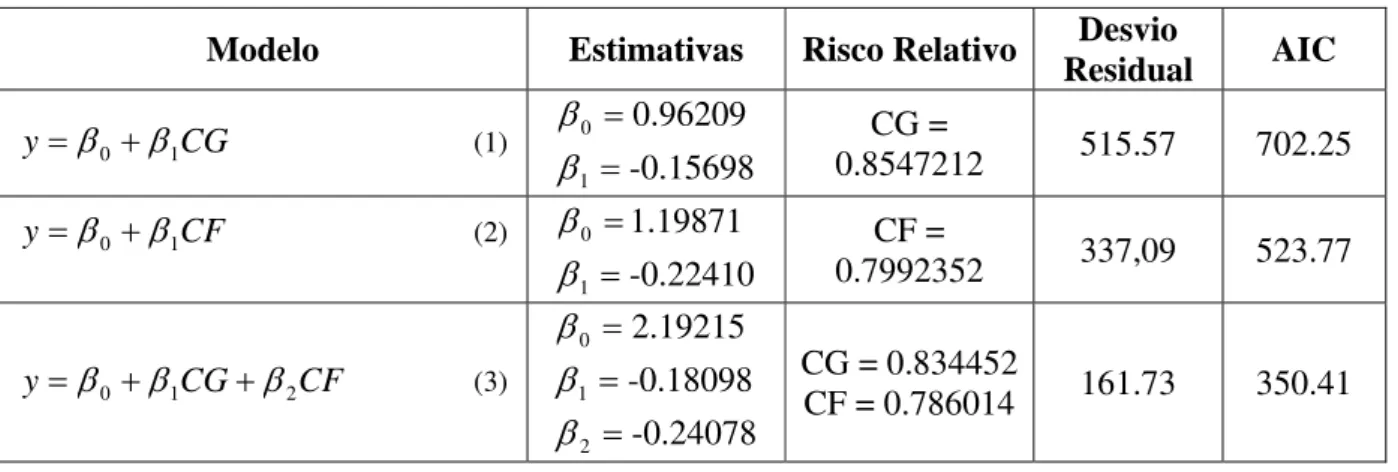
A construção do modelo logístico foi feita através da avaliação do valor do desvio residual e do critério de informação de Akaike (1974), AIC. Os modelos foram construídos até chegar ao modelo completo composto pelos fatores CG e CF, com valores mínimos do desvio residual e AIC.
b) Regressão linear múltipla para avaliar a influência dos fatores CG e CF nas variáveis DC, CPA, CPAT, CR, PMF, PMS.
c) Os resultados referentes à atividade de peroxidase foram transformados para log, devido à heterocedasticidade de variância. As médias dos tratamentos foram comparados pelo teste de Tukey a 5% de significância.
Tabela 3. Construção do modelo logístico.
Modelo Estimativas Risco Relativo Desvio
Residual AIC
CG
y=β0+β1 (1)
-0.15698 0.96209 1 0 = = β
β CG =
0.8547212 515.57 702.25
CF
y=β0 +β1 (2)
-0.22410 1.19871 1 0 = = β
β CF =
0.7992352 337,09 523.77
CF CG
y=β0 +β1 +β2 (3)
-0.24078 -0.18098 2.19215 2 1 0 = = = β β β
CG = 0.834452
6. RESULTADOS E DISCUSSÃO
6.1. Análise da taxa de sucesso de plântulas
A análise de desvio aponta como mais indicado a escolha do modelo (3) (Tabela 3) que inclui as variáveis CG (períodos em câmara de germinação) e CF (períodos em câmara fria), como estimativas de parâmetro significativas. O risco relativo, calculado através da função exponencial aplicada à estimativa do parâmetro mostra o que acontece com a probabilidade de sucesso da plântula fixado os outros fatores. Neste caso, para o fator CG, a chance de sucesso da plântula em relação ao fracasso foi equivalente a 0,834, ou seja, como o valor do risco relativo é menor que 1, a chance de fracasso da plântula aumenta com o aumento do período de armazenamento em câmara de germinação. A mesma interpretação se faz com respeito ao fator CF, que também foi inferior igual a 0,786, portanto, as chances de sucesso da plântula diminuem com o aumento do período em câmara fria.
Diante dos resultados apresentados pode-se detectar que o período em CG e o período de armazenamento em CF afetaram a taxa de sucesso das plântulas de Euterpe edulis.
Embora os resultados desta pesquisa sejam referentes à taxa de sucesso das plântulas, analisado no período de 6 meses, pode-se relacioná-los com resultados obtidos na literatura sobre efeito da interação de armazenamento na qualidade de plântulas.
meses de armazenamento em câmara fria (temperatura de 10 ºC), a germinação diminuiu de 90 para 44%. Martins et al. (2009) verificaram que a qualidade de sementes de Euterpe edulis avaliada pelos testes de germinação e de vigor foi prejudicada pelo aumento do tempo de armazenamento à temperatura de 10oC.
Considerando-se germinação e vigor, foi verificado por Martins et al. (2000) que sementes de palmito-vermelho (Euterpe espiritosantensis Fernandes) devem ser armazenadas entre 5oC e 15oC, porém, o tempo de armazenamento deve ser o mais curto possível, visto
redução drástica destes parâmetros ao longo do tempo.
Após os tratamentos quando as sementes e/ou plântulas iniciaram seu desenvolvimento vegetativo no viveiro, estas foram classificadas de acordo com o estádio vegetativo que apresentavam (Tabela 2). No final do experimento foi verificada que o estádio vegetativo onde houve maior perda de sementes (insucesso) foi o estádio B (onde estas apresentavam o botão germinativo já formado), provavelmente fase em que a semente se encontra mais vulnerável a manipulação. Foi observado também que quanto mais desenvolvida a plântula (excetuando as sementes no estádio B), maior sua possibilidade de sucesso em se tornar uma planta normal, esse fato deve estar relacionado com maior vigor dessas sementes. Dessa forma os tratamentos selecionaram as sementes de maior vigor.
Tabela 4. Número de sementes e/ou plântulas de Euterpe edulis no momento de transferência para o viveiro e Número de plântulas com desenvolvimento normal e Porcentagem de sucesso de sementes e/ou plântulas após o período de permanência de 6 meses em viveiro, baseado em seu estádio germinativo(*).
Estádio germinativo Sementes e/ou plântulas Plântulas com desenvolvimento normal Porcentagem de sucesso
A 886 370 41,76
B 504 173 34,33
C 749 456 60,88
D 501 333 66,47
Total 2640 1332 50,45
-10 10 30 50 70 90
0 1 2 3 4 5 6 7 8 9 10
Su ce ss o de pl ân tu la s (% )
Períodos em câmara de germinação (semanas) Estádio A Estádio B Estádio C Estádio D
Figura 10. Relação da Porcentagem de sucesso de plântulas de Euterpe edulis obtidas no final do experimento a partir de sementes/plântulas em diferentes estádios germinativos e os tratamentos em câmara de germinação, sem armazenamento em de câmara fria.
-10 10 30 50 70 90
0 1 2 3 4 5 6 7 8 9 10
Suce sso d e pl ânt ula s (% )
Períodos em câmara de germinação (semanas) Estádio A Estádio B Estádio C Estádio D
-10 10 30 50 70 90
0 1 2 3 4 5 6 7 8 9 10
Sucesso d e p lâ nt ula s (% )
Períodos em câmara de germinação (semanas) Estádio A Estádio B Estádio C Estádio D
Figura 12. Relação da Porcentagem de sucesso de plântulas de Euterpe edulis obtidas no final do experimento a partir de sementes/plântulas em diferentes estádios germinativos e os tratamentos em câmara de germinação e câmara fria por período de 6 meses.
-10 10 30 50 70 90
0 1 2 3 4 5 6 7 8 9 10
Sucesso d e p lântu la s (% )
Períodos em câmara de germinação (semanas)
Estádio A Estádio B Estádio C Estádio D
Analisando as Figuras 10 a 13 pode ser observado que as maiores porcentagens de sucesso foram detectadas nos estádios C e D, fases em que as sementes se encontram em estádios mais avançados de desenvolvimento. Pode-se afirmar que quanto mais desenvolvida estava a plântula no momento de transferência para o viveiro, maior a possibilidade de sucesso em se tornar uma planta normal, fato este relacionado ao maior vigor destas sementes. Desta forma, os tratamentos em câmara fria e câmara de germinação foram determinantes para a seleção de sementes de maior vigor.
0,00 0,10 0,20 0,30 0,40 0,50 0,60 0,70 0,80 0,90 1,00
0 2 4 6 8 10 12
Tempo na Câmara de Germinação (semanas)
T a xa d e S u cess o d a P lân tu la ( E st im ad o) ) 0 meses 3 meses 6 meses 9 meses
Câm ara Fria
Figura 14. Relação entre a taxa de sucesso da plântula (em termos relativos) e os fatores CG e CF.
A equação que descreve o gráfico acima é:
2 1 2 1 24078 , 0 18098 , 0 19215 , 2 24078 , 0 18098 , 0 19215 , 2
1
x xx x
e
e
y
− −− −
+
=
y = proporção de sucesso de plântulas (ou taxa de sucesso de plântulas) x1 = período na câmara de germinação
De acordo com os resultados apresentados na Figura 14 pode ser afirmado que o aumento da permanência de sementes e/ou plântulas de Euterpe edulis em CG e CF, anteriormente ao plantio em condições de viveiro diminui a possibilidade de formação de plântulas normais desta espécie.
Quando as sementes foram armazenadas em CF, sem a manutenção prévia em CG (0 semanas) houve uma redução na taxa de sucesso das plântulas decorrente do período de armazenamento em câmara fria. Neste sentido, a taxa de redução foi maior, quanto mais longo o período de armazenamento.
Analisando a condição de permanência em CG por 10 semanas, pode ser observado que houve redução de aproximadamente 50% da taxa de sucesso das plântulas após o período de armazenamento por 6 meses em CF.
De acordo com Bovi & Cardoso (1978) sementes de Euterpe edulis perdem 70% seu poder germinativo após um mês de colheita, por ressecamento do embrião. Entretanto, baseado nos resultados desta pesquisa, pode ser afirmado que o armazenamento das sementes desta espécie em câmara fria por um período de até 9 meses, a taxa de sucesso das plântulas reduz somente ao redor de 50%. Deste modo, pode ser sugerido que o armazenamento sob condições de câmara fria diminui a taxa metabólica da semente, prolongando o período para o início da deterioração da mesma.
6.2. Avaliação dos fatores CG e CF nas variáveis contínuas: Diâmetro do coleto, Comprimento da parte aérea, Comprimento da parte aérea total, Comprimento da raiz, Massa da matéria fresca total e Massa da matéria seca.
7 8 9 10 11 12 13 14
0 1 2 3 4 5 6 7 8 9 10
Períodos em câmara de germinação (semanas)
C om pr im ent o da pa rt e a ér ea (c m )
CF= 0 CF= 3 meses CF= 6 meses CF= 9 meses
Figura 15. Relação entre o comprimento da parte aérea e os fatores período na câmara de germinação (CG) e período na câmara fria (CF).
14 16 18 20 22 24
0 1 2 3 4 5 6 7 8 9 10
Períodos em câmara de germinação (semanas)
C om pr im ent o da p ar te a ér ea tot al (c m )
CF= 0 CF= 3 meses CF= 6 meses CF= 9 meses
4 4,5 5 5,5 6 6,5 7
0 1 2 3 4 5 6 7 8 9 10
Períodos em câmara de germinação (semanas)
D iâm et ro d o c ol et o ( m m )
CF= 0 CF= 3 meses CF= 6 meses CF= 9 meses
Figura 17. Relação entre o diâmetro do coleto e os fatores período na câmara de germinação (CG) e período na câmara fria (CF).
2 3 4 5 6
0 1 2 3 4 5 6 7 8 9 10
Paeríodods em câmara de germinação (semanas)
M as sa d e m at ér ia fr es ca (g )
CF= 0 CF= 3 meses CF= 6 meses CF= 9 meses
0,6 0,7 0,8 0,9 1 1,1 1,2 1,3
0 1 2 3 4 5 6 7 8 9 10
Períodos em câmara de germinação (semanas)
M as sa d e m at ér ia s ec a (g )
CF= 0 CF= 3 meses CF= 6 meses CF= 9 meses
Figura 19. Relação entre a massa de matéria seca e os fatores período na câmara de germinação (CG) e período na câmara fria (CF).
15 17 19 21 23 25
0 1 2 3 4 5 6 7 8 9 10
C om pri m en to de ra íz es (cm )
Períodos em câmara de germinação (semanas) CF= 0 CF= 3meses CF= 6 meses CF= 9 meses
Figura 20. Relação entre o comprimento de raiz e os fatores período em Câmara de Germinação (CG) e período em câmara fria (CF).
A equação que descreve o gráfico acima é:
2 1 2
1 0,93322 0,07556 72649
, 0 75199 ,
23 x x x x
y= − − + , onde:
y = comprimento de raízes
x1 = tempo na câmara de germinação
Nas Figuras 15 a 20 estão representadas os resultados da relação dos parâmetros de desenvolvimento (comprimento de parte aérea, comprimento total de parte aérea, diâmetro do coleto, massa de matéria fresca, massa de matéria seca e comprimento de raiz, respectivamente), em função dos fatores períodos de permanência em câmara de germinação e armazenamento em câmara fria.
Considerando as variáveis analisadas como contínuas, realizou-se a regressão linear múltipla para cada uma delas, considerando CG e CF como fatores, além da interação entre eles. Na Tabela 5 estão representadas as estatísticas dos modelos ajustados para as diferentes variáveis de crescimento analisadas.
Tabela 5. Valores de significância do ajuste coeficiente de determinação do modelo para as diferentes variáveis analisadas.
Variável Analisada Valor p R² ajustado Comprimento da parte aérea 0,7116 0,000 Comprimento da parte aérea total 0,5772 0,000
Diâmetro do coleto 0,0059 0,2102
Peso de matéria fresca 0,0630 0,1023 Peso de matéria seca 0,0289 0,1467 Comprimento de raiz < 0,001 0,5981
Conforme pode ser observado na Tabela 5, os valores dos coeficientes de determinação ajustados (R² ajustado) variaram entre 0,5981 e zero, indicando que é baixa a relação entre as variáveis analisadas neste trabalho e os fatores (período em câmara de germinação e período em câmara fria). No entanto, os ajustes foram significativos apenas para a variável comprimento de raiz.
Martins et al. (2000) verificaram redução do comprimento da raiz em função do armazenamento de sementes de Euterpe espiritosantensis Fernandes (palmito-vermelho) por um período de 2 meses a temperatura entre 5oC e 15oC. Entretanto, além da diminuição do comprimento da raiz, foi detectado redução da matéria seca das plântulas mantidas nestas condições.
Tabela 6. Análise de variância da regressão para a variável comprimento de raiz
Fonte de Variação GL SQ QM F p
Câmara de Germinação 1 65,721 65,721 17,845 < 0,001 ***
Câmara Fria 1 152,707 152,707 41,465 < 0,001 ***
Interação (CG:CF) 1 28,260 28,260 7,674 0,008 **
Resíduo 40 147,311 3,683
Total 43 393,999
Diversos trabalhos relacionam menor desenvolvimento radicular relacionado com o aumento do período de armazenamento de sementes. Souza et al. (2005) verificaram diminuição do comprimento de raízes de ipê amarelo, Tabebuia serratifolia (VAHL.) NICH, até 150 dias de armazenamento em câmara úmida, laboratório e geladeira (temperaturas de 22±3, 27±3 e 7oC, respectivamente). Em cumaru (Amburana cearensis) Lúcio et al. (2010) verificaram que o armazenamento de sementes por 12 meses em câmara fria acarretou diminuição de até 50% do comprimento da raíz.
Schuch et al. (1999) constataram que o comprimento das raízes é o parâmetro mais adequado do que o comprimento da parte aérea para se avaliar diferenças no vigor de sementes de aveia-preta, Avena strigosa Schreb.
6.3. Análise da Atividade da Peroxidase
Através da análise exploratória dos resultados, a fim de conhecimento da natureza e distribuição dos dados, foi detectado dados anômalos que poderiam comprometer os resultados da análise estatística.
Para análise estatística foram removidos os resultados referentes aos períodos 2 e 3 semanas em câmara de germinação, devido a algumas inconsistências dos resultados. Na Figura 21 estão representadas as médias da atividade da peroxidase determinada em todos os períodos de permanência em câmara de germinação. Como a atividade da peroxidase foi muito variável ao longo dos tratamentos, não havendo tendência linear contínua, os resultados foram representados pelo modelo de médias.
Analisando a Tabela 7, referente à estatística descritiva da peroxidase, pode ser verificado que ocorreu elevada variação nos dados. Como a variação experimental, representada pelo coeficiente de variação, normalmente não deve ultrapassar 30%, foi analisada se esta variação dos dados estava presente em todo o experimento ou apenas em alguns tratamentos, como mostrado na Figura 22. Pode ser verificado que apesar da existência de variação dentro dos tratamentos, esta não foi superior a 16%, indicando bom controle experimental dentro de cada tratamento.
Neste caso, houve efeitos significativos da câmara de germinação, câmara fria e da interação, e atendidas as pressuposições do modelo linear, procedeu-se a aplicação do teste de Tukey de comparações múltiplas.
Para atender as pressuposições do modelo, foi necessário transformar a variável Atividade da Peroxidase em log (log POD), devido a heterocedasticidade de variância. O quadro da análise de variância se encontra na Tabela 8, para a variável resposta log POD.
Tabela 7: Estatística Descritiva da atividade da peroxidase (POD) Medidas de Posição e Dispersão
Mínimo 1º Quartil Mediana Média 3º Quartil Máximo
0,20 2,93 5,41 7,99 9,10 38,01
Variância Desvio Padrão Coeficiente de Variação
-10 0 10 20 30
0 1 2 3 4 5 6 7 8 9 10
Períodos em câmara de germinação (semanas)
A
ti
vi
da
de
da
pe
roxi
da
se
CF= 0 CF= 3 meses CF= 6 meses CF= 9 meses
Figura 21. Relação entre Atividade de Peroxidase e os tratamentos em câmara de germinação (CG) e câmara fria (CF)
Tabela 8. Análise de variância do log POD.
Fonte de Variação GL SQ QM F P
Câmara de Germinação 8 59,003 7,375 1513,30 < 0,0001
Câmara Fria 3 24,534 8,178 1677,96 < 0,0001
Interação (CG;CF) 24 87,220 3,634 745,67 < 0,0001
Resíduo 104 0,507 0,005
Total 139 171,264
Tabela 9. Teste de comparações múltiplas pelo teste de Tukey para a variável log POD.
Câmara Fria (meses) Câmara de
Germinação
(semanas) 0 3 6 9
0 0,37 (*) g D 2,77 f B 4,56 d A 2,00 a C
1 0,22 h D 1,28 g C 5,46 c A 2,66 g B
4 13,23 a A 4,03 e C 8,53 b B 13,03 c A
5 3,76 e D 7,76 c B 19,41 a A 5,88 f C
6 4,74 d B 5,16 d B 4,22 de C 19,43 b A
7 3,77 e B 2,67 f C 8,02 b A 6,88 e A
8 6,56 c C 13,30 b A 0,59 g D 9,78 d B
9 7,79 b B 6,16 d C 1,67 f D 22,64 ab A
10 2,70 f D 29,60 a A 3,72 e C 23,23 a B
(*) Médias seguidas de mesmas letras minúsculas na coluna e maiúsculas na linha não diferem
entre si a 5% de significância.
Analisando a Tabela 9 e Figura 21 verifica-se que a atividade da peroxidase apresenta grande variação quando as sementes/plântulas foram submetidas aos tratamentos de câmara de germinação e câmara fria. Embora tenha ocorrido este fenômeno, fazendo uma análise geral, pode-se constatar alguns fatos:
a) a atividade da peroxidase aumenta com a evolução do processo germinativo;
b) Não foi detectado atividade da peroxidase nas sementes que não permaneceram em câmara de germinação (0 semanas) e não foram armazenadas em câmara fria (0 meses), visto que ainda não tinha sido iniciado o processo de germinação;
d) As sementes e/ou plântulas que foram mantidas em CG e que foram armazenadas, por períodos de 3, 6 e 9 meses em câmara fria a atividade da peroxidase foi superior em comparação aquelas que não foram mantidas em câmara fria, visto que algumas sementes nestas condições já havia iniciado a germinação, tornando as amostras utilizadas para o processo de extração enzimática heterogêneas quanto ao estádio germinativo;
e) A atividade da peroxidase foi mais elevada nas sementes e/ou plântulas que foram mantidas por 9 meses em câmara fria.
As peroxidases estão envolvidas em muitos processos fisiológicos e de desenvolvimento e deste modo, podem ser detectadas nas plantas desde a germinação até a senescência (PASSARDI et al., 2004). Uma das características notáveis destas enzimas é que elas estão associadas com processos de elongação celular, mas também com reações de restrição de crescimento.
O aumento da atividade da peroxidase está associado à senescência das sementes. Em Arabidopsis foi verificado por Abarca et al. (2001) aumento da atividade da peroxidase durante a senescência de tecidos. De acordo com Passardi et al. (2004) estas enzimas estão envolvidas na senescência devido seu envolvimento no controle da parede celular, primeiramente por gerar ERO, como possível moléculas sinalizadoras e também por ligações cruzadas dos componentes na parede celular secundária.
Em muitas sementes secas e plântulas, a peroxidase está presente e novas isoenzimas aparecem conforme tem início a embebição das sementes (SIEGEL & GALSTON, 1966, apud SIEGEL, 1993; PASSARDI et al., 2004). Estas enzimas podem desempenhar um papel crucial na proteção de sementes nos primeiros dias de germinação por reduzirem ataque de patógenos (PASSARDI et al., 2004). Em estudos com sementes de tomate, Lycopersicon
esculentum (MOROHASHI & MATSUSHIMA, 2000) e de rabanete, Raphanus sativus (WU et al. , 2001) foram confirmados que a produção de peroxidase começa logo que ocorre a protusão da radícula, que cria uma “ferida” no endosperma, cuja região é vulnerável ao ataque de patógenos.
(MITTLER, 2002), que induzem a atividade da enzima para evitar que estas provoquem danos ao sistema de membranas, proteínas ou ácidos nucléicos.
7. CONCLUSÕES
Com a permanência de sementes/plântulas de Euterpe edulis em CG por até 10 semanas, seguido de armazenamento em CF por até 9 meses, pode-se constatar:
- diminuição da taxa de sucesso de plântulas, sem diminuição do vigor;
- senescência das sementes e/ou plântulas, confirmado pela elevada atividade da peroxidase; - que o armazenamento em CF é muito eficiente para conservação das sementes e/ou plântulas prolongando o período para a propagação desta espécie;
8. REFERÊNCIAS
ABARCA, D.; MARTIM, M. SABATER, B. Differential leaf stress responses in young and senescent plants. Physiology Plant, Waterbury, v. 113, p. 409-415, 2001.
AKAIKE, H. A new look at the statistical model identification. IEEE Transactions on Automatic Control, Boston, v. 19, n. 6, p. 716-723, Dec. 1974.
ANDRADE, A. C. S. The effect of moisture content and temperature on the longevity of heart of palm seeds (Euterpe edulis). Seed Science and Technology, Bassersdorf , v. 29, n. 1, p. 171-182, 2001.
ANDRADE, A. C. S.; PEREIRA, T. S. Comportamento de armazenamento de sementes de palmiteiro (Euterpe edulis Mart.). Pesquisa Agropecuária Brasileira, Brasília, DF, v. 32, n. 10,
p. 987-991, 1997.
BELIGNI, M. V.; LAMATTINA, L. Nitric oxide counteracts cytotoxic processes mediated by reactive oxygen species in plant tissues. Planta, Mar del Plata, v. 208, p. 337-44, 1999.
BOVI, M. L. A. O agronegócio palmito de pupunha. O Agronômico, Campinas, v. 52, n. 1, p. 10-12, 2000.
BOVI, M. L. A.; DIAS, D. S. Biologia floral do palmiteiro (Euterpe edulis Mart.). In: CONGRESSO NACIONAL DE BOTÂNICA, 37., 1986, Ouro Preto. Anais...Ouro Preto: Universidade Federal de Ouro Preto, 1986. p. 33.
BOVI, M. L. A.; GODOY JUNIOR, G.; SAES, L. A Pesquisa com o gênero Euterpe e Bactris no Instituto Agronômico de Campinas. In: ENCONTRO NACIONAL DE PESQUISADORES EM PALMITO, 1., 1988, Curitiba. Anais... Curitiba: Embrapa, CNPF, 1988. p. 1-44,
BOVI, M. L. A.; GODOY-JUNIOR, G.; SAES, L. A. Pesquisas com os gêneros Euterpe e
Bactris no Instituto Agronômico de Campinas. Agronômico, Campinas, v. 39, n. 2, p. 129-174,
1987.
CAMPA, A. Biological roles of plant peroxidases: known and potential function. In: EVERSE, J.; EVERSE, K. E.; GRISHAM, M. B. (Eds.). Peroxidases in chemistry and biology. Boca Raton: CRC Press, 1991. p. 25-50.
CARVALHO, D. et al. Eletroforese de proteínas e isoenzimas em sementes de Copaífera Langsdorffii Desf. (Leguminosae Caesalpinioideae) Envelhecidas Artificialmente. Revista Árvore, Viçosa, v. 30, p. 19-24, 2006.
CARVALHO, N. M.; NAKAGAWA, J. Sementes: ciência, tecnologia e produção. 4. ed. Jaboticabal: FUNEP, 2000. 588 p.
CLEMENT, C. R.; LLERAS P.; VAN LEEUWEN, J. O potencial das palmeiras tropicais no Brasil: acertos e fracassos das últimas décadas. Agrociencias, Montevideu, v. 9, n. 1/2, p. 67-71, 2005.
COUÉE, I. et al. Involvement of soluble sugars in reactive oxygen species balance and responses to oxidative stress in plants. Journal of Experimental Botany, Oxford, v. 57, p. 449-59, 2006.
CREPALDI, I. C. et al. Composição nutricional do fruto do licuri (Syagrus coronata (Martius) Beccari). Revista Brasileira de Botânica, São Paulo, v. 24, p. 155-159, 2001.
DELOUCHE, J. C. Seed deterioration. Seed World, Tallahassee, v. 92, n. 4, p. 14-15, 1963.
DRANSFIELD, J.; JOHSON, D.; SYNGE, H. The palms of the new word: a conservation census. Cambridge: IUCN-WWF, 1988. 30 p. Plants conservation programe. (Publication, 2).
DUBOIS, M. et al. Colorimetric method for determination of sugars and related substances. Analytical Chemical, Washington, DC, v. 28, p. 350-356, 1956.
FARRANT, J. M.; PAMMENTER, N. W.; BERJAK, P. Recalcitrance a current assessment. Seed Science and Technology, Bassersdorf, v. 16, p. 155-166,1988.
FERREIRA, A. G.; BORGUETTI, F. (Orgs.). Germinação: do básico ao aplicado. Porto Alegre: Artmed, 2004. 324 p.
FIGLIOLIA, M. B. et al. Conservação de sementes de Euterpe edulis Mart. em diferentes
embalagens e ambientes de armazenamento. Boletim Técnico do Instituto Florestal, São Paulo,
v. 41, n. 2, p. 355-368, 1987.
FOYER, C. Ascorbic acid. In: ALSCHER, R. G.; HESS, J. L. (Eds.). Antioxidants in higher plants. Boca Raton: CRC Press, 1993. p. 31-58.
GALETTI, M. Fruits and frugivores in a brasilian Atlantic forest. 1996. 220 p. Thesis (PhD in Biological Sciences)-Cambrigde University, Cambridge, 1996.
GALETTI, M. Indians within conservation units: Lessons from the Atlantic forest. Conservation Biology, Malden, v. 15, p. 798-799, 2001.
GATSUK, L. E. et al. Age states of plants of various growth forms: a review. Journal of Ecology, Londres, v. 68, p. 675-696, 1980.
GENTIL, D. F. de O.; FERREIRA, S. A. do N. Morfologia da plântula em desenvolvimento de Astrocaryum aculeatum Meyer (Arecaceae). Acta Amazônica, Manaus, v. 35, n. 3, p. 337-342, 2005.