UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE CIÊNCIAS DA SAÚDE
DEPARTAMENTO DE ODONTOLOGIA
PROGRAMA DE PÓS-GRADUAÇÃO EM PATOLOGIA ORAL
LUIZ EDUARDO RODRIGUES JULIASSE
ESTUDO DA EXPRESSÃO IMUNO-HISTOQUÍMICA DAS PROTEÍNAS MMP-9, MMP-13 E TIMP-1 EM AMELOBLASTOMAS E TUMORES ODONTOGÊNICOS
CERATOCÍSTICOS
LUIZ EDUARDO RODRIGUES JULIASSE
Orientadora: Profa. Dra. Roseana de Almeida Freitas
Natal/RN 2014
Dissertação apresentada ao Programa de Pós-graduação em Patologia Oral da Universidade Federal do Rio Grande do Norte como parte dos requisitos para obtenção do Título de Mestre em Patologia Oral.
ESTUDO DA EXPRESSÃO IMUNO-HISTOQUÍMICA DAS PROTEÍNAS MMP-9, MMP-13 E TIMP-1 EM AMELOBLASTOMAS E TUMORES ODONTOGÊNICOS
Catalogação na Fonte. UFRN/Departamento de Odontologia Biblioteca Setorial de Odontologia “Prof. Alberto Moreira Campos”. Juliasse, Luiz Eduardo Rodrigues.
Estudo da expressão imuno-histoquímica das proteínas MMP-9, MMP-13 e TIMP-1 em ameloblastomas e tumores odontogênicos ceratocistos / Luiz Eduardo Rodrigues Juliasse. – Natal, RN, 2014.
85 f. : il.
Orientador: Prof.ª. Dr.ª Roseana de Almeida Freitas.
Dissertação (Mestrado em Patologia) – Universidade Federal do Rio Grande do Norte. Centro de Ciências da Saúde. Programa de Pós-Graduação em Patologia Oral. 1. Ameloblastoma – Dissertação. 2. Tumores Odontogênicos – Dissertação. 3. Metaloproteinases da Matriz – Dissertação. 4. Inibidores teciduais de metaloproteinases – Dissertação. I. Freitas, Roseana de Almeida. II. Título.
“O dom da fala foi concedido aos
homens não para que eles enganassem uns aos outros,
mas sim para que expressassem seus pensamentos uns aos outros”
Santo Agostinho
É com imensa satisfação e emoção que dedico este trabalho àqueles que
são a razão de meu viver:
Aos meus pais, Alba e Wilson, maior graça dada a mim por Deus, vocês
são tudo o que um filho poderia desejar.
AGRADECIMENTOS
É chegado o grande momento.
Quando se deixa guiar pela vontade do Senhor não há dúvidas de que tudo o que
acontece é o melhor e para o melhor. Então devemos agradecer por tudo.
Foram anos imaginando (e desejando), se um dia eu conseguiria ser mestre. Há quase
dez anos ingressei na Base de Pesquisa em Patologia Oral; e este desejo foi amadurecendo em
meu coração. O tempo passou e mesmo com outras atividades sentia que algo me faltava.
Voltei!
Foi muito difícil a caminhada, mas as dificuldades só fazem o gosto da vitória ser ainda
mais saboroso. Afinal, o fracasso nunca alcançará se a vontade de vencer for suficientemente
forte...
Então eu agradeço!
Agradeço primeiramente a Deus, meu Senhor, meu Tudo! Muito obrigado Pai Santo
por ter propiciado coisas em minha vida que eu nunca imaginei que teria...e tão rápido! Que
eu consiga ter fidelidade para alcançar e realizar todos os Seus preceitos em minha vida!
Aos meus pais, Alba e Wilson, maiores presentes de Deus. Vocês são a fonte que gerou
minha essência. Sou eternamente grato por tudo o que vocês fizeram por mim. Me moldaram.
Vocês são os exemplos que procuro seguir em tudo. Tudo o que eu faço é por vocês e pra vocês.
Eu me orgulho demais por ter vocês em minha vida. Amo vocês incondicionalmente!
À minha noiva Lucélia. Mozi, você foi outro presente dado por Deus pra mim. Você me
completa de um jeito surpreendente. Sinceramente, não sei como faria sem tê-la ao meu lado.
Com certeza faria muita besteira hehehe... Muito obrigado por caminhar ao meu lado! Te amo
demais! Você não tem noção...
À minha orientadora Profa. Dra. Roseana de Almeida Freitas. “Somos todos anjos de uma asa só; e só podemos voar quando abraçamos uns aos outros”. Pois é professora, a senhora foi um anjo que Deus colocou em minha vida. Geralmente a escolha dos orientadores
é feita por sorteio, mas no nosso caso não foi, foi uma escolha. Escolha de Deus, já lá desde
muito tempo, na época de iniciação científica... sou muito grato por ter me acolhido e me
ajudado a alçar voo. Nunca esquecerei daquela conversa que tivemos um dia em sua sala,
quando conversávamos sobre meu futuro... naquela conversa pude perceber que a senhora
conseguia olhar para dentro de mim e enxergar o meu ser de uma maneira incrível, que até eu
senhora foi uma mãe. Eu tenho uma admiração enorme pela senhora. Muito obrigado pela paciência, pelos ensinamentos, pela sua dedicação em educar e, sobretudo, por ser “mãe”.
Aos demais professores e exemplos de dedicação à nobre tarefa de ensinar e formar
pessoas:
À coordenadora do Programa de Pós-Graduação em Patologia Oral da UFRN, Profa.
Dra. Lélia Batista de Souza, exemplo de competência e amor à profissão. Ao Prof. Dr. Leão
Pereira Pinto, exemplo de entrega e profissionalismo, sempre de bom humor e cordial; é belo
ver o amor com que o senhor carrega a base de pesquisa em Patologia Oral. O senhor foi,
através da base, o meu primeiro contato com a Patologia, quando nem tinha pago a disciplina
básica ainda. Seu fascínio pela Patologia foi (e ainda é) inspiradora. À Profa. Dra. Hébel
Cavalcanti Galvão, exemplo de alegria. Não me lembro da senhora sem um sorriso no rosto.
Sua alegria é contagiante. Muito obrigado pelas valiosas sugestões oferecidas no exame de
Qualificação deste trabalho. À Profa. Dra. Márcia Cristina da Costa Miguel, exemplo de
sabedoria e inteligência. Ao Prof. Dr. Antônio de Lisboa Lopes Costa, exemplo de caráter e
simplicidade. Admiro muito o senhor. Muito obrigado pelas correções sugeridas no exame de
Qualificação deste estudo. À Profa. Dra. Éricka Janine Dantas da Silveira, a quem tenho
enorme admiração pela inteligência e competência. Muito obrigado professora por todas as
oportunidades dadas a mim na clínica de Estomatologia. À Profa. Dra. Ana Myriam Costa de
Medeiros e Profa. Dra. Lélia Maria Guedes Queiroz, as quais admiro profundamente pela
sabedoria e tranquilidade. À Profa. Dra. Patrícia Teixeira de Oliveira, pelos conhecimentos
transmitidos num dos momentos mais valiosos para mim, a clínica.
Em especial ao Prof. Dr. Manuel Antonio Gordón-Núñez. Meu amigo, tenho enorme
admiração por você. Você é um exemplo de simplicidade e amizade. Sou muito grato por estar
sempre disposto em me ajudar.
Agradeço profundamente à Maria Luiza. Malu, meus pais sempre quiseram ter uma
filha, porém eles não tiveram. Mas por bem Deus quis que eu tivesse sim uma irmã, então me
deu sua amizade. Você é a irmã que eu nunca tive. Mal consigo lembrar de algum momento em
minha vida que não tenha compartilhado com você. Muito obrigado por estar sempre ao meu
lado, em todos os momentos. Serei eternamente grato por tudo que você já fez por mim.
Aos amigos da Patologia... mais presentes de Deus em minha vida. Meus companheiros
de mestrado: Andréia, sempre carinhosa; Luciana, sempre sorrindo; Marcelo, sempre tão
educado; Thaís, sempre meiguinha; Thâmara, sem dúvida uma das pessoas mais engraçadas
determinado e atencioso; e Viviane, sempre simples e interessada. Vocês são todos muito
queridos por mim, de coração.
Aos doutorandos, em especial a minha maninha patológica Melka! Não tenho palavras
o suficiente para agradecer por tudo o que você fez para me ajudar. É incrível sua prontidão
em se dispor aos outros. Você é uma pessoa admirável, sempre sorridente e de alto astral. O
mundo seria muito melhor se as pessoas fossem como você.
À amiga Clarissa, que convive comigo desde tempos de iniciação científica e que me
incentivou ao ingresso no mestrado. Muito obrigado por todo o apoio, dicas, ensinamentos e
por estar sempre disposta a me ajudar. Você é uma pessoa bastante querida.
Aos demais doutorandos, Ana Luiza, Denise, Natália, Roseane, Jadson, Stefânia,
Adriana, Edilmar, Emília, Endrigo, Fernanda, Jamile, Maiara, Nazareno, Rodrigo e Vilson,
com quem tive a graça de conviver. Às quase doutoras Keila e Cynthia. E também àqueles que
já terminaram o doutorado, Fernando, Felipe, Emeline e em especial à Joabe, pela amizade,
momentos de descontração e pela valiosa ajuda na análise estatística desse trabalho. Muito
obrigado à todos por terem compartilhado estes momentos comigo. Todos vocês tornaram o
dia a dia na patologia mais agradável.
Aos funcionários, Gracinha, Hévio, Idel, Lourdinha, Ricardo, Sandrinha e Patrícia.
Muito obrigado por sempre me tratarem tão bem e estarem sempre dispostos a me ajudar.
Vocês fazem acontecer.
Aos meu irmão Leandro, um dos maiores exemplos de minha vida. Seu amor pela
profissão e amizade são admiráveis. Obrigado por tudo! À minha sogra, D. Zeni, obrigado por
me tratar como um filho. Às minha cunhadas, Odisséia e Katarina, obrigado por completarem
minha vida. Ao meu primo Rodrigo, meu brother! Que sempre me apoia em todos os momentos;
e ao grande amigo Eimar Lopes, obrigado por todo apoio e confiança em mim, você é um
exemplo de dedicação e ética que sigo em minha vida profissional.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelo
apoio financeiro que possibilitou a realização dessa pesquisa.
À todos os meus mais sinceros agradecimentos!
Paz e bem!
“
Comece fazendo o que é necessário, depois o que é possível, e
de repente v
ocê estará fazendo o impossível”
RESUMO
Os ameloblastomas e tumores odontogênicos ceratocísticos (TOC) representam lesões odontogênicas que, apesar de sua natureza benigna, se destacam por um comportamento biológico distinto, caracterizado pelo crescimento localmente agressivo e episódios recidivantes. A reabsorção dos ossos gnáticos provocada pelo crescimento dessas lesões constitui um fator determinante à expansão das mesmas, sendo mediada tanto por células osteoclásticas como pela ação enzimática de diversas metaloproteinases de matriz (MMPs). A expressão de fatores estimuladores e inibidores da reabsorção óssea vem sendo correlacionada com o desenvolvimento destas lesões, merecendo destaque algumas MMPs como as colagenases e as gelatinases e os inibidores teciduais de metaloproteinases (TIMPs), dentre outros. Baseados na premissa de que fatores estimuladores e inibidores de processos osteolíticos podem ser determinantes para o ritmo de crescimento de lesões odontogênicas intraósseas, o objetivo de estudo foi avaliar a imunoexpressão das proteínas MMP-9, -13 e TIMP-1 no epitélio e mesênquima de espécimes de ameloblastomas e TOC. A análise estatística foi realizada através dos testes de Mann-Whitney e Wilcoxon com nível de significância estabelecido em 5%. Através de uma análise quantitativa das células imunomarcadas, foi observada a expressão imuno-histoquímica das MMP-9, -13 e TIMP-1 em 100% dos casos, tanto no epitélio quanto no mesênquima tumoral. Mais de 76% das células epiteliais (escore 3) dos TOC e ameloblastomas apresentaram imunomarcação para MMP-9 (p=0,382) e MMP-13 (p=0,069), sendo estatisticamente significativa para o TIMP-1 (p=0,003) nos ameloblastomas. No mesênquima, observou-se maior escore de imunomarcação da MMP-13 (p=0,031) nos ameloblastomas em relação aos TOC, enquanto para a MMP-9 e TIMP-1 não se observou diferença estatisticamente significativa (p=0,403; p=1,000). O cálculo da razão entre os escores de expressão das proteínas revelou, de uma maneira geral, similaridade entre as lesões, sendo observado predomínio significante de igualdade de expressão do TIMP-1 e da MMP-9 apenas no epitélio dos ameloblastomas. A imunoexpressão marcante das MMP-9, MMP-13 e TIMP-1 no epitélio e mesênquima das lesões estudadas indica que estas proteínas participam na remodelação da MEC necessária à progressão tumoral, no entanto, as diferenças pontuais observadas na expressão de algumas destas proteínas, não são suficientes para sugerir diferenças no comportamento biológico dos ameloblastomas e dos TOCs.
ABSTRACT
Ameloblastomas and keratocystic odontogenic tumors (KOT) represent odontogenic
lesions that, despite their benign nature, are distinguished by a distinct biological behavior,
characterized by locally aggressive growth and recurrent episodes. The gnathic bone
resorption caused by the growth of these lesions is a key to the expansion of the same, both
being mediated by osteoclastic cells like enzymatic activity of various matrix
metalloproteinases (MMPs) factor. The expression of stimulatory factors and inhibitors of bone
resorption has been correlated with the development of these lesions, with emphasis to some
MMPs such as collagenases and gelatinases and tissue inhibitors of metalloproteinases
(TIMPs), among others. Based on the premise that stimulatory and inhibitory factors of
osteolytic processes can be decisive for the growth rate of intraosseous odontogenic lesions,
this experiment evaluated the immunoreactivity of MMP-9, -13 and TIMP-1 protein in the
epithelium and mesenchyme of ameloblastoma and the KOT specimens, by a quantitative
analysis of the immunoreactivity cells. Statistical analysis was performed using the
Mann-Whitney and Wilcoxon tests with a significance level set at 5 %. Immunohistochemical
expression of MMP-9, -13 and TIMP-1 was observed in 100% of cases both in the epithelium
and in mesenchyme. The immunoreactivity in the epithelium of KOT and ameloblastomas
revealed a predominance of score 3 for MMP-9 (p=0.382) and MMP-13 (p=0.069) and no
statistically significance for TIMP-1, the latter being significantly higher immunoreactivity in
ameloblastomas. In the mesenchyme, there was a higher score immunoreactivity of MMP-13
(p=0.031) in ameloblastomas in relation to KOT, whereas for MMP-9 and TIMP-1 no
statistically significant difference (p=0.403 was observed, p=1.000). The calculation of the
ratio of scores revealed expression of proteins in general, similarity of the lesions, a significant
predominance of equal expression of TIMP-1 and MMP-9 was observed only in the epithelium
of ameloblastoma. The marked immunostaining of MMP-9 , MMP-13 and TIMP-1 in epithelium
and mesenchyme of the lesion indicate that these proteins involved in ECM remodeling required
for tumor progression, however, specific differences in the expression of some of these proteins,
are not sufficient to suggest differences in the biological behavior of ameloblastomas and
KOTs.
Key-words: Ameloblastoma. Odontogenic Tumors. Matrix Metalloproteinases. Tissue Inhibitor
LISTA DE ILUSTRAÇÕES
Página Quadro 1. Especificações dos anticorpos utilizados na pesquisa. Natal-RN,
2014... 46 Figura 1. Estrutura das famílias das MMPs... 34 Figura 2. Estrutura tridimensional dos TIMP-1 e -2... 39 Figura 3. Distribuição dos escores de imunomarcação para MMP-9, MMP-13
e TIMP-1 no epitélio dos TOC e Ameloblastomas. Natal – RN, 2014. 52 Figura 4. Distribuição dos escores de imunomarcação para MMP-9, MMP-13
e TIMP-1 no mesênquima dos TOC e Ameloblastomas. Natal/RN-2014... 53 Figura 5. Tumor odontogênico ceratocístico – Imunoexpressão da MMP-9
localizada em epitélio e mesênquima. (STUHRP; 400X)... 56 Figura 6. Ameloblastoma – Imunoexpressão da MMP-9 em epitélio e
mesênquima. (STUHRP; 400X)... 56 Figura 7. Tumor odontogênico ceratocístico – Imunoexpressão da MMP-13
localizada em epitélio e mesênquima. (ADVANCE; 400X)... 57 Figura 8. Ameloblastoma – Imunoexpressão da MMP-13 em epitélio e
mesênquima. (ADVANCE; 400X)... 57 Figura 9. Tumor odontogênico ceratocístico – Imunoexpressão da TIMP-1
localizada em epitélio e mesênquima. (ENVISION; 400X)... 58 Figura 10. Ameloblastoma – Imunoexpressão do TIMP-1 em epitélio e
LISTA DE TABELAS
Página Tabela 1. Sistema de escore para a imunoexpressão da MMP-9, MMP-13 e
TIMP-1... 49 Tabela 2. Grupo de tumor, tamanho da amostra, mediana, quartis, média dos
postos e significância estatística para os escores de imunoexpressão de MMP-9, MMP-13 e TIMP-1 no epitélio. Natal, RN – 2014... 53 Tabela 3. Grupo de tumor, tamanho da amostra, mediana, quartis, média dos
postos e significância estatística para os escores de imunoexpressão de MMP-9, MMP-13 e TIMP-1 no mesênquima dos TOC e Ameloblastomas. Natal, RN – 2014... 54 Tabela 4. Distribuição dos casos em relação aos postos de escores de
imunomarcação para o TIMP-1 e MMP-9 no epitélio e no mesênquima dos TOC e Ameloblastomas. Natal, RN – 2014... 54 Tabela 5. Distribuição dos casos em relação aos postos de escores de
LISTA DE SIGLAS E ABREVIATURAS
BFGF Fator de crescimento básico de fibroblastos (do inglês “Basic fibroblast growth factor”)
CD Cisto dentígero
CR Cisto radicular
CEP Comitê de ética em pesquisa
CONEP Comissão nacional de ética em pesquisa Da Dalton (unidade de massa atômica)
EGF Fator de crescimento epidérmico (do inglês “Epidermal growth factor”)
EGFR Receptor do fator de crescimento epidérmico (do inglês “Epidermal growth factor receptor”)
HE Hematoxilina e eosina
Hpx Domínio hemopexina
IL-1α Interleucina-1α IL-1 Interleucina-1β IL-6 Interleucina-6
kDa Kilodalton (1000 x Da) MEC Matriz extracelular
mRNA Ácido ribonucleico mensageiro (do inglês “messenger RNA”) MMP Metaloproteinase de matriz
MMP-2 Metaloproteinase de matriz-2 MMP-8 Metaloproteinase de matriz-8 MMP-9 Metaloproteinase de matriz-9 MMP-13 Metaloproteinase de matriz-13
MT1-MMP Metaloproteinase de matriz transmembranar-1 MT3-MMP Metaloproteinase de matriz transmembranar-3 MT5-MMP Metaloproteinase de matriz transmembranar-5 OMS Organização mundial de saúde
OPG Osteoprotegerina
PDGF Fator de crescimento derivado de plaquetas (do inglês “Platelet-derived growth factor”)
RANK Receptor ativador do fator nuclear kappa B
SCNCB Síndrome do carcinoma nevóide de células basais
TGF-α Fator de crescimento transformador (do inglês “Transforming growth factor alpha”)
TIMP Inibidor tecidual de metaloproteinase TIMP-1 Inibidor tecidual de metaloproteinase-1 TIMP-2 Inibidor tecidual de metaloproteinase-2 TIMP-3 Inibidor tecidual de metaloproteinase-3 TIMP-4 Inibidor tecidual de metaloproteinase-4
TNF-α Fator de necrose tumoral α(do inglês “Tumor necrosis factor”) TOA Tumor odontogênico adenomatoide
SUMÁRIO
1 INTRODUÇÃO
Os tumores odontogênicos constituem lesões de frequência relativamente comum nos ossos gnáticos, com histogênese associada a remanescentes epiteliais e/ou ectomesenquimais relacionados à odontogênese. A Organização Mundial de Saúde (OMS) define os tumores odontogênicos e as lesões semelhantes a tumores como um grupo de doenças heterogêneas que variam desde proliferação hamartomatosa benigna não neoplásica a crescimentos neoplásico benignos e malignos. Os tumores odontogênicos são raros, alguns até mesmo extremamente raros, fato que pode criar desafios diagnósticos e terapêuticos significativos (BARNES et al., 2005).
Dentre os tumores odontogênicos, duas lesões que merecem destaque são os ameloblastomas e os tumores odontogênicos ceratocísticos. O primeiro, embora seja um tumor benigno dos maxilares, se destaca pelo comportamento localmente agressivo e de alto potencial invasivo, o que resulta em um elevado índice de recidiva após enucleação e curetagem (QIAN; HUANG, 2010; HENRIQUES et al., 2011); e ainda que raro, o subtipo sólido é o segundo tumor odontogênico mais comum, sendo menos comum apenas que os odontomas (NEVILLE et al., 2009). O segundo, antes chamado de ceratocisto odontogênico, se caracteriza pelo comportamento diferenciado quando comparado a outros cistos odontogênicos, de tal modo que, devido às suas peculiaridades, como a recorrência e suas características histopatológicas (SCHUSSEL et al., 2011) foi recategorizado, em 2005, pela OMS, como um neoplasma odontogênico benigno, sendo sugerida a denominação de tumor odontogênico ceratocístico, por ser uma lesão de natureza localmente agressiva e com alta taxa de recorrência (LEONARDI et al. 2010; SANTOS et al., 2011; RIBEIRO et al., 2012).
A matriz extracelular é um componente essencial do microambiente estromal, que além de servir como arcabouço para os elementos celulares, exerce profunda influência sobre o comportamento celular, afetando o crescimento, a diferenciação, mobilidade e viabilidade. A homeostase tecidual é garantida pelo equilíbrio entre as células e o microambiente do estroma circundante. Tal microambiente pode ser perturbado por condições patológicas, onde a alteração celular se estabelece junto com a superexpressão de proteases que modificam a composição da matriz extracelular (MARASTONI et al., 2008). A invasão tumoral é um processo onde as células neoplásicas destroem e infiltram o tecido normal adjacente à massa
degradação proteolítica da MEC; e por fim, (3) migração das células através da área lesada. No caso dos tumores odontogênicos, a reabsorção óssea promovida pela degradação da MEC circundante seria a responsável pela progressão e expansão tumoral.
Nesse sentido, muitos estudos apontam que a interação entre as MMPs e TIMPs é considerada um possível fator regulador determinante na proliferação das células tumorais, estabilização e agressividade dos diferentes cistos e tumores odontogênicos (SIQUEIRA et al., 2010; HENRIQUES et al., 2011; RIBEIRO et al., 2012).
2 REVISÃO DA LITERATURA
A OMS define os tumores odontogênicos e as lesões semelhantes a tumores, como um grupo de doenças heterogêneas, cujos limites compreendem desde proliferação de tecido hamartomatoso benigno não neoplásico, até tumores malignos com potencial de metástases. Tais tumores são derivados de elementos formadores de dente e aparelho de suporte, epiteliais, ectomesenquimáticos e/ou mesenquimáticos. Os tumores odontogênicos são raros, alguns até mesmo extremamente raros, fato que pode criar desafios diagnósticos e terapêuticos significativos (BARNES et al., 2005). Dentre estes tumores, destacam-se pela frequência e pelo comportamento biológico, dois representantes de natureza benigna, originados a partir de epitélio odontogênico com estroma fibroso maduro, sem participação do ectomesênquima odontogênico, que são o ameloblastoma sólido/multicístico ou convencional e o tumor odontogênico ceratocístico (PHILIPSEN et al., 2005).
2.1 AMELOBLASTOMA
O ameloblastoma é um tumor odontogênico benigno dos maxilares, porém localmente agressivo e de alto potencial invasivo, o que resulta em um elevado índice de recidiva após enucleação e curetagem (variando de 20% a 90% dos casos) (MEER et al., 2003; QIAN; HUANG, 2010; HENRIQUES et al., 2011) e representa 1% de todas as neoplasias da cavidade oral (SADDY et al., 2005; BARNES et al., 2005). Teoricamente podem se originar de remanescentes da lâmina dentária, do órgão do esmalte em desenvolvimento, do revestimento epitelial de um cisto odontogênico ou das células da camada basal do epitélio de mucosa bucal (ADEBIYI et al., 2006; NEVILLE et al., 2009).
Na classificação da OMS (2005), os ameloblastomas ocorrem em quatro situações clínico-radiográficas distintas: (1) tipo sólido/multicístico – que representam cerca de 80% dos casos; (2) tipo periférico/extra-ósseo – compreende de 1,3% a 10% de todos os ameloblastomas; (3) tipo desmoplásico – variando de 1,28% a 5,19% dos casos; e (4) tipo unicístico, que correspondem de 5% a 15% dos ameloblastomas (BARNES et al., 2005; DHANUTHAI et al., 2012).
retrospectivo, encontraram uma incidência de 201 tumores odontogênicos, sendo o ameloblastoma o segundo tumor de maior frequência, representando 29,8% dos tumores.
Clinicamente, os ameloblastomas do tipo sólido apresentam evolução lenta e geralmente assintomática. Mais comumente, exibem expansão da cortical óssea, o que pode provocar tumefação gengival, mobilidade dentária e até mesmo perda espontânea de dentes. Raramente apresenta dor ou parestesia e, quando não tratado, pode assumir proporção grotesca. A localização mais frequente é em mandíbula posterior.
Ao exame radiográfico observa-se uma lesão radiolúcida multilocular, com aspectos
semelhantes a “bolhas de sabão” e expansão das corticais ósseas vestibular e lingual. Por vezes
observa-se reabsorção ou deslocamento das raízes dentais ou um dente incluso envolvido (BACHMANN; LINFESTY, 2009).
De acordo com a OMS (2005), histologicamente os ameloblastomas apresentam cinco padrões distintos: folicular, plexiforme, acantomatoso, de células granulares e de células basais; sendo os padrões folicular e o plexiforme os mais comuns (BARNES et al., 2005). O padrão folicular caracteriza-se por ilhas de epitélio circundadas por células colunares ou cuboidais com polaridade invertida em um estroma de tecido conjuntivo fibroso. As células centrais estão arranjadas frouxamente lembrando o retículo estrelado do órgão do esmalte. O padrão plexiforme é caracterizado pela presença de cordões de epitélio odontogênico anastomosados, delimitados por células cuboidais, colunares, semelhantes a ameloblastos circundando células epiteliais arranjadas frouxamente. No padrão acantomatoso observa-se extensa metaplasia escamosa, frequentemente associada a formação de ceratina, na região central de um ameloblastoma folicular. A presença de células cuboidais, colunares ou arredondadas, contendo grânulos eosinofílicos com citoplasma abundante caracterizam o padrão de células granulares, enquanto a presença de células basalóides se proliferando em ninhos ou cordões com células periféricas cúbicas, sem a presença de retículo estrelado no centro, caracteriza o ameloblastoma sólido com padrão de células basais (BARNES et al., 2005; BACHMANN; LINFESTY, 2009; FULCO et al., 2010).
20% a 90% recidivam após abordagem cirúrgica conservadora (enucleação seguida de curetagem) (MEER et al., 2003).
2.2 TUMOR ODONTOGÊNICO CERATOCÍSTICO
Antes denominado ceratocisto odontogênico, era definido como um cisto de desenvolvimento, sendo reclassificado em 2005, pela OMS, como um neoplasma cístico odontogênico benigno, onde foi sugerida a denominação de tumor odontogênico ceratocístico (TOC), por ser uma lesão de natureza localmente agressiva e com alta taxa de recorrência (LEONARDI et al., 2010; SANTOS et al., 2011; RIBEIRO et al., 2012).
Em detrimento de seu comportamento biológico distinto, muitos estudos têm se dedicado a compreender os mecanismos envolvidos que justifiquem a progressão deste tumor e sua alta agressividade. Desta maneira, estudos têm demonstrado, através da técnica de imuno-histoquímica, que essa lesão diferentemente das outras lesões císticas de origem odontogênica, apresenta maior índice de proliferação celular (KICHI et al., 2005; KOLÁŘ et al., 2006; TSUNEKI et al., 2008), maior expressão de fatores de crescimento (LI; BROWNE;
MATTHEWS, 1997; KOLÁŘ et al., 2006; SUYAMA et al., 2008), de proteínas
anti-apoptóticas (KICHI et al., 2005; KOLÁŘ et al., 2006; VERED et al., 2009), além de proteínas
supressoras tumorais (SHEAR, 2002; KICHI et al., 2005).
Os TOCs podem aparecer como lesões solitárias ou múltiplas, sendo a multiplicidade de lesões bem reconhecida na síndrome do carcinoma nevóide de células basais (SCNCB), também chamada síndrome de Gorlin-Goltz (EVANS et al., 1993; KICHI et al., 2005; LEONARDI et al., 2010). Os tumores sindrômicos tendem a ser maiores, mais agressivos e com maior potencial recidivante (HENRIQUES et al., 2011).
A origem dos TOCs é incerta, mas acredita-se ser proveniente de remanescentes da lâmina dental localizados dentro dos maxilares, onde esses remanescentes epiteliais odontogênicos seriam estimulados por fatores ainda desconhecidos (SHEAR, SPEIGTH, 2007).
o gene causador da doença na síndrome de Gorlin-Goltz (HAHN et al.,1996; JOHNSON et al., 1996).
Segundo Domingues e Gil (2007) e Li (2011), esses achados indicam que defeitos do PTCH1 estão envolvidos tanto na patogênese da síndrome quanto na dos casos esporádicos. Os autores afirmam, ainda, que as alterações desses genes estão associadas aos TOCs mostrando um aumento da atividade proliferativa da camada epitelial, demonstrando, assim, um fenótipo de alta tendência à recorrência, o que poderia explicar a agressividade da lesão e suportar sua característica neoplásica.
Mesmo passando a ser considerado como um tumor odontogênico pela OMS, em 2005, alguns autores ainda o enquadram dentre as lesões císticas e relatam que os mesmos correspondem de 3% a 11% de todos os cistos odontogênicos (VICENTE et al., 2010).Souza et al. (2010) determinaram a distribuição de cistos odontogênicos na população brasileira durante um período de 38 anos, de acordo com idade, gênero e sítio afetado. Dos 1019 casos entre os anos de 1970 e 2007, 65 casos (6,4%) foram diagnosticados como ceratocisto odontogênico, sendo a terceira lesão cística mais comum.
O pico de ocorrência dos TOCs corresponde à segunda e terceira décadas de vida, porém podem surgir desde primeira até a nona década de vida, acometendo mais pacientes do gênero masculino. A mandíbula é afetada em 60 a 80% dos casos, com maior tendência de envolver a região posterior do corpo mandibular e ramo ascendente (BARNES et al., 2005; SHEAR; SPEIGHT, 2007; NEVILLE et al., 2009).
Comumente são assintomáticos, no entanto as lesões maiores podem estar associadas a dor, tumefação ou drenagem. Entretanto, há relatos de alguns tumores extremamente grandes e assintomáticos (NEVILLE et al., 2009; COTTOM et al., 2012).
Radiograficamente, os TOCs podem se apresentar como radiolucência bem definida, circular ou ovóide, pequena e uni ou multilocular (CHIRAPATHOMSAKUL; SASTRAVAHA; JANSISYANONT, 2006; KUMAMOTO, 2006; SHEAR; SPEIGHT, 2007). Lesões maiores, particularmente acometem a região posterior da mandíbula envolvendo o ângulo e ramo ascendente e podem deslocar o nervo alveolar inferior (SHEAR, 2002; MENDES; CARVALHO; VAN DER WAAL, 2010).
permeio. Ilhas, cordões e cistos satélites no interior da cápsula também podem ser observadas. Displasia epitelial ocasional pode estar presente, no entanto a transformação maligna é rara (BARNES et al. 2005; GOMES et al., 2009; LI, 2011).
O principal tratamento de escolha é a enucleação cirúrgica. A completa remoção da lesão é, muitas vezes, difícil devido à natureza friável e à espessura fina da cápsula (NEVILLE et al., 2009). Pogrel (2013) propôs um esquema de tratamento que consiste em biópsia incisional com instalação de dreno. Após o diagnóstico de TOC o dreno é mantido, com irrigações duas vezes ao dia e controle radiográfico. Após a redução da lesão é feita a enucleação juntamente com crioterapia e a remoção do dente adjacente, caso exista. A atual literatura reporta uma ampla taxa de recorrência para as diferentes opções de tratamento cirúrgico (0% a 62%), com a maioria dos casos recorrendo dentro dos primeiros cinco anos pós-tratamento (NEVILLE et al., 2009; KINARD et al., 2013).
2.3 METALOPROTEINASE DE MATRIZ (MMP)
As MMPs são classificadas como uma subfamília de proteinases da família de metaloproteinases zinco-dependentes M10, especializadas na clivagem das proteínas extracelulares (ANDERSEN et al., 2004; NAGASE et al., 2006; HANNAS et al., 2007; KRANE, INADA, 2008). A família de MMPs inclui pelo menos 24 membros bem caracterizados, que podem ser classificados em subgrupos de acordo com sua especificidade para determinados substratos e por sua homologia de subsequências em 5 subfamílias: colagenases 1, -8 e -13); gelatinases/colagenase IV 2 e -9); estromelisina 3 e -10); MMPs tipo membrana (MT-MMPs, MMP-14, -15, -16 e -17) e outras MMPs (MMP-7, -11, -12, -19, -20 e outras) (KUMAMOTO et al., 2003; ZHANG et al., 2005; GEORGES et al., 2009).
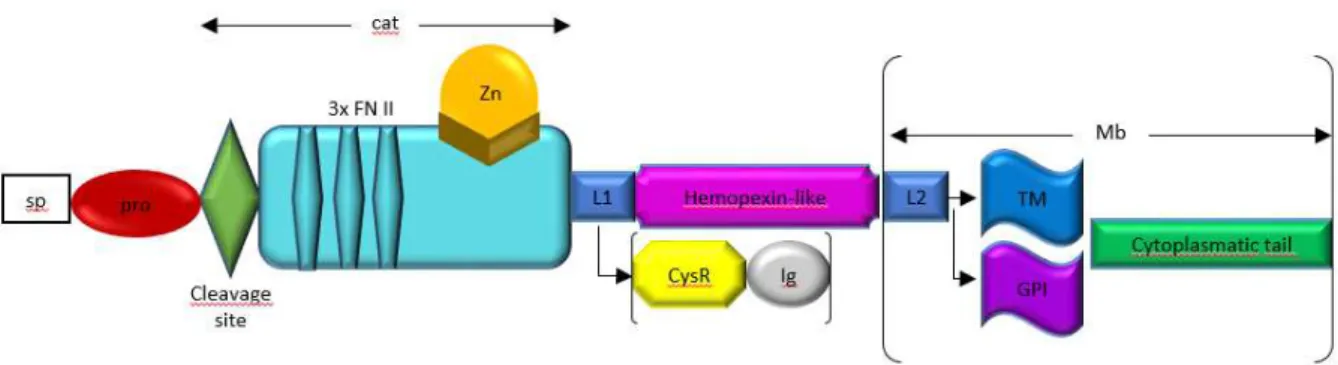
Uma MMP típica consiste em um pro-peptídeo com cerca de 80 aminoácidos, um domínio catalítico com cerca de 170 aminoácidos, um peptídeo ligante de variados tamanhos,
também chamado de “hinge region”, e um domínio hemopexina (Hpx), com aproximadamente
Figura 1. Estrutura das famílias das MMPs.
Fonte: Adaptado de Nagase, Visse e Murphy, 2006.
Legenda: sp, sinal de sequência; pro, pró-domínio; cat, domínio catalítico; FNII, fibronectina tipo II; L1, ligante 1; CysR, rico em cisteína; Ig, domínio imunoglobulina; L2, ligante 2; Mb, membrana plasmática; TM, domínio transmembrana; GPI, ancora glicosilfosfatidilinositol.
A atividade funcional das MMPs é regulada por 4 mecanismos: (1) por controle transcricional positivo e negativo dos genes de MMP; (2) pela ativação de estado latente; (3) pelas diferenças entre substratos específicos; ou (4) por modulação através dos inibidores teciduais de metaloproteinases (TIMPs) (DEW et al., 2000; HANNAS et al., 2007). A degradação da matriz extracelular (MEC), mediada por MMPs, é uma característica importante do desenvolvimento, morfogênese, reparo tecidual e remodelagem. É precisamente regulada sob condições fisiológicas normais, mas quando se encontra desregulada pode causar diversas doenças tais como artrite, nefrite, câncer, encefalomielite, úlceras crônicas, fibrose, entre outras (NAGASE; VISSE; MURPHY, 2006).
Além das MMPs e seus inibidores teciduais, a expressão de outros biomarcadores está envolvida no processo de reabsorção óssea e no desenvolvimento de lesões odontogênicas, como RANK/RANKL/OPG (KUMAMOTO; OOYA, 2004; SILVA et al., 2008), IL-1α (KUBOTA, SHIRASUNA, 2007; SUYAMA et al., 2008) e TNF-α (KUMAMOTO, OOYA, 2006).
Acredita-se que, células tumorais no microambiente de um tecido ósseo, iniciam uma resposta inflamatória que leva ao recrutamento de osteoclastos ativados e então, à reabsorção óssea, criando um meio favorável ao seu próprio crescimento, contribuindo para o desenvolvimento do tumor (STEEVE et al., 2004). Silva et al. (2008) afirmam que o desequilíbrio na ação de fatores sinalizadores de processos de diferenciação e ativação osteoclásticas pode contribuir para a reabsorção óssea envolvida no crescimento de ameloblastomas, TOCs e cistos dentígeros.
Assim, a participação das MMPs na progressão tumoral tem sido amplamente estudada. De acordo com Ribeiro et al. (2012), os tumores são tipicamente circundados por MEC. A invasão tumoral é um processo neoplásico em que as células neoplásicas destroem e infiltram o tecido normal ao redor da massa tumoral principal. Segundo esses autores, este processo pode ser analisado em três estágios, que se inicia pela adesão da célula tumoral à MEC, seguida pela degradação proteolítica da MEC, e finalmente, migração das células neoplásicas pela área lesada, sendo essa degradação da MEC realizada pelas MMPs.
Embora alguns autores discordem de que as MMPs atuem como as principais proteínas envolvidas no processo de degradação da MEC e consequente reabsorção óssea e progressão tumoral (FULLER; KIRSTEN; CHAMBERS, 2007), diversos estudos apontam que as MMPs podem modular outras funções no microambiente tumoral em adição à sua atividade proteolítica, interagindo com a MEC liberando e ativando diferentes fatores de crescimento; assim, as MMPs são reguladoras das funções celulares tanto em condições fisiológicas quanto patológicas (SANTOS et al., 2011; RIBEIRO et al., 2012).
2.3.1 Metaloproteinase de matriz – 9 (MMP-9)
A MMP-9 é uma colagenase que possui 92 kDa em sua forma latente e 83 kDa em sua forma ativa (KUBOTA et al., 2000). É também chamada de gelatinase B (ANNE et al., 2013), sendo assim denominada em função de sua capacidade de degradar colágeno desnaturado (gelatina) (THOMAS; LEWIS; SPEIGHT, 1999).
Segundo Pinheiro et al. (2004), a MMP-9 não apenas contribui para a degradação óssea, mas também atua como uma reguladora no processo de reabsorção óssea inicial. É considerada a proteinase mais importante envolvida na reabsorção óssea devido os osteoclastos expressarem essa enzima em níveis extremamente elevados (ANNE et al., 2013).
Segundo Santos et al. (2011), o papel da MMP-9 no desenvolvimento dos TOCs, cistos dentígeros e cistos radiculares está associado à regulação de fatores ligados à proliferação e migração celular, apoptose e respostas imune e inflamatória.
Henriques et al. (2011) sugeriram que a interação entre a produção de MMP-9 e TIMP-2 e a degradação dos componentes da membrana basal contribuem para os distintos comportamentos dos ameloblastomas e TOCs quando comparados com cistos dentígeros e radiculares.
Juntamente com a MMP-2, possui um papel importante na tumorigênese pela habilidade de degradar colágeno tipo IV, que constitui o maior componente da membrana basal e representa o primeiro obstáculo para invasão e metástase das células tumorais (HONG et al., 2000; ROBINSON et al., 2003; RIBEIRO et al., 2012). Muitos cistos dentígeros têm apresentado uma contínua positividade para colágeno tipo IV na membrana basal do epitélio, enquanto nos TOCs e ameloblastomas uma presença mais marcante e difusa tem sido identificada tanto nas células epiteliais quanto nas mesenquimais (ANNE et al., 2013).
O estudo de Kumamoto et al. (2003) avaliou a expressão imuno-histoquímica de algumas MMPs, dentre elas a MMP-9, e seus inibidores teciduais (TIMPs) em casos de ameloblastomas e germes dentários. Os resultados deste estudo apontaram que a expressão estromal da MMP-9 nos ameloblastomas foi significantemente maior que no componente mesenquimal dos germes dentários, sugerindo que uma produção aumentada desta MMP poderia estar relacionada com a alteração neoplásica dos tecidos odontogênicos.
permitiu a indução da diferenciação osteoclástica com consequente atividade de reabsorção óssea pelas células de ameloblastomas. Porém, ao incluir o TIMP-1 ao sistema, a atividade inibitória desta proteína sobre a MMP-9 não mostrou um efeito inibitório significativo no processo de reabsorção óssea. Portanto, esses autores sugeriram que a MMP-9 poderia participar na degradação da matriz óssea, entretanto não seria a principal protease envolvida.
Contudo, a expressão de MMP-9 tem sido demonstrada como um importante fator para o estabelecimento das diferenças entre o comportamento biológico de lesões odontogênicas mais indolentes, tais como os cistos dentígeros, cistos radiculares e tumores odontogênicos adenomatóides (TOAs), e as mais agressivas, como os TOCs e ameloblastomas (RIBEIRO et al, 2009; HENRIQUES et al., 2011; FINKELSTEIN et al., 2013).
Uma expressão elevada dessa protease tanto em células neoplásicas quanto estromais, também foi encontrada por Siqueira et al. (2010), quando compararam o comportamento biológico de ameloblastomas e tumores odontogênicos císticos calcificantes (TOCCs). Esses autores sugerem que mecanismos independentes envolvendo a síntese dessas MMPs e a atividade proliferativa contribuem para a invasão local dos ameloblastomas, influenciando seu comportamento biológico agressivo.
Ribeiro et al. (2012) avaliaram a expressão das MMPs em relação à agressividade e atividade proliferativa de TOCs e encontraram uma expressão significativamente mais abundante de MMP-9 nesses tumores quando comparados ao TOCCs, que são caracterizados como tumores minimamente invasivos, isto é, não agressivos.
2.3.2 Metaloproteinase de matriz – 13 (MMP-13)
A MMP-13, ou colagenase-3, foi originalmente relacionada ao câncer de mama (FREIJE, DÍEZ-ITZA, BALBIN, 1994), sendo produzida tanto por fibroblastos e células do epitélio escamoso maligno, como por células plasmáticas associadas à lesão óssea destrutiva (WAHLGREN et al., 2001, 2003).
Juntamente com as MMP-1 e MMP-8, constituem as principais proteinases capazes de iniciar a degradação de vários colágenos fibrilares nativos, incluindo os colágenos I, II, III e IV (STAMENKOVIC, 2000).
O colágeno é considerado o principal componente orgânico do tecido ósseo normal e a proteína mais abundante da matriz extracelular intersticial. Sendo que em mamíferos, o colágeno tipo I representa cerca de 90% do total dessas proteínas fibrosas (BRASILEIRO FILHO, 2004; COWAN et al., 2009).
A MMP-13 exerce um papel essencial na cascata de ativação de MMPs, tanto ativando como sendo ativada por outras MMPs (LEEMAN et al., 2002) e tem seu efeito biológico marcadamente relacionado com a ativação de células osteoclásticas (HANNAS et al., 2007).
Desde a descoberta de seu envolvimento com tumores em humanos em 1994, a expressão elevada de MMP-13 tem sido encontrada em diferentes malignidades, sendo relacionada tanto com o comportamento do tumor quanto com o prognóstico do paciente (FREIJE et al., 1994; JOHANSSON et al., 1997; NIELSEN et al., 2001).
Escassos trabalhos são relatados na literatura quanto a expressão da MMP-13 em lesões odontogênicas, porém, seu papel na progressão de outros tumores tem sido bastante demonstrado, tais como em câncer de cabeça e pescoço, de laringe, de mama, gástrico, condrossarcoma, coloretal, carcinomas vulvares e linfomas epiteliais malignos (FREIJE et al., 1994; JOHANSSON et al., 1997; JOHANSSON et al., 1999; PENDÁS et al., 2000; DEL CASAR LIZCANO et al., 2003; KRECICKI et al., 2003; CULHACI et al., 2004; ROEB et al., 2004; CORTE et al., 2005; LUUKKAA et al., 2006; KUDO et al., 2012).
Leonardi et al. (2010) sugeriram que a MMP-13 pode induzir a migração epitelial e o potencial de crescimento dos TOCs, quando comparados a outros cistos odontogênicos, tais como os cistos dentígeros e radiculares. Estes autores encontraram uma expressão mais proeminente desta MMP no estroma da lesão, principalmente quando associadas à SCNCB, o que pode justificar a maior agressividade dos ceratocistos odontogênicos sindrômicos quando comparados aos casos esporádicos.
2.4 INIBIDOR TECIDUAL DE METALOPROTEINASE (TIMP)
estão envolvidos no desenvolvimento de células germinativas e têm efeito na angiogênese e na migração e apoptose celular (WESTERMARCK, KAHARI, 1999; SIQUEIRA et al., 2010; MATOS et al., 2012).
Os TIMPs são proteínas pequenas de aproximadamente 2500 Da, cuja estrutura se divide em: domínio N-terminal e o subdomínio C-terminal (BORD et al., 1999; NAGASE; VISSE; MURPHY, 2006; KRANE, INADA, 2008) (Figura 2).
Figura 2. Estrutura tridimensional dos TIMP-1.
Fonte: Nagase, Visse e Murphy, 2006.
Há, atualmente, quatro membros conhecidos dessa família: TIMP-1, -2, -3 e -4, que exibem 30 a 40% de homologia na cadeia de aminoácidos e possuem 12 resíduos de cisteína conservados (WESTERMARCK, KAHARI, 1999; CURRAN, MURRAY, 2000). Thomas, Lewis e Speight (1999) relataram em sua revisão que os TIMP-1 e -2 são expressos por muitos tipos celulares, enquanto o TIMP-3 parece estar associado a tecidos conjuntivos. A expressão do TIMP-1 e TIMP-3 é induzida por uma ampla variedade de agentes, enquanto a expressão do TIMP-2 é constitutiva. O padrão de expressão do TIMP-4 parece mais restrito que os outros TIMPs. Os TIMPs podem ser encontrados na forma de proteínas secretadas ou encontrados na superfície celular associados à proteínas constituintes da membrana celular (GEORGES et al., 2009).
O equilíbrio entre MMPs e TIMPs determina, em última instância, a extensão da degradação da MEC em condições fisiológicas e patológicas (BORD et al., 1999; KUMAMOTO et al., 2003). Assim, dentre várias condições patológicas, vem surgindo estudos sobre essa relação na biologia do câncer oral (BIRKEDAL-HANSEN et al., 2000; TAKAOKA et al., 2006; FULLÁR et al., 2012; SUAREZ-ROA et al., 2012) e dos cistos e tumores odontogênicos (KUMAMOTO, 2003; SILVEIRA et al., 2007; GOMES et al., 2010; LEONARDI et al., 2010; SIQUEIRA et al., 2010; RIBEIRO et al., 2012).
Nesse sentido, muitos estudos apontam que a interação entre as MMPs e TIMPs é considerada um possível fator regulador determinante na proliferação das células tumorais, estabilização e agressividade dos diferentes cistos e tumores odontogênicos (SIQUEIRA et al., 2010; HENRIQUES et al., 2011; RIBEIRO et al., 2012).
2.4.1 Inibidor tecidual de metaloproteinase – 1 (TIMP-1)
O TIMP-1 é uma proteína glicosilada de 28 kDa (BORD et al., 1999). Embora os TIMPs inibam todas as MMPs, o TIMP-1 é um pobre inibidor para MMP-19 e para MMPs ancoradas à membrana plasmática, MT1-MMP, MT3-MMP e MT5-MMP (NAGASE; VISSE; MURPHY, 2006).
Muitos dos fatores que estão envolvidos com a regulação e expressão do TIMP-1, também estão implicados na regulação do crescimento celular e no funcionamento da IL-1b, IL-6,
TNF-α, EGF, BFGF, PDGF, dentre outros. De grande interesse é o fato de que muitos desses fatores
regulam a expressão de proteínas da matriz extracelular e de MMPs (THOMAS; LEWIS; SPEIGHT, 1999).
tumorais. Esses autores sugerem, assim, que o TIMP-1 estaria atuando na regulação das MMPs em um processo que estaria relacionado com a supressão tumoral.
Siqueira et al., (2010) avaliaram a expressão de MMPs e TIMPs na evolução do padrão de invasão do ameloblastoma e observaram que os níveis de expressão tanto de fatores de crescimento quanto de MMPs e TIMPs estavam significativamente aumentados quando comparados aos dos TOCCs, concluindo que o envolvimento dessas proteínas entre si exercem um papel importante no comportamento biológico dos ameloblastomas.
3 PROPOSIÇÃO
4 MATERIAL E MÉTODOS
4.1 CONSIDERAÇÕES ÉTICAS
Este estudo constitui parte de um projeto de pesquisa cadastrado na Comissão Nacional de Ética em Pesquisa (CONEP) e submetido à análise do seu conteúdo pelo Comitê de Ética em Pesquisa – CEP da Universidade Federal do Rio Grande do Norte, sendo aprovado sob parecer nº 175/2010.
4.2 CARACTERIZAÇÃO DO ESTUDO
O presente estudo caracterizou-se por uma pesquisa laboratorial, consistindo de uma análise imuno-histoquímica descritiva e comparativa, da expressão da MMP-9, MMP-13 e do TIMP-1 em espécimes de TOC e ameloblastomas.
4.3 POPULAÇÃO
A população deste estudo foi constituída por todos os casos de TOC e ameloblastomas arquivados no Serviço de Anatomia Patológica da Disciplina de Patologia Oral do Departamento de Odontologia da Universidade Federal do Rio Grande do Norte (UFRN).
4.4 AMOSTRA
A amostra do estudo foi intencional e constituída por 40 espécimes de tumores odontogênicos sendo 20 espécimes de ameloblastomas sólidos/multicísticos e 20 espécimes de TOCs, de acordo com a última classificação da OMS (BARNES et al., 2005).
4.5 CRITÉRIOS DE SELEÇÃO DA AMOSTRA
4.5.1 Critérios de inclusão
4.5.2 Critérios de exclusão
Foram excluídos do estudo os espécimes com material insuficiente para análise imuno-histoquímica.
Sendo assim, em nosso estudo foram excluídos dois casos de TOC corados, respectivamente, pela MMP-13 e TIMP-1.
4.6 ESTUDO MORFOLÓGICO
Para o estudo morfológico, examinou-se sob microscopia de luz as lâminas confeccionadas e arquivadas no Laboratório de Anatomia Patológica da Disciplina de Patologia Oral da UFRN, previamente submetidas a cortes histológicos de 5μm de espessura e coradas pela técnica de rotina da hematoxilina e eosina (H.E). Aspectos referentes à presença dos componentes epiteliais e mesenquimais foram observados para seleção e composição da amostra.
4.7 MÉTODO IMUNO-HISTOQUÍMICO
Toda a amostra selecionada, fixada em formol a 10% e incluída em parafina, foi submetida a cortes histológicos de 3 µm de espessura que, foram estendidos em lâminas de vidro previamente limpas e desengorduradas, preparadas com adesivo a base de Organosilano (3-aminopropyltrietroxisilano, Sigma Chemical CO, USA). Esses cortes histológicos foram corados pelo método da estreptoavidina-biotina (streptavidin-biotin complex, SABC) utilizando-se os anticorpos anti-MMP-9, anti-MMP-13 e anti-TIMP-1 (Quadro 1).
Quadro 1. Especificações dos anticorpos utilizados na pesquisa. Natal-RN, 2014.
*Novocastra Laboratories LTDA; **NeoMarkers, Fremont, CA, USA; ***EMD MilliporeCorp., Billerica, MA.
Especificidade e
Clone Fabricante Diluição Recuperação Antigênica Incubação
MMP-9 (15W2) Novocastra* 1:80 Citrato pH 6,0 Overnight
MMP-13 (3533-100) Neo Markers** 1:250 Citrato Pascal 60’
4.7.1 Coloração pelo método imuno-histoquímico
A técnica utilizada seguiu o seguinte protocolo:
Desparafinização – realizada por meio de 2 banhos em xilol, sendo o primeiro em temperatura de 60ºC durante 30 minutos e o segundo em temperatura ambiente durante 20 minutos;
Reidratação em banhos de etanóis com concentrações decrescentes:
Álcool etílico absoluto I (5 minutos);
Álcool etílico absoluto II (5 minutos);
Álcool etílico absoluto III (5 minutos);
Álcool etílico 95 GL (5 minutos);
Álcool etílico 80 GL (5 minutos).
Imersão em solução de hidróxido de amônia a 10% por 10 minutos, com a finalidade de remoção do pigmento formólico;
Lavagem do material em água corrente por 10 minutos e duas passagens por agua destilada deionizada;
Recuperação antigênica de acordo com as especificações sugeridas pelo fabricante de cada anticorpo;
Passagem em água corrente durante 10 minutos;
Imersão em água destilada por 2 vezes, com tempo de 5 minutos cada;
Duas incubações dos cortes, durante 15 minutos cada, em solução de peroxido de hidrogênio a 10 volumes;
Lavagem em água corrente durante 10 minutos;
Duas imersões em água destilada, com tempo de 5 minutos cada;
Duas passagens em solução de Tween 20 a 1% em TRIS-HCI (pH 7,4) por 5 minutos cada;
Incubação dos cortes com os anticorpos primários diluídos em preparado com albumina bovina (BSA) a 1% (a diluição e o tempo de incubação serão realizados de acordo com as especificações sugeridas pelo fabricante de cada anticorpo);
Duas passagens em solução de Tween 20 a 1% em TRIS-HCI (pH 7.4) por 5 minutos cada;
Duas passagens em solução de Tween 20 a 1% em TRIS-HCI (pH 7.4) por 5 minutos cada;
Incubação com o complexo estreptavidina-biotina (Dakocytomation LSAB + System-HRP, Dakocytomation, A/S, Glostrup, Dinamarca), diluído em tampão TRIS-HCI (pH 7.4), durante 30 minutos à temperatura ambiente;
Lavagem com TRIS-HCI (pH 7.4);
Incubação em duas trocas de TRIS-HCI (pH 7.4) por 5 minutos cada;
Aplicação do agente cromógeno diaminobenzidina (DAB), durante 3 minutos, diluída em TRIS-HCI (pH 7.4) e ativada pelo peroxido de hidrogênio a 10 volumes, em câmara escura;
Lavagem em água corrente e água destilada durante 10 minutos cada;
Contra-coloração utilizando hematoxilina de Mayer durante 10 minutos;
Desidratação em série de etanóis com concentrações ascendentes:
Álcool etílico 80 GL (3 minutos);
Álcool etílico 95 GL (3 minutos);
Álcool etílico absoluto I (3 minutos);
Álcool etílico absoluto II (3 minutos);
Álcool etílico absoluto III (3 minutos).
Imersão em xilol I (5 minutos);
Imersão em xilol II (5 minutos);
Montagem em resina Permount para observação ao microscópio de luz.
4.7.2 Análise imuno-histoquímica
imunomarcadas foram contadas com a utilização do software ImageJ (ImageJ para Windows, versão 1.47, 64-bit Java: Wayne Rasband, National Innstitute of Health, USA) sendo calculado, então, o número médio de células positivas e negativas por campo em cada caso. Esses números foram utilizados para o cálculo da razão entre os diferentes fatores ativadores de osteólise ou inibidores de osteólise, definindo, então, a expressão predominante em cada caso e em cada grupo de tumor estudado, classificando-os em escores de acordo com o metodologia adaptada proposta por Moraes et al. (2011) (tabela 1).
Tabela 1. Sistema de escore para a imunoexpressão das MMPs -9 e -13 e TIMP-1.
Escore Padrão de imunoexpressão Classificação
MMP-9, MMP-13 e TIMP-1
0 <10% de células positivas 0 ou expressão ausente 1 11 – 25% de células positivas Expressão fraca 2 26 – 75% de células positivas Expressão moderada 3 >76% de células positivas Expressão forte
4.8 ANÁLISE ESTATÍSTICA
Após a coleta dos dados, os mesmos foram digitados em planilha eletrônica Excel (Microsoft Office 2013® para Windows) e, posteriormente, exportados para o programa estatístico SPSS (Statistical Package for the Social Sciences) na versão 20.0, no qual foi, à princípio, realizada a análise descritiva dos dados e, em seguida, os testes estatísticos pertinentes, descritos abaixo.
Para comparar os escores de imunoexpressão de MMP-9, MMP-13 e TIMP-1 no epitélio e mesênquima com o tipo de lesão (TOC e Ameloblastoma) foi realizado o teste não-paramétrico de Mann-Whitney. Para análise da razão entre os escores de imunomarcação de MMP-9 e TIMP-1, como também de MMP-13 e TIMP-1, no epitélio e mesênquima dos TOCs e Ameloblastomas utilizou-se o Wilcoxon signed rank test.
5 RESULTADOS
5.1 RESULTADOS IMUNO-HISTOQUÍMICOS
5.1.1 Análise descritiva da expressão de MMP-9, MMP-13 e TIMP-1
A presente amostra foi intencional e composta por 20 casos de ameloblastomas do tipo sólido/multicístico e 20 casos de TOC. Todos os casos estudados apresentaram imunorreatividade para as MMP-9 e -13 e TIMP-1. A expressão dessas proteínas foi evidenciada pela marcação citoplasmática das células epiteliais e mesenquimais (fibroblastos, células inflamatórias e endoteliais). Verificou-se que o padrão de marcação mais evidente nos casos de ameloblastomas se localizava na periferia das ilhas epiteliais e em células inflamatórias e endoteliais do estroma, enquanto nos casos de TOC, observou-se maior imunoexpressão em toda a extensão do epitélio, porém, quando não apresentou imunorreatividade, esta foi menos evidente nas células da camada basal. No mesênquima, o padrão de marcação foi bem distribuído entre as células (fibroblastos, inflamatórias e endoteliais).
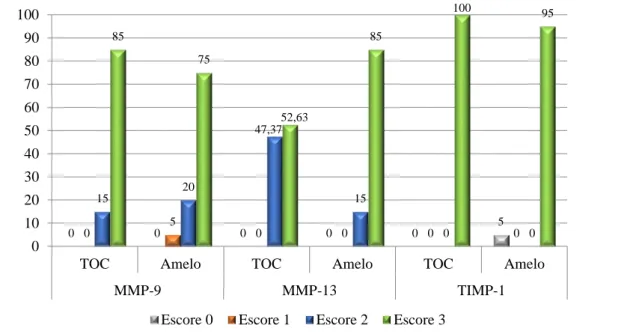
A avaliação do percentual dos escores de células que apresentaram imunorreação aos anticorpos anti-MMP-9 e -13 e anti-TIMP-1 no tecido epitelial mostrou uma maior expressão da MMP-9 nos TOCs, enquanto uma maior expressão da MMP-13 foi observada nos ameloblastomas. Em ambas as lesões o TIMP-1 se encontrou marcadamente expresso no epitélio (Figura 3).
Figura 3. Distribuição dos escores de imunomarcação para MMP-9, MMP-13 e TIMP-1 no epitélio dos TOC e Ameloblastomas. Natal – RN, 2014.
Fonte: Programa de Pós-Graduação em Patologia Oral/UFRN.
Legenda: TOC, tumor odontogênico ceratocístico; Amelo, ameloblastoma.
A análise dos escores de expressão de MMP-9, -13 e TIMP-1 no mesênquima mostrou uma maior expressão da MMP-9 nos TOCs quando comparados aos ameloblastomas, enquanto uma maior expressão da MMP-13 foi observada nos ameloblastomas. Com relação ao TIMP-1, observou-se marcada expressão em ambas as lesões (Figura 4).
Em relação à expressão da MMP-9 no mesênquima observou-se uma predominância de escore 3 (n=17; 85%), seguido do escore 2 (n=3; 15%) nos casos de TOCs. O grupo dos ameloblastomas exibiu uma predominância também do escore 3 (n=15; 75%), seguido dos escores 2 (n=4; 20%) e 1 (n=1; 5%). A expressão da MMP-13 no mesênquima dos TOCs demonstrou que a maioria dos casos foi classificada como escore 3 (n=10; 52,63), seguido do escore 2 (n=9; 47,37%). Nos casos de ameloblastomas, constatou-se predomínio do escore 3 (n=17; 85%) seguido do escore 2 (n=3; 15%). Por fim, verificou-se escore 3 para a expressão do TIMP-1 no mesênquima de todos os casos, tanto no grupo de TOC (100%) quanto no de ameloblastoma (95%). 10 20 26,3 5 36,8 0 90 80 73,7 95 63,2 100 0 10 20 30 40 50 60 70 80 90 100
TOC Amelo TOC Amelo TOC Amelo
MMP-9 MMP-13 TIMP-1
Figura 4. Distribuição dos escores de imunomarcação para MMP-9, MMP-13 e TIMP-1 no mesênquima dos TOC e Ameloblastomas. Natal/RN-2014.
Fonte: Programa de Pós-Graduação em Patologia Oral/UFRN.
Legenda: TOC, tumor odontogênico ceratocístico; Amelo, ameloblastoma
5.1.2 Resultados estatísticos
Ao comparar as medianas dos escores dos TOC e ameloblastomas para MMP-9 e -13, não se observou diferença estatisticamente significativa entre os grupos em relação à imunoexpressão dessas proteínas no epitélio das lesões (p=0,382 e p=0,069, respectivamente). Já em relação ao TIMP-1 observou-se diferença estatisticamente significativa entre os grupos de lesões (p=0,003), onde analisou-se uma maior participação do TIMP-1 no epitélio dos ameloblastomas (Tabela 2).
Tabela 2. Grupo de tumor, tamanho da amostra, mediana, quartis 25 e 75, média dos postos, soma dos postos e significância estatística para os escores de imunoexpressão de MMP-9, MMP-13 e TIMP-1 no epitélio. Natal, RN – 2014.
Fonte: Programa de Pós-Graduação em Patologia Oral/UFRN.
Legenda: TOC, tumor odontogênico ceratocístico; Amelo, ameloblastoma. (+): Teste Mann-Whitney.
* Diferença significante a 5,0%.
** Não foi possível a realização dos testes pois não houve variabilidade da amostra.
0 0 0 0 0
5 0
5
0 0 0 0
15 20 47,37 15 0 0 85 75 52,63 85 100 95 0 10 20 30 40 50 60 70 80 90 100
TOC Amelo TOC Amelo TOC Amelo
MMP-9 MMP-13 TIMP-1
Escore 0 Escore 1 Escore 2 Escore 3
Grupo n Mediana Q25-Q75 Média dos
postos
Soma dos
Postos U p
(+)
MMP-9 TOC 20 3,00 3,00 – 3,00 21,50 430,00 180,00 0,382
Amelo 20 3,00 3,00 – 3,00 19,50 390,00
MMP-13 TOC 19 3,00 2,00 – 3,00 17,87 339,50 149,50 0,069
Amelo 20 3,00 3,00 – 3,00 22,03 440,50
TIMP-1 TOC 19 3,00 2,00 – 3,00 **
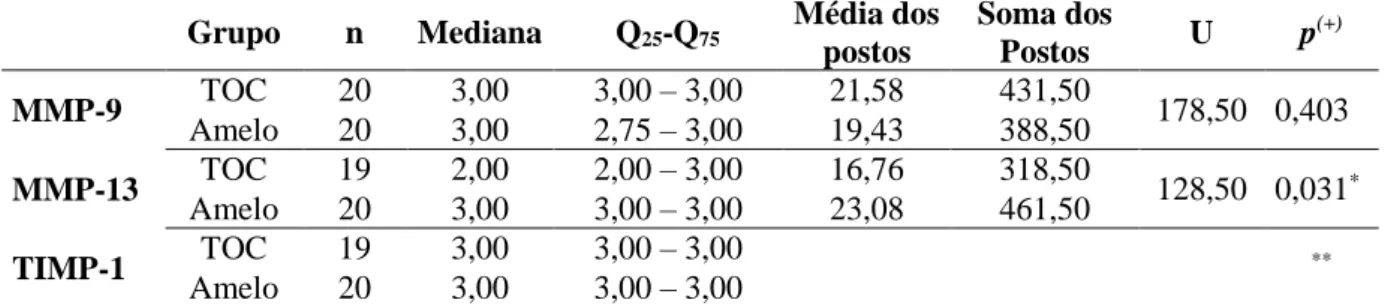
A análise da mediana dos escores de expressão da MMP-13 por meio do teste não-paramétrico de Mann-Whitney, demonstrou diferença estatisticamente significativa entre os grupos de lesões no mesênquima tumoral (p=0,031), em que a maior concentração de MMP-13 foi observada no mesênquima dos ameloblastomas. Além disso, foi observada ausência de diferença estatisticamente significativa para os marcadores MMP-9 e TIMP-1 entre os dois grupos de lesão (Tabela 3).
Tabela 3. Grupo de tumor, tamanho da amostra, mediana, quartis 25 e 75, média dos postos, soma dos postos e significância estatística para os escores de imunoexpressão de MMP-9, MMP-13 e TIMP-1 no mesênquima dos TOCs e Ameloblastomas. Natal, RN – 2014.
Fonte: Programa de Pós-Graduação em Patologia Oral/UFRN.
Legenda: TOC, tumor odontogênico ceratocístico; Amelo, ameloblastoma. (+): Teste Mann-Whitney.
*Diferença significante a 5,0%.
** Não foi possível a realização dos testes pois não houve variabilidade da amostra.
Ao avaliar a razão entre os escores de imunomarcação de TIMP-1 e MMP-9 no epitélio dos TOCs, a fim de se investigar expressão predominante de alguma dessas proteínas, não se observou diferença significante (p=0,096). Já nos ameloblastomas constatou-se diferença estatisticamente significativa (p=0,046), onde a maioria dos casos (80%) apresentou similaridade de escores (Tabela 4).
Quando foi considerada a razão entre os escores de expressão de TIMP-1 e MMP-9 no mesênquima dos TOCs e dos ameloblastomas, não demonstrou-se diferença estatística significante (p=0,083 e p=0,408, respectivamente), uma vez que em ambas as lesões a maioria dos casos mostrou escores iguais para TIMP-1 e MMP-9 (Tabela 4).
Tabela 4. Distribuição dos casos em relação aos postos de escores de imunomarcação para o TIMP-1 e MMP-9 no epitélio e no mesênquima dos TOCs e Ameloblastomas. Natal, RN – 2014.
Grupo n Mediana Q25-Q75 Média dos
postos
Soma dos
Postos U p
(+)
MMP-9 TOC 20 3,00 3,00 – 3,00 21,58 431,50 178,50 0,403
Amelo 20 3,00 2,75 – 3,00 19,43 388,50
MMP-13 TOC 19 2,00 2,00 – 3,00 16,76 318,50 128,50 0,031*
Amelo 20 3,00 3,00 – 3,00 23,08 461,50
TIMP-1 TOC 19 3,00 3,00 – 3,00 **
Amelo 20 3,00 3,00 – 3,00
Tecido Lesão TIMP-1<MMP-9 TIMP-1>MMP-9 TIMP-1=MMP-9 p(+)
Epitélio TOC 7 (36,84%) 2 (10,53%) 10 (52,63%) 0,096
Amelo 0 (0,00%) 4 (20,00%) 16 (80,00%) 0,046*
Mesênquima TOC 0 (0,00%) 3 (15,79%) 16 (84,21%) 0,083
Amelo 1 (5,00%) 4 (20,00%) 15 (75,00%) 0,408 Fonte: Programa de Pós-Graduação em Patologia Oral/UFRN.
Legenda: TOC, tumor odontogênico ceratocístico; Amelo, ameloblastoma. (+): Teste Mann-Whitney.
A avaliação da razão entre os escores de imunomarcação do TIMP-1 e da MMP-13 no epitélio dos TOCs, assim como no epitélio dos ameloblastomas, revelou não existir diferença estatisticamente significativa (p=0,480; p=0,317), sendo observado que 57,89% dos casos de TOC e 95,00% dos ameloblastomas apresentaram similaridade de escores (Tabela 5).
O cálculo da razão entre os escores de imunomarcação do TIMP-1 e MMP-13 no mesênquima dos TOC, mostrou diferença estatisticamente significativa (p=0,003), onde 52,63% dos TOC exibiram similaridade de escores. Com relação aos ameloblastomas, 80% dos casos exibiram similaridade de escores para a expressão de TIMP-1=MMP-13, no entanto este resultado não exibiu significância estatística (p=0,705) (Tabela 5).
Tabela 5. Distribuição dos casos em relação aos postos de escores de imunomarcação para o TIMP-1 e MMP-13 no epitélio e no mesênquima dos TOC e Ameloblastomas. Natal, RN – 2014.
Fonte: Programa de Pós-Graduação em Patologia Oral/UFRN.
Legenda: TOC, tumor odontogênico ceratocístico; Amelo, ameloblastoma. (+): Teste Wilcoxon.
*Diferença significante a 5,0%.
Tecido Lesão TIMP-1<MMP-13 TIMP-1>MMP-13 TIMP-1 = MMP-13 p(+)
Epitélio TOC 5 (26,31%) 3 (15,79%) 11 (57,89%) 0,480
Amelo 0 (0,00%) 1 (5,00%) 19 (95,00%) 0,317
Mesênquima TOC 0 (0,00%) 9 (47,37%) 10 (52,63%) 0,003
6 DISCUSSÃO
O ameloblastoma e o tumor odontogênico ceratocístico (TOC) são lesões que, em virtude de seu comportamento biológico potencialmente agressivo, alto poder de destruição local e taxas relativamente elevadas de recidiva, representam alvos de diversos estudos em torno das possíveis razões para esse desfecho.
Nesse contexto, muitos autores investigam, através da técnica de imuno-histoquímica, os possíveis mecanismos que justifiquem o comportamento biológico expansivo e infiltrativo local dessas lesões, principalmente do ameloblastoma. Estudos têm demonstrado que tais lesões apresentam maior expressão de fatores de crescimento que outras lesões de natureza odontogênica tais como EGF e TGF-α (SIQUEIRA et al., 2010). Kubota e Shirasuna (2007) investigaram o papel exercido pela IL-1 em favorecer o crescimento lesional. A função da
endoglina (CD105) e o aumento da angiogênese e do fator nuclear κB também foram alvos de
estudos como possíveis razões para esse distinto comportamento (SANTOS et al., 2011), bem como o papel do RANKL no processo de reabsorção óssea (QIAN; HUANG, 2010). Outros estudos mostraram, ainda, que estes tumores apresentam alterações na expressão de genes supressores de tumor (p53) e de proteínas reguladoras do ciclo celular, tais como a MDM2, p14ARF e Ki-67 (SHEAR, 2002; MEER et al., 2003; KUMAMOTO et al., 2004, KICHI et al., 2005). Proteínas anti-apoptóticas (bcl-2) e possíveis alterações nas moléculas de adesão (α2β1,
α3β1 eα5β1) presentes nesses tumores também foram objetos de estudos (KICHI et al., 2005;
ANDRADE et al., 2008).
Em adição, sugere-se que interações intermoleculares entre as células tumorais e a MEC circundante contribuem para o comportamento biológico distinto dos tumores antes citados e as demais lesões odontogênicas, influenciando seu crescimento, infiltração local e agressividade. Estudos têm mostrado que a expressão das MMPs tem sido encontrada em níveis elevados nos ameloblastomas e TOCs quando comparados a outras lesões também de origem odontogênica, porém com curso clínico mais indolente (LEONARDI et al., 2010; QIAN; HUANG, 2010; HENRIQUES et al., 2011; SANTOS et al., 2011; RIBEIRO et al., 2012; ANNE et al., 2013). Face ao exposto, o presente estudo se propôs a analisar a imunoexpressão das MMP-9 e -13 e seu inibidor tecidual intrínseco, o TIMP-1, em uma série de casos de ameloblastomas e TOC a fim de contribuir para uma maior compreensão da participação dessas proteínas no desenvolvimento e comportamento biológico dessas lesões.