UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE
CENTROS ROMBENCEFÁLICOS DE PROCESSAMENTO AUDITIVO DO SAGÜI (Callithrix jacchus): UMA ANÁLISE CITOARQUITETÔNICA E
NEUROQUÍMICA
FRANCIMAR ARAÚJO DOS SANTOS
CENTROS ROMBENCEFÁLICOS DE PROCESSAMENTO AUDITIVO DO SAGÜI (Callithrix jacchus): UMA ANÁLISE CITOARQUITETÔNICA E
NEUROQUÍMICA
Dissertação de Mestrado submetida ao Programa de Pós-graduação em Psicobiologia da Universidade Federal do Rio Grande do Norte como pré-requisito para a obtenção do título de Mestre.
Orientadora: Profa. Miriam Stela M. O. Costa.
Título: Centros rombencefálicos de processamento auditivo do sagüi (Callithrix jacchus): uma análise citoarquitetônica e neuroquímica .
Autora: Francimar Araújo dos Santos
Data da Defesa: 26/09/2008
Banca Examinadora:
Profª Dra. Miriam Stela Maris de Oliveira Costa UFRN - Orientadora
Prof. Dr. Ricado Luiz Smith - UNIFESP
No olhar de um irmão Vejo a mão do Mestre No viver, no morrer Vejo a mão do Mestre Na poesia, na canção No pulsar do coração Vejo a mão de Deus Sinto a mão de Deus Na emoção que estou sentindo Eu vejo a mão de Deus Em saber que estão me ouvindo Eu vejo a mão de Deus, Vejo a mão de Deus
O sol nasceu, o sol se pôs Fica a mão do Mestre O ano vem, o ano vai Fica a mão do Mestre Sobre nós a proteger Sobre todos posso ver Vejo a mão de Deus Sinto a mão de Deus Na emoção que estou sentindo Eu vejo a mão de Deus Em saber que estão me ouvindo Eu vejo a mão de Deus, Vejo a mão de Deus
AGRADECIMENTOS
Em primeiro lugar, quero agradecer ao Senhor Jesus por ter me capacitado a iniciar e a concluir esse mestrado, assim como por ter cuidado de mim e ter reservado pessoas especiais para cooperarem com minha vida.
Aos meus pais: Norma Araújo dos Santos e Francisco dos Santos, aos meus irmãos: Francilene Araújo dos Santos e Francisco dos Santos Júnior e a minha doce sobrinha: Ana Luísa dos Santos Lorenzato, assim como a toda a minha família, espalhada por este grande País, que mesmo sem compreender muito bem o valor dessa conquista cooperaram e me incentivaram a continuar lutando para obter mais essa vitória! Essa vitória também é de vocês. Sem vocês eu jamais teria chegado até aqui.
Aos amigos de fé, irmãos camaradas: Lígia e Carlos Quintans, Rubenita e Robinson Lima, Mari e Luís Carlos Souza e Raquel Justino pelo amor, orações, incentivo e carinho. Vocês são luz no meu caminho, manifestação do cuidado de Deus em minha vida. Obrigada.
A minha querida orientadora Dra. Miriam Stela Maris de Oliveira Costa pela incansável dedicação e paciência. Seu cuidado, amor e dedicação aos alunos me fizeram conhecer uma verdadeira doutora na arte de ensinar. Através de seus conhecimentos e entusiasmo me ensinou a construir e lutar pelos meus sonhos. Obrigada por acreditar e investir na minha vida! Seu exemplo de caráter, seriedade e dedicação refletem a esperança que tenho na educação desse país e despertou em mim o desejo pela docência.
A Márcia Albuquerque e Sebastião Franco por terem me incentivado, cada um a seu modo, desde a graduação, a me dedicar à pesquisa e expor os meus conceitos e ideais.
Prof. Dr. Jeferson de Sousa Cavalcante pelo interesse e cooperação indispensáveis para confecção desse trabalho.
A minha querida amiga Patrícia Cavalcanti Rocha e sua família por me adotarem e terem me incentivado e apoiado nessa jornada.
A Janaina Ferreira e Dinaide Marinho por sonharem junto comigo e não me deixarem desistir desse ideal, mesmo quando nossos caminhos se separaram.
A Rosângela Machado, Wani Gurgel e Carmem Rejane pelos conselhos e exemplo profissional que tem me ajudado a escolher a estrada correta a trilhar.
Aos meus pacientes que me ensinaram a perseverar dia-a-dia e a sorrir diante das mais genuínas adversidades (-a própria vida)!
Ao saudoso Iram (em memória) pelas palavras sábias, abraço sincero e amor que dedicou a minha vida. Você realmente foi usado por Deus para reciclar (transformar) vidas como a minha.
A todos os professores de Graduação do Curso de Fonoaudiologia da UnP e do Programa de Pós-Graduação em Psicobiologia da UFRN, os quais contribuíram fundamentalmente para minha formação acadêmica.
Ao Departamento de Morfologia na pessoa de chefe, Celcimar, assim como seus demais funcionários pelo suporte, infra-estrutura e manutenção do laboratório de neuranatomia.
Aos funcionários do Núcleo de Primatologia da UFRN, pelo cuidado com os animais e apoio a esse estudo.
RESUMO
O sistema auditivo compreende uma série de estações que se estendem desde a orelha externa até o córtex cerebral. Em mamíferos o sistema auditivo central subcortical é formado essencialmente por núcleos cocleares, complexo olivar superior, colículo inferior e corpo geniculado medial. Neste estudo, os centros rombencefálicos, compreendendo o complexo nuclear coclear e o complexo olivar superior foram avaliados com relação a sua citoarquitetura e conteúdo neuroquímico de corpos celulares e terminais axônicos, através das técnicas de coloração de Nissl e imuno-histoquímica para proteína nuclear neurônio específica (NeuN), glutamato (Glu), descaboxilase de ácido glutâmico (GAD), encefalina (ENK), serotonina (5-HT), colina acetiltransferase (ChAT) e proteínas ligantes de cálcio calbindina (CB), cal-retinina (CR) e parvalbumina (PV). Foi utilizado como animal experimental o sagüi (Callithrix jacchus), um pequeno primata nativo da Mata Atlântica do Nordeste Brasileiro. Como resultados, foi evidenciado que o complexo nuclear coclear é composto pelos núcleos cocleares antero-ventral, póstero-ventral e dorsal, e o complexo olivar superior pelos núcleos olivares superiores lateral e medial e o núcleo do corpo trapezóide. Em todos os núcleos, de ambos os complexos, foram encontrados de forma variável corpos celulares, fibras e terminais imunorreativos a Glu, GAD, ChAT, CB, CR, PV, corpos celulares e terminais imunoreativos a ENK, além de fibras e terminais imunorreativos a 5-HT em diferentes densidades. Os dados obtidos são discutidos dentro de um contexto comparativo e funcional e representam uma importante contribuição ao conhecimento das vias auditivas centrais no sagüi, e por extensão em primatas.
ABSTRACT
The auditory system is composed by a set of relays from the outer ear to the cerebral cortex. In mammals, the central auditory system is composed by cochlear nuclei, superior olivary complex, inferior colliculus and medial geniculate body. In this study, the auditory rombencephalic centers, the cochlear nuclear complex and the superior olivary complex were evaluated from the cytoarchitecture and neurochemical aspects, thorough Nissl staining and immunohistochemical techniques to reveal specific neuron nuclear protein (NeuN), glutamate (Glu), glutamic acid decarboxilase (GAD), enkephalin (ENK), serotonin (5-HT), choline acetyltransferase (ChAT) and calcium-binding proteins calbindin (CB), calretinin (CR), and parvalbumin (PV).
The common marmoset (Callithrix jacchus), a little native primate of the Brazilian atlantic forest was used as an experimental animal. As results, it was noted that the cochlear nuclear complex is composed by anteroventral, posteroventral and dorsal nuclei, and the superior olivary complex is constituted by the lateral and medial superior olivary nuclei and the trapezoid body nucleus. Glu, GAD, ENK, ChAT, CB, CR, PV- immunoreactive cells, fibers and terminals besides besides only 5-HT terminals were found unhomogeneously in all nuclei, of both complex. The emerging data are discussed in a comparative and functional context, and represent an important contribution to knowledge of the central auditory pathways in the common marmoset, and then in primates.
LISTA DE ABREVIATURAS
5-HT - Serotonina ACh - Acetilcolina CB - Calbindina
ChAT - Colina acetiltransferase
CNVA - Núcleo coclear ventral anterior COS - Complexo olivar superior CR Cal-retinina
ENK - Encefalina
GABA - Ácido gama-amino-butírico GAD - Descarboxilase do ácido glutâmico Glu - Glutamato
NC Complexo Núclear coclear NCD - Núcleo coclear dorsal NCV - Núcleo coclear ventral
NCVP - Núcleo coclear ventral posterior NT - Núcleo do corpo trapezóide
LISTA DE FIGURAS E TABELAS
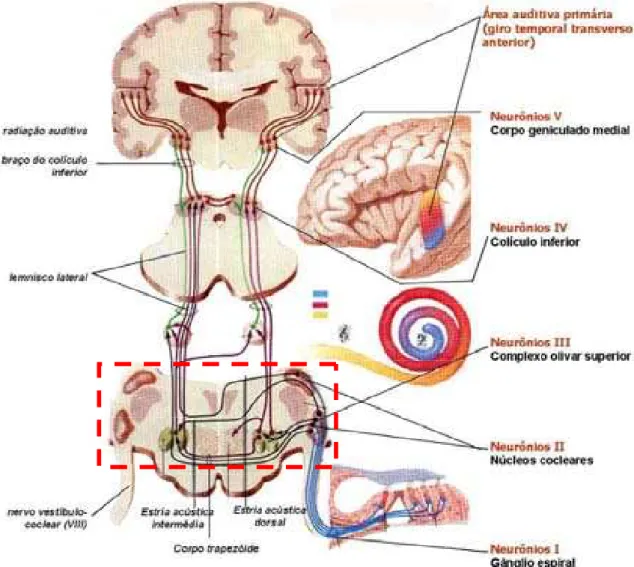
Figura 1 (pág. 17): Visão geral do sistema auditivo periférico. Figura 2 (pág. 24): Via Auditiva.
Figura 3 (pág. 27): O Sagüi.
Figura 4 (pág. 31): Cérebros de sagüi.
Figura 5 (pág. 32): Fotomicrografia de secções de Nissl representando secções aproxidamente no nível rostral (A e D), médio (B e E) e caudal (C e F) para o complexo olivar superior (A, B e C) e núcleos cocleares (D, E e F) do sagüi.
Figura 6 (pág. 39): Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral, médio e caudal, mostrando a citoarquitetura pelo método de Nissl (A, B e C) e NeuN (D, E e F). NCAV, núcleo coclear ântero-ventral; NCPV, núcleo coclear póstero-ventral; NCD, núcleo coclear dorsal.
Figura 7(pág. 40): Fotomicrografias em campo claro de secções coronais do NCD do sagüi em níveis rostral, médio e caudal, mostrando a citoarquitetura pelo método de Nissl (A, B e C) e NeuN (D, E e F). Observe a camada molecular na periferia do NCD.
Figura 8 (pág. 41): Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para Glu em corpos celulares, fibras e terminais em todos os núcleos.
Figura 9 (pág.42): Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para GAD em pericários, fibras e terminais em todos os núcleos.
Figura 10 (pág. 43): Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para ENK em pericários e terminais em NCAV e NCPV e predomínio de terminais em NCD.
distribuição de imunorreatividade para ChAT em pericários no NCAV, fibras e terminais no NCV e corpos celulares, fibras e terminais no NCD.
Figura 13 (pág. 46): Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para CB em corpos celulares, fibras e terminais em todos os núcleos.
Figura 14 (pág. 47): Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para CR em pericários, fibras e terminais em todos os núcleos.
Figura 15 (pág. 48): Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para PV em corpos celulares, fibras e terminais em todos os núcleos.
Figura 16 (pág. 49 e 50): Esquema ilustrando a distribuição de imunorreatividade em pericários (pontos pretos) e neuróglia (tons de cinza de acordo com a densidade) para Glu, GAD, ENK, 5-HT, ChAT, CB, CR e PV nos núcleos do complexo nuclear coclear em três níveis de secção (rostral, médio e caudal).
Figura 17 (pág. 54): Fotomicrografias em campo claro de secções coronais do através do complexo olivar superior do sagüi em níveis rostral (A e D), médio (B e E) e caudal (C e F), mostrando a citoarquitetura pelo método de Nissl (A, B e C) e NeuN (D, E e F).
Figura 18(pág. 55): Fotomicrografias em campo claro de secções coronais do COS do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição da imunorreatividade para Glu em pericários, fibras e terminais em todos os núcleos.
Figura 19(pág. 56): Fotomicrografias em campo claro de secções coronais do COS do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição da imunorreatividade para GAD em pericários, fibras e terminais em todos os núcleos.
Figura 22(pág. 59): Fotomicrografias em campo claro de secções coronais do COS do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição da imunorreatividade para ChAT em pericários, fibras e terminais no CT e OSM médio e caudal. Pericários e densa neurópila no OSL.
Figura 23(pág. 60): Fotomicrografias em campo claro de secções coronais do COS do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição da imunorreatividade para CB em pericários, fibras e terminais em todos os núcleos.
Figura 24(pág. 61): Fotomicrografias em campo claro de secções coronais do COS do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição da imunorreatividade para CR em pericários, fibras e terminais em todos os núcleos.
Figura 25(pág. 62): Fotomicrografias em campo claro de secções coronais do COS do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição da imunorreatividade para PV em pericários, fibras e terminais em todos os núcleos.
Figura 26 (pág. 63 e 64): Esquema ilustrando a distribuição de imunorreatividade em pericários (pontos pretos) e neuróglia (tons de cinza de acordo com a densidade) para Glu, GAD, ENK, 5-HT, ChAT, CB, CR e PV nos núcleos do complexo olivar superior em três níveis de secção (rostral, médio e caudal).
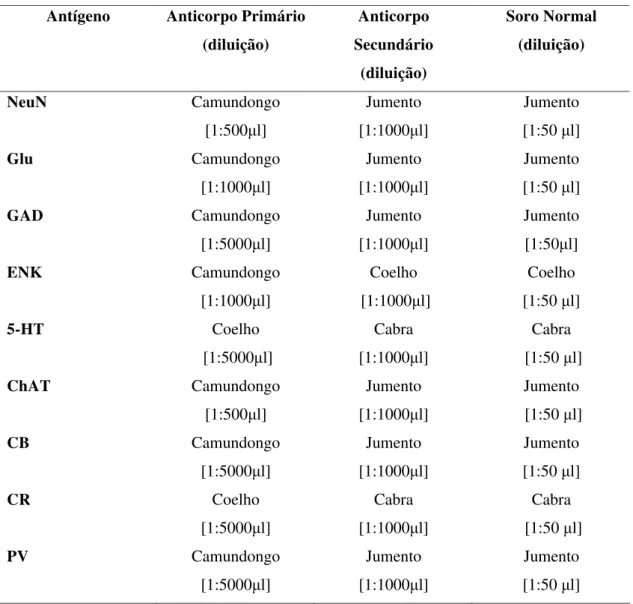
Tabela 1 (pág. 34): Número de cortes para cada núcleo auditivo rombencefálico. Tabela 2 (pág. 35): Lista de substâncias e diluições utilizadas no experimento.
SUMÁRIO
Página
1. INTRODUÇÃO 14
A Audição e o sistema auditivo 14
O sistema auditivo periférico 15
O sistema auditivo central 17
Os núcleos cocleares primeira estação da via auditiva central 18 O complexo olivar superior fundamental na localização sonora 19 O colículo inferior principal estação auditiva do tronco encefálico 20 O corpo geniculado medial relé talâmico 21
Áreas auditivas corticais 22
Propriedades do sistema auditivo 23
Neuroquímica aliada na delimitação anatômica e funcionalidade neuronal 25
O Sagüi (Callithrix jacchus) 26
2. JUSTIFICATIVA 28
3. OBJETIVOS 28
4. METODOLOGIA 29
5. RESULTADOS 36
6. DISCUSSÃO 66
7. CONCLUSÃO 79
8. CONSIDERAÇÕES FINAIS E PERSPECTIVAS 81
1. INTRODUÇÃO
A audição e o Sistema Auditivo
A grande maioria dos seres vivos é capaz de interagir entre os indivíduos e com o meio ambiente por meio de alguma forma de comunicação. A participação do som é evidente nesse processo, quando se observa comportamentos, tais como o sofisticado canto de acasalamento de alguns pássaros (Snowdon, 2007). Ao longo do processo seletivo, a possibilidade de detecção à distância dos estímulos provenientes do meio externo tornou-se uma grande vantagem adaptativa, pois permitiu aos animais localizar e identificar presas, predadores, obstáculos, como também os animais da mesma espécie, favorecendo o processo de reprodução. Isso foi conseguido através do desenvolvimento da capacidade auditiva, conseqüência do desenvolvimento de órgãos auditivos sofisticados e de grande sensibilidade, capazes de detectar as menores vibrações sonoras do meio, transmitidas através do ar ou da água, permitindo ao animal uma maior percepção do meio ambiente ao seu redor até mesmo durante o sono (Motta, 2005; Snowdon, 2007).
Dessa forma, a audição se destaca como uma das mais importantes modalidades sensoriais para muitos animais e principalmente para o ser humano. Através dela o indivíduo adquire uma maior socialização e desenvolve sua singularidade, pois ela favorece a aquisição da linguagem e a conseqüente integração do homem ao mundo sonoro (Lent, 2004; Gazzaniga e Heatherton, 2005; Silveira e Vaucher, 2006; Snowdon, 2007). Atualmente já se tem desenvolvido equipamentos sofisticados e de alta sensibilidade e tecnologia, como os aparelhos de amplificação sonora individual e mesmo os implantes cocleares e de tronco cerebral, mas, nenhum destes instumentos foi suficientemente capaz de substituir o sistema auditvo funcionalmente por completo, mesmo que associados a terapias fonoaudiológicas.
Do ponto de vista anátomo-funcional, em mamíferos o sistema auditivo divide-se em sistema auditivo periférico e sistema auditivo central. A porção periférica estende-se do pavilhão auricular até o nervo vestíbulo-coclear (VIII par craniano). O sistema auditivo central compreende estruturas e vias situadas no tronco encefálico, tálamo e córtex cerebral, onde sucessivamente os impulsos traduzidos por informações auditivas são decodificados e transformados em informações compreensíveis ao indivíduo (Russo e Santos, 1994; Schoeny e Talbott, 1999; Hudspeth, 2000a; Santos e Branco Barreiro, 2005; Pereira, 2005; Glendnning, 2005; Tortora, 2007).
impulsos nervosos, discriminação, localização e reconhecimento do som, associados à compreensão, atenção seletiva e memória auditiva, formando, assim, em conjunto as vias de processamento do som (Machado 2003; Friedland, 2006).
O sistema auditivo periférico
A porção periférica do sistema auditivo é formada pela orelha, a qual didaticamente é dividida em orelha externa, orelha média e orelha interna. A orelha tem origem a partir dos três folhetos embrionários. A orelha interna desenvolve-se a partir de um espessamento do ectoderma que cobre as laterais da cabeça do embrião. A orelha média origina-se do endoderma da primeira bolsa faríngica, que forma os ossículos, e do mesoderma, que forma os músculos neles inseridos. A orelha externa desenvolve-se à custa de proliferação do mesênquima das regiões dorsais do primeiro e segundo arcos branquiais e do ectoderma, que forma a pele que o reveste por fora (Northern e Downs, 2002; Tortora, 2007).
A orelha externa está parcialmente incluída no osso temporal e é composta por pavilhão auricular, concha e meato acústico externo. O pavilhão auricular consiste de uma prega cutânea da face lateral da cabeça, com um esqueleto de cartilagem elástica, de forma afunilada, com saliências e depressões. É o pavilhão auricular o responsável por coletar a energia sonora e afunilá-la em direção ao meato acústico externo, que é um tubo curvo, medindo cerca de 2,5 cm em humanos, situado no osso temporal, estendendo-se do pavilhão auricular até a membrana timpânica, ou tímpano. A membrana timpânica estabelece a separação entre a orelha externa e a orelha média. É uma membrana delgada e semitransparente, côncava, e levemente em forma de cone, cujo ápice está voltado para a orelha média. É pela vibração dessa membrana que ocorre a passagem da energia mecânica sonora, capaz de movimentar os ossículos da orelha média (Russo e Santos, 1994; Wright, 1995; Hudspeth, 2000a; b; Machado 2003; Lent, 2004).
membrana timpânica secundária. Além dos ligamentos, dois pequenos músculos esqueléticos se prendem aos ossículos. O músculo tensor do tímpano, inervado pelo ramo mandibular do nervo trigêmeo (V) limita o movimento e aumenta a tensão sobre a membrana do tímpano, para impedir lesão da orelha interna por sons muito intensos. O músculo estapédio, que é inervado pelo nervo facial (VII), amortece as grandes vibrações do estribo, produzidas por sons de grande intensidade, protegendo a janela oval, diminuindo também a sensibilidade auditiva. A parede anterior da orelha média contém uma abertura que tem continuidade com um canal formado por osso e cartilagem hialina: é a tuba faringotimpânica, que conecta a orelha média com a nasofaringe, tendo por finalidade equalizar a pressão atmosférica dos dois lados da membrana do tímpano. Quando as pressões estão equilibradas a membrana timpânica vibra livremente à medida que as ondas sonoras a atingem. Quando a pressão não está equalizada podem ocorrer dores intensas, zumbido, surdez e mesmo vertigem (Wright, 1995; Hudspeth, 2000a; b; Lent, 2004; Tortora, 2007).
encefálico para, através de estações sucessivas, chegarem ao córtex cerebral auditivo (Brugge e Geisler, 1978; Nelly, 1989; Dallos, 1992; Hudspeth, 2000a; b; Lent, 2004).
A figura 1 ilustra o sistema auditivo periférico:
Figura 1. Visão geral do sistema auditivo periférico (modificado de Netter, 1987).
O sistema auditivo central
Os núcleos cocleares Primeira estação central da via auditiva As fibras do nervo coclear, que têm como principal neurotransmissor o glutamato, penetram pelo sulco bulbopontino, atingindo de cada lado os núcleos cocleares situados na porção caudal da ponte, lateralmente às fibras do pedúnculo cerebelar inferior (Brugge e Geisler, 1978; Baran e Musiek, 2001; Snell, 2003). Esta é a primeira estação sináptica da via auditiva. De cada lado, os núcleos cocleares são em número de dois: o dorsal e o ventral, este subdividido em ântero-ventral e póstero-ventral (Bellis, 1996; Parent, 1996; Schoeny e Talbott, 1999; Snell, 2003). Ao penetrarem na ponte, as fibras do nervo coclear bifurcam-se em seqüência ordenada e são distribuídas a ambos os núcleos cocleares, dorsal e ventral, o ramo ascendente terminando no núcleo coclear antero-ventral e o descendente nos núcleos cocleares póstero-ventral e dorsal. Além disso, cada um dos dois núcleos cocleares é tonotopicamente organizado, de tal modo que em todos eles, neurônios que respondem às freqüências mais altas (agudas) são localizados dorsalmente e os que respondem às freqüências mais baixas (graves) progressivamente mais ventralmente (Brodal, 1993; Bellis, 1996; Martin, 1998; Hudspeth, 2000a; Machado, 2003). O núcleo coclear dorsal emite fibras que cruzam o plano mediano pelas estrias acústicas dorsal e intermédia e ascendem pelo lemnisco lateral até o colículo inferior contralateral. Já os neurônios de ambas as divisões do núcleo coclear ventral projetam-se para o complexo olivar superior do mesmo lado e do lado oposto, o cruzamento se dando pela estria acústica intermédia e estria acústica ventral (ou corpo trapezóide), considerando-se as conexões recíprocas entre os complexos olivares superiores entre si (Brodal, 1993; Bellis, 1996; Parent, 1996; Martin, 1998; Snell, 2003).
Em mamíferos roedores o núcleo coclear dorsal é estratificado, apresentando uma camada molecular superficial, caracterizada pelo seu conteúdo em zinco (Féres e Cairasco, 2003), e quatro camadas celulares mais profundas. Os principais neurônios de projeção são as células fusiformes, orientadas radialmente, lembrando a organização das células de Purkinje no córtex do cerebelo. Contém também as células tentaculares (Brodal, 1993; Hudspeth, 2000a; Machado, 2003). Já o núcleo coclear ventral contém predominantemente as células estreladas e as células em arbusto (Hudspeth, 2000a) e a marcação pelo íon zinco é restrita à periferia do subnúcleo (Féres e Cairasco, 2003).
Os axônios dos diversos tipos celulares presentes nos núcleos cocleares projetam-se para diversos outros núcleos em níveis mais rostrais do tronco encefálico. Do núcleo coclear antero-ventral emerge o maior volume de fibras para o lado oposto, formando o corpo trapezóide (ou estria acústica ventral), que se estende do nível da ponte até os três núcleos do complexo olivar superior (lateral, medial e o núcleo do corpo trapezóide). Axônios de neurônios do núcleo coclear dorsal ao saírem formam a estria acústica dorsal e ascendem pelo lemnisco lateral contralateral (Hudspeth, 2000a).
O complexo olivar superior Fundamental na localização sonora O complexo olivar superior é constituído por três divisões anatômicas, as quais são: núcleo olivar superior medial, núcleo olivar superior lateral e o núcleo do corpo trapezóide (Martin, 1998). As três porções do complexo olivar superior emitem fibras ascendentes tanto ipso quanto contralaterais, contribuindo para formar o lemnisco lateral. Este ascende pelo tronco encefálico até atingir o mesencéfalo, terminando no colículo inferior. Circundando o complexo olivar superior, pequenos grupamentos neuronais constituem os núcleos periolivares (Martin, 1998; Malmierca e Merchán, 2004), de onde têm origem as fibras eferentes que formam o fascículo olivococlear (Guinan, Jr, 2006). O fascículo olivococlear tem dois componentes: um componente medial, de espessas fibras mielinizadas, que termina primariamente nas células ciliadas externas, predominantemente para o lado contralateral, e um componente lateral, de fibras amielínicas, que se projeta para as células ciliadas internas, predominantemente ipsolaterais. Esta é uma via através da qual o sistema nervoso central pode influenciar sua própria entrada sensorial (Parent, 1996; Breuel et al., 2001; Aquino e Araújo, 2002; Guinan, Jr, 2006).
O lemnisco lateral, a principal via auditiva ascendente no tronco encefálico contém fibras ipso e contralaterais e ascende na parte lateral do tegmento, terminando no colículo inferior do mesencéfalo. Imersos entre as fibras do lemnisco lateral estão os núcleos do lemnisco lateral, os quais recebem e contribuem com fibras para o feixe principal (Bellis, 1996; Parent, 1996). As informações que chegam a cada núcleo do lemnisco lateral são predominantemente contralaterais (Bellis, 1996; Aquino e Araújo, 2002; Machado, 2003).
O colículo inferior Principal estação auditiva do tronco encefálico O colículo inferior é um núcleo par situado na parte caudal do teto mesencefálico. Pode ser dividido em três partes: (1) o núcleo central, uma massa celular ovóide e de estrutura laminar, formado por duas subdivisões: uma dorsomedial, menor, composta de células grandes, e uma ventrolateral, maior, de células pequenas a médias, com um arranjo laminar; (2) o núcleo pericentral, uma fina camada celular dorsal; e (3) o núcleo externo, que circunda o núcleo central, lateral e ventralmente (Brodal, 1993; Parent, 1996). O colículo inferior funciona como o principal núcleo relé do sistema auditivo no tronco encefálico, transmitindo sinais recebidos do lemnisco lateral para o corpo geniculado medial. Fibras auditivas ascendentes no lemnisco lateral projetam-se para as divisões dorsomedial e ventrolateral do núcleo central do colículo inferior. Fibras que penetram na divisão ventrolateral cursam ao longo do comprimento de cada lâmina seguindo sua curvatura e, à medida em que atravessam estas lâminas, estabelecem contatos sinápticos com neurônios coliculares. A divisão dorsomedial do núcleo central recebe conexões comissurais da região correspondente do colículo inferior oposto e projeções bilaterais do córtex auditivo. O núcleo pericentral também recebe entradas bilaterais do córtex auditivo e projeções ascendentes do núcleo dorsal do lemnisco lateral. Células do núcleo pericentral projetam fibras para dentro do núcleo central, as quais cursam em paralelo às suas lâminas (Parent, 1996; Okoyama et al., 2006).
A maioria das células do colículo inferior responde à estimulação biauricular, e muitas células codificam a localização do som com padrões de descarga espaço-temporal (Champoux et al., 2007). Uma localização tonotópica definida está presente dentro dos núcleos central e pericentral do colículo inferior. Neurônios no núcleo central do colículo inferior são arranjados em um padrão laminar que representam diferentes faixas de freqüência. A representação da freqüência no núcleo central reflete a representação proporcional de freqüências ao longo de partes da cóclea, em que baixas freqüências são percebidas no ápice e altas freqüências na base (Parent, 1996).
Fibras eferentes do núcleo central do colículo inferior projetam-se através do braço do colículo inferior para a parte laminada ventral do corpo geniculado medial. Células na divisão dorsal do núcleo central e no núcleo pericentral enviam fibras para a parte dorsal do corpo geniculado medial. Assim, a divisão dorsal do núcleo central e o núcleo pericentral do colículo inferior, os quais recebem fibras do córtex auditivo, finalmente enviam sinais de volta para o córtex auditivo secundário. Células da parte ventral do corpo geniculado medial projetam-se tonotopicamente, através da radiação auditiva, sobre o córtex auditivo primário (Parent, 1996; Machado, 2003; Okoyama et al., 2006).
Estudos eletrofisiológicos destacam a importância do complexo olivar superior e a via até os colículos inferiores no mecanismo de fala na presença de ruído, logo a integridade dessas estruturas, bem como de sua via é essencial para uma comunicação adequada (Okoyama et al., 2006; Schochat et al., 2006).
O corpo geniculado medial Relé talâmico
O corpo, núcleo ou complexo geniculado medial no encéfalo de primata situa-se no tálamo posterior, fazendo saliência na superfície ventral, medialmente ao corpo geniculado lateral e dorsalmente ao pedúnculo cerebral. Esta massa nuclear laminada, o núcleo relé talâmico auditivo, recebe fibras do colículo inferior e dá origem à radiação auditiva. Diferentemente dos núcleos relés auditivos do tronco encefálico, não há conexões comissurais entre os corpos geniculados mediais (Bellis, 1996; Parent, 1996).
auditivo primário dá origem a fibras córtico-talâmicas que terminam na divisão ventral do corpo geniculado medial. Ambas as conexões genículo-corticais e córtico-geniculadas são sempre ipsolaterais (Parent, 1996).
Os demais componentes do núcleo geniculado medial são multimodais, recebendo entradas somatossensoriais e visuais, além das projeções auditivas. A divisão dorsal do corpo geniculado medial contém vários núcleos, entre os quais os núcleos suprageniculado e dorsal. O núcleo dorsal, proeminente em níveis caudais do corpo geniculado medial, recebe projeções de uma área tegmental lateral, estendendo-se das camadas profundas do colículo superior para a área adjacente ao lemnisco lateral. A divisão medial, magnocelular, do corpo geniculado medial, recebe entradas do colículo inferior, do tegmento lateral e da medula espinhal. Porções não laminadas do corpo geniculado medial enviam fibras ipsolateralmente para uma faixa cortical que circunda a área auditiva primária (Parent, 1996; Hudspeth, 2000a).
Áreas auditivas corticais
Em humanos, a principal projeção do corpo geniculado medial, originada essencialmente da divisão ventral, é para o giro temporal transverso anterior (giro de Heschl, área 41 de Brodman, A1), através da radiação auditiva ou trato genículo-temporal. Este giro cortical está localizado no assoalho do sulco lateral e é caracterizado por ter uma representação tonotópica, em que tons altos são processados medial e caudalmente e tons baixos são representados lateral e anteriormente (Bellis, 1996; Parent, 1996; Hudspeth, 2000a; b; Teixeira, 2005).
as áreas auditivas dos dois hemisférios, permitindo dessa forma o cruzamento das informações sonoras (Bellis, 1996; Baran e Musiek, 2001).
Propriedades do Sistema Auditivo
O processamento auditivo envolve não apenas a percepção do som, mas também a capacidade de identificar, localizar, analisar, manter a atenção, memorizar e recuperar esse estímulo (Katz e Wilde, 1999; Silveira et al., 2004).
Pode-se enumerar quatro características específicas do sistema auditivo: (a) representação cortical bilateral; (b) capacidade de localização da fonte sonora; (c) representação tonotópica e (d) controle eferente descendente para ajuste dos receptores (Bhatnagar, 2004; Cramer, 2005).
A representação auditiva bilateral é decorrente dos cruzamentos de informações auditivas devido às interconexões ascendentes nos níveis dos núcleos cocleares, lemnisco lateral e colículo inferior. O córtex auditivo primário em cada hemisfério cerebral recebe impulsos provenientes de ambas as orelhas, embora o impulso principal para o córtex auditivo primário provém do receptor contralateral, com um menor número de projeções do ipsolateral. Esta característica possibilita que lesões em qualquer ponto da via auditiva central não resulte em surdez completa no ouvido oposto, mas cause apenas uma perda auditiva leve ou mesmo nenhuma alteração. Porém, se a ablação ou lesão bilateral envolver o córtex auditivo primário ou o córtex de associação resultará em grande perda de discriminação auditiva e da percepção da fala (Bonaldi et al., 1997; Bhatnagar, 2004).
A localização da fonte sonora ocorre devido à diferença de tempo de chegada do estímulo sonoro em cada orelha, já que a orelha mais próxima da fonte sonora recebe a informação primeiro. O mecanismo de localização sonora começa no nível do núcleo olivar superior. É este o núcleo o primeiro a receber projeções cruzadas e não cruzadas dos dois receptores auditivos e usa as diferenças de tempo e intensidade para determinar a localização exata e a direção da fonte sonora (Brust, 2000; Bhatnagar, 2004).
A representação tonotópica, iniciada no nível coclear, é mantida em toda a via auditiva central. Vale salientar que mesmo no nível mais elevado, ou seja, no córtex auditivo, apenas um neurônio responde melhor a determinadas freqüências sonoras (Brugge e Geisler, 1978; Waxman. 1996; Read et al., 2002; Bhatnagar, 2004).
encefálico (colículo inferior e núcleo olivar superior), até atingirem as células ciliadas cocleares através do feixe olivococlear (Bellis, 1996; Bonaldi et al., 1997; Breuel et al., 2001). Também foi descrita uma projeção da rafe para as células ciliadas cocleares (Kim et al., 2003). Estas projeções não apenas tornam o sinal acústico mais definido, para melhorar a proporção sinal-ruído, como também melhoram os indícios para a localização do som, e contribuem para a qualidade do som percebido, por supressão dos sinais concorrentes, assim como ajudam a proteger as células ciliadas cocleares de estímulos muito intensos (Waxman, 1996; Kim et al., 2003; Bhatnagar, 2004; Friedland, 2006).
Neuroquímica aliada na delimitação anatômica e funcionalidade dos centros neurais
A comunicação neuronal depende da capacidade do neurônio em responder a uma determinada estimulação. A estimulação pode ser capaz de tornar o neurônio eletricamente excitado e, consequentemente, apto para transmitir sinais para outros neurônios. Dessa forma são gerados potenciais de ação, que fazem com que os neurônios liberem neurotransmissores, os quais são substâncias químicas capazes de inibir ou estimular a ação de um outro neurônio. Esses neurotransmissores são liberados na fenda sináptica e se unem a um receptor específico no neurônio seguinte, chamado então, neurônio pós-sináptico. São os neurotransmissores que ajudam a regular os mecanismos encefálicos que controlam a cognição, a linguagem, a fala, audição, o humor, bem como a atenção, a memória, a personalidade, a motivação e os ajustes fisiológicos do encéfalo (Kolb e Whishaw, 2002; Bhatnagar, 2004; Von Bohlen und Halbach e Dermietzel, 2006).
Os receptores são moléculas de proteínas especializadas que quando unidos aos respectivos neurotransmissores facilitam a abertura dos canais iônicos e, modificando o potencial de membrana naquele ponto, afetam a probabilidade da descarga neuronal. Quando um neurotransmissor se une com o receptor e provoca despolarização na membrana pós-sináptica é considerado excitatório, uma vez que aumenta a probabilidade desse receptor descarregar. No entanto, quando a união deste neurotransmissor com o receptor provoca hiperpolarização no neurônio pós-sináptico é considerado inibitório, já que torna menos provável a descarga do neurônio receptor (Kolb e Whishaw, 2002; Gazzaniga e Heatherton, 2005).
Até a década de 70 acreditava-se que cada neurônio utilizava um único neurotransmissor. Atualmente acredita-se que há na maioria das sinapses, um neurotransmissor principal, que ativa diretamente um canal iônico. Outros neurotransmissores co-localizados funcionariam, em geral, como moduladores da atividade do neurotransmissor primário, facilitando ou inibindo sua ação (Burt 1995; Lent, 2004). Muitos neurotransmissores têm mais de um receptor e podem ter efeitos variados em diferentes sinapses no sistema nervoso (Kolb e Whishaw, 2002; Lent, 2004; Gazzaniga e Heatherton, 2005).
ali presentes. As enzimas envolvidas na síntese de tais neurotransmissores são produzidas no soma (corpo celular do neurônio) e transportadas até o terminal axonal e, neste local, rapidamente dirigem a síntese desses mediadores químicos. Uma vez sintetizados, os neurotransmissores aminoácidos e aminas são levados para as vesículas sinápticas que liberam seus conteúdos por exocitose. Os neurotransmissores peptídeos, por sua vez, constituem-se de grandes moléculas armazenadas e liberadas em grânulos secretores. A síntese dos neurotransmissores peptídicos ocorre no retículo endoplasmático rugoso do soma. Após serem sintetizados, são clivados no complexo de Golgi, transformando-se em neurotransmissores ativos, que são secretados em grânulos secretores e transportados até o terminal axonal (transporte anterógrado) para serem liberados na fenda sináptica (Burt, 1995).
Os vários centros que compõem o sistema auditivo podem ser identificados através de técnicas imuno-histoquímicas, por uma variedade de neurotransmissores, tais como acetilcolina (Ach), ácido gama-amino-butírico (GABA), glutamato (Glu), serotonina (5-HT), encefalina (ENK) e outras substâncias neuroativas, como as proteínas ligantes de cálcio, calbindina (CB), cal-retinina (CR) e parvalbumin a (PV).
O sagüi (Callithrix jacchus)
de 10 anos, podendo atingir os 16 anos no cativeiro. Embora oriundo das florestas tropicais do Nordeste Brasileiro, o sagüi é atualmente encontrado em colônias de diversas partes do mundo para onde foi levado, sendo utilizado como modelo para estudo nas mais diversas áreas (Rylands, 1996).
Por ser um animal de repertório vocal bem desenvolvido, o sagüi representa um bom modelo para estudos também do sistema auditivo.
O Núcleo de Primatologia da UFRN, coordenado e mantido pelo Departamento de Fisiologia, é responsável há vários anos pela manutenção e reprodução em cativeiro do sagüi (Registro IBAMA no. 1/24/92/0039-0). Desde a criação do Núcleo de Primatologia, muitos trabalhos foram produzidos na UFRN, nas áreas de comportamento social, sexual e reprodutivo, ritmos biológicos e neuranatomia, dando suporte ao Programa de pós-graduação em Psicobiologia. Os estudos neuranatômicos iniciados a partir de 1992 com a instalação do Laboratório de Neuranatomia foram inicialmente voltados para a elucidação das bases circadianas dos ritmos biológicos e sistemas visuais (ver, por exemplo, Costa e Britto, 1997; Costa et al., 1998; 1999; Cavalcante et al., 2002; 2005; 2008; Pinato et al., 2007). Este trabalho representa o início da expansão das linhas pesquisas na direção de estudar o sistema auditivo, tendo o sagüi como modelo experimental.
2. JUSTIFICATIVA
O sistema auditivo tem muitas funções, sendo uma das mais importantes a análise de vocalizações de co-específicos. Em humanos, a capacidade de ouvir a fala é vital para a sobrevivência, tanto do indivíduo como da espécie. Sendo as espécies mais próximas de humanos, primatas não humanos são modelos naturais para estudo dos processamentos cerebrais relevantes à condição humana, particularmente com relação à fala. Assim, justifica-se esjustifica-se estudo no sagüi, um primata caracterizado por aprejustifica-sentar um rico repertório vocal.
3. OBJETIVOS
3.1. Objetivo geral
Este estudo tem como objetivo descrever, baseado na citoarquitetura, as estações subcorticais que compõem a via auditiva do sagüi, bem como caracterizar os principais neurotransmissores e substâncias neuroativas presentes nestes centros neurais, iniciando-se pelas estações rombencefálicas.
3.2. Objetivos específicos
3.2.1. Caracterizar a citoarquitetura e a neuroquímica dos núcleos cocleares;
4. METODOLOGIA
SUJEITOS:
Foram utilizados 2 (dois) sagüis adultos jovens (com idade variando entre 18 a 60 meses) saudáveis provenientes do Núcleo de Primatologia de Universidade Federal do Rio Grande do Norte (registro IBAMA n° 1/24/92/0039-00). Todos os esforços foram feitos para minimizar o número de animais e o seu sofrimento, seguindo estritamente as normas estabelecidas pelo National Research Council of the National Academy publicadas no livro Guidelines for the Care and use of Mammals in Neuroscience and Behavioral Research . Uma versão em formato PDF está disponível gratuitamente no site da Sociedade de Neurociências e Comportamento (SBNEC):http://www.sbnec.gov.br/links.
Secções rombencefálicas utilizadas em outros projetos e armazenadas no laboratório foram utilizadas para complementar nossa análise.
PROCEDIMENTOS:
Para investigar os centros rombencefálicos de processamento auditivo do sagüi, os animais foram submetidos aos procedimentos de perfusão, remoção do encéfalo, microtomia, colorações e reações imuno-histoquímicas da área de interesse, ou seja, o tronco encefálico.
Perfusão
Os animais foram anestesiados com tiopental sódico (Thiopentax, Cristália), na dose de 400 mg por quilograma de peso corporal por via intraperitonial. Atestada a anestesia, os animais foram submetidos à perfusão transcardíaca, de acordo com o seguinte protocolo:
seguida, é realizada uma pequena incisão no átrio direito. Logo em seguida liga-se a bomba, promovendo-se a impulsão de 300 ml de solução salina a 0,9% em tampão fosfato 0,1M, pH 7,4 com heparina (Parinex 5000 UI/ml, Hipolabor, 2 ml/1000ml de solução salina), a um fluxo de 100 ml por minuto, com o objetivo de lavar o sistema circulatório. Em seguida são impulsionados 700 ml de solução fixadora (paraformaldeído a 4% em tampão fosfato 0,1M, pH 7,4), a primeira metade à velocidade de 90 ml/min e a outra metade à velocidade de 25 ml/min aproximadamente, devendo todo o fluxo de soluções durar em torno de 30 minutos.
Remoção do Encéfalo
Passadas pelo menos duas horas após perfusão, o encéfalo foi removido da cavidade craniana através da secção de tecidos moles e osteotomia dos ossos da calota craniana. O encéfalo foi armazenado em solução de sacarose a 30% em tampão fosfato 0,1M, pH 7,4, a 4 C, até a realização da microtomia com trocas de solução a cada dois dias, caso ultrapassasse o intervalo de 48h.
1
2
3
2
1
3
Fig. 5: Fotomicrografia de secções de Nissl representando secções aproxidamente no nível rostral (A e D), médio (B e E) e caudal (C e F) para o complexo olivar superior (A, B e C) e núcleos cocleares (D, E e F) do sagüi. Adaptado de Stephan et al, 1980. NC (núcleo coclear), Cb (cerebelo), CI (colículo inferior), CS (colículo superior), COS (complexo olivar superior), H (hipocampo).
NC
NC NC
Cb Cb
Cb
CI CI
CI
CI CI CI
Cb Cb
Cb
COS COS
COS H
H H
H
A
B
C
D
E
F
CS CS
CS CS
Microtomia
Os blocos encefálicos foram congelados por gelo seco e seccionados em micrótomo de deslizamento (Leica SM 2000R), obtendo-se secções coronais de 20 m, as quais foram coletadas seriadamente em 10 (dez) compartimentos com tampão fosfato 0,1M, pH 7,4. Cada compartimento continha um corte de cada seqüência de 10 (dez), de modo que a distância entre uma secção e a seguinte no mesmo compartimento era de aproximadamente 200 m. As secções foram conservadas em solução anticongelante, a -20 C, até a realização dos processamentos subseqüentes.
Coloração citoarquitetônica
Uma das séries de cada encéfalo foi utilizada para coloração pelo método de Nissl, utilizando o corante thionina. Esta técnica tem como finalidade delimitar os grupamentos neuronais.
Imuno-histoquímica
Do encéfalo de cada animal restaram 9 séries, as quais foram submetidas para imuno-histoquímica para identificar as seguintes substâncias neuroativas: NeuN (Mullen et al, 1992; Kumar e Buckmaster, 2007) , Glu, GAD, ENK, 5-HT, ChAT e as proteínas ligantes de cálcio CB, CR e PV.
Os anticorpos utilizados nesse estudo são os mesmos utilizados em outros trabalhos nesse laboratório, e por não apresentarem reações cruzadas e serem previamente testados, dispensam a necessidade de experimento controle.
O procedimento imuno-histoquímico foi realizado com os cortes mergulhados em solução, submetidos a seguinte seqüência de eventos, de acordo com o protocolo descrito abaixo:
1. 4 lavagens, durante 10 minutos cada, em solução de tampão fosfato 0,1 M, pH 7,4, em agitador orbital.
2. Anticorpo primário diluído em Triton X-100 a 0,4% (ver tabela 1), acrescido de soro normal do animal em que foi obtido o anticorpo secundário, durante 18 a 24 horas, à temperatura ambiente, em rotor. 3. 3 três lavagens em tampão fosfato 0,1 M, pH 7,4, de 10 minutos cada. 4. Anticorpo secundário diluído em Triton X-100 a 0,4%, durante 90
minutos, à temperatura ambiente, em rotor.
6. Complexo avidina-biotina-peroxidade (Kit ABC elite, Vector) a uma diluição 1:100 em Triton X-100 a 0,4% contendo NaCl. Os cortes ficam nesta solução durante 90 minutos, à temperatura ambiente, sob agitação lenta, em rotor.
7. 4 lavagens em tampão fosfato 0,1 M, pH 7,4, de 10 minutos cada. 8. Na reação final os cortes são colocados em um meio contendo H2O2a
0,03% como substrato para peroxidase e a 3,3 , 4,4 -tetrahidrocloreto-diaminobenzidina (DAB-Sigma), como cromógeno. 9. 4 lavagens em solução tampão fosfato 0,1 M, pH 7,4, de 10 minutos
cada.
10. Motangem dos cortes em lâminas de vidro previamente gelatinizadas e secagem à temperatura ambiente.
11. Intensificação pelo ósmio: Após a secagem, as lâminas são mergulhadas rapidamente em solução de tetróxido de ósmio a 0,05% para intensificação da reação, seguindo-se a desidratação e diafanização dos cortes seguido da montagem das lamínulas, estando prontas para serem examinadas ao microscópio óptico.
Análise dos resultados
As secções montadas em lâminas foram analisadas através de microscópio óptico (Olympus BX41) em campo claro. As imagens digitais foram obtidas através de uma câmera de vídeo (Nikon DXM1200) acoplada ao microscópio.
O programa Adobe Photoshop 7.0 foi utilizado para correções mínimas de brilho e contraste. Os cortes foram organizados em três níveis de secção, sendo selecionados aqueles que melhor representassem o nível rostral, médio e caudal em cada área de estudo.
Tabela 1: Número de cortes para cada núcleo auditivo rombencefálico:
Núcleos cocleares Complexo olivar superior
Tabela 2. Lista de substâncias e diluições utilizadas no experimento. Antígeno Anticorpo Primário
5. RESULTADOS
Neste estudo foram analisadas as estações rombencefálicas da via auditiva do sagüi: os núcleos cocleares (NC) e o complexo olivar superior (COS). Ambos os centros foram analisados em três níveis rostral, médio e caudal. De cada um dos complexos nucleares serão descritas em sequência a citoarquitetura (Técnica de Nissl e imuno-histoquímica para NeuN) e a caracterização imuno-imuno-histoquímica para Glu, GAD, ENK, 5-HT, ChAT, CB, CR e PV.
5.1. Complexo nuclear coclear (NC)
Citoarquitetura
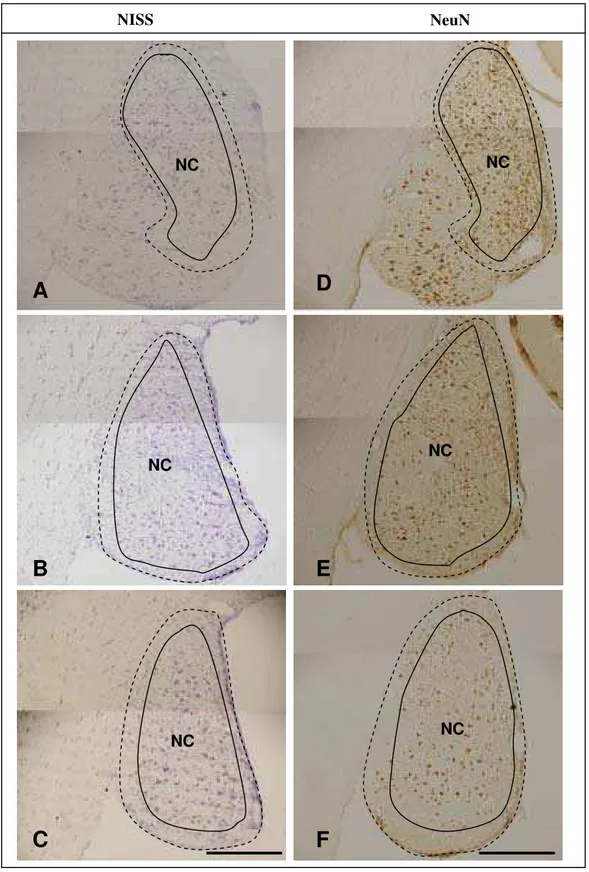
Em secções frontais do encéfalo do sagüi coradas pelo método de Nissl ou imunocoradas para NeuN, os núcleos cocleares foram visualizados como uma proeminência no contorno lateral da parte caudal da ponte, nas imediações do sulco bulbo-pontino. Citoarquitetonicamente foi possível delimitar 3 núcleos analisando-se os níveis rostral, médio e caudal. Rostralmente, o núcleo coclear ântero-ventral (NCAV) é o primeiro a aparecer (Fig. 6 A e D), mas, devido a sua extensão e ângulo de secção, esse subnúcleo ainda pode ser visualizado no nível médio, dorsalmente ao núcleo coclear póstero-ventral (NCPV), onde também se visualiza a parte inicial do núcleo coclear dorsal (NCD), dorsalmente ao NCAV (Fig. 6 B e E). No nível caudal, apenas o NCD é visualizado (Fig. 6 C e F). Neste nível o NCD exibe uma camada externa pobre em células (Fig. 7).
Caracterização neuroquímica
Glutamato (Glu)
Corpos celulares, fibras e terminais imunorreativos a Glu foram visualizados no NC do sagüi no nível rostral (NCAV, fig. 8 A e D), médio (NCAV, NCPV e NCD, fig. 8 B e E) e caudal (NCD, fig. 8 C e F), com aparente menor densidade neste último. Ver representação gráfica na figura 16.
Descarboxilase do ácido glutâmico GAD
delimitação encontrada com a técnica de Nissl e NeuN nos três níveis de secção. No nível rostral corpos celulares, fibras e terminais imunorreativos a GAD foram visualizadas no NCAV (Fig. 9 A e D). No nível médio foi detectada a presença maciça de terminações nervosas e de poucas fibras e corpos celulares imunomarcadas no NCPV (Fig. 9 B e E). No nível caudal corpos celulares, fibras e terminações imunocoradas para GAD foram vistas no NCD (Fig 9 C e F). Ver representação gráfica na figura 16.
Encefalina (ENK)
A imunorreatividade a ENK também foi útil para delimitar os núcleos cocleares, tendo-se encontrado uma presença maciça de corpos celulares imunorreativos a ENK e menor quantidade de terminais em NCAV (fig. 10 A e D) e NCPV (Fig. 10 B e E), o inverso ocorrendo com o NCD, no qual predominam e terminações nervosas imunorreativas a ENK (Fig. 10 C e F). Ver representação gráfica na figura 16.
Serotonina (5-HT)
Todos os núcleos do NC do sagüi apresentaram imunorreatividade a 5-HT em fibras e terminais em todos os níveis de secção (Fig 11 A-F). Entretanto esta distribuição não foi homogênea, verificando-se uma maior concentração no NCD e no contorno lateral do NCAV (Fig 11 A-F). Ver representação gráfica na figura 16.
Colina acetil transferase (ChAT)
Rostralmente foram visualizadas pericários imunorreativas a ChAT no NCAV. No nível médio, foi detectada a presença de fibras e terminais imunorreativos a ChAT no NCAV, NCPV e corpos celulares, fibras e terminais imunomarcados no NCD. No nível caudal, onde é visualizado apenas o NCD, verificou-se pericários, fibras e terminais imunomarcados a ChAT (Fig. 12 A-F). Ver representação gráfica na figura 16.
Proteínas ligantes de cálcio (PLC) Calbindina (CB)
Cal-retinina (CR)
Corpos celulares, fibras e terminais fortemente imunorreativos a CR foram encontrados em todas as subdivisões do NC. O NCAV apresentou uma concentração maior de fibras imunorreativas a CR do que o NCPV, e este apresentou uma concentração de fibras imunorreativas maior que o NCD (Fig 14 A-F). Ver representação gráfica na figura 16.
Parvalbumina (PV)
Figura 6. Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral, médio e caudal, mostrando a citoarquitetura pelo método de Nissl (A, B e C) e NeuN (D, E e F). NCAV, núcleo coclear ântero-ventral; NCPV, núcleo coclear póstero-ventral; NCD, núcleo coclear dorsal, Barra: A, B e C: 1000 µm e D, E e F: 700µm.
NCA NCP
NC
NC NCA
D
F
E
NCA
NCA
NCP NC
NC
NISSL NeuN
A
Figura 7. Fotomicrografias em campo claro de secções coronais do NCD do sagüi em níveis rostral, médio e caudal, mostrando a citoarquitetura pelo método de Nissl (A, B e C) e NeuN (D, E e F). Observe a camada molecular na periferia do NCD. Barra: 290µm.
NISS
L NeuN
A
B
C
D
E
F
NC NC
NC NC
Figura 8. Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para Glu em corpos celulares, fibras e terminais em todos os núcleos. D: ampliação do retângulo em A, E: ampliação do retângulo em B, F: ampliação do retângulo em C. Barra: A, B e C: 700 µm e D, E e F: 40µm.
Glu
A
B
C
E
Figura 9. Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para GAD em pericários, fibras e terminais em todos os núcleos. D: ampliação do retângulo em A, E: ampliação do retângulo em B, F: ampliação do retângulo em C. Barra: A, B e C: 700 µm e D, E e F: 40µm.
GAD
A
B
C
D
E
Figura 10. Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para ENK em pericários e terminais em NCAV e NCPV e predomínio de terminais em NCD. D: ampliação do retângulo em A, E: ampliação do retângulo em B, F: ampliação do retângulo em C. Barra: A, B e C: 700 µm e D, E e F: 40µm.
ENK
A
B
C
D
E
Figura 11. Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para 5-HT em terminais e fibras em todos os núcleos. D: ampliação do retângulo em A, E: ampliação do retângulo em B, F: ampliação do retângulo em C. Barra: A, B e C: 700 µm e D, E e F: 40µm.
5-HT
A
B
C
D
Figura 12. Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para ChAT em pericários no NCAV, fibras e terminais no NCV e corpos celulares, fibras e terminais no NCD. D: ampliação do retângulo em A, E: ampliação do retângulo em B, F: ampliação do retângulo em C. Barra: A, B e C: 700 µm e D, E e F: 40µm.
CHAT
A
B
C
D
E
Figura 13. Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para CB em corpos celulares, fibras e terminais em todos os núcleos. D: ampliação do retângulo em A, E: ampliação do retângulo em B, F: ampliação do retângulo em C. Barra: A, B e C: 700 µm e D, E e F: 40µm.
CB
A
B
C
D
E
Figura 14. Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para CR em pericários, fibras e terminais em todos os núcleos. D: ampliação do retângulo em A, E: ampliação do retângulo em B, F: ampliação do retângulo em C. Barra: A, B e C: 700 µm e D, E e F: 40µm.
CR
A
B
C
D
E
Figura 15. Fotomicrografias em campo claro de secções coronais do complexo nuclear coclear do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição de imunorreatividade para PV em corpos celulares, fibras e terminais em todos os núcleos. D: ampliação do retângulo em A, E: ampliação do retângulo em B, F: ampliação do retângulo em C. Barra: A, B e C: 700 µm e D, E e F: 40µm.
PV
A
C
B
D
E
Rostral Médio Caudal ChAT ENK 5HT GAD Glu Nissl Cb NCVA Cb NCD Cb NCD NCVP NCVA
Rostral Médio Caudal
ChAT ENK 5HT GAD Glu Nissl Cb NCVA Cb NCD Cb NCD NCVP NCVA
Rostral Médio Caudal
Figura 16. Esquema ilustrando a distribuição de imunorreatividade em pericários (pontos pretos) e neuróglia (tons de cinza de acordo com a densidade) para Glu, GAD, ENK, 5-HT, ChAT, CB, CR e PV nos núcleos do complexo nuclear coclear em três níveis de secção (rostral, médio e caudal). Cb, cerebelo.
CR
PV CB
5.2. Complexo olivar superior (COS)
Citoarquitetura
A técnica de Nissl, em combinação com a imuno-histoquímica para NeuN foi útil para delimitar os núcleos do complexo olivar superior (COS) do sagüi, distinguindo-se três núcleos característicos: olivar superior lateral (OSL), olivar superior medial (OSM) e o núcleo do corpo trapezóide (CT). Em nosso material, o OSM destaca-se pela forte afinidade tintorial das suas células, sendo identificado como um conjunto de neurônios densamente compactados em formato aproximado de uma fita vertical ligeiramente curva, de concavidade lateral (Fig. 17 B, C, E e F). Nos níveis médio e caudal, o OSM é ladeado pelo CT, medialmente, e o OSL, lateralmente. O CT pode ser reconhecido como o menor núcleo em secção coronal, porém de maior extensão rostrocaudal, sendo o primeiro a ser visualizado em nível pontino rostral, lateralmente à pirâmide (Fig. 17 A e D). O OSL é o que apresenta maior área seccional em secção coronal, tendo os seus neurônios arranjados de maneira esparsa, em comparação ao OSM. O OSL assume formato ligeiramente oval, podendo ser dividido grosseiramente em uma porção dorsal, com os neurônios arranjados mais compactamente e uma porção ventral, de neurônios mais esparsos (Fig 17 B, C, E e F). Ver representação gráfica na figura 26.
Caracterização neuroquímica
Glutamato (Glu)
Pericários, fibras e terminais imunorreativos a Glu estavam presentes nos três núcleos do COS do sagüi, contribuindo para a delimitação de todos eles (Fig 18). Ver representação gráfica na figura 26.
Descarboxilase do ácido glutâmico (GAD)
Encefalina (ENK)
Foi evidenciada imunorreatividade a ENK nos 3 núcleos do COS, em pericários e terminais no nível rostral do CT e em todos os níveis do OSM. Apenas terminais foram vistos no OSL e nos nível médio e caudal do CT (Fig. 20). Ver representação gráfica na figura 26.
Serotonina (5-HT)
Fibras e terminais imunorreativos a 5-HT foram evidenciados nos três núcleos (OSL, OSM e CT) nos três níveis de secção. No OSL a imunorreatividade a 5-HT aparentava ser mais densa na porção dorsal, principalmente em nível rostral. O OSM é discretamente mais marcado em nível rostral e o CT mostrou-se bem marcado em todos os níveis (Fig. 21). Alguns pericários imunorreativos a 5-HT foram vistos nas vizinhanças do CT, provalvelmente representando neurônios deslocados do grupo serotoninérgico da formação reticular pontina (Fig 21). Ver representação gráfica na figura 26.
Colina acetil-transferase (ChAT)
Foram visualizados nos três níveis de secção a presença de corpos celulares, fibras e terminais imunorreativos a ChAT no CT (Fig. 22 A1, B4 e C7) e nos níveis médio e caudal no OSM (Fig. 22 B3 e C6). Presença de pericários e densa neurópila foi observada no OSL com maior densidade na porção dorsal (Fig. 22 B2 e C5). Ver representação gráfica na figura 26.
Proteínas Ligantes de cálcio (PLC)
Calbindina (CB)
Corpos celulares, fibras e terminais imunorreativos a CB foram evidenciados nos três níveis de secção dos núcleos do COS, contribuindo para sua delimitação (Fig. 23). Ver representação gráfica na figura 26.
Cal-retinina (CR)
Parvalbumina (PV)
Figura 17. Fotomicrografias em campo claro de secções coronais do através do complexo olivar superior do sagüi em níveis rostral (A e D), médio (B e E) e caudal (C e F), mostrando a citoarquitetura pelo método de Nissl (A, B e C) e NeuN (D, E e F). OSL, núcleo olivar superior lateral, OSM, núcleo olivar superior medial, CT, núcleo do corpo trapezóide. Barra: A, B e C: 1000 µm; D, E, F: 700 µm).
F
D
E
A
B
C
NISS
L
Neu
N
C
C OS
OS
Figura 18. Fotomicrografias em campo claro de secções coronais do COS do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a distribuição da imunorreatividade para Glu em pericários, fibras e terminais em todos os núcleos. À direita de cada figura, ampliações das áreas dos retângulos de acordo com a numeração correspondente. Barra: A, B e C: 700 µm; 1, 2, 3, 4, 5, 6 e 7: 60 µm.
Glu
A
1
CT
1
C
OSL
OSM
CT 5
6
7 5
6
7
B
OSL
OSM
CT 2
3
4 2
3