Estudo retrospetivo de casos de osteocondrose de um hospital de
equinos português
Dissertação de Mestrado Integrado em Medicina Veterinária
Luis Pedro Salgueirinho da Silva Ferreira
Orientador: Professor Doutor Mário Pedro Gonçalves Cotovio
III
Universidade de Trás-os-Montes e Alto Douro
Estudo retrospetivo de casos de osteocondrose de um hospital de
equinos português
Dissertação de Mestrado Integrado em Medicina Veterinária
Luis Pedro Salgueirinho da Silva Ferreira
Orientador: Professor Doutor Mário Pedro Gonçalves Cotovio
Composição do Júri: Presidente: Nuno Alegria Arguente: Filipe Silva
Vogal: Mário Cotovio
V
DECLARAÇÃO
NOME: Luís Pedro Salgueirinho da Silva Ferreira
C.C:14202564
TELEMÓVEL: (+351) 915251766
CORREIO ELECTRÓNICO: luis.p.salgueirinho@gmail.com
DESIGNAÇÃO DO MESTRADO: Mestrado Integrado em Medicina Veterinária
TÍTULO DA DISSERTAÇÃO DE MESTRADO EM MEDICINA VETERINÁRIA: Estudo retrospetivo de casos de osteocondrose de um hospital de equinos português
ORIENTADOR: Professor Doutor Mário Pedro Gonçalves Cotovio
ANO DE CONCLUSÃO: 2017
Declaro que esta dissertação de mestrado é resultado da minha pesquisa e trabalho pessoal e das orientações dos meus supervisores. O seu conteúdo é original e todas as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição para obtenção de qualquer grau académico.
Vila Real, Outubro de 2017
VII AGRADECIMENTOS
Estou grato à UTAD. Incluo, aqui, todos os meus amigos e colegas. Para os “especiais”, um obrigado muito especial…por serem meus amigos!! Naturalmente, incluo, também, todo o pessoal administrativo e de apoio, sem o qual a “roda” não andaria!
Ao Corpo Docente, um agradecimento especial! Sem o vosso apoio, sem o vosso saber, o caminho estaria, ainda, por percorrer!
Ao meu Orientador nesta dissertação, Professor Doutor Mário Cotovio, um enorme “Muito obrigado”!! Obrigado pela paciência, pela notória dedicação, pela prontidão das respostas às minhas solicitações, pelo conhecimento que me transmitiu e, muito principalmente, pela disponibilidade permanente, nunca regateada!! O senhor foi ímpar!! Obrigado, Professor.
Ao Dr. José Prazeres, pela oportunidade de estágio, pela colaboração e pela possibilidade de acesso aos dados em que baseei a minha dissertação, os meus agradecimentos. À Drª Maria Antónia Nabais, pela colaboração e pelo conhecimento transmitido, o meu sincero obrigado.
Ao Dr. Bruno Rego e ao Dr. Pedro Costa, por me abrirem as portas e me providenciarem estágio, muito obrigado.
À minha família, por ter colaborado, de todas as maneiras possíveis, neste percurso! Foram, de facto, FAMÍLIA! Sabem que lhes estarei sempre agradecido.
À Diana Rodrigues - a amiga, a mulher, a companheira, a conselheira, a confidente, a cúmplice – agradeço tudo o que tem sido para mim. E quero que o sejas … sempre! Obrigado, Diana!
IX RESUMO
A osteocondrose (OC) é uma Doença Ortopédica de Desenvolvimento (DOD) com marcada expressão na saúde e bem-estar do cavalo e na economia da indústria equestre. É uma doença multifatorial, que resulta de anomalias na ossificação endocondral na placa metafisária e no complexo articular-epifisário. Na literatura, estão disponíveis valores amplos e diversificados de prevalências: ora de 13-74%, ora de 5-20%, entre outros. Este trabalho tem como objetivo o estudo retrospetivo da osteocondrose/osteocondrite dissecante (OC/OCD) numa população de cavalos, num estabelecimento médico-veterinário em território nacional. Espera-se, com ele, complementar a reduzida disponibilidade de estudos sobre esta doença em Portugal e que se revele útil e oportuno face à realidade da doença na medicina e cirurgia de equinos.
Neste estudo, foi realizado, em 2015, o levantamento de dados radiográficos, num hospital de equinos no Ribatejo, referentes a uma população de 64 equinos sem registo de raça, dos quais 12 apresentaram lesões de OC(D).
A população revelou uma prevalência de OC(D) de 18,75% (n=12). Dentro da população afetada por OC(D), 66,67% (n=8) dos animais apresentaram lesões na articulação metacarpofalângica (MCF), 16,67% (n=2) na articulação tarsocrural (TC), 16,67% (n=2) na articulação femuropatelar (FP) e nenhum animal apresentou lesões na articulação metatarsofalângica (MTF).
De um modo geral, os resultados aqui encontrados enquadram-se no intervalo de valores de prevalência da doença assinalados em grande parte dos estudos disponíveis na literatura. Foram observadas outras semelhanças, quanto ao género e à média etária dos animais lesionados, às articulações afetadas e conjugação entre elas. Mais, verificaram-se paralelismos no respeitante à preponderância da lesão na articulação metacarpofalângica, relativamente às articulações metatarsofalângica, tarsocrural e femuropatelar, bem como à lateralidade e à gravidade das lesões. Adicionalmente, neste estudo, foi percetivel a afeção de apenas uma articulação em cada animal com OC(D). Foram, ainda, confirmados os locais de predileção de lesão.
XI ABSTRACT
Osteochondrosis (OC) is a Developmental Orthopedic Disease (DOD), which has an important impact in horse health and welfare as well as in the equestrian industry economy. It is a multifactorial disease that results from abnormalities in endochondral ossification, in both the metaphyseal plate and the articular-epiphyseal complex. In the literature, there are available broad and diverse values of prevalence for the disease, such as 13-74% and 5-20%, amongst others. This work aims to be a retrospective study on the incidence of osteochondrosis/osteochondritis dissecans (OC / OCD) in a population of horses, which were examined at a veterinary medical establishment in Portugal. It is expected that it may complement the limited availability of studies on this disease in Portugal and that it results useful and timely, taking into account the reality of the disease in equine medicine and surgery. In order to support this study, in 2015 it was carried out a survey of the radiographic data, in a veterinary hospital in Ribatejo, referring to a population of 64 horses without breed registration, of which 12 have shown some degree of OC(D) lesions.
The population revealed an overall OC(D) prevalence of 18.75% (n = 12). Within the affected population 66.67% (n = 8) of the animals presented lesions in metacarpophalangeal (MCP) joint, 16.67% (n = 2) in the tarsocrural (TC) joint and 16.67% (n = 2) in femoropatellar (FP) joint and none of them showed lesions on the metatarsophalangeal (MTP) joint.
The results found in this study fall within the range of prevalence values as identified in most of the available studies. Furthermore, there were noted similatities with other studies, particularly with regard to the gender, the average age of affected animals, the affected joints and combination of affected joints. Moreover, some parallelism was found with regard to the preponderance of lesions in the metacarpophalangeal joint compared to the metatarsophalangeal, tarsocrural or femoropatellar joints, as well as regarding the laterality and the severity of detected lesions. In addition, in this study it was noted that every affected animal showed lesions just at one single joint. The lesion’s predilection sites were also confirmed.
XIII ÍNDICE GERAL
1. INTRODUÇÃO ...1
1.1. Ossificação endocondral ...1
1.2. Etiologia ...3
1.2.1. Taxa de crescimento e tamanho corporal ...3
1.2.2. Traumatismo ...4
1.2.3. Stress biomecânico...4
1.2.4. Nutrição, desequilíbrios hormonais e minerais ...6
1.2.4.1. Cálcio e fósforo ...6
1.2.4.2. Cobre ...6
1.2.4.3. Hidratos de carbono e proteína ...7
1.2.5. Predisposição genética...8 1.2.5.1. Hereditariedade ...9 1.2.5.2. Genes...9 1.3. Patogenia ...10 1.4. Epidemiologia ...13 1.4.1. Raças ...14 1.4.2. Articulações...14 1.4.3. Locais de predileção ...15 1.4.4. Idade ...16 1.4.5. Género ...17
1.4.6. Lateralidade das lesões ...17
1.5. Diagnóstico ...18
1.5.1. Sinais clínicos ...18
1.5.2. Exames complementares ...18
1.5.2.1. Radiografia...18
1.5.2.2. Ultrasonografia ...19
1.5.2.3. Tomografia axial computorizada ...20
1.5.2.4. Ressonância magnética ...20 1.5.2.5. Biomarcadores...20 1.5.2.6. Cintigrafia ...21 1.5.2.7. Artrocentese...21 1.5.2.8. Artroscopia e artrotomia ...21 1.6. Tratamento e Prognóstico ...22 1.6.1. Tratamento médico ...22
XIV
1.6.1.1. Anti-inflamatórios não esteroides ...22
1.6.1.2. Corticosteroides ...23
1.6.1.3. Ácido hialurónico ...23
1.6.1.4. Glicosaminoglacanos polisulfatados, glucosamina e sulfato de condroitina ...23
1.6.1.5. Polisulfato de pentose ...24
1.6.2. Tratamento cirúrgico ...24
1.6.2.1. Artrotomia e artroscopia ...24
1.6.2.2. Desbridamento (“Joint resurfacing”)...25
1.6.2.3. Reparação endógena estimulada ...25
1.6.2.4. Re-união de defeitos osteocondrais com parafusos de poliadioxanona absorvível ...25 2. OBJETIVOS ...27 3. MATERIAIS E MÉTODOS ...29 3.1. População ...29 3.2. Dados da amostra ...29 3.3. Análise estatística ...30 4. RESULTADOS ...31 5. DISCUSSÃO ...39 6. CONCLUSÃO...47 7. BIBLIOGRAFIA ...49 8. ANEXOS ...63
8.1. Anexo A – Prevalência de OC(D) em diferentes raças ...63
8.2. Anexo B – Imagens Radiográficas dos casos clínicos com OC(D)...65
XV ÍNDICE DE FIGURAS
XVII ÍNDICE DE TABELAS
Tabela 1 - Prevalência de OC(D) na população ... 31 Tabela 2 - Prevalência de OCe OCD na população total e valor absoluto e percentual
de animais com OC e OCD na população afetada ... 31 Tabela 3 - Registo das idades dos animais com lesões de OC(D) na população afetada e
por articulação e respetivas médias de idades ... 32 Tabela 4 - Prevalência de OC(D), por articulação, na população total e distribuição, por
articulação, nos animais afetados ... 33 Tabela 5 - Distribuição das lesões pelas articulações ... 33 Tabela 6 - Número de lesões nos locais de predileção das diferentes articulações e
respetiva percentagem na articulação... 34 Tabela 7 - Número de lesões nas diferentes articulações e respetivos graus de lesão.... 36 Tabela 8 - Distribuição percentual das lesões, por grau de lesão, em cada lado do
XIX ÍNDICE DE GRÁFICOS
Gráfico 1 - Distribuição da lateralidade das lesões na articulação MCF ... 34
Gráfico 2 - Distribuição da lateralidade das lesões na articulação TC ... 35
Gráfico 3 - Distribuição da lateralidade das lesões na população afetada... 35
Gráfico 4 - Distribuição das lesões, por grau, na articulação MCF ... 36
Gráfico 5 - Distribuição das lesões, por grau, na articulação TC... 37
XXI
LISTA DE ABREVIATURAS, SIGLAS, SÍMBOLOS OU ACRÓNIMOS
AH - Ácido hialurónico
AINE - Anti-inflamatórios não esteroides ATPases - Adenosina trifosfatases
BMP - Bone morphogenetic proteins (Proteínas morfogenéticas ósseas) CTx - Telopeptideo colagénio tipo I
D45ºL-PlMObl - Dorso45ºlateral-plantaromedial oblíqua DOD - Doença ortopédica de desenvolvimento
FAO - Fosfatase alcalina de especificidade óssea FP - Femuropatelar
GAGPS - Glicosaminoglicanos polissulfatados GH - Growth hormone (Hormona do crescimento)
Gli1 - Glioma-associated oncogene homolog 1 (Fator de transcrição primário para a IHH) ICTP - Telopeptídeo carboxiterminal de colagénio tipo I
IGF-I - Insuline-like growth factor I (Fator de crescimento semelhante à insulina I) IGF-II - Insuline-like growth factor II (Fator de crescimento semelhante à insulina II) IHH - Indian hedgehog (Via de sinalização do desenvolvimento embrionário) IL-1β - Interleucina-1 beta
LM - Lateromedial
MAD - Membro anterior direito MAE - Membro anterior esquerdo McIII - Osso metacarpiano III MCF - Metacarpofalângica MEC - Matriz extracelular
XXII MMP – Metaloproteinases
MPD - Membro posterior direito MPE - Membro posterior esquerdo MtIII - Osso metatarsiano III MTF - Metatarsofalângica OC - Osteocondrose
OCD - Osteocondrite dissecante OE - Ossificação endocondral
PICP - Péptideo carboxiterminal de procolagénio tipo I PRE - Pura Raça Espanhola
PSL - Puro Sangue Lusitano
PTHrP - Parathyroid hormone-related protein (Proteína relacionada com a hormona paratiroide)
QTL - Quantitative trait loci (Loci de características quantitativas) RM - Ressonância magnética
Rx - Radiografia T3 - Triiodotironina T4 – Tiroxina
TAC - Tomografia axial computorizada TC - Tarsocrural
TDPyr - Desoxipiridinolina total
TGF-β - Transforming growth factor-beta (Fator de crescimento transformador beta) TNF-α - Tumor necrosis factor alpha (Fator necrotico tumoral alfa)
US - Ultrassonografia
1 1. INTRODUÇÃO
A Osteocondrose (OC) é uma doença da cartilagem de crescimento, enquadrada no grupo das Doenças Ortopédicas do Desenvolvimento (DOD). Esta doença está relatada em várias espécies animais, incluindo o Homem (Peterson et al.,1999). Entre outras, encontra-se na vaca (Olstad et al., 2015), no rato (Kato et al., 1987), no porco (Jørgensen et al., 1995), no frango (Poulos et al., 1978b), no peru (Poulos, 1978a), no cão (Nečas et al., 1999), no gato (Palierne et al., 2010) e no cavalo.
No cavalo, a doença foi descrita pela primeira vez em 1947, por Nilsson (citado por McIlwraith & Trotter, 1996). Desde então, vigora alguma controvérsia em torno da sua etiologia e fisiopatogenia.
Quanto à sua nomenclatura, surgem as designações “osteocondrose”, “osteocondrite” e “osteocondrite dissecante” (OCD), nem sempre usadas de forma correta e diferenciada. De facto, a “osteocondrose” é o processo inicial de lesão; a “osteocondrite” constitui a resposta inflamatória à ostecondrose e a “osteocondrite dissecante” corresponde à dissecação de um fragmento de cartilagem articular no osso subcondral e consequente formação de fragmentos ósseos intra-articulares (Stock et al., 2005b; Novales, 2007).
Existe alguma controvérsia em relação ao uso do termo “osteocondrose”, uma vez que a lesão inicial se reporta apenas à cartilagem e não ao osso, pelo que Olsson, em 1978 (Jeffcott, 1991) propõe o termo “discondroplasia”. No entanto a alteração da nomenclatura tem-se manifestado extremamente difícil, face à já generalizada utilização e tradição do primeiro termo.
Face à grande preponderância de estudos sobre a doença na articulação tarsocrural (TC), em detrimento do que acontece no caso das restantes articulações, à disparidade dos resultados que deles decorrem e ao fracasso dos protocolos de controlo da doença experimentados em diversas raças de cavalo, afiguram-se deveras úteis estudos adicionais acerca da doença, nos quais o presente trabalho se pretende incluir.
Este trabalho representa um estudo de uma população de equinos, com o objetivo de caracterização epidemiológica da doença, com base nos exames radiográficos realizados num hospital veterinário em território nacional.
1.1. Ossificação endocondral
Na fase inicial da vida fetal, os mamíferos apresentam esqueleto cartilagíneo que sofre crescimento e transformação em osso. Nos ossos longos estão presentes dois tipos de centros de ossificação: os centros primários de ossificação, localizados na diáfise e os
2
centros secundários de ossificação, localizados nas epífises e, ainda, nas apófises e ossos cubóidais do tarso e carpo (Hurtig, 1996; van Weeren, 2005). Os centros primários de ossificação sofrem uma ossificação precoce ainda na fase fetal e, assim, aquando do nascimento, as diáfises dos ossos longos já são estruturas ósseas. Já o mesmo não acontece com os centros secundários de ossificação, que permanecem parcialmente cartilagíneos na altura do nascimento (van Weeren, 2006c). O desenvolvimento do esqueleto ósseo acontece em dois locais na região terminal dos ossos longos com cartilagem de crescimento: na placa de crescimento metafisária e na cartilagem epifisária do complexo cartilagíneo articular epifisário. O primeiro apresenta-se na forma de disco cartilagíneo de cada lado do centro primário de ossificação e é responsável pelo crescimento longitudinal. O segundo está localizado entre os centros de ossificação secundários e as superfícies articulares e é responsável pela formação de osso subcondral e pela morfologia adequada da articulação ao crescimento ósseo (Ytrehus et al., 2007). Nestas duas regiões, a cartilagem de crescimento sofre ossificação endocondral (OE) (Lefebvre & Smits, 2005).
A OE consiste na substituição de cartilagem por osso, através de um processo sequencial de proliferação celular, síntese de matriz extracelular, hipertrofia dos condrócitos, mineralização da matriz e invasão vascular. Os condrócitos da cartilagem de crescimento estão organizados em 5 zonas. A primeira, a “zona de repouso”, é constituída por cartilagem hialina sem alterações de morfologia e caraterizada pela divisão lenta de condrócitos. A segunda, é a “zona de proliferação”, onde ocorrem uma divisão celular rápida e produção ativa de matriz com disposição de colunas paralelas no sentido longitudinal do osso na placa de crescimento e de “clusters” na cartilagem epifisária (Ytrehus et al., 2007). Na “zona de cartilagem hipertrófica”, acontecem a diferenciação terminal de condrócitos hipertróficos e a secreção de matriz extracelular (MEC) altamente especializada que envolve os condrócitos, com produção de vesículas ricas em fosfatase alcalina, para que ocorra a calcificação da cartilagem. Posteriormente, serve como molde para a formação do tecido ósseo pelos osteoblastos. Aqui ocorrem, ainda, o início da apoptose dos condrócitos. A MEC é constituída essencialmente por colagénio tipo II e proteoglicanos (van de Lest et al., 2004) e a renovação desta é controlada pela produção enzimática dos condrócitos, as metaloproteinases de matriz (MMP) (colagenases, estromelisinas e gelatinases), catepsinas e adenosina trifosfatases (ATPases) (Al-Hizab et al., 2002; Vidal et al., 2009). Na “zona de cartilagem calcificada” ocorre mineralização e termina a apoptose dos condrócitos. Finalmente, na “zona de ossificação” ocorre a invasão por capilares sanguíneos e células osteoprogenitoras provenientes do periósteo e tecido conjuntivo da cavidade medular (Hall et al., 2006). Esta invasão vascular é originada pelo “fator de crescimento endotelial
3
vascular” (VEGF - “vascular endotelial growth factor”), produzido pelos condrócitos hipertróficos (Jeffcott & Henson, 1998). As células osteoprogenitoras formam osteoblastos e, assim, depositam tecido ósseo na zona de ossificação. A calcificação deste tecido aprisiona os osteoblastos e estes dão lugar a osteócitos, ocorrendo, assim, a camada esponjosa primária constituída por cartilagem calcificada e por tecido ósseo esponjoso e lamelar (Junqueira & Carneiro, 1999b; Ytrehus et al., 2007). Em simultâneo com a deposição de tecido ósseo, os condroclastos reabsorvem a cartilagem e os osteoclastos reorganizam o tecido, de modo que o osso esponjoso seja substituído por osso lamelar (Junqueira & Carneiro, 1999b).
O ritmo, a organização espacial e durabilidade da OE são condicionados pelo metabolismo, por fatores nutricionais e mecânicos e pela genética (Ytrehus et al., 2007). A “proteína relacionada com a hormona paratiroide” (PTHrP - “parathyroid hormone-related protein”), a “via de sinalização do desenvolvimento embrionário” (IHH - “Indian hedgehog”), e o “fator de crescimento transformador beta” (TGF-β - “transforming growth factor-beta”) são as moléculas responsáveis pelo controlo da proliferação dos condrócitos e pela passagem para a fase hipertrófica (Provot & Schiipani, 2005; Goldring et al., 2006). A PTHrP, sintetizada por células pericondrais periarticulares e por condrócitos em fase avançada de diferenciação, promove a proliferação dos condrócitos na placa de crescimento e inibe a sua hipertrofia (Juppner, 2000). A IHH, produzida pelos condrócitos pré-hipertróficos e hipertróficos, promove a manutenção da PTHrP. A TGF-β, produzida pelas células pericondrais, após “feedback” positivo da IHH, promove o aumento de PTHrP, podendo, ainda, atuar diretamente sobre os condrócitos inibindo a hipertrofia (Ballock & O’Keefe, 2003; Shum et al., 2003).
1.2. Etiologia
A OC é uma doença multifatorial, complexa, sem exclusividade de um fator etiológico perante os restantes.
1.2.1. Taxa de crescimento e tamanho corporal
São vários os estudos acerca da taxa de crescimento como fator etiológico da doença, em diferentes espécies, com resultados diversos. No porco, o aumento da taxa de crescimento, quer por origem alimentar, quer por via hereditária, conduziu a uma maior predisposição para a OC (Stromberg, 1979; Jørgensen & Andersen, 2000). Também em frangos, touros e cavalos é admitida a influência deste fator na etiologia da doença (Olsson & Reiland, 1978; Stromberg, 1979). Porém, outros estudos realizados em porcos (Woodard,
4
1987, citado por Ytrehus et al., 2007) não revelaram correlação entre a taxa de crescimento e a doença, mesmo quando foi reduzida a taxa de crescimento induzida pela via alimentar.
Na espécie equina, foi revelada associação entre a OC na articulação do boleto em poldros com elevada taxa de crescimento após os primeiros 110 dias de vida (Jeffcott, 1997). Nas articulações femuropatelar (FP) e TC, a incidência foi superior em poldros com maior taxa de crescimento entre os 3 - 8 meses de idade e com maior peso ao nascimento (Pagan, 1996). Sandgren e coautores, em 1993, acrescentaram a associação entre lesões visíveis ao RX na articulação TC e o peso vivo ao nascimento, a taxa de ganho de peso diário e o tamanho corporal. No entanto, outros estudos não encontraram relação entre a frequência ou gravidade da doença e a taxa de crescimento ou peso vivo (Vervuert et al., 2005).
A importância da taxa de crescimento, por si só, é questionável face aos estudos acima apresentados. Mais, é difícil de quantificar e avaliar o seu impacto isolado, tendo em conta que é influenciada, até certo ponto, pela alimentação e pela genética. Num estudo de Philipsson e coautores (1993), citado por Ytrehus e coautores (2007), é apontada a relação do tamanho corporal e da taxa de crescimento com a OC, com fundo ambiental em detrimento da genética. No cavalo, um maior diâmetro da canela (Donabédian et al., 2006), maior altura ao garrote e má conformação do membro foram associados a lesões, essencialmente nas articulações metacarpofalângica (MCF) e metatarsofalângica (MTF) (Sandgren et al., 1993). A articulação TC revelou-se independente destes fatores (Stock & Distl., 2006).
O caráter dinâmico da doença e a influência genética dificultam a mensuração e perceção do valor real da influência do tamanho corporal na etiologia da doença.
1.2.2. Traumatismo
O traumatismo tem sido associado à doença como catalisador da evolução de OC para OCD, uma vez que o início dos sinais clínicos pode ocorrer aquando do traumatismo provocado pelas cargas biomecânicas iniciais após o nascimento. Foi verificado, em suínos, que os lotes com maior número de quedas traumáticas apresentaram o maior número de lesões (Nakano & Aherne, 1988, citado por Ytrehus et al., 2007). No entanto, o traumatismo não é aceite como fator etiológico inicial na formação das lesões primárias, uma vez que há registo de lesões sem qualquer evidência de traumatismo. Argumenta-se, por outro lado, que as forças envolvidas neste mesmo traumatismo, por exemplo durante a locomoção (Ytrehus et al., 2007), por si só, não seriam suficientes para originar as lesões iniciais. O mesmo foi concluído para a espécie humana (Blitz et al., 2005, citado por Ytrehus et al., 2007).
5 1.2.3. Stress biomecânico
No homem (Schenck, 1996), no porco (Grøndalen, 1974, citado por Bernardes, 2008) e no cão (Olsson,1987, citado por Ytrehus et al., 2007) a conformação anatómica tem influência na prevalência, incidência (Grøndalen, 1974, citado por Bernardes, 2008) e gravidade (van der Wal et al., 1980) das lesões, sendo considerada como fator etiológico quando associada a sobrecarga local (Grøndalen, 1974, citado por Bernardes, 2008). Estas características anatómicas exteriores são sujeitas, em certa medida, à influência do padrão genético do animal (Ytrehus et al., 2004).
No cavalo, a literatura suporta a existência de locais de predileção para as lesões de OCD nas diferentes articulações (van Weeren, 2005; Rejno & Stromberg, 1978). Alguns autores explicam, à luz da teoria do stress biomecânico, a formação de lesões em locais específicos sujeitos a cargas biomecânicas (van Weeren, 2006a; Ytrehus et al., 2007). Esta carga biomecânica, associada a alterações de cartilagem no período fetal (van Weeren, 2006c), ocorre muitas das vezes após o parto, ou mesmo na fase fetal em raças de grandes dimensões (Olstad et al., 2008), sendo caraterizada, inicialmente, por uma deficiência do aporte vascular e, depois, pela formação dos flaps cartilagíneos (Semevolos & Nixon, 2007). Acontece, assim, a evolução de uma situação subclínica para um caso clínico (Ytrehus et al., 2007), tendo por base forças mínimas como as envolvidas na locomoção. A prevalência e gravidade das lesões são concomitantes com a intensidade do stress biomecânico (Ytrehus et al., 2007).
Segundo van Weeren e Barneveld (1999b), a localização e tipo de lesão são determinados pela pressão exercida, estática e/ou dinâmica, verificando-se que poldros estabulados sujeitos a pressões estáticas apresentavam quistos ósseos subcondrais nos côndilos femurais e, por sua vez, poldros em regime de treino ou em liberdade apresentavam lesões de OC na tróclea lateral do fémur.
Associados a este fator etiológico ocorrem outros, como o exercício físico, tamanho corporal (através do peso corporal) e a genética (intervindo na conformação corporal individual) (Bramlage, 1993). As fronteiras entre estes fatores são ténues, sendo difícil a determinação e quantificação da influência de cada um deles nos casos de doença.
Os estudos acerca da influência do exercício físico na etiologia e prevalência da doença articular são escassos (Lepeule et al., 2009).
A atividade física tem reflexo na remodelação e renovação da arquitetura óssea (Young et al., 1989; McCarthy & Jeffcott, 1992) e a sua intensidade é proporcional à atividade mineral óssea (Harris, 1997; Price et al., 1995b). O primeiro ano de vida é marcado
6
por uma importante diferenciação colagénica articular, induzida pelo exercício (Brama et al., 2009; Barneveld & van Weeren, 1999). A prática regular de exercício surge associada a uma menor incidência de lesões OC (Bruin et al., 1992, citado por Rasquilha, 2015). Já van Weeren & Barneveld (1999b) defendem que este fator etiológico não tem repercussão no número de lesões, contribuindo, antes, para uma menor gravidade das mesmas, demonstrando, assim, o seu papel regenerador, essencialmente nas articulações MCF/MTF. Paralelamente, foi verificado que poldros privados de atividade física ou associados a um nível de exercício irregular apresentam predisposição para lesões de OC (Christmann, 2004; Wittwer et al., 2006). Aparentemente, o efeito benéfico do exercício físico é mais notório quando os animais são alimentados com rações energéticas (Jeffcott, 1997).
Por outro lado, na presença de lesões de OCD, a atividade física intensa não é aconselhada, podendo contribuir para a evolução das lesões, essencialmente no primeiro ano de vida (van Weeren, 2005). Brama e coautores (1999) colocam, mesmo, a hipótese de perda da viabilidade dos condrócitos, com o tempo, em animais em regime de exercício.
Este fator etiológico não é assumido como fulcral na patogenia da doença (van Weeren, 2006c), mas sim determinante na localização e aspeto final das lesões (van Weeren & Barneveld, 1999b). É um fator que merece mais estudo e reflexão, uma vez que é o ponto etiológico que mais facilmente pode ser controlado e alterado pelo homem (van Weeren & Barneveld, 1999b), com vista final a uma redução da prevalência da doença.
Assim, o stress biomecânico - tal como o traumatismo - é considerado um dos fatores participantes da etiologia da doença, mas não único ou preponderante, nem tampouco iniciador (Dik et al., 1999; McIlwraith, 2004).
1.2.4 Nutrição, desequilíbrios hormonais e minerais
1.2.4.1. Cálcio e fósforo
Os níveis de cálcio e de fósforo são importantes na ossificação endocondral e na estrutura do osso subcondral, pelo que o seu défice poderá levar a lesões de OC (Aldred, 1998; van Weeren, 2006a). Estes minerais devem ser ingeridos em quantidade individual suficiente e numa razão cálcio/fósforo de 1,5:1 (Pagan, 2003), uma vez que dietas com elevado teor de fósforo (cerca de quatro vezes o recomendado) parecem estar associadas a um maior número de lesões, devido a osteoporose do osso subcondral secundária a hiperparatiroidismo (Savage et al., 1993). Por sua vez, dietas ricas em cálcio parecem não ter repercussão na incidência da doença (Jeffcott, 1997; Savage, 1993).
7 1.2.4.2. Cobre
Dietas com défice de cobre foram associadas à OC, em equinos (Hurtig et al., 1993) e noutras espécies por exemplo em cervídeos (Handeland & Bernhoft, 2004), no bisonte (Woodbury et al., 1999). O défice em cobre, devido a um aporte insuficiente na dieta (Bridges & Harris, 1988) ou devido aos níveis de outros compostos que interfiram com a absorção deste, como zinco e ferro (Aldred, 1998), cádmio (van Weeren, 2006a), sulfatos inorgânicos (Thompson et al.,1994), cálcio (Lawrence & Pagan, 2005; Aldred, 1998), molibdênio e fósforo (Watkins, 1992), potencia a ocorrência de DOD (Lawrence & Pagan, 2005).
Na perspetiva da fisiopatogenia articular, na ausência ou défice de cobre, a enzima lisil-oxidase, cobre-dependente, tem a sua atividade comprometida; daí a presença de cartilagens com reduzido número de ligações cruzadas de colagénio (van Weeren et al., 2003; Lawrence & Pagan, 2005). Mais, as enzimas superóxido-dismutase e citocromo-oxidase (presentes no osso e cartilagem e para as quais o cobre é co-factor) vêem comprometida a sua atividade de síntese de componentes da cartilagem do cavalo (Davies et al., 1996, citado por Jeffcott & Henson, 1998).
Uma vez que o leite das éguas não responde cabalmente às necessidades do poldro em cobre e outros minerais (Lawrence & Pagan, 2005), é necessária a suplementação, com cobre, da dieta da progenitora no final da gestação (Pearce et al., 1998) e do poldro. Os filhos de éguas suplementadas com cobre e as próprias m ães apresentam níveis hepáticos de cobre adequados até por volta do 150º dia de vida do poldro (Pearce et al., 1998,a,b,c).
Assim, no geral, a literatura atual suporta a influência do défice de cobre na incidência e prevalência da doença (van Weeren, 2006c; Semevolos & Nixon, 2007), embora o seu mecanismo não seja totalmente entendido (Bridges & Moffitt, 1990). É plausível que o cobre represente maior importância na reparação das lesões já estabelecidas do que na patogenia e prevalência destas (van Weeren et al, 2003).
1.2.4.3. Hidratos de carbono e proteína
Após uma refeição de elevado teor energético (Glade & Belling, 1986, citado por Auer & Stick, 2006), constituída essencialmente por hidratos carbono facilmente digestíveis (Savage et al., 1993; Semevolos & Nixon, 2007), ocorre hiperglicemia, que resulta em acentuada hiperinsulinemia pós-prandial (Ralston, 1997; Gee et al., 2007). Num estudo de (Ralston, 1996), demonstrou-se que os cavalos com lesão osteocondrótica apresentavam maior glicemia pós-prandial e resposta à insulina. É percetível algum grau de variação na resposta glicémica individual de cada animal (Pagan et al., 2001; van Weeren, 2006a). Os
8
elevados níveis em circulação da insulina e dos seus derivados, as somatomedinas - fatores de crescimento semelhantes à insulina-I e II (IGF-I e IGF-II) - por desregulação central da hormona do crescimento (GH – “Growth Hormone”) e rutura do eixo GH-IGF-I, atuam na ossificação endocondral como mitogénicos sobre os condrócitos, evitando a sua apoptose (Henson et al., 1997a; Verwilghen et al., 2009). Tal poderá estar relacionado com os numerosos condrócitos hipertróficos presentes em lesões de OC em equinos (Henson et al., 1997a), em redor dos canais de cartilagem, devido a um melhor acesso às hormonas em circulação (Jeffcott & Henson, 1998; Shingleton et al., 1997). O tipo de articulação lesionada é influenciado pelo momento da disponibilidade da alimentação energética para o equino e pela respetiva “janela de vulnerabilidade” da articulação. Verifica-se que poldros nascidos mais cedo no ano, na Primavera, são mais afetados na articulação TC, enquanto os nascidos mais tarde, no Outono, são mais afetados na articulação FP (Paasch & Bramlage, 2004).
Como consequência da hiperinsulinemia pós-prandial, surge uma fase metabólica de hipotiroidismo transitório, caracterizado pela diminuição das hormonas triiodotironina (T3) e tiroxina (T4) em circulação. Assim, fica comprometida a presença destas hormonas na fase final de diferenciação dos condrócitos - caracterizada pela invasão das cartilagens de crescimento por vasos sanguíneos (Jeffcott & Henson, 1998) e por fenómenos bioquímicos inerentes à mineralização (Glade & Belling, 1984; Jeffcott & Henson, 1998) - resultando num atraso ou mesmo falha da maturação das cartilagens de crescimento (van Weeren, 2006c).
A adequada constituição proteica da dieta é essencial ao desenvolvimento músculo-esquelético, que poderá ser comprometido pelo défice desta (Aldred, 1998). Por outro lado, o seu excesso não parece produzir efeitos negativos (Savage et al., 1993; Ralston, 1999).
A nutrição representa, assim, um fator marcante na etiologia da doença, que ocorre de forma indissociável da genética, como acontece na resposta glicémica individual e hormonal de cada animal, acima referida (Pagan et al., 2001; van Weeren, 2006a). Este fator aparece, também, associado à taxa de crescimento e ao exercício físico (van Weeren,2006c), como sustenta a diversidade de lesões em animais com o mesmo regime alimentar (Glade & Belling, 1984).
1.2.5. Predisposição genética
Vários são os estudos que asseguram a predisposição genética da doença (Hoppe, 1984; Jeffcott, 1991; Donabedian et al., 2008; Lykkjen et al., 2012) e, inclusivamente, a sua influência na gravidade das lesões (Ytrehus et al., 2007).
9
Em vários estudos foram determinadas diferentes prevalências em linhas distintas de cães (Nečas et al., 1999), porcos (Jørgensen & Andersen, 2000) e cavalos (Foerner, 2003) e diferente incidência entre poldros filhos de diferentes garanhões (Schougaard et al., 1990, citado por Auer & Stick, 2006), o que suporta a presença de um padrão genético na doença. O facto de se verificar uma reduzida incidência em póneis e cavalos selvagens (Voûte et al., 1997, citado por Auer & Stick, 2006; Valentino et al., 1999), em contraste com o verificado nas raças de cavalo doméstico, apoiam a conclusão acima.
Vários estudos suportam, também, a influência genética na eventual conjugação entre lesões nas diferentes articulações (Stock et al., 2005a; Foland et al., 1992).
Segundo van Grevenhof e coautores (2009b) e Novales (n.d.), os suportes genéticos da localização e tipologia de lesões (edentação, aplanamento, fragmentação) são independentes entre si, com distintos genótipos e heritabilidade, sem significado evolutivo de gravidade, após encontrar valores de correlação baixos entre estas formas de lesão.
Van Weeren (2006) coloca, ainda, a hipótese do processo regenerativo das lesões poder ter por base o padrão genético
1.2.5.1. Hereditariedade
A hereditariedade da OC é apoiada por diversos autores (Pieramati et al., 2003; van Weeren, 2006a; Wittwer et al., 2007), com distintos resultados de heritabilidade disponíveis na literatura atual.
A amplitude de valores de heritabilidade da doença varia entre 0.05-0.60 (van Weeren, 2006a). Em cavalos de sangue frio, identificam-se valores de 0.07 (van Grevenhof, 2011), 0.43 (Stock & Distl, 2006) e entre 0.16-0.48 (Wittwer et al., 2007). Por sua vez, em cavalos de sangue quente, adiantam-se valores compreendidos entre 0,19-0,37 (Stock et al., 2005, citado em Wittwer et al., 2007) e 0,19-0,34 (Willms et al., 1999 citado em Wittwer et al., 2007). Em cavalos trotadores apontam-se valores de 0,26 (Schougaard et al., 1990 citado em Wittwer et al., 2007), entre 0,21-0,52 (Grøndahl & Dolvik, 1993) e entre 0,24-0,27 (Philipsson et al., 1993 citado em Wittwer et al., 2007).
De um modo geral, existe concordância dos estudos em que a doença na articulação TC tem uma maior heritabilidade quando comparada com as restantes articulações (van Grevenhof, 2011), com fulcral influência genética nas lesões.
De modo diverso, na articulação FP, MTF e MCF verificam-se valores de heritabilidade da doença mais reduzidos, com maior importância da influência ambiental em detrimento da genética (Dik et al., 1999; Christmann, 2004),
10
A variedade dos valores de heritabilidade referidos será, em parte, devida às diferenças nas amostras das populações dos estudos, no que refere à raça, número de animais, metodologia de trabalho (Wittwer, 2006; van Grevenhof et al., 2009a) e, também, ao tipo e localização das lesões estudadas (Jørgensen & Andersen, 2000; Yazdi et al., 2000).
1.2.5.2. Genes
Quanto aos genes responsáveis pela doença, é reconhecido um fundo poligénico em cães (Padgett et al.,1995), humanos (Tsirikos et al., 2003; Gustavel & Beals, 2002) e, também, em cavalos (Philipsson, 1996).
As regiões dos genes com possível ligação à doença são denominadas de “loci de características quantitativas” (QTL - “quantitative trait loci”). São bastantes os estudos que mostram o envolvimento de diferentes genes e moléculas na etiopatogenia da doença.
A OCD é classificada, por alguns autores, como uma doença recessiva, com genes distintos associados às diversas articulações afetadas (Christmann, 2004; Wittwer et al., 2007). Num estudo foram identificadas 11 proteínas moduladas e 140 genes associados a 100 mutações em 30 regiões QTL (Desjardin et al., 2014).
Foi colocada a possibilidade da atividade enzimática e hormonal, dos recetores da ossificação endocondral e do metabolismo serem codificados por genes presentes em QTL’s para a doença (Semevolos & Nixon, 2007; Serteyn et al., 2010).
Vários estudos suportam, também, a influência genética na eventual conjugação entre lesões nas diferentes articulações. Stock e coautores (2005a) concluiram que os fragmentos nas articulações interfalângica proximal, interfalângica distal e o boleto são geneticamente relacionados, com correlação moderadamente positiva e que a correlação entre lesões nos boletos é positiva. Já a correlação genética entre fragmentos ósseos do boleto e o género é negativa.
Associada à componente genética aqui abordada, com 25 % de contribuição para o fenótipo, surge a componente ambiental, com os restantes 75% (van Weeren, 2006a). Tal como antes referido, a medida precisa da interação entre estes é uma incógnita (McIlwraith, 2002).
Em suma, é concluida a complexidade da hereditariedade (van Weeren, 2006c), dada a multiplicidade de genes com possível ligação à doença.
11
Na literatura atual, existe controvérsia e uma notória diversidade de teorias na tentativa de explicar a patogenia da doença. Não é, tampouco, consensual que a lesão inicial apareça exclusivamente durante o processo de OE (Lepeule et al., 2009).
Na placa de crescimento, as lesões iniciais de osteocondrose caraterizam -se pela presença de condrócitos hipertróficos, envolvidos em matriz cartilagínea resistente à invasão pelos vasos sanguíneos metafisários (Hill et al., 1984). Quanto à patogenia neste local, pensa-se que as lesões poderão resultar de um processo isquémico, ora no lado epifisário, ora no lado metafisário, da placa (Ytrehus et al., 2007).
No complexo cartilagíneo articular epifisário, as lesões são caraterizadas por uma área de necrose focal na cartilagem de crescimento, não afetando a cartilagem articular e o osso subcondral (Carlson et al., 1995) e culminam numa junção osteocondral irregular. No cavalo, na maioria dos casos, apenas o complexo cartilagíneo articular epifisário é afetado.
Vários autores afirmam que alterações no suprimento sanguíneo estão na origem da doença (Olstad et al., 2007; Ytrehus et al., 2007; Olstad et al., 2008). As alterações, a este nível, foram primeiramente verificadas em suínos (Carlson et al., 1991). A interpretação da patogenia da doença nos equinos é realizada, em parte, por extrapolação daquela espécie, o que, dadas as diferenças, poderá levar a conclusões menos fiáveis.
Alguns autores defendem a hipótese da ocorrência da OC secundariamente a uma necrose isquémica focal da cartilagem epifisária, devido a uma falha na irrigação sanguínea dos canais de cartilagem, aquando da anastomose com os vasos metafisários provenientes da frente de ossificação, na fase de crescimento (Olstad et al., 2007; Olstad et al., 2013), com possível predisposição hereditária (Olstad et al., 2015). Estas anastomoses atravessam a junção osteocondral, zona esta de intensa atividade remodeladora e ponto de contato entre cartilagem e tecido esponjoso primário, daí decorrendo a suscetibilidade para lesões.
Este processo leva à consequente resistência à invasão vascular pelos vasos da medula óssea, à mineralização e à substituição da cartilagem por osso quando as áreas necróticas entrarem em contacto com a frente de ossificação, culminando numa falha na OE (Olstad et al., 2013). Estas zonas de lesão são progressivamente substituidas por tecido fibroso e sofrem ossificação membranosa (Ytrehus et al., 2007).
Nesta linha, alguns autores defendem a hipótese de a necrose cartilagínea preceder o atraso da ossificação endocondral (Carlson et al., 1991; Woodard et al., 1987, citado em Carlson et al., 1995), ou seja, que a OC ocorra secundariamente à necrose, posição esta também defendida por Olstad e seus colaboradores (2007). No entanto, van Weeren (2006c) adianta a possibilidade de a condronecrose ser uma consequência e não um fator iniciador da doença. Esta hipótese é corroborada por Henson e colaboradores (1997b), que
12
observaram canais de cartilagem retidos associados a lesões, mas nem sempre associados a condronecrose.
Numa aproximação diferente, nalguns estudos é defendido que os canais cartilagíneos - os vasos sanguíneos que nutrem a cartilagem - face à sua condrificação (o processo fisiológico de regressão vascular e ocupação por matriz) (Olstad et al., 2007; Ytrehus et al., 2007) vêem a sua atividade limitada desde muito cedo, pelo que cerca dos 2,5 - 4 meses de idade já existem em número diminuto, desaparecendo após os 7 meses (Carlson et al., 1995). O momento em que este processo acontece enquadra-se, temporalmente com as chamadas “janelas de vulnerabilidade” das articulações – o diferente intervalo de idades durante o qual as articulações estão suscetíveis ao aparecimento das lesões - e os respetivos pontos de não retorno, justificando-os assim (van Weeren et al., 1999c).
À luz das hipóteses patogénicas da doença, acima referidas, são também justificadas a existência de locais de predileção das lesões e, à semelhança do trajeto vascular, a simetria bilateral de algumas delas (Ytrehus et al., 2007).
O osso apresenta capacidade remodelativa durante toda a vida do animal, mas esta capacidade de remodelação da rede de colagénio tende a diminuir com a idade e os tempos de remodelação tendem a aumentar (Verzijl et al., 2000). Assim, a recuperação das lesões durante a “janela de vulnerabilidade” é possível enquanto o nível metabólico da MEC é suficiente elevado (van Weeren, 2006c).
Alguns trabalhos apontam, ainda, a discondroplasia - a anormal diferenciação dos condrócitos - como modelo patogénico da doença (Henson et al., 1997b; Shingleton et al., 1997). Os autores afirmam a presença de condrócitos de pequenas dimensões, pré-hipertróficos, adjacentes aos vasos sanguíneos dos canais de cartilagem na zona hipertrófica desta. Esta alteração fenotípica dos condrócitos é originada por isquemia, induzida por necrose dos canais vasculares (Ekman & Heinegård, 1992; Ekamn et al., 1990); como resultado, não ocorre hipertrofia dos condrócitos, mineralização da matriz, invasão vascular nem transformação em osso. Segundo os mesmos autores, este fenómeno é justificado pelos desequilíbrios hormonais a que os condrócitos são expostos, nomeadamente diminuição da tiroxina e aumento da insulina circulantes em resultado de dietas energéticas. Esta abordagem não justifica os locais de predileção das lesões nem a sua simetria bilateral. Num estudo de Kinsley e coautores, em 2015, foi concluído o fundo genético do catabolismo e da inibição da maturação dos condrócitos em animais com OC.
Outros autores atribuem o protagonismo na patogenia, em lesões iniciais, às alterações dos componentes da MEC (Lecocq et al., 2008; Hill et al., 1984, citado em Ytrehus et al., 2007; Watkins, 1992), nomeadamente à diminuição do conteúdo total de
13
colagénio (essencialmente o colagénio II) e de ligações cruzadas (Billinghurst et al., 2003; van de Lest et al., 2004). Incluem, ainda, o aumento da renovação de colagénio na cartilagem (Laverty et al., 2002) e no líquido sinovial (Laverty et al., 2000) e o aumento da atividade da colagenase tecidual (MMP-1), gelatinases (MMP-2 e MMP-9), e outras enzimas proteolíticas (Laverty et al., 2002; Semevolos & Nixon, 2007; Vidal et al., 2009). No entanto, continua por determinar se as alterações de síntese e estrutura do colagénio são responsáveis pelas falhas vasculares. A catepsina B está aumentada em lesões de OC (Gee et al., 2007). No entanto, Brama e coautores (1998) e Lecocq e coautores (2007) não verificaram estas alterações da MEC, acima referidas, em animais com OC, respetivamente ao nível das MMPs e do colagénio da matriz. Permanece, ainda, por esclarecer se estas alterações são primárias ou secundárias (Laverty et al., 2002; van Weeren, 2006c).
Trumble e coautores, em 2001, afirmaram que a interleucina-1 beta (IL-1β) e o “fator necrótico tumoral alfa” (TNF-α - “ tumor necrosis factor alpha”) poderão desempenhar um papel na patogénese da OCD. Designadamente, é argumentado que a primeira contribui para o aumento de MMP-2 (Clegg & Carter, 1999).
Outros autores apresentam a hipótese de determinados genes em QTL associados à doença, codificarem fatores metabólicos, enzimas, hormonas e recetores envolvidos na OE, com repercussões negativas na MEC e condrócitos da cartilagem de crescimento. Desjardin e coautores (2014) apoiam o acima referido e ainda correlacionam as lesões de osteocondrite dissecante com a diferenciação terminal hipertrófica ass ociada à disfunção mitocondrial.
De modo diverso, outros autores interpretam os vasos sanguíneos como uma forma de reparação das áreas lesionadas, de transporte de células osteoprogenitoras e de mineralização da cartilagem retida (Chandraraj & Briggs, 1988). Já van Weeren (2006a) encara o aumento da renovação do colagénio como um processo de reparação. Refere, ainda, a patogenia e a reparação como processos distintos, influenciados pela genética e fatores ambientais, defendendo que a razão entre eles irá ditar o resultado final.
Segundo Wittwer e coautores (2007), apenas algumas fases da OE se apresentam alteradas, uma vez que, apesar da deficiente maturação e diferenciação dos condrócitos, a proliferação ocorre de forma fisiológica. Já Jeffcott e Henson (1998) defendem que a alteração da expressão das moléculas PTHrP, IHH, TGF-β, que regulam a fase proliferativa do OE, poderá levar à existência de condrócitos pré-hipertróficos. Tal foi verificado por Semevolos (2005), que registou um aumento da expressão de PTHrP e de IHH em cartilagem com lesões. No entanto, a identificação de níveis reduzidos do “fator de transcrição primário para a IHH” (Gli1 - “Glioma-associated oncogene homolog 1”), coloca algumas incógnitas sobre esta matéria (Semevolos et al., 2002; Semevolos et al., 2005).
14 1.4. Epidemiologia
Em 1999, foi estimado existirem na Europa cerca de 20.000-25.000 poldros com possibilidade de desenvolverem algum grau de OC (Barneveld & van Weeren, 1999).
De uma forma geral, os valores de prevalência de OC(D) são elevados nas diferentes raças de cavalos, com amplo intervalo de valores, entre 13-74.3%(van Weeren, 2006c) e 5-20% (Novales, 2007). Maioritariamente, os estudos têm por base a articulação TC, devido à elevada incidência da doença nesta articulação (Orr et al., 2012).
1.4.1. Raças
Da análise de estudos diversos, verifica-se uma variação substancial dos valores de prevalência de OC(D) consoante as raças, assim como, dentro de cada uma destas, para as distintas articulações. Tal variedade de valores encontra-se refletida no Anexo A, para onde foram remetidos de modo a permitir melhor fluidez de leitura do presente trabalho.
Para além desses resultados, todos referentes a raças específicas, importa mencionar, pela dimensão e variedade de raças da amostra, um outro estudo, realizado por (Denoix & Valette, 2001, citado por Auer & Stick, 2006), envolvendo 1180 cavalos Selle français, Anglo-Árabes e Thoroughbred, que concluiu um valor de incidência de 13,3% na articulação TC. Por outro lado, valores bem mais baixos foram encontrados noutras raças. Estudos efetuados em cavalos selvagens divulgam prevalências de 2.5% na articulação TC e 0% na articulação FP (Valentino et al., 1999, citado por Auer et Stick, 2006). Em cavalos de tiro, referem-se valores de 5 % (Riley et al., 1998) e em póneis a doença é considerada rara (Voûte et al., 1997, citado por Auer & Stick, 2006; Bjornsdottir et al., 2000, citado por Olstad et al., 2015).
O contraste de valores verificado entre estas raças e as referidas na tabela, demonstra o impacto da intervenção e manipulação do homem sobre estas últimas, nomeadamente ao nível do maneio alimentar, reprodutivo e da atividade física.
1.4.2. Articulações
De um modo geral, as articulações TC, FP e MCF e MTF são as mais afetadas. As articulações escápuloumeral e interfalângicas proximal e distal são pouco afetadas e a doença nas articulações coxofemoral, radioumeral, carpo e vértebras cervicais é rara.
15
A doença na articulação FP é comum nalgumas raças, nomeadamente em cavalos Thoroughbred (Foland et al., 1992), principalmente em cavalos de desporto (Sparks et al., 2011). Num estudo, incluindo maioritariamente as raças Percheron e Clydesdale, foram concluídos valores de prevalência de 26 % (Riley et al., 1998). Quanto à Pura Raça Espanhola (PRE) estão registados valores de prevalência de 2% (Novales, 2007), 1,4% (Hernández, 2007, citado em Novales, 2007). Já van Grevenhof (2009b) indicou valores de 39% em cavalos Dutch Warmblood.
A doença na articulação TC tem marcada expressão em machos com aptidão desportiva, nomeadamente em Thoroughbred (Beard et al., 1994). Foram encontrados valores de prevalência de 26% em cavalos Standardbred e 10% em cavalos de sangue quente (Hoppe & Philipsson, 1985; Hoppe, 1984). Foram, ainda, encontrados valores de prevalência de 31% (van Grevenhof et al., 2009b) e 16% (Vos, 2008) na raça KWPN. Por sua vez, identificaram-se valores de 9,6% (Stock & Distl, 2005) e 10,4% (Christaman, 2004) em cavalos Hanoverianos. Na PRE argumentam-se valores de 17,9% (Novales, 2007) e 19,2% (Novales et al., 1999, citado em Novales, 2007). Em cavalos Puro Sangue Lusitano (PSL), foi verificada uma prevalência de 4.7 %, afetando maioritariamente os machos (Valentino et al., 1999).
São muitos os estudos relacionados com a doença nas articulações MCF e MTF e variados os valores de prevalência obtidos. Em estudos de cavalos PSL, verificou-se uma prevalência de 12% (Bernardes, 2008), e Teixeira, em 2009, concluiu uma prevalência de 47.2%, no conjunto das 4 articulações do boleto, sendo 13.9 % nos membros posteriores e 33.3% nos membros anteriores. Em cavalos jovens de raças Standardbred foramrelatados valores de 14% a 29% de incidência de OC nestas articulações (Jørgensen et al., 1997). Por sua vez, em cavalos Hanoverianos concluíram-se valores de 16,6% (Christmann, 2004), de 20,7% (Stock & Distl, 2005) e, ainda, de 35% (van Grevenhof et al., 2009b).
O membro anterior, ou seja, a articulação MCF, é indicada em vários estudos como sendo mais afetada que a articulação MTF (Bernardes, 2008; Vos, 2008; van Grevenhof et al., 2009b; Teixeira, 2009; Wittwer et al., 2007). Uma possível justificação será o equilíbrio e biomecânica do cavalo, cujo centro de gravidade se encontra mais próximo dos membros anteriores (Ytrehus et al., 2007)
1.4.3. Locais de predileção
A articulação FP tem como local de predileção a tróclea lateral do fémur (Stromberg & Rejno, 1978; Riley et al., 1998), e, em menor frequência, a tróclea medial e a porção distal da patela (van Weeren, 2006c). O côndilo medial do fémur (Pool, 1993; McIlwraith, 2002),
16
além da fossa troclear e da face articular da patela são, também, possíveis locais de predileção de lesão (Foland et al., 1992). Outros autores defendem que a lesão na patela é rara (McIlwraith & Trotter, 1996).
Quanto à articulação TC, a literatura apresenta vários estudos que indicam a crista intermédia da cóclea da tíbia como sendo o principal local de predileção (Strömberg & Rejnö, 1978; Novales, 2007). Seguem-se a porção distal da tróclea lateral do tálus (Wittwer, et al., 2006), o maléolo medial da tíbia (Riley et al., 1998; McIlwraith et al., 1991) e, por fim, a tróclea medial do tálus (McIlwraith & Anthony, 2008). O maléolo lateral da tíbia é, igualmente, um possível local de lesão (Novales, 2008a, citado por Neves, 2010).
Quanto às articulações MCF e MTF, o local de predilecção é a crista sagital distal do osso metacarpiano III (McIII) e do osso metatarsiano III (MtIII), respetivamente (Wright & Minshall, 2014 ; Wittwer et al., 2006).Tal é corroborado por Pool (1993) e McIlwraith (2002).
1.4.4. Idade
Parecem existir diferentes janelas temporais em que as diferentes articulações estão suscetíveis à doença, as já referidas “janelas de vulnerabilidade”. Neste período as lesões podem aparecer, regredir, total ou parcialmente ou alterar a sua forma de apres entação (Dik et al., 1999). A altura de deteção das lesões é influenciada pelo tipo de estudo, pela raça estudada, pela idade dos animais, pela própria articulação afetada e pelo momento da realização do exame radiográfico.
No que respeita à articulação FP, a “janela de vulnerabilidade” situa-se entre o terceiro e oitavo meses de idade. Nesta articulação, a influência ambiental é primordial, em detrimento da genética (Dik et al., 1999). A deteção radiográfica de lesões na articulação FP é possível a partir dos 3 meses de idade, ocorrendo mais frequentemente cerca dos 6 meses de idade e, em média, 90 % das lesões detetadas são temporárias (Dik et al., 1999; Christmann, 2004). Segundo Sparks e coautores (2011) as lesões podem ser detetadas a qualquer idade, tendencialmente em cavalos com idade não superior a 1 ano de idade - com média de 9,7 meses - e com tendência para lesões graves.
Na articulação TC, as lesões tendem a aparecer desde o nascimento, com possibilidade de recuperação entre o segundo e o quinto meses de idade (Dik et al., 1999). Já Carlson e coautores (1995) afirmam que a suscetibilidade para o aparecimento de lesões nesta articulação termina por volta das dez semanas de idade. A deteção radiográfica de lesões na articulação TC é possível a partir do primeiro mês de idade, sendo temporárias cerca de 75% delas (Dik et al., 1999; Christmann, 2004).
17
Nas articulações MCF e MTF, tal como acontece na articulação FP, é verificada uma preponderância do fundo ambiental em detrimento do fundo genético, pelo que as lesões podem surgir até por volta dos 8 meses de idade (Dik et al., 1999). Os animais afetados têm, geralmente, 1 ano ou mais de idade (De Moor et al., 1972).
De uma forma geral, as “janelas de vulnerabilidade” parecem situar-se entre o primeiro e o décimo primeiro mês de vida (Dik et al., 1999), ou mesmo até ao ano de idade (van Weeren, 2006a,b).
Lepeule e coautores, em 2009, referiram uma maior incidência em poldros nascidos antes de Março e depois de Maio, uma vez que os que nascem mais cedo no ano estão estabulados, privados do exercício físico e da pastagem, enquanto os que nascem mais tarde são colocados na pastagem em idade mais tenra e por maiores períodos de tempo (Christmann, 2004; Wittwer et al., 2006).
1.4.5. Género
Os estudos presentes na literatura apresentam conclusões divergentes sobre a relação doença/género. Diversos estudos revelaram uma prevalência superior em machos (Mohammed, 1990, citado em Stock et al., 2006; Philipsson et al., 1993, citado em Stock et al., 2006; Lindsell et al., 1983), relacionando-a com o efeito hormonal e com uma taxa de crescimento e um tamanho corporal superiores (Jeffcott, 1991, citado em Watkins, 1992). Por outro lado Wittwer e coautores (2007) relatam uma maior prevalência em fêmeas. Já outros autores, não verificaram diferenças na prevalência para os géneros (Novales, 2007; Hernández, 2003, citado por Novales, 2007; Vos, 2008).
1.4.6. Lateralidade das lesões
Existe alguma controvérsia em relação à lateralidade das lesões. Um estudo de Watkins (1992) apontou uma bilateralidade das lesões na ordem dos 20%-67% dos casos. Valores de 50% foram encontrados noutros trabalhos (Sandgren, 1988; Jørgensen et al., 1997). Van Grevenhof e coautores (2009b) acrescentaram que existe propensão para bilateralidade quanto à tipologia das lesões, ainda que com menor expressão.
A gravidade das lesões parece não ser influenciada pelo lado em que ocorre (Canonici et al., 1996; Brink et al., 2010).
Na articulção FP, predomina a apresentação bilateral (Riley et al., 1998; Rejnö & Strömberg, 1978).
18
Quanto à articulação TC, surge alguma controvérsia em relação à lateralidade das lesões. Os lados direito e esquerdo parecem igualmente afetados e com tendência para unilateralidade das lesões (McIlwraith et al., 1991). No entanto, alguns trabalhos afirmam a bilateralidade em 41.3% dos casos (Rejnö & Strömberg, 1978), 27.3% (McIlwraith et al., 1991), 45% (Brink et al., 2010), 50 % (Alvarado et al., 1989; Jørgensen et al., 1997) e van Weeren, em 2006, verificou mesmo mais de 50 % de lesões bilaterais. Mais, Bernardes, em 2008, verificou 66.7%.
Nas articulações MCF e MTF, é apontada bilateralidade de 20% na primeira, enquanto na segunda as lesões tendem a ser unilaterais. Bernardes, em 2008, encontrou 33.3 % de bilateralidade nos boletos e, segundo McIlwraith (1993), todos os boletos tendem a ser afetados concomitantemente.
1.5. Diagnóstico
1.5.1 Sinais clínicos
Normalmente, os sinais clínicos da doença não são evidentes (van Weeren, 2006c; Marshall, 2007). Antes, surgem associados a lesões em áreas de elevada carga articular ou associados a lesões dissecantes (McIlwraith, 2008; Carmona et al., 2009). Em animais jovens, os sinais clínicos poderão ser percetíveis aquando do desbaste ou poderão permanecer assintomáticos (van Weeren, 2006c). Animais com menos de 6 meses de idade, quando sintomáticos, apresentam efusão articular e dificuldade em manter a posição de estação (Marshall, 2007) e, em cavalos adultos, predominam sinais de efusão articular, claudicação leve, atrofia muscular e resposta positiva à analgesia e ao teste de flexão (McIlwraith, 2008; Brink et al., 2010). O diagnóstico definitivo é possível a partir da idade correspondente ao “ponto de não retorno” das respectivas articulações, momento este a partir do qual já não regridem espontaneamente.
1.5.2. Exames complementares
A imagiologia representa a fonte fulcral de diagnóstico na doença articular do cavalo. A utilidade desta ferramenta está presente, ainda, na delineação de tratamento, determinação de prognóstico e na avaliação da regressão e progressão das lesões.
19 1.5.2.1. Radiografia
A radiografia (Rx) foi o primeiro meio de diagnóstico instituído na abordagem da doença. É o exame complementar de eleição no diagnóstico da OC por variadas razões: não é invasivo, tem um custo mais reduzido que outros métodos de diagnóstico, apresenta relativa simplicidade de execução e permite acesso às principais articulações lesionadas. É o método mais indicado em lesões já estabelecidas (Jeffcott, 1997; Bourzac et al., 2009). A artrografia tem utilidade na distinção entre ratos articulares, efusão e proliferação de tecido sinovial secundário à sinovite crónica. A artrografia de contraste duplo é útil na avaliação da cápsula articular, ratos articulares, e na identificação de erosão, fissuras e fragmentação da cartilagem (McIlwraith & Trotter, 1996). Apresenta limitações na avaliação da cartilagem articular, que apenas é percetível se ocorrerem deformações extensas e 30-40% de alteração da densidade do osso subcondral (Greenfield, 1986, citado por Rasquilha, 2015). De um modo geral, apenas reflete destruição óssea, deformidade e estreitamento do espaço articular, não permitindo diferenciar corretamente o grau de união dos fragmentos ósseos (Vanderperren et al., 2009). Pode, ainda, subestimar a extensão da lesão (McIlwraith, 2008).
A correlação do exame radiográfico com sinais clínicos e dados de artroscopia e de necropsia nem sempre ocorre (McIlwraith & Trotter, 1996). Geralmente, a correlação é boa em alterações radiográficas graves (Steimbeimer et al., 1995, citado por McIlwraith & Trotter, 1996).
O exame radiográfico de articulações contralaterais e/ou correlacionadas entre si é aconselhado, face à bilateralidade e à possível presença de lesões simultâneas em diferentes tipos de articulações (van Weeren, 2006c).
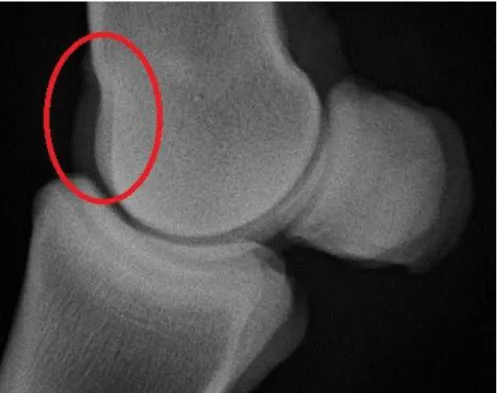
Com base no sistema espanhol de classificação (Novales et al., 2008), as lesões de OC são classificadas de grau 0 a 3, conforme os resultados do exame radiográfico: grau 0 (negativo) carateriza-se por contorno ósseo redondo; grau 1 (leve) corresponde a lesões suaves de aplanamento; grau 2 (moderado) em lesões irregulares ou edentação e grau 3 (grave) em lesões no osso subcondral e com presença de fragmentos.
20
Figura 1 - Sinais radiográficos de OC(D). A - Lesão de OC de aplanamento (grau 1) na tróclea lateral do tálus, na articulação TC; B - Lesão de OC de edentação (grau 2) na crista sagital do McIII, na articulação MCF; C - Lesão de OCD com presença de fragmentos (grau 3) na tróclea lateral do fémur e na tróclea medial do fémur, na articulação FP (radiografias de animais afetados no present e estudo).
1.5.2.2. Ultrassonografia
É usada de forma complementar ou em substituição do exame radiográfico (Bourzac et al., 2009), nomeadamente quando este não é conclusivo. A ultrassonografia (US) é um exame não invasivo, de sensibilidade superior à radiografia, que permite avaliar defeitos e espessamento da cartilagem articular e identificar lesões do osso subcondral subjacente. Permite, ainda, a deteção, quantificação e localização de fragmentos osteocondrais precoces pouco mineralizados, não detetados no exame radiográfico (Vanderperren et al., 2009; Relave et al., 2009).
Tem como limitações apenas permitir avaliar regiões mais superficiais das articulações, o que dificulta a visualização, na articulação TC, do maléolo medial da tíbia, da crista intermédia da cóclea da tíbia e da porção distal da tróclea lateral do tálus, devido à proximidade da articulação intertársica (Relave et al., 2009).
1.5.2.3. Tomografia Axial Computorizada
A tomografia axial computorizada (TAC) é um método imagiológico de visualização, em três dimensões, de estados precoces e crónicos da doença (Olstad et al., 2015). Este exame deteta diferentes padrões de densidade óssea (McIlwraith, 2005) sem sobreposição de estruturas. Possibilita, ainda, a avaliação de esclerose e lise do osso subcondral, em estados mais precoces que o conseguido através do exame radiográfico (Denoix & Audigié, 2004).
Apresenta como limitações a necessidade de indução anestésica dos animais, o custo e a acessibilidade da técnica apenas a zonas distais ao carpo e ao tarso e apenas aos dois terços anteriores do pescoço.
1.5.2.4. Ressonância Magnética
A ressonância magnética (RM) é o meio de diagnóstico de elite na avaliação da geometria articular e alterações da cartilagem. Apresenta uma resolução superior à TAC (Schramme et al., 2007), nomeadamente em alterações degenerativas numa fase precoce (Sintzoff et al., 1999) e na avaliação da densidade óssea do osso subcondral (Denoix & Audigié, 2004), bem como em estados iniciais e crónicos da doença (Olstad et al., 2015).




 [VALOR](n=6) [VALOR](n=2)](https://thumb-eu.123doks.com/thumbv2/123dok_br/15869887.1087864/58.893.108.777.724.1072/gráfico-distribuição-lesões-articulação-grau-valor-valor-valor.webp)