i
UNIVERSIDADE DA BEIRA INTERIOR
Ciências
Novas estratégias de purificação de RNAs usando
líquidos iónicos
João Carlos Claudino Martins
Dissertação para obtenção do grau de Mestre em
Biotecnologia
(2º ciclo de estudos)
Orientadora: Profª. Doutora Fani Sousa
Co-orientadora: Profª. Doutora Mara G. Freire
iii Para aqueles que sempre acreditaram, principalmente os meus pais, a minha irmã. Amo-vos!
v
Agradecimentos
Em primeiro lugar, gostaria de agradecer à Professora Doutora Fani Sousa e à Professora Doutora Mara G. Freire por possibilitarem a realização deste trabalho. Agradeço também toda a orientação, ajuda e transmissão de conhecimentos pois era impossível ter desenvolvido este projeto sem o acompanhamento que me foi dado. Um sincero agradecimento por todo o exemplo de profissionalismo que me foi demonstrado assim como toda a amizade, dedicação, querer e crer. Ao longo deste ano ensinaram-me a olhar de uma forma crítica, quer para os aspetos positivos quer para os aspetos menos positivos, e que para alcançar os nossos objetivos é necessário muito trabalho.
Obrigado à Doutora Patrícia Pereira e ao Doutor Augusto Pedro por tudo! Pelo profissionalismo, experiencia, ajuda e passagem de conhecimentos inacabáveis. É impressionante a vossa entrega e dedicação mesmo com todas as adversidades. Obrigado por toda a amizade! Obrigado por realmente vos ter conhecido e por todos os bons momentos. Desejo-vos os maiores sucessos a nível pessoal e profissional e peço desculpa se alguma vez não correspondi com a merecida amizade. Admiro-vos!
Obrigado à Doutora Márcia Neves por me ter recebido tão bem em Aveiro e por me ter ajudado com todo o trabalho e me transmitido todos os conhecimentos para o desenvolvimento do meu projeto.
Durante o desenvolvimento deste projeto muitas foram as dificuldades. É um percurso longo e duro devido a muitos obstáculos que, sem as pessoas certas, correm o risco de não ser ultrapassados. Felizmente tive a sorte de conhecer quatro pessoas fantásticas que estiveram prontamente em todos os momentos. Obrigado Milos! Obrigado Maria, Joana, Joel e Pedro por terem conseguiram tornar esta caminhada muito melhor. Vão ficar comigo para sempre!
Por toda a prontidão e disponibilidade, um enorme obrigado à Filipa Silva que me acolheu e colocou de parte a sua comodidade para que eu pudesse estar em Aveiro. Adoro-te e devia ter feito mais força para não teres saído da Covilhã. És das pessoas com quem realmente me importo!
Nunca esquecerei a ajuda que a Raquel Luzes e a sua família que me deram neste ano. Senti-me como sendo um eleSenti-mento da sua família. Estarei para sempre grato, por tudo!
Um agradecimento a todas as pessoas com quem trabalhei quer no Centro de Investigação de Ciências da Saúde quer no grupo Path por todo o acompanhamento laboratorial.
Obrigado à minha família da Covilhã, esta que foi a minha segunda casa. Á Desertuna, aos “Top”, ao curso de Biotecnologia e à Lista M da AAUBI um profundo obrigado por fazerem parte da minha vida. Vivi e aprendi convosco os melhores anos da vida de estudante. Obrigado a todos os meus amigos que me acompanharam desde sempre, este trabalho também é vosso!
vi
Agradeço à Universidade da Beira Interior e à Universidade de Aveiro pela garantia das condições essenciais para o meu percurso académico e desenvolvimento deste trabalho.
Por último, os mais importantes! Obrigado aos meus pais e irmã por todo o amor e carinho! Obrigado por lutarem por mim, pela inspiração que são e pelas oportunidades que me deram! Tenho a melhor família do mundo!
vii
Resumo
As terapia baseadas em RNA têm emergido como estratégias promissoras no tratamento de diversas doenças, como cancro, doenças autoimunes e neuro-degenerativas. Contudo, o estabelecimento de terapias com base no RNA requer a preparação de elevada quantidade de RNA mantendo a sua integridade, pureza e atividade biológica. Este é o maior objetivo do uso de metodologias de purificação de RNA. Os líquidos iónicos (LI) são um grupo de sais orgânicos de variada estrutura, com grande versatilidade para manipular o design de catião/anião e apresentam características físico-químicas particulares. Mais ainda, alguns LIs conseguem o estatuto de solventes “green” e têm sido observados como uma alternativa aos solventes orgânicos usados num vasto leque de aplicações.
O principal objetivo deste trabalho é o desenvolvimento de novas matrizes superporosas funcionalizadas com ILs para cromatografia liquida preparativa com a purificação de RNA em vista.
Diferentes LIs foram ligados covalentemente em sílica (S-Sil), usada como fase estacionária, para avaliação inicial das interações dos ILs com o RNA. Esta técnica revela ser reprodutível e mais económica para a pré-avaliação antes de usar uma coluna cromatográfica. A capacidade de diferentes tipos de S-Sils (SilPrMImCl; SilPrMImArg; SilPrPyCl; SilPrArgCl; SilPrBenzCl; SilPrNEt3Cl; SilPrN(C8)3Cl; SilPrLyCl) para reconhecer e ligar ao RNA foi avaliada em modo batch e, de seguida, foram realizados diferentes testes de modo a provar a reprodutibilidade, a robustez e a resistência à regeneração. Em geral, os S-Sils mostraram a possibilidade de promover múltiplas interações incluindo hidrofóbicas, iónicas, pontes de hidrogénio e interações dipolo-dipolo com o RNA. Em particular, S-SilPrMImCl, S-SilPrNEt3Cl e S-SilPrMet2ButCl mostram ser ligandos promissores para aplicação na purificação do RNA. Inicialmente foi realizada a funcionalização da matriz cromatográfica Sp-SilPrMImCl e, após confirmação da funcionalização, foram realizados ensaios de purificação de RNA a partir de lisados de E. coli. Neste estudo foi confirmada a completa separação entre o RNA e o DNA num único passo cromatográfico. Foi ainda avaliada a reprodutibilidade da coluna onde é visível a separação do RNA sem contaminação. O novo suporte demonstrou ainda apresentar ainda uma elevada capacidade de ligação dinâmica comprovando assim a robustez da matriz para purificar uma grande quantidade de amostra, considerando até a potencial aplicação na purificação de vários tipos de biomoléculas.
Palavras-chave
ix
Abstract
RNA-based therapies have emerged as a promising strategy in the treatment of diverse human diseases, such as cancer, autoimmune and neurodegenerative diseases. However, the establishment of RNA-based therapeutics requires large quantities of the target RNA with high integrity, purity and biological activity. This has been mostly accomplished using RNA purification methodologies that rely on using organic solvents or imply the structural modification of RNAs. Ionic liquids (ILs) are a group of organic salts of varying structure, with great versatility to manipulate the cation/anion design, and presenting particular physicochemical characteristics. Moreover, some ILs earned the statute of ‘‘green solvents’’ and have been seen as an alternative to organic solvents used in a wide range of applications. Therefore, the main aim of this work was the development of new superporous-based matrices functionalized with ILs for preparative liquid chromatography, envisaging RNA purification. First, different ILs were covalently attached on silica (Sils), used as the stationary phase, for the screening of ILs interacting with RNA. This approach revealed as a reproducible and more economical method for a pre-evaluation before using the chromatographic column. The ability of different Sils (SilPrMImCl; SilPrMImArg; SilPrPyCl; SilPrArgCl; SilPrBenzCl; SilPrNEt3Cl; SilPrN(C8)3Cl; SilPrLyCl) to selectively capture RNA was evaluated in a batch mode and then, different experiments were designed to prove the reproducibility, robustness and resistance to regeneration of the supports. In general, the obtained SILs showed the possibility to promote a multitude of interactions including hydrophobic, ionic, hydrogen bond and dipole–dipole interactions with RNA. In particular, SilPrMImCl and SilPrNEt3Cl seem to be the most promising ligands to be further explored in preparative column liquid chromatography of different biomolecules.
Initially, the Sp-SilPrMImCl chromatographic matrix functionalization was performed and, after functionalization confirmation, some RNA purification assays were performed trying to isolate RNA from E. coli lysates. In this study the complete separation between RNA and DNA was achieved in a single chromatographic step. It was also evaluated the reproducibility of the column where it is visible the separation of the RNA without contamination. The results of the dynamic binding capacity were also very interesting, as it was verified a high binding capacity for this new column. Thus, it was confirmed the robustness of the matrix and the potential application in the purification of several types of biomolecules.
Keywords
xi
Índice
Capítulo 1 - Introdução ... 1
1.1 RNA ... 1
1.1.1. RNA codificante ... 2
1.1.a. RNA não codificante ... 2
1.2. Métodos de produção e obtenção de RNA ... 4
1.2.1. Síntese química ... 4
1.2.2. Métodos enzimáticos in vitro ... 5
1.2.3. Produção recombinante ... 5
1.3. Problemas associados à utilização de RNA ... 7
1.4. Purificação de RNA ... 7
1.4.1. Cromatografia de exclusão molecular ... 8
1.4.2. Cromatografia de troca iónica ... 9
1.4.3. Cromatografia de interação hidrofóbica ... 9
1.4.4. Cromatografia de afinidade ... 10
1.5. Líquidos iónicos ... 10
1.6. Processos de separação com líquidos iónicos ... 11
1.7. Líquidos iónicos aplicados na cromatografia ... 12
1.8. Líquidos iónicos em suportes sólidos ... 13
1.8.1. Fase estacionária de líquidos iónicos com um único catião ... 14
1.8.2. Fase estacionária de líquidos iónicos com multi-catiões ... 14
1.8.3. Fase estacionária de líquidos iónicos poliméricos ... 15
1.8.4. Fase estacionária de líquidos iónicos quirais ... 15
1.8.5. Monolitos funcionalizados com líquidos iónicos ... 15
Capítulo 2 – Objetivos ... 19
Capítulo 3 – Materiais e métodos... 23
3.1. Materiais ... 23
3.2. Métodos ... 24
3.2.1. Funcionalização da sílica ... 24
3.2.2. Funcionalização da Matriz Superporosa ... 25
3.2.3. Caracterização das matrizes ... 26
3.2.4. Produção e Recuperação de RNA a partir de Escherichia coli DH5α.... 26
3.2.5. Cultura de E. coli DH5α para produção e isolamento de pcDNA3-FLAG-p53 27 3.2.6. Ensaios de ligação/eluição de RNA nos suportes S-SilPr(IL) ... 28
3.2.7. Método de regeneração dos suportes funcionalizados ... 30
3.2.8. Ensaios cromatográficos ... 31
3.2.9. Ensaios de reprodutibilidade da coluna Sp-SilPrMImCl ... 31
xii
3.2.11. Testes de capacidade de ligação dinâmica (DBC) da coluna
Sp-SilPrMImCl ... 32
Capítulo 4 - Resultados e discussão ... 35
4.1. Modificação e caracterização da sílica com LIs ... 35
4.1.1. Caracterização da Sílica ... 35
4.1.1.1. Análise Elementar ... 35
4.1.1.2. Potencial Zeta ... 38
4.1.1.3. Microscopia Eletrónica de Varrimento... 41
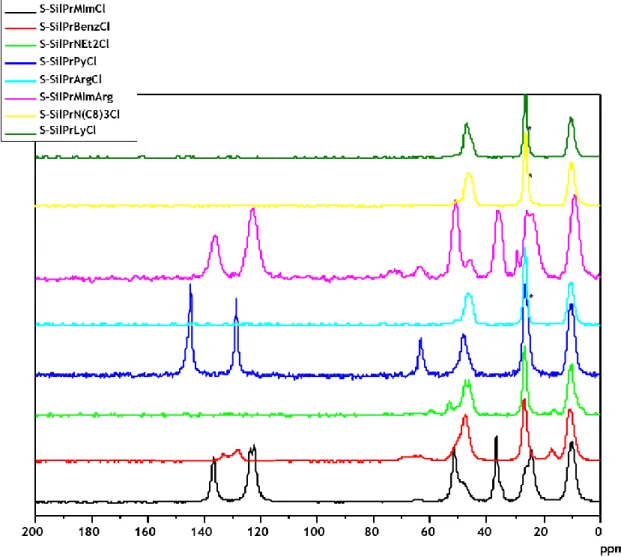
4.1.1.4. Espetroscopia por Ressonância Magnética Nuclear ... 42
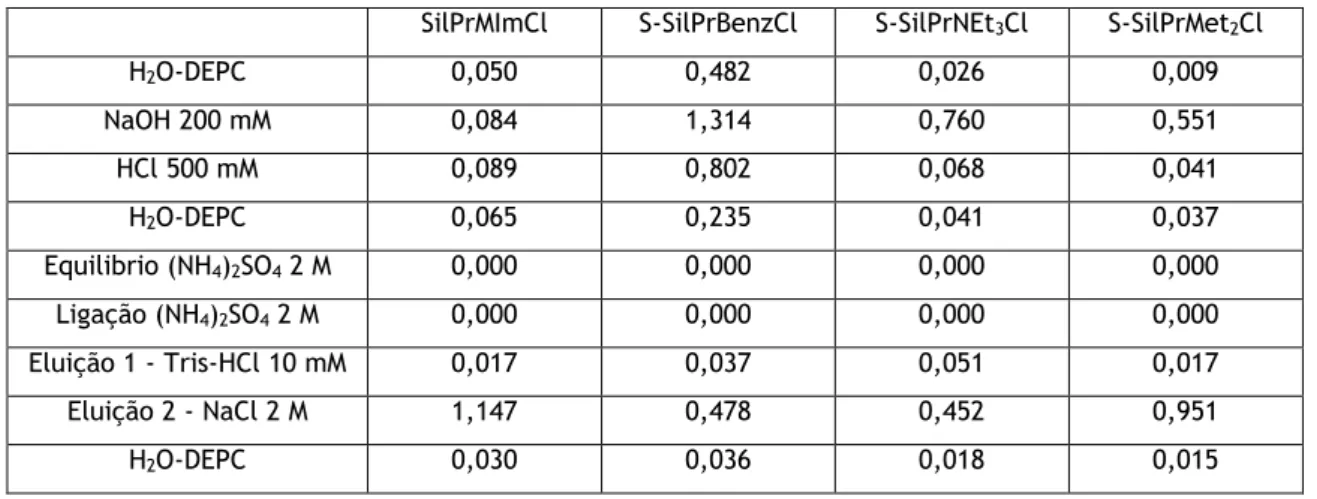
4.1.2. Ensaios de ligação/eluição de ácidos nucleicos nos suportes de sílica funcionalizada com líquidos iónicos ... 44
4.1.2.1. Condições que favorecem maioritariamente interações iónicas . 45 4.1.2.2. Condições que favorecem maioritariamente interações hidrofóbicas 46 4.2. Utilização da matriz superporosa funcionalizada com SilPrMImCl ... 48
4.2.1. Caraterização da matriz funcionalizada ... 49
4.2.1.1. Análise Elementar ... 49
4.2.1.2. Potencial Zeta ... 49
4.2.1.3. RMN ... 50
4.2.2. Estratégia de purificação ... 51
4.2.2.1. Purificação de RNA ... 51
4.2.2.2. Testes de capacidade de ligação dinâmica ... 53
Capítulo 5 – Conclusões e Perspetivas Futuras ... 57
xiii
Lista de Figuras
Figura 1. Representação esquemática dos diferentes tipos de imobilização dos LI ao suporte. ... 14 Figura 2. Esquema representativo da funcionalização dos suportes com líquidos iónicos, nomeadamente dos suportes SilPrMImCl, SilPrMImArg e SilPrArgCl ... 25 Figura 3. Esquema representativo do processo e condições usadas nos ensaios de ligação/eluição de amostras de lisado aos suportes modificados com LIs. ... 29 Figura 4. Esquema representativo do processo de regeneração dos suportes. ... 30 Figura 5. Ilustração representativa das várias etapas do projeto: A) produção de E. coli DH5α; B) extração e recuperação de RNA; C) Sínteses de matrizes funcionalizadas com líquidos iónicos; D) ensaios de interação dos suportes com os ácidos nucleicos; E) ensaio cromatográfico para separação de RNA e DNA ... 32 Figura 6. Resultado da análise de RMN 13C no estado sólido dos suportes de sílica funcionalizada com os diferentes LIs ... 43 Figura 7. Eletroforese representativa dos ensaios de interação iónica obtidos após interação do RNA com as sílicas modificadas com diferentes ILs. Ligação efetuada com uma solução de Tris-HCl 10mM a pH 8. Eluição promovida com a adição de uma solução de NaCl 2M em Tris-Tris-HCl 10mM. ... 46 Figura 8. Eletroforese representativa dos ensaios de interação hidrofóbicas obtidos após interação do RNA com as sílicas modificadas com diferentes LI. Ligação efetuada com uma solução de (NH4)2SO4 2 M em Tris-HCl 10 mM a pH 8. Primeira eluição promovida com a adição de uma solução de Tris-HCl 10 mM e segunda eluição promovida com NaCl 2 M em Tris-HCl 10 mM. ... 48 Figura 9. Gráfico representativo do potencial zeta das amostras de Superporosa e Sp-SilPrMImCl ... 50 Figura 10. Comparação entre a matriz superporosa, Sp-SilPrMImCl e Sp-SilPrMImCl regenerada após utilização ... 50 Figura 11. (A) Cromatograma representativo do estudo da interação dos ácidos nucleicos com a matriz Sp-SilPrMImCl. (B) Electroforese em gel de agarose para análise das frações recolhidas do cromatograma. Poço 1: Marcador de pesos moleculares; Poço 2: Amostra inicial; Poço 3: Fração correspondente ao pico 1; Poço 4: fração correspondente ao pico 2. ... 52 Figura 12. Cromatograma representativo dos ensaios de reprodutibilidade da coluna em condições de interação iónica. ... 52 Figura 13. Electroforeses em gel de agarose representativa dos cromatogramas obtidos nos ensaios 1, 4, 7 e 10 dos testes de reprodutibilidade e respetivas amostras iniciais e estratégias de ligação/eluição. ... 53 Figura 14. Cromatogramas representativos das curvas de capacidades de ligação dinâmica da proteína BSA, pDNA e RNA. ... 54
xv
Lista de Tabelas
Tabela 1. Caracterização geral dos ncRNA ... 3 Tabela 2. Iões utilizados na síntese de LIs e preparação das matrizes ... 23 Tabela 3. Resultado da análise elementar de cada síntese em suporte de sílica. Comparação entre os resultados teóricos esperados (AT) e os resultados reais obtidos (AR). ... 36 Tabela 4. Medição do Potencial Zeta de cada suporte de sílica funcionalizado ... 39 Tabela 5. Análise SEM da superfície das matrizes de sílica e sílica modificada com LIs. Observação com uma ampliação de 600x e 8000x. ... 41 Tabela 6. Absorvância dos sobrenadantes recolhidos dos ensaios de interação de RNA em sílica modificada com diferentes Lis após lavagem, ligação e eluição. ... 45 Tabela 7. Absorvância dos sobrenadantes recolhidos dos ensaios de interação de RNA em sílica modificada com diferentes Lis após lavagem, ligação e eluição. ... 47 Tabela 8. Resultado da análise elementar da matriz superporosa e da matriz superporosa funcionalizada com 1-metilimidazol (Sp-SilPrMImCl). Comparação entre os resultados teóricos esperados (AT) e os resultados reais obtidos (AR). ... 49 Tabela 9. Avaliação da capacidade de ligação dinâmica da matriz Sp-SilPrMImCl para a proteína da BSA, pDNA e RNA. ... 55
xvii
Lista de Acrónimos
RNA Ácido ribonucleico iRNA RNA de interferência
miRNA Micro RNA
mRNA RNA mensageiro
rRNA RNA ribossómico
tRNA RNA transferência
ncRNA RNA não codificante lncRNA RNA não codificante longo
sRNA RNA pequeno
XIST RNA RNA de inibição de transcrição especifico para o cromossoma X rasiRNA RNA de interferência pequeno de associação repetitiva
snoRNA sRNA nucleolar
snRNA sRNA nuclear
piRNA RNA associado a Piwi dsRNA RNA dupla cadeia ssRNA RNA de cadeia simples
RNase Ribonuclease
DNA Ácido desoxirribonucleico
pDNA DNA plasmídico
PCR Reação de polimerização em cadeia E. coli Escherichia coli
DO600 Densidade ótica a 600 nanometros
UV Ultra violeta
rpm Rotações por minutos
Abs Absorvância
xix
Lista de comunicações científicas
Lista de comunicações em formato de poster relacionadas com este trabalho:
1. João C. Martins, Márcia C. Neves, Patrícia Pereira, João A. Queiroz, Mara G. Freire, Fani Sousa. New strategies for RNAs purification using ionic liquids ligands. II International Congress in Health Sciences Research: Towards Innovation and Entrepreneurship - Trends in Biotechnology for Biomedical Applications. 17 a 20 de Maio de 2017, Covilhã, Portugal
Lista de comunicações orais relacionadas com este trabalho:
1. João C. Martins, Márcia C. Neves, Patrícia Pereira, Augusto Q. Pedro, João A. Queiroz, Mara G. Freire, Fani Sousa. Synthesis and characterization of Ionic-liquid-functionalized matrices for RNAs purification. XII Annual CICS-UBI Symposium. 6 e 7 de Julho de 2017, Covilhã, Portugal.
2. João C. Martins, Márcia C. Neves, Patrícia Pereira, Augusto Q. Pedro, João A. Queiroz, Mara G. Freire, Fani Sousa. Functionalization of chromatographic matrices with ionic liquids for RNA purification. Biopartitioning and Purification (BPP), 2017, Copenhagen
xxi “O primeiro passo para conseguirmos o que queremos na vida, é decidirmos o que queremos…” Ben Stein
1
Capítulo 1 - Introdução
1.1 RNA
Ao longo das últimas décadas, os investigadores têm tentado compreender todos os mecanismos associados à informação genética, nomeadamente relativos à sua manutenção, transmissão e possível utilização terapêutica. Alguns avanços alcançados no século passado forneceram informação importante sobre vários tipos de ácidos nucleicos, a sua estrutura, organização e função de armazenamento e transmissão de informação genética [1].
Inicialmente o DNA era colocado como a molécula de maior relevância de todo o processo de síntese e produção de proteínas e o RNA seria apenas um intermediário que formaria complexos enzimáticos desde o inicio até ao fim de todo o ciclo [2,3]. Esta visão de que o RNA é um mero intermediário na expressão génica tem vindo a ser alterada e tem levado os investigadores a tentar compreender outros mecanismos onde está envolvido, avaliando a sua importância em diversas funções celulares, nomeadamente relacionadas com a expressão génica, regulação da expressão, proliferação, diferenciação, entre outras [4]. O avanço do conhecimento nesta área tem assim permitido o desenvolvimento de novas vertentes na área da Biomedicina, nomeadamente através da utilização deste tipo de biomoléculas quer em diagnóstico quer em terapias inovadoras [5].
O estudo de novas vias e moléculas regulatórias da expressão de genes tem vindo a aumentar mais do que qualquer outra área, concretizando-se nono entendimento dos mecanismos de biogénese e atuação de novas moléculas como alvos terapêuticos para o tratamento de doenças que a sociedade tem enfrentado. Relativamente à tecnologia do RNA de interferência (iRNA), tem-se verificado muita investigação na área, que tem revelado que é um método efetivo e simples para promover a regulação e silenciamento de genes, pelo facto de se basear numa interação de elevada especificidade e complementaridade entre o RNAi e o RNA mensageiro alvo. Para além disso, o interesse nesta tecnologia é reforçado ainda pelo facto de a indústria farmacêutica também considerar importante o desenvolvimento de novos fármacos, especialmente no sentido de potenciar a aprovação e comercialização de produtos biológicos. Dentro da classe dos iRNA, os microRNAs (miRNA) têm vindo a ser usados como biomarcadores em várias doenças sendo assim considerado moléculas promissoras para aplicação em métodos de diagnóstico. A utilização de RNA não se prende apenas com o diagnóstico, e mesmo ao nível terapêutico têm sido diversos os exemplos descritos. Em vários estudos é sugerida a possível utilização de RNA como agente retro-viral e inibidor do HIV. Este ligar-se-ia à proteína ativadora do vírus e, por competição com pequenas estruturas de RNA como a TAR (trans-activation response region) e RRE (reverse response element), poderia evitar a trans-ativação e propagação do vírus [6].
De tal forma geral, este conhecimento levou ao avanço da investigação para a utilização desta biomolécula no combate de várias doenças, explorando diferentes possibilidades de
2
mecanismos de ação, que dependem de interações específicas, nomeadamente entre RNA-RNA, RNA-DNA e RNA-proteínas [7].
A aplicação terapêutica tem, assim, focado essencialmente a aplicação terapêutica de RNA codificante nomeadamente com o desenvolvimento de vacinas de mRNA e a tecnologia de RNA não codificante, como o iRNA com a possibilidade de promover o silenciamento de genes [8– 10].
1.1.1. RNA codificante
Os mRNA, obtidos com base na sequência do DNA, codificam e transportam a informação genética até à produção de proteínas. A nível terapêutico a prevenção da tradução de um mRNA incorreto pode corresponder à eliminação da síntese de uma proteína que está na origem de uma possível doença. A tradução desta molécula é facilitada com a metilação da extremidade 5’ uma vez que estabiliza a biomolécula e, após a transcrição, a saída do núcleo para o citoplasma é iniciada com a adição de uma cadeia de adeninas à extremidade da cadeia de mRNA [11]. Durante este processo ocorre a remoção de intrões não codificantes da sequência (maturação do mRNA) e são mantidos os exões como moléculas codificantes. O RNA ribossómico (rRNA) está presente na composição do ribossoma para síntese proteica promovendo um mecanismo de tradução de mRNA em proteínas. Está dividido em duas subunidades onde na mais pequena ocorre a descodificação e na maior a catálise das biomoléculas proteicas [12–15]. A nível terapêutico, são conhecidas muitas interações entre os complexos ribossómicos e antibióticos que interferem no mecanismo de ação das subunidades do ribossoma [11,16]. A transferência de aminoácidos para a cadeia polipeptídica que está a ser formada no ribossoma é realizada através da ação dos RNA de transferência (tRNA) e ocorre durante a tradução. Uma abordagem terapêutica com a utilização de mRNA tem sido explorada com o objetivo de estimular os linfócitos para a resposta ao cancro uma vez que estes são cruciais no reconhecimento de péptidos antigénicos e no controlo do crescimento tumoral [17]. A fim de estudar este mecanismo, com recurso a um processo in vitro, procede-se ao isolamento de células dendríticas e estas são modificadas com antigénios tumorais. Após a transfeção das células dendríticas com mRNA codificante do antigénio tumoral, estas células são injetadas nos doentes potenciando assim a resposta dos linfócitos e estimulando a resposta imune ao tumor. [18–20].
1.1.a. RNA não codificante
Os RNAs não codificantes (ncRNA), tal como a designação indica, são RNAs que não conduzem à expressão de proteínas, e são bastante diversificados e abundantes nas células. Os ncRNAs estão divididos em ncRNA longos - lncRNA- (que incluem o tRNA e o rRNA), e em ncRNA de pequeno tamanho – sRNA- (onde estão incluídos os microRNAs, RNA de interferência, RNA
3 nuclear, piwi-interacting RNA, entre outros) [21]. Cada um destes tipos de biomolécula apresenta várias características e funções específicas, como está descrito na tabela 1.
Tabela 1. Caracterização geral dos ncRNA
Tamanho Função ncRNA longos RNA
ribossomal
1.9 Kb Essencial para síntese proteica XIST RNA 17 Kb Inativação do cromossoma X Outros tipos
de RNA
> 200 nt Modificação epigenética, processo pós transcripcional, modulação da estrutura da cromatina
NcRNA de pequeno tamanho
miRNA 18-21 nt Regulação da expressão génica
siRNA 21 nt Regulação da expressão génica, defesa contra vírus rasiRNA 24-27 nt Orientação da heterocromatina na formação de
centrómeros
snoRNA 60-300 nt Metilação e pseudo-uridilação de outros RNA snRNA 100-300 nt Envolvido no complexo de spliceossoma
piRNA 26-30 nt Regulação da atividade de transposões e estado da cromatina
No mecanismo de interferência, a injeção de RNA de cadeia dupla (dsRNA) leva à destruição de mRNA alvo e alteração do fenótipo correspondente, comprovando-se assim que o RNA de interferência (RNAi) pode ser utilizado corretamente como técnica efetiva de silenciamento pós-transcricional e consequente na regulação da expressão génica, embora sejam necessárias elevadas quantidades de RNAi na célula [22]. O interesse nesta área, mais especificamente nos miRNA, surgiu após verificação da sua complementaridade com a região não transcrita da extremidade 3’ do mRNA, que promove o silenciamento da expressão de genes, através do bloqueio da tradução ou degradação do mRNA. O estudo do mecanismo de ação do miRNA tem vindo a ser aprofundado com base em estudos realizados em insetos e alguns mamíferos [23– 26]. A sua biogénese é iniciada pela transcrição de sequências génicas pela RNA polimerase II formando um primeiro intermediário, o pri-miRNA [27]. Posteriormente, ocorre a maturação do pri-miRNA, sendo reconhecido e clivado formando o pré-miRNA, que é posteriormente exportado para o citoplasma, concluindo o seu processamento para obtenção de miRNA maduro [28]. A extremidade 5’, que possui menos energia livre, é incorporada pelo RISC (complexo silenciador induzido por RNA) e é direcionado para interagir com o mRNA alvo que é complementar, e se a complementaridade for de 100%, o mRNA é degradado [29].
Um único miRNA tem a capacidade de regular diferentes mRNAs assim como o mesmo mRNA pode ser regulado por inúmeros miRNA, devido à sua sequência [22]. A formação de miRNA
4
pode também ocorrer por diferentes vias uma vez que as sequências de intrões podem ser transcritas em miRNA [30]. A principal via pela qual os mRNA são regulados pelos miRNA relaciona-se com o facto de as células usarem este mecanismo como defesa contra mRNAs exógenos, apelidado de silenciamento de genes pós-transcricionais (PTGS) [10]. Quando necessário, o PTGS cliva as cadeias duplas de RNA em cadeias menores, siRNA, que se associam ao RISC levando ao silenciamento por RNA de interferência (iRNA).
No caso dos RNAs endógenos, os miRNAs apresentam um papel fundamental uma vez que regulam processos complexos como a apoptose, diferenciação e o desenvolvimento embrionário e no caso de haver uma possível desregulação, o ser humano pode estar sujeito ao desenvolvimento de cancro, à ativação de oncogenes ou inativação de genes supressores de tumores [31]. Outros estudos revelaram também que os miRNAs têm um papel fundamental a nível muscular e cardíaco [32–34]. A nível oncológico, primeiro campo de estudo da desregulação dos miRNA, verificou-se que os locais de transcrição estão presentes nas regiões genómicas envolvidas no cancro e que este tipo de RNA está presente em menores quantidades em tecidos tumorais comparados com tecidos normais [35,36]. A nível viral, os miRNA regulam os seus próprios genes assim como os genes envolvidos na interação com as células tendo um papel importante na transição para a fase de latência do vírus [37,38]. O conhecimento destes miRNA poderão vir a permitir um correto tratamento e utilização dos vírus como sistemas de entrega de fármacos. O conhecimento dos miRNA passa por investigar através da bioinformática os seus alvos, uma vez que apenas um miRNA consegue ter vários alvos [39]. Com o avanço da tecnologia, o uso desta biomolécula como identificador de funções de genes e silenciador de genes tem ganho elevado interesse o que levou a um grande estudo e que levou ao ganho de prémios nobel devido ao seu uso com potencial terapêutico [40–43].
1.2. Métodos de produção e obtenção de RNA
Considerando a potencial aplicação dos diversos tipos de RNA, foi necessário estabelecer metodologias adequadas à sua preparação, visando alcançar rendimentos elevados, que possibilitem a comercialização e distribuição alargada, sem comprometer a qualidade e a segurança do produto. As principais metodologias disponíveis para a obtenção de RNA são a síntese química, a obtenção por métodos enzimáticos e a produção recombinante, como se apresentam de seguida.
1.2.1. Síntese química
A síntese química de oligonucleótidos requer proteção dos grupos hidroxilo 5’ e 2’ e reações sequenciais de desproteção-ligação-oxidação que permitem a modificação de cada grupo em separado para posterior adição específica de elementos na sequência. Após estas reações o RNA alvo é purificado por cromatografia. Em paralelo às reações de síntese são também
5 frequentemente incluídas algumas modificações químicas na molécula de RNA, que permitem uma melhor estabilidade da molécula ou eventualmente maior afinidade para o alvo. Compreende a substituição do oxigénio do grupo fosfato por um átomo de enxofre, levando a um melhoramento da resistência à degradação nucleofílica, e a alteração variada de grupos ribose. Embora estas alterações permitam um melhoramento farmacocinético, o alcance do efeito não desejado e as alterações estruturais e funcionais permanecem em estudo [44]. Este tipo de procedimento poderá apresentar algumas desvantagens uma vez que, para além de todos os solventes necessários, poderá comprometer a dinâmica estrutural, a estabilidade, a atividade biológica e os perfis de segurança levando a um baixo rendimento, altos custos de produção e a incerteza que ocorre como esperado [44].
1.2.2. Métodos enzimáticos in vitro
Este procedimento tem vido a ser estabelecido para produção de cadeias simples de RNA a partir da utilização de RNA polimerase. O método tem como vantagem a simplicidade e a versatilidade já que envolve a produção de RNA com recurso à transcrição in vitro, usando como molde uma sequência linear de DNA, produtos de PCR ou oligonucleótidos sintetizados especificamente. Dois dos fatores que podem tornar esta técnica menos efetiva é a pureza ou a incorreta aplicação da RNA polimerase por esta não identificar o promotor para a transcrição levando a que ocorra de forma não reprodutível [44–46]. Para além disto, após a conclusão da reação enzimática, é necessário incluir um passo de purificação para remoção dos contaminantes provenientes das reações de transcrição, assim como RNAs cuja sequência está incompleta ou errada. De modo a eliminar algumas limitações desta técnica e obter RNA de sequência correta, estável e funcional, tem vindo a ser desenvolvido um protocolo com um passo adicional onde é utilizada a Dicer que leva ao reconhecimento de RNA de dsRNA, que podem surgir com a junção de duas cadeira simples de RNA ssRNA, e posterior processamento em siRNA [44].
1.2.3. Produção recombinante
A produção recombinante, também conhecida como produção in vivo, é considerada como a opção mais rentável a nível económico e a nível de metodologias [46]. As vantagens desta metodologia estão associadas à possibilidade de eliminar contaminantes e possíveis agentes de degradação de RNA que estão presentes nas técnicas de síntese química e in vitro, fornecendo a biomolécula alvo com maior sustentabilidade e potencial [45].
Este método tem vindo a ser desenvolvido com recurso a hospedeiros procariotas transformados com plasmídeos previamente desenhados e construídos de forma a produzir o RNA de interesse, durante a etapa de crescimento do sistema hospedeiro. A nível dos promotores, e
6
contrariamente ao que acontece na técnica in vitro, podem ser escolhidos, melhorados e induzidos de modo a facilitar a transcrição do RNA [46].
Embora este método seja apresentado como o mais vantajoso, terá de ser considerada a suscetibilidade da biomolécula de interesse às RNases e as estratégias que são desenvolvidas para combater essa situação como, por exemplo, a utilização de scaffolds de RNA para transporte e proteção da molécula enquanto está presente no meio de cultura [47]. O tRNA é considerado um ótimo scaffold para a produção de largas quantidades de moléculas de RNA recombinante pois possui grande resistência a agentes desnaturantes devido à sua estrutura terciaria e ao complexo que estes formam. Neste complexo é substituído o anticodão pelo RNA de interesse e assim, mantendo a sua estrutura, as células hospedeiras (normalmente a E. coli) produzem as espécies de RNA desejadas [44,46].
Após a produção de RNA é necessário garantir os melhores métodos para que a biomolécula de interesse se mantenha com qualidade, não se degrade e mantenha as suas funções para posterior aplicação quer em análises bioquímicas, quer em aplicações terapêuticas. O primeiro passo a ter em conta será o método de lise da célula hospedeira, que deverá ser selecionado de acordo com a localização do RNA dentro da célula. Assim, consoante a localização do RNA alvo, podemos efetuar a lise com o tampão que se adeque uma vez que este passo determinará qual o procedimento seguinte para remoção dos vários contaminantes presentes no meio. Ao longo do processo de lise e recuperação do RNA deve garantir-se também a inativação das nucleases, uma vez que o RNA é facilmente degradado pelas RNases que devido à sua ubiquidade podem estar presentes em qualquer tipo de material. Assim, de modo a garantir a manutenção e o armazenamento do RNA é necessário, em alguns casos, a adição de tampões inibidores de RNase, que não alterem a estrutura do RNA.
De uma maneira geral, a remoção de contaminantes como proteínas e DNA da amostra poderá ocorrer através de vários procedimentos, nomeadamente:
- Hidrólise de proteínas com a proteinase K; - Salting-out de proteínas;
- Solubilização de proteínas em tampões de guanidinium; - Extração com mistura de fenol e clorofórmio;
- Combinação das técnicas supracitadas.
Uma ultima fase do isolamento do RNA é a concentração da amostra que pode ocorrer por precipitação com a utilização de sais e álcool, como o acetato de sódio e etanol. O armazenamento poderá ocorrer a -20 ºC durante curtos períodos de tempo ou a -80 ºC caso o tempo de armazenamento seja maior. Caso o armazenamento não ocorra da forma mais correta, poderá haver a degradação e perda de função do RNA. [48]
7
1.3. Problemas associados à utilização de RNA
As moléculas de RNA são altamente suscetíveis à degradação por parte das RNases, quer no meio de fermentação quer durante o armazenamento. Por isso será necessário o desenvolvimento de novas técnicas para evitar a degradação do RNA de interesse.
Durante a manipulação de ácidos nucleicos, muitos são os fatores que podem afetar a sua estrutura dinâmica e as ligações estáveis de pontes de hidrogénio deixando assim as moléculas exposta a condições adversas que podem levar, em casos extremos, à degradação da biomolécula. Durante o estudo das condições que afetam os ácidos nucleicos, foi verificado o comportamento em diferentes condições e apelidado de estringência. Elevadas condições de estringência serão uma vantagem para uma hibridação estável favorecendo os ácidos nucleicos com alta complementaridade, ou seja, no caso dos RNA é favorecido o aparecimento de Hairpin loops. Sob condições de baixa estringência estas hibridações estáveis não acontecem e é favorecida a decomposição do RNA[48].
As variáveis são usadas de acordo com a influência na estabilidade das ligações tendo em conta as características da molécula alvo e com o principal objetivo de manipular as hibridações através da alteração das condições de pH, força iónica, temperatura [49] e uso de formamida [50]. A concentração de catiões será favorável para neutralização da carga presente no grupo fosfato. Assim é eliminada a repulsão natural e são favorecidas as interações que levam à ligação por pontos de hidrogénio. Esta interação leva ao emparelhamento das bases e à formação de hairpins loops que, como referido anteriormente, evitam a degradação das moléculas [51,52]. Num ambiente celular, as proteínas catiónicas neutralizam as cargas negativas dos ácidos nucleicos mimetizando assim o efeito dos sais. O efeito do pH está relacionado com o ponto isoelétrico dos ácidos nucleicos. Num meio de pH básico e neutro ocorre a neutralização das cargas negativa e o comportamento é semelhante aquando da presença de catiões, como referido anteriormente, e dá-se a hibridação da molécula de RNA, enquanto num meio ácido pode existir a depuração da biomolécula e consequente degradação [49]. O efeito da temperatura está relacionado com o número de pontes de hidrogénio estabelecidas na molécula, que depende do teor de G-C. Quanto maior o conteúdo de Guanina e Citosina mais estável será a molécula e menos sensível a alteração de temperatura. A utilização de elevadas temperaturas que favorecem as condições de estringência podem comprometer a estabilidade das cadeias dos ácidos nucleicos. A utilização de formamida leva a uma diminuição do ponto de fusão e consequente diminuição da temperatura a utilizar para que ocorra as ligações de hidrogénio e a estrutura dos ácidos nucleicos não seja comprometida [50].
1.4. Purificação de RNA
A cromatografia é uma técnica de separação de biomoléculas com base na interação que se estabelece entre a amostra e as duas fases que constituem o processo, a fase móvel e a fase
8
estacionária [8,53,54]. Dependendo das caraterísticas físico-químicas das espécies que estão presentes na amostra, cada um dos componentes irá apresentar interações distintas com o suporte cromatográfico, mediante determinadas condições no processo, dando origem à separação e purificação da biomolécula de interesse [55,56]. Existem dois tipos de metodologias ao nível da separação cromatográfica: a positiva, onde a biomolécula de interesse se liga fortemente à fase estacionária, e a negativa, em que a primeira espécie a eluir é a biomolécula de interesse apresentando fraca ou nula interação com a fase estacionária. Durante o ensaio são estabelecidas diferentes etapas nomeadamente o equilíbrio das fases de acordo com as condições de ligação de modo a ajustar a fase móvel e estacionária, uma segunda etapa onde, após injeção da amostra, ocorre a lavagem/eluição das moléculas que não ligam à fase estacionária; a terceira que consiste na eluição do material ligado à fase estacionária por alteração das condições e da composição da fase móvel e, para finalizar, é efetuado um passo de regeneração/limpeza da fase estacionária de modo a que todo o material e impurezas presentes nesta fase sejam eluídas.
Nesta área, a investigação tem focado o desenvolvimento de suportes cromatográficos mais eficientes, que permitem obter melhor resolução, maior capacidade de ligação e de grande robustez, de forma a purificar os produtos de interesse, mantendo a sua estabilidade e atividade [57]. Relativamente à separação e purificação de ácidos nucleicos, apesar de apresentarem características semelhantes, tem sido possível estabelecer alguns métodos que conduzem à purificação de algumas espécies. De seguida, são apresentados os tipos de cromatografia que têm sido usados com a maior frequência na purificação de RNA.
1.4.1. Cromatografia de exclusão molecular
Este tipo de cromatografia permite separar moléculas com base no teu tamanho molecular, uma vez que as moléculas migram ao longo do suporte, através de uma rede de poros de dimensão controlada, promovendo diferenças de retenção das biomoléculas consoante o teu tamanho [55]. Aquando da aplicação da amostra na matriz, as moléculas de maiores dimensões são as primeiras a serem excluídas, enquanto as moléculas mais pequenas, devido ao facto de entrarem nos poros, efetuam um percurso maior, resultando num maior tempo de retenção, sendo as últimas a eluir. Esta técnica pode ser usada para a separação de ácidos nucleicos uma vez que o RNA, que possui um tamanho inferior, pode ser separado dos vários tipos de DNA e outros tipos de impurezas de maior tamanho [54,58]. No entanto esta é uma técnica que apresenta algumas desvantagens, nomeadamente o facto de não ser tão eficaz na separação de RNA a partir de amostras muito complexas, e também porque é uma técnica que induz a diluição da amostra.
9
1.4.2. Cromatografia de troca iónica
A cromatografia de troca iónica tem como princípio de separação a interação electroestática que se estabelece entre os grupos funcionais carregados das moléculas alvo e as cargas presentes nos ligandos da fase estacionária. Este tipo de interação é reversível uma vez que a utilização de um contra-ião na fase móvel irá competir com a molécula ligada à fase estacionária e assim, com as condições apropriadas, ocorrerá a separação de moléculas consoante a intensidade das ligações. Após injeção da amostra e difusão pela coluna, as moléculas que apresentam a mesma carga que a fase estacionária eluem imediatamente e, seguidamente, através de um aumento gradual da concentração de contra-ião na fase móvel, por ordem crescente de intensidade da interação, serão eluídas as moléculas que interagiram com a fase estacionária. Esta reversibilidade e permuta de iões é designada de troca aniónica caso a fase estacionária tenha carga positiva e a molécula e o contra-ião, que competem pela matriz funcionalizada, tenham carga negativa. Caso se verifique o contrário e a fase estacionária possua um caracter negativo é designada por cromatografia de troca catiónica. A separação de ácidos nucleicos com esta técnica acontece devido à interação dos grupos negativos das biomoléculas com as matrizes carregadas positivamente. Os primeiros compostos a eluir são aqueles que apresentam uma menor densidade de carga que, neste caso, serão os ácidos nucleicos de cadeia simples, como é o RNA, e posteriormente os ácidos nucleicos de maiores dimensões que possuem uma maior densidade de carga, e portanto estabelecem interações mais fortes [54,55]. Apesar de ser uma das técnicas mais usadas, no caso da purificação do RNA pode apresentar como limitação a impossibilidade de isolar espécies particulares, devido à similaridade estrutural e físico-química entre as moléculas de RNA.
1.4.3. Cromatografia de interação hidrofóbica
Com base na interações entre ácidos nucleicos e as cadeias espaçadoras dos suportes surgiu esta técnica que está relacionada com o efeito hidrofóbico como fator de grande importância e fundamental na estrutura e estabilidade das biomoléculas. No entanto não é só este fator que condiciona as características hidrofóbicas e é através das diferenças entre o número, o tamanho e as distribuições das diferentes regiões hidrofóbicas que se torna possível uma posterior separação dos ácidos nucleicos e purificação do RNA. Aquando da exposição a solventes polares, são formados agregados de moléculas apolares que ficam rodeados por moléculas polares do solvente. De modo a diminuir a entropia, as moléculas agregam para diminuir a sua superfície de contacto acorrendo uma organização da molécula. Quando a amostra entra no sistema de cromatografia num solvente polar irá ocorrer a interação com a fase estacionária [54,55]. Esta técnica apresenta algumas limitações uma vez que utiliza altas concentrações de sal que representam um elevado custo à escala industrial e um impacto ambiental significativo.
10
1.4.4. Cromatografia de afinidade
Neste tipo de cromatografia é utilizado um ligando específico acoplado à matriz que através de uma conjugação de múltiplas interações não covalentes, nomeadamente, interações electroestáticas, interações hidrofóbicas, forças de van der Waals e/ou pontes de hidrogénio interage de forma reversível com a biomolécula e permite purificar biomoléculas com base na sua função ou estrutura individual e de forma específica. O processo de eluição pode ocorrer através da utilização de agentes competitivos (numa estratégia específica) ou manipulando as condições da fase móvel por alteração de pH e força iónica (considerada a vertente não específica), consoante a matriz utilizada. A especificidade das interações é a maior vantagem deste tipo de cromatografia pois confere elevada seletividade e resolução evitando assim a utilização de maior número de passos no processo [54,55,58,59]. Os ligandos associados às matrizes que são utilizadas neste método têm vindo a ser desenhados e sintetizados tendo em conta as características naturais das biomoléculas de interesse e tem como princípios: I) adição de iões metálicos de transição que interagem especificamente com a base azotada das purinas de ácidos nucleicos de cadeia simples (em IMAC); II) eluição do RNA em modo negativo, após reconhecimento e ligação do DNA, com formação de cadeias triplas envolvendo a cadeia dupla de DNA e os oligonucleótidos imobilizados na matriz cromatográfica, complementares a sequências específicas de DNA previamente marcadas com homopurinas (THAC); III) Utilização de polimixina B para reconhecimento do pDNA e eluição de endotoxinas e RNA; IV) imobilização de proteínas na matriz que e promovem a ligação de DNA ou RNA; V) Imobilização de aminoácidos para promover bioreconhecimento de ácidos nucleicos, envolvendo múltiplas interações, nomeadamente electroestáticas, por pontes de hidrogénio, interações hidrofóbicas e outras polares [55].
No entanto considerando as limitações dos métodos existentes continua a investigação no sentido de melhorar a performance dos suportes, no que diz respeito à especificidade de interação, capacidade de ligação, e robustez dos suportes, aproximando cada vez mais da spropriedades das moléculas alvo, neste caso o RNA.
1.5. Líquidos iónicos
Os líquidos iónicos (LIs) são geralmente definidos como uma classe de sais orgânicos com um ponto de fusão inferior a 100 ºC, tipicamente compostos por um catião orgânico de baixa simetria e por um anião que pode ser orgânico ou inorgânico. O número de combinações possíveis entre aniões e catiões é muito elevado, o que pode ser explorado para definir determinadas características úteis nas diversas aplicações dos LIs.
Os LIs têm vindo a despertar grande interesse na comunidade científica, devido às suas particularidades, nomeadamente a reduzida pressão de vapor, enorme variedade, boa capacidade de dissolução, alta estabilidade química e térmica, absorção de micro-ondas, condutividade elétrica, elevado espectro eletroquímico, e por serem não inflamáveis [60–64]. Os LIs são descritos como apróticos ou próticos dependendo das suas características e
11 propriedades estruturais [60]. Os LIs apróticos, ou convencionais, utilizam catiões grandes e orgânicos derivados do imidazol, amónio, piridina, sulfonio, entre outros. Os Aniões que complementam a sua estrutura podem ser orgânicos ou inorgânicos [65]. Relativamente aos LIs próticos, estes surgem por transferência de protões a partir de um ácido de Bronsted para uma base de Bronsted [60,66].
Consoante a finalidade de aplicação e as características finais pretendidas dos LIs, estes podem ser desenhados, considerando a temperatura de fusão e decomposição, uma vez que os LIs apresentam pontos de fusão inferiores a 100 ºC, o que os torna bastante estáveis a nível térmico e esta característica é determinada pela capacidade de formação de pontes de hidrogénio por parte do anião, ou seja, uma diminuição da nucleofilicidade leva ao aumento da estabilidade [60,67]. Este espectro térmico permite um aumento da temperatura para a preparação de partículas coloidais em comparação com as condições usadas para outros solventes. A combinação entre os catiões e os aniões vai definir qual a polaridade do LI devido à variação das interações por pontes de hidrogénio e às densidades de cargas. Normalmente, os LIs apresentam polaridade superior a solventes moleculares, podendo ainda ser aumentada com a adição de grupos funcionais [60].Grande parte dos LIs apresentam densidade superior água em condições de pressão e temperatura ambiente (1.05-1.35 g.cm-3) [68,69] o que permite uma separação entre os dois tipos de solventes. Na indústria química são utilizados solventes orgânicos que apresentam viscosidade inferior aos LIs. O aumento da viscosidade nos LIs deve-se à formação de interações de van der Waals e pontes de hidrogénio e pode deve-ser considerado um fator limitante da difusão de reagente. Esta propriedade irá influenciar o processo químico assim como a condutividade térmica e, consequentemente, a transferência de massa e de calor [65,68]. O facto de apresentarem uma tensão superficial inferior à água e uma tensão interfacial inferior entre a água e o LI comparativamente com os sistemas ar-liquido, permite concluir que a razão de nucleação de partículas é superior com LIs [70,71]. Considerando a atividade de superfície, a principal vantagem deste parâmetro é a capacidade de formação de estruturas organizadas devido às características anfifílicas o que permite criar micelas, vesículas, cristais de líquido liotrófico, géis e microemulsões [72]. Esta capacidade permite a proteção de materiais que em outro tipo de solventes seriam solúveis.
1.6. Processos de separação com líquidos iónicos
Tendo em conta a grande relevância prática e as características vantajosas dos LIs, a utilização e descrição de novos métodos tem vindo a aumentar assim como a sua importância.
O facto de os LIs apresentarem um ponto de fusão elevado sem que a sua estabilidade e estrutura sejam comprometidas fez com que fossem ultrapassados alguns problemas durante a captura de CO2 e H2S como a perda da estrutura dos solventes utilizados, corrosão e elevados gastos de energia para a adsorção destes compostos aquando da utilização de alcanoamidas [73]. O desenvolvimento e utilização de membranas liquidas tem sido crescente e vantajoso
12
uma vez que não é necessário reposição do LI por estes não evaporarem, possuírem alta viscosidade e apresentarem alta estabilidade mesmo sob pressão para estudo de difusão, dissolução e propriedades termodinâmicas de gazes [74]. As extrações em fase sólida são um campo de investigação onde os LIs tem vindo a ser aplicados. Tendo em conta a possível seleção dos iões utilizados é possível o controlo de parâmetros como a seletividade, afinidade e capacidade consoante o composto imobilizado na matriz solida. A aplicação de LIs em cromatografia gasosa tem demonstrado os seus benefícios uma vez que, quando acoplados à fase estacionária do processo, se apresentam como uma opção fiável devido à sua estabilidade e seletividade [75]. Relativamente à sua aplicação em cromatografia líquida apresenta como vantagens a manutenção das propriedades de design dos LIs na fase estacionária e a possibilidade de manipulação tendo em conta as características pretendidas [75].
1.7. Líquidos iónicos aplicados na cromatografia
Como referido anteriormente, devido a todo um conjunto de propriedades dos LIs, e por serem considerados, na sua maioria, como “green solvents”, faz com que estes sejam uma alternativa promissora à utilização de solventes libertadores de compostos voláteis e prejudiciais de grande impacto ambiental [61].
A utilização de técnicas cromatográficas nas áreas da engenharia química para a separação e purificação de biomoléculas [76,77] para posterior aplicação terapêutica tem vido a aumentar com o avanço das inovações a nível da fase estacionária e da fase móvel [61,78]. Porém, por vezes eram utilizadas misturas de solventes que libertavam compostos voláteis e que, para além de prejudiciais para o meio ambiente e saúde pública, requeriam enormes investimentos para efetuar a sua difícil reciclagem [78,79]. Estes fatores levaram à interdição do uso de vários compostos. Devido a todo um conjunto de propriedades, os LIs são indicados como uma alternativa promissora para a substituição aos solventes nocivos [61]. Tendo em conta as características dos LIs, estes compostos têm sido estudados e aplicados na cromatografia de modo a que esta técnica desenvolva solventes e matrizes que conferem uma melhor performance para a purificação das moléculas alvo com uma maior resolução e rapidez [80,81] Com o objetivo de aumentar o espectro de compostos utilizados na cromatografia e para a resolução de algumas limitações supracitadas das técnicas cromatográficas na separação de biomoléculas, os LIs, que são designados como “design solvents” por permitirem que ocorram entre 106 e 1018 tipos diferentes de combinações [82], são introduzidos como alternativa aos vários tipos de solventes tendo em conta estudos sobre a aplicação em compostos inorgânicos e orgânicos [78,83]. A escolha dos LIs para estudo na área da cromatografia, iniciado no ano de 1999 [84], surgiu devido às várias características físico-químicas que estes apresentam. Consoante os iões utilizados, as características dos LIs são ajustadas permitindo assim uma otimização do processo para cada aplicação em específico. Como exemplo, destaca-se a aplicação de uma segunda fase imiscível obtida através de um solvente molecular, uma solução aquosa de sal ou um segundo LI, obtendo-se assim um sistema de extração de duas fases [85].
13 A otimização destes sistemas contribuiu para um aumento exponencial do potencial desta técnica através da inserção de LI para a extração de proteínas para aplicação terapêutica, anticorpos e poluentes das águas que, anteriormente necessitavam de um processos mais demorados, dispendiosos e de difícil manuseamento [61,86–88].
Nos finais dos anos 90 foi descrita a primeira utilização de LIs, para separação de moléculas orgânicas de acordo com a polaridade dos elementos, em cromatografia gasosa devido à sua pressão de vapor negligenciável a pressão ambiente [62,84]. Em 2002 foi reportado a utilização de LIs em eletroforese capilar, para separação de Sildenafil [89], e em Stacked disk CPC para a separação de aminoácidos com LIs quirais [90]. Desde então, o estudo e as diversas utilizações destes compostos em cromatografia tem vindo a despertar grande interesse [78].
A aplicação de LIs na fase móvel da cromatografia tem como principal objetivo a otimização da resolução desta técnica por melhoramento dos picos obtidos no ensaio cromatográfico e redução dos tempos de retenção da amostra. O aperfeiçoamento desta técnica tem em conta o facto de os catiões dos LI conseguirem competir pela ligação aos grupos de silanol da superfície da sílica por interações electroestáticas e consequente repulsão dos adsorventes da amostra anteriormente retidos pela matriz. Esta competição poderá também acontecer devido a interações hidrofóbicas entre os grupos alquil apolares da fase estacionária e os grupos alquil de anéis heterocíclicos e catiões quaternários dos LI. [91]
Mais recentemente têm sido desenvolvidos suportes cromatográficos de superfície modificada com catiões orgânicos combinados com aniões. Estas matrizes têm demonstrado um aumento da eficiência das matrizes na separação e purificação de compostos. As interações hidrofóbicas e electroestáticas entre a fase estacionária e a fase móvel que contém a amostra de interesse são os principais fatores que influenciam a retenção e posterior separação dos compostos. A utilização e comercialização destas matrizes com LIs apresenta como principais vantagens a estabilidade química e térmica dos compostos funcionalizados na sua superfície [91].
Outra das aplicações destes compostos em processos de separação é a imobilização de LI em membranas porosas. Para além de separarem os compostos com base no seu tamanho e massa, a seletividade é melhorada com a imobilização de LI nos poros das membranas. A estabilidade das membranas anteriormente utilizadas é baixa uma vez que perderiam a capacidade de imobilização devido à evaporação e dissolução do solvente orgânico, o que já não acontece com a utilização de LI por estes apresentarem uma baixa pressão de vapor e a imiscibilidade com água [91].
1.8. Líquidos iónicos em suportes sólidos
Nesta abordagem de utilização de LIs em cromatografia, é realizada a imobilização de LIs em suportes sólidos, para serem usados como ligandos [92,93]. Retratado na figura 1 está a funcionalização dos suportes que pode ocorrer de cinco formas distintas: I) e II) onde ocorre imobilização do ião no suporte sólido (normalmente o catião) e o contra-ião se apresenta livre, o que facilita a síntese e promove interações por trocas iónicas [92,94,95]. Em muitos casos,
14
este tipo de estrutura e interação pode provocar a remoção do contra-ião durante os ensaios cromatográficos, o que não é desejável. De modo a combater essa perda existem LIs que mantêm na sua estrutura os contra-iões ligados covalentemente (imobilização III) e IV)) [96]. A quinta possibilidade para se obterem LIs imobilizados no suporte sólido é através da imobilização do anião e do catião na matriz [97]. Devido ao elevado número de combinações que os LIs dispõem e à sua variada estrutura, são vários os tipos de fases estacionárias que poderão ser obtidos através de, principalmente, reações nucleofílicas.
1.8.1. Fase estacionária de líquidos iónicos com um único catião
Este tipo de fase estacionária apresenta, normalmente, catiões do grupo do imidazol [98–100] ligados à matriz e tem demonstrado resultados promissores na separação de alcalóides, catiões e aniões inorgânicos [101], xilose e glucose [100] e compostos polares [96]. Estes suportes, relativamente a outros, apresentam alta estabilidade e eficiência [94,102,103]. Recentemente tem sido realizada a síntese destes suportes com a adição de compostos à base de silano [104] e grafeno [105] de modo a atuarem como um espaçador entre a matriz e o ião. Este espaçador influenciará a seletividade da matriz uma vez que irá afeta a distribuição dos grupos polares.
1.8.2. Fase estacionária de líquidos iónicos com multi-catiões
A utilização de mais do que uma espécie de catiões ligados por um espaçador à matriz permitiu uma melhoria na performance dos suportes uma vez que confere à matriz um comportamento multimodal, melhorando a seletividade a estabilidade térmica [106]. Este comportamento deve-se ao facto de apresentarem vários locais de interação [107]. Pode ser obtido com a utilização de dois catiões e dois contra-iões [108] ou através da utilização de um espaçador de três braços ligado a um grupo de carga positiva [106]. Estudos realizados com estes compostos, Figura 1. Representação esquemática dos diferentes tipos de imobilização dos LI ao suporte.
15 comprovaram que a alteração do tamanho da cadeia de carbonos influencia a seletividade do suporte [109].
1.8.3. Fase estacionária de líquidos iónicos poliméricos
Este tipo de matrizes é preparada com a polimerização de LIs que garantem um aumento dos sítios de interação e que promovem um comportamento multimodal através te interações por fase reversa, troca iónica e interações hidrofílicas [110,111]. É sintetizada com base nas características estruturais e na copolimerização dos LIs. Embora a construção deste suporte necessite de uma fase prévia de polimerização dos compostos, as suas características funcionais permanecem semelhantes comparativamente aos suportes com multi-catiões [94].
1.8.4. Fase estacionária de líquidos iónicos quirais
Devido às suas características estruturais, as ciclodextrinas foram estudadas e utilizadas na preparação de suportes cromatográficos sólidos uma vez que possuem uma cavidade capaz de reter a molécula de interesse [112–114]. Ligação de ciclodextrinas a imidazol para incorporação na matriz faz com que a interação com os substratos seja maior e promova a separação de enantiómeros [115,116]. Estudos recentes afirmam que a boa separação destes suportes se deve à fácil inclusão de complexos na cadeia formada pelos compostos quirais e os analitos [117].
1.8.5. Monolitos funcionalizados com líquidos iónicos
Atendendo às características dos monolitos [118], é possível uma vantajosa utilização destes como suportes para funcionalização com LIs e utilização em eletrocromatografia capilar e cromatografia capilar líquida. Os trabalhos relacionados com suportes monolíticos funcionalizados com LIs demonstraram a interação com os compostos de interesse através de um comportamento multimodal, com separação de compostos realizada com êxito e sem alteração das características dos suportes monolíticos como a sua permeabilidade e performance [119–124].
17 “Que tempos loucos, os de estudante”
19
Capítulo 2 – Objetivos
A investigação de novos métodos para separação e purificação de biomoléculas tem tido um crescente interesse, acompanhando também a identificação e caracterização de diferentes moléculas alvo, com aplicabilidade no desenvolvimento de novos métodos terapêuticos ou de diagnóstico. O RNA é um exemplo disso, já que diferentes aplicações têm sido descritas nomeadamente, como estratégia de vacinação, ou no tratamento de cancro, doenças neurodegenerativas, entre outras.
Como referido, os LIs são também um outro campo em crescente desenvolvimento. O facto de apresentarem um conjunto de características únicas, faz destes compostos versáteis uma aposta de enorme potencial para o desenvolvimento de novos métodos de separação, com vantagens económicas e permitindo a redução do impacto ambiental.
O objetivo principal deste projeto relaciona-se com o desenvolvimento de novos métodos de purificação de RNA, usando LIs como ligandos para funcionalizar uma matriz superporosa. O projeto prevê a imobilização de diferentes LIs em suportes cromatográficos, sendo posteriormente avaliado o comportamento de ligação e eluição do RNA, de modo a estudar o tipo de interações estabelecidas entre esta biomolécula e o suporte preparado com cada LI em estudo.
De uma maneira geral, este trabalho pretende o desenvolvimento de processos de separação mais vantajosos, com potencial de aplicação na purificação de biomoléculas terapêuticas, com impacto no tratamento de diversas patologias que afetam grandemente a sociedade atual.
21 “A diferença entre o vencedor e o perdedor não é a força nem o conhecimento, mas, sim, a vontade de vencer”
23
Capítulo 3 – Materiais e métodos
3.1. Materiais
Para a funcionalização dos suportes, a sílica foi adquirida à Merck (Darmstadt, Alemanha), a matriz superporosa AF-Epoxy-650M à Tosoh (Tóquio, Japão) e a trietilamina à Sigma-Aldrich (St. Louis, Missouri, EUA). O tolueno é comercializado pela Fisher Chemical (Waltham, EUA) e o metanol pela CHEM-LAB (Zedelgem, Bélgica). Os LIs foram preparados e imobilizados na
matriz in situ através da utilização dos reagentes presentes na tabela 2.
Tabela 2. Iões utilizados na síntese de LIs e preparação das matrizes Nome do
suporte
Catião Pureza dos
reagentes
Empresa fornecedora SilPrCl (3-Cloropropil)trimetoxisilano 98% Acros Organics (Geel, Bélgica) SilPrMImCl 1-Metilimidazol 98% Lolitec (Courrendlin, Suíça)
SilPrNEt3Cl Trietilamina Grau HPLC TCI (Tóquio, Japão)
SilPrPyCl Butilpiridina 98% Lolitec (Courrendlin, Suíça)
SilPrBenzCl Benzilmetilamina 97% Aldrich (St. Louis, Missouri, EUA)
SilPrArgCl Arginina
SilPrMIm[Arg] 1-Metilimidazol 98% Lolitec (Courrendlin, Suíça)
SilPrLyCl Lisina
SilPrN(C8)3Cl Trioctilamina < 98% Fluka (Reino Unido)
SilPrMet2Cl N,N-Dimetilbutilamina 99% Aldrich (St. Louis, Missouri, EUA)
Para a cultura de células bacterianas foram usados triptona e extrato de levedura adquiridos na empresa Bioakar (Beauvais, França), glicerol de Himedia, cloreto de sódio e fosfato de dipotássio (K2HPO4) da Panreac (Barcelona, Espanha), Fosfato monopotássico (KH2PO4) da Sigma-Aldrich (St. Louis, Missouri, EUA), Canamicina da Thermo Fisher Scientific Inc. (Waltham, EUA) e LB Agar da Pronalab (Mérida, Iucatã, México).
Para a extração de RNA foram utilizados tiocianato de guanidina, álcool isóamilico e citrato de sódio da Sigma-Aldrich (St. Louis, Missouri, EUA), N-laurosylsarcosine da Fluka Analytical (Reino Unido), isopropanol da Thermo Fisher Scientific Inc. (Waltham,EUA), β-Mercaptoetanol, acetato de sódio anidro e clorofórmio da Merck (Whitehouse Station, EUA) e ácido acético glaciar adquirido da Chem-Lab (Zedelgem, Belgica).
Nos testes de cromatografia é utilizado cloreto de sódio (NaCl) que é comercializado pela Panreac (Barcelona, Espanha) e tris(hidroximetil)aminometano (Tris-HCl) pela Merck (Darmstadt, Alemanha). Todas as soluções foram preparadas com água tratada com 0,05% de di-etil pirocarbonato (DEPC; Sigma-Aldrich) e os tampões de equilíbrio, ligação e eluição são filtrados em membranas com poros de 0,20 µm e colocados no ultrassom 15 minutos antes de