Carlos José de Sousa Pereira
Quantificação e Classificação de
Fitoplâncton por Espetrofotometria
Tese de Mestrado
Ciclo de Estudo Integrados Conducentes ao Grau de Mestre em Engenharia Eletrónica Industrial e Computadores
Trabalho efetuado sob a orientação da Professora Doutora Graça Minas
As primeiras palavras de agradecimento são direcionadas aos meus pais, Francisco Pereira e Maria Adosinda, por todo o apoio educacional, psicológico e financeiro, durante todo o percurso académico, pois sem eles esta dissertação nunca se realizaria.
À minha orientadora Professora Graça Minas, bem como ao professor Luís Gonçalves, por todo o apoio prestado ao longo da realização deste trabalho.
Ao Center for Microelectromechanical Systems e ao projeto Nextsea, por me ter proporcionado todas as condições para a realização deste trabalho.
Aos meus colegas de curso que me acompanharam ao longo destes anos, em especial ao Cláudio Silva, que esteve envolvido no projeto onde se integra a dissertação, por todo o companheirismo e ajuda prestada, bem como à Denise Carvalho por toda a disponibilidade para me ajudar, esclarecer e partilhar conhecimento.
À minha restante família e ao meu grupo de amigos (Cláudio, Jeffren, Neves, Baptista, João, Squirtle, César, Tiago e Mota), por todos os momentos vividos e partilhados e por todo o apoio prestado nos momentos mais difíceis.
Finalmente, e não menos importante, à minha namorada Diana Rodrigues, por sempre acreditar na realização desta dissertação.
Este trabalho foi suportado pelo projeto “Next-Sea: Next generation monitoring of coastal ecosystems in a scenario of global change”, NORTE-01-0145-FEDER-000032, financiado pelo Fundo Europeu de Desenvolvimento Regional (FEDER) e Programa Operacional Regional do Norte (NORTE2020).
This work was supported by the project “Next-Sea: Next generation monitoring of coastal ecosystems in a scenario of global change”, NORTE-01-0145-FEDER-000032, co-funded by Fundo Europeu de Desenvolvimento Regional (FEDER), with Programa Operacional Regional do Norte (NORTE2020).
A biodiversidade aquática encontra-se constantemente ameaçada devido, sobretudo, às alterações climáticas que se têm verificado nos últimos anos. Em resposta a essa ameaça, surgiu a necessidade da implementação de um plano de gestão das zonas costeiras. Assim, com o intuito de se obter informação sobre a saúde ecológica dos ecossistemas marítimos, tais como o tipo de alterações que ocorrem e o motivo das mesmas, têm sido construídas estruturas que fornecem à comunidade científica, responsável por monitorizar este ecossistema, informação valiosa de como contrariar essas alterações. Esta dissertação visa a sensorização de uma das variáveis marítimas, especificamente, a quantificação e classificação de fitoplâncton em determinadas áreas marítimas.
O fitoplâncton, capaz de realizar fotossíntese, encontra-se na base da cadeia alimentar marítima, sendo que o estudo das suas comunidades em determinadas zonas é fundamental para a compreensão da dinâmica e da saúde ecológica, do estado nutricional, bem como, da existência de algas potencialmente prejudiciais.
Assim, com o objetivo de estudar as comunidades de fitoplâncton, desenvolveu-se um sistema de baixo custo, com baixo consumo de energia e que possibilitasse uma monitorização contínua da quantidade e das classes de fitoplâncton marítimo, através da espetrofotometria. Mais especificamente, utiliza a deteção por fluorescência, uma vez que o fitoplâncton apresenta caraterísticas óticas específicas, ou seja, absorve naturalmente luz na gama espetral visível e fluoresce na gama espetral entre 650 nm a 750 nm. Para tal, este sistema incorpora LEDs (Light Emitting Diodes) como fonte de luz e fotodíodos para a quantificação da intensidade de luz fluorescente emitida pelo fitoplâncton. Neste sistema foi demonstrado com sucesso a medição de várias amostras de três espécies de fitoplâncton. Os resultados obtidos permitiram: (1) verificar a existência de pigmentos fluorescentes nas diferentes amostras e gama espectral fluorescente; (2) confirmar que à medida que o número de células de fitoplâncton diminui, a emissão fluorescente diminui proporcionalmente; (3) verificar, através da obtenção de gráficos 3D de cada espécie com recurso a um fluorímetro comercial, a sua própria impressão ótica sendo possível, futuramente, a sua diferenciação.
The aquatic biodiversity is constantly threatened, mainly due to the climate changes that have occurred in recent years. In response to this threat, appeared a need to develop a plan coastal zone management. Thus, in order to obtain information about the ecological health of marine ecosystems, such as the type of changes that occur and their reason, have been built structures which provide the scientific community, responsible for monitoring this ecosystem, valuable information on how to counteract these changes. This thesis discusses the monitoring of one of the variables, specifically, the quantification and classification of phytoplankton in certain maritime areas.
The phytoplankton, able to do photosynthesis, is in the bottom of the food chain at sea, and the study of their communities in certain areas is crucial to understanding the dynamics and ecological health, nutritional status, as well as the existence of algae, which are potentially harmful.
So, with the objective of studying the communities of phytoplankton, was developed a microsystem of low cost, with low energy consumption and able to do continuous monitoring of the quantity and of the classes of marine phytoplankton, through the spectrophotometry. It uses the detection by fluorescence, once the phytoplankton presents specific optical features, e.g, it absorbs naturally light in visible spectral range and fluorescence in the spectral range between 650 nm to 750 nm. Thus, this microsystem is built by LEDs (light Emitting Diodes) as light source and by a photodiode to quantify the intensity of emitted fluorescent light by phytoplankton. This system demonstrated with success the measuring of various samples of three species of phytoplankton. The results obtained allowed: (1) verify the existence of fluorescent pigments in different samples and their fluorescent spectral range; (2) confirm that, with the decreases of the number of cells of phytoplankton, the fluorescent emission decreases proportionally; (3) verify, through the achievement of 3D graphics for each species using a commercial fluorometer, its own optical printing, being possible in the future, their differentiation.
Í
NDICE
Agradecimentos ... vii
Resumo ... xi
Abstract ... xiii
Lista de Figuras ... xvii
Lista de Tabelas ... xxi
Capítulo 1 Introdução ... 23
Enquadramento ... 23
Objetivos ... 24
Organização da Dissertação ... 24
Capítulo 2 Estado da Arte ... 27
Técnicas para quantificação e classificação de fitoplâncton ... 27
Equipamentos para quantificação e classificação de fitoplâncton ... 30
Capítulo 3 O fitoplâncton e as espécies de estudo ... 37
O Fitoplâncton ... 37
3.1.1 O que é o Fitoplâncton? ... 37
3.1.2 A fotossíntese ... 38
3.1.3 A importância do fitoplâncton ... 39
3.1.4 Fatores que influenciam a produtividade do fitoplâncton ... 41
3.1.5 Consequências de níveis incomuns de fitoplâncton ... 41
Pigmentos fotossintéticos do Fitoplâncton... 42
3.2.1 Classificação das microalgas “perspetiva do pigmento fotossintético” ... 42
3.2.2 Propriedades óticas dos pigmentos de fitoplâncton ... 45
3.2.3 Interpretação dos espectros de absorção e de fluorescência ... 45
3.2.4 Monitorização das caraterísticas óticas dos pigmentos de fitoplâncton ... 46
Espécies de estudo ao longo da dissertação ... 47
Capítulo 4 Métodos e materiais ... 49
Introdução ... 49
Setup para a conservação das espécies ... 50
Métodos ... 52
4.3.1 Setup fluorométrico e procedimento para a deteção de pigmentos fotossintéticos ... 52
4.3.2 Setup para a caraterização do LED ... 53
4.3.3 Setup espectrofotométrico e procedimento para a deteção de pigmentos fotossintéticos ... 55
4.3.4 Procedimento para a contagem de células de fitoplâncton ... 55
4.3.5 Setup fluorométrico e procedimento para a quantificação das espécies de fitoplâncton ... 60
4.3.6 Setup espectrofotométrico e procedimento para a quantificação das espécies de fitoplâncton ... 60
Índice
xvi Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
Deteção de pigmentos fotossintéticos ... 77
Quantificação das espécies de fitoplâncton... 84
Classificação das três espécies de fitoplâncton ... 107
Capítulo 6 Conclusões ... 113
Conclusão ... 113
Trabalho futuro ... 114
Figura 2.1. Diagrama de um citómetro de fluxo [7]. ... 28
Figura 2.2. Diferentes componentes fluorescentes gerados a partir do modelo PARAFAC [4]. ... 29
Figura 2.3. Equipamento ALFA [13]. ... 31
Figura 2.4. Equipamento Hydrolab [46]. ... 32
Figura 2.5. Arquitetura dos fluorímetros BBFL2 e 3x1M [47]. ... 33
Figura 2.6. Imagens recolhidas por satélite [48]. ... 34
Figura 2.7. Arquitetura do sistema SIMPATICO [16]. ... 34
Figura 3.1. Equação do processo fotossintético [17]. ... 38
Figura 3.2. Taxa de absorbância das diferentes moléculas de clorofila [17]. ... 39
Figura 3.3. Cadeia alimentar desde fitoplâncton até grandes predadores [17]. ... 40
Figura 4.1. Arquitetura do microssistema [23]. ... 50
Figura 4.2. Incubadora utilizada para a conservação das espécies. ... 51
Figura 4.3. Fluorímetro comercial. ... 52
Figura 4.4. Vista geral da colocação dos equipamentos. ... 54
Figura 4.5.Vista detalhada do LED acoplado ao monocromador (interior da forma circular). ... 54
Figura 4.6. Disposição dos equipamentos. ... 55
Figura 4.7. Câmara de Neubauer (vista de topo). ... 56
Figura 4.8. Superfície de contagem [10]. ... 56
Figura 4.9. Local de quantificação de baixas densidades celulares (azul) e densidades mais elevadas (vermelho) [10]. ... 57
Figura 4.10. Esquema de contagem celular [10]. (a) Círculos com preenchimento preto representam as células contadas e os círculos cinzentos representam as células não contadas; (b) seguimento de contagem de células. ... 58
Figura 4.11. Contagem automática no programa Image J. ... 59
Figura 4.12. Contagem manual no programa Image J. ... 59
Figura 4.13. Diluições da espécie Nannochloropsis gaditana. ... 60
Figura 4.14. Setup espectrofotométrico para quantificação das espécies de fitoplâncton. ... 61
Figura 4.15. Disposição do sistema de leitura... 62
Figura 4.16. Vista pormenorizada do sistema de excitação e deteção de fluorescência. ... 62
Figura 4.17. Diluições da espécie Nannochloropsis gaditana. ... 63
Figura 4.18. LED Rebel Royal Blue ... 64
Figura 4.19. Curva caraterística do LED. ... 65
Figura 4.20. Exemplo de um Fotodetetor Hamamatsu. ... 65
Lista de Figuras
xviii Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
Figura 4.26. Representação do efeito do filtro passa-baixo [43]... 72
Figura 4.27. Diagrama de blocos de um amplificador Lock-in [44]. ... 72
Figura 4.28. Set up para a escolha do melhor duty-cycle. ... 74
Figura 4.29. Circuito de comutação da fonte de excitação. ... 74
Figura 4.30. Circuito usado para o sinal de referência. ... 75
Figura 5.1. Espectro de absorção das espécies Nannochloropsis gaditana e Isochrysis galbana. ... 78
Figura 5.2. Espectro de fluorescência das espécies Nannochloropsis gaditana e Isochrysis galbana... 79
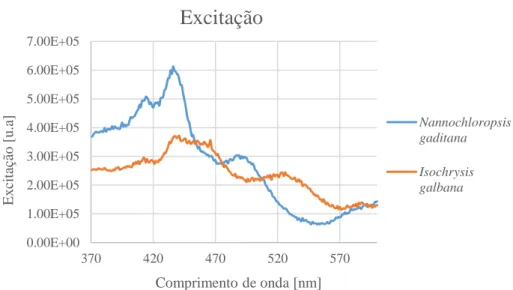
Figura 5.3. Confirmação dos picos de excitação nas espécies Nannochloropsis gaditana e Isochrysis galbana. ... 80
Figura 5.4. Espectro de fluorescência usando o LED como fonte emissora de luz da espécie Nannochloropsis gaditana. ... 80
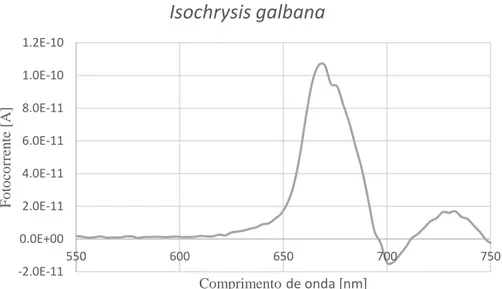
Figura 5.5. Espectro de fluorescência usando o LED como fonte emissora de luz da espécie Isochrysis galbana. ... 81
Figura 5.6. Espectro de fluorescência usando o LED como fonte emissora de luz da espécie Tetraselmis suecica. ... 81
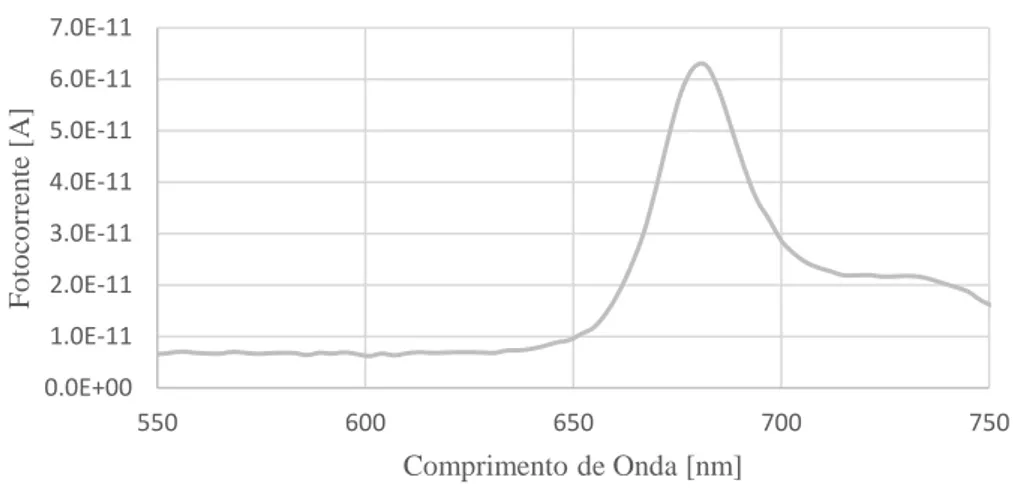
Figura 5.7. Espectro de fluorescência usando o fotodetetor Hamamatsu S5971 da espécie Nannochloropsis gaditana. ... 82
Figura 5.8. Espectro de fluorescência usando o fotodetetor Hamamatsu S5971 da espécie Isochrysis galbana. ... 82
Figura 5.9. Espectro de fluorescência usando o fotodetetor Hamamatsu S5971 da espécie Tetraselmis suecica. ... 83
Figura 5.10. Espectro de fluorescência usando o fotodetetor Hamamatsu S5973 da espécie Nannochloropsis gaditana. ... 83
Figura 5.11. Espectro de fluorescência das diferentes diluições para a espécie Nannochloropsis gaditana. ... 85
Figura 5.12. Espectro de fluorescência das diferentes diluições para a espécie Isochrysis galbana. ... 85
Figura 5.13. Espectro de fluorescência das diferentes diluições para a espécie Tetraselmis suecica. ... 86
Figura 5.14. Gráfico número de células versus intensidade de fluorescência da espécie Nannochloropsis gaditana. ... 87
Figura 5.15. Gráfico número de células versus intensidade de fluorescência da espécie Isochrysis galbana. ... 87
Figura 5.16. Gráfico número de células versus intensidade de fluorescência da espécie Tetraselmis suecica. ... 88
Figura 5.17. Sinal gerado pelo Arduino Uno com um duty-cycle de 50%. ... 89
Figura 5.18. Sinal de referência. ... 89
Figura 5.19. Sinal de referência após filtro passa banda. ... 90
Figura 5.20. Sinal à saída do multiplicador. ... 90
Figura 5.21. Tensão de saída... 91
Figura 5.22. Sinal gerado pelo Arduino Uno com um duty-cycle de 25%. ... 91
Figura 5.23. Sinal de referência. ... 92
Figura 5.24. Sinal de referência após filtro passa banda. ... 92
Figura 5.25. Sinal à saída do multiplicador. ... 93
Figura 5.26. Tensão de saída... 93
Figura 5.27. Sinal gerado pelo Arduino Uno com um duty-cycle de 75%. ... 94
Figura 5.28. Sinal de referência. ... 94
Lista de Figuras
Figura 5.30. Sinal à saída do multiplicador. ... 95
Figura 5.31. Tensão de saída... 96
Figura 5.32. Corrente de referência à saída do fotodetetor. ... 97
Figura 5.33. Tensão de saída do amplificador Lock-in para água do mar filtrada. ... 97
Figura 5.34. Gráfico número de células versus tensão de saída da espécie Nannochloropsis gaditana. ... 99
Figura 5.35. Gráfico número de células versus tensão de saída da espécie Isochrysis galbana. ... 99
Figura 5.36. Gráfico número de células versus tensão de saída da espécie Tetraselmis suecica ... 100
Figura 5.37. Espectro de fluorescência das diferentes diluições para a espécie Nannochloropsis gaditana. ... 101
Figura 5.38. Espectro de fluorescência das diluições 1/1000 e 1/10000 para a espécie Nannochloropsis gaditana. ... 102
Figura 5.39. Corrente de referência à saída do fotodetetor. ... 103
Figura 5.40. Tensão de saída do amplificador Lock-in para água do mar filtrada. ... 103
Figura 5.41. Número de células versus tensão de saída da espécie Nannochloropsis gaditana. ... 104
Figura 5.42. Corrente de saída do fotodetetor versus tensão à saída do amplificador Lock-in ... 105
Figura 5.43. Espectro de fluorescência da água do mar filtrada e do meio de cultura. ... 106
Figura 5.44. Gráfico de fluorescência 3D da espécie Nannochloropsis gaditana. ... 107
Figura 5.45. Gráfico de fluorescência 3D da espécie Isochrysis galbana... 108
Figura 5.46. Gráfico de fluorescência 3D da espécie Tetraselmis suecica. ... 108
Figura 5.47. Diferença de intensidade de fluorescência entre as espécies Nannochloropsis gaditana e Isochrysis galbana. ... 109
Figura 5.48. Diferença de intensidade de fluorescência entre as espécies Nannochloropsis gaditana e Tetraselmis suecica. ... 110
Figura 5.49. Diferença de intensidade de fluorescência entre as espécies Isochrysis galbana e Tetraselmis suecica. ... 110
Figura 6.1. Protótipo do sistema de medição de fitoplâncton. ... 115
Tabela 3.1. Classificação das classes de microalgas fotossintéticas encontradas no fitoplâncton [35] ... 44
Tabela 3.2 Divisão de grupos e classes [35]. ... 47
Tabela 4.1. Caraterísticas dos fotodetetores escolhidos. ... 69
Tabela 5.1. Pico de fluorescência e número de células para as diferentes diluições. ... 86
Tabela 5.2. Tensão de saída para diferentes valores de duty-cycle. ... 96
Tabela 5.3. Relação tensão de saída/número de células por ml da espécie Nannochloropsis gaditana. ... 98
Tabela 5.4. Relação tensão de saída/número de células por ml da espécie Isochrysis galbana. ... 98
Tabela 5.5. Relação tensão de saída/número de células por ml da espécie Tetraselmis suecica. ... 98
Tabela 5.6. Valores do pico de intensidade de fluorescência. ... 102
Tabela 5.7. Relação tensão de saída/número de células por ml da espécie Nannochloropsis gaditana. ... 104
Neste capítulo é contextualizado o âmbito desta dissertação, evidenciando a importância, a atualidade e a motivação do trabalho. Apresenta-se também a definição dos objetivos a alcançar, e por último, descreve-se a organização da dissertação.
Enquadramento
Atualmente, a biodiversidade aquática e os processos físicos e biológicos do oceano assumem-se, pela comunidade científica, como caraterísticas preponderantes para serem estudadas. Ao longo dos últimos anos e com o objetivo de se saber mais sobre a saúde ecológica dos ecossistemas marítimos, têm sido construídas estruturas costeiras, as quais permitem recolher e reter informação de forma contínua, e.g. a monitorização, de determinadas zonas da costa marítima [1].
O projeto Nextsea é um deles. Tem como objetivo a monitorização subaquática de vários parâmetros marítimos, estando dividido em quatro áreas distintas: Energy Harvesting; sistemas de sensorização de variáveis marítimas; data logger; e comunicações subaquáticas. Esta dissertação, integrada neste projeto, enquadra-se na área dos sistemas de sensorização de variáveis marítimas, especificamente na quantificação e classificação de fitoplâncton por espectrofotometria.
O fitoplâncton são microrganismos que realizam fotossíntese, através de processos físico-químicos, produzindo oxigénio a partir de dióxido de carbono [2]. Estes microrganismos encontram-se na base da cadeia alimentar marítima, alimentando desde o zooplâncton microscópio a baleias de grandes toneladas [3]. Afetam também os ciclos globais de carbono e os processos ecológicos marinhos [4]. Certas espécies de fitoplâncton produzem biotoxinas tóxicas responsáveis pelas chamadas “marés vermelhas” ou pela proliferação de algas nocivas, capazes de matar a vida marítima e as pessoas que dela se
Capítulo 1
24 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
dinâmica e a saúde ecológica, o estado nutricional e as algas potencialmente prejudiciais em sistemas aquáticos [2].
Assim, a construção de um microssistema de baixo custo, baixo consumo energético, autossuficiente e capaz de detetar, quantificar e classificar os diferentes grupos de fitoplâncton, culminando num equipamento para monitorização subaquática (4 a 6 metros de profundidade), é o grande desafio desta dissertação.
Objetivos
Esta dissertação visa a conceção e desenvolvimento de um microssistema para quantificação e classificação de fitoplâncton por espectrofotometria, mais especificamente por fluorescência. Este microssistema deve cumprir caraterísticas como baixo custo, baixo consumo energético, autossuficiente, capaz de realizar leituras viáveis e monitorização subaquática. Para a sua implementação é necessário implementar uma fonte emissora de luz, utilizando LEDs ou díodos laser, na gama espetral de 350 nm a 650 nm de forma a excitar os pigmentos fluorescentes constituintes do fitoplâncton e, de seguida, detetar-se a sua fluorescência, utilizando fotodetetores, mais especificamente, fotodíodos de silício com elevada eficiência quântica na gama espetral de 650 nm a 750 nm. O posicionamento da fonte emissora de luz e dos fotodetetores deve ser de tal forma, que reduza a quantidade de luz de excitação que pode atingir o fotodetetor de forma a não afetar a medição. Para tal, será necessário a utilização de filtros óticos passa-banda posicionados sobre os fotodíodos. Este sistema de deteção deverá estar inserido numa caixa estanque e opaca.
Organização da Dissertação
No presente capítulo, capítulo 1, faz-se uma pequena introdução onde o trabalho é contextualizado, são especificados os objetivos e é descrita a estrutura da dissertação.
No capítulo 2 descrevem-se as diferentes técnicas e equipamentos já existentes para deteção, quantificação e classificação de fitoplâncton, de forma a perceber qual a melhor arquitetura para a sua deteção.
No capítulo 3 explica-se o que é o fitoplâncton, a sua constituição e a sua classificação. Além destes conceitos, serão enumeradas as espécies de estudo ao longo da dissertação, bem como da sua importância nos sistemas aquáticos.
Capítulo 1
No capítulo 4 descreve-se os setup e procedimentos para os testes realizados ao longo da dissertação, bem como, os equipamentos escolhidos para integrar o microssistema espectrofotométrico.
No capítulo 5 apresentam-se os resultados e conclusões obtidos nos diferentes testes, descritos no capítulo anterior.
O documento termina com o capítulo 6, no qual são apresentadas as principais conclusões do trabalho realizado, assim como algumas sugestões para trabalho futuro.
Com o objetivo de conhecer, perceber e entender as modificações que ameaçam a biodiversidade marítima surgiu a necessidade da monitorização da flora nos mares e nos oceanos. O fitoplâncton é encontrado até duzentos metros de profundidade, pois necessita de luz para realizar a fotossíntese [5]. A quantificação de fitoplâncton permite a obtenção de informação sobre o estado ecológico e nutricional da região em estudo. Por exemplo, a escassez de fitoplâncton em determinada região é um sinal preocupante, uma vez que 98% do oxigénio presente na atmosfera é da responsabilidade das microalgas presentes no fitoplâncton, libertando mais do que aquele que consomem, devido à sua eficiência no processo fotossintético. Por outro lado, o excesso de algas pode causar a morte de peixes, por falta de oxigénio ou por intoxicação, e de animais que deles se alimentam, constituindo um perigo para o ser humano uma vez que as toxinas produzidas pelas algas são letais [6]. Através das caraterísticas óticas que o fitoplâncton apresenta, tais como, a absorção de luz na gama espectral visível e a fluorescência na gama espectral de 650 nm a 750 nm, é possível a sua deteção, quantificação e classificação. Surgiram, assim, técnicas e equipamentos comercialmente disponíveis para esta deteção, quantificação e classificação [4]. De seguida, serão apresentadas algumas dessas técnicas e equipamentos já desenvolvidos no estudo das comunidades de fitoplâncton.
Técnicas para quantificação e classificação de fitoplâncton
A espectroscopia de fluorescência, fluorescense spectroscopy, é uma técnica analítica, rápida, simples e sensível utilizada para a deteção de grupos taxonómicos de fitoplâncton [4]. Esta técnica baseia-se nas propriedades óticas do fitoplâncton, utilizando uma fonte emissora de luz que excita a amostra de fitoplâncton e um fotodetetor responsável por ler a intensidade de fluorescência emitida pela amostra. Para tal, utilizam-se cinco comprimentos de onda de excitação, centrados a 450 nm, 525 nm, 570 nm, 590 nm
Capítulo 2
28 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
A citometria de fluxo é outra das técnicas utilizadas no estudo da oceanografia que permite não só a medição de intensidade de fluorescência relativa, mas também do tamanho relativo de uma partícula, da granularidade relativa ou da complexidade interna. É uma técnica que, simultaneamente, mede e analisa múltiplas características físicas de partículas únicas, geralmente células, à medida que elas fluem num canal fluídico. Estas características são determinadas através de um acoplamento ótico-eletrónico, que regista a forma como a partícula dispersa a luz incidente e como emite a fluorescência [7]. A figura 2.1 ilustra um exemplo de um diagrama de um citómetro de fluxo.
Um citómetro de fluxo é constituído por três sistemas principais: sistema de fluidos, sistema que transporta as partículas através de um fluxo para o feixe de laser; sistema ótico, constituído por lasers para iluminar as partículas contidas no fluxo de amostra e por filtros óticos que têm como função direcionar a resposta de fluorescência das partículas para os detetores apropriados; e por último o sistema eletrónico, responsável pela conversão dos sinais luminosos em sinais elétricos que serão posteriormente processados por um computador [8]. A citometria de fluxo apresenta-se coma uma técnica rápida, conseguindo analisar milhares de células individuais por segundo, precisa, de elevada sensibilidade e com uma capacidade de classificação, pois consegue isolar fisicamente as células com base na combinação das caraterísticas óticas medidas, possibilitando a obtenção de amostras puras compreendidas por células específicas para posterior análise. Porém, apresenta uma resolução limitada, uma vez que a citometria de fluxo normalmente mede apenas sinais de pico de fluorescência, pelo que a amostra raramente é classificada em espécie. A maioria dos citómetros de fluxo analisa amostras de volumes muito pequenos, em que algumas
Capítulo 2
células não são devidamente analisadas e outras não conseguem ser detetadas devido à presença de um grande número de partículas interferentes, sendo isto uma desvantagem [9]. A fluorescência, excitation-emission matrix (EEM) juntamente com o parallel factor analysis (PARAFAC) e com o nonnegative least squares (NNLS), é um método utilizado para a diferenciação de grupos taxonómicos de fitoplâncton [4]. O EEM fornece uma “impressão digital”, que consiste em parcelas tridimensionais de emissão e de excitação. Utilizando a espetroscopia de fluorescência EEM, através da alteração do comprimento de onda de excitação e do comprimento de onda de emissão simultaneamente, é possível distinguir diferentes grupos taxonómicos de fitoplâncton, uma vez que estes possuem variações nas suas composições e, consequentemente, nas suas propriedades óticas. Assim, a resposta do sinal de fluorescência pode ser utilizada para a diferenciação de grupos de fitoplâncton. Como os diversos pigmentos constituintes do fitoplâncton apresentam sinais de fluorescência muito semelhantes e com espectros sobrepostos, é necessário um método de resolução para os diferenciar. O PARAFAC permite individualizar os diferentes componentes constituintes do fitoplâncton. A fluorescência EEM utilizada em conjunto com o método de resolução PARAFAC pode ser utilizada para a obtenção de informação qualitativa e quantitativa sobre os pigmentos presentes na amostra [4]. Na figura 2.2 verificam-se diferentes componentes gerados a partir do modelo PARAFAC.
Figura 2.2. Diferentes componentes fluorescentes gerados a partir do modelo PARAFAC [4].
Capítulo 2
30 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
o modelo NNLS é uma ferramenta poderosa para analisar rapidamente um grande número de amostras in situ.
Apesar dos métodos de laboratório serem relativamente demorados, a informação recolhida fornece dados quantitativos extremamente valiosos. Os métodos quantitativos mais comuns incluem a contagem de células, que pode ser feita visualmente utilizando uma Câmara de Neubauer contendo a amostra e posteriormente colocada no microscópio, onde a contagem é feita manualmente pelo observador [10], ou através de um citómetro de fluxo [11]. Outro método de quantificação do fitoplâncton é a análise da concentração de pigmentos fotossintéticos, em que o pigmento fotossintético específico é extraído da célula de fitoplâncton e as suas concentrações são determinadas com base nas suas propriedades óticas [11]. Um problema associado à medição em laboratório é que, a concentração de fitoplâncton presente na amostra pode não ser a mesma aquando da análise, ou seja, desde que é feita a recolha da amostra até à sua análise, a concentração de fitoplâncton nela contida pode variar, através da morte ou crescimento deste, não fornecendo dados exatos da região de estudo.
Equipamentos para quantificação e classificação de
fitoplâncton
Nos últimos anos e para além das técnicas e métodos utilizados na deteção e diferenciação de fitoplâncton, têm sido desenvolvidos equipamentos baseados nas propriedades óticas do fitoplâncton, utilizando as mesmas técnicas, ou semelhantes, que foram descritas anteriormente. De seguida, são apresentados alguns desses mesmos equipamentos capazes de detetar, quantificar e classificar o fitoplâncton.
O equipamento ALFA (figura 2.3) fornece medições espectrais e temporais de variáveis bio ambientais em águas oceânicas e costeiras [12]. O seu modo de operação permite medições em oceanos como, por exemplo, a bordo de navios, fazendo a análise de amostras de água utilizando para tal uma bomba de tamanho reduzido instalada no painel frontal da caixa do instrumento. Estas análises permitem avaliações precisas da biomassa de pigmentos, da estrutura e da fisiologia da comunidade de fitoplâncton. Das suas caraterísticas de análise destacam-se: a diferenciação espectral de bandas de fluorescência sobrepostas; a avaliação da concentração de clorofila, pigmento que permite estimar a biomassa do fitoplâncton; a descrição de cinco pigmentos de phycobiliprotein para caraterização estrutural do fitoplâncton; e a análise de dados em tempo real com coordenadas GPS e horas [13]. A caraterização estrutural do fitoplâncton é efetuada através
Capítulo 2
da medição espectral com duas larguras de banda diferentes. A primeira largura de banda está compreendida entre 400 nm e 800 nm, utilizando uma fonte de excitação centrada nos 405 nm. A segunda está compreendida entre 500 nm e 800 nm e utiliza uma fonte de excitação centrada em 514 nm [12]. A análise da diferenciação espectral é utilizada para avaliar as bandas espectrais de pigmentos de fluorescência aquática que se encontram sobrepostas [12]. Este tipo de equipamento fornece um meio para estudos de campo e pesquisas ambientais, de forma a melhorar a compreensão e o avanço na capacidade de monitorização do estado de saúde dos ecossistemas aquáticos.
Um outro equipamento utilizado para medições in vivo da biomassa de fitoplâncton é a sonda multiparâmetros Hydrolab, a qual utiliza sensores de fluorescência submersíveis (figura 2.4). Esta sonda inclui sensores projetados para medir a clorofila-a, o phycocyanin e os pigmentos de phycoerythrin [2]. Estes sensores podem ser implementados para o uso em amostras pontuais, perfis verticais, perfis horizontais e aplicações contínuas de implantação a longo prazo, dependendo do objetivo do utilizador. Tem como vantagem a capacidade de fornecer resultados instantâneos em relação às modificações relativas da biomassa do fitoplâncton, sendo relevante para a compreensão das alterações que ameaçam a biodiversidade aquática. Através da recolha de amostras e de testes em ambiente laboratorial é possível obter-se informação do valor quantitativo real da amostra, bem como, uma relação entre a resposta de fluorescência e o seu valor quantitativo [2].
Capítulo 2
32 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
O equipamento Hydrolab é um microssistema com algumas semelhanças ao que se pretende desenvolver neste trabalho de dissertação, uma vez que a medição é instantânea, a sua sonda possui uma fonte de excitação e um recetor para leitura da resposta de fluorescência, ambos submersíveis. Porém, a necessidade de deslocamento ao local de estudo e de um conhecimento prévio do funcionamento do equipamento por parte do operador são alguns dos inconvenientes.
O BBFL2 e o 3X1M são dois tipos de fluorímetros, da classe ECO Triplet, baseados em múltiplos pares de excitação-emissão, que permitem medição in situ. Cada sensor é constituído por três díodos emissores de luz (LED), responsáveis pela excitação da amostra, e por fotodetetores que medem o sinal de fluorescência dos pigmentos contidos na amostra [14]. Na figura 2.5 pode visualizar-se a arquitetura destes dois fluorímetros.
Capítulo 2
Esta arquitetura é muito semelhante à que se pretende desenvolver em que, este sistema ótico é constituído por uma fonte de luz, colocada com um ângulo de 55º, e a luz resultante da fluorescência dos pigmentos presentes na amostra é recebida com um ângulo de 140º. De modo a rejeitar a luz de excitação dispersa é colocado um filtro na face do fotodetetor. O fluorímetro BBFL2 possui três pares de emissão-excitação utilizados para medir: (1) a fluorescência da matéria orgânica dissolvida (Colored Dissolved Organic Matter), que tem uma excitação a 370 nm e uma resposta de emissão a 460 nm; (2) e a fluorescência da phycoerythrin, pigmento encontrado em algumas cianobactérias o qual tem uma excitação a 540 nm e uma emissão a 570 nm. Por outro lado, o fluorímetro 3X1M é constituído por três LEDs de excitação centrados a 435 nm, 470 nm e 532 nm e permite a medição da intensidade de fluorescência da clorofila-a, a qual apresenta uma resposta de emissão centrada a 685 nm. [14]. Foi concedido para quantificar a concentração e a composição dos pigmentos presentes nas algas.
Outro tipo de monitorização é a sensorização remota, realizada com recurso a naves ou a satélites. Este tipo de sensorização apresenta como grande vantagem o facto de abranger uma maior área de análise. Na figura 2.6 visualiza-se uma imagem que representa a distribuição de clorofila-a obtida por satélite.
Capítulo 2
34 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
Um sistema para monitorização contínua é o sistema SIMPATICO (figura 2.7). Consiste num sistema automático para medição de caudais e propriedades da água, através de uma boia, ancorada ao fundo do mar, e equipada com uma sonda multiparâmetros e um correntómetro, que comunicam com um computador central. Tem como principais vantagens a aquisição de dados de diversos parâmetros e o facto da alimentação de todo o sistema ser através de painéis solares [15]. Contudo, é uma tecnologia bastante dispendiosa, devido ao equipamento necessário para aquisição e tratamento de dados [16].
Figura 2.7. Arquitetura do sistema SIMPATICO [16]. Figura 2.6. Imagens recolhidas por satélite [48].
Capítulo 2
De todos os sistemas abordados não existe nenhum para a quantificação e classificação de fitoplâncton, que seja de baixo custo, portátil, e que esteja preparado para monitorização contínua subaquática (até 6 metros) durante 3 a 6 meses. É este o objetivo principal do trabalho a ser desenvolvido no âmbito desta dissertação. Pretende-se que o sistema a desenvolver aproveite as caraterísticas óticas específicas do fitoplâncton utilizando a espectrofotometria como técnica de deteção. Mais ainda, o fitoplâncton é constituído por diferentes pigmentos e cada pigmento tem caraterísticas de absorbância e fluorescência próprias. É assim possível quantificar e classificar os diferentes grupos de fitoplâncton existentes nos sistemas aquáticos [4]. Esta quantificação requer a utilização de uma fonte emissora de luz na gama espectral de 350 nm a 650 nm para excitar o fitoplâncton e, de seguida, detetar-se a sua fluorescência na gama espectral de 650 nm a 750 nm [4]. Para classificar e diferenciar os diferentes pigmentos constituintes do fitoplâncton é necessário conhecer previamente as suas respostas de fluorescência, de modo a que seja possível comparar as respostas obtidas com as caraterísticas já conhecidas na bibliografia. Deste modo, nesta dissertação, o fitoplâncton será dividido em três espécies, em que cada espécie poderá ser detetada, quantificada e classificada devido à presença de pigmentos únicos com comprimentos de onda de excitação e comprimentos de emissão caraterísticos.
O capítulo anterior permitiu conhecer e compreender as técnicas e equipamentos utilizados para a deteção, quantificação e classificação de fitoplâncton. Neste capítulo, por sua vez, explicar-se-ão alguns conceitos teóricos, nomeadamente, o que é o fitoplâncton, que impacto têm no ecossistema marítimo e terrestre e a importância da sua medição, o que é a fotossíntese e qual o pigmento fotossintético encontrado no fitoplâncton. Será também abordado o método de classificação do fitoplâncton, a importância dos seus pigmentos, quais as espécies escolhidas para este trabalho de dissertação.
O Fitoplâncton
3.1.1 O que é o Fitoplâncton?
O fitoplâncton são microrganismos, que podem ser bactérias, seres protistas mas a maioria são seres unicelulares, que andam à deriva pela água, podendo ser encontrados em água doce ou água salgada [17]. Os tipos mais comuns são: cyanobacterias, sílica-encased diatoms, dinoflagellates, green algae, e chalk-coated coccolithophores [18]. São seres unicelulares, mas podem crescer em colónias suficientemente grandes para serem vistas pelo olho humano, que realizam fotossíntese, ou seja, têm a capacidade de usar a luz solar para converter dióxido de carbono em energia e oxigénio [19]. Como precisam de luz solar para realizar fotossíntese, o fitoplâncton encontrar-se-á até duzentos metros de profundidade [5]. O seu crescimento pode depender da disponibilidade de dióxido de carbono, luz solar e de nutrientes presentes na água [18]. A temperatura da água, a salinidade, a turbidez e o vento são outros fatores que podem influenciar a taxa de crescimento das comunidades de fitoplâncton [18].
Capítulo 3
38 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
3.1.2 A fotossíntese
O processo pelo qual os organismos usam a luz solar para produzir energia é designado por fotossíntese [20]. Isto é, estes organismos necessitam de dióxido de carbono, água, nutrientes e luz solar e utilizam estes quatro ingredientes para produzirem energia sobre a forma de: (1) açúcar, o qual é por eles usado nos processos metabólicos do organismo; (2) e oxigénio, considerado um subproduto da fotossíntese, o qual é fundamental para todas as vidas subaquáticas e terrestres [17]. A figura 3.1 traduz a equação do processo fotossintético.
3.1.2.1 Clorofila
A clorofila é um pigmento esverdeado, encontrada em plantas, algas e fitoplâncton, responsável pelo processo fotossintético, ou seja, esta molécula é considerada como um fotorreceptor, uma vez que absorve luz, mais especificamente, a energia da luz solar [21]. A clorofila divide-se em seis tipos de clorofila diferentes: a, b, clorofila-c, clorofila-d, clorofila-e e clorofila-f. Cada um destes apresenta comprimentos de onda de excitação e de fluorescência ligeiramente diferentes (figura 3.2). A clorofila-a é a principal molécula responsável pela fotossíntese, sendo encontrada em todos os organismos fotossintéticos, absorvendo luz solar na gama espectral de 430 nm a 445 nm e apresenta o seu pico de fluorescência centrado a 685 nm [22]. Apresenta uma maior abundância em relação aos outros tipos de clorofila, por exemplo, a proporção de a para clorofila-b é de 3:1, motivo pelo qual ela tem sido utilizada como marcador de clorofila-biomassa de fitoplâncton [23].
Capítulo 3
3.1.2.2 Fatores que afetam a fotossíntese
Apesar da luz solar ser um dos ingredientes deste processo químico, nem toda a luz incidente pode ser usada para fotossíntese [17]. Apenas a gama espectral visível (de 400 nm a 750 nm, que corresponde às cores entre o azul a o vermelho) é considerada radiação fotossintética ativa. A luz ultravioleta possui demasiada energia para a fotossíntese, danificando o ADN (ácido desoxirribonucleico) do fitoplâncton, e a luz infravermelha não tem energia suficiente [24]. A clorofila faz com que as plantas e algas possuam uma cor verde devido à capacidade de absorverem a luz visível na gama espectral azul e vermelha. Devido a essa absorção ótica, a luz refletida e transmitida reside nos comprimentos de onda do verde, daí essa coloração [17]. A turbidez, definida como a presença de partículas suspensas na água [25], é um outro fator que influencia a fotossíntese. Quanto maior a quantidade de partículas suspensas na água, menor a intensidade de luz que atravessa a água e, por consequente, a produção fotossintética será menor. Como a fotossíntese é uma reação química, esta necessita de calor para ser iniciada e acelerada [26]. Portanto, a temperatura da água é um outro fator importante em todo o processo fotossintético. Todos os organismos têm uma temperatura ideal para a qual o processo é otimizado e quando essa temperatura é excedida a taxa de fotossíntese diminuirá [26].
3.1.3 A importância do fitoplâncton
Figura 3.2. Taxa de absorbância das diferentes moléculas de clorofila [17].
Capítulo 3
40 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
planeta [27]. Estes microrganismos são considerados seres autotróficos, ou também chamados de produtores primários, porque todos os outros organismos presentes nos ecossistemas marítimos dependem indireta ou diretamente deles como fonte de alimento, encontrando-se assim na base da cadeia alimentar [18]. O fitoplâncton é, geralmente, consumido por zooplâncton e por outros pequenos organismos. Por sua vez, estes pequenos organismos são consumidos por organismos marinhos maiores, como por exemplo o peixe. Esta cadeia alimentar continua até grandes predadores, tais como, ursos polares, tubarões e o ser humano [15]. Na figura 3.3 ilustra-se essa cadeia alimentar.
Para além de se encontrar na base da cadeia alimentar, o fitoplâncton é responsável por cerca de metade de todo o oxigénio existente nos oceanos e na atmosfera [28]. Assim, os restantes organismos marinhos não se alimentam apenas do fitoplâncton, como também consomem o oxigénio por eles produzido, o que é essencial para a sua sobrevivência.
Por último, as pequenas alterações nas comunidades de fitoplâncton podem ter um grande efeito na atmosfera e no clima mundial, uma vez que para além de fornecer alimentos e produzir oxigénio, o fitoplâncton assume um papel preponderante na regulação de dióxido de carbono da atmosfera. Sendo o dióxido de carbono um ingrediente usado na fotossíntese, o seu consumo no processo fotossintético ajuda a manter os seus níveis sob
Figura 3.3. Cadeia alimentar desde fitoplâncton até grandes predadores [17].
Peixes Sol Urso Tartaruga Foca Pato Homem Rã Aves Fitoplâncton Lagostim Zooplâncton Larva de inseto Moluscos Microrganismos
Capítulo 3
controlo, reduzindo assim a sua presença como gás com efeito de estufa [27] e mantendo as temperaturas globais da superfície [18].
3.1.4 Fatores que influenciam a produtividade do fitoplâncton
O crescimento das comunidades de fitoplâncton é influenciado pela quantidade de luz solar e pelos níveis de nutrientes presentes no meio aquático. Uma vez que o fitoplâncton necessita da luz solar para a fotossíntese, uma limitação dessa luz diminuirá a sua produtividade fotossintética. Se por um longo período de tempo a luz solar não estiver disponível, os restantes organismos aquáticos consumirão o oxigénio presente no meio, mais rápido do que o fitoplâncton o consegue repor [17], podendo levar à morte em massa de determinadas espécies [17]. Apesar da energia produzida durante o processo fotossintético, o fitoplâncton necessita de nutrientes para conseguir crescer e reproduzir-se. Um aumento excessivo dos níveis de nutrientes no meio aquático, designado por eutrofização [29], por consequência de escoamentos agrícolas [30], leva a um aumento das populações de fitoplâncton, fazendo com que as algas formem floração afetando a qualidade e a saúde aquática [31].
3.1.5 Consequências de níveis incomuns de fitoplâncton
Como referido anteriormente, o fitoplâncton assume um papel preponderante no estado e saúde ecológica dos ecossistemas marítimos, pelo que níveis incomuns da sua concentração podem desencadear consequências devastadoras, afetando não só o nicho ecológico marinho, mas também o ser humano. De seguida apresentam-se algumas dessas consequências.
A excessiva disponibilidade de nutrientes no meio, ou até mesmo um clima quente após uma tempestade, desencadeia uma proliferação de algas levando a um aumento súbito na concentração de fitoplâncton [31], podendo crescer o suficiente para cobrir dezenas de quilómetros e serem visíveis a partir de satélites [18]. Durante a proliferação de algas, algumas delas podem produzir toxinas que comprometem a vida aquática e o ser humano. Este fenómeno é conhecido como maré vermelha [32]. Em níveis normais, certas bactérias conseguem combater as toxinas antes que se tornem perigosas, mas o aparecimento
Capítulo 3
42 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
ao contacto direto (através de natação ou ingestão de água afetada), ou por contacto indireto (por via da ingestão de animais que foram expostos à floração tóxica) [17]. Uma outra consequência dos desníveis de fitoplâncton é a morte de uma grande concentração peixes, devido à falta de oxigénio. Se uma comunidade de fitoplâncton crescer de uma forma excessiva, o oxigénio disponível no meio pode esgotar-se, uma vez que, durante o período noturno não há luz solar disponível para realizar a fotossíntese e as algas consomem mais oxigénio do que aquele que conseguem produzir. Isto leva a que os níveis de oxigénio estejam abaixo dos níveis sustentáveis, levando à morte de peixes [17].
Pigmentos fotossintéticos do Fitoplâncton
Uma vez que os níveis de fitoplâncton marinho afetam direta ou indiretamente, todas as comunidades animais, este assume um papel fundamental na biomassa da vegetação mundial. Os pigmentos fotossintéticos encontram-se associados a importantes ciclos biogeoquímicos, como por exemplo a dinâmica do carbono em mares atuando, atualmente, como indicadores da composição e do comportamento do fitoplâncton nos oceanos. Para além da clorofila existem outros pigmentos fotossintéticos que podem ser encontrados nas algas e no fitoplâncton, tais como, os carotenoids e phycobilins. Há duas phycobilins que podem ser encontradas no fitoplâncton: (1) phycoerythrin, que reflete luz vermelha, (2) e phycocyanin, que reflete luz azul. Estes pigmentos fotossintéticos melhoram a absorção de luz, mas não são parte primária da fotossíntese, sendo responsáveis por atribuir aos organismos outras colorações, como amarelo, vermelho e azul [34]. Como a clorofila está presente em todos os organismos que realizam fotossíntese, este pigmento tem sido muito utilizado como marcador da biomassa de fitoplâncton. Assim, a monitorização da biomassa de fitoplâncton e o aumento da precisão na medição de pigmentos fotossintéticos do fitoplâncton in situ para determinação dos tipos de algas, tornaram-se áreas de elevada prioridade para o estudo da oceanografia [35].
3.2.1 Classificação das microalgas “perspetiva do pigmento
fotossintético”
As algas são considerados organismos aquáticos e vegetais, compreendendo uma variedade de estruturas simples, desde o fitoplâncton unicelular que flutua na água, a grandes algas encontradas no fundo dos oceanos [35]. Com o avançado da tecnologia e com o desenvolvimento de microscópios avançados permitiu a descoberta de espécies de algas não visíveis a olho humano. A classificação de plantas terrestres aconteceu antes da
Capítulo 3
classificação de algas, sendo estas diferenciadas das outras plantas devido a vários fatores, tais como: à capacidade de produção de oxigénio através do processo fotossintético; à ausência de tecidos e de órgãos para transporte de nutrientes de diferentes locais dentro do organismo; à reprodução sexual ou assexuada para produzir gâmetas; e à ausência de raiz [35]. As algas são distinguidas e classificadas entre elas com base na sua forma, composição da parede celular, pigmentação, estrutura, produtos armazenados, caraterísticas de flagelos e método de propagação [34]. Mais ainda, dependendo de certas variáveis do meio, como por exemplo, nutrientes, luz disponível, pH e temperatura, as caraterísticas de uma dada espécie de algas podem ser alteradas num único dia [34].
Recentemente, no estudo das populações de fitoplâncton in situ padronizou-se o uso de dados de pigmentos fotossintéticos para mapear populações de microalgas nos mares e nos oceanos [35]. A disponibilidade de novas culturas de algas e o recurso a técnicas específicas, como por exemplo, a fluorescência, permitiram a identificação de uma série de pigmentos fotossintéticos dando origem a uma série de classes de algas [34], algumas delas invisíveis ao olho humano. Foi de igual modo possível a extração de pigmentos fotossintéticos de extratos de algas marinhas e a sua posterior distinção. O crescente sucesso da cultura de microalgas permitiu também que muitas outras espécies fossem isoladas e analisadas, aumentando exponencialmente a gama de pigmentos fotossintéticos disponíveis para caraterizar os vários conjuntos de algas [35].
As algas pertencem ao Reino Protista, podendo-se distinguir algas eucariontes e algas procariontes. As algas procariontes, como as cyanobacterias, não possuem núcleo ou outros organelos ligados à sua membrana. Por outro lado, as algas eucariontes possuem uma membrana nuclear individualizada e vários tipos de organelos [34]. Assim, com base nos pigmentos constituintes do fitoplâncton é possível identificar 24 classes de microalgas fotossintéticas pigmentadas em 11 divisões (tabela 3.1) [35]. Dentro de cada classe é possível distinguir várias espécies de fitoplâncton. A quarta coluna na tabela 3.1 representa o nome usualmente utilizado pelos biólogos para a designação de cada classe.
Capítulo 3
44 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
Tabela 3.1. Classificação das classes de microalgas fotossintéticas encontradas no fitoplâncton [35]
Divisão de
algas Divisão Classe Nome Comum
Procariontes Cyanophyta Cyanophyceae
Cyanophyte, cyanobacteria, blue-green
algae, prochlorophytes
Eucariontes
Glaucocystophyta Glaucocystophyceae Glaucocystophyte Rhodophyta Rhodophyceae Red algae
Heterokontophyta or Chromista or Chromophyta or Stramenopiles Bacillariophyceae Diatom Bolidophyceae Bolidophyte Chrysophyceae Golden-brown algae Dictyochophyceae Silicoflagellate Eustigmatophyceae Eustigmatophyte Pelagophyceae Pelagophyte Phaeothamniophyceae Phaeothamniophyte Pinguiophyceae Pinguiophyte Raphidophyceae Raphidophyte Synurophyceae Synurophyte Xanthophyceae Xanthophyte Haptophyta
Pavlovophyceae Golden-brown algae Prymnesiophyceae
(=Coccolithophyceae) Golden-brown algae Cryptophyta Cryptophyceae Cryptomonad
Dinophyta Dinophyceae Dinoflagellate Euglenophyta Euglenophyceae Euglenophyte Chlorarachniophyta Chlorarachniophyceae Chlorarachniophyte
Chlorophyta
Chlorophyceae Chlorophyte/green algae Prasinophyceae Prasinophyte Trebouxiophyceae Green algae/lichen algae Streptophyta Mesostigmatophyceae Mesostigmatophyte
Capítulo 3
3.2.2 Propriedades óticas dos pigmentos de fitoplâncton
A importância de medir as propriedades óticas (absorção, dispersão e fluorescência) de uma cultura, população ou comunidade de fitoplâncton é que permite a recolha de informação taxonómica, filogénica e fisiológica [35]. As caraterísticas óticas do espectro de absorção do fitoplâncton, na gama espectral 350 nm a 700 nm, é fundamental para compreender os processos que afetam as propriedades óticas de uma determinada zona marítima, a taxa potencial de produção primária e a estrutura e fisiologia das comunidades de fitoplâncton [35].
A luz que penetra a água e atinge uma célula viva de fitoplâncton pode ser absorvida, refratada, emitida como fluorescência e/ou calor, ou induzir uma reação fotoquímica [35]. Através do espectro de absorção do fitoplâncton verifica-se que o fitoplâncton é composto por pigmentos fotossintéticos cuja natureza da pigmentação varia consoante as classes de fitoplâncton e as condições ambientais [35]. Deste modo, variando as condições ambientais ao longo do dia, a radiação absorvida por uma célula varia, variando de igual modo a forma como esta interage com o campo de luz envolvente. Esta interação depende das propriedades da superfície celular, do tamanho e da forma, bem como da distribuição de pigmentos dentro da célula [35]. Assim, o fitoplâncton pode ser divido em três grandes grupos baseados nos pigmentos fotossintéticos e nas suas propriedades óticas [35]. O primeiro, que contém clorofila-c, compreende as classes Bacillariophyceae, Dinophyceae, Chrysophyceae, Coccolithophyceae, Pavlovophyceae, Raphidophyceae, Dictyochophyceae, é designado de Chromophyta. O segundo grupo que contém clorofila-b, compreendendo as classes Prasinophyceae, Eugleophyceae e Chlorophyceae, é designado de Clorophyta. O terceiro grupo, que contém clorofila-c e phycoerythrin incluindo as classes Cyanophyceae e Cryptophyceae, é designado por phycobiliprotein. [35].
3.2.3 Interpretação dos espectros de absorção e de fluorescência
A recolha de informação sobre os pigmentos fotossintéticos do fitoplâncton realizada através de estudos experimentais derivados de medições óticas (baseados nos espectros de absorção), é limitativa devido à não-linearidade da relação entre as concentrações do pigmento e os coeficientes de absorção medidos [35]. Além disso, uma
Capítulo 3
46 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
mas também a sua quantificação, essa limitação é um grande obstáculo para a quantificação [35].
Assim, têm sido utilizados vários métodos, ou uma combinação de métodos, para extrair informação dos pigmentos fotossintéticos de fitoplâncton com base nos seus espectros de absorção [35]. Uma das primeiras técnicas, baseou-se na decomposição em bandas gaussianas dos espectros de absorção, medidos numa solução contendo algas. Essas bandas foram atribuídas a pigmentos individuais, mas a quantificação dos pigmentos foi limitada pelas similaridades nos diferentes tipos de algas. Uma outra abordagem, a análise discriminante passo a passo, foi aplicada aos espectros de absorção, medidos numa solução contendo algas, para os classificar entre 31 phytoplankters de 10 classes. Este método associado ao uso de um algoritmo de índice de similaridade permitiu quantificar a biomassa permitindo assim a descriminação de diferentes grupos taxonómicos. Posteriormente, a análise derivada, que decompõe os espectros de absorção em curvas gaussianas-lorentzianas centradas nos picos identificados, permitiu estimar as contribuições relativas dos pigmentos. Porém, as técnicas baseadas na citometria de fluxo, descrita na secção 2.1, são as mais bem-sucedidas, uma vez que se baseiam na análise combinada da dispersão da luz e em medições de fluorescência, fornecendo informações essenciais sobre os pigmentos presentes [35].
Cerca de 1% a 5% da luz solar que é absorvida por uma célula de fitoplâncton é novamente emitida como fluorescência pela clorofila-a, sendo esta responsável por 95% da fluorescência in vivo de fitoplâncton [35]. Isto acontece devido ao fato de in vivo, todos os pigmentos fotossintéticos transferirem a luz para o pigmento principal, ou seja, a luz é transferida para o centro de reação da clorofila-a [35]. Nas medições in vitro isto não acontece devido à capacidade de separação, através do uso de técnicas laboratoriais, como por exemplo, a técnica HPLC (High-performance liquid chromatography), dos diferentes pigmentos fotossintéticos, dividindo assim a clorofila nos seus seis tipos distintos [35].
3.2.4 Monitorização das caraterísticas óticas dos pigmentos de
fitoplâncton
Da secção anterior concluiu-se que a medição das caraterísticas óticas dos pigmentos de fitoplâncton fornece dados importantes sobre a saúde ecológicas dos sistemas aquáticos. O avanço tecnológico permitiu o desenvolvimento de diferentes técnicas para monitorização subaquática em diferentes escalas geográficas, através do estudo da absorção de luz solar pelos pigmentos, que determina a absorção do fitoplâncton e, assim, contribui
Capítulo 3
para caraterísticas óticas in situ de mares e oceanos [35]. Atualmente, e com recurso a diferentes sensores e múltiplas plataformas para a monitorização da dinâmica populacional de fitoplâncton, é possível obter informação importante para estimar as mudanças na produtividade primária que afetam os ciclos de carbono e de nutrientes nos meios subaquáticos (ver secção 2.2) [35]. As regiões costeiras dependem de redes de alerta e de avisos rápidos e eficientes que permitem ao ser humano atuar de uma forma rápida e pronta sobre a proliferação de algas nocivas, que afetam diretamente a aquacultura, a pesca e até mesmo o turismo [35], prevenindo a morte ou a contaminação de peixes e o esgotamento de oxigénio presente no meio [35].
Porém, apesar da importância da medição das caraterísticas óticas dos pigmentos de fitoplâncton, as medições óticas in situ não são capazes de distinguir pigmentos individuais, permitindo apenas a distinção de quatro grupos principais: Chromophyta; Chlorophyta; prochlorophytes; e phycobiliprotein [35]. Destes quatro grupos ainda é possível classificar em 12 classes baseadas nos pigmentos fotossintéticos (tabela 3.2) [35]. O grupo Chromophyta é caraterizado por conter o pigmento clorofila-c, o grupo Clorophyta por ter clorofila-b, o grupo Phycobliliprotein por ter clorofila-c e phycoerythrin e o grupo Prochlorophytes por contem vestígios de clorofila-b e carotenoids.
Tabela 3.2 Divisão de grupos e classes [35].
Espécies de estudo ao longo da dissertação
Grupo Classe Chromophyta Bacillariophyceae Dinophyceae Prymnesiophyceae Chrysophyceae Raphidophyceae Pavlovophyceae Dictyochophyceae Clorophyta Chlorophyceae Prasinophyceae Euglenophyceae Phycobiliprotein Cyanophyceae Cryptophyceae Prochlorophytes ---
Capítulo 3
48 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
para a classificação dos diferentes grupos taxonómicos. Pelo facto do estudo das propriedades óticas ter recaído apenas nestas três espécies, a classificação do fitoplâncton em diferentes grupos ficou limitada.
A Nannochloropsis gaditana é uma alga eucariótica, que pertence à classe Eustigmatophyceae resultante de um processo endossimbiótico secundário [36]. Devido à sua capacidade na produção de biocombustíveis, a sua caraterização ganhou um maior relevo nos últimos tempos. É caraterizada pela presença de apenas clorofila-a, violaxanthin e vaucheriaxanthin [37] não pertencendo a nenhum dos grupos descritos na seção anterior. A Isochrysis galbana é também uma alga eucariótica, que pertence à classe Prymnesiophyceae do grupo Chromophyta [35]. É caraterizada pela presença de clorofila-a, clorofila-c e fucoxanthin [38]. Por último, a Tetraselmis suecicclorofila-a, é considerada uma microalga verde, que pertence à classe clorophyceae do grupo clorophyta, muito utilizada na aquacultura servindo de alimento a moluscos e crustáceos e desintoxicação de peixes [39]. É caraterizada pela sua riqueza em vitamina-E, sendo utilizada como suplemento alimentar em dietas humanas e animais [39], pela capacidade de melhorar a pigmentação dérmica, e aumentar o crescimento de cabelo [39]. É aplicada também na reconstituição de células na linha celular de cancro dos pulmões no ser humano e apresenta uma excelente atividade antioxidante [39]. Apresenta pigmentos de clorofila-a, clorofila-b, porphyrin e xanthophyll [39].
O capítulo anterior expôs conceitos importantes, como por exemplo, o que é o fitoplâncton e a sua importância no ecossistema global terrestre, o que é a fotossíntese e qual o pigmento responsável por essa reação química, a classificação de algas na perspetiva dos pigmentos fotossintéticos e a importância da sua distinção e medição para a classificação do fitoplâncton.
No presente capítulo, serão descritos os equipamentos utilizados para a obtenção dos resultados experimentais, assim como o setup e os procedimentos seguidos em cada fase desses resultados.
Introdução
O microssistema de deteção espectrofotométrica que se pretende desenvolver, capaz de detetar, quantificar e diferenciar as três espécies de fitoplâncton será constituído por diferentes LEDs, centrados em diferentes comprimentos de onda, e diferentes fotodetetores, possivelmente com diferentes larguras de banda. Este sistema de deteção terá que ser inserido numa caixa estanque e opaca com vários orifícios que servem de passagem da luz para o processo de excitação e de emissão do fitoplâncton, ficando os LEDs e fotodetetores posicionados com um ângulo de 90º entre eles. Esta disposição ajuda a reduzir a quantidade de luz de excitação que pode atingir o fotodetetor afetando a medição. Na figura 4.1 ilustra-se uma aproximação da arquitetura do equipamento.
Capítulo 4
50 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
Na escolha do LED e do fotodetetor é necessário ter em conta a extrema baixa intensidade de fluorescência emitida pelas espécies de fitoplâncton. Assim, toda esta arquitetura poderá estar sujeita a alterações, como por exemplo, a substituição dos LEDs por lasers de modo a aumentar a intensidade da luz de excitação, levando ao aumento da intensidade de emissão fluorescente. Contudo, esta solução aumenta também o consumo de energia, pelo que as tomadas de decisão terão que ser bem estudadas pesando as restrições de sensibilidade, limite de deteção e consumo de energia.
Setup para a conservação das espécies
Fora do seu habitat natural é preciso criar condições para que as espécies de fitoplâncton consigam sobreviver e, se necessário, reproduzir-se de forma a aumentar as concentrações presentes nas amostras. A figura 4.2 mostra o local de conservação das espécies.
Capítulo 4
As espécies, colocadas em frascos Erlenmeyer, foram instaladas numa incubadora com agitação. Devido à necessidade de luz solar para a sua sobrevivência, foram acopladas três lâmpadas fluorescência de 18 W na parte de trás da incubadora. Apesar da necessidade de luz para sobreviverem e para realizarem fotossíntese, as espécies têm também um período de “descanso”, pelo que as lâmpadas compreendem um fotoperíodo de 12 horas por dia. Um outro fator importante é a temperatura a que as espécies estão expostas. Idealmente é cerca de 18º, sendo por isso a incubadora colocada junto a um microssistema de ar condicionado de forma a manter a temperatura o mais próximo possível desse valor.
Como qualquer outro ser vivo, as espécies de fitoplâncton necessitam de alimento e de um meio para a sua conservação e crescimento. Estas três espécies necessitam do mesmo meio, e este é constituído por walne (meio de cultura sintético), vitaminas e extrato de solo.
Capítulo 4
52 Quantificação e Classificação de Fitoplâncton por Espetrofotometria Carlos José de Sousa Pereira – Universidade do Minho
Métodos
Ao longo da dissertação foram realizados testes experimentais que podem ser divididos em três partes de acordo com o que se pretende medir: (1) deteção de pigmentos fotossintéticos presentes nas amostras; (2) quantificação das espécies de fitoplâncton; (3) e classificação das três espécies de fitoplâncton. De seguida, apresentam-se e descrevem-se, para cada teste, o setup utilizado assim como o procedimento seguido.
4.3.1 Setup fluorométrico e procedimento para a deteção de pigmentos
fotossintéticos
O setup fluorométrico tem como objetivo verificar a existência de pigmentos fotossintéticos capazes de absorver e emitir luz fluorescente das diferentes espécies de fitoplâncton. Num passo inicial pretendeu-se obter o espectro de absorbância dessas espécies, necessário para determinar qual o comprimento de onda em que a espécie de fitoplâncton apresenta maior absorbância, comprimento este à volta do qual será feita a excitação para a emissão de luz fluorescente das espécies. Neste procedimento utilizou-se o equipamento Fluorolog da marca HoribaJobin Yvon (figura 4.3), disponível no departamento de Física da Universidade do Minho. As espécies estudadas nesta primeira fase foram a Nannochloropsis gaditana e Isochrysis galbana.
![Figura 4.10. Esquema de contagem celular [10]. (a) Círculos com preenchimento preto representam as células contadas e os círculos cinzentos representam as](https://thumb-eu.123doks.com/thumbv2/123dok_br/17287207.790099/55.892.189.664.93.333/esquema-contagem-círculos-preenchimento-representam-círculos-cinzentos-representam.webp)

![Figura 4.24. Exemplo ilustrativo de um sinal embebido em ruído [43].](https://thumb-eu.123doks.com/thumbv2/123dok_br/17287207.790099/67.892.166.740.180.477/figura-exemplo-ilustrativo-de-um-sinal-embebido-ruído.webp)
![Figura 4.25. Representação do efeito do desmodulador no sinal de ruído [43].](https://thumb-eu.123doks.com/thumbv2/123dok_br/17287207.790099/68.892.253.655.377.625/figura-representação-do-efeito-do-desmodulador-sinal-ruído.webp)