PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS
NATURAIS E SINTÉTICOS BIOATIVOS
IGOR RAFAEL PRAXEDES DE SALES
ATIVIDADE ANTIULCEROGÊNICA DE
Cissampelos sympodialis
EICHL. (MENISPERMACEAE) EM MODELOS ANIMAIS
ATIVIDADE ANTIULCEROGÊNICA DE
Cissampelos sympodialis
EICHL. (MENISPERMACEAE) EM MODELOS ANIMAIS
ORIENTADORA: Profa. Dra. Leônia Maria Batista
JOÃO PESSOA - PB
2016
ATIVIDADE ANTIULCEROGÊNICA DE
Cissampelos sympodialis
EICHL. (MENISPERMACEAE) EM MODELOS ANIMAIS
APROVADA EM: 26 / 02 / 2016
BANCA EXAMINADORA:
_______________________________________________
Profa. Dra. Leônia Maria Batista Orientadora - UFPB
_______________________________________________
Profa. Dra. Aurigena Antunes de Araujo Examinadora Externa – UFRN
______________________________________________
Profa. Dra. Tatjana Keesen de Souza Lima Examinadora Interna - UFPB
Agradecimentos
tudo conforme o seu tempo e a sua vontade. Pelas inúmeras dificuldades e vitórias que surgiram para que esse sonho fosse concretizado, tua bondade me manteve de pé!
À minha preciosa família...
Meus pais, Francisco de Sales e Vânia Maria,por formarem uma base tão sólida, cheia de amor e perseverança. O meu irmão-amigo, João Paulo, o meu eterno companheiro que sempre irradia felicidade por onde passa. A minha querida irmã, Paula Rafaela, seu esposo Maykon Oliveira e o meu sobrinho Enzo, agradeço pelo companheirismo e pelos nossos reencontros cheios de felicidade. Expresso gratidão a minha querida avó paterna, Antônia de Freitas, por todo o carinho e atenção. A todos os demais familiares, o meu agradecimento. Amo vocês!
À Profa. Dra. Leônia Batista,
que esteve acompanhando meuspassos como tutora/orientadora desde o meu segundo semestre no curso de Farmácia, por ser uma profissional tão dedicada e zelosa no que lhe é proposto. Eu sou extremamente grato pelas inúmeras oportunidades criadas durante esses anos de convivência, pelos espaços de discussão e aprendizado e pela confiança em mim depositada.
Ào Prof. Dr. José Maria Barbosa Filho,
pela sua atenção egentileza em ceder o material vegetal desse estudo. Também agradeço a Dra. Ana Sílvia e o Dr. Alexsandro Marinho por todo o apoio durante a execução desse trabalho.
Às Profas. Dra. Aurigena Antunes e a Dra. Tatjana Keesen,
pelasvaliosas contribuições para o enriquecimento desse trabalho. Durante o mestrado tive a oportunidade de frequentar o laboratório das duas e agradeço pelos ensinamentos e por ter sido sempre muito bem recebido.
Àos Professores
do Curso de Farmácia e do Programa dePós-Graduação em Produtos Naturais e Sintéticos Bioativos, especialmente, Dra. Bagnólia Araújo, Dra. Márcia Piuvezam, Dra. Fabiana Cavalcante e Dr. Reinaldo Nóbrega. Meu agradecimento às Profas. Ana Gerda e Bryza Duarte do Núcleo Inglês Sem Fronteiras (Nucli-ISF-UFPB).
Àos amigos e colegas
da turma de mestrado 2014.1 e agregados pelosconhecimentos compartilhados e pelos momentos de superação e de alegria que passamos juntos.
À minha equipe infalível
do Laboratório de Farmacologia do TratoGastrintestinal, catorze mãos e sete mentes que trabalham e se ajudam mutuamente... A doutoranda Flávia Frota, minha grande parceira, muito obrigado por todas as palavras de incentivo. A mestranda Raphaela Francelino que foi uma doce companhia durante esse período. Aos estudantes de iniciação científica, Rodrigo Formiga, Matheus Marley e Monique Xavier, a ajuda de vocês foi essencial para que chegássemos até aqui. Sentirei falta dos nossos bons momentos de descontração, do nosso espírito festivo e dos
nossos “cafés com prosa” regados de muitas risadas e boa comida. Gostaria de agradecer também ao Sr. Josué, responsável pelos serviços gerais do laboratório, pela sua prontidão em me ajudar.
Oncofarmacologia, Laboratório de Imunofarmacologia e do Laboratório de Farmacologia Funcional, pelas inúmeras vezes que precisei utilizar algum equipamento e sempre fui prontamente atendido.
À Profa. Dra. Giciane Vieira
pela colaboração em realizar a análisehistológica desse trabalho. Também agradeço aos estudantes Alysson e Raquel pelo processamento das amostras biológicas.
Àos meus grandes amigos
Hanna Jarine e Eryck Holmes, que foram porinúmeros momentos a minha família em João Pessoa, por todos os bons e inesquecíveis momentos que vivemos, pelas nossas aventuras e viagens, e por acreditarem tanto em mim. Aos meus amigos da graduação em Farmácia, Kaio Lucena (meu irmão em JP), Mariana Medeiros e Ana Letícia, sou muito grato pela amizade de vocês. Aos amigos e colegas que conheci através da ciência, Wermerson Assunção, Camila Montenegro, Joleen Lopes, Thaylan Martins, Marcelo Ricardo, Cynthia Layse, Luciano Leite, Adriano Alves, Renan Marinho, Italo Rossi, Joedna Cavalcante, Paula Benvindo, Carol Lima e Ceiça Correia
pelo companheirismo de todos. Aos amigos “wi-fi”, Gislainy Luciana, Marcos
Vinícius e Liege Helena, que mesmo distantes fisicamente sempre se fizeram presentes com suas palavras de carinho e incentivo. Todos vocês tornam minha vida mais leve e cheia de amor!
À coordenação e os funcionários
do Programa de Pós-Graduação emProdutos Naturais e Sintéticos Bioativos, na pessoa do Prof. Dr. Josean Fechine Tavares e o apoio técnico de Caroline Mangueira, pela atenção concedida sempre que necessário. E ao Instituto Pesquisa em Fármacos e Medicamentos (IPeFarM-UFPB), sob direção do Prof. Dr. Rui Macedo.
À equipe
da Unidade de Produção Animal do IPeFarM, especialmente obioterista Crispim Duarte, pelo constante apoio e atenção.
Ào CNPQ, CAPES e a Universidade Federal da Paraíba
(UFPB)
pelo apoio institucional e financeiro necessários para odesenvolvimento desse trabalho.
Àos animais de experimentação
utilizados nesse estudo que representamum privilégio para quem faz ciência.
Àos trabalhadores brasileiros
que, por meio do pagamento dos seusimpostos, me mantiveram durante esses anos em uma universidade pública.
Com gratidão,
Igor Rafael”
Se você for tentar, vá até o fim. Senão, nem comece. Vá. Até. O fim. Isso pode significar perder amores, amigos, empregos e talvez até a cabeça. Vá até o fim.
Isso pode significar três ou quatro dias sem comer. Isso pode significar congelar no banco de um parque. Isso pode significar deboche, rejeição. Solidão. Solidão? Pense nela como um presente. E em todo o resto como um teste à sua persistência. O tamanho da sua vontade de chegar lá. Você vai chegar. E vai ser melhor que qualquer coisa que você possa imaginar. Vá. Vá. Vá. Até o fim. Você nunca vai estar sozinho. (Campanha publicitária postos Shell 2015)
RESUMO
Cissampelos sympodialis Eichl. (Menispermaceae) é uma espécie endêmica no Brasil,
popularmente conhecida como “milona”, “jarrinha” ou “orelha-de-onça”. Esta espécie foi selecionada para este estudo a partir de critérios quimiotaxonômicos (alcaloides e flavonoides) e etnofarmacológico, já que essa espécie é utilizada popularmente no tratamento de desordens inflamatórias. Este trabalho teve como objetivo avaliar a toxicidade pré-clínica aguda e a atividade antiulcerogênica do extrato etanólico bruto (EEtOH-Cs) e da fração de alcaloides
totais (FAT-Cs) obtidos das partes aéreas de C. sympodialis. No ensaio de toxicidade aguda,
as doses de 300 e 2000 mg/kg do EEtOH-Cs administrado por via oral (v.o.) não induziu sinais
de toxicidade em camundongos fêmeas nas condições experimentais avaliadas e a dose letal 50% (DL50) é igual ou superior a 5000 mg/kg de acordo com o guia 423 da OECD. Para a FAT-Cs foi verificado que os animais tratados com a dose de 2000 mg/kg apresentaram cauda
em straub e analgesia, sendo a DL50 dessa substância de aproximadamente 1000 mg/kg. Para a avaliação da atividade gastroprotetora foram utilizados os modelos de indução aguda de úlcera gástrica: por etanol em ratos, anti-inflamatório não-esteroidal (AINE - piroxicam), estresse (por imobilização e frio) em camundongos e contensão do suco gástrico em ratos. No modelo de úlcera induzida por etanol a carbenoxolona (100 mg/kg), o EEtOH-Cs ou FAT-Cs
(62,5; 125; 250 e 500 mg/kg - v.o.) reduziram a área de lesão ulcerativa (ALU) em 97, 69, 75, 94, 98; 97, 88, 90, 94, 95% (p<0,001), respectivamente, em comparação ao controle negativo. Na úlcera por etanol, os tratamentos com carbenoxolona (100 mg/kg), EEtOH-Cs (500 mg/kg) e
FAT-Cs (250 mg/kg) melhoraram os parâmetros histológicos analisados. Nas úlceras induzidas
por AINE, a cimetidina (100 mg/kg), o EEtOH-Cs ou FAT-Cs (62,5; 125; 250 e 500 mg/kg - v.o.)
reduziram o índice de lesão ulcerativo (ILU) em 43, 59, 60, 64, 76; 47, 51, 62, 75 e 78% (p<0,001), respectivamente. Em lesões induzidas por estresse a cimetidina, o EEtOH-Cs ou
FAT-Cs nas mesmas doses reduziram o ILU em 44, 37, 38, 42, 52; 57, 39, 54, 75 e 76%
(p<0,001), respectivamente. Nas úlceras induzidas por contensão do suco gástrico (ligadura do piloro) a cimetidina (100 mg/kg), o EEtOH-Cs (500 mg/kg) e FAT-Cs (250 mg/kg) diminuíram o
ILU em 35, 42 e 40% (p<0,001) (v.o.) e em 39, 34 e 33% (p<0,01) (intraduodenal – i.d.), respectivamente. Na perspectiva de investigar os mecanismos envolvidos na atividade gastroprotetora das amostras de C. sympodialis foram avaliados os mecanismos
antissecretórios ou neutralizantes da secreção ácida gástrica, mecanismos citoprotetores, antioxidante e imunorregulatório. Os tratamentos (v.o. e i.d.) com o EEtOH-Cs (500 mg/kg) e
FAT-Cs (250 mg/kg) não alteraram os parâmetros bioquímicos do suco gástrico, sugerindo que
a atividade gastroprotetora não envolve mecanismos antissecretórios ou neutralizantes. A atividade gastroprotetora do EEtOH-Cs (500 mg/kg) envolve participação de grupamentos sulfidrila, óxido nítrico, KATP, muco e prostaglandinas. A gastroproteção promovida pela FAT-Cs
(250 mg/kg) envolve a participação de grupamentos sulfidrila, muco e prostaglandinas. O EEtOH-Cs (500 mg/kg) (p<0,001) e FAT-Cs (250 mg/kg) (p<0,01) apresentaram atividade
antioxidante por um aumento nos níveis de glutationa reduzida (GSH) quando comparados ao controle negativo, nas úlceras induzidas por etanol. O EEtOH-Cs (500 mg/kg) diminui os níveis
das citocinas pró-inflamatórias, interleucina 1 beta (IL-1β) (p<0,001) e fator de necrose tumoral alfa (TNF-α) (p<0,05) e aumentou os níveis da interleucina anti-inflamatória, interleucina 10 (IL-10) (p<0,001), quando comparado ao controle negativo. O tratamento com a FAT-Cs
(250 mg/kg) não alterou os níveis de IL-1β e TNF-α mas aumentou os níveis de IL-10 (p<0,001), quando comparado ao controle negativo. No modelo de úlcera duodenal induzida
por cisteamina, o lansoprazol (30 mg/kg), EEtOH-Cs (500 mg/kg) ou FAT-Cs (250 mg/kg)
reduziram a ALU em 93, 49; 61, e 89% (p<0,001), respectivamente. Diante desses resultados, foi possível sugerir que C. sympodialis e seus derivados apresentam atividade antiulcerogênica
e que a atividade gastroprotetora dessa espécie envolve mecanismos citoprotetores, antioxidantes e imunorregulatórios.
Palavras-chave: Cissampelos sympodialis, plantas medicinais, gastroproteção, citoproteção e
antioxidante.
graduação em Produtos Naturais e Sintéticos Bioativos, CCS/UFPB.
ABSTRACT
Cissampelos sympodialis Eichl. (Menispermaceae) is an endemic species in Brazil, popularly
known as "Milona", "Jarrinha" or "Orelha-de-onça". This species was selected for this study considering the chemotaxonomic (alkaloids and flavonoids) and ethnopharmacological criteria, due to this species be popularly used to treat inflammatory disorders. This study aimed to evaluate the acute preclinical toxicity and anti-ulcer activity of the ethanolic extract (EtOHE-Cs)
and alkaloids total fraction (TAF-Cs) obtained from aerial parts of C. sympodialis. In acute
toxicity, doses of 300 and 2000 mg/kg EtOHE-Cs were administered orally (p.o.). Our
experiment conditions shows that, this type of doses did not induce signs of toxicity in female mice and 50% of lethal dose (LD50) is equal to or greater 5000 mg/kg according to the OECD 423 guide. For TAF-Cs was founded that the animals treated with the dose of 2000 mg/kg
showed straub tail and analgesia. In addition, the LD50 of this substance being approximately 1000 mg/kg. To evaluate the gastroprotective activity using induced acute models of gastric ulcers were used: ethanol and containment of gastric juice in rats, anti-inflammatory non-steroidal drug (NSAID - piroxicam) and stress (immobilization and cold) in mice. In ulcer model induced by ethanol the results showed that carbenoxolone (100 mg/kg), EtOHE-Cs or TAF-Cs
(62.5; 125; 250 and 500 mg/kg – v.o.) reduced the ulcerative lesion area (ULA) of 97, 69, 75, 94, 98; 97, 88, 90, 94, 95% (p<0,001) respectively in comparison with the negative control. In the same model, treatment with carbenoxolone (100 mg/kg), EtOHE-Cs (500 mg/kg) or TAF-Cs
(250 mg/kg) improved histological parameters analyzed. Considering ulcers induced by NSAIDs, cimetidine (100 mg/kg), the EtOHE-Cs or TAF-Cs (62.5; 125; 250 and 500 mg/kg –
p.o.) reduced the ulcerative lesion index (ULI) in 43, 59, 60, 64, 76; 47, 51, 62, 75 and 78% (p<0,001), respectively. In the lesions induced by stress cimetidine, EtOHE-Cs or TAF-Cs at the
same doses reduced ULI at 44, 37, 38, 42, 52; 57, 39, 54, 75 and 76% (p<0,001), respectively. Ulcers induced by restraining of the gastric juice (pylorus ligation) treated with cimetidine (100 mg/kg), EtOHE-Cs (500 mg/kg) and TAF-Cs (250 mg/kg) decreased the ULI at 35, 42 and 40 %
(p.o.) (p<0,001) and 39, 34 and 33% (intraduodenally – i.d.) (p<0,01), respectively. To investigate the mechanisms of samples of C. sympodialis involved in gastroprotective activity it was evaluated the antisecretory or neutralizing mechanisms of the gastric acid secretion and cytoprotective, antioxidant and immunoregulatory properties. Treatments (p.o. and i.d.) with EtOHE-Cs (500 mg/kg) and TAF-Cs (250 mg/kg) did not alter biochemical parameters of gastric
juice, suggesting that gastroprotective activity does not involve antisecretory or neutralizing mechanisms. The gastroprotective activity of EtOHE-Cs (500 mg/kg) involves participation of
sulfhydryl groups, nitric oxide, KATP, mucus and prostaglandins. The gastroprotection promoted
by the TAF-Cs (250 mg/kg) involves the participation of sulfhydryl groups, mucus and
prostaglandins. EtOHE-Cs (500 mg/kg) (p<0,001) and TAF-Cs (250 mg/kg) (p<0,01) showing
antioxidant activity by an increase in reduced glutathione (GSH) levels compared to the negative control in ethanol-induced gastric ulcers. The EtOHE-Cs (500 mg/kg) reduces the
levels of pro-inflammatory cytokines, interleukin 1 beta (IL-1β) (p<0,001) and tumor necrosis factor (TNF-α) (p<0,05) and levels of anti-inflammatory interleukin were increased, interleukin 10 (IL-10) (p<0,001) compared to the negative control. Treatment with TAF-Cs (250 mg/kg) did
not alter IL-1β and TNF-α levels, however this treatment increased IL-10 levels compared to the negative control (p<0,001). In the cysteamine-induced duodenal ulcer lansoprazole (30 mg/kg), EtOHE-Cs (500 mg/kg) or TAF-Cs (250 mg/kg) reduced the ULA in 93, 49; 61 and 89%
(p<0,001), respectively. Considering these results, it was possible to suggest that C.
sympodialis and derivates presents antiulcerogenic activity and the gastroprotective activity of
this species involves cytoprotective, antioxidants and immunoregulatory mechanisms.
Key words: Cissampelos sympodialis, medicinal plants, gastroprotection, cytoprotective and
antioxidant.
Figura 1. Representação esquemática da área de ocorrência da úlcera
péptica (esofágica, gástrica e duodenal)... 4
Figura 2. Mecanismo de secreção ácida gástrica... 9
Figura 3. Sinalização na célula parietal... 10
Figura 4. Fatores protetores da mucosa gástrica... 13
Figura 5. Sistema antioxidante... 22
Figura 6. Terapêutica da úlcera péptica... 29
Figura 7. Cissampelos sympodialis... 35
Figura 8. Alcaloides isolados de Cissampelos sympodialis... 36
Figura 9. Marcha para obtenção do EEtOH-Cs e FAT-Cs... 46
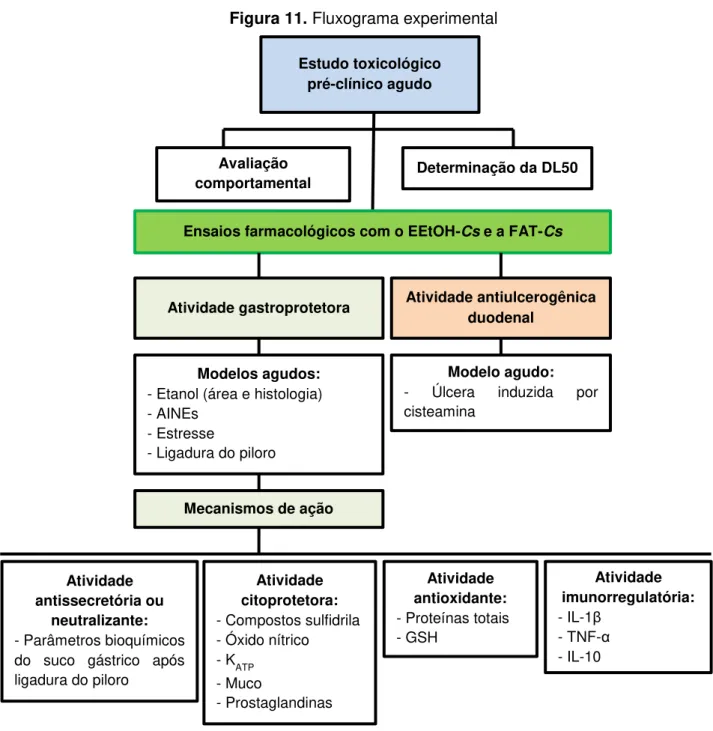
Figura 10. Animais utilizados em ensaios farmacológicos: camundongo Swiss (Mus musculus) (A) e rato Wistar (Rattus norvegicus) (B)... 47 Figura 11. Fluxograma experimental... 49
Figura 12. Lupa OLYMPUS Optical TL3 - SZ40 (A) e estômago de rato ulcerado com etanol absoluto (B) para determinação do ILU... 52
Figura 13. Estômago de rato ulcerado com etanol absoluto (A e B) e quantificação da área de lesão ulcerativa (B) com AVSoft Bioview Spectra 4.0®... 52 Figura 14. Animal tratado com a FAT-Cs (2000 mg/kg) com cauda em Straub... 62
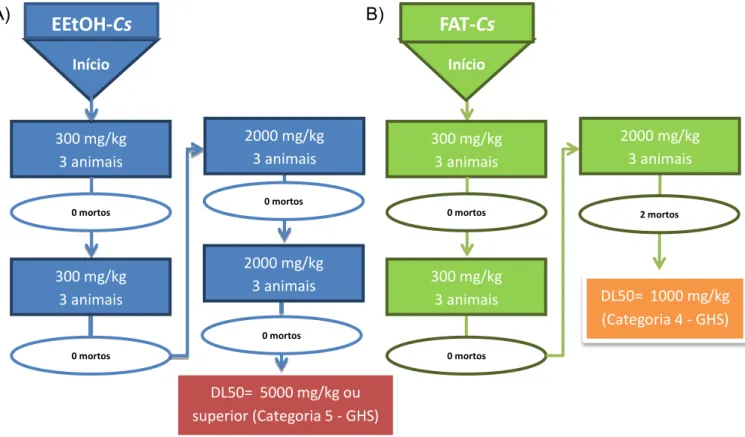
Figura 15. Estimativa da DL50 do a) EEtOH-Cs e da b) FAT-Cs (Guia 423 da OECD)... 63
Figura 16. Estômagos de ratos pré-tratados (v.o.) com Tween 80 12% (A), carbenoxolona 100 mg/kg (B), EEtOH-Cs (62,5 mg/kg) (C), EEtOH-Cs (125 mg/kg) (D), EEtOH-Cs (250 mg/kg) (E) e EEtOH-Cs (500 mg/kg) (F) no modelo de etanol... 66 Figura 17. Estômagos de ratos pré-tratados (v.o.) com Tween 80 12% (A), carbenoxolona 100 mg/kg (B), FAT-Cs (62,5 mg/kg) (C), FAT-Cs (125 mg/kg) (D), FAT-Cs (250 mg/kg) (E) e FAT-Cs (500 mg/kg) (F) no modelo de etanol... 66 Figura 18. Fotomicrografias coradas com HE a partir do modelo de úlceras gástricas induzidas por etanol em ratos... 68
Figura 19. Fotomicrografias coradas com PAS a partir do modelo de úlceras gástricas induzidas por etanol em ratos... 68
Figura 21. Estômagos de ratos pré-tratados com sol. salina 0,9% e tratados com sol. Tween 80 12% (A), carbenoxolona 100 mg/kg (B), EEtOH-Cs 500 mg/kg (C) ou pré-tratados com NEM e tratados com sol. Tween 80 12% (D), carbenoxolona 100 mg/kg (E) e EEtOH-Cs 500 mg/kg (F) no modelo de úlceras induzidas por etanol para avaliação da participação dos grupamentos sulfidrila... 75
Figura 22. Estômagos de ratos pré-tratados com sol. salina 0,9% e tratados com sol. Tween 80 12% (A), carbenoxolona 100 mg/kg (B), FAT-Cs 250 mg/kg (C) ou pré-tratados com NEM e tratados com sol. Tween 80 12% (D), carbenoxolona 100 mg/kg (E) e FAT-Cs 250 mg/kg (F) no modelo de úlceras induzidas por etanol para avaliação da participação dos grupamentos sulfidrila... 76
Figura 23. Estômagos de ratos pré-tratados com sol. salina 0,9% e tratados com sol. Tween 80 12% (A), carbenoxolona 100 mg/kg (B), EEtOH-Cs 500 mg/kg (C) ou pré-tratados com L-NAME e tratados com sol. Tween 80 12% (D), carbenoxolona 100 mg/kg (E) e EEtOH-Cs 500 mg/kg (F) no modelo de úlceras induzidas por etanol para avaliação da participação do óxido nítrico... 78
Figura 24. Estômagos de ratos pré-tratados com sol. salina 0,9% e tratados com sol. Tween 80 12% (A), carbenoxolona 100 mg/kg (B), FAT-Cs 250 mg/kg (C) ou pré-tratados com L-NAME e tratados com sol. Tween 80 12% (D), carbenoxolona 100 mg/kg (E) e FAT-Cs 250 mg/kg (F) no modelo de úlceras induzidas por etanol para avaliação da participação do óxido nítrico... 78
Figura 25. Estômagos de ratos pré-tratados com sol. salina 0,9% e tratados com sol. Tween 80 12% (A), EEtOH-Cs mg/kg (B), FAT-Cs 250 mg/kg (C) ou pré-tratados com glibenclamida e tratados com EEtOH-Cs (D) e FAT-Cs 250 mg/kg (E) no modelo de úlceras induzidas por etanol para avaliação da participação dos canais de potássio sensíveis ao ATP... 80
Figura 26. Estômagos de ratos pré-tratados com sol. salina 0,9% e tratados com sol. Tween 80 12% (A), misoprostol 50 mcg/kg (B), EEtOH-Cs 500 mg/kg (C) e FAT-EEtOH-Cs 250 mg/kg (D) ou pré-tratados com indometacina e tratados com sol. Tween 80 12% (E), misoprostol (F), EEtOH-Cs (G) e FAT-Cs (H) no modelo de úlceras induzidas por etanol para avaliação da participação das prostaglandinas... 82
Figura 27. Fotografias de úlceras duodenais induzidas por cisteamina em animais tratados com solução Tween 80 12% (A), Lansoprazol (B), EEtOH-Cs (500 mg/kg) (C), solução Tween 80 12% (D), Lansoprazol (E) e FAT-Cs (250 mg/kg)...
86
Tabela 1. Efeito da administração oral do EEtOH-Cs e da FAT-Cs na evolução ponderal, índice dos órgãos, consumo de água e ração em camundongos fêmeas...
64
Tabela 2. Efeito da administração oral do EEtOH-Cs, FAT-Cs e cimetidina em úlceras gástricas induzidas por anti-inflamatório não esteroidal em camundongos... 70
Tabela 3. Efeito da administração oral do EEtOH-Cs, FAT-Cs e cimetidina em úlceras gástricas induzidas por estresse em camundongos... 71
Tabela 4. Efeito da administração oral e intraduodenal do EEtOH-Cs, FAT-Cs e cimetidina em úlceras gástricas induzidas por ligadura do piloro em ratos...
72
Tabela 5. Efeito da administração oral e intraduodenal do EEtOH-Cs, FAT-Cs e cimetidina nos parâmetros do conteúdo gástrico após ligadura do piloro...
73
Gráfico 1. Efeito da administração oral do EEtOH-Cs (a), da FAT-Cs (b) e carbenoxolona em úlceras gástricas induzidas por etanol em ratos... 65
Gráfico 2. Efeito da administração oral do EEtOH-Cs (A), FAT-Cs (B) e carbenoxolona após pré-tratamento com salina e NEM (i.p.), na úlcera
gástrica induzida por etanol em
ratos... 74
Gráfico 3. Efeito da administração oral do EEtOH-Cs (A), FAT-Cs (B) e carbenoxolona após pré-tratamento com salina e L-NAME (i.p.), na úlcera
gástrica induzida por etanol em
ratos... 77
Gráfico 4. Efeito da administração oral do EEtOH-Cs (A), FAT-Cs (B) e carbenoxolona após pré-tratamento com salina e glibenclamida (i.p.), na úlcera gástrica induzida por etanol em ratos ... 79
Gráfico 5. Efeito da administração oral do EEtOH-Cs, FAT-Cs e carbenoxolona na concentração do muco aderido à mucosa gástrica após ligadura do piloro... 80
Gráfico 6. Efeito da administração oral do misoprostol, EEtOH-Cs e FAT-Cs após pré-tratamento com salina e indometacina (v.o.), na úlcera gástrica induzida por etanol em ratos... 81
Gráfico 7. Efeito da administração oral do EEtOH-Cs (a), da FAT-Cs (b) e carbenoxolona nos níveis de GSH a partir do modelo de úlceras gástricas induzidas por etanol em ratos... 83
Gráfico 8. Efeito da administração oral do EEtOH-Cs, FAT-Cs e carbenoxolona nos níveis de IL-1β (a), TNF-α (b) e IL-10 (c) a partir do modelo de úlceras gástricas induzidas por etanol em ratos... 84
Gráfico 9. Efeito da administração oral do EEtOH-Cs (A), FAT-Cs (B) e lansoprazol na úlcera duodenal induzida por cisteamina em ratos...
86
AA AC
Ácido araquidônico Ciclase de adenilil
ACh Acetilcolina
AINE Anti-inflamatório não esteroidal
ALU Área de lesão ulcerativa
AMPc 3’,5’- monofosfato cíclico de adenosina ANOVA Análise de variância de uma via
CagA Ca2+
Citotoxina associada ao gene A Íon cálcio
CAT Catalase
CBioTEC Centro de Biotecnologia
CCK Colecistocinina
CCK-1 Receptor de colecistocinina tipo 1 CCK-2 Receptor de colecistocinina tipo 2 CCS
CEUA
Centro de Ciências da Saúde Comitê de Ética em Uso Animal CGRP
Cl
-Peptídeo relacionado ao gene da calcitonina Íon cloreto
CRF Fator de liberação da corticotropina
CSPP-28 Fosfoproteína sensível a concentração de Ca2+
CoQ10 Coezima Q10
CO2 Dióxido de carbono
COX COX-1 COX-2 COX-3
Ciclooxigenase Ciclooxigenase tipo 1 Ciclooxigenase tipo 2 Ciclooxigenase tipo 3
DAG Diacilglicerol
DL50 Dose Letal 50%
DNA DP
Ácido desoxirribonucleico Receptor de PGD2
d.p. Desvio padrão da média
EEtOH-Cs Extrato etanólico bruto obtido das partes aéreas de
Cissampelos sympodialis EGF
EGF-R
Fator de crescimento epidérmico
Receptor do fator de crescimento epidérmico eNOS Sintase de óxido nítrico endotelial
e.p.m. Erro padrão da média
EP EP1 EP2 EP3 EP4 ERNs
Receptor de prostaglandina E Receptor de prostaglandina E tipo 1 Receptor de prostaglandina E tipo 2 Receptor de prostaglandina E tipo 3 Receptor de prostaglandina E tipo 4 Espécies reativas de nitrogênio EROs
FAT-Cs
Espécies reativas de oxigênio
Fração de alcaloides totais obtida das partes aéreas de Cissampelos sympodialis
FGF FP
Fator de crescimento de fibroblastos Receptor de PGF
GCs Ciclase de guanilil solúvel
Gi GIP
Proteína G inibitória
Polipeptídeo gástrico inibitório
GS Proteína G estimulatória
Gq/11 Proteína Gq ou proteína 11
GMPc GPCR
Monofosfato cíclico de guanosina Receptor acoplado a proteína G
GPx Glutationa peroxidase
GR GRP
Glutationa redutase
Peptídeo liberador de gastrina
GSH Glutationa reduzida
GSSH Glutationa oxidada
H+ HCl HCO3-
Íon hidrogênio Ácido clorídrico Íon bicarbonato
HE Hematoxilina e eosina H2O2
HO2.
Peróxido de hidrogênio Radical hidroperoxila HPA
HP-NAP
Hipotálamo-pituitária-adrenal Proteína ativada por neutrófilos HSP
ICAM-1 IgE
Proteína de choque térmico Molécula de adesão tipo 1 Imunoglobulina E
IL-1 Interleucina 1 beta
IL-6 Interleucina 6
IL-8 Interleucina 8
IL-10 INF-
Interleucina 10 Interferon gama
IP3 1,4,5-trisfosfato de inositol
IPeFarM Instituto de Pesquisa em Fármacos e Medicamentos
i.p. Via intraperitoneal
ILU Índice de Lesão Ulcerativa
iNOS KATP Kir
Sintase de óxido nítrico induzível Canais de potássio sensíveis ao ATP Subunidade retificadora
L-NAME N-nitro-L-arginina metil éster
LPS Lipopolissacarídeo
LT Leucotrieno
M3 Receptor muscarínico tipo 3
MDA Malondialdeído
mMol Mili mol
MPO Mieloperoxidase
NA Na+
Noradrenalina Íon sódio
NEM N-etilmaleimida
nNOS Sintase de óxido nítrico neuronal
NP-SH Compostos não proteícos sulfidrílicos
O2 Oxigênio molecular
O2.- Ânion superóxido
OECD Organisation for Economic Cooperation and Development OH.
OMS ONOO- OVA
Radical hidroxila
Organização Mundial de Saúde Peroxinitrito
Ovoalbumina
PAS Ácido periódico de Schiff
PDGF Fator de crescimento derivado de plaquetas
PG Prostaglandina
PGE2 Prostaglandina da série E2
PGD2 Prostaglandina da série D2
PGF2 PGH2
Prostaglandina da série 2
Prostaglandina H2
PGI2 pH
Prostaciclina
Potencial hidrogeniônico
PK proteína quinase
PKA Proteína quinase dependente de AMPC
PKG PLA2
Proteína quinase dependente de GMPc
Fosfolipase A2
PLC- 1 Fosfolipase C beta 1
PNA PNPMF
Peptídeo natriurético atrial
Programa Nacional de Plantas Medicinais e Fitoterápicos PPgPNSB Programa de Pós-graduação em Produtos Naturais e
Sintéticos Bioativos
RENAFITO RENISUS
Relação Nacional de Plantas Medicinais e Fitoterápicos Relação Nacional de Plantas Medicinais de Interesse ao SUS
s.c. Subcutânea
SH Compostos sulfidrila
SNAS Sistema nervoso autônomo simpático
SNC Sistema nervoso central
SNE Sistema nervoso entérico
SOD Superóxido dismutase
SSTR2 SUR
Receptor de somatostatina tipo 2 Subunidade receptora de sulfonilureia
SUS Sistema Único de Saúde
TFF Fator trefoil
TGF- Fator de transformação de crescimento alfa
TGI Trato gastrintestinal
TNF-α Fator de necrose tumoral alfa TRF Fator de liberação da tireotropina TRH
TXA2
Hormônio liberador de tireotrofina Tromboxano A2
TSH Hormônio estimulante da tireoide
VacA Citotoxina vacuolizante A
UFPB Universidade Federal da Paraíba
UFRN Universidade Federal do Rio Grande do Norte VEGF Fator de crescimento endotelial vascular
v.o. Via oral
Obs: As abreviaturas, siglas e símbolos utilizados neste trabalho e que não constam nesta relação, encontram-se descritas no texto ou são convenções adotadas universalmente.
RESUMO ... VIII
ABSTRACT ... IX
LISTA DE FIGURAS ... X
LISTA DE TABELAS ... XII
LISTA DE GRÁFICOS ... XIII
LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS ... XIV
1 INTRODUÇÃO ... 2
1.1 Considerações gerais... 2
1.2 Úlcera péptica... 4
1.2.1 Etiologia da úlcera péptica... 4
1.2.2 Epidemiologia da úlcera péptica... 5
1.2.3 Fisiologia gastrintestinal... 7
1.2.3.1 Secreção gástrica... 7
1.2.3.2 Mecanismos de proteção da mucosa gástrica... 12
1.2.3.2.1 Defesa pré-epitelial... 12
1.2.3.2.2 Defesa e reconstituição epitelial... 14
1.2.3.2.3 Defesa sub-epitelial... 16
1.2.3.2.3.1 Fluxo sanguíneo... 16
1.2.3.2.3.2 Inervação sensorial ... 16
1.2.3.3 Fatores que modulam a mucosa gástrica... 17
A) Óxido nítrico e KATP... 17
B) Prostaglandinas... 18
C) Grupamentos sulfidrila (SHs)... 20
D) Sistema antioxidante... 20
E) Citocinas... 22
1.2.4 Fatores agressores da mucosa gástrica e duodenal... 24
1.2.4.4 Helicobacter pylori... 27
1.2.4.5 Cisteamina hidroclorídrica... 29
1.2.5 Terapia da úlcera péptica... 29
1.2.6 Produtos naturais... 32
1.2.6.1 Plantas medicinais... 33
1.3 Espécie selecionada para estudo... 34
1.3.1 Cissampelos sympodialis Eichl.... 34
1.3.1.1 Estudos químicos... 35
1.3.1.2 Ensaios toxicológicos e farmacológicos de C. sympodialis... 37
2 OBJETIVOS ... 43
2.1 Objetivo Geral ... 43
2.2 Objetivos Específicos ... 43
3 MATERIAL E MÉTODOS ... 45
3.1 Material ... 45
3.1.1 Local da Pesquisa ... 45
3.1.2 Material Botânico ... 45
3.1.2.1 Obtenção do extrato etanólico e fração de alcaloides totais... 45
3.1.3 Animais... 46
3.1.4 Drogas utilizadas ... 48
3.2 Métodos... 48
3.2.1 Ensaio toxicológico pré-clínico agudo do EEtOH-Cs e da FAT-Cs... 49
3.2.2 Avaliação da atividade antiulcerogênica do EEtOH-Cs e da FAT-Cs... 50
3.2.2.1 Modelos de indução aguda de úlcera gástrica... 52
3.2.2.1.1 Úlceras gástricas induzidas por etanol... 52
3.2.2.1.1.1 Análise histológica... 53
3.2.2.1.2 Úlceras gástricas induzidas por anti-inflamatório não-esteroidal... 53
3.2.3 Investigação dos mecanismos de ação envolvidos na atividade gastroprotetora do EEtOH-Cs e da FAT-Cs...
54
3.2.3.1 Mecanismo antissecretório ou neutralizante... 54
3.2.3.1.1 Avaliação dos parâmetros bioquímicos do suco gástrico após ligadura do piloro (v.o./i.d.)... 55
3.2.3.2 Mecanismos citoprotetores... 55
3.2.3.2.1 Avaliação da participação dos grupamentos sulfidrílicos (SHs) na gastroproteção... 55
3.2.3.2.2 Avaliação da participação do óxido nítrico (NO) na gastroproteção.... 56
3.2.3.2.3 Avaliação da participação dos canais de potássio sensíveis ao ATP (KATP) na gastroproteção...
56
3.2.3.2.4 Quantificação da concentração de muco aderido à parede gástrica... 57
3.2.3.2.5 Avaliação da participação das prostaglandinas (PGs) na gastroproteção... 58
3.2.3.3 Atividade antioxidante... 58
3.2.3.3.1 Extração dos componentes citosólicos... 58
3.2.3.3.2 Determinação das proteínas totais... 58
3.2.3.3.3 Determinação dos níveis de GSH... 59
3.2.3.4 Mecanismo imunorregulatório... 59
3.2.3.4.1 Determinação das interleucinas... 59
3.2.4 Modelo de indução aguda de úlcera duodenal... 60
3.2.4.1 Úlceras duodenais induzidas por cisteamina... 60
3.3 Análise estatística... 60
4 RESULTADOS... 62
4.1 Ensaio toxicológico pré-clínico agudo do EEtOH-Cs e da FAT-Cs... 62
4.2 Avaliação da atividade antiulcerogênica do EEtOH-Cs e da FAT-Cs... 64
4.2.1 Úlceras gástricas induzidas por etanol... 64
4.2.1.1 Análise histológica... 66
4.3 Investigação dos mecanismos de ação envolvidos no efeito gastroprotetor do EEtOH-Cs e da FAT-Cs...
72
4.3.1 Mecanismos antissecretórios ou neutralizantes... 72
4.3.1.1 Avaliação dos parâmetros bioquímicos do suco gástrico após ligadura do piloro... 72
4.3.2 Mecanismos citoprotetores... 73
4.3.2.1 Avaliação do envolvimento dos grupamentos sulfidrila (SH) na atividade gastroprotetora do EEtOH-Cs e da FAT-Cs...
73
4.3.2.2 Avaliação da participação do óxido nítrico (NO) na atividade gastroprotetora do EEtOH-Cs e da FAT-Cs...
76
4.3.2.3 Avaliação da participação dos canais de potássio sensíveis ao ATP (KATP) na atividade gastroprotetora do EEtOH-Cs e da FAT-Cs...
78
4.3.2.4 Quantificação do muco aderido à mucosa gástrica... 80
4.3.2.5 Avaliação da participação das prostaglandinas no efeito gastroprotetor do EEtOH-Cs e da FAT-Cs...
81
4.3.3 Investigação da atividade antioxidante... 82
4.3.3.1 Determinação dos níveis de GSH... 82
4.3.4 Investigação da atividade imunorregulatória... 83
4.3.4.1 Quantificação das citocinas IL-1β, IL-10 e TNF-α teciduais... 83
4.4 Atividade antiulcerogênica duodenal do EEtOH-Cs e da FAT-Cs... 85
4.4.1 Úlceras duodenais induzidas por cisteamina... 85
5 DISCUSSÃO ... 88
6 CONCLUSÃO ... 108
7 PERSPECTIVAS ... 110
REFERÊNCIAS ... 112
1 INTRODUÇÃO
1.1 Considerações gerais
Nos últimos anos tem sido verificado um aumento no interesse pelos produtos naturais, especialmente organismos vegetais, como fontes de novos bioprodutos com atividade biológica (BRAZ-FILHO, 2010). Além de serem utilizados na medicina popular como remédios, os produtos naturais têm servido como fonte e inspiração para uma grande parte da farmacopeia atual. Estima-se que entre 25% a 50% dos medicamentos comercializados atualmente foram desenvolvidos a partir de produtos naturais (KINGSTON, 2011).
O crescente interesse nas terapias naturais deve-se a utilização de plantas medicinais por parte da população mundial, considerando as suas propriedades curativas, bem como, pelo seu valor nutricional (ERNST, 1988;
CINDRIĆ et al., β01γ).
Cerca de 80% da população dos países subdesenvolvidos e em desenvolvimento, como o Brasil, faz uso de espécies vegetais nas necessidades primárias de saúde (BRAZ-FILHO, 2010).
O Brasil é privilegiado e disponta como um dos países com maior biodiversidade do mundo, considerando que ele abriga em torno de 20% de todas as espécies vegetais do planeta (KATO, 2001; COSTA-LOTUFO et al., 2010). Essas espécies encontram-se distribuídas em zonas biogeográficas distintas, chamadas de biomas (Mata Atlântica, Cerrado, Pantanal, Caatinga, entre outros), que concentram em torno de 60 mil espécies vegetais (ELISABETSKY; COSTA-CAMPOS, 1996; COSTA-LOTUFO et al., 2010).
A biodiversidade do Brasil representa um grande potencial para o desenvolvimento de novos medicamentos. Para a população e, especialmente para os pesquisadores brasileiros, a riqueza biológica do país é de grande importância científica, social, econômica, cultural e ambiental (COSTA-LOTUFO et al., 2010). Segundo Braz-Filho, (β010) essa riqueza de ―potencial
químico adormecido‖ é oriunda de um acervo natural de vegetais existentes
nos ambientes aquáticos e terrestres, entretanto, os recursos são escassos no que diz respeito às pesquisas para o seu conhecimento e utilização.
(PNPMF) no Sistema Único de Saúde (SUS). Estas políticas tiveram como objetivo oferecer para a população a utilização segura e racional de plantas medicinais e fitoterápicos, bem como, contribuir de forma complementar no tratamento dos agravos à saúde (BRASIL, 2006; BRASIL, 2008).
Entre as afecções que acometem a saúde do homem encontram-se os transtornos do trato gastrintestinal (TGI), a exemplo da úlcera péptica que caracteriza-se como um problema de saúde pública mundial, cujo aumento de sua incidência e prevalência está relacionado a fatores cotidianos como condições de vida estressantes, hábitos alimentares e culturais, infecções bacterianas e uso contínuo de medicamentos, tais como os anti-inflamatórios não esteroidais (AINEs) (MEGALA; GEETHA, 2010).
Há uma busca incessante na identificação de novas estratégias terapêuticas, para tratar os distúrbios do TGI, em especial da úlcera péptica e que possam oferecer melhor segurança e eficácia que os medicamentos disponíveis no mercado. Muitas espécies vegetais apresentam um grande potencial para tratar a úlcera péptica e outros distúrbios gastrintestinais, tendo muitas delas, indicação popular a exemplo de Maytenus ilicifolia (BANSAL et al., 2009; AWAAD; EL-MELIGY; SOLIMAN, 2013).
Nesta perspectiva, foram propostos os ensaios realizados nesse trabalho com a espécie C. sympodialis, utilizada popularmente para o tratamento de infecções do trato geniturinário, inflamações, diarreia e doenças no trato respiratório, particularmente a asma (CORRÊA, 1984; SEMWAL et al., 2014; SILVA et al., 2015a). Em estudos anteriores, já foi demonstrada a atividade antidiarreica dessa espécie (SALES et al., 2015). Diante da relevância dos resultados aqui obtidos, foi proposto o estudo dessa espécie vegetal (extrato e fração de alcaloides) frente aos diferentes modelos de indução aguda de úlcera péptica.
1.2 Úlcera péptica
1.2.1 Etiologia da úlcera péptica
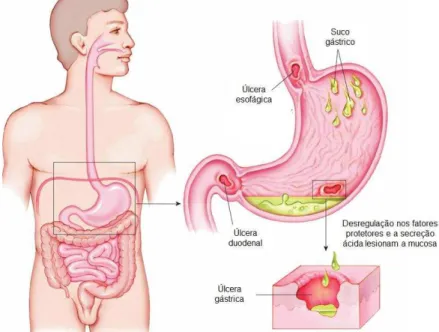
A úlcera péptica é uma doença complexa e multifatorial caracterizada pela presença de pontos hemorrágicos e/ou lesões necrotizantes que acometem o esôfago, estômago ou duodeno. Essas lesões, de acordo com parâmetros histopatológicos, consistem em danos epiteliais que podem acometer a camada mucosa, submucosa, podendo atingir a camada muscular (TARNAWSKI, 2005; MALFERTHEINER; CHAN; MCCOLL, 2009; TARNAWSKI; AHLUWALIA, 2012; NIETO, 2012) (Figura 1).
A depender da severidade e localização dessa lesão, pode ocorrer o comprometimento dos componentes do tecido epitelial e conectivo (mucosa) até danos em células do músculo liso, vasos e nervos (TARNAWSKI et al., 1990; TARNAWSKI; AHLUWALIA, 2012).
Figura 1. Representação esquemática da área de ocorrência da úlcera péptica (esofágica, gástrica e duodenal)(Adaptado de: <http://edgarysross.soup.io>)
endoteliais de proliferação que forma os microvasos sanguíneos (TARNAWSKI, 2010; TARNAWSKI; AHLUWALIA, 2012).
A sintomatologia clássica do indivíduo com úlcera péptica é a dor ou desconforto abdominal (NIETO, 2012), êmese, sensação de plenitude, refluxo, azia e fadiga. Em casos mais graves podem ocorrer hemorragias que são uma das queixas mais comuns na emergência médica e caracteriza a principal complicação da úlcera péptica (MALFERTHEINER; CHAN; MCCOLL, 2009; WONG; SUNG, 2013) e a perfuração que atinge 2-5% nos casos de úlcera gástrica e 6-11% dos portadores da úlcera duodenal (CASALI et al., 2012).
É importante considerar que a depender do tipo de úlcera ocorre uma diferença na manifestação dos sintomas. Em indivíduos com úlcera gástrica a dor localiza-se na região epigástrica antes da ingestão de alimentos e normalmente está associada com a falta de apetite e perda de peso. Já nos portadores da úlcera duodenal a dor ocorre na região epigástrica com sensação de ardência que surge 2-3 horas após as refeições e que diminui com a ingesta de alimentos (NIETO, 2012).
Com relação a sua patogênese, a úlcera péptica surge a partir de um desequilíbrio entre os fatores protetores e agressores da mucosa do trato gastrintestinal (LAINE; TAKEUCHI; TARNAWSKI, 2008; FARZAEI; ABDOLLAHI; RAHIMI, 2015). Como exemplos de fatores agressores têm-se a secreção ácido-péptica, refluxo biliar, infecção por Helicobacter pylori, ingesta excessiva de álcool, estilo de vida estressante, tabagismo e o uso contínuo de anti-inflamatórios não-esteroidais (AINEs). Entre os fatores defensivos da mucosa destacam-se a monocamada de fosfolipídeos de membrana, secreção de muco e bicarbonato, fluxo sanguíneo, prostaglandinas e o sistema antioxidante (CRYER, 2001; ZHENG et al., 2014; FARZAEI; ABDOLLAHI; RAHIMI, 2015).
1.2.2 Epidemiologia da úlcera péptica
A alta prevalência dessa doença também está relacionada com o envelhecimento populacional e o aumento da utilização de AINEs (LAU et al., 2011). Indivíduos que fazem uso de AINES e são infectados pela H. pylori são mais vulneráveis para o desenvolvimento de úlcera péptica (ZAPATA-COLINDRES et al., 2006; LAU et al., 2011).
Mais da metade da população mundial é infectada pela H. pylori, e cerca de 20% dos indivíduos infectados desenvolvem a úlcera péptica. Há estimativas que 90% dos indivíduos com úlcera duodenal são infectados pelo
H. pylori e para a úlcera gástrica esse percentual é de 60-80% (MARSHALL, 1994; BLASER, 1997; NIETO, 2012).
A úlcera duodenal é o tipo mais comum da úlcera péptica (BARAZANDEH et al., 2012), sendo 2-4 vezes mais prevalente que a úlcera gástrica (SONNENBERG; EVERHART, 1997; KHOMENKO et al., 2009).
Em um levantamento epidemiológico realizado por Groenen e colaboradores (2009), foi verificado que em países ocidentais, as úlceras duodenais são mais prevalentes quando comparadas às úlceras gástricas. O gênero mais acometido é o masculino, que corresponde a 58% dos indivíduos portadores da úlcera duodenal e 51% na úlcera gástrica. Com relação à faixa etária, indivíduos acometidos com as úlceras gástricas fazem parte de uma população com idade mais avançada com faixa etária entre 60-70 anos (média: 66 anos) e que inicia-se geralmente após os 50 anos. Enquanto que a úlcera duodenal acomete faixa etária entre 50-60 anos (média: 57 anos) podendo ter início após os 20 anos de idade.
No Brasil, devido às subnotificações, os estudos epidemiológicos sobre a úlcera péptica são escassos e há uma estimativa que, cerca de 1-20% da população seja acometida por esta doença (CASTRO et al., 2009).
Na Paraíba, não há indicadores epidemiológicos definidos, no entanto, as úlceras gástricas e duodenais representaram em torno de 0,05% das internações nos hospitais da rede pública de João Pessoa em 2012 (SOUZA et al., 2013)
1.2.3 Fisiologia gastrintestinal 1.2.3.1 Secreção gástrica
O trato gastrintestinal (TGI) é um tubo longo e oco que se estende desde a boca até o ânus, sendo composto majoritariamente por camadas musculares (músculo liso), tecido conectivo, vasos sanguíneos, tecido linfoide e glândulas (CAMPBELL, 2014).
Entre o esôfago e o intestino delgado há uma extensão do TGI denominada estômago, esse órgão está envolvido na ativação enzimática, absorção de nutrientes, bem como, na digetão dos alimentos (FREEDBERG; ABRAMS, 2013; WALDUM; HAUSO; FOSSMARK, 2014; SCHUBERT, 2014). Em se tratando dessa última função, o estômago funciona como um órgão de armazenamento onde o bolo alimentar é processado em uma pasta chamada quimo (BERRIDGE, 2014).
O estômago é dividido em três regiões: fundo, corpo e antro. Cada uma dessas regiões possui células específicas. No fundo e no corpo o epitélio forma as glândulas gástricas onde são encontradas as células secretoras de muco e bicarbonato (células mucosas do colo), células-chefe que secretam pepsinogênio e as células parietais que secretam o ácido clorídrico e o fator intríseco. No antro gástrico não há células parietais, mas há as células G que secretam a gastrina (BERRIDGE, 2014; SCHUBERT, 2014).
Na região oxíntica juntamente com as células parietais são encontradas as células semelhantes às células enterocromafins (ECL) que secretam histamina. Próximo ao piloro gástrico há também as células D que secretam somatostatina e amilina, células X/A que secretam grelina e obestatina e as células enterocromafins que secretam serotonina, peptídeo natriurétrico atrial e adrenomedulina (CHU; SCHUBERT, 2012).
A secreção gástrica é constituída pelo pepsinogênio, íon bicarbonato (HCO3-), muco livre, eletrólitos, fator intrínseco, ácido clorídrico (HCl), gastrina
Essa secreção tem fundamental importância na digestão péptica dos alimentos, na regulação do esvaziamento gástrico e na distribuição de nutrientes para o intestino delgado (FRY, 2009).
As células parietais, localizadas na região do corpo e fundo estomacal, são responsáveis por produzir e secretar ácido gástrico na região glandular gástrica (BERRIDGE, 2014). Estima-se que, diariamente, sejam secretados em torno de três litros de ácido a uma concentração de aproximadamente 160 mMol ou pH 0,8, sendo o pH diário médio no lúmen do estômago humano de aproximadamente 1,4 (JOHANSSON; SYNNERSTAD; HOLM, 2000; DI MARIO; GONI, 2014).
O ácido gástrico facilita a digestão de proteínas por meio da conversão do pepsinogênio em pepsina (enzima proteolítica ativa) (CHU; SCHUBERT, 2013; SCHUBERT, 2014). Além disso, o ácido gástrico é importante na absorção do ferro, cálcio, vitamina B12, e certos medicamentos (por exemplo, tiroxina e cetoconazol), além de impedir o crescimento excessivo de bactérias (FREEDBERG; ABRAMS, 2013; WALDUM; HAUSO; FOSSMARK, 2014; SCHUBERT, 2014).
A secreção ácida gástrica é o resultado da interação das vias endócrina (representada pela gastrina), parácrina (histamina e somatostatina) e a neural (acetilcolina - ACh) (BERRIDGE, 2014; SCHUBERT, 2014).
A secreção gástrica compreende três fases distintas: a fase cefálica, fase gástrica e a fase intestinal. Durante a fase cefálica da digestão que é controlada somente pelo cérebro, ocorre a geração de sinais que irão iniciar a secreção de ácido via inervação vagal que é ativada por estímulos sensoriais como visão, olfato e gustação (MCCOLL; EL-OMAR, 2002; DI MARIO; GONI, 2014).
A fase gástrica é mais importante que as demais fases. Durante essa etapa, a secreção é amplificada tanto por estímulos químicos como por estímulos mecânicos que se iniciam a partir da presença do bolo alimentar no lúmen estomacal. Há também um aumento no fluxo sanguíneo para suprir as necessidades metabólicas das células que secretam ativamente o ácido (MCCOLL; EL-OMAR, 2002; DI MARIO; GONI, 2014).
presença de aminoácidos e peptídeos no lúmen intestinal e pela diminuição na capacidade de tamponamento do intestino com consequente aumento do pH. Nessa fase ocorre a ativação de uma retroalimentação negativa da secreção ácida que envolve vias parácrinas e endócrinas, como a secreção de colecistocinina (MCCOLL; EL-OMAR, 2002; DI MARIO; GONI, 2014).
A secreção ácida gástrica envolve mediadores que estimulam a secreção, chamados de secretagogos como ACh, histamina, gastrina e grelina, além de substâncias que inibem a secreção como a somatostatina e a prostaglandina E2 (SCHUBERT, 2014; BERRIDGE, 2014).
Os neurônios pós-ganglionares inervam as células semelhantes às células enterocromafins (ECL) que liberam histamina pela ativação de receptores muscarínicos tipo 3 (M3) e também liberam ACh para atuar
diretamente na célula parietal e nas ECL. O nervo vago também induz a liberação do peptídeo liberador de gastrina (GRP) no antro estomacal, o qual libera gastrina pela ação nas células G. A gastrina entra na corrente sanguínea e é transportada para a região fúndica onda irá atuar nas ECL, nas células D e nas células parietais, ligando-se em receptores CCK2 (Figura 2) (CHU;
SCHUBERT, 2013; BERRIDGE, 2014; SCHUBERT, 2014).
Figura 2. Mecanismo de secreção ácida gástrica (Adaptado de BERRIDGE, 2014).
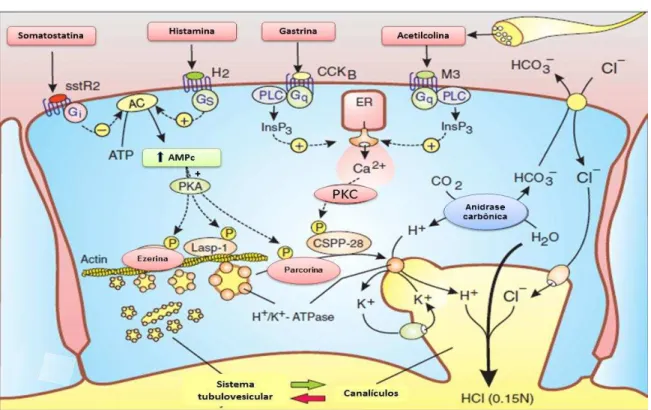
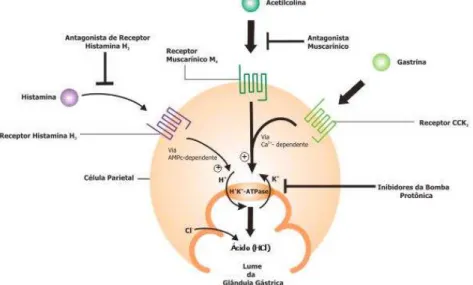
A célula parietal é estruturalmente formada por um sistema tubovesicular e após o seu estímulo esse sistema remodela-se e funde-se a membrana apical formando uma rede de canalículos secretores que irão facilitar a secreção de ácido. Na membrana basolateral da célula parietal ocorre a ação da ACh, gastrina e histamina em receptores M3, CCK2 e H2, respectivamente
(Figura 3) (CHU; SCHUBERT, 2013; BERRIDGE, 2014; SCHUBERT, 2014).
Figura 3. Sinalização na célula parietal (Adaptado de BERRIDGE, 2014).
Legenda: mecanismos moleculares de ação das substâncias que regulam a secreção ácida gástrica na membrana basolateral das células parietais. A gastrina, acetilcolina e histamina estimulam, enquanto que a somatostatina inibe a secreção ácida.
A ativação de receptores M3 e CCK2 que encontram-se acoplados a
proteína heterotrimérica Gq/11, leva a um aumento nas concentrações do íon
cálcio (Ca2+) e a ativação da fosfolipase C beta-1 (PLC- 1). O aumento das
concentrações de Ca2+ é o estímulo para a translocação das vesículas
contendo a H+-K+ATPase, inativa, para a região apical das células parietais
tornando-a ativa. Além disso, a PLC- 1irá fosforilar alvos intracelulares como a
fosfoproteína sensível ao cálcio de 28 kDa (CSPP-28) que irá auxiliar na transferência das vesículas para a membrana apical (BERRIDGE, 2014).
A ação da histamina em receptores H2 na célula parietal envolve a
ativação da proteína G estimulatória (Gs), que ativa a enzima ciclase de adenilil (AC), o que gera o γ‘,5‘-monofosfato cíclico de adenosina (AMPC). O aumento
das concentrações intracelulares de AMPc, ativa a proteína cinase dependente de AMPC (PKA) que irá fosforilar alvos como ezerina, Lasp-1 e parcorina, que
estão envolvidas no transporte e fusão das vesículas contendo a H+-K+ATPase
para a região apical. Após fundir-se com a membrana apical da célula parietal a H+-K+ATPase encontra-se ativada e promove a extrusão do íon hidrogênio (H+)
e a entrada do íon potássio (K+) para o interior da célula. O gradiente
eletroquímico criado pela saída do H+ favorece a saída do íon cloreto (Cl-), que no lúmen formam o ácido clorídrico (HCl) (CHU; SCHUBERT, 2013; BERRIDGE, 2014).
A gastrina liberada pelas células G no antro gástrico e em menor quantidade no duodeno estimula a secreção ácida de forma direta pela ligação nos receptores CCK2 das células parietais, e indiretamente pela ativação dos
mesmos receptores nas células ECL que culminam com a liberação de histamina. A grelina estimula a secreção ácida gástrica por aumentar a liberação de histamina nas células ECL (BERRIDGE, 2014; SCHUBERT, 2014).
A inibição da secreção ácida gástrica inicia-se pelos próprios mecanismos que a estimulam. A gastrina, além de atuar como um dos maiores secretagogos, age nas células D induzindo a liberação de somatostatina que por um mecanismo de retroalimentação negativa inibe a secreção de gastrina. Essas células possuem grandes projeções citoplasmáticas que permitem um contato com as células G e com a célula parietal (ação parácrina) apresentando sensores da concentração de H+ que, quando elevada, também
estimula a secreção de somatostatina. A ação da somatostatina na célula pariental é mediada pelos receptores do tipo sstR2, acoplados a proteína G
inibitória (Gi) que uma vez ativada diminui as concentrações intracelulares de AMPc e compromete o processo de extrusão e ativação da H+-K+ATPase (CHU; SCHUBERT, 2013; BERRIDGE, 2014; SCHUBERT, 2014).
Outros mediadores químicos como a PGE2, PGI2, CGRP
A secreção de HCl mantém o pH do lúmen gástrico muito baixo (pH: 1,0). Devido a esse microambiente hostil que compromete a integridade das células da mucosa, o organismo desenvolveu além da própria inibição da secreção, mecanismos de proteção contra a autodigestão pela secreção ácida (BERRIDGE, 2014).
1.2.3.2 Mecanismos de proteção da mucosa gástrica
A manutenção da homeostasia do trato gastrintestinal (TGI) envolve o entendimento de mecanismos que mantém a integridade morfofuncional desse sistema, mesmo diante da exposição diária a inúmeros agentes agressores químicos, físicos e biológicos (LAINE; TAKEUCHI; TARNAWSKI, 2008; TULASSAY; HERSZÉNYI, 2010).
Há mecanismos tão específicos em termos celulares que são capazes de diferenciar bactérias comensais de bactérias invasoras (SOMMER; BACKHED, 2013).
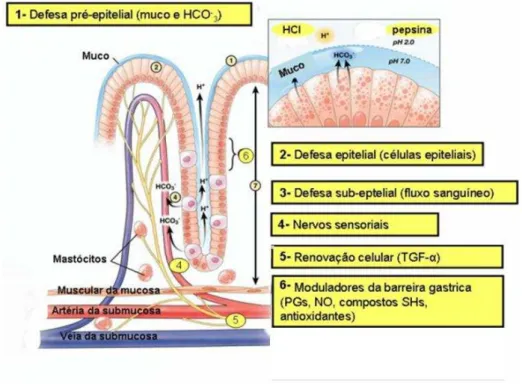
Os mecanismos de defesa da mucosa gástrica (Figura 4) envolvem sistemas locais e neuro-hormonais que compreendem: fatores pré-epiteliais (muco, íons bicarbonato, fosfolipídios de membrana e o ácido gástrico); fatores epiteliais (células epiteliais, fatores de crescimento e renovação celulares) e fatores sub-epiteliais (inervação sensorial, fluxo sanguíneo, fatores que atuam na reconstituição do epitélio e os moduladores da barreira gástrica - prostaglandinas, óxido nítrico e o sistema antioxidante) (LAINE; TAKEUCHI; TARNAWSKI, 2008; NAYEB-HASHEMI; KAUNITZ, 2009; TARNAWSKI, AHLUWALI; JONES, 2014).
1.2.3.2.1 Defesa pré-epitelial:
LAINE; TAKEUCHI; TARNAWSKI, 2008; TARNAWSKI; AHLUWALIA; JONES, 2014).
O muco é um gel transparente, viscoso e aderente formado por cerca de 95% de água e 5% de glicoproteínas (mucina), além de pequenas quantidades de lipídios, ácidos nucléicos e proteínas que revestem toda a mucosa gastrintestinal (ATUMA et al., 2001; LAINE; TAKEUCHI; TARNAWSKI, 2008).
Figura 4. Fatores protetores da mucosa gástrica (Adaptado de LAINE; TAKEUCHI; TARNAWSKI, 2008).
A mucina é secretada na região apical das células epiteliais estimuladas por hormônios gastrintestinais (secretina), PGE2 e agentes colinérgicos. Após a
sua secreção, ocorre a polimerização de vários monômeros de mucina que se unem por pontes de dissulfeto (MONTROSE; YASUTADA; TAKEUCHI, 2006; LAINE; TAKEUCHI; TARNAWSKI, 2008).
Um fator determinante no papel protetor do muco é a espessura desse gel, pois quanto maior essa espessura melhor será a proteção oferecida para determinado órgão (PENISSI; PIEZZI, 1999; ARAWWAWALA; ARAMBEWELA; RATNASOORIYA, 2014)
estabilização e viscosidade da mucina (POULSOM; WRIGHT, 1993; LAINE; TAKEUCHI; TARNAWSKI, 2008).
Os íons bicarbonato que fazem parte da camada de muco gel são responsáveis por criar um gradiente de pH na superfície epitelial, que neutraliza o conteúdo ácido estomacal. Esses íons entram na célula por meio do cotransporte Na+-HCO
3- na membrana basolateral e são expelidos pelo
trocador Cl-- HCO
3-para o lúmen do estômago. Algumas substâncias modulam
a secreção de bicarbonato como as prostaglandinas, o ácido gástrico e a melatonina (ROSSMANN et al., 1999; ALLEN; FLEMSTRÖM, 2005; LAINE; TAKEUCHI; TARNAWSKI, 2008).
A mucosa gástrica dispõe de uma camada de fosfolipídios tensoativos que encontram-se agrupados acima do muco formando uma monocamada em contato direto com o lúmen gástrico. Os fosfolipídios possuem uma região polar voltada para a camada de muco e uma porção apolar (hidrofóbica) composta de ácidos graxos, voltada para o lúmen que dificulta a difusão dos íons H+ para as células epiteliais evitando assim a injúria gástrica (LICHTENBERGER, 1999; LAINE; TAKEUCHI; TARNAWSKI, 2008).
O ácido clorídrico ainda que seja um agente lesivo da mucosa gástrica também desempenha um papel protetor da mesma, tendo em vista que a sua acidez elevada é responsável pela desnaturação da imunoglobulina E (IgE) promotora da alergia alimentar, inativação de toxinas e eliminação de microrganismos ingeridos (vírus, bactérias entéricas, fungos e parasitas), evitando assim o seu crescimento (CHOI et al., 2011; CHU; SCHUBERT, 2012; SCHUBERT, 2014). Caso esse mecanismo químico de inativação de patógenos falhe, o agente invasor terá de enfrentar a barreira física para que encontre o epitélio gástrico.
1.2.3.2.2 Defesa e reconstituição epitelial
A segunda linha de defesa consiste de uma camada contínua de células epiteliais fortemente interligadas por junções do tipo gap. A qual previne a retrodifusão da secreção ácido-péptica e secreta muco, bicarbonato, prostaglandinas (PGs), proteínas do choque térmico (HSPs), catelicidinas
(MONTROSE; YASUTADA; TAKEUCHI, 2006; LAINE; TAKEUCHI; TARNAWSKI, 2008; TULASSAY; HERSZÉNYI, 2010).
Quando as células do epitélio gástrico são submetidas a alguma condição estressante ocorre a transcrição do fator de choque térmico 1 (HSF1) que, por sua vez, induz a produção das HSPs. Essas proteínas impedem que as células entrem em apoptose, por previnirem a desnaturação proteica intracelular (MATHEW; MORIMOTO, 1998; ISHIHARA et al., 2011). Especialmente, a chaperona HSP70 confere a célula uma resistência a agentes estressantes, estabilizando proteínas essenciais para o funcionamento da maquinaria celular e auxiliando na degradação de proteínas já desnaturadas. A perturbação no metabolismo das proteínas HSP também pode induzir injúria na mucosa em resposta às espécies reativas de oxigênio (MATHEW; MORIMOTO, 1998; ISHIHARA et al., 2011; LEUNG; REDLAK; MILLER, 2015).
As catelicidinas e as -defensinas são peptídeos que estão envolvidos
na imunidade inata, sendo que as primeiras exercem função antimicrobiana, enquanto que as segundas estão envolvidas nos processos de cicatrização da úlcera, bem como, na defesa da mucosa frente à colonização bacteriana (GUANÍ-GUERRA et al., 2010; BRIDLE et al, 2011).
O epitélio gástrico é constantemente renovado e esse processo leva em torno de 3-7 dias. O processo se inicia pelo envelhecimento das células epiteliais ou ainda por uma lesão que leve a morte das mesmas, ocorrendo assim uma translocação de células jovens presentes na região das glândulas gástricas (LAINE; TAKEUCHI; TARNAWSKI, 2008). As células-mãe que se encontram em constante proliferação recebem influência do fator de crescimento epidérmico (EGF), fator de crescimento de fibroblastos (FGF), fator de crescimento endotelial vascular (VEGF), fator de crescimento derivado de plaquetas (PDGF), entre outros (LAINE; TAKEUCHI; TARNAWSKI, 2008; TARNAWSKI; AHLUWALIA; JONES, 2014).
no remodelamento dos vasos promovendo a angiogênese para suprir a necessidade tecidual de nutrientes e oxigênio (TARNAWSKI; AHLUWALIA; JONES, 2014).
1.2.3.2.3 Defesa sub-epitelial 1.2.3.2.3.1 Fluxo sanguíneo
Os microvasos que irrigam a mucosa gástrica são responsáveis pelo suprimento de oxigênio e de nutrientes para as células daquela região e também atuam mantendo o equilíbrio ácido-base no tecido por meio de um pH do microambiente relativamente elevado. Em casos de acidose tecidual podem ocorrer danos na mucosa gástrica (WALLACE; MCKNIGHT, 1990;WALLACE, 2008; TULASSAY; HERSZÉNYI, 2010; RAMSAY; CARR, 2011).
Quando ocorre um processo de lesão/irritação da mucosa, devido essa região ser extremamente vascularizada, ocorre um aumento significativo no fluxo sanguíneo na tentativa de drenar o conteúdo ácido e impedir a lesão nas células epiteliais. Esse processo envolve tanto ativação dos nervos aferentes sensoriais como também liberação de óxido nítrico (NO) (WALLACE; MCKNIGHT, 1990;WALLACE, 2008; LAINE; TAKEUCHI; TARNAWSKI, 2008).
O endotélio que reveste os vasos sanguíneos geram substâncias vasodilatadoras a exemplo do NO e prostaciclinas (PGI2) que apresentam
efeitos protetores na mucosa gástrica (GUTH, 1992; LAINE; TAKEUCHI; TARNAWSKI, 2008).
1.2.3.2.3.2 Inervação sensorial
A inervação sensorial consiste em um conjunto de fibras nervosas que se encontram distribuídas em torno dos vasos arteriais da mucosa gástrica. Essas fibras originam-se a partir de neurônios sensitivos espinhais e inervam o estômago por meio dos nervos esplânicos e mesentéricos bem como pelas fibras aferentes do nervo vago (HOLZER, 2007).
aumento do fluxo sanguíneo nos vasos que irrigam a mucosa gástrica. Essas fibras também são sensíveis ao conteúdo alimentar que se encontra no lúmen estomacal bem como ao aumento da secreção ácida gástrica (KONTUREK et al., 2010; WARZECHA et al., 2011; KWIECIEN et al., 2012).
1.2.3.3 Fatores que modulam a mucosa gástrica A) Óxido nítrico e KATP
O óxido nítrico (NO) é um gás lipossolúvel instável, com meia vida em torno de cinco segundos, originado de reações que convertem o aminoácido L-arginina em L-citrulina e NO pela ação da enzima sintase de óxido nítrico (NOS) (NAPOLI; IGNARRO, 2009).
A NOS existe em três isoformas: NOS neuronal (nNOS) expressa em neurônios e no músculo esquelético, a NOS endotelial (eNOS) expressa em células endoteliais e uma forma induzida (iNOS) expressa em macrófagos e monócitos, sendo essa última isoforma independente de Ca2+/calmodulina e produtora de uma grande quantidade de NO (efeito citotóxico) (NAPOLI; IGNARRO, 2001; NAPOLI et al., 2006; NAPOLI; IGNARRO, 2009).
No trato gastrintestinal, o óxido nítrico é produzido pelo endotélio dos vasos que irrigam a mucosa gástrica ou ainda liberado pelas terminações nervosas sensoriais (NAPOLI; IGNARRO, 2009; MAGIEROWSKI et al., 2015). Assim, o NO atua como modulador na mucosa gástrica por aumentar o fluxo sanguíneo e a angiogênese, estimular a secreção de muco e bicarbonato, inibir o estresse oxidativo, diminuir a degranulação de mastócitos e liberação de citocinas por macrófagos, e reduzir a adesão neutrofílica em células endoteliais (TANAKA et al., 2001; MAGIEROWSKI et al., 2015).
Quanto à ação protetora do NO, enquanto regulador da microcirculação sanguínea, na camada muscular dos vasos sanguíneos, ele se liga a guanilil ciclase solúvel (GCs), que aumenta os níveis intracelulares de monofosfato ciclico de guanosina (GMPc), e ativa a proteína cinase dependente de GMPc (PKG). Esta cinase induz uma série de fosforilações e, entre esses alvos fosforilados estão os KATP. Toda essa cascata de eventos resulta na diminuição
Os canais de potássio sensíveis ao ATP (KATP) são complexos
hetero-octaméricos, formados pelas subunidades retificadoras (Kir) e subunidades receptoras de sufonilureias (SUR). Eles foram originalmente descobertos em miócitos cardíacos e posteriormente identificados em vários tecidos, incluindo o músculo liso. O fechamento desses canais causa despolarização de membrana celular e contração da musculatura lisa (KO et al., 2008)
Os KATP são funcionalmente expressos nas células do músculo liso de
estômago de cobaias e a ativação da via NO/GMPc/KATP resulta em
mecanismos de proteção da mucosa gástrica (SIM et al., 2002; TRISTE et al., 2014). Esses canais também podem ser ativados pela sinalização promovida pelo CGRP. O bloqueio desses canais utilizando a glibenclamida, um hipoglicemiante oral, reverte o efeito de muitas drogas com atividade gastroprotetora (MURPHY; BRAYDEN, 1995; DOI et al., 1998; VIANA et al., 2013; TRISTE et al., 2014).
B) Prostaglandinas
As prostaglandinas (PGs) são mediadores lipídicos resultantes do metabolismo do ácido araquidônico (AA), um ácido graxo insaturado de 20 carbonos, que é liberado a partir da membrana plasmática pela ação da fosfolipase A2 (PLA2) e metabolizado em prostaglandina pelas enzimas
ciclooxigenases por uma série de reações de isomerizações (MITCHELL; WARNER, 1999; KAM; SO, 2009).
Há três isoformas da COX (COX-1, COX-2 e uma variante da COX-1 chamada de COX-3). No entanto, apenas a COX-1, constitutiva, e COX-2, induzível, levam à formação de eicosanoides, como as prostaglandinas (FORNAI et al., 2010).
A COX converte o ácido araquidônico (AA) em prostaglandina H2
(PGH2), que é o intermediário precursor dos eicosanoides: a prostaglandina da
série E2 (PGE2), prostaciclina (PGI2), prostaglandina D2 (PGD2), prostaglandina
Fβα (PGFβα) e tromboxano A2 (TXA2), sendo a PGE2 e a PGI2 responsáveis pela
gastroproteção (MITCHELL; WARNER, 1999; SIMMONS, 2003; KAM; SO, 2009; FORNAI et al., 2010).