Universidade de Trás-os-Montes e Alto Douro
Caracterização química dos extratos aquosos e hidro-etanólicos de
Tomilho vulgar (Thymus vulgaris L.), Tomilho bela-luz (Thymus
mastichina L.) e Tomilho limão (Thymus x citriodorus L.) e avaliação
da sua toxicidade usando modelos in vitro
Dissertação de Mestrado em Bioquímica
Sambrine Deolinda Jesus da Silva
Orientadora: Professora Doutora Amélia M. Lopes Dias da Silva
Coorientador: Professor Doutor Fernando Hermínio Ferreira Milheiro Nunes
Universidade de Trás-os-Montes e Alto Douro
Caracterização química dos extratos aquosos e hidro-etanólicos de
Tomilho vulgar (Thymus vulgaris L.), Tomilho bela-luz (Thymus mastichina
L.) e Tomilho limão (Thymus x citriodorus L.) e avaliação da sua toxicidade
usando modelos in vitro
Dissertação de Mestrado em Bioquímica
Sambrine Deolinda Jesus da Silva
Orientadora: Professora Doutora Amélia M. Lopes Dias da Silva
Coorientador: Professor Doutor Fernando Hermínio Ferreira Milheiro Nunes
Composição do Júri: _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ Data: ___________________________
Vila Real, 2014
“As doutrinas expostas neste trabalho são da exclusiva responsabilidade do autor”
Agradecimentos
Às pessoas seguidamente mencionadas, expresso o meu sincero reconhecimento e gratidão pelo papel importante, direto ou indireto, na realização deste trabalho.
Para começar gostaria de agradecer à Professora Doutora Amélia da Silva por se ter disponibilizado a ser minha orientadora da tese, pela sugestão do tema e pela ajuda prestada. Mas acima de tudo, um muito obrigado pela sua paciência e pelos seus ensinamentos enriquecedores.
Ao Professor Doutor Fernando Nunes um grande obrigado por ter aceitado ser o meu coorientador, agradeço a disponibilidade e prontidão, com que me apoiou desde o início deste trabalho.
Um especial agradecimento à Constance Santos por todos os momentos bem passados ao longo destes dois anos, sem ela não teria conseguido.
Ao pessoal do laboratório, principalmente ao Senhor Carlos, á Ana, ao André, á Juliana e á Joana obrigado por toda a ajuda prestada ao longo deste trabalho.
Um obrigado generalizado a todos os meus amigos tanto de Vila Real como de Ribeira de Pena por todo o apoio e incentivo que me deram ao longo desta fase.
Para terminar quero agradecer à minha família principalmente à minha mãe e ao meu avô por todo amor, carinho, amizade e paciência que tiveram comigo nesta fase da minha vida.
Resumo
As plantas medicinais são utilizadas há milhares de anos para fins curativos e terapêuticos. Muitas das estruturas químicas dos fármacos utilizados atualmente são baseadas em estruturas de produtos naturais, dos princípios ativos presentes nos extratos, ou nos óleos essenciais, que conferem às plantas medicinais, atividade terapêutica.
O tomilho vulgar (Thymus vulgaris L.) é uma planta da família Lamiaceae, sobre a qual têm sido efetuados vários estudos in vitro tendo-lhe sido atribuídas várias atividades medicinais importantes, como, atividades antimicrobianas, carminativas, expetorantes, antioxidantes e espasmolíticas, atividades estas atribuídas ao timol e ao carvacrol, componentes principais do seu óleo essencial.
O tomilho bela-luz (Thymus mastichina L.) é um pequeno arbusto, endémico da Península Ibérica. Esta planta possui um elevado efeito antioxidante, devido aos seus constituintes maioritários, o 1-8 cineol, o barneol e o linalol. As partes aéreas são usadas nas infeções das vias respiratórias e também nas digestões lentas, gastrites crónicas e dores espasmódicas do tubo digestivo.
O tomilho limão (Thymus x citriodorus) é considerado ser um hibrido entre o Thymus pulegioides e o Thymus vulgaris originário do Sul da Inglaterra. O extrato das folhas do tomilho limão, especialmente o seu óleo essencial é um poderoso antisséptico, desodorizante e desinfetante.
O objetivo deste trabalho foi obter uma breve caracterização química dos extratos aquosos e hidro-etanólicos do tomilho vulgar, tomilho bela-luz e do tomilho limão, bem como caracterizar o efeito da aplicação destes extratos nas linhas celulares HepG2 e Caco-2 (ensaios in vitro) para avaliar a sua potencial citotoxicidade
A caracterização fitoquímica dos extratos iniciais (aquoso e hidro-etanólico) e do seu fracionamento (fração aquosa e metanólica) foi analisada por HPLC e os principais compostos fenólicos encontrados nas extrações das amostras iniciais destas três espécies de tomilho foram a luteolina e seus derivados como a luteolina-7-O-glucosilada, o ácido cafeico e a apigenina e seus derivados como a apigenina-7-O-glucosilada, na fração metanólica para além dos compostos mencionados anteriormente também se detectou o ácido rosmarínico em todas as espécies e a epicatequina no tomilho vulgar.
A composição química dos óleos essenciais obtidos por hidrodestilação foi avaliada através da técnica GC-MS e revelou que os compostos maioritários no tomilho vulgar foram o
timol, o p-cimeno e o γ-terpineno, no tomilho bela-luz foi o 1-8 cineol, o α-terpineol e α-pineno e por fim no tomilho limão obtivemos o geraniol, o neral e o trans-cariofileno.
Aplicaram-se todos os extratos e frações obtidas às duas linhas celulares nas concentrações de 50, 100, 200 e 500 g/mL, a viabilidade celular foi medida ao fim de 24 e 48 h de exposição.
Podemos concluir que estas espécies apresentam uma forte atividade anticancerígena nos extratos que apresentam concentrações mais altas (200 e 500 µg/ mL) principalmente na fração metanólica onde se encontram a maioria dos compostos fenólicos.
Palavras-chave: Plantas aromáticas e medicinais; tomilho vulgar (Thymus vulgaris L.); tomilho bela-luz (Thymus mastichina L.); tomilho limão (Thymus x citriodorus L.); atividade anticancerígena; HPLC (composição química);
Abstract
The medicinal plants are used since thousands of years aiming therapeutic, medicinal and food dressing purposes. A great part of the chemical structures of current prescribing drugs are based on structures of natural products due to the presence of bioactive molecules in their essential oils and other plant products that confer to the medicinal plants, therapeutic activity.
The common thyme (Thymus vulgaris L.) is a plant of the Lamiaceae family, several in vitro studies have been performed with this specie and some medicinal relevant activities have been attributed, such as, antimicrobial activities, carminative and expectorant, antioxidant and spasmolytic, these activities have been attributed to thymol and carvacrol, main component of its essential oil.
The thyme “bela luz” (Thymus mastichina L.) is a small shrub, endemic of the Iberian Peninsula. This plant has an elevated antioxidant effect due to its components, 1-8 cynolene, the barneol and the linaleol. The aerial parts are used for the respiratory tract infections and also to slow digestions, chronic gastritis and spasmodic pains of the digestive tube.
The lemon thyme (Thymus x citriodorus) is considered as being a hybrid between the Thymus pulegioides and Thymus vulgaris original from the South of England. The extract of the leaves of the lemon thyme, specially his essential oil, is a mighty anti-septic, deodorant and disinfectant.
The objective of this work was to obtain a brief chemical characterization of the aqueous and hydroethanolic extracts of the common thyme, thyme “bela luz” and of the lemon thyme, as well as to characterize the effect of the application of these extracts to cell lines in culture, HepG2 and Caco-2 (in vitro), to value the potential cytotoxicity.
The phytochemistry characterization of the extracts was analysed by HPLC and the main phenolic compounds found in the initial extraction samples of these three species if Thymus were luteoline and its derivates such as luteolin-7 O-glucoside, the cafeic acid and the apigenin and its derivates such as apigenin-7-O-glucoside, in the methanolic phase, besides the compounds mentioned previously, also it was detected rosmarinic acid in all species and the epicatequin in the common thyme.
The chemical composition of the essential oils obtained by hydrodistillation was evaluated by GC-MS and it showed that the main compounds in common thyme were thymol, the p-cymene and its γ-terpinene, in the thyme “bela-luz” were 1-8 cineole, terpineol and
α-pinene and finally in the lemon thyme we obtained the geraniol the z-citral and the trans-caryophyllene.
All the obtained extracts and fractions were applied in two cell lines, at 50, 100, 200 and 500 μg/mL and the cellular viability was measured after 24 and 48 h of exposure.
We may conclude that these species present a strong anticarcinogenic activity in extracts applied at higher concentrations (200 and 500 µg / mL) principally the methanolic phase where most of the phenolic compounds are found.
Keywords: aromatic and medicinal plants; common thyme (Thymus vulgaris L.); thyme “bela-luz” (Thymus mastichina L.); lemon thyme (Thymus x citriodorus L.); anticarcinogenic activity; HPLC (chemistry composition);
Índice
Agradecimentos ... vii
Resumo ... ix
Abstract ... xi
Índice ... xiii
Índice de figuras ... xvii
Índice de tabelas ... xix
Índice de reações ... xxi
Índice de equações ... xxi
Índice de abreviaturas e símbolos ... xxiii
1. Introdução ... 1
1.1. Utilização de plantas medicinais ... 1
1.2. Óleos essenciais ... 2
1.3. Extratos de plantas e compostos biologicamente ativos ... 3
1.3.1. Terpenos ... 4 1.3.2. Compostos fenólicos ... 5 1.3.2.1. Ácidos fenólicos ... 6 1.3.2.2. Flavonóides ... 7 1.3.2.3. Taninos ... 7 1.4. Radicais livres ... 8 1.5. Antioxidantes ... 9
1.6. Caracterização das espécies de Tomilhos ... 10
1.6.1. Género Thymus ... 10 1.6.2. Thymus vulgaris L. ... 12 1.6.2.1. Distribuição geográfica ... 12 1.6.2.2. Morfologia ... 12 1.6.2.3. Bioquímica ... 13 1.6.2.4. Aplicações ... 13
1.6.2.5. Estudos in vivo e in vitro sobre os efeitos dos seus extratos ... 14
1.6.3. Thymus mastichina L. ... 15
1.6.3.1. Distribuição geográfica ... 15
1.6.3.3. Bioquímica ... 16
1.6.3.4. Aplicações ... 16
1.6.3.5. Estudos in vivo e in vitro sobre os efeitos dos seus extratos ... 17
1.6.4. Thymus x citriodorus L. ... 18
1.6.4.1. Distribuição geográfica ... 18
1.6.4.2. Morfologia ... 18
1.6.4.3. Bioquímica ... 18
1.6.4.4. Aplicações ... 19
1.6.4.5. Estudos in vivo e in vitro sobre os efeitos dos seus extratos ... 19
2. Objetivos ... 21
3. Material e métodos ... 23
3.1. Origem do material vegetal ... 23
3.2. Extração dos óleos essenciais ... 23
3.2.1. Princípio do método ... 23
3.2.2. Procedimento ... 23
3.3. Análise da composição do óleo essencial ... 23
3.3.1. Princípio do método ... 23
3.3.2. Procedimento ... 24
3.3.2.1 Cromatografia em fase gasosa acoplada à espectrometria de massa ... 24
3.4. Obtenção de extratos aquosos e hidro-etanólicos ... 25
3.4.1. Princípio do método ... 25
3.4.2. Procedimento ... 25
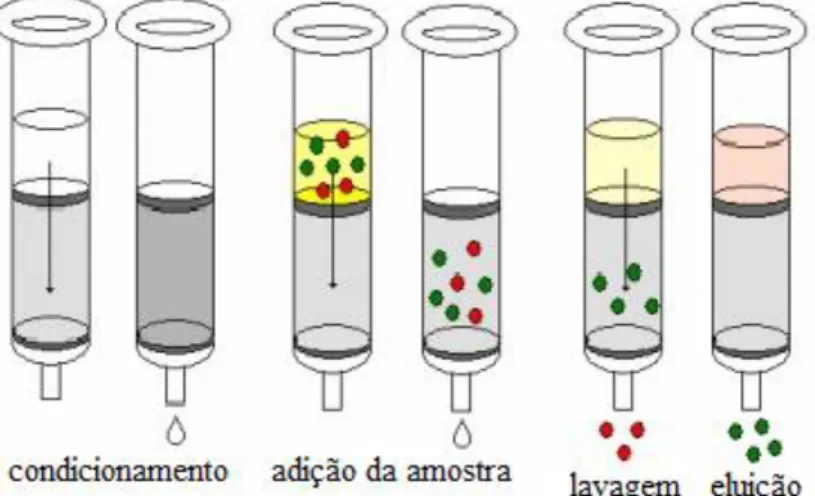
3.5. Fracionamento dos extratos por extração em fase sólida (SPE) ... 26
3.5.1. Princípio do método ... 26
3.5.2. Procedimento ... 26
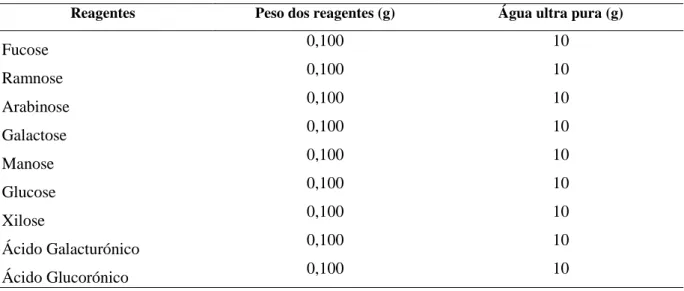
3.6. Quantificação dos açúcares ... 27
3.6.1. Princípio do método ... 27
3.6.2. Procedimento ... 27
3.6.2.1. Hidrólise ácida ... 27
3.6.2.2. Cromatografia iónica de alta eficiência com deteção de pulso amperométrico (HPAEC-PAD) para a análise das amostras ... 28
3.7. Quantificação dos Fenóis Totais... 29
3.7.2. Procedimento ... 29
3.8. Identificação de compostos fenólicos por cromatográfica líquida de alta eficiência em fase reversa (RP-HPLC) ... 30
3.8.1. Princípio do método ... 30
3.8.2. Procedimento ... 31
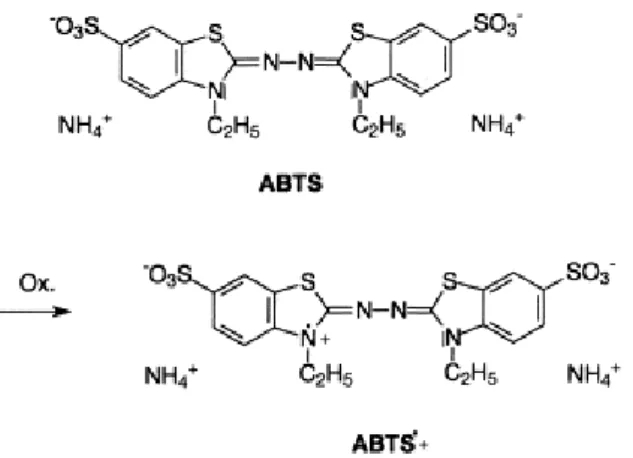
3.9. Determinação da atividade antioxidante... 31
3.9.1. Princípio do método ... 31
3.9.2. Procedimento ... 32
3.9.2.1. Preparação do radial ABTS ... 32
3.9.2.2. Preparação da solução de trabalho de ABTS ... 32
3.9.2.3. Determinação da capacidade antioxidante ... 33
3.9.2.4. Determinação da percentagem de inibição ... 33
3.10. Cultura celular ... 34
3.10.1. Culturas Celulares: manutenção e manuseamento ... 34
3.10.2. Meios de Cultura e soluções ... 34
3.10.2.1. Meio de cultura completo ... 34
3.10.2.2. Meio de cultura sem soro ... 34
3.10.2.3. Solução PBS 1x ... 35
3.10.2.4. Soluções stock ... 35
3.10.3. Manutenção da linha celular ... 35
3.10.4. Subcultura e tripsinização de células aderentes ... 35
3.10.4.1.Principio do método ... 35
3.10.4.2. Procedimento ... 36
3.10.5. Contagem de células e viabilidade celular ... 37
3.10.5.1. Determinação da viabilidade celular: princípio do método ... 37
3.10.5.2. Procedimento ... 38
3.11. Análise dos dados ... 39
4. Resultados e discussão ... 41
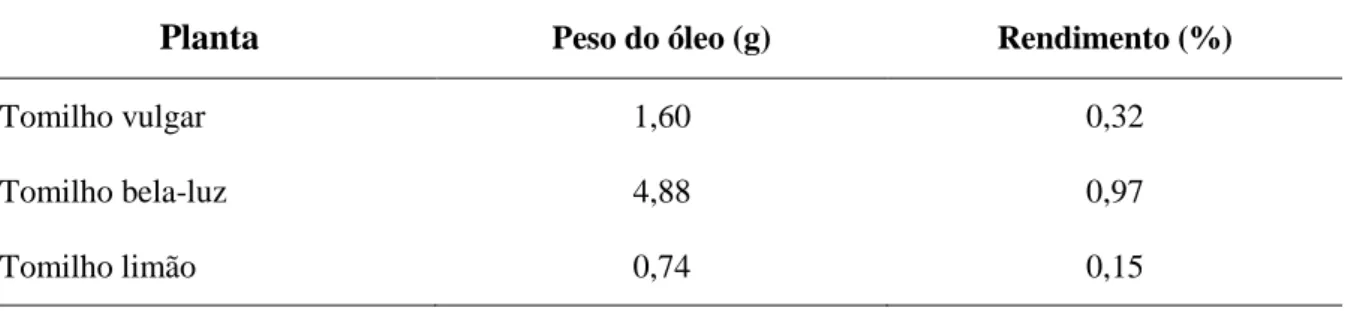
4.1. Rendimento da extração dos óleos essenciais ... 41
4.2. Composição dos óleos essenciais ... 41
4.2.1. Tomilho vulgar ... 41
4.2.2. Tomilho bela-luz ... 44
4.3. Rendimentos das extrações aquosas e hidro-etanólicas dos tomilhos ... 51
4.3.1. Da amostra inicial ... 51
4.3.2. Da fração metanólica ... 52
4.3.3. Da fração aquosa ... 53
4.4. Compostos fenólicos e atividade antioxidante ... 54
4.4.1. Da amostra inicial ... 54
4.4.2. Da fração metanólica ... 55
4.4.3. Da fração aquosa ... 56
4.5. Caracterização fitoquímica do extrato ... 57
4.5.1. Da amostra inicial e fração metanólica ... 57
4.5.1.1. Tomilho vulgar ... 57
4.5.1.2. Tomilho bela-luz ... 61
4.5.1.3. Tomilho limão ... 65
4.5.2. Da fração aquosa após fracionamento da amostra inicial ... 68
4.6. Quantificação de açúcares ... 69
4.6.1. Da amostra Inicial ... 69
4.6.2. Da fração aquosa ... 70
4.6.3. Da fração metanólica ... 71
4.7. Efeito dos extratos dos tomilhos na viabilidade celular ... 72
4.7.1. Efeitos nas células Caco-2 ... 73
4.7.1.1. Exposição à amostra inicial ... 73
4.7.1.2.Exposição à fração metanólica dos vários extratos ... 74
4.7.1.3. Exposição á fração aquosa dos vários extratos ... 76
4.7.2.Efeitos nas células HepG2 ... 77
4.7.2.1.Exposição à amostra inicial ... 77
4.7.2.2. Exposição à fração metanólica dos vários extratos ... 79
4.7.2.3. Exposição à fração aquosa dos vários extratos ... 80
5. Conclusões Gerais ... 83
Índice de figuras
Figura 1 – Estrutura química de alguns terpenos ... 5
Figura 2 - Estrutura básica das moléculas dos flavonoides. ... 6
Figura 3 – Estrutura química de alguns ácidos fenólicos ... 7
Figura 4- Estrutura química dos principais tipos de flavonóides. ... 7
Figura 5 – Estrutura química dos Taninos ... 8
Figura 6 - Espécies do Género Thymus ... 11
Figura 7 - Tomilho comum, Thymus vulgaris ... 12
Figura 8- Tomilho bela-luz, Thymus mastichina ... 15
Figura 9 - Tomilho limão, Thymus x citriodorus ... 18
Figura 10 - Principais etapas empregadas em SPE visando o isolamento de um composto ou classe de compostos ... 26
Figura 11 - Principio do método da determinação da capacidade antioxidante com o radical ABTS•+ ... 32
Figura 12 - Representação esquemática da reação de redução no teste de viabilidade celular com alamar blue ... 38
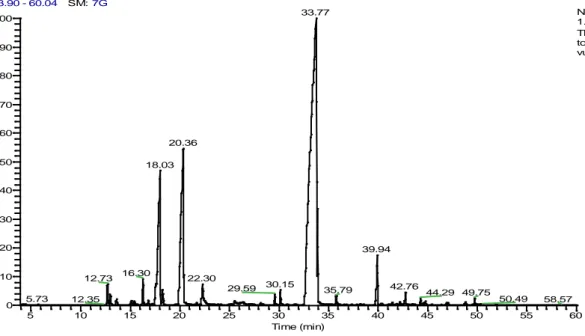
Figura 13 Cromatograma do óleo essencial do Thymus vulgaris ... 42
Figura 14 – Cromatograma do óleo essencial do Thymus mastichina ... 45
Figura 15 – Cromatograma do óleo essencial do Thymus citriodorus ... 49
Figura 16 – Concentração de compostos fenólicos totais (A) e da atividade antioxidante (B) da amostra inicial. ... 55
Figura 17 – Concentração de compostos fenólicos totais (A) e da atividade antioxidante (B) da fração metanólica dos extratos hidro-etanólicos e aquosos ... 56
Figura 18 – Concentração de compostos fenólicos totais (A) e da atividade antioxidante (B) da fração aquosa. ... 57
Figura 19 - Cromatograma dos extratos iniciais e da fração metanólica da extração hidro-etanólica e aquosa de tomilho vulgar; ... 59
Figura 20 - Picos do cromatograma obtidos na separação dos compostos dos extratos de tomilho vulgar ... 61
Figura 21- Cromatograma dos extratos iniciais e fração metanólica da extração hidro-etanólica e aquosa, de tomilho bela-luz; ... 63
Figura 22 - Picos do cromatograma obtidos na separação dos compostos dos extratos de tomilho bela-luz ... 65
Figura 23 - Cromatograma dos extratos iniciais e fração metanólica da extração hidro-etanólica e aquosa, de tomilho limão ... 66 Figura 24 - Picos do cromatograma obtidos na separação dos compostos dos extratos de tomilho bela-luz ... 68
Figura 25- Valores de percentagem de monossacáridos nos extratos da amostra inicial. ... 70 Figura 26 – Valores de percentagem de monossacáridos nos extratos da fração aquosa presentes no extrato hidro-etanólico (A) e no extrato aquoso (B). ... 71
Figura 27 - Percentagem de açúcar (monossacáridos) da fração metanólica dos extratos hidro-etanólicos (A) e aquosos (B). ... 72
Figura 28 - Viabilidade celular (em percentagem de redução de alamar blue) de células Caco-2 expostas aos extratos iniciais das três espécies de tomilho. ... 74
Figura 29 - Viabilidade celular (em percentagem de redução de alamar blue) de células Caco-2 expostas aos extratos metanólicos das três espécies de tomilho. ... 76
Figura 30 - Viabilidade celular (em percentagem de redução de alamar blue) de células Caco-2 expostas aos extratos aquosos das três espécies de tomilho. ... 77
Figura 31 - Viabilidade celular (em percentagem de redução de alamar blue) de células HepG2 expostas aos extratos iniciais das três espécies de tomilho. ... 79
Figura 32 - Viabilidade celular (em percentagem de redução de alamar blue) de células HepG2 expostas aos extratos metanólicos das três espécies de tomilho. ... 80
Figura 33 - Viabilidade celular (em percentagem de redução de alamar blue) de células HepG2 expostas aos extratos aquosos das três espécies de tomilho. ... 81
Índice de tabelas
Tabela 1 – Massa dos reagentes e de água para preparação das soluções padrão dos açúcares. ... 28
Tabela 2 - Esquema ilustrativo das soluções preparadas para a reta padrão de Trolox . 33 Tabela 3 – Massa e rendimento do óleo essencial obtidos da amostra inicial. ... 41 Tabela 4 - Composição do óleo essencial (expresso em percentagem da área dos picos) do Thymus vulgaris ... 43
Tabela 5 - Composição do óleo essencial (expresso em percentagem da área dos picos) do Thymus mastichina ... 45
Tabela 6 - Composição do óleo essencial (expresso em percentagem da área dos picos) do Thymus citriodorus ... 49
Tabela 7 – Massa e rendimento obtidos nos extratos da amostra inicial da extração aquosa e hidro-etanólica. ... 52
Tabela 8 – Massa e rendimento obtidos na fração metanólica da extração aquosa e hidro-etanólica. ... 53 Tabela 9 – Massa e rendimento obtidos na fração aquosa da extração aquosa e hidro-etanólica. ... 54 Tabela 10 - Composição química dos extratos iniciais e fração metanólica da extração hidro-etanólica e aquosa, identificados pelos picos do cromatograma obtido na separação dos compostos dos extratos de tomilho vulgar ... 60
Tabela 11- Composição química dos extratos iniciais e fração metanólica da extração hidro-etanólica e aquosa, identificados pelos picos do cromatograma obtido na separação dos compostos dos extratos de tomilho bela-luz ... 64
Tabela 12 - Composição química dos extratos iniciais e fração metanólica da extração hidro-etanólica e aquosa, identificados pelos picos do cromatograma obtido na separação dos compostos dos extratos de tomilho limão ... 67
Índice de reações
Reação 1 - Reação de quantificação de fenóis totais pelo reagente de Folin Ciocalteu 29
Índice de equações
Equação 1 – Percentagem de inibição do radical ABTS. ... 33 Equação 2 – Fórmula de cálculo da percentagem da redução de alamar blue. ... 38
Índice de abreviaturas e símbolos
AB Alamar blue
ABTS Ácido 2,2-azino-bis-3-etilbenzotazolina-6-sulfónico
ABTS+• Radical catião ácido 2,2-azino-bis-3-etilbenzotazolina-6-sulfónico BHA Butil hidroxianisol
BHT Butil hidroxitolueno
CAT Catalase
Caco-2 Células de adenocarcinoma do epitélio colorectal humano (do inglês “human epethelial colorectal adenocarcinoma cell”)
FBS Soro fetal bovino
GAE Equivalente de ácido gálico (do inglês “galic acid equivalent”) GC Cromatografia gasosa (do inglês “gas chromatography”) GPx Glutationa peroxidase
GR Glutationa redutase
HBSS Solução-tampão salina de Hank (do inglês “Hank’s balanced salt solution”) HepG2 Células de hepatocarcinoma humano (do inglês “Hepatocellular carcinoma”) HPAEC Cromatografia iónica de alta eficiência (do inglês “High performance
anion-exchange chromatography”)
HPLC Cromatografia líquida de alta pressão (do inglês “High-performance liquid chromatography”)
RNS Espécies reativas de nitrogénio (do inglês “ reactive nitrogen species”) OMS Organização mundial de saúde
PBS Tampão fosfato (do inglês “phosphate buffer solution”)
ROS Espécies reativas de oxigénio (do inglês “reactive oxygen species”) rpm Rotações por minuto
SOD Superóxido dismutase, SPE Extração em fase sólida t-BHP Hidroperóxido de terc-butilO
TEAC Capacidade antioxidante em equivalentes de Trolox (do inglês “trolox equivalence antioxidante capacity”)
RT Tempo de retenção (do inglês “retention time”) Trolox Ácido (6-hidroxi-2,5,7,8-tetrametil-2-cromanóico)
TB Tomilho Bela-luz
TV Tomilho Vulgar
UV Ultravioleta
1. Introdução
1.1. Utilização de plantas medicinais
Desde a antiguidade que as propriedades antissépticas das plantas medicinais e aromáticas são conhecidas, sendo utilizadas há milhares de anos na medicina tradicional para fins curativos e terapêuticos (Carretto et al., 2007). A maior parte dessa utilização empírica é baseada no conhecimento popular, transmitido ao longo de gerações, esse conhecimento pode levar à descoberta de moléculas importantes que venham a ser usadas nas áreas da medicina e farmacêutica (Fernandes et al., 2005).
Durante muito tempo, o uso de plantas medicinais foi o principal recurso terapêutico utilizado nos cuidados de saúde da população em geral, entretanto com os avanços ocorridos no meio técnico-científico, sobretudo, no âmbito das ciências da saúde, foram surgindo novas maneiras de tratar e curar doenças, essencialmente recorrendo à síntese química de compostos, apesar de muitas vezes a estrutura química básica destes fármacos ser baseada em estruturas de ocorrência natural. Atualmente, cerca de 25 mil espécies de plantas medicinais são usadas em todo o mundo para a produção de medicamentos, incluindo não somente aqueles obtidos por síntese a partir de produtos naturais, mas também os medicamentos comercializados como produtos fitoterapêuticos (Velloso & Albuquerque, 2002).
Tradicionalmente assume-se que as plantas medicinais são vegetais utilizados para fins terapêuticos, em que pelo menos uma das suas partes possui propriedades curativas ou preventivas (Carretto et al., 2007). Muitas das plantas medicinais, também apresentam aplicações alimentares, cosméticas. Podem ainda, em função dos seus diversos componentes químicos, serem utilizadas como matérias-primas por diversas indústrias, de perfumaria, produtos fitossanitários, pigmentos, entre outros. Dependendo da sua aplicabilidade, uma mesma espécie vegetal pode ser encontrada na literatura como planta medicinal, planta aromática, planta condimentar, planta de extratos e matéria-prima. Ainda, em função da sua composição e da quantidade utilizada da mesma, pode ser considerada planta tóxica (Lorenzi & Matos, 2002).
Nos países em desenvolvimento cerca de dois terços da população utiliza plantas ou os seus extratos como fonte de agentes farmacológicos, embora não possuam conhecimentos científicos ou práticos para o fazerem, podendo originar intoxicações agudas ou crónicas (Harvey, 2000). Desde 1977, a Organização Mundial da Saúde (OMS) tem incentivado o estudo destas plantas, com o objetivo de avaliar, cientificamente, os benefícios e os riscos da utilização
de medicamentos fitoterapêuticos. No entanto, faltam ainda muitas evidências laboratoriais e clínicas sobre a eficácia e segurança da utilização de determinadas plantas (Carretto et al., 2007).
Atualmente, o comércio de produtos naturais provenientes de plantas aromáticas e medicinais encontra-se em expansão por todo o mundo, devido aos vários estudos etnobotânicos que têm surgido, levando os consumidores a preferirem os produtos de origem natural. Esta tendência deve-se, em parte, ao elevado custo dos medicamentos sintéticos, à falta de acesso aos agentes químio-terapêuticos por algumas populações e devido ao reduzido número de contra indicações e de efeitos colaterais que as plantas apresentam, quando comparadas com os medicamentos sintéticos (Lorenzi & Matos, 2002).
Das famílias botânicas que reúnem maior número de espécies medicinais das que os especialistas citam as que exibem um índice de importância relativa mais elevado (Carvalho, 2005), destacam-se a família Lamiaceae (15% do total de espécies), Asteraceae (11%), Rosaceae (9%), Fabaceae (5%) e Poaceae (4%). Estas são as famílias que assumem maior relevância, pois são usadas no tratamento de um grande número de doenças respiratórias, digestivas, do aparelho reprodutor, do aparelho locomotor e do sistema nervoso (Carvalho et al., 2007).
As condições climáticas existentes em Portugal, com Primaveras suaves e Verões secos (especialmente no Centro e Sul e na Terra Quente Transmontana), são favoráveis ao desenvolvimento de um largo número de espécies de plantas aromáticas e medicinais que produzem, entre outros, óleos essenciais ou produtos naturais de valor para a indústria farmacêutica e cosmética (Franco et al., 1984).
1.2. Óleos essenciais
O conhecimento sobre os óleos essenciais também chamados de óleos voláteis das plantas data de alguns séculos antes de Cristo. As referências sobre o modo de obtenção e utilização desses óleos estão ligadas, originalmente, aos países orientais, com destaque para Egito, Pérsia, Japão, China e Índia. A evolução de conhecimentos técnicos sobre os óleos essenciais deu-se em meados do século XVIII, quando se iniciaram os estudos da sua caraterização química (Moldão-Martins et al., 2004). Os óleos essenciais são produtos do metabolismo secundário das plantas, sintetizados e libertados através de estruturas epidérmicas, glândulas secretoras e tricomas, encontradas em folhas, raízes, caule, flores e frutos de diversas espécies de plantas aromáticas, quando ocorrem em diferentes regiões na mesma planta normalmente apresentam
composição química diferente (Oussalah et al., 2007; Simões et al., 2007). A evaporação das essências da superfície das plantas é considerada um mecanismo de defesa da planta contra as bactérias e fungos, mas também funciona como mecanismo de aproximação de insetos e pássaros polinizadores, garantindo a sua reprodução (Nocacosk & Torres, 2006). Os óleos essenciais de plantas, geralmente são agentes que apresentam atividade antimicrobiana contra um grande número de microrganismos incluindo espécies resistentes a antibióticos e antifúngicos (Moldão-Martins et al., 2004), além disso apresentam propriedades antibacterianas, antifúngicas, antivirais, inseticidas, anticancerígenas e antioxidantes (Tohidpour et al., 2010).
Os óleos essenciais são utilizados em diversos setores industriais como, por exemplo, no fabrico de fármacos, perfumes, cosméticos, produtos de higiene e limpeza, aditivos para alimentos e bebidas (Moldão-Martins et al., 2004), entre outros. Na indústria alimentar podem ser usados como agentes antioxidantes e antibacterianos, além disso, os óleos essenciais podem melhorar as propriedades organoléticas dos alimentos e bebidas, pelo facto de reproduzirem o sabor e odor da planta utilizada (Moldão-Martins et al., 2004). O seu uso, principalmente na indústria farmacêutica/fitofarmacêutica, cosmética e medicina natural, têm-se acentuado nos últimos anos (Rota et al., 2008; Dawidowicz et al., 2008).
Os principais constituintes dos óleos essenciais são mono e sesquiterpenos mas também possuem hidrocarbonetos, fenóis, álcoois, éteres, aldeídos e cetonas que são responsáveis pela atividade biológica das plantas aromáticas e medicinais assim como pela sua fragrância (Soković et al., 2010).
A composição química de óleos essenciais pode depender do clima, estação do ano, condições geográficas, período de colheita, técnicas de secagem e das técnicas de extração (Oussalah et al., 2007; Rota et al., 2008). No processo de extração do óleo essencial das plantas, podem ser aplicados diversos métodos, como a hidrodestilação, maceração, extração por solvente, “enfleurage”, gases supercríticos e micro-ondas. Dentre esses, o método mais utilizado é o de hidrodestilação (Dawidowicz et al., 2008; Gavahian et al., 2012).
1.3. Extratos de plantas e compostos biologicamente ativos
As plantas contêm inúmeros constituintes nos seus extratos que quando testados podem apresentar efeitos sinérgicos entre os diferentes princípios ativos devido à presença de compostos, classes ou estruturas diferentes que contribuem para a mesma atividade. Esta tem sido uma das fontes mais ricas de substâncias orgânicas, contribuindo de forma significativa
para o fornecimento de metabolitos secundários, dos quais muitos têm sido utilizados na produção de medicamentos, cosméticos, alimentos, agroquímicos, entre outros (Niero et al., 2003; Rota et al., 2008).
Os princípios ativos das plantas medicinais são substâncias que a planta sintetiza e armazena durante o seu crescimento. No entanto, nem todos os produtos metabólicos sintetizados possuem valor medicinal. Em todas as espécies existem ao mesmo tempo princípios ativos e substâncias inertes. Estas últimas determinam a eficácia da planta medicinal acelerando ou retardando a absorção dos princípios ativos pelo organismo. Geralmente, na mesma planta, encontram-se vários componentes ativos, dos quais um ou mais grupos determinam a sua ação principal (Anderson et al., 1988).
A avaliação do potencial terapêutico de plantas medicinais e de alguns dos seus metabolitos secundários tem sido objeto de incessantes estudos, onde já foram comprovadas as ações farmacológicas através de testes pré-clínicos com animais (Cechinel Filho & Yunes, 1998). Os metabolitos secundários são frequentemente acumulados pelas plantas em quantidades menores que os metabolitos primários, além disso, tendem a ser sintetizados em células especializadas e em fases distintas de desenvolvimento, tornando difícil a sua extração e purificação (Balandrin et al., 1985). Existem três grandes grupos de metabólitos secundários os terpenos, os compostos fenólicos e os alcalóides. Com o avanço da ciência foram atribuídas às referidas substâncias importantes funções nos mecanismos de defesa da planta contra os seus predadores e resistência a situações de stresse, como por exemplo no combate às espécies reativas de oxigénio (ROS) (Niero et al., 2003).
Entre os diversos exemplos de substâncias oriundas de plantas e de importância atualmente, podemos mencionar a forscolina, obtida de Coleus barbatus, que apresenta promissores efeitos contra a hipertensão, glaucoma, asma e certos tumores, a artemisinina, presente em Artemisia annua, que exerce potente atividade antimalárica, o diterpeno anticancerígeno taxol, isolado de plantas do género Taxus, e o timol e o carvacrol obtido do óleo essencial de Thymus vulgaris que produz efeitos antibacterianos, antifúngicos e anti-helmínticos (Cechinel Filho & Yunes, 1998; García-Risco et al., 2011).
1.3.1. Terpenos
De entre as classes de produtos naturais com grande diversidade estrutural e para o qual se verifica um maior número de substâncias descritas em plantas superiores destacam-se os terpenos (González-Coloma et al., 2011).
Os terpenos são metabolitos secundários de plantas, produzidos, em parte, para defesa contra microrganismos e insetos (Figura 1). Estes compostos podem ser encontrados também em organismos marinhos, algas, microrganismos e em menor quantidade em fungos e quando contém oxigénio na sua estrutura são denominados terpenóides (Hill & Connolly, 2013).
Os terpenos são formados a partir do ácido mevalónico, no citoplasma, ou do piruvato e 3-fosfoglicerato, no cloroplasto e apresentam uma grande diversidade estrutural derivada da junção cabeça-cauda de unidades de cinco átomos de carbono denominadas isoprenos. As classes mais importantes dos terpenos são os mono e sesquiterpenos pois são os principais constituintes de óleos essenciais e resinas muito utilizados como aditivos de aroma e sabor na indústria alimentar e farmacêutica (Croteau, 1987; Seo et al., 2008; Trudgill, 1990).
Grande parte dos compostos terpénicos apresenta atividade anti-inflamatória, expetorante (Duke, 2010) e antimicrobiana (Raman et al., 1995).
Os terpenos isolados apresentam aromas florais, frutados, amadeirados e cítricos.
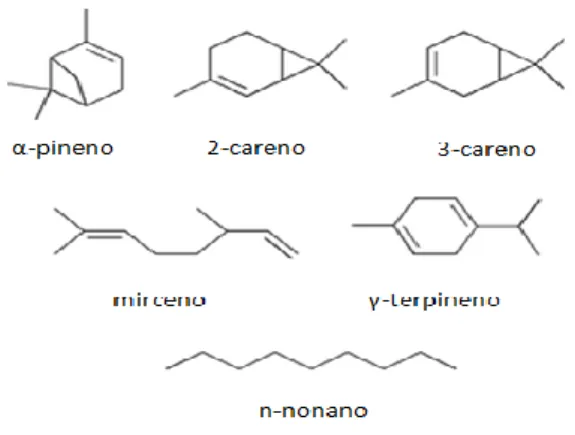
Figura 1 – Estrutura química de alguns terpenos
(adaptado de Timerghazin & Ariya, 2001)
1.3.2. Compostos fenólicos
Os compostos fenólicos são derivados da fenilalanina e tirosina. (Lima et al., 2007) e estão presentes em vários alimentos e bebidas, são constituídos por várias classes de substâncias com propriedades antioxidantes.
Os compostos fenólicos pertencem a uma classe de compostos com estrutura simples, que possuem um anel aromático com um ou mais substituintes hidroxilos (Figura2), possibilitando aos compostos fenólicos eliminar e estabilizar radicais livres, reduzir o oxigénio singleto, atuar nas reações de oxidação lipídica, na complexação de metais e também são capazes de modular a atividade de muitas enzimas, sugerindo, deste modo, o envolvimento nos processos bioquímicos e fisiológicos não somente nas plantas como também em animais e humanos
(Malacrida & Motta, 2005; Orhan et al., 2009; Podsędek, 2007; Rusak et al., 2008; Zheng & Wang, 2001). Os compostos fenólicos formam-se maioritariamente em condições de stresse, como infeções, lesões, radiações UV, entre outras (Bravo, 1998; Naczk & Shahidi, 2004).
Os compostos fenólicos de maior ocorrência natural apresentam-se conjugados com mono e polissacáridos, através de um ou mais grupos fenólicos, podem também ocorrer como derivados funcionais, como ésteres e metil-ésteres. A atividade antioxidante dos compostos fenólicos depende da sua estrutura, particularmente do número e posição dos grupos hidroxila e da natureza das substituições nos anéis aromáticos (Balasundram et al., 2006).
Entre os diversos compostos fenólicos, podem ser citados três grupos principais: ácidos fenólicos, flavonóides e taninos.
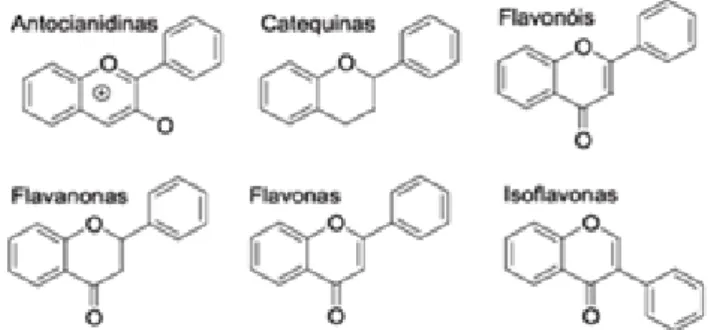
Figura 2 - Estrutura básica das moléculas dos flavonoides.
A - Anel aromático derivado da via metabólica do acetato/malonato; B - Anel derivado da fenilalanina através da via metabólica do shikimato; C - Variações nas configurações de substituição do anel resultam na maioria das 6 subclasses dos flavonóides: flavonas, flavanonas, isoflavonas, flavonóis, flavanóis e antocianinas.
(adaptado de Balasundram et al., 2006).
1.3.2.1. Ácidos fenólicos
Os ácidos fenólicos são compostos simples formados por um anel aromático e os substituintes ligados à sua estrutura, (Figura 3), conferindo capacidade de sequestrar espécies reativas, como o radical hidroxilo e o oxigénio singleto (Marinova & Yanishlieva, 2003). Os ácidos fenólicos são divididos em dois grupos. Os ácidos hidroxibenzóicos (por exemplo o ácido gálico, vanílico, p-hidroxibenzóico, protocatecuico, vanílico e siríngico) que possuem sete átomos de carbono (C6-C1) e são os ácidos fenólicos mais simples encontrados na natureza. Os ácidos hidroxicinâmicos (por exemplo o ácido cafeico, ácido ferúlico, ácido cumarínico e ácido sinápico), que possuem nove átomos de carbono (C6-C3), sendo estes os mais comumente encontrados no reino vegetal. Os ácidos fenólicos, além de se apresentarem na sua forma livre, podem também estar ligados entre si ou com outros compostos (Bravo, 1998; Soares, 2002).
Figura 3 – Estrutura química de alguns ácidos fenólicos
(adaptado de Yeh et al., 2009).
1.3.2.2. Flavonóides
Os flavonóides constituem o maior grupo de compostos fenólicos de plantas (Figura 4). Estes compreendem um grupo de compostos fenólicos amplamente distribuídos nas frutas e nos vegetais, apresentando-se sob muitas variações como flavonóis, flavonas, flavanonas, catequinas, antocianidinas, isoflavonas e chalconas (Reynertson et al., 2008; Van Acker et al., 1996). Estruturalmente são normalmente caracterizados por um esqueleto de carbono C6-C3-C6 e ocorrem como agliconas (sem açúcares) e glicosídeos (apresentando açucares ligados).
Os flavonóides têm demonstrado atividade contra alergias, hipertensão, viroses, inflamações, artrites, mutações, carcinogénese e HIV (Katsube et al., 2003; Merken & Beecher, 2000).
Figura 4- Estrutura química dos principais tipos de flavonóides.
(adaptado de Março et al., 2008)
1.3.2.3. Taninos
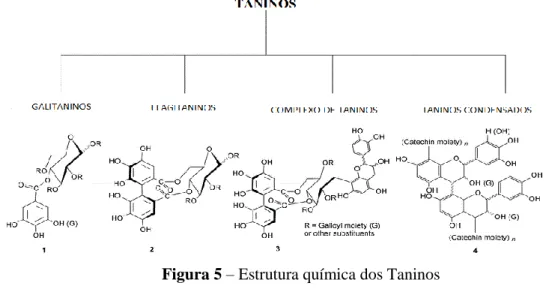
Os taninos são compostos fenólicos presentes na maioria das plantas (Figura 5)., em que a sua concentração pode variar de acordo com os tecidos vegetais, em função da idade e
tamanho da planta, da parte colhida, da época ou, ainda, do local de colheita (Monteiro et al., 2005).
Os taninos são classificados em dois grupos principais, os taninos hidrolisáveis que incluem os galitaninos e os elagitaninos, polímeros derivados dos ácidos gálico e elágico, este tipo de taninos pode ser encontrado principalmente em madeiras, cascas de árvores, folhas e galhos (Mueller-Harvey, 2001). O outro tipo de taninos existentes são os condensados sendo formados por polímeros de catequina e leucoantocianidinas, estes apresentam uma estrutura semelhante aos flavonóides e estão mais largamente distribuídos nas plantas superiores (Schofield et al., 2001). Além destes tipos de taninos também existe os taninos complexos que contém tanto unidades de taninos hidrolisáveis como de taninos condensados.
Figura 5 – Estrutura química dos Taninos
(adaptado de Khanbabaee & van Ree, 2001)
1.4. Radicais livres
Os radicais livres são classificados como moléculas orgânicas, inorgânicas ou átomos que contêm um ou mais eletrões não emparelhados (Boyce, 1999). Devido a esta estrutura são moléculas muito instáveis, possuem tempo de meia-vida curto e são muito reativos. Estes radicais são produzidos em todos os organismos vivos durante as reações de oxidação, nos processos do metabolismo celular A manutenção do equilíbrio entre a produção de radicais livres e as defesas antioxidantes é uma condição essencial para o funcionamento normal do organismo. Quando este equilíbrio tende para a produção de radicais livres dizemos que o organismo está em stress oxidativo, e nestas situações os radicais livres em excesso podem oxidar e danificar lípidos celulares, proteínas e ADN, inibindo a sua função normal e conduzindo a várias doenças, como doenças cardiovasculares, doenças do sistema imunológico
(Gioti et al., 2009), problemas pulmonares, diabetes, cataratas, esclerose múltipla, disfunção cerebral, inflamações crónicas (Su et al., 2007), doenças neurodegenerativas (Jang et al., 2007), doenças cancerígenas (Reynertson et al., 2006) e aceleramento do processo de envelhecimento (Sikora et al., 2008)
Os radicas livres e outras espécies reativas como as do oxigénio (ROS) ou de azoto (NOS) constantemente presentes no organismo, podem ser gerados endogenamente como produtos das vias metabólicas ou ainda podem ter origem exógena através da ingestão e da respiração devido a fatores ambientais como radiação, poluição e tabagismo (Huang et al., 2005).
As ROS são formadas pela redução do oxigénio, e dão origem ao radical superóxido (O2 •-), ao não radical peróxido de hidrogénio (H2O2), ao ácido hipocloroso (HOCl) e ao radical hidroxilo (OH•). Em concentrações baixas ou moderadas, as ROS podem ser benéficas para a célula, estando envolvidos em vários processos fisiológicos de sinalização e de regulação. No entanto, há situações em que o equilíbrio entre a produção de ROS e as defesas antioxidantes podem ser destruídos devido a uma produção excessiva de ROS, ou porque existe uma deficiência nas defesas antioxidantes da célula. A produção contínua de ROS durante os processos metabólicos leva ao desenvolvimento de muitos mecanismos de defesa antioxidante para limitar os níveis intracelulares e impedir a indução de danos (Sies, 1993), como por exemplo a produção de compostos fenólicos, que podem ser encontrados em diversas fontes vegetais (Broinizi et al., 2007; Galati & O'Brien, 2004).
Nos últimos anos, vários estudos têm revelado a importância do consumo de dietas ricas em vegetais e frutas na prevenção de doenças crónicas e degenerativas tais como Parkinson, Alzheimer (Getoff, 2007), doenças cardiovasculares, artrites, inflamações crónicas, diminuição no sistema imunitário, carcinogéneses (Lin & Tang, 2007; Pande & Akoh, 2009), cirrose, aterosclerose e fibrose (Vayalil, 2002).
1.5. Antioxidantes
Os antioxidantes podem ser definidos como qualquer substância que, presente em baixas concentrações, quando comparada com um substrato oxidável, atrasa ou inibe a oxidação desse substrato. Podem atuar como agentes redutores, sequestradores de radicais livres, inibidores de enzimas e como complexantes de metais, prevenindo o desenvolvimento de doenças e contribuindo, dessa maneira, para uma maior longevidade (Velioglu et al., 1998; Wang & Lin, 2000).
A exposição do organismo a radicais livres, provenientes de diversas fontes, levou o organismo a desenvolver uma série de mecanismos de defesa para eliminar estes radicais livres. Estas defesas podem ser enzimáticas ou não enzimáticas. As defesas antioxidantes enzimáticas são em grande número e encontram-se espalhadas por todo o organismo, tanto no meio intracelular como no meio extracelular como a superóxido dismutase (SOD), glutationa peroxidase (GPx), glutationa redutase (GR) e a catalase (CAT) (Ferreira & Matsubara, 1997). Entre as defesas antioxidantes não enzimáticos destacam-se compostos como a glutationa (GSH) o α-tocoferol (vit. E), o ácido ascórbico (vit. C), o ácido lipóico, os carotenóides, os flavonóides, entre outros (Velioglu et al., 1998)
As substâncias antioxidantes podem apresentar diferentes propriedades protetivas e agir em diversas etapas do processo oxidativo, funcionando por diferentes mecanismos e são, portanto, classificadas em duas categorias principais: antioxidantes primários e secundários.
São considerados primários os compostos de ação antioxidante capazes de inibir ou retardar a oxidação por inativação de radicais livres graças à doação de átomos de hidrogénio ou de eletrões, o que transforma os radicais em substâncias estáveis. Os antioxidantes secundários apresentam uma grande variedade de modos de ação: ligação de iões metálicos (alteração de valência); inativação de ROS, conversão de hidroperóxidos em espécies não-radicalares ou absorção de radiação ultravioleta (UV) (Maisuthisakul et al., 2007).
Além da ingestão de frutas e vegetais, que são recomendados como fontes de compostos antioxidantes, acredita-se que a suplementação da dieta com ervas, contendo altas concentrações de compostos capazes de desativar radicais livres, tenha também efeitos benéficos (Capecka et al., 2005).
1.6. Caracterização das espécies de Tomilhos
1.6.1. Género Thymus
A família Lamiacea compreende cerca de 300 géneros, e aproximadamente 7500 espécies distribuídas por todo o mundo onde se inclui o género Thymus, este inclui aproximadamente 220 espécies (Girón et al., 2012).
Dentro dos géneros cultivados desta família destacam-se várias espécies usadas como condimentos, tais como: sálvia (Salvia officinalis L.), manjericão (Ocimum basilicum L.), orégão (Origanum vulgaris L.), manjerona (Origanum majorana L.), tomilho (Thymus vulgaris L.) entre outras (Porte & Godoy, 2001) (Figura 6). A composição química dos óleos essenciais
de várias espécies de tomilho tem sido extensivamente estudada (Horváth et al., 2006). Em Portugal podem ser encontradas aproximadamente 11 espécies de tomilho (Faleiro et al., 2003). O género Thymus tem sido creditado por uma longa lista de propriedades farmacológicas, tais como propriedades espamolíticas, expetorantes, antissépticas, carminativas, antimicrobianas e uma elevada capacidade antioxidante (Horváth et al., 2006).
Este género é excecionalmente rico em espécies, devido à diversidade e plasticidade destas plantas (Smolik et al., 2009).
Os fenóis e os terpenos são particularmente característicos do género Thymus (Smolik et al., 2009). A presença de outros compostos e as suas proporções podem sofrer variações consideráveis dependendo da origem das plantas, variedade e de fatores ambientais (Smolik et al., 2009).
Figura 6 - Espécies do Género Thymus
1.6.2. Thymus vulgaris L. Nome Comum: Tomilho vulgar Espécie: Thymus vulgaris Género: Thymus
Família: Labiatae (Lamiaceae) Ordem: Lamiales
Classe: Magnoliopsida Subclasse: Lamiidae Divisão: Spermatophyta
Subdivisão: Magnoliophytina (Angiospermae) Reino: Plantae
Domínio: Eucária
Figura 7 - Tomilho comum, Thymus vulgaris
(adaptado de Flora.on, 2012)
1.6.2.1. Distribuição geográfica
Thymus vulgaris L., mais conhecido como tomilho vulgar é nativo da região do Mediterrâneo (Portugal, Espanha, Itália, França, Grécia) e também da Ásia (El-Nekeety et al., 2011; Goodner et al., 2006; Letchamo et al., 1995), sendo hoje em dia cultivado em quase todos os continentes. Pertence à família Lamiaceae e ao género Thymus (Golmakani & Rezaei, 2008). É principalmente encontrado em regiões secas, áridas, expostas ao sol, com solos arenosos e calcários enriquecidos com matéria orgânica; é uma planta de solos pobres, rústica, evita a humidade e terras compactadas (Ronicely, 2011).
1.6.2.2. Morfologia
O tomilho vulgar (Thymus vulgaris L.) é uma planta aromática subarbustiva de textura semilenhosa (Goodner et al., 2006) de pequeno porte, de cerca de 15 a 30 cm de altura com praticamente o dobro de largura. No verão surgem numerosas flores pequenas e arroxeadas (Ronicely, 2011). Apresenta uma ramagem ramificada, retorcida, com ramos levemente cobertos de pelos brancos e recoberta por folhas pequenas, lineares a ovaladas e opostas (Guillén & Manzanos, 1999). Multiplica-se por sementes, estaca, alporquia e divisão da ramagem enraizada. As folhas e ramos desta planta são tipicamente utilizados na culinária como condimento e erva aromática.
1.6.2.3. Bioquímica
O óleo essencial do tomilho é responsável pelo aroma típico das folhas desta especiaria, e está armazenado nos tricomas das folhas (Gavahian et al., 2012). Estudos realizados sobre a composição química do óleo desta espécie revelaram que o óleo é produzido em maiores quantidades na época de floração (Gavahian et al., 2012).
O timol é o composto maioritário da composição química do óleo essencial do tomilho, seguido pelo carvacrol, o p-cimeno e o γ-terpineno. Para além destes dois compostos, esta espécie também contém geraniol, linalol, α-terpineol, 1-8-cineol, cimol, borneol, cineno, pineno (Dawidowicz et al., 2008; Daferera et al., 2000; Guillén & Manzanos, 1999; Hussain et al., 2011; Kulišić et al., 2006; Rota et al., 2008; Soković & van Griensven, 2006; Soković et al., 2010).
Esta espécie é conhecida por ser rica em polifenóis como o ácido cafeico e o ácido rosmarínico, flavonas como a apigenina, luteolina, β-glucuronida, luteolina-7-O-β-glucosilada, 6-hidroxi-luteolina-glicosilada e polimetoxiflavonas (Dorman et al., 2003) (Fecka & Turek, 2008).
As folhas do tomilho são uma excelente fonte de muitos tipos de vitaminas incluindo a vitamina A, betacaroteno, vitaminas do complexo B, vitamina C, vitamina E e vitamina K (García-Risco et al., 2011).
1.6.2.4. Aplicações
O tomilho é uma das plantas aromáticas mais utilizadas na indústria alimentar devido ao sabor específico desta erva (Gavahian et al., 2012). Os monoterpenos fenólicos do tomilho, timol e carvacrol, são os principais compostos que contribuem para o aroma característico do seu óleo essencial. Também são conhecidos por inibir a peroxidação lipídica.
Na medicina o óleo essencial do tomilho é utilizado devido às suas atividades antimicrobianas, carminativas, expetorantes, espasmolíticas, diuréticas bem como antioxidantes. Atividades estas atribuídas ao timol e ao carvacrol, componentes fenólicos do óleo essencial, sendo o timol o mais potente (Al-Bayati, 2008; Bazylko & Strzelecka, 2007; Bhaskara Reddy et al., 1998; El-Nekeety et al., 2011; Gavahian et al., 2012; Hussain et al.).
As atividades antifúngicas, pesticidas e antibacterianas do óleo essencial de tomilho foram demonstradas por diversos investigadores (Bhaskara Reddy et al., 1998)
O timol tem demonstrado efeitos antibacterianos, antifúngicos e anti-helmínticos, é também muito utilizado como ingrediente de pastas dentífricas devido ao seu efeito
antibacteriano. O carvacrol tem sido investigado principalmente devido aos seus efeitos bactericidas (García-Risco et al., 2011).
1.6.2.5. Estudos in vivo e in vitro sobre os efeitos dos seus extratos
Com o avanço da ciência os estudos in vivo e in vitro desenvolvidos com extratos e óleo essencial da espécie Thymus vulgaris têm sido cada vez maiores principalmente devido aos seus componentes medicinais. Foi desenvolvido um estudo in vivo por El-Nekeety e colaboradores (2011) que teve como objetivo determinar os componentes do óleo essencial do Thymus vulgaris e avaliar os seus efeitos protetores contra a aflatoxina, indutora de stresse em ratos, concluindo que o óleo essencial do tomilho possui uma elevada atividade antioxidante e um efeito protetor contra a toxicidade das aflatoxinas e esta proteção é dependente da dosagem de óleo aplicada. Outro estudo in vivo teve como objetivo estudar o efeito do óleo essencial do tomilho como suplemento na dieta de ratos para avaliar os efeitos que este tinha sobre os danos causados pela idade, medindo a atividade da SOD (superóxido dismutase) e GSHPx (Glutationa Peroxidase) e o estado total oxidante em vários tecidos de rato chegando à conclusão que os ratos onde se tinha colocado o suplemento do óleo na dieta apresentavam maior atividade antioxidante que os restantes (Youdim & Deans, 1999). Shati e Elsaid (2009) estudaram o papel in vivo de extratos aquosos de tomilho e gengibre no melhoramento dos danos provocados pelo abuso de álcool no fígado e rim e concluíram que estes possuíam um efeito destoxificante e antioxidante contra a toxidade causada pelo álcool (Shati & Elsaid, 2009)
O estudo in vitro da integridade de tecido duodenal de frangos utilizando a linha próbiótica E. faecium AL41 como microrganismo indicador, na água potável, e avaliando os efeitos do óleo essencial do Thymus vulgaris no duodeno foi desenvolvido por Placha e colaboradores (2010) e estes observaram que o óleo essencial numa concentração de 0,4 % (v/v) provoca um efeito negativo na integridade duodenal. O E. faecium conseguia eliminar este efeito e fortalecer assim a imunidade não-especifica. Outro estudo in vitro foi desenvolvido para determinar a atividade antimicrobiana do óleo essencial do tomilho contra fungos micotoxigénicos Aspergillus ochraceus, Penicillium expansum e Penicillium verrucosum, tendo-se verificado que realmente este apresentava actividade antimicrobiana (Nguefack et al., 2012). Foram também feitos estudos in vitro para avaliar o efeito do óleo essencial de Tomilho (Thymus vulagris), rosmaninho (Rosmarinus officinalis) e orégão (Origanum vulgare) numa mistura com uma dose subletal de ácido láctico numa população de L. monocytogenes. com o objetivo de prevenir infeções provocadas por este agente bacteriano, as conclusões deste estudo
revelaram que uma dose sub-letal de ácido láctico aumenta a atividade antilisterial do óleo essencial do tomilho e do rosmaninho mas os efeitos sinergéticos diminuem com concentrações maiores dos óleos (Dimitrijević et al., 2007). Outro dos estudos in vitro feitos com esta espécie diz respeito à avaliação do seu efeito na sobrevivência e crescimento de alguns agentes patogénicos, os testes demonstraram a atividade antimicrobiana do óleo principalmente contra o agente patogénico Pseudomonas aeruginosa (Al-Bayati, 2008).
1.6.3. Thymus mastichina L.
Nome Comum: Tomilho bela-luz; sal-puro; tomilho-alvadio-do-algarve
Espécie: Thymus mastichina L. Género: Thymus
Família: Labiatae (Lamiaceae) Ordem: Lamiales
Classe: Magnoliopsida Subclasse: Lamiidae Divisão: Spermatophyta
Subdivisão: Magnoliophytina (Angiospermae) Reino: Plantae
Domínio: Eucária
Figura 8- Tomilho bela-luz, Thymus mastichina
(adaptado de Flora.on, 2012)
1.6.3.1. Distribuição geográfica
Thymus mastichina L., também designado por Tomilho bela-luz ou sal puro, é um pequeno arbusto perene da família Lamiaceae, endémico da Península Ibérica e muito frequente em Portugal (Cunha et al., 2007; Girón et al., 2012; Miguel et al., 2004). É uma planta heliófita e ruderal (que vive nos caminhos e beiras das estradas), é também muitas vezes encontrado em terrenos incultos, matos e matagais um pouco por todo o país (Cunha et al., 2007). Em Portugal encontra-se distribuído de norte a sul do país (Stahl-Biskup & Sáez, 2002), destacando-se a região de Trás-os-Montes, Beira Alta e Algarve (Girón et al., 2012).
1.6.3.2. Morfologia
O Thymus mastichina L. é uma espécie subarbustiva de 20-45 cm de altura, com ramos lenhificados na base, com caules puberulentos, eretos, ou ascendentes (Tavares et al., 2010). As suas folhas geralmente excedem os fascículos de folhas axilares, lineares, subagudas, sésseis, tomentosas, de margens revolutas e esparsamente ciliadas. Na base apresenta inflorescências verticilastros até 10 cm, espiciformes ou capituliformes, de brácteas semelhantes às folhas e excedendo os verticilastros. O cálice tem 3 a 4 mm, verde-acinzentado, de dentes tão compridos como largos, geralmente não ciliados. Possui também uma corola de 4 a 5 mm, esbranquiçada (Cunha et al., 2007).
Adapta-se bem ao cultivo, exigindo solos com boa exposição, de preferência virado a Sul, e bem drenados. É uma espécie muito rústica, bastante resistente à geada, às doenças e pragas (Gordo et al., 2012).
Na altura da floração que ocorre entre Maio e Setembro esta espécie produz flores que se agrupam em espigas e apresentam corola branca-rosada (Cunha et al., 2007; Tavares et al., 2010).
1.6.3.3. Bioquímica
Os estudos científicos sobre a composição dos óleos essenciais desta planta, ainda é uma área pouco explorada.
A composição do óleo essencial das partes aéreas do Thymus mastichina contém monoterpenos e sesquiterpenos entre eles o 1,8-cineol, o barneol e o linalol que são os principais componentes do óleo essencial (Albano & Miguel, 2011; Albano et al., 2012; Miguel et al., 2004; Salgueiro et al., 1997; Salgueiro et al., 2000).
Os compostos fenólicos presentes nesta espécie são o ácido carnósico (Vegara et al., 2011) a luteolina e o ácido rosmarínico (Gordo et al., 2012).
1.6.3.4. Aplicações
Esta planta possui um forte aroma a eucalipto e é muito utilizada devido às suas numerosas propriedades medicinais. O seu óleo possui um elevado efeito antioxidante (Albano & Miguel, 2011; Albano et al., 2012; Miguel et al., 2004).
Em fitoterapia, as partes aéreas são usadas nas afeções das vias respiratórias (gripe, catarros, tosse irritativa) e também nas digestões lentas, gastrites crónicas e dores espasmódicas do tubo digestivo (Cunha et al., 2007; Gordo et al., 2012).
Esta espécie é muito utilizada em aromaterapia como relaxante, desinfetante e soporífero. As folhas também são usadas em culinária, o seu óleo essencial é utilizado como aditivo alimentar em vários produtos pois substitui facilmente o sal na alimentação (Gordo et al., 2012). Devido às suas propriedades relaxantes, o óleo essencial não deve ser utilizado antes de conduzir ou noutras atividades que exijam concentração (Cunha et al., 2007).
1.6.3.5. Estudos in vivo e in vitro sobre os efeitos dos seus extratos
Os estudos in vivo e in vitro feitos com o tomilho bela-luz ainda estão pouco desenvolvidos sendo principalmente encontrados estudos sobre o seu óleo essencial (Salgueiro et al., 1997; Salgueiro et al., 2000) e estudos sobre a avaliação da capacidade antioxidante do seu óleo (Miguel et al., 2004)
Leal e colaboradores (2013) provaram que este tomilho apresenta atividade antifúngica contra o fungo Aspergillus fumigatus.
Um estudo lavada a cabo por Giner e colaboradores (2012) utilizando extratos hidro-etanólicos de Thymus mastichina e de outras espécies provaram que o tomilho bela-luz apresentou atividade antimicrobiana porém devem ser feitos mais estudos para saber qual os compostos presentes nesta espécie que provocam esta atividade.
Gordo e colaboradores (2012) através do guia citotóxico de extratos de diclorometano e etanol usando a linha celular HCT (colon cancer cell line) conseguiram identificar nove compostos sakuranetina (1), sterubina (2), ácido oleanólico (3), acido ursólico (4), luteína (5), beta-sitosterol (6), acido rosmarínico (7), 6-hidoxiluteolina-7-O-beta-glucopiranosida (8) e hidroxiapigenina-7-O-beta-glucopiranosida, a citotoxicidade desses compostos foi testada nas HCT. O composto 4 mostrou possuir citotoxicidade e uma fração composta de uma mistura (1:1) dos ácidos triterpenóides 3 e 4 provou possuir também citotoxicidade contra esta linha celular, provando que esta espécie poderá ter um efeito protetor contra o cancro do cólon.
1.6.4. Thymus x citriodorus L. Nome Comum: Tomilho limão Espécie: Thymus x citriodorus Género: Thymus
Família: Labiatae (Lamiaceae) Ordem: Lamiales
Classe: Magnoliopsida Subclasse: Lamiidae Divisão: Spermatophyta
Subdivisão: Magnoliophytina (Angiospermae) Reino: Plantae
Domínio: Eucária Figura 9 - Tomilho limão, Thymus x
citriodorus
(adaptado de Flora Digital de Portugal, 2013)
1.6.4.1. Distribuição geográfica
O Thymus x citriodorus é um híbrido entre o tomilho-poêjo (Thymus pulegioides) e o tomilho vulgar (Thymus vulgaris) (Tavares et al., 2010) e é originário do Sul da Inglaterra (Cunha et al., 2007; Stahl-Biskup & Holthuijzen, 1995; 2005).
As condições climáticas preferenciais desta espécie são de boa exposição solar e solos bem drenados, preferencialmente calcários (Tavares et al., 2010).
1.6.4.2. Morfologia
O tomilho-limão é um arbusto perene, semi-lenhoso, pubescente, com porte ereto atingindo até 30 cm de altura e com aroma a limão. As folhas são estreitas, ovais a lanceoladas, de cor verde ou amarelas e brancas em algumas cultivares, as flores são brancas ou ligeiramente rosadas e a floração ocorre durante o Verão (Tavares et al., 2010).
1.6.4.3. Bioquímica
Os principais constituintes encontrados nas folhas do tomilho limão são flavonoides, ácidos fenólicos e taninos.
Os principais compostos fenólicos encontrados nesta espécie são derivados de O-glicosilados da luteolina e da apigenina, bem como o ácido rosmarínico (Pereira et al., 2010).
O óleo essencial desta espécie é maioritariamente constituído por geraniol seguido pelo carvacrol e acetato de geranilo além destes constituintes também possui geranial e neral que são responsáveis pelo seu aroma a limão (Horváth et al., 2006; Lisi et al., 2011; Sacchetti et al., 2005).
1.6.4.4. Aplicações
O extrato das folhas do tomilho limão, especialmente o seu óleo essencial é um poderoso antisséptico, desodorizante e desinfetante (Omidbaigi et al., 2005). O óleo do tomilho limão é usado na aromaterapia para tratar a asma e outras complicações respiratórias, especialmente em crianças (Horváth et al., 2006). O tomilho limão também é muito utilizado em chás e saladas (Horváth et al., 2006).
1.6.4.5. Estudos in vivo e in vitro sobre os efeitos dos seus extratos
Os trabalhos realizados ao nível desta espécie são na sua maioria estudos da composição do seu óleo essencial (Horváth et al., 2006; Omidbaigi et al., 2005; Stahl-Biskup & Holthuijzen, 1995). As propriedades antioxidantes e antimicrobianas do tomilho limão também são muito estudadas. Um estudo levado a cabo na Itália avaliou a capacidade antioxidante e antimicrobiana de 11 espécies de plantas, sendo o tomilho limão a espécie que apresentou melhores resultados (Sacchetti et al., 2005).
Os efeitos antioxidantes e citoprotectores com extratos etanólicos purificados desta espécie revelaram a sua elevada capacidade antioxidante e citoprotectora utilizando modelos de stresse químico induzido pelo dicromato de potássio (DK) com células HepG2 (Pereira et al., 2013a).
2. Objetivos
O principal objetivo deste trabalho foi comparar os extratos obtidos de três espécies de tomilho, o tomilho vulgar (Thymus vulgaris L.), o Tomilho bela-luz (Thymus mastichina L.) e o tomilho limão (Thymus x citriodorus L.), em termos de composição química e de efeitos biológicos usando células em cultura.
Mais especificamente ao longo deste trabalho pretendeu-se:
i) Obter extratos aquosos e hidro-etanólicos destas três espécies, e proceder ao seu fracionamento de acordo com a sua polaridade por extração sólida.
ii) Caracterizar estes extratos e respetivas frações, no que diz respeito aos seus principais componentes usando as técnicas de HPLC.
iii) Obter e caracterizar os óleos essenciais destas três espécies.
iv) Avaliar a atividade antioxidante e a atividade anticancerígena dos extratos e fracionamentos, usando modelos in vitro, nomeadamente avaliar a citotoxicidade/segurança destes extratos em ensaios in vitro,
3. Material e métodos
3.1. Origem do material vegetal
Neste estudo foram utilizados 3 espécies de tomilho (Thymus vulgaris, Thymus mastichina e Thymus x citriodorus) que foram adquiridas à empresa ERVITAL (ERVITAL- Plantas Aromáticas e Medicinais, Lda; Mezio Castro Daire, Portugal) e foram produzidos em condições de produção biológica, em estufa. Entre a sua colheita e utilização, as amostras foram congeladas a uma temperatura de 20 °C. Antes da preparação dos extratos, as folhas e flores foram removidas dos talos e troncos.
3.2. Extração dos óleos essenciais
3.2.1. Princípio do método
Para a extração dos óleos essenciais utilizou-se o método de hidrodestilação através da metodologia padrão de arraste por vapor de água. É um sistema constituído por um recipiente com água a ferver que injeta vapor em outro recipiente contíguo, no qual se encontra o material vegetal para extração (Richter & Schellenberg, 2007). Na sua passagem pelo recipiente contíguo o vapor de água fica misturado com os compostos voláteis (óleos essenciais) do material botânico (Edris et al., 2003; Richter & Schellenberg, 2007). Em seguida, o vapor é condensado e arrefecido, obtendo-se no final um extrato de mistura líquida de óleos essenciais, num recipiente. Após algumas horas de repouso, os óleos essenciais separam-se da água, formando-se duas fases, as quais podem ser finalmente separadas (Edris et al., 2003).
3.2.2. Procedimento
Utilizou-se aproximadamente 500 g de massa foliar para cada espécie de tomilho. Recolheu-se o produto da destilação e separou-se a fase aquosa da fase orgânica por centrifugação a 3600 rpm durante 20 minutos. O óleo foi coletado com o auxílio de uma micropipeta, pesado e colocado num tubo de vidro e por fim congelado a –20 °C. Após a extração, foram calculados os rendimentos dos óleos obtidos.
3.3. Análise da composição do óleo essencial
3.3.1. Princípio do método
A cromatografia é um método físico de separação. Esta técnica baseia-se na migração diferencial dos componentes de uma mistura, que ocorre devido a diferentes interações, entre