Faculdade de Medicina da Universidade de Lisboa
Clínica Universitária de Pediatria
Trabalho Final do Mestrado Integrado em Medicina
Sildenafil na hipertensão pulmonar persistente do
recém-nascido associada a hérnia diafragmática congénita
Autor: Gonçalo Filipe Lopes Miranda
Orientador: Kátia Cardoso
2
Índice
Resumo ...3 Abstract ...4 Abreviaturas ...5 Introdução...6 Casos clínicos ...7 Caso clínico 1 ...7 Caso clínico 2 ...9 Caso clínico 3 ... 10 Discussão ... 12 Agradecimentos ... 16 Bibliografia ... 17 Anexos ... 203
Resumo
A hipertensão pulmonar persistente do recém-nascido é um dos principais fatores determinantes da morbilidade e mortalidade em doentes com hérnia diafragmática congénita. A utilização de vasodilatadores pulmonares tem melhorado a sua evolução clínica e prognóstico. O óxido nítrico inalado tem sido o vasodilatador mais utilizado embora com resposta insuficiente nestes casos, pelo que se tem procurado identificar novas alternativas terapêuticas.
O sildenafil é um inibidor seletivo da fosfodiesterase tipo 5 que reduz a resistência vascular pulmonar e tem sido utilizado no tratamento de vários tipos de hipertensão pulmonar. O seu uso em idade pediátrica é recente, sendo alvo de grande controvérsia.
Descrevem-se três casos de recém-nascidos com hérnia diafragmática congénita que mantiveram hipertensão pulmonar grave após otimização das medidas terapêuticas convencionais atualmente recomendadas, pelo que se recorreu ao tratamento com sildenafil. Discute-se o conhecimento científico existente na literatura sobre a utilização deste fármaco na patologia em causa, relacionando-o com a experiência clínica do seu uso nos casos descritos.
Palavras-chave
4
Abstract
Persistent pulmonary hypertension of the newborn is one of the major determining factors of morbidity and mortality among patients with congenital diaphragmatic hernia. The use of pulmonary vasodilators has been proved to enhance the clinical course and prognosis of these patients. Inhaled nitric oxide has been the most commonly used vasodilator, although with insufficient response among congenital diaphragmatic hernia patients, thus it has been attempted to identify new therapeutic alternatives.
Sildenafil is a selective phosphodiesterase type 5 inhibitor that reduces the pulmonary vascular resistance and it has been used for the treatment of pulmonary arterial hypertension. Its application among pediatric patients is of recent date and it is subject of much controversy.
This paper describes three cases of newborns with congenital diaphragmatic hernia who maintained severe pulmonary arterial hypertension, even though the conventional therapeutics, which are currently recommended, had been optimized. Thereafter the treatment with sildenafil was started. Subject of discussion is the scientific knowledge in literature about the use of sildenafil in congenital diaphragmatic hernia, relating it to the clinical experience of its use in the cases described.
Keywords
5
Abreviaturas
BNF British National Formulary
ECMO Oxigenação por membrana extracorpórea ELSO Extracorporeal life support organization
EMA Agência europeia de medicamentos ETT Ecocardiograma transtorácico FDA U. S. Food and Drug Administration GMPc Monofostato cíclico de guanosina HDC Hérnia diafragmática congénita HTP Hipertensão pulmonar
HTPP Hipertensão pulmonar persistente ONi Óxido nítrico inalado
PDE-5 Fosfodiesterase tipo 5
PSAP Pressão sistólica da artéria pulmonar
RN Recém-nascido (s)
SNG Sonda nasogástrica
SpO2 Saturação periférica de oxigénio
UCIPed Unidade de Cuidados Intensivos Pediátricos VAFO Ventilação de alta frequência oscilatória VMC Ventilação mecânica convencional VNI Ventilação não invasiva
6
Introdução
A hérnia diafragmática congénita (HDC) é uma anomalia congénita que afeta 1-5/10.000 nados-vivos [1]. Definida como a presença de um orifício no diafragma, mais frequentemente com localização posterolateral esquerda, que permite a herniação de conteúdo abdominal para o tórax, esta patologia condiciona um anormal desenvolvimento vascular pulmonar com diminuição do leito capilar, espessamento da musculatura lisa vascular arterial e vasoconstrição que podem culminar no estabelecimento de hipertensão pulmonar persistente (HTPP) do recém-nascido (RN). Esta carateriza-se pela presença de elevada resistência vascular pulmonar e shunt direito-esquerdo através do foramen ovale ou do canal arterial, na ausência de anomalias cardíacas congénitas [2][3]. Nos RN com HDC a hipertensão pulmonar (HTP) é um dos principais fatores determinantes da morbilidade e mortalidade [4].
A abordagem terapêutica de doentes com HDC nos países europeus tem sido baseada nas recomendações elaboradas pelo CDH EURO Consortium. A gravidade clínica, a necessidade de abordagem interdisciplinar e a complexidade das técnicas diagnósticas e terapêuticas determinam a importância dos partos de fetos com diagnóstico pré-natal de HDC se realizarem em centros terciários diferenciados com a experiência e os recursos necessários ao melhor tratamento destes casos complexos. Em termos terapêuticos tem-se tornado cada vez mais frequente o recurso a estratégias como a correção cirúrgica apenas depois de alcançada a estabilidade clínica, a ventilação de alta frequência oscilatória (VAFO), estratégias ventilatórias com parâmetros minimamente invasivos e hipercapnia permissiva, e a oxigenação por membrana extracorpórea (ECMO). [5] A utilização de vasodilatadores pulmonares mostrou melhorar a evolução clínica e o prognóstico dos doentes com HTPP associada. Até à data o óxido nítrico inalado (ONi) é considerado o tratamento padrão [5][6]. Contudo, ao contrário de outras causas de HTPP, RN com HDC parecem não responder tão eficazmente à terapêutica com ONi [7]. Enquanto a taxa de resposta em todos os RN com HTPP é de cerca de 60%, RN com HDC têm uma taxa de resposta de apenas 30% [6]. Adicionalmente, o ONi é um fármaco muito dispendioso não estando disponível em muitos dos centros de tratamento [8]. Assim, torna-se imperativa a identificação de novas alternativas terapêuticas. Nesse sentido têm sido propostos vários fármacos como análogos da prostaciclina [9], antagonistas dos recetores da endotelina-1 [10], inibidores da fosfodiesterase tipo 3 [11], sendo que um outro grupo, os inibidores da fosfodiesterase tipo 5 (PDE-5), tem demonstrado particular interesse.
O sildenafil é um inibidor seletivo da PDE-5 que reduz a resistência vascular pulmonar com poucos efeitos sistémicos. Inibindo a PDE-5, mantem os níveis intracelulares de monofostato cíclico de
7 guanosina (GMPc) prolongando o efeito vasodilatador do ON nas artérias pulmonares [12]. Este fármaco tem sido utilizado no tratamento de vários tipos de HTP, sendo o seu uso em idade pediátrica recente e alvo de grande controvérsia [13].
O objetivo deste trabalho é descrever a experiência da administração de sildenafil no tratamento de RN com HTPP associada a HDC, internados na Unidade de Cuidados Intensivos Pediátricos (UCIPed) do Departamento de Pediatria do Hospital de Santa Maria - Centro Hospitalar Lisboa Norte e tratados em colaboração interdisciplinar com outras unidades do Departamento de Pediatria assim como com os Serviços de Cardiologia Pediátrica e Cirurgia Cardiotorácica do Hospital de Santa Cruz - Centro Hospitalar Lisboa Ocidental.
Casos clínicos
Caso clínico 1
RN do sexo feminino, primeira filha de pais saudáveis não consanguíneos, com diagnóstico pré-natal às 33 semanas de gestação de HDC à esquerda com herniação de conteúdo intestinal e gástrico condicionando hipoplasia do pulmão esquerdo. Parto às 38 semanas e 6 dias por cesariana de emergência motivada por cardiotocograma patológico e ecografia fetal com alterações graves da fluxometria fetal. O índice de Apgar foi 3, 5 e 8 ao 1º, 5º e 10º minutos, respetivamente, e o peso ao nascer de 2340 g, leve para a idade gestacional.
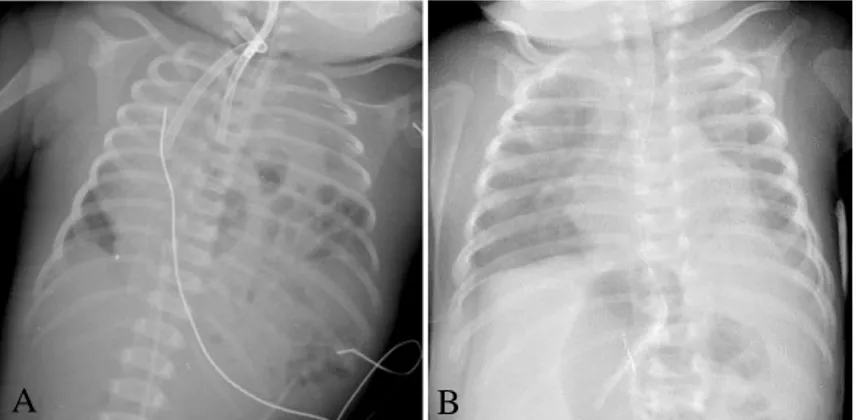
Após o parto foi intubada e ventilada com VAFO, mantendo hipoxemia apesar da otimização dos parâmetros ventilatórios. Na radiografia de tórax observou-se hemicampo pulmonar direito ocupado pelo coração e hemicampo pulmonar esquerdo ocupado por conteúdo intestinal (Figura 1-A). O ecocardiograma transtorácico (ETT) revelou desvio extremo do coração para a direita, sinais de HTP major com cavidades direitas muito aumentadas, shunt direito-esquerdo através do canal arterial e ausência de alterações estruturais. Perante a confirmação de HTP e persistência da hipoxemia iniciou ONi e suporte inotrópico. No entanto, não se obteve resposta significativa, pelo que iniciou terapêutica com ECMO veno-arterial, verificando-se subida imediata da saturação periférica de oxigénio (SpO2).
Ao 5º dia de vida, após alcançada estabilidade clínica, realizou correção cirúrgica da HDC com reposicionamento do conteúdo intestinal na cavidade abdominal e colocação de prótese, sem complicações intraoperatórias (Figura 1-B). O pós-operatório complicou-se com formação de hemotórax que foi drenado por toracotomia com colocação de drenos torácicos. Ambas as cirurgias decorreram sob ECMO.
8 Ao 27º dia de vida é suspensa a terapêutica com ECMO e VAFO, ficando ventilada com ventilação mecânica convencional (VMC) até e ao 59º dia de vida, quando é extubada eletivamente para ventilação não invasiva (VNI).
Por persistência de HTP grave apesar da utilização de ONi, ao 33º dia de vida foi associado sildenafil na dose 1,5 mg a cada 8 horas por sonda nasogástrica (SNG). Suspendeu terapêutica com ONi ao 39º dia de vida. No 45º dia de vida aumentou a dose de sildenafil para 2 mg a cada 6 horas que manteve até à data de transferência.
Do ponto de vista neurológico há a referir a ocorrência de crises convulsivas transitórias ao 4º dia de vida. Posteriormente realizou eletroencefalograma que não mostrou alterações. As ecografias cerebrais transfontanelares seriadas e a ressonância magnética cranioencefálica evidenciaram alterações compatíveis com padrão de lesão hipoxico-isquémica.
Durante o internamento na UCIPed esteve sob sedoanalgesia, realizou múltiplas transfusões de hemoderivados, fez ciclos de antibioticoterapia para tratamento de três episódios de pneumonia associada aos cuidados de saúde e manteve alimentação parentérica até ao 26º dia de internamento, que se complicou com colestase.
Ao 73º dia de vida foi transferida para a Unidade de Pneumologia Pediátrica, sob VNI e sildenafil que aumentou para 3 mg a cada 6 horas. Houve necessidade de ser transferida para a UCIPed por duas vezes por agravamento do quadro de síndrome de dificuldade respiratória, voltando a ser ventilada com VAFO e a realizar terapêutica com ONi, mantendo sempre terapêutica com sildenafil.
Teve alta para o domicílio ao 213º dia de vida mantendo VNI e sildenafil na dose 4 mg a cada 6 horas, com plano de reabilitação motora, respiratória e treino da deglutição.
Suspendeu o sildenafil ao 234º dia de vida depois de verificada melhoria dos sinais de HTP. Aos 15 meses realizou ETT que demonstrou ausência de sinais de HTP e boa função biventricular.
Figura 1. Radiografias de tórax do doente 1 pré-operatório (A); pós-operatório (B).
9 Atualmente, com 18 meses, mantém necessidade de VNI durante o período de sono noturno e oxigénio suplementar no restante período do dia. Tem um atraso global ligeiro do desenvolvimento psicomotor.
Caso clínico 2
RN do sexo feminino, primeira filha de pais saudáveis não consanguíneos, com diagnóstico pré-natal às 32 semanas de gestação de HDC à esquerda. Parto às 39 semanas e 4 dias por cesariana eletiva devido a patologia fetal. O índice de Apgar foi 7, 8, 8 ao 1º, 5º e 10º minutos, respetivamente, e o peso ao nascer de 3150 g.
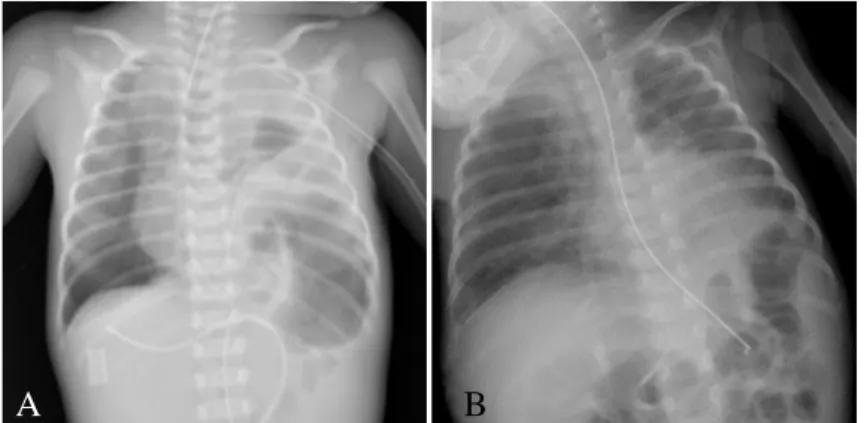
Após o parto foi intubada, ventilada com VAFO, iniciou terapêutica com ONi e foi medicada com surfatante. Na radiografia de tórax observou-se a presença de ansas intestinais no hemitórax esquerdo com desvio do mediastino para a direita (Figura 2-A). O ETT revelou sinais de HTP com cavidades cardíacas direitas dilatadas, canal arterial grande e ausência de alterações estruturais. Iniciou suporte inotrópico com aminas vasoativas.
No 2º dia de vida, por persistência da hipoxemia e instabilidade hemodinâmica, foi decidido iniciar terapêutica com ECMO. Dado que esta técnica não está disponível no hospital onde decorreu o parto e uma vez que o RN se encontrava clinicamente instável foi necessário que a equipa do centro de referência de ECMO pediátrico se deslocasse a este hospital. Após iniciar ECMO veno-arterial verificou-se uma subida imediata da saturação periférica de oxigénio (SpO2), sendo então transferida, pela equipa do transporte interhospitalar pediátrico, para a UCIPed.
Realizou correção cirúrgica da HDC sob ECMO ao 9º dia de vida com reposicionamento do conteúdo herniado e colocação de prótese, sem complicações imediatas (Figura 2-B).
Por presença de coágulos na cânula arterial que foram aspirados por diversas vezes, houve necessidade de proceder a interrupções transitórias do ECMO. Por este motivo e atendendo à estabilidade clínica, foi descanulada eletivamente de ECMO ao 15º dia de vida. Cerca de 12 horas depois inicia quadro de hipoxemia e hipotensão com necessidade de terapêutica expansora. O ETT mostrou manutenção de sinais de HTP, pelo que reiniciou VAFO e também ECMO.
Ao 22º dia de vida iniciou sildenafil na dose 1 mg a cada 6 horas por SNG, tendo aumentado gradualmente até um máximo de 3 mg a cada 8 horas. Manteve esta dose até ao 43º dia de vida, altura em que foi reduzida após realização de ETT que mostrou melhoria dos sinais de HTP, com pressão sistólica da artéria pulmonar (PSAP) de 16 mmHg. Na reavaliação ecocardiográfica três dias depois verificou-se agravamento dos sinais de HTP, com PSAP de 70 mmHg, pelo que não foi possível prosseguir com redução da dose de sildenafil.
10 Atendendo à melhoria progressiva do quadro clínico, suspendeu a terapêutica com ECMO ao 26º dia de vida, VAFO ao 34º dia de vida e ONi ao 36º.
Durante o internamento na UCIPed manteve-se sob sedoanalgesia, teve necessidade de suporte transfusional de hemoderivados e fez vários ciclos de antibioticoterapia devido à ocorrência de dois episódios de pneumonia associada aos cuidados de saúde.
Foi transferida para a Unidade de Pneumologia Pediátrica ao 47º dia de vida, tendo mantido necessidade de VNI até ao 107º dia de vida. Ao 135º dia de vida realiza ETT, não se observando aspetos sugestivos de HTP, pelo que suspendeu sildenafil. Por deiscência da sutura operatória com herniação de ansas intestinais para o tórax, realizou ao 148º dia de vida nova cirurgia com redução do conteúdo herniado e colocação de nova prótese.
Teve alta para o domicílio ao 163º dia de vida com plano de reabilitação motora, respiratória e treino da deglutição.
Aos 6 meses de vida esteve novamente internada na Unidade de Pneumologia Pediátrica por infeção respiratória alta com hipoxemia e fez antibioticoterapia, tendo tido alta com necessidade de oxigénio suplementar.
Caso clínico 3
RN do sexo masculino, segundo filho de pais saudáveis não consanguíneos, com diagnóstico pré-natal às 22 semanas de gestação de HDC à esquerda com herniação do estômago, ansas intestinais, baço e lobo hepático esquerdo e com franca hipoplasia pulmonar observada em ressonância magnética fetal. Fez indução da maturação pulmonar com betametasona. Parto às 37 semanas e 3 dias por cesariana eletiva devido deteção na ecografia fetal de derrame pleural esquerdo de grandes dimensões. O índice de Apgar foi 5 e 8 ao 1º e 5º minutos, respetivamente, e o peso ao nascer de 2680 g.
Após o parto foi intubado, ventilado com VAFO, fez surfatante e iniciou terapêutica com ONi por hipoxemia refratária e suporte inotrópico com aminas vasoativas. Foi submetido a colocação de
Figura 2. Radiografia de tórax do doente 2 pré-operatória (A); pós-operatória (B).
11 dreno torácico. Na radiografia de tórax confirmou-se a presença de HDC. No ETT observa-se desvio da aorta para a direita em resultado do efeito de massa de derrame pleural, com sinais de HTP e ausência de cardiopatia estrutural (Figura 3-A).
Por persistência de hipoxemia, apesar da otimização da terapêutica médica, iniciou no 2º dia de vida terapêutica com ECMO veno-arterial com melhoria imediata da SpO2. Posteriormente interrompeu VAFO passando a VMC.
Foi submetido a cirurgia para correção da HDC sob ECMO ao 8º dia de vida (Figura 3-B). A cirurgia e o pós-operatório imediato complicaram-se com hemorragia para a cavidade abdominal com instabilidade hemodinâmica. Houve necessidade de descontinuar a terapêutica anti-coagulante realizada com ECMO e, posteriormente, a própria técnica por se manter a hemorragia e se verificar maior estabilidade respiratória após a cirurgia corretiva. No pós-operatório verificou-se a ocorrência de quilotórax e ascite quilosa, com necessidade de colocação de drenos torácico e abdominal e terapêutica com octreótido.
Iniciou terapêutica com sildenafil ao 16º dia de vida na dose 1 mg a cada 6 horas por SNG. Aumentou progressivamente a dose alcançando, no 32º dia de vida, um máximo de 3 mg a cada 8 horas. Ao 35º dia de vida diminuiu para 2 mg a cada 8 horas e suspendeu a terapêutica ao 39º dia de vida, altura em que também suspendeu a terapêutica com ONi e passou a VNI.
Durante o internamento na Unidade de Cuidados Intensivos Pediátricos manteve-se sob sedoanalgesia, teve necessidade de suporte transfusional de hemoderivados, fez vários ciclos de antibioticoterapia para tratamento de pneumonias associadas aos cuidados de saúde e dois episódios de sépsis sem agente etiológico identificado e terapêutica antifúngica após isolamento de Candida
parapsilosis no líquido ascítico.
Ao 69º dia de internamento foi transferido para a Unidade de Pneumologia Pediátrica, mantendo VNI e antibioticoterapia.
Figura 3. Radiografia de tórax do doente 3 pré-operatória (A); pós-operatória (B).
12 Teve alta para o domicílio ao 140º dia de vida com necessidade de VNI durante os períodos de sono e oxigénio suplementar nos restantes períodos e com plano de reabilitação motora, respiratória e treino da deglutição.
Foi reinternado aos 6 meses de vida por infeção respiratória baixa com necessidade de tratamento com antibioticoterapia.
Discussão
Nos casos clínicos dos RN com HDC internados na UCIPed, descreveu-se a abordagem terapêutica da HTPP salientando a utilização de sildenafil.
Todos os doentes apresentaram diagnóstico pré-natal de HDC. Tal como recomendado no consenso do CDH EURO Consortium [5] para o tratamento de doentes com HDC, nos casos clínicos 1 e 3 o parto foi programado num centro diferenciado com experiência e recursos necessários à abordagem pós-natal desta patologia. No período pós-parto, seguindo as indicações do consenso, os três doentes foram intubados e ventilados com VAFO, iniciaram terapêutica com ONi e colocaram SNG. A radiografia de tórax confirmou o diagnóstico de HDC, o ETT mostrou sinais de HTP e excluiu cardiopatias congénitas. De acordo com os critérios da Extracorporeal life support organization (ELSO) [14] e das recomendações do CDH EURO Consortium [5] para o tratamento com ECMO, todos os doentes iniciaram esta terapêutica, tendo sido submetidos, assim que adquirida a estabilidade clínica, a cirurgia de correção de HDC sob ECMO. Perante a persistência de HTP, tendo-se já otimizado as estratégias terapêuticas recomendadas, foi decidido realizar terapêutica
off-label com sildenafil.
A Agência Europeia de Medicamentos (EMA) aprova o sildenafil para o tratamento de adultos e crianças entre 1 e 17 anos de idade com HTP [15]. Já a U. S. Food and Drug Administration (FDA) aprova o uso do medicamento apenas em adultos [16] e publicou em 2012 um comunicado contra o seu uso em doentes pediátricos [17] baseando-se nos resultados de um ensaio clínico, STARTS-1 [STARTS-18], que tinha como objetivo avaliar os efeitos do sildenafil oral no tratamento de crianças com HTP. Segundo a FDA este estudo mostrou maior risco de mortalidade em crianças tratadas com uma dose alta de sildenafil comparado com crianças tratadas com uma dose baixa, sendo que o tratamento com baixa dose não revelou melhoria da capacidade para o exercício após 16 semanas de tratamento. Contudo, os resultados do prolongamento deste estudo, STARTS-2 [19], mostraram que apesar de a mortalidade em doentes tratados com alta dose ser maior quando comparada com o grupo tratado com baixa dose, todos os doentes tratados com sildenafil apresentaram uma sobrevivência favorável quando comparada com doentes não submetidos a esta terapêutica. É ainda
13 importante referir que o aumento de mortalidade ocorreu após dois anos de tratamento. Assim, o efeito de aumento da mortalidade aplica-se ao uso deste fármaco a longo prazo e não ao uso a curto prazo, como na fase de internamento em unidade de cuidados intensivos, quando a relação risco-benefício do tratamento com sildenafil poderá ser favorável.
A Pediatric Critical Care Medicine publicou recentemente uma revisão sistemática de 49 ensaios clínicos onde se incluíram 625 crianças, das quais 140 eram RN, que veio contrariar o comunicado da FDA, concluindo que não existe evidência de reações adversas graves em RN tratados com sildenafil, admitindo-o como opção viável para o tratamento de HTP de doentes em idade pediátrica [20]. Numa metanálise da Cochrane Collaboration realizada com o objetivo de avaliar a eficácia e a segurança do sildenafil no tratamento de HTPP do RN em centros que não dispunham de ONi, observou-se uma melhoria da oxigenação e redução da mortalidade nos doentes tratados com sildenafil, sem ocorrência de efeitos adversos significativos [21]. Num estudo prospetivo de 36 RN com HTPP verificou-se melhoria da oxigenação após o tratamento com sildenafil endovenoso [22]. Num estudo realizado em ratos com HDC, a administração pré-natal de sildenafil revelou melhoria do desenvolvimento pulmonar, aumento da densidade de vasos pulmonares, redução da hipertrofia do ventrículo direito e melhoria da resposta da artéria pulmonar ao dador de ON [23].
Nos casos clínicos descritos verificou-se uma diminuição da necessidade de suporte ventilatório, necessidade de agentes vasoativos e melhoria contínua dos resultados dos ETT durante o tratamento com sildenafil, sendo que atualmente os doentes não apresentam HTP. No entanto, tratando-se este trabalho de uma análise de apenas três casos, não foi possível estabelecer uma associação ou relação causal entre a utilização do sildenafil e a melhoria da HTP. Contudo, constatou-se que no caso clínico 2 houve um agravamento acentuado da HTP com PSAP que aumentou de 16 mmHg horas antes da redução do sildenafil para 70 mmHg no dia seguinte, impedindo que se reduzisse mais a dose. Assim, a eficácia do tratamento poderá ter sido resultado da combinação das várias estratégias terapêuticas, incluindo o efeito do sildenafil.
Na revisão publicada pela Pediatric Critical Care Medicine, as únicas reações adversas identificadas em RN foram hipotensão e a persistência do canal arterial [20]. Já no estudo STARTS-1 [STARTS-16] e no seu prolongamento STARTS-2 [STARTS-17] as reações adversas mais frequentemente identificadas foram cefaleias, náuseas, vómitos e tosse. No estudo STARTS-2, 5 dos 229 indivíduos do grupo tratado com sildenafil tiveram uma reação adversa grave, nomeadamente convulsão, hipersensibilidade, enterocolite, hipoxia ou arritmia ventricular. Nos casos descritos neste trabalho não se identificaram reações adversas relacionadas com o tratamento com sildenafil.
O primeiro estudo que carateriza a farmacocinética do sildenafil [24] mostrou que a excreção deste fármaco 24 horas depois do nascimento era cerca de um terço da observada nos adultos,
14 aumentando para um valor semelhante ao dos adultos uma semana mais tarde. Esta descoberta foi atribuída a alterações na expressão das enzimas hepáticas implicadas no metabolismo deste fármaco durante a primeira semana depois do nascimento. Sabe-se também que as caraterísticas farmacocinéticas do sildenafil em crianças, depois de ajustadas para o peso corporal, são semelhantes às dos adultos. Nestes, o sildenafil é rapidamente absorvido depois de administração oral, com uma biodisponibilidade de aproximadamente 40%, atingindo uma concentração sérica máxima em 0,5 a 2 horas. Tem uma ligação às proteínas plasmáticas de 96% e distribui-se extensivamente por todo o organismo. É metabolizado no fígado pelo citocromo P450, CYP3A4 (79%) e CYP2C9 (20%), no seu metabolito UK-103320. É excretado 80% nas fezes e 13% na urina, tendo uma semivida de aproximadamente 4 horas [25]. A administração de sildenafil nos casos clínicos descritos foi iniciada depois da primeira semana de vida, por via gastroentérica e ajustada ao peso corporal que, segundo o conhecimento científico, parece proporcionar a melhor farmacocinética.
A posologia de sildenafil para o tratamento de crianças com HTP ainda não está bem estabelecida. A dose de sildenafil via oral recomendada pela EMA [15] para crianças entre 1 e 17 anos de idade é de 10 mg 3 vezes por dia para doentes com menos de 20 kg e 20 mg 3 vezes por dia para doentes com mais de 20 kg. Doses superiores são desaconselhadas pela EMA. O British National
Formulary (BNF) for Children [26] recomenda o uso de doses semelhantes para doentes entre 1 e
17 anos de idade e sugere que o tratamento não licenciado de RN e crianças até 1 ano de idade se deve iniciar com uma dose de 0,25 a 0,5 mg/kg a cada 4-8 horas, com ajuste de acordo com a resposta clínica, não excedendo 30 mg por dia. Um estudo prospetivo alerta que em RN e lactentes previamente sujeitos a tratamento com ECMO existe uma grande variabilidade na farmacocinética do sildenafil, sendo que uma dose 0,5 a 2,0 mg/kg 4 vezes por dia proporciona uma exposição semelhante à dose recomendada para adultos de 20 mg 3 vezes por dia [27].
Nos três doentes as doses iniciais encontram-se no intervalo de dose inicial aconselhada pelo BNF para administração de sildenafil em RN [26], abaixo da posologia utilizada nos estudos revistos pela
Cochrane collaboration [21] e são sobreponíveis à dose média do estudo STARTS-1, a qual parece
apresentar a melhor eficácia e perfil de segurança [16].
Os doentes descritos são considerados de alto risco, pelo que mantêm vigilância em ambulatório por várias especialidades num esforço conjunto interdisciplinar para tratamento das comorbilidades e identificação e tratamento precoces de complicações que possam surgir [28].
Em suma, não obstante os avanços na abordagem diagnóstica e terapêutica, a HTP associada a HDC é ainda um dos maiores desafios nas unidades de cuidados intensivos neonatais e pediátricas, continuando a ser uma das principais causas de morbilidade e mortalidade em RN com esta
15 patologia. Assim, apesar da controvérsia, o sildenafil continua a ser um recurso importante do tratamento atual de HTP associada a diversas patologias, incluindo a HDC. Apesar de não ser possível neste trabalho estabelecer um nexo de causalidade, o sildenafil parece ter contribuído para a evolução clínica favorável destes doentes.
Embora decorra uma extensa investigação relativa à utilização do sildenafil, existem ainda algumas lacunas no que se refere ao momento ideal de início e suspensão deste tratamento. Assim torna-se importante promover a continuidade de novos estudos sobre o sildenafil e a investigação de possíveis alternativas. Neste âmbito, estão atualmente em curso ensaios clínicos para estudo da sua eficácia no tratamento crónico de RN com HDC [29] e no tratamento combinado com ONi de RN com HTPP [26][27], e um estudo de farmacocinética em RN pré-termo [32]. Recentemente têm também vindo a ser estudados novos inibidores da PDE-5 como o vardenafil e o tadalafil [33].
16
Agradecimentos
A realização deste trabalho não teria sido possível sem a ajuda de algumas pessoas a quem agradeço.
À Drª. Kátia Cardoso, minha orientadora neste trabalho, pela disponibilidade e ensinamentos constantes em todo o processo de orientação científica deste trabalho.
À Drª. Marisa Vieira, coordenadora da Unidade de Cuidados Intensivos Pediátricos pela autorização para a realização deste trabalho, assim como à restante equipa da UCIPed pelos ensinamentos sobre os cuidados de saúde em doentes pediátricos críticos.
À Paula Belmonte, secretária da Clínica Universitária de Pediatria e à Lurdes Barata da Biblioteca-CDI da Faculdade de Medicina da Universidade de Lisboa pelo auxílio no acesso à bibliografia necessária para a realização deste trabalho.
Ao Francisco Cunha e Alexandra Sitzberger pela revisão do trabalho e a todos os meus amigos, fundamentais no incentivo para a realização deste trabalho e em todo o meu percurso académico.
À minha família, em especial à minha mãe Carla, ao meu pai Carlos, à minha irmã Carina e às minhas avós Odete e Mercedes pelo apoio incondicional em todas as etapas da minha vida e em particular no meu percurso académico. A eles dedico este trabalho.
17
Bibliografia
[1] Tovar, J. A. (2012). Congenital diaphragmatic hernia. Orphanet J Rare Dis, 7(1), 1.
[2] Cabral, J. E., & Belik, J. (2013). Persistent pulmonary hypertension of the newborn: recent advances in pathophysiology and treatment. Jornal de Pediatria (Versao en Portugues), 89(3), 226-242.
[3] Nair, J., & Lakshminrusimha, S. (2014, March). Update on PPHN: Mechanisms and treatment. In Seminars in perinatology (Vol. 38, No. 2, pp. 78-91). WB Saunders.
[4] Wynn, J., Krishnan, U., Aspelund, G., Zhang, Y., Duong, J., Stolar, C. J., ... & Arkovitz, M. S. (2013). Outcomes of congenital diaphragmatic hernia in the modern era of management. The Journal of pediatrics, 163(1), 114-119.
[5] Reiss, I., Schaible, T., van den Hout, L., Capolupo, I., Allegaert, K., van Heijst, A., ... & Tibboel, D. (2010). Standardized postnatal management of infants with congenital diaphragmatic hernia in Europe: the CDH EURO Consortium consensus. Neonatology, 98(4), 354-364. [6] Vijfhuize, S., Schaible, T., Kraemer, U., Cohen-Overbeek, T. E., Tibboel, D., & Reiss, I. (2012).
Management of pulmonary hypertension in neonates with congenital diaphragmatic hernia. European Journal of Pediatric Surgery, 22(5), 374.
[7] Finer, N. N., & Barrington, K. J. (2006). Nitric oxide for respiratory failure in infants born at or near term. Cochrane Database Syst Rev, 4.
[8] Juliana, A. E., & Abbad, F. C. (2005). Severe persistent pulmonary hypertension of the newborn in a setting where limited resources exclude the use of inhaled nitric oxide: successful treatment with sildenafil. European journal of pediatrics, 164(10), 626-629.
[9] Nakayama, T., Shimada, H., Takatsuki, S., Hoshida, H., Ishikita, T., Matsuura, H., & Saji, T. (2007). Efficacy and limitations of continuous intravenous epoprostenol therapy for idiopathic pulmonary arterial hypertension in Japanese children. Circulation journal: official journal of the Japanese Circulation Society,71(11), 1785.
[10] Nakwan, N., Choksuchat, D., Saksawad, R., & Thammachote, P. (2009). Successful treatment of persistent pulmonary hypertension of the newborn with bosentan. Acta Pædiatrica, 98(10), 1683-1685.
[11] McNamara, P. J., Laique, F., Muang-In, S., & Whyte, H. E. (2006). Milrinone improves oxygenation in neonates with severe persistent pulmonary hypertension of the newborn. Journal of critical care, 21(2), 217-222.
[12] Sildenafil. DynaMed. Retrieved March 30, 2014 from http://web.a.ebscohost.com/dynamed/ detail?vid=3&sid=2dc42ee5-6429-47c9-ac4c-248ea627ee6f%40sessionmgr4003&hid= 4214&bdata=JnNpdGU9ZHluYW1lZC1saXZlJnNjb3BlPXNpdGU%3d#db=dme&AN =233582
[13] Wardle, A. J., Tulloh, R. M. R., & Wardle, R. (2013). Paediatric pulmonary hypertension and sildenafil: current practice and controversies. Archives of disease in childhood-Education & practice edition, 98(4), 141-147.
18 [14] Extracorporeal Life Support Organization (2013). ELSO Guidelines for Neonatal Respiratory
Failure. Extracorporeal Life Support Organization Guidelines, 1-5.
[15] European Medicines Agency. (2011). Assessment report for Revatio. EMA.europa.eu Retrieved March 30, 2014 from http://www.ema.europa.eu/ema/index.jsp?curl=pages/ medicines/human/medicines/000638/human_med_001033.jsp
[16] U.S. Food and Drug Administration. Drug Approval Package for Revatio (sildenafil). FDA.gov Retrieved March 30, 2014 from http://www.accessdata.fda.gov/ drugsatfda_docs/nda/2005/021845s000_RevatioTOC.cfm
[17] U.S. Food and Drug Administration. FDA Drug Safety Communication: FDA recommends against use of Revatio (sildenafil) in children with pulmonary hypertension. FDA.gov Retrieved March 30, 2014 from http://www.fda.gov/drugs/drugsafety/ ucm317123.htm. [18] Barst, R. J., Ivy, D. D., Gaitan, G., Szatmari, A., Rudzinski, A., Garcia, A. E., ... & Wessel, D.
L. (2012). A Randomized, Double-Blind, Placebo-Controlled, Dose-Ranging Study of Oral Sildenafil Citrate in Treatment-Naive Children With Pulmonary Arterial Hypertension. Circulation, 125(2), 324-334.
[19] Barst, R. J., Beghetti, M., Pulido, T., Layton, G., Konourina, I., Zhang, M., & Ivy, D. D. (2014). STARTS-2: Long-Term Survival With Oral Sildenafil Monotherapy in Treatment-Naïve Pediatric Pulmonary Arterial Hypertension. Circulation, CIRCULATIONAHA-113. [20] Samiee-Zafarghandy, S., Smith, P. B., & van den Anker, J. N. (2014). Safety of Sildenafil in
Infants. Pediatric critical care medicine: a journal of the Society of Critical Care Medicine and the World Federation of Pediatric Intensive and Critical Care Societies.
[21] Shah, P. S., & Ohlsson, A. (2011). Sildenafil for pulmonary hypertension in neonates. Cochrane Database Syst Rev, 8.
[22] Steinhorn, R. H., Kinsella, J. P., Pierce, C., Butrous, G., Dilleen, M., Oakes, M., & Wessel, D. L. (2009). Intravenous sildenafil in the treatment of neonates with persistent pulmonary hypertension. The Journal of pediatrics, 155(6), 841-847.
[23] Luong, C., Rey-Perra, J., Vadivel, A., Gilmour, G., Sauve, Y., Koonen, D., ... & Thébaud, B. (2011). Antenatal sildenafil treatment attenuates pulmonary hypertension in experimental congenital diaphragmatic hernia. Circulation,123(19), 2120-2131.
[24] Mukherjee, A., Dombi, T., Wittke, B., & Lalonde, R. (2009). Population pharmacokinetics of sildenafil in term neonates: evidence of rapid maturation of metabolic clearance in the early postnatal period. Clinical Pharmacology & Therapeutics, 85(1), 56-63.
[25] Yaseen, H., Darwich, M., & Hamdy, H. (2012). Is sildenafil an effective therapy in the management of persistent pulmonary hypertension?. Journal of clinical neonatology, 1(4), 171.
[26] Paediatric Formulary Committee. (2009). British National Formulary for Children. London: British Medical Association, the Royal Pharmaceutical Society of Great Britain, the Royal College of Paediatrics and Child Health, and the Neonatal and Paediatric Pharmacists Group.
19 [27] Ahsman, M. J., Witjes, B. C., Wildschut, E. D., Sluiter, I., Vulto, A. G., Tibboel, D., & Mathot, R. A. (2010). Sildenafil exposure in neonates with pulmonary hypertension after administration via a nasogastric tube. Archives of Disease in Childhood-Fetal and Neonatal Edition, 95(2), F109-F114.
[28] Lally, K. P., & Engle, W. (2008). Postdischarge follow-up of infants with congenital diaphragmatic hernia. Pediatrics, 121(3), 627-632.
[29] University of California, San Francisco; Children's Hospital Los Angeles; Ann & Robert H Lurie Children's Hospital of Chicago. Chronic Sildenafil for Severe Diaphragmatic Hernia. ClinicalTrials.gov. Retrieved March 30, 2014, from http://clinicaltrials.gov/ct2/show/ study/NCT00133679 (Identification No. NCT00133679).
[30] Hamad Medical Corporation. Sildenafil in Persistent Pulmonary Hypertension in Newborns. ClinicalTrials.gov Retrieved March 30, 2014, from http://clinicaltrials.gov/ ct2/show/study/NCT01558466 (Identification No. NCT01558466).
[31] Pfizer. A Study To Evaluate Safety And Efficacy Of IV Sildenafil In The Treatment Of Neonates With Persistent Pulmonary Hypertension Of The Newborn. In: ClinicalTrials.gov Retrieved March 30, 2014, from http://clinicaltrials.gov/ct2/show/ study/NCT01720524 (Identification No. NCT01720524).
[32] University of North Carolina, Chapel Hill; Duke University; Eunice Kennedy Shriver National Institute of Child Health and Human Development (NICHD); The EMMES Corporation. Pharmacokinetics of Sildenafil in Premature Infants. In: ClinicalTrials.gov Retrieved March 30, 2014 from http://clinicaltrials.gov/ct2/show/ study/NCT01670136 (Identification No. NCT01670136).
[33] Wardle, A. J., & Tulloh, R. M. (2013). Evolving management of pediatric pulmonary arterial hypertension: impact of phosphodiesterase inhibitors. Pediatric cardiology, 34(2), 213-219.
20
Anexos
Tabela 1 – Características clínicas dos doentes
Caso 1 Caso 2 Caso 3
Sexo Feminino Feminino Masculino
IG (semanas) 38 39 37
Tipo de parto Cesariana de emergência Cesariana eletiva Cesariana eletiva
Peso à nascença (g) 2340 3150 2680
IA (1º/5º/10º minutos) 3 / 5 / 8 7 / 8 / 8 5 / 8 / -
DPN - IG (semanas) Sim - 33 Sim - 32 Sim - 22
Localização da hérnia Esquerda Esquerda Esquerda
Conteúdo da hérnia Intestino, estômago, baço e fígado
Estômago, intestino delgado, colón e baço
Estômago, intestino delgado, baço e lobo hepático esquerdo Legenda: IG – idade gestacional; IA .- Índice de Apgar; DPN – Diagnóstico pré-natal
Tabela 2 – Tratamento da hérnia diafragmática congénita e hipertensão pulmonar persistente do recém-nascido
Caso 1 Caso 2 Caso 3
Ventilação VAFO, VMC e CPAP VAFO, VMC e BiPAP VAFO, VMC e CAPAP
ONi Sim Sim Sim
Suporte inotrópico Sim Sim Sim
ECMO Sim Sim Sim
Cirurgia Dia de vida Colocação de prótese Complicações 5º dia Sim Hemotórax 9º dia Sim Deiscência da sutura diafragmática 8º dia Não Hemorragia para a cavidade abdominal Quilotórax Ascite quilosa
Sildenafil Sim Sim Sim
Legenda: BiPAP - pressão positiva bi-nível nas vias aéreas; CPAP - pressão positiva contínua nas vias aéreas; ECMO - oxigenação por membrana extracorpórea; ONi - óxido nítrico inalado; VAFO - ventilação de alta frequência oscilatória; VMC – ventilação mecânica convencional.
Tabela 3 – Tratamento com sildenafil
Caso 1 Caso 2 Caso 3
Início (dia de vida) 33º dia 22º dia 16º dia
Dose inicial 1,5 mg a cada 8 horas 1 mg a cada 6 horas 1 mg a cada 6 horas
Duração (dias) 201 113 23