ADRIANA LINO DOS SANTOS FRANCO
ESTADO FUNCIONAL DE FAGÓCITOS APÓS A
EXPOSIÇÃO DE RATOS AO FORMALDEÍDO:
RELEVÂNCIA PARA A INFLAMAÇÃO ALÉRGICA
ADRIANA LINO DOS SANTOS FRANCO
ESTADO FUNCIONAL DE FAGÓCITOS
APÓS EXPOSIÇÃO DE RATOS AO
FORMALDEÍDO: RELEVÂNCIA PARA A
INFLAMAÇÃO ALÉRGICA PULMONAR
Tese apresentada ao Instituto de Ciências
Biomédicas da Universidade de São Paulo para
obtenção do Título de Doutor em Ciências.
ADRIANA LINO DOS SANTOS FRANCO
ESTADO FUNCIONAL DE FAGÓCITOS
APÓS EXPOSIÇÃO DE RATOS AO
FORMALDEÍDO: RELEVÂNCIA PARA A
INFLAMAÇÃO ALÉRGICA PULMONAR
Tese apresentada ao Instituto de Ciências
Biomédicas da Universidade de São Paulo
para obtenção do Título de Doutor em
Ciências.
Área de concentração: Farmacologia
Orientador: Wothan Tavares de Lima
DEDICATÓRIA
Ao meu filho Gustavo, luz da minha vida, que enche minha alma de amor, paz e esperança. Aprendo muito com você a cada dia,
você me ensinou o verdadeiro amor, aquele que é incondicional, que faz concessões,
que não traz sofrimentos, mas sim alegrias, que brota do fundo do nosso coração. Agradeço a você por ter me dado A oportunidade do milagre da vida.
Ao meu marido Joaquim, companheiro, amigo, pai, a pessoa que escolhi para compartilhar, minhas alegrias, minhas tristezas,
meus acertos, meus erros, meus medos, meus desafios, minhas vitórias, minhas derrotas, minha vida, feitos um pro outro, feitos pra durar,
AGRADECIMENTOS
Aos meus pais Gentil e Neide, que pela sua dedicação, tem muito de anjo e pela imensidão de seu amor, tem um pouco de Deus.
À minha irmã Luciana, pela amizade, amor, ensinamentos, exemplo e força de tentar fazer um mundo melhor.
Aos meus sogros Irineu e Clélia, pelo amor, dedicação e ajuda constante, principalmente no que tange a educação do Gustavo. Agradeço de coração, vocês foram fundamentais para a realização deste trabalho.
Ao meu mestre e amigo Wothan, pelos ensinamentos, exemplo, dedicação, paciência, amizade e principalmente, compreensão. O verdadeiro mérito não está em receber honras, mas sim em merecê-las.
Ao querido professor Ricardo, pelos ensinamentos, amizade, dedicação e uma referência de um excelente professor.
Aos colegas do laboratório de fisiopatologia da inflamação experimental Zilma, Beatriz, Fernando, Alexandre, Isabelle, Clariana, Luana, Simone e Fernanda, pela amizade e auxílio. E em especial a Tatiana, Helory, Ana Paula e Ana Cristina pela amizade, ensinamentos e ajuda constante em todos os momentos, inclusive em diversos experimentos.
À Vivi da veterinária, pelo auxílio nos experimentos de citometria de fluxo e à Simoninha do laboratório de farmacologia das espécies reativas, pelo auxílio na realização do Western blot.
À Dra. Zuleica Bruno Fortes, pelos ensinamentos e pela disponibilização do seu laboratório.
Ao Dr. Marcelo Nicolas Muscará, pelos ensinamentos e disponibilização de seu laboratório.
À Dra. Soraia K. P. Costa, pelos ensinamentos e disponibilização de seu laboratório.
À Dra. Sandra Farsky, pelos ensinamentos e colaboração nos experimentos de imunohistoquímica.
Ao Dr. Bernardo Boris Vargaftig, pelos ensinamentos.
Às funcionárias da biblioteca do ICB e às secretárias do departamento de Farmacologia, Selma e Julieta, pelo atendimento prestativo.
Ao Marcos e Manuel, pelos cuidados e manutenção dos animais no biotério.
RESUMO
LINO DOS SANTOS FRANCO, A. Estado funcional de fagócitos após exposição de ratos ao formaldeído: relevância para inflamação alérgica pulmonar. 2008. 121f. Tese (Doutorado em Farmacologia) – Instituto de Ciências Biomédicas, Universidade de São Paulo, São Paulo, 2008.
O formaldeído (FA) é um poluente ambiental amplamente utilizado em materiais de construção, produtos de madeira, têxtil, cosméticos, laboratórios de patologia, histologia e anatomia. É também exalado em ambiente doméstico, pela queima do gás de cozinha. A exposição ao FA causa potencial risco à saúde constituindo importante fonte de origem de asma ocupacional e ambiental. Neste estudo avaliamos os efeitos da exposição ao FA sobre o estado funcional de fagócitos pulmonares e medulares, bem como a expressão de moléculas de adesão. Ratos Wistar foram divididos em 5 grupos: Grupos FA e FA 15, consistiram de ratos submetidos à inalação com FA (1%, 3 dias, 90 min/dia), sendo o período de análise diferente (FA após 24h e FA15 após 15 dias da última inalação); grupo OVA/OVA, ratos sensibilizados e desafiados com OVA (1%, 15 min); grupo FA/OVA ratos submetidos a exposição ao FA e posteriormente sensibilizados e desafiados com OVA. Como controle utilizamos ratos não manipulados (basal). Realizamos culturas de células do LBA e do LF e as amostras de sobrenadante foram recolhidas 1h ou 24h após a adição ou não do estímulo secundário (PMA ou LPS) para quantificação de NO2, H2O2, LTB4, TXB2, PGE2 e TNF-α. Utilizamos também
amostras de sobrenadante de cultura pulmonar (explante) recolhidas 4h ou 24h após a adição ou não de LPS para quantificação de IL-1β e IL-10. Os dados obtidos indicaram que o FA causa efeitos locais (pulmão) e sistêmicos (medula) que puderam ser observados através de alterações tanto na celularidade quanto no estado funcional. O aumento no número de células recuperadas no LBA após exposição ao FA parece se relacionar ao aumento na expressão de VCAM-1 e PECAM-1. Ainda, o FA causou alterações no estado funcional de fagócitos de origem inflamatória (neutrófilos) e principalmente de fagócitos residentes (macrófagos alveolares), sendo tais alterações observadas através do aumento na liberação de NO2, H2O2 e LTB4. Notamos também que os efeitos do FA são prolongados, haja vista que
após 15 dias da última exposição, apesar de a celularidade pulmonar não estar alterada, as células residentes estão liberando altas concentrações de H2O2, LTB4, PGE2 e IL-10, além de observarmos a
expressão de ICAM-1, VCAM-1 e PECAM-1 elevadas. Podemos também inferir que o FA induz estresse oxidativo, evidenciado não apenas pelo aumento na geração de espécies reativas (H2O2 e NO2),
mas também pelo aumento na nitração de proteínas e que tais efeitos são vistos até 15 dias após sua última exposição. A exposição de animais alérgicos ao FA, embora não determine aumento na celularidade pulmonar, possivelmente pela redução na expressão de ICAM-1, VCAM-1 e PECAM-1, causa alterações no estado funcional de macrófagos alveolares, os quais mostraram aumento na liberação de NO2, H2O2, LTB4, TXB2, PGE2, TNF-α e IL-1β. Sendo assim, admitimos que o FA
induza geração de espécies reativas e estas por sua vez, sejam, em parte, responsáveis pelas alterações no estado funcional de macrófagos alveolares, fazendo com que estes liberem quantidades apreciáveis de mediadores inflamatórios por um tempo prolongado e também aumentem a resposta a um segundo estímulo. A exposição ao FA apesar de não afetar o número de células na medula óssea, causou alterações no estado funcional celular que puderam ser notadas pelo aumento na liberação de LTB4,
TXB2, PGE2, IL-1β e IL-10. Entretanto, em animais alérgicos, a exposição ao FA causou redução na
celularidade da medula sugerindo efeito imunomodulador. Considerando os efeitos entre poluentes e vias aéreas, estudos que visem à compreensão destes mecanismos adquirem relevância no contexto de fatores que desencadeiam ou exacerbam a asma, além de fornecerem subsídios para sua prevenção.
ABSTRACT
LINO DOS SANTOS FRANCO, A. Functional status of phagocytes after rat formaldehyde exposure: Relevance for allergic lung inflammation. 2008. 121f. Thesis (PhD in Pharmacolgy) – Instituto de Ciências Biomédicas, Universidade de São Paulo, São Paulo, 2008.
Formaldehyde (FA) is a common indoor and outdoor pollutant that is found in many products including particle board, plywood, floor coverings, cosmetics, laboratories of pathology, histology and anatomy. It is also emitted in domestic place due to GLP burning. The FA exposure causes potential risk for human health and constitutes an important factor for development of ambiental and occupational asthma. In this study we evaluated the effects of FA exposure on functional state of pagocytes obtained from lung and bone marrow, as well the expression of adhesion molecules. Male Wistar rats were randomly assigned into 5 groups: FA and FA 15 groups, consisted as rats subjected to FA inhalation (1%, 3 days, 90 min/day), with different analysis period (24h e 15 days after the last inhalation respectively); OVA/OVA group, rats sensitized and challenged (1%, 15 min); FA/OVA group, being OVA-sensitized rats after the last exposure to FA inhalation. Control data of the investigated parameters were obtained using non manipulated rats (basal group). We have done cells culture of BAL and FL and the supernatant were colleted 1 or 24h after the addition or not of secondary stimulus (PMA or LPS) for quantification of NO2, H2O2, LTB4, TXB2, PGE2 e TNF-α. We used also supernatant from lung culture (explant) colleted 4 or 24 h after the addition or not of LPS for quantification of IL-1β and IL-10. The data obtained indicated that FA causes local (lung) and systemic (bone marrow) effects, which can be observed through modifications in cellularity and in functional state. The increase in the number of cells recovered in BAL after FA exposure can have relation with enhance in VCAM-1 and PECAM-1 expression. FA induced changed in functional state of inflammatory phagocytes (neutrophils) and resident phagocytes (alveolar macrophages), and these modifications can be observed through increase in NO2, H2O2 e LTB4 release. We observed also that the effects of FA are prolonged because 15 days after the last exposure, the resident cells are releasing high concentrations of H2O2, LTB4, PGE2, IL-10 and the expression of ICAM-1, VCAM-1 e PECAM-1 are elevated. On the other hand, the pulmonary cellularity is not altered. We can infer also that FA induces oxidative stress, observed not only in the increase of reactive species generation (H2O2 e NO2), but also the increase of proteins nitration and these effects are noted 15 days after the last exposure. The exposure of allergic animals to FA, although did not to determine enhance in the pulmonary cellularity, possibly due to reduction of ICAM-1, VCAM-1 and PECAM-1 expression, it causes alterations in the alveolar macrophages functional state, which shown increase in NO2, H2O2, LTB4, TXB2, PGE2, TNF-α and IL-1β release. Then, we admit that FA induces reactive species generation and these by your turn are responsible, in part, to alterations of alveolar macrophages functional state, causing an increase in the liberation of several inflammatory mediators during a prolonged time and increasing the response to a secondary stimulus too.
LISTA DE ABREVIAÇÕES
AA: ácido araquidônico BSA: albumina bovina sérica CAMs: moléculas de adesão celular CAT: catalase
CO2: dióxido de carbono COX: cicloxigenase
DNA: ácido desoxiribonucléico ECP: proteína catiônica eosinofílica EPM: erro padrão da média
EPO: peroxidase eosinofílica
EROs: espécies reativas derivadas do oxigênio FA: formaldeído
GM-CSF: fator de crescimento de colônia granulocítica macrofágica GSH: glutationa
H2O2: peróxido de hidrogênio IFN-γ: intérferon gama
IgE: imunoglobulina tipo E IL: interleucina
KH2PO4: fosfato de potássio LBA: lavado broncoalveolar LF: lavado femural
LPS: lipopolissacarídeo LT: leucotrieno
MPB: proteína básica principal MPO: mieloperoxidase
NaCl: cloreto de sódio NaOH: hidróxido de sódio NO: óxido nítrico
NO2: nitritos
NOS: óxido nítrico sintase O2: oxigênio
OVA: ovoalbumina
PAF: fator ativador de plaquetas
PBS: solução salina tamponada fosfatada PG: prostaglandina
PMA: acetato de forbol miristato RNA: ácido ribonucléico
SOD: superóxido dismutase
TGF: fator de transformação de crescimento TNF-α: fator de necrose tumoral alfa
LISTA DE FÁRMACOS E REAGENTES
Bayer: Redoxon® (vitamina C)
BD Biosciences: ICAM-1, VCAM-1, PECAM-1, E-selectina
Cayman: LTB4, TXB2, PGE2
Cultilab: albumina bovina sérica (BSA), soro bovino fetal (BSF), DMEM
DuoSet RD: IL-1β, IL-10, IL-4
Labsynth: PBS (cloreto de sódio, fosfato de potássio dibásico, fosfato de potássio monobásico), nitrito de sódio, hidróxido de sódio,
Leica: OCT (tissue freezing medium)
Mayne Pharma: Fausblastina® (sulfato de vimblastina)
Merck: ácido acético, ácido sulfúrico, hidrato de cloral, metanol, azul de tripan, cristal violeta, peróxido de hidrogênio, entellan, EDTA, TRIS, glicose
Sanofi-Synthelabo: hidróxido de alumínio (alúmen)
Schering-Plough: Garamicina® (sulfato de gentamicina)
Sigma: ovoalbumina (grau II), RPMI-1640, tripsina, L-glutamina, actinomicina-D, fenol red, 3,3-diaminobenzidina tetrahydrochloride (DAB), lipopolissacarídeo (LPS), acetato de forbol miristato (PMA)
Synth: hexano, formaldeído, Tween-20, xylol, acetona
LISTA DE ILUSTRAÇÕES
Esquema 1. Delineamento experimental... 43
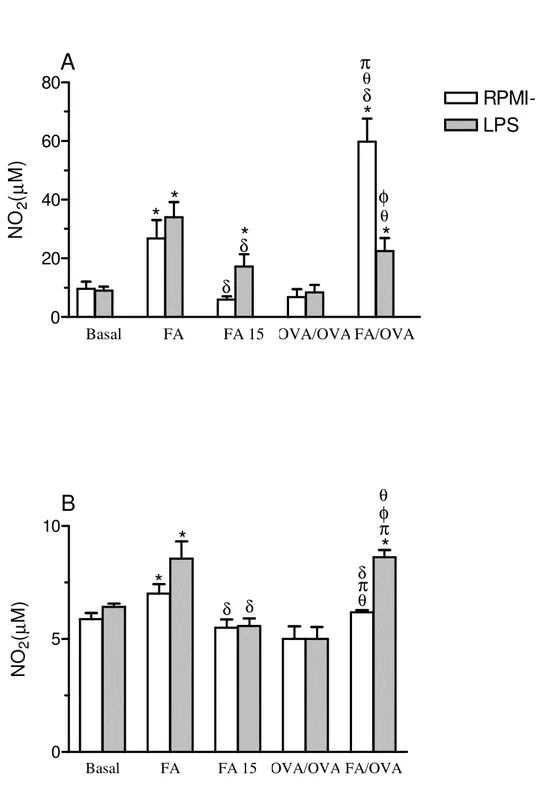
Figura 1. Determinação de NO2 em sobrenadantes de culturas de células totais (A) e de
neutrófilos (B) do LBA estimuladas ou não com LPS... 45
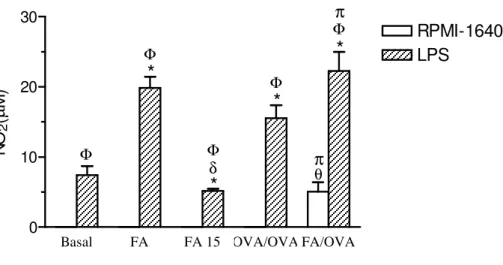
Figura 2.Determinação de NO2 em sobrenadantes de culturas de células do LF estimuladas ou
não com LPS... 46
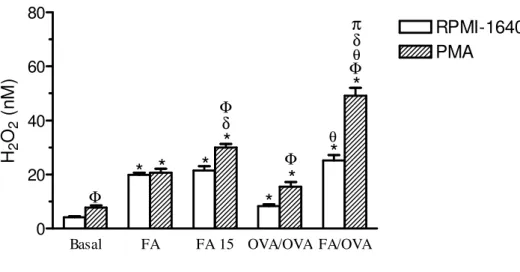
Figura 3.Quantificação da liberação de H2O2 em sobrenadantes de culturas de células do LBA
estimuladas ou não com PMA... 47
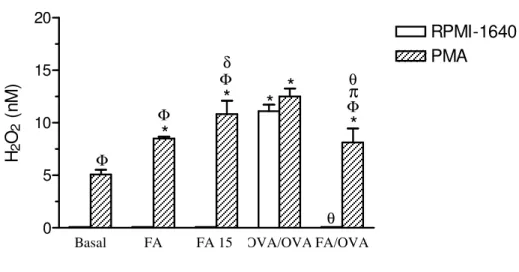
Figura 4. Quantificação da liberação de H2O2 em sobrenadantes de culturas de células do LF
estimuladas ou não com PMA ... 48
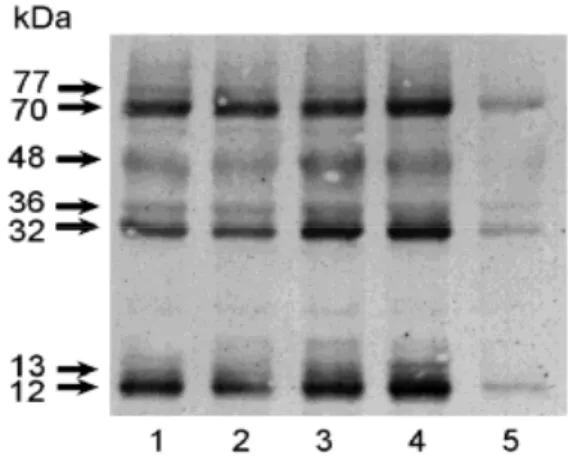
Figura 5. Western blot representativo da expressão de proteínas nitradas em resíduos de tirosina presentes em homogenatos de pulmão de ratos alérgicos ou não e expostos à inalação com FA... 49
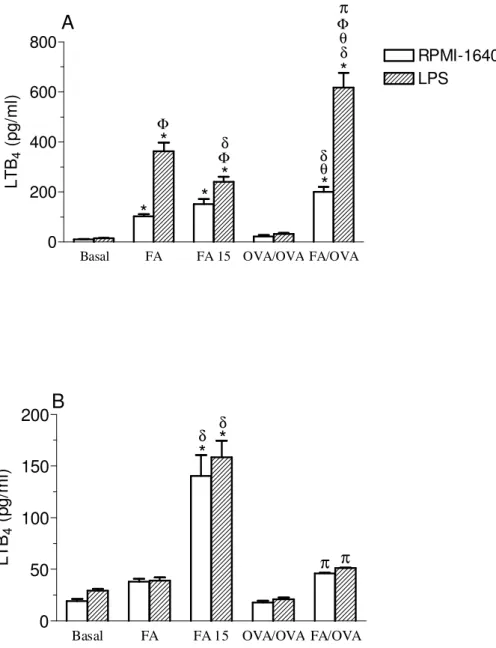
Figura 6. Determinação de LTB4 em sobrenadantes de culturas de células totais (A) e de neutrófilos (B) do LBA estimuladas ou não com LPS... 51
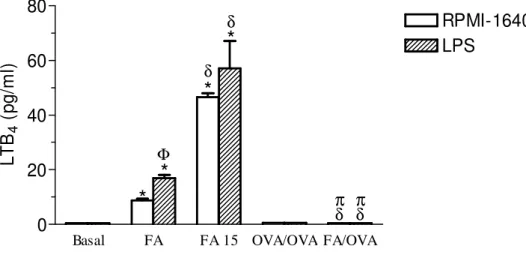
Figura 7. Quantificação de LTB4 em sobrenadantes de culturas de células do LF estimuladas ou não com LPS... 52
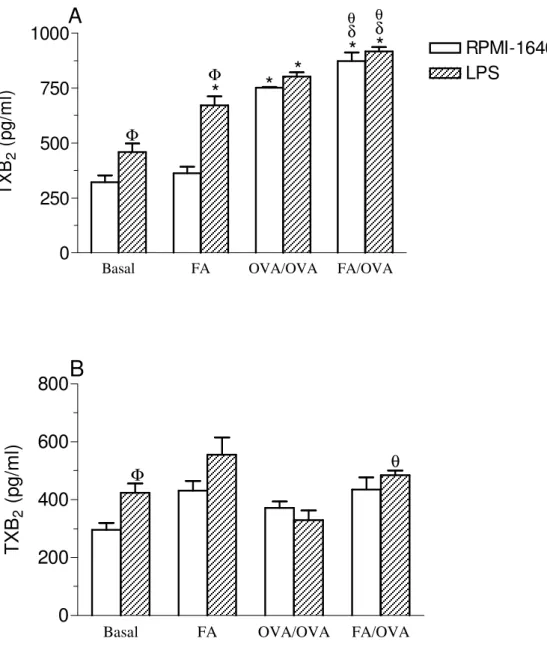
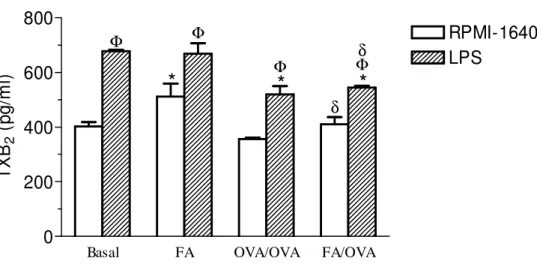
Figura 8. Determinação de TXB2 em sobrenadantes de culturas de células totais (A) e de
neutrófilos (B) do LBA estimuladas ou não com LPS... 54
Figura 9. Quantificação de TXB2 em sobrenadantes de culturas de células do LF estimuladas
ou não com LPS... 55
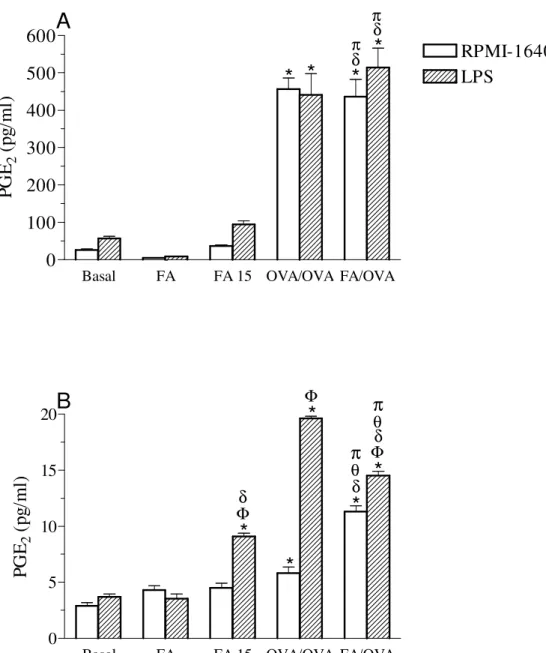
Figura 10. Determinação de PGE2 em sobrenadantes de culturas de células totais (A) e de
neutrófilos (B) do LBA estimuladas ou não com LPS... 57
Figura 11. Quantificação de PGE2 em sobrenadantes de culturas de células do LF estimuladas
ou não com LPS... 58
Figura 12. Quantificação de TNF-α em sobrenadantes de cultura de células totais (A) e de
neutrófilos (B) do LBA estimuladas ou não com LPS... 60
Figura 13. Quantificação da liberação de IL-1β em sobrenadantes de culturas de pulmão
estimuladas ou não com LPS... 62
Figura 14. Quantificação da liberação de IL-1βem sobrenadantes de culturas de células do LF
estimuladas ou não com LPS... 63
estimuladas ou não com LPS... 65
Figura 16. Quantificação da liberação de IL-10em sobrenadantes de culturas de células do LF estimuladas ou não com LPS... 66
Figura 17. Efeito do tratamento com vimblastina na liberação de H2O2 em culturas de células
do LBA estimuladas ou não com PMA... 68
Figura 18. Efeito dos tratamentos com vitaminas C e E sobre o número de células no LBA (A e B) e no LF (C e D)... 70
Figura 19. Efeito dos tratamentos com vitaminas C e E sobre a liberação de H2O2 em
sobrenadantes de culturas de células do LBA estimuladas ou não com PMA... 72
Figura 20. Efeito dos tratamentos com vitaminas C e E sobre a liberação de H2O2 em
sobrenadantes de culturas de células do LF estimuladas ou não com PMA... 74
Figura 21. Efeito dos tratamentos com vitamina C e E sobre a liberação de NO2 em
sobrenadantes de cultursa de células do LBA estimuladas ou não com LPS... 76
Figura 22. Efeito dos tratamentos com vitaminas C e E sobre a liberação de NO2 em
sobrenadantes de culturas de células do LF estimuladas ou não com LPS... 78
Figura 23. Efeito dos tratamentos com vitaminas C e E sobre a liberação de LTB4 em
sobrenadantes de culturas de células do LBA estimuladas ou não com LPS... 80
Figura 24. Efeito dos tratamentos com vitaminas C e E sobre a liberação de LTB4 em
sobrenadantes de cultura de células do LF estimuladas ou não com LPS... 82
Figura 25. Efeito da exposição ao FA sobre a expressão de moléculas de adesão do complexo CD11/CD18 (Mac-1) (A) e ICAM-1 (B) em células presentes no LBA de ratos alérgicos ou não... 84
Figura 26. Expressão de moléculas de adesão no pulmão... 86
Figura 27. Expressão de E-selectina em pulmão de ratos alérgicos ou não e expostos à inalação com FA... 87
Figura 28. Expressão de ICAM-1 em pulmão de ratos alérgicos ou não e expostos à inalação com FA... 88
Figura 29. Expressão de PECAM-1 em pulmão de ratos alérgicos ou não e expostos à inalação com FA... 89
SUMÁRIO
1 INTRODUÇÃO... 16
1.1 Fisiopatologia da asma... 16
1.2 Inflamação e migração celular... 20
1.3 Asma e fatores desencadeantes... 22
1.4 Exposição ao formaldeído e inflamação pulmonar... 23
1.5 Mediadores inflamatórios... 27
2 OBJETIVOS... 32
3 MATERIAIS E MÉTODOS... 33
3.1 Animais... 33
3.2 Inalação de formaldeído... 33
3.3 Sensibilização e broncoprovocação in vivo... 33
3.4 Cultura de tecido pulmonar isolado (explante)... 34
3.5 Estudo da expressão protéica em pulmão... 34
3.6 Avaliação do estado funcional de fagócitos... 35
3.6.1 Obtenção dos fagócitos... 35
3.6.2 Cultura de células... 36
3.7 Quantificação de mediadores... 37
3.7.1 Nitritos (NO2)... 37
3.7.2 Peróxido de hidrogênio (H2O2)... 37
3.7.3 Eicosanóides (LTB4, TXB2 e PGE2)... 38
3.7.4 Fator de necrose tumoral (TNF)... 38
3.7.5 Citocinas (IL-1β, IL-4 e IL-10)... 39
3.8 Tratamentos farmacológicos... 40
3.8.1 Depleção de neutrófilos... 40
3.8.2Participação das espécies reativas derivadas do oxigênio e do nitrogênio... 40
3.9 Avaliação da expressão de ICAM-1 e Mac-1 em células do LBA por citometria de fluxo... 41
3.10 Determinação da expressão de ICAM-1, PECAM-1, VCAM-1 e E-selectina em pulmão por imunohistoquímica... 41
3.11 Análise estatística... 42
4 RESULTADOS... 44
4.1 Quantificação de nitritos em sobrenadante de cultura de células totais (A) e de neutrófilos (B) do LBA... 44
4.2 Quantificação de nitritos em sobrenadante de cultura de células da medula óssea... 46
4.3 Determinação de peróxido de hidrogênio em sobrenadante de cultura de células totais do LBA... 47
4.4 Quantificação de peróxido de hidrogênio em sobrenadante de cultura de células da medula óssea... 48
4.5 Estudo da expressão de nitrotirosina... 49
4.7 Quantificação de LTB4 em sobrenadante de cultura de células da medula
óssea... 52
4.8 Quantificação de tromboxana B2 em sobrenadante de cultura de células totais (A) e de neutrófilos (B) do LBA... 53
4.9 Determinação de TXB2 em sobrenadante de cultura de células da medula óssea... 55
4.10 Quantificação de PGE2 em sobrenadante de cultura de células totais (A) e de neutrófilos (B)do LBA... 56
4.11 Determinação de PGE2 em de cultura de células da medula óssea... 58
4.12 Quantificação de fator de necrose tumoral (TNF-α) em sobrenadante de cultura de células totais (A) e de neutrófilos (B) do LBA... 59
4.13 Quantificação da produção de IL-1β por explante pulmonar... 61
4.14 Determinação de IL-1β em sobrenadante de cultura de células da medula óssea... 63
4.15 Quantificação da produção de IL-10 por explante pulmonar... 64
4.16 Determinação de IL-10 em sobrenadante de cultura de células da medula óssea... 66
4.17 Efeito do tratamento com vimblastina sobre a produção de peróxido de hidrogênio por fagócitos do LBA... 67
4.18 Efeito dos tratamentos com vitaminas C e E sobre o número de células totais presentes no LBA (A e B) e no LF (C e D)... 69
4.19 Efeito dos tratamentos com vitaminas C e E sobre a produção de peróxido de hidrogênio em cultura de células totais do LBA... 71
4.20 Efeito dos tratamentos com vitaminas C e E sobre a produção de peróxido de hidrogênio em cultura de células da medula óssea... 73
4.21 Efeito dos tratamentos com vitaminas C e E sobre a produção de nitritos em cultura de células totais do LBA... 75
4.22 Efeito dos tratamentos com vitaminas C e E sobre a produção de nitritos em cultura de células da medula óssea... 77
4.23 Efeito dos tratamentos com vitaminas C e E sobre a produção de LTB4 em cultura de células totais do LBA... 79
4.24 Efeito dos tratamentos com vitaminas C e E sobre a produção de LTB4 em cultura de células da medula óssea... 81
4.25 Efeito da exposição ao FA sobre a expressão de molécula de adesão do complexo CD11/CD18 (Mac-1) e de ICAM-1 em células presentes no LBA... 83
4.26 Efeito da exposição ao FA sobre a expressão de E-selectina, ICAM-1, PECAM-1 e VCAM-1 no pulmão... 85
5 DISCUSSÃO... 91
6 CONCLUSÕES... 105
1 INTRODUÇÃO
1.1 Fisiopatologia da asma
Estudos epidemiológicos indicam que a incidência de asma tem aumentado nos últimos anos e em grande parte, o aumento da sua morbidade se relaciona com a industrialização (ANDERSON, 1997; CHARPIN et al., 1996; CIENCEWICKI e JASPERS, 2007;
D’AMATO, 2000; KIM et al., 2001).
A asma é uma doença inflamatória pulmonar crônica caracterizada por broncoconstrição, aumento do número de células inflamatórias no espaço aéreo (eosinófilos, mastócitos, neutrófilos, linfócitos entre outras), perda do epitélio brônquico e reatividade exacerbada do músculo liso (BICE et al., 2000; GINA, 2007; SPAHAN e COVAR, 2008) e em condições crônicas pode ocorrer remodelamento das vias aéreas, com presença de fibras elásticas, colágeno e matriz extracelular (AMMIT, 2005; BROIDE, 2008; DUVERNELLE et al., 2003; KELLY et al., 2007).
O espectro de mediadores inflamatórios liberados pelas células envolvidas na asma é amplo e inclui histamina, leucotrienos (LT) C4, D4, E4, prostaglandinas (PG); TNF-α, 2, IL-3, IL-4, IL-5, IL-1IL-3, fator de crescimento de colônia granulocítica macrofágica (GM-CSF), endotelina-1, óxido nítrico (NO) e espécies reativas derivadas do oxigênio (BELVISI, 2004; HAWORTH e LEVY, 2007; TALATI et al., 2006; TRIGGIANI et al., 2005). Tais mediadores
modulam o recrutamento e ativação de outras células inflamatórias bem como a atividade funcional do músculo liso das vias aéreas (PEACHELL, 2005; TALATI et al., 2006).
A fase tardia da asma apresenta, entre outras características, presença de intenso infiltrado celular no pulmão (eosinófilos, neutrófilos, mastócitos e linfócitos). Entende-se que, da ativação destas células, diversos mediadores são liberados, e que atuando no micro-ambiente pulmonar, causam lesão do epitélio brônquico, ativação de nervos sensoriais, secreção de muco e hiperreatividade brônquica (BELVISI, 2004; HAWORTH e LEVY, 2007; MARCUCCI et al., 2001; MATSUMOTO e SAITO, 2001; THOMAS e WARNER,1996).
Diante do exposto é razoável admitir que a indução do processo alérgico que precede a asma depende de IgE. A síntese desta imunoglobulina obedece complexo e estruturado conjunto de reações moduladas pelo sistema imunológico. Apesar de a asma ser considerada uma reação tipicamente mediada por linfócitos Th2 e de caráter eosinofílico, estudos recentes mostram sua relação com linfócitos Th1, citocinas inflamatórias como IL-1, IL-8, IL-17 e neutrofilia (FOLEY e HAMID, 2007). Em 1989, Mosmann e Coffman descreveram subpopulações de linfócitos auxiliares com distinto padrão de produção de citocinas. Linfócitos Th1 geram citocinas cujas ações são importantes para defesa contra fungos e vírus (componente da imunidade celular) em contraste aos Th2, os quais liberam citocinas com participação relevante na inflamação alérgica (ROMAGNANI, 2004). A produção de anticorpos é, na maioria das vezes, dependente de linfócitos (Th2), que secretam IL-4 e estimulam a produção de IgE pelos linfócitos B (AKDIS et al., 2005). Por outro lado, não ocorre produção de IgE nas respostas envolvidas com linfócitos Th1, devido o predomínio da liberação de IFN- γ (CALVANI et al., 2005). Admite-se que na resposta alérgica, há
predomínio de células Th2. Após a ativação dos linfócitos pelo contato com antígeno, a subpopulação CD4+ tem como principal função direcionar a resposta imune para o padrão de citocinas tipicamente alérgico (IL-4 e IL-13). Tais citocinas participam da estimulação e coordenação da secreção de imunoglobulinas e contribuem para a indução da asma (NGOC et al., 2005).
Mastócitos ativados liberam aminas vasoativas (histamina e serotonina), proteases, heparina, interleucinas, citocinas entre outros (BRADDING et al., 1992; LINDSTEDT e KOVANEN, 2006). As proteases liberadas pelos mastócitos são agrupadas em quimases, triptases e carboxipeptidase. As proteases exercem importante efeito inflamatório das vias aéreas (HUANG et al., 1998) e estão criticamente envolvidas na angiogênese, assim podem ter papel no remodelamento das vias aéreas observado na asma (CHAMBERS e LAURENT, 2002).
É importante mencionar que os mastócitos constituem população heterogênea e em geral são referidos como mastócitos de mucosa e de conjuntivo (BRIGHTLING, 2002; ENERBACK, 1966). Estas populações diferem em localização, dimensão, ultraestrutura, repertório de mediadores liberados, bem como na susceptibilidade a agentes secretagogos (PRUSSIN e METCALFE, 2006). Mastócitos de mucosa contém triptase e liberam grandes quantidades de leucotrienos, enquanto os de conjuntivo contém triptase e quimase, além de serem potentes liberadores de prostaglandinas (TAM et al., 1988). Estudos realizados por De Lima e Da Silva (1998) sugerem que os mediadores derivados dos mastócitos de tecido conjuntivo são relevantes para obstrução das vias aéreas na reação anafilática in vitro.
Outras células implicadas na asma são os eosinófilos. Estas células participam do desencadeamento da fase tardia da asma liberando potentes agentes tóxicos, que contribuem para o desenvolvimento da hiperreatividade das vias aéreas (AHN et al, 2007; THOMAS e WARNER, 1996). Os eosinófilos liberam proteína básica principal (MPB), peroxidase
eosinofílica (EPO), proteína catiônica eosinofílica (ECP) entre outros (FILLEY et al., 1982;
GOETZL, 1975; GUILPAIN et al., 2006). Sob estimulação os eosinófilos produzem ainda PAF, leucotrienos (LTC4), GM-CSF, IL3, IL4, IL5, IL6, TGF entre outros (BJERKE et al., 1996; LACY E MOQBEL, 2000; WOOLLEY et al., 1995). Além disso, estudos recentes mostram que a proximidade dos eosinófilos aos nervos colinérgicos induz o remodelamento neural, de maneira a elevar a síntese de acetilcolina e reduzir a atividade da acetilcolinesterase (DURCAN et al., 2006).
et al., 2006). Tais mediadores, além de modularem o tônus da musculatura lisa, interferem também com a migração celular pulmonar desencadeando e/ou modulando a inflamação pulmonar (VISSERS et al., 2005). Em contraste, outros estudos indicam que macrófagos podem exercer efeito protetor na indução e progressão da asma alérgica (VISSERS et al., 2005).
Observa-se também aumento no número de neutrófilos migrados para o pulmão de pacientes asmáticos. Sabe-se que este aumento pode ocorrer concomitantemente à elevação do número de eosinófilos. Ainda, estudos em animais de experimentação indicam que os eosinófilos por si só não são suficientes para desencadear hiperreatividade brônquica (ALVAREZ et al., 2000). Diversos modelos experimentais de inflamação alérgica das vias aéreas imputam aos neutrófilos relevante participação no desenvolvimento da inflamação e que não só o número, mas também o estado de ativação dos neutrófilos parece estar alterado em pacientes asmáticos (LACOSTE et al., 1993;). Além disso, existe uma subclasse de indivíduos asmáticos que apresenta asma neutrofílica (SIMPSON et al., 2006). Ainda, a
expressão de L-selectina pode estar aumentada na vigência da resposta alérgica, fortalecendo assim, a participação dos neutrófilos na asma (MONTESEIRIN et al., 2005).
Neutrófilos podem causar danos pulmonares pela liberação de proteases e de espécies reativas derivadas do oxigênio (EROs) como peróxido de hidrogênio, radical hidroxila e ânion superóxido (BLOEMEN et al., 2007). Uma das principais proteases liberada pelos neutrófilos, com potente ação lesiva é a elastase. Concentrações elevadas desta enzima têm sido encontradas no LBA de pacientes asmáticos, sendo sua presença correlacionada com a gravidade da doença (SUTER et al., 1992). Ainda, mediadores inflamatórios originados a partir do ácido araquidônico, como leucotrienos, tromboxana entre outros também são liberados pelos neutrófilos e atuam como fatores quimiotáxicos. Além disso, neutrófilos produzem altas concentrações de mieloperoxidase (MPO), a qual contribui para a lesão do epitélio brônquico (KEATINGS e BARNES, 1997).
derivadas do oxigênio e aderência no endotélio (TANABE et al., 1996); sugerindo que o
sistema nervoso sensorial exerce importante papel na modulação da resposta inflamatória.
1.2 Inflamação e migração celular
O acúmulo de células para um sítio após estímulo inflamatório ocorre a partir do contato e da rolagem dos leucócitos circulantes sobre as células endoteliais (KELLY et al., 2007). Estas
etapas são necessárias para que os leucócitos adiram ao endotélio e migrem do leito vascular para a área afetada (LUSTER et al., 2005). O controle destes eventos é multimediado e envolve complexa interação das membranas dos leucócitos com as células endoteliais (KELLY et al., 2007; ZIMMERMAN et al., 1996). Eventos esses onde as moléculas de adesão exercem efeito modulador.
As moléculas de adesão celular (CAMs) são glicoproteínas expressas na superfície das células, as quais medeiam o contato entre duas células ou entre células e a matriz extracelular. O processo de adesão é essencial e ocorre em vários eventos biológicos como inflamação, morfogênese, crescimento, organização e estabilidade tecidual, resposta ao hospedeiro a infecções e cicatrização. As CAMs também são consideradas moléculas sinalizadoras e participam da regulação da inflamação e da resposta imunológica, como ocorre na asma (KELLY et al., 2007; PANÉS et al., 1999; ULBRICH et al., 2003). As CAMs estão agrupadas em quatro superfamílias: integrinas, selectinas, imunoglobulinas e caderinas.
integrinas é também denominada VLA (“very late activation antigen”); a β2 é a LeuCAM (“leucocyte cell adhesion molecule”) e a β3 constitui as citoadesinas (HEMLER, 1988). As integrinas também participam da organização tissular e são receptores para outras moléculas de adesão (BAZAN-SOCHA et al., 2005).
A família das selectinas é composta por três proteínas: E-selectina, também denominada ELAM-1 (“endothelial leukocyte adhesion molecule-1”) presente nas células endoteliais; P-selectina, também denominada GMP-140 (“granule membrane protein-140”) ou PADGEM (“platelet-activation dependent granule external membrane protein”) encontrada nos corpúsculos de Weibel-Palade das células endoteliais e grânulos-α das plaquetas e a L-selectina ou LECAM (LEC, por sua homologia com as lectinas) localizada na membrana de monócitos, linfócitos e neutrófilos. As selectinas têm como função a fixação inicial dos leucócitos ao endotélio vascular, promovendo o rolamento (ROMANO, 2005).
A superfamília das imunoglobulinas consiste em proteínas da superfície celular que contêm um ou mais domínios Ig. Estão incluídos nesta superfamília anticorpos, receptores de células T, proteínas MHC e co-receptores CD4+, CD8+, CD28, receptores FC nos linfócitos e várias moléculas de adesão celular. Os membros desta família abrangem as moléculas de adesão ICAM-1 (“intercellular adhesion molecule-1”), ICAM-2 (“intercellular adhesion molecule-2”), ICAM-3 (“intercellular adhesion molecule-3”), VCAM-1 (“vascular adhesion molecule-1”), PECAM-1 (“platelet endothelial cell adhesion molecule”) e MAd-CAM-1, as quais são caracterizadas pela presença de uma ou mais unidades semelhantes às classes das imunoglobulinas G (HUNKAPPILER e HOOD, 1989). A superfamília das imunoglobulinas G está envolvida no reconhecimento de antígenos, fixação do complemento ou adesão celular (CHIHARA, 2005).
No contexto da asma, o aumento de neutrófilos, eosinófilos e linfócitos na mucosa das vias aéreas se dá paralelamente ao aumento na expressão de moléculas de adesão específicas em células endoteliais. Isto inclui E-selectina, ICAM-1 e VCAM-1 (BOCHNER, 2004). A elevada expressão de moléculas de adesão celular, como VCAM-1 e ICAM-1 nas células do endotélio vascular são fundamentais para o desencadeamento da inflamação pulmonar (BAZAN-SOCHA et al., 2005). Formas solúveis de moléculas de adesão foram identificadas na circulação e no LBA de pacientes com asma. O aumento na expressão sistêmica e local de ICAM-1 solúvel sugere papel funcional dessa molécula na inflamação pulmonar (GRZELEWSKA-RZYMOWSKA e PIETRZKOWICZ, 2004). De fato, em modelo murino de asma o tratamento com anticorpos anti-ICAM-1 e anti-CD18 reduz o infiltrado eosinofílico nas vias aéreas (UYAMA et al., 1995).
1.3 Asma e fatores desencadeantes
A asma afeta parcela significativa da população, com elevado custo social e econômico. No Brasil, os estudos epidemiológicos referentes à asma não são muitos e desconhece-se a verdadeira dimensão da doença nas diferentes regiões do país. Esse fato dificulta o planejamento e a execução de programas que visam a sua prevenção. Dados revelam que entre as décadas de 70 e 90 a mortalidade cresceu 6,8% ao ano na faixa etária de 5 a 19 anos (CHATKIN et al., 1999). Salto Júnior et al. (2002) realizaram um estudo em São
Paulo e mostraram que em indivíduos de 5 a 34 anos também foi observada elevada taxa de mortalidade no mesmo período (0,2% a 0,4%).
Apesar de ainda não existirem explicações definitivas para a causa da asma, sabe-se que o seu desenvolvimento está relacionado a vários fatores. Esses fatores classificam-se em predisponentes, causais e de contribuição (POPP et al., 1993; SIBBALD, 1992;
TILLIE-LEBLOND et al., 2005). Fundamentalmente, os fatores predisponentes se relacionam à
(DELFINO, 2002; HANDZEL, 2000; POPP et al., 1993; SIBBALD, 1992). No contexto dos
fatores causais é interessante notar que alguns indivíduos desencadeiam asma apenas quando em contato com substâncias dispersas na atmosfera, fato que sugere a existência de asma induzida por fatores ambientais (asma ambiental) e potencialmente asma ocupacional.
Um aspecto interessante é que pacientes portadores de asma ocupacional têm dificuldade de reconhecer a relação entre o seu ambiente de trabalho e os sintomas da sua doença. Isto ocorre porque muitos sinais típicos do ataque asmático ocorrem algumas horas após a exposição do indivíduo ao agente desencadeante (MOSCATO et al., 1995). Por esta razão estudos que visem à compreensão dos efeitos da exposição a agentes sensibilizadores são de importância para a prevenção da asma ocupacional.
1.4 Exposição ao formaldeído e inflamação pulmonar
O aumento da morbidade e da mortalidade de doenças inflamatórias no trato respiratório tais como asma, enfisema e bronquite têm sido correlacionadas com a exposição de indivíduos a poluentes ambientais incluindo matéria particulada e substâncias químicas como o formaldeído (FA) (EZRATTY et al., 2007; FUJIMAKI et al., 2004; GREEN-MCKENZIE e HUDES, 2005; LAMBERT et al., 2003).
O FA é indutor de asma ocupacional. Profissionais da saúde como farmacêuticos, médicos, enfermeiros, dentistas e veterinários estão expostos às ações do FA em decorrência de suas atividades (NIOSHA, 1983). O mesmo pode ser considerado para indivíduos que utilizam técnicas em estudos de patologia e histologia. Além destes, estudantes e profissionais que manuseiam peças preservadas como aquelas existentes em laboratórios de anatomia são considerados grupos de risco (WANTKE et al., 2000).
Há de se considerar também que o FA está presente em materiais de construção, produtos de madeira, têxtil, móveis, papéis, cosméticos, fumaça do cigarro entre outros (FLÓ-NEYRET et al., 2001; OSHA, 2001). Assim, dada a sua ampla utilização, o FA constitui importante fonte de origem de inflamação pulmonar ocupacional e ambiental. Além disso, o uso do metanol como alternativa ao uso de combustíveis fósseis se tornou problemático, visto que sua biotransformação enzimática gera FA.
Quimicamente o FA é um gás incolor, inflamável, com odor pungente e sufocante encontrado geralmente em solução aquosa conhecida como formalina, contendo 30-50% de formaldeído e 10-15% de metanol, o qual inibe sua polimerização.
Nos últimos anos poucos registros relataram os efeitos do FA no aparelho respiratório e suas conseqüências para a deterioração da asma (FLÓ-NEYRET et al., 2001; FRANKLIN et al., 2000; FUJIMAKI et al., 2004; GARRET et al., 1996; HAMMERLE et al., 1996; KAZUE et al., 1996; KIM et al., 2001; LINO DOS SANTOS FRANCO et al., 2006; REIDEL et al.,
1996; WANTKE et al., 2000). Nas décadas de 80 e 90, com o crescimento da industrialização e conseqüentemente da poluição, muitos estudos foram conduzidos relacionando os efeitos dos poluentes com o desenvolvimento de doenças pulmonares. Nesse sentido, Holmstrom et al.
(1988) mostraram que indivíduos expostos ao FA apresentam sintomas similares aos observados em asmáticos. Em 1993, Pazdrak et al. relacionaram a exposição ao FA com
aumento do influxo de eosinófilos nas vias aéreas, enquanto Kriebel et al. (1993) mostraram que a exposição continuada ao FA causa redução no fluxo expiratório forçado. Ainda, Kim et al. (2001) sugeriram que o FA desencadeia asma ocupacional não mediada por IgE. Em
Dales e Raizenne (2004) analisaram dados relacionando exposição ocupacional a compostos orgânicos voláteis como o FA e suas implicações na asma. Esses autores observaram que alguns estudos indicaram o desenvolvimento de asma por exposição a poluentes, enquanto outros estudos não estabeleceram tal conexão. Tais divergências foram atribuídas aos diferentes períodos de exposição aos poluentes, bem como as diversas concentrações utilizadas.
O FA induz irritação das vias aéreas superiores e dos olhos (SCHUCH et al., 1966) e também é potente desencadeador de inflamação das vias aéreas inferiores (BARDANA e MONTANARO, 1991). Hendrick e Lane (1975) demonstraram o desenvolvimento de reação broncoespástica em indivíduos expostos ao FA. Embora o FA seja considerado indutor de sintomas de asma, os estudos existentes sobre seus efeitos são, de forma geral, circunscritos aos seus efeitos tóxicos pulmonares (FRANKLIN et al., 2000; KAZUE et al., 1996; KIM et al., 2001). Recentemente mostramos redução da inflamação alérgica pulmonar causada pela ovoalbumina (OVA) em ratos submetidos à inalação prévia com FA (FRANCO, 2004). Paralelamente, observamos hiperreatividade da traquéia in vitro a metacolina (FRANCO,
2004). A análise dos nossos resultados permitiu sugerir potencial ação do FA sobre mastócitos e no sistema nervoso sensorial. Nossos resultados não permitiram indicar em que nível ocorre tal interação, nem se os efeitos do FA sobre mastócitos são diretos ou indiretos. Apesar do mencionado, a inalação de FA em animais não alérgicos causa inflamação pulmonar e hiporreatividade brônquica a metacolina. Nesses eventos mastócitos, prostanóides, neuropeptídeos e óxido nítrico são potenciais mediadores (LINO DOS SANTOS FRANCO et al., 2006).
Animais alérgicos a OVA quando expostos previamente ao FA não apresentaram mobilização de células da medula óssea em relação ao observado na ausência da exposição ao FA. Estes dados podem sugerir que a inalação de FA modifique a atividade funcional da medula óssea, que se torna observável quando ocorre um segundo estímulo inflamatório (FRANCO, 2004). Outros estudos mostraram que a exposição de camundongos durante 21 dias, sendo 6 h/dia a 15 ppm de FA não modifica a celularidade na medula óssea (DEAN et al., 1984). Vale lembrar que estes autores não avaliaram um segundo estímulo inflamatório.
musculatura lisa das vias aéreas isoladas frente ao desafio com o antígeno, sugerindo que nesse modelo a migração celular e a resposta alérgica contrátil in vitro são moduladas
diferentemente.
Estudos realizados por Fujimak et al. (1992) revelaram que cultura de mastócitos peritoneais incubados com FA por 30 min geram proteínas relacionadas ao estresse celular. De acordo com esses autores, os mastócitos parecem constituir importante alvo para as ações do FA. Em que medida tais alterações podem refletir a síntese e liberação de mediadores inflamatórios pulmonares, os estudos realizados até o momento ainda não permitiram inferir. Como hipótese, sugerimos que a exposição ao FA causa modificação no estado funcional dos mastócitos, fazendo com que ocorra desgranulação denominada “piecemeal” (CRIVELLATO et al., 2003). O tipo de desgranulação mastocitária “piecemeal” tem sido interpretado como uma redução na capacidade secretória do mastócito, ocorrendo interferência na liberação dos grânulos estocados em períodos que podem variar entre horas ou até dias (DVORAK, 2005). Nesse sentido, o FA poderia promover tal desgranulação interferindo na capacidade de desgranulação dos mastócitos após o desafio com a OVA. Se tal evento estiver ocorrendo, a quantidade de mediadores liberados pelos mastócitos é pequena e consequentemente a resposta inflamatória é menor.
Existe estreita relação entre as terminações nervosas sensoriais e a localização dos mastócitos (GALLI, 1990), fato que justifica a influência dos neuropeptídeos sobre sua atividade funcional (BARNES, 2001; HEANEY et al., 1995). Além disso, existem relatos da expressão de receptores para substância P na membrana de mastócitos (BISCHOFF et al., 2004).
É bem estabelecido que mediadores inflamatórios liberados pelos mastócitos, tais como bradicinina, prostaglandinas, leucotrienos, PAF, substância P, neurocinina A, IL-1β
explosão inflamatória pulmonar pode decorrer de mastócitos ativados diretamente pelo FA ou indiretamente pela estimulação do sistema nervoso sensorial. É importante mencionar que o FA causa extravasamento microvascular nas vias aéreas de ratos devido à liberação de taquicininas e o tratamento prévio com capsaicina previne este aumento (KAZUE et al., 1996;
LUNDBERG e SARIA, 1983)
Nossos dados revelaram que os efeitos do FA sobre a inflamação pulmonar, mas não sobre a reatividade brônquica são mediados pelo sistema nervoso sensorial (LINO DOS SANTOS FRANCO et al., 2006). Outros estudos corroboram nossos achados mostrando que a
exposição de camundongos ao FA aumenta significativamente o nível plasmático de substância P (FUJIMAKI et al., 2004), reforçando a idéia de que as fibras sensoriais sensíveis a capsaicina podem ser alvo para as ações do FA. Além disso, o aumento nos níveis plasmáticos de substância P pode indicar que o FA exerce efeitos sistêmicos, que podem ser refletidos tanto na atividade funcional das células migradas para o pulmão, como nas células da medula óssea. Diversos estudos indicam que neuropeptídeos, especialmente substância P, induzem acúmulo leucocitário por mecanismos dependentes de mastócitos (SUZUKI et al., 1995). Ainda, Ali et al. (1986) mostraram que a substância P promove liberação de histamina de mastócitos pulmonares.
Os mastócitos não são os únicos alvos dos neuropeptídeos; neutrófilos, eosinófilos, linfócitos, macrófagos também são modulados pela substância P, neurocinina A entre outros. Tais mediadores causam quimiotaxia de eosinófilos, ativam macrófagos alveolares, monócitos causando a liberação de IL-1β, IL-6, IL-10 e TNF-α (KRANEVELD e NIJKAMP, 2001).
Assim, é razoável supor que o FA ative os mastócitos via estimulação do sistema nervoso sensorial levando essas células a liberarem interleucinas e citocinas pró-inflamatórias.
Nossos estudos indicando redução da inflamação alérgica pulmonar não concluiram se a exposição dos animais ao FA modifica a atividade funcional dos mastócitos ou se algum mecanismo endógeno antiinflamatório é acionado pelo FA.
É notável que não só o número, mas também o estado de ativação funcional dos neutrófilos (LACOSTE et al., 1993) e de macrófagos (KOBAYASHI et al., 2006) parece estar
1.5 Mediadores inflamatórios
As espécies reativas derivadas do oxigênio (EROs) são importantes mediadores na lesão celular, e desempenham papel essencial no estresse oxidativo, podendo contribuir para o desencadeamento e/ou exacerbação de diversas doenças, incluindo a asma (BARNES, 2000; BLESA et al., 2002; HALLIWELL, 1997; TALATI et al., 2006). EROs incluem oxigênio “singlet”, peróxido de hidrogênio (H2O2), ânion superóxido, radical hidroxila entre outros e podem ser produzidas a partir de diversas fontes endógenas, por meio do metabolismo aeróbico celular, durante a inflamação ou ainda pela exposição a uma variedade de agentes químicos e físicos.
A toxicidade produzida pelas EROs parece ser baseada na sua ação direta sobre lipídeos, esteróides, proteínas, DNA, RNA entre outros (CUZZOCREA et al., 2001). O estresse oxidativo pode ser regulado por mecanismos de defesa celular, os quais incluem a ação de superóxido dismutase (SOD), catalase (CAT) e glutationa (GSH) (HALLIWELL e GUTTERIDGE, 1989). Existem estudos relatando que os níveis de H2O2 estão aumentados em condensados exalados de indivíduos asmáticos (YEMELYANOV et al., 2001). De fato, o envolvimento de radicais livres na asma está bem documentado (MARK et al., 2006).
Estudos revelaram alterações bioquímicas no córtex frontal e no hipocampo em resposta a administração intraperitoneal de FA (10mg/Kg, 10 dias) e estes efeitos são resultados do estresse oxidativo ocasionado pelo aumento de EROs (GUREL et al., 2005). Outros dados revelaram que EROs causam peroxidação lipídica e/ou oxidação de proteínas contribuindo para e perda da função celular e necrose associadas à toxicidade do FA e seus derivados (DATTA e NAMASIVAYAM, 2003).
participa do estresse oxidativo gerando agentes oxidantes como o peroxinitrito, o qual pode amplificar a resposta inflamatória observada na asma ou na doença pulmonar obstrutiva crônica (RICCIARDOLO et al., 2006). Existem evidências do aumento na expressão de iNOS nas vias aéreas de pacientes asmáticos, particularmente em células epiteliais e macrófagos (GIAID et al., 2003). Estudos realizados por Lino dos Santos Franco et al. (2006) mostraram que após exposição ao FA ocorre liberação de NO mediando a hiporreatividade brônquica e que o bloqueio da síntese de NO reverte este efeito. Outros estudos também associaram inflamação das vias aéreas com níveis domésticos de FA e aumento do NO exalado (FRANKLIN et al., 2000).
Os derivados do ácido araquidônico (AA) compõem um grupo de mediadores inflamatórios que merecem destaque. O AA pode ser metabolizado pelas enzimas: cicloxigenase e lipoxigenase. Existem 3 isoformas de cicloxigenase: constitutiva (COX-1), induzida (COX-2) e (COX-3), as quais são responsáveis pela síntese de prostanóides (prostaglandinas, prostaciclina e tromboxana) (QIN et al., 2005). A lipoxigenase (LOX) é a
enzima responsável pela geração de leucotrienos (para revisão ver BOYCE, 2005).
Embora consideradas enzimas associadas à manutenção fisiológica (COX-1) e aos eventos inflamatórios (COX-2), sabe-se que a expressão constitutiva da COX-2 está bem estabelecida (SINICROPE e GILL, 2004) e que em diversas condições tal enzima exerce efeito fisiológico distinto da sua ação inflamatória (RYAN et al., 2006). COX-1 e COX-2 são expressas em pulmão de humanos (DEMOLY et al., 1997). Células epiteliais das vias aéreas de humanos expressam em níveis basais COX-1, enquanto COX-2 é induzida por IL-1β e
TNF-α ou ainda pode ser aumentada pelo NO (ASANO et al., 2002).
Allen et al. (2006) demonstraram que tromboxana A2 modula a ativação dos receptores colinérgicos e determina hiperreatividade brônquica in vivo. A tromboxana A2 tem potente ação agregante plaquetária e contrátil sobre a musculatura lisa de vasos e brônquios. Ainda, pode ser detectada em exsudatos inflamatórios e pode aumentar a expressão de moléculas de adesão, favorecendo a migração leucocitária (DOGNE et al., 2002). Possui também a capacidade de modular a atividade oxidativa de polimorfonucleares (TSUKAGOSHI e KUROSAWA, 1991).
aéreas em pacientes normais (PAVORD et al., 1994), além de proteger contra broncoconstrição causada por alérgenos (MELILLO et al., 1994).
Está bem estabelecido que os leucotrienos têm papel importante na fisiopatologia da asma (HOLGATE et al., 2003). Os leucotrienos são derivados da metabolização do AA pela ação da 5-lipoxigenase, convertendo hidroperóxidos em leucotrieno A2, a partir do qual são formados outros compostos, os leucotrienos C4, D4 e E4 denominados peptídicos ou cisteinil leucotrienos (WENZEL, 2003).
Dados na literatura sugerem que o leucotrieno B4 contribui para o infiltrado de eosinófilos e neutrófilos e ainda aumenta a reatividade brônquica em modelos experimentais de asma (SAMPSOM et al., 1997). Com respeito às ações dos leucotrienos peptídicos, podemos destacar efeitos de broncoconstrição, hiperreatividade das vias aéreas e aumento de permeabilidade vascular (MULDER et al., 1999).
No que tange os efeitos de poluentes ambientais e a liberação de mediadores originados do metabolismo do AA, Leikauf (1992) mostrou aumento na liberação de PGF2α, TXB2 e LTC4 imediatamenteapós exposição ao FA.
As citocinas têm funções importantes nas células e regulam eventos locais e sistêmicos em vários processos fisiológicos e patológicos. Diversas citocinas estão envolvidas no desenvolvimento do estado atópico e do processo inflamatório crônico observado na asma, contribuindo com a liberação de histamina, TNF-α, NO, leucotrienos entre outros, podendo
levar ao remodelamento das vias aéreas, broncoconstrição e hiperreatividade brônquica (BARNES etal., 2000).
A IL-1β é produzida por diversas células, incluindo monócitos/macrófagos,
fibroblastos, células B e T, neutrófilos e eosinófilos. Suas ações inflamatórias incluem acúmulo de neutrófilos, sendo esta ação dependente da expressão de moléculas de adesão (DANGERFIELD et al., 2005). A IL-1β aumenta a expressão de moléculas de adesão e
também pode aumentar a afinidade dessas moléculas com eosinófilos e células endoteliais (LAMPINEN et al., 2004).
macrófagos, regula a expressão de VCAM-1 no endotélio, promove o crescimento de basófilos e eosinófilos em humanos, inibe a expressão de i-NOS nas células epiteliais humanas e reduz a expressão de IL-8 nas células do músculo liso das vias aéreas em humanos (STEINKE E BORISH, 2001).
O TNF-α é produzido por diferentes tipos celulares, incluindo linfócitos, mastócitos,
neutrófilos e célula muscular lisa. Contudo, macrófagos são sua principal fonte e também seu principal alvo (RUSSO e POLOSA, 2005). Esta citocina determina aumento na expressão de moléculas de adesão, facilitando assim, a migração de leucócitos (TONNEL et al., 1996). Ainda, promove aumento da permeabilidade vascular, alteração no sistema de coagulação, liberação de outros mediadores tais como, prostaglandina E2 e I2, tromboxana A2, NO e endotelina (HART, 2001).
Durante o processo inflamatório, o TNF-α induz a síntese de vários agentes
quimiotáxicos em macrófagos. Assim, o TNF-α pode ter papel fundamental na amplificação e manutenção da inflamação asmática (DJUKANOVIC, 2000). Estudos realizados por Grzelewska-Rzymowska e Pietrzkowicz (2004) demonstraram aumento na liberação de
TNF-α pelos leucócitos presentes no LBA de pacientes asmáticos.
Fundamentados na literatura há evidências da importância de se estudar a relação entre poluentes e seus efeitos sobre as vias aéreas, sobretudo na doença alérgica pulmonar (asma). Nesse sentido, há de se considerar um trabalhador exposto ao FA e que após um período desenvolve asma. Deste modo, este estudo refere-se às repercussões pulmonares e sistêmicas da inalação de FA e suas conseqüências para a doença alérgica pulmonar. O fio condutor do estudo visa a investigar como a exposição ao FA pode interferir com o curso da inflamação pulmonar decorrente de um segundo estímulo não relacionado ao FA. Resultados das diferentes abordagens já realizadas convergem para o conceito de que o FA modula negativamente a alergia pulmonar. Sendo assim, maiores investigações para a compreeensão do mecanismo operado pelo FA na vigência da alergia são importantes. A relevância desse estudo reside no fato de o FA ser um poluente ambiental, estar presente também em ambientes domésticos e a despeito de seus efeitos tóxicos, ser amplamente utilizado na indústria e como desinfetante.
2 OBJETIVOS
Considerando que observamos em estudos anteriores que o FA não só induz inflamação pulmonar, como também altera o curso da resposta inflamatória de origem alérgica, por interferir na geração de mediadores inflamatórios, e que não apenas o número, mas também o estado de ativação funcional de neutrófilos e de macrófagos parece estar alterado em pacientes com inflamação pulmonar, nossos objetivos foram:
1) Investigar os efeitos da exposição ao FA sobre o estado funcional de fagócitos pulmonares e medulares;
2) Avaliar a interferência do FA sobre o estado funcional de fagócitos pulmonares e medulares durante a inflamação alérgica;
3) Determinar a expressão de moléculas de adesão após exposição ao FA e sua repercussão na inflamação de origem alérgica.
3 MATERIAIS E MÉTODOS
3.1 Animais
Foram utilizados ratos Wistar machos adultos (160-180g), provenientes do Biotério
Central do Instituto de Ciências Biomédicas da Universidade de São Paulo. Este estudo foi aprovado pela Comissão de Ética em pesquisa do Instituto de Ciências Biomédicas da Universidade de São Paulo.
3.2 Inalação com formaldeído (FA)
Grupos de animais foram expostos a 1 sessão de inalação com uma solução de FA a 1%, a partir da formalina, durante 3 dias consecutivos por 90 min. Foram colocados cinco animais por sessão em compartimento de vidro com capacidade de 20 litros, acoplado a um nebulizador ultrassonic (Icel®) com capacidade de produzir névoa com partículas entre 0,5 a 1,0 micron. O sistema gerador de FA apresentou fluxo contínuo, de forma a evitar problemas secundários a hipóxia, interferências pela amônia ou excesso de umidade. Para isto, foram realizados dois orifícios em lados opostos na caixa de vidro, sendo um para a entrada do gás e outro para a saída. Os experimentos foram conduzidos 24 h ou 15 dias após a última exposição ao FA (ver esquema de delineamento experimental pág. 43).
3.3 Sensibilização e broncoprovocação in vivo
Os animais receberam 10 μg de ovoalbumina (OVA, grau II) dissolvidas em alúmen
rapidamente entre 7 e 14 dias. Os experimentos foram conduzidos 24 h após a broncoprovocação.
3.4 Cultura de tecido pulmonar isolado (explante)
A cultura de parênquima pulmonar (explante) foi realizada de acordo com Proust et al.,
(2003). Os animais foram expostos ou não a inalação com FA e sensibilizados e desafiados ou não com OVA. Decorridas 24 h ou 15 dias da última exposição ao FA ou 24 h do desafio antigênico com OVA esses animais foram anestesiados, dessangrados e o leito vascular pulmonar perfundido com 5 ml de PBS heparinizado (5 UI/ml) através de uma cânula inserida na artéria pulmonar para remoção do sangue. Fragmentos de igual peso do lóbulo pulmonar foram estimulados ou não com 1 µg/ml de lipopolissacarídeo (LPS, Escherichia coli) e
incubados por 4 ou 24 h em placas de 24 poços a 37° C e 5% de CO2 em meio DMEM, contendo 1% de L-glutamina e gentamicina (10 μg/ml). Os sobrenadantes das culturas
pulmonares foram coletados e armazenados a -80°C até a análise. Os resultados foram expressos em pg de citocinas produzidas por mg de tecido pulmonar (peso seco).
3.5 Estudo da expressão protéica em pulmão
A expressão de proteínas nitradas em resíduos de tirosina é considerada um indicador da produção de peroxinitrito in vivo. Assim, avaliamos através de técnica de Western blot
primários específicos para 3-nitrotirosina (monoclonal anti-nitrotirosina de camundongo) e a lavagem apropriada foi realizada com TBS-t (6 x 10 min). Em seguida, as membranas foram incubadas com anticorpos secundários (anti-camundongo de cabra conjugado com fosfatase alcalina, 1:3000 de kit de quimioluminescência, Bio Rad, EUA) e então foram submetidas a uma nova série de lavagens com TBS-t. As bandas imunoreativas foram reveladas por quimioluminescência. As imagens foram captadas mediante sistema ChemiImager (Alpha Innotech, EUA).
3.6 Avaliação do estado funcional de fagócitos
3.6.1 Obtenção dos fagócitos
Lavado broncoalveolar (LBA)
Os fagócitos (mononucleares e neutrófilos) presentes no espaço alveolar foram obtidos pelo LBA realizado de acordo com De Lima et al. (1992). Para tanto, os animais foram anestesiados com hidrato de cloral (400 mg/Kg, i.p.) e a cavidade peritoneal exposta para realização do dessangramento da aorta abdominal. Foi feita incisão longitudinal na região cérvico-ventral e a traquéia foi exposta e canulada utilizando uma válvula reguladora com três entradas. Acoplou-se a uma das entradas uma cânula de polietileno; à segunda, uma seringa de plástico contendo 20 ml de meio de cultura RPMI 1640, contendo 10% de soro bovino fetal e à terceira, uma seringa vazia para a realização da coleta. A cânula foi inserida na traquéia e feita a lavagem do espaço broncoalveolar. Esta lavagem foi realizada em etapas, injetando-se lentamente no espaço alveolar um volume de 10 ml de RPMI-1640. A seguir, a válvula ligada à seringa contendo RPMI-1640 foi fechada, abrindo-se aquela ligada à seringa vazia, sendo feita à aspiração do RPMI-1640 injetado, acompanhado de delicadas massagens no pulmão. Esse procedimento foi repetido até que todo o volume de RPMI-1640 fosse injetado.
A viabilidade celular foi determinada em câmara de Neubauer em microscopia óptica pela exclusão do azul de tripan (0,5%) em solução de cloreto de sódio (0,45%). Os neutrófilos foram separados pelo método de aderência. Para tanto, após a centrifugação do LBA, as células permaneceram em estufa (5% CO2; 95% O2) por 3 horas, período o qual macrófagos aderem na placa e então no sobrenadante obtivemos os neutrófilos com 80 a 90% de pureza.
Lavado femural (LF)
Células da medula óssea foram obtidas a partir da lavagem da cavidade femural. Decorridas 24 h da broncoprovocação com OVA ou da última exposição ao FA, os animais foram anestesiados com hidrato de cloral (400 mg/Kg, i.p.) e sacrificados por dessangramento (secção da aorta abdominal). O fêmur esquerdo foi retirado e com o auxílio de uma pinça foi mantido sobre um tubo Falcon (50 ml). Em seguida o canal medular foi perfundido com RPMI-1640 (5 ml) utilizando uma seringa plástica. A suspensão medular obtida foi homogeneizada com o auxílio de uma pipeta automática de 5ml e centrifugada a 1.000 rpm por 10 min. O sobrenadante foi desprezado e as células ressuspensas em 1ml de RPMI-1640.
A viabilidade celular foi determinada em câmara de Neubauer em microscopia óptica pela exclusão do azul de tripan (0,5%) em solução de cloreto de sódio (0,45%).
3.6.2 Cultura de células
Lavado broncoalveolar (LBA) e lavado femural (LF)
(200µg/ml) por 4 ou 24 h ou com PMA (20 ng/ml) por 1 h. Decorrido o tempo de incubação, alíquotas foram estocadas em freezer -80ºC para posterior quantificação de mediadores.
3.7 Quantificação de mediadores
3.7.1 Nitritos (NO2)
A produção de nitritos foi determinada de acordo com o método de Griess. O ensaio foi realizado pela adição de 50 µl de sobrenadante de cultura de células do LBA ou do LF em placas de 96 poços contendo o mesmo volume do reagente de Griess em temperatura ambiente por 10 min. Como grupo controle foram utilizados sobrenadante de cultura de células de animais não manipulados (basal). A densidade óptica (540 nm) foi obtida utilizando leitor ELISA automático (Bio-Tek Instruments) e os níveis de nitritos foram determinados utilizando curva padrão previamente estabelecida de NaNO2 (5µM -60µM).
3.7.2 Peróxido de hidrogênio (H2O2)
Nesta série de experimentos foi avaliada a produção de peróxido de hidrogênio pelo método de Pick e Mizel (1981). Para tanto, o botão celular obtido e centrifugado do LBA e do LF foram diluídos em PBS glicosado (NaCl 140M; KH2PO4 1mM; glicose 5mM), contendo 0,56 mM do indicador vermelho de fenol acrescido de peroxidase de rabanete (20 UI/ml) e superóxido dismutase (2 mg/ml). A concentração final de células foi ajustada para 2,0 x 106células/ml.
A densidade óptica foi determinada em leitor de ELISA, em comprimento de onda de 620 nm. Para controle da reação, a densidade óptica foi obtida em solução contendo vermelho de fenol e NaOH 1N.
Os resultados obtidos em densidade óptica foram transformados em nmoles de H2O2/2,0x105 células, mediante equação de regressão linear com base em uma curva padrão que foi feita com concentrações conhecidas de peróxido de hidrogênio (5,10,20 e 40 nmoles).
3.7.3 Eicosanóides (LTB4, TXB2 ePGE2)
Alíquotas do sobrenadante de cultura de fagócitos pulmonares e medulares foram utilizadas para as dosagens de LTB4, TXB2 e PGE2. Para tanto foram utilizados “Kits” de ensaio imunoenzimáticos (EIA-Cayman). O procedimento foi realizado de acordo com as especificações do fabricante. Resumidamente, o sobrenadante de cultura de células foi incubado com os eicosanóides conjugados a acetilcolinesterase e anticorpos monoclonais de camundongo anti-coelho. Após incubação por 18 h a temperatura ambiente, o substrato enzimático foi adicionado (Reagente de Elliman) e a densidade óptica determinada espectrofotometricamente.
3.7.4 Quantificação da produção de fator de necrose tumoral (TNF)
A concentração de TNF-α foi mensurada através da sua atividade lítica contra células
L-929. O ensaio foi conduzido a partir da cultura (3,5 x 104 células/poço) colocada para aderir em placas de 96 poços (NUNC) em meio de cultura RPMI-1640, contendo 10% de soro bovino fetal.
sobrenadante da cada poço foi desprezado e adicionado 100 µl (por poço) de cristal violeta (0,05%) em ácido acético (30%). Decorridos 15 min, as placas foram lavadas em água corrente e colocadas para secar.
Após a secagem das placas foram adicionados 100 µl de metanol (por poço) para dissolução do cristal violeta e a densidade óptica foi determinada em leitor de ELISA (Bio-tek Instruments) em comprimento de onda de 620nm.
A porcentagem de lise celular foi baseada na densidade óptica calculada através da seguinte fórmula: % de lise = 1 – [ABSa/ABSc] x 100
Onde ABSa representa a absorbância da amostra e ABSc a absorbância do controle. As amostras foram sempre dosadas em duplicata e o resultado expresso pela média aritmética das leituras. O título de TNF-α em U/ml foi definido como recíproca da diluição onde se observa
50% de lise celular.
Manutenção da cultura de células L-929 para quantificação de TNF-α
Células da linhagem de fibroblastos murinos L-929 foram cultivadas em garrafas plásticas (Corning) contendo meio RPMI-1640 suplementado com 10% de soro fetal bovino, L-glutamina (0,2mM) e gentamicina (10 µg/ml).
As garrafas plásticas contendo as células em culturas foram mantidas em atmosfera úmida com 5% de CO2 a 37ºC. Ao formarem uma monocamada na superfície da garrafa, normalmente a cada 2 dias, o meio RPMI-1640 foi retirado e em substituição foi adicionado tampão Versene [PBS+ tripsina (0,05%)+ EDTA (0,02%)]. Uma vez que as células encontram-se em suspensão, o tampão Versene foi inativado (adicionando-se meio RPMI-1640+SBF-10%). Após centrifugação, as alíquotas foram redistribuídas em outras garrafas.
3.7.5 Citocinas(IL-1β, IL-4 e IL-10 )
As citocinas IL-1β, IL-4 e IL-10 foram quantificadas por ELISA em amostras de
comercialmente (R & D System®). Os ensaios foram conduzidos de acordo com as normas do fabricante.
Em síntese, placas de 96 poços NUNC-MAXISORP foram sensibilizadas “overnight” a temperatura ambiente com 100 μl de anticorpos monoclonais específicos de captura para as
citocinas: anti-IL-1β, anti- IL-4 e anti-IL-10. As placas foram lavadas 3 vezes com
PBS-Tween 0,05% e bloqueadas por 2 h com 200 μl de PBS contendo 1% de BSA e 5% de
sacarose. Após este período, as placas foram novamente lavadas e 50 μl das amostras ou da
curva padrão foram adicionados e incubados por 2 h a temperatura ambiente. A seguir, as placas foram lavadas e adicionados 100 μl do anticorpo de detecção biotilinado específico para
cada citocina, seguido de incubação por 2 h a temperatura ambiente. As placas foram lavadas novamente e incubadas com solução de peroxidase de raiz forte conjugada a avidina em PBS contendo 1% de BSA durante 20 min a 37º C. Após lavagem das placas foram adicionados 100 μl de reagente para revelação da reação. Finalmente, após 30 min a reação foi
interrompida com ácido sulfúrico 1 M e a densidade óptica lida em 450 nm. A concentração das citocinas presentes nas amostras foi calculada com base em curva padrão.
3.8 Tratamentos farmacológicos
3.8.1Depleção de neutrófilos