PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA
DESENVOLVIMENTO E AVALIAÇÃO DE
NANOEMULSÕES COM EXTRATO ETANÓLICO BRUTO
DAS FOLHAS DE Melaleuca leucadendron E CLORIDRATO
DE PILOCARPINA PARA O USO POTENCIAL COMO
RADIOPROTETOR TÓPICO
KAREN VITOR CARVALHO
KAREN VITOR CARVALHO
DESENVOLVIMENTO E AVALIAÇÃO DE
NANOEMULSÕES COM EXTRATO ETANÓLICO BRUTO
DAS FOLHAS DE Melaleuca leucadendron E CLORIDRATO
DE PILOCARPINA PARA O USO POTENCIAL COMO
RADIOPROTETOR TÓPICO
Dissertação apresentada ao Programa de Pós-Graduação em Biotecnologia da Universidade Federal de Ouro Preto como parte das exigências para obtenção do grau de mestre em Biotecnologia.
Orientador: Prof. Dr. Orlando David Henrique dos Santos - UFOP
FICHA CATALOGRÁFICA
C331d Carvalho, Karen Vitor.
Desenvolvimento e avaliação de nanoemulsões com extrato etanólico bruto das folhas de Melaleuca leucadendron e cloridrato de pilocarpina para o uso potencial como
radioprotetor tópico [manuscrito] / Karen Vitor Carvalho. - 2014.
129f.: il.: color; grafs; tabs.
Orientador: Prof. Dr. Santos Orlando David Henrique dos. Coorientador: Prof. Dr. Souza Gustavo Henrique Bianco de. Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas.
Departamento de Farmácia. Núcleo de Pesquisas em Ciências Biológicas.
Área de Concentração Biotecnologia aplicada a processos e ao tratamento de doenças.
1. Radioterapia - Teses. 2. Agentes de radiopreteção - Teses. I. Santos, Orlando David Henrique dos. II. Souza, Gustavo Henrique Bianco de. III. Universidade Federal de Ouro Preto. IV. Titulo.
CDU: 615.849
“Eu me sinto como uma criança brincando à beira-mar, divertindo-me em descobrir uma pedrinha mais lisa ou uma concha mais bonita que as outras, enquanto o imenso oceano da verdade continua misterioso diante de meus olhos.”
Aos meus pais,
meus maiores exemplos e minha
maior fonte de energia e coragem
À Deus por estar comigo a cada instante! Obrigada por cuidar de mim, da minha família e dos meus amigos, permitindo que encontremos apoio uns nos outros!
Ao Orlando, pela oportunidade proporcionada ao aceitar ser meu orientador! Obrigada por confiar na minha capacidade, compartilhar conhecimentos e se empenhar em me amparar mesmo de longe!
Aos meus pais, ao Ritchelly e à vó Geralda, por serem a minha família, o meu porto seguro! Obrigada pelo amor, pela dedicação e por acreditarem em mim mesmo quando eu duvidei!
Aos meus demais familiares, pelos bons conselhos, palavras de incentivo e por cada pequeno gesto de afeto e cuidado! Em especial ao tio Hariph, à tia Zenaidia, à tia Elisama e suas respectivas famílias, por estarem sempre presentes!
Ao amigo Ricardo Zatti, por me incentivar a escolher esse caminho, me indicar ao Orlando e me motivar sempre!
Aos hermanos Ricardo, Simone e Vanessa, por toda amizade, cumplicidade e crescimento! Obrigada pelos momentos e conhecimentos compartilhados, desde os dias de trabalho intenso no laboratório até as risadas mais despreocupadas fora dele!
Aos amigos que me receberam no mestrado, Liliam, Zabelê, Shiara, Diego, Thais e Fred, por me acolherem com os corações abertos! Obrigada pelo cuidado, pelas dicas, pelas alegrias, enfim, pelo companheirismo que fez de vocês tão especiais para mim!
Aos amigos que vieram com o tempo, em especial Thales, Patrícia e Quênia, por tornarem o meu dia-a-dia muito mais agradável! Obrigada por todo apoio, conversas e descontrações!
Ao Gustavo e à Marina, por sua imensa dedicação e disponibilidade! Obrigada por toda a boa vontade, abrindo mão de finais de semana e feriados para me ajudar! Sou muito grata pela amizade que construímos e por me fazerem acreditar que era possível concluir os experimentos!
Aos amigosde Sericita, que eu trago sempre na bagagem, por serem parte de mais essa conquista! Obrigada por todo amor e torcida dedicados a mim!
amizade e companheirismo de sempre!
À Republica Hipnose, com suas moradoras, ex-alunos e agregados, por me conceder a fantástica experiência de morar em uma república com o meu perfil! Obrigada Neylli, Satto, Lorens, Sílvia e Raquel por se tornarem as amigas com quem eu vivi tudo isso!
À gloriosa Republica Tcheca, por ser uma segunda casa para mim! Obrigada Ricardo, por me levar até eles! Obrigada moradores, ex-alunos e agregados, por serem amigos admiráveis, que o convívio transformou em família!
Às republicas estudantis, em especial à Alforria, Mata Burro, Skulaxu, Saideira, Mata Virgem e Molotov, por serem fonte de amizade e descontração!
Ao professor Gustavo, meu co-orientador, por sua assistência! Obrigada pelas sugestões enriquecedoras que fez!
À professora Sandra, por sua colaboração! Obrigada por aceitar essa parceria, me ensinar sobre uma área nova e me disponibilizar o Gustavo e a Marina!
Ao professor Bibo, por todo o conhecimento científico e pessoal compartilhados! Obrigada por ser um exemplo de professor e de pessoa!
Aos professores Milton e Daniel por aceitarem participar da banca e contribuir para o enriquecimento desse estudo! Obrigada pela prontidão!
Aos funcionários do Cipharma, em especial à Mirella, Léo, Paty, Ramon e Jhon, por sua disponibilidade e boa vontade! Obrigada pelo apoio e convívio!
Ao Josino e à Renata Guerra, por todo esclarecimento e ajuda que foram prestados! Obrigada pela disposição!
A todos com quem dividi tempo e espaço no Laboratório de Nanotecnologia e Desenvolvimento Galênico, no Laboratório de Farmacognosia e no Laboratório de Imunoparasitologia, por toda contribuição e boa convivência!
À Prefeitura Municipal de Sericita, em especial à Marilda, Robson, Elielma e Wagner, por me cederem um espaço com internet de qualidade para escrever! Obrigada pela prestatividade e amizade!
À ilustre Escola de Farmácia, por ter a honra de fazer parte da sua história!
À Fapemig, por conceder a bolsa que tanto me ajudou financeiramente!
RESUMO... i
ABSTRACT... ii
LISTA DE FIGURAS... iii
LISTA DE TABELAS... v
LISTA DE ABREVIATURAS E SIGLAS... vii
1. INTRODUÇÃO... 1
2. REVISÃO DA LITERATURA... 4
2.1. O câncer... 5
2.2. Radioterapia... 6
2.2.1.Radiodermatites... 7
2.3. Radioprotetores... 9
2.3.1. Atividade antioxidante... 10
2.3.1.1. Método de redução do radical DPPH... 12
2.3.1.2. Método de redução do radical ABTS... 12
2.4. Melaleuca leucadendron... 13
2.5. Cloridrato de pilocarpina... 15
2.6. Óleo de girassol... 16
2.7. Nanoemulsões... 17
2.7.1. Estabilidade das nanoemulsões... 19
2.7.2. Emulsificação pelo método da temperatura de inversão de fases... 20
2.7.3. Vantagens das nanoemulsões... 20
3. OBJETIVOS... 22
4. MATERIAL E MÉTODOS... 24
4.1. Materiais... 25
4.1.1. Material Botânico... 25
4.1.2. Material para o desenvolvimento das nanoemulsões... 25
4.2. Obtenção do extrato... 26
4.3. Prospecção Fitoquímica... 27
4.3.1. Compostos fenólicos... 28
4.3.2. Triterpenos e esteróides... 28
4.3.3. Taninos... 28
4.3.4. Flavonóides... 28
4.3.5. Antranóides e cumarinas... 29
4.3.6. Saponinas... 29
4.3.7. Alcalóides... 29
4.4. Determinação do teor de fenóis totais... 29
4.5. Avaliação da capacidade antioxidante in vitro... 30
4.5.1. Método de redução do radical DPPH... 30
4.5.2. Método de redução do radical ABTS liofilizado... 31
4.6. Desenvolvimento das nanoemulsões O/A... 32
4.6.1. Emulsificação por inversão de fases... 32
4.6.2. Determinação da composição das nanoemulsões... 32
4.6.3. Determinação do sistema tensoativo... 33
4.7. Avaliação macroscópica das formulações... 34
4.8. Avaliação microscópica das formulações... 34
4.9. Determinação da distribuição granulométrica... 34
4.10. Testes preliminares de estabilidade... 35
4.11.1. Adição do EEB... 36
4.11.2. Adição do cloridrato de pilocarpina... 37
4.12. Caracterização físico-química das nanoemulsões... 37
4.12.1. Avaliação macroscópica... 37
4.12.2. Avaliação microscópica... 38
4.12.3. Determinação da distribuição granulométrica... 38
4.12.4. Determinação do pH... 38
4.12.5. Determinação da temperatura de inversão de fases... 38
4.12.6. Determinação do potencial zeta... 38
4.13. Testes de estabilidade... 39
4.14. Determinação da citotoxicidade in vitro das nanoemulsões por MTT... 39
4.15. Determinação da atividade antioxidante in vitro das nanoemulsões... 41
4.16. Análises estatísticas... 43
5. RESULTADOS E DISCUSSÃO... 44
5.1. Obtenção do extrato... 45
5.2. Prospecção fitoquímica... 45
5.3. Determinação do teor de fenóis totais... 46
5.4. Avaliação da capacidade antioxidante in vitro... 48
5.4.1. Avaliação da capacidade antioxidante do extrato... 48
5.4.1.1. Método de redução do radical DPPH... 48
5.4.1.2. Método de redução do radical ABTS liofilizado... 49
5.4.2. Avaliação da capacidade antioxidante do cloridrato de pilocarpina... 51
5.4.3. Avaliação da capacidade antioxidante do óleo de girassol... 51
5.4.3.1. Método de redução do radical DPPH... 51
5.4.3.2. Método de redução do radical ABTS liofilizado... 53
5.5. Desenvolvimento das nanoemulsões O/A... 54
5.6. Determinação da distribuição granulométrica... 59
5.7. Testes preliminares de estabilidade... 59
5.7.1. Estresse térmico... 60
5.7.2. Centrifugação... 60
5.8. Adição dos princípios ativos às nanoemulsões... 61
5.8.1. Adição do EEB... 61
5.8.2 Adição do cloridrato de pilocarpina... 63
5.9. Caracterização físico-química das nanoemulsões... 64
5.9.1. Avaliação macroscópica... 65
5.9.2. Avaliação microscópica... 65
5.9.3. Determinação da distribuição granulométrica... 65
5.9.4. Determinação do pH... 66
5.9.5. Determinação da temperatura de inversão de fases... 67
5.9.6. Determinação do potencial zeta... 69
5.10. Testes de estabilidade... 71
5.10.1. Estresse térmico... 71
5.10.2. Centrifugação... 72
5.11. Determinação da citotoxicidade in vitro das nanoemulsões por MTT... 73
5.12. Determinação da atividade antioxidante in vitro das nanoemulsões... 75
6. CONCLUSÃO... 80
7.PERSPECTIVAS... 82
i etanólico bruto das folhas de Melaleuca leucadendron e cloridrato de pilocarpina para o uso potencial como radioprotetor tópico. 2014. Dissertação (Mestrado). Núcleo de Pesquisas em Ciências Biológicas, Universidade Federal de Ouro Preto.
As radiodermatites são efeitos secundários que podem comprometer a dose e a adesão à radioterapia, em pacientes com câncer. Substâncias radioprotetoras não tóxicas, capazes de prevenir ou minimizar esses danos, são necessárias. A espécie Melaleuca leucadendron e a pilocarpina possivelmente apresentam essa capacidade. O objetivo da pesquisa foi desenvolver e avaliar nanoemulsões com extrato etanólico bruto das folhas de Melaleuca leucadendron e cloridrato de pilocarpina para o uso potencial como radioprotetor tópico. O extrato de M. leucadendron foi obtido e apresentou conteúdo fenólico de 10,23%. O cloridrato de pilocarpina não apresentou capacidade antioxidante. O extrato e o óleo de girassol foram altamente antioxidantes, apresentando CE50 de 17,0 ±0,59 µg/mL e 6,39 ±0,27 mg/mL, respectivamente, pelo
método DPPH. Nanoemulsões estáveis foram obtidas combinando óleo de girassol, monoestearato de sorbitano e óleo de rícino hidrogenado e etoxilado, através do método de inversão de fases. Boa incorporação do extrato às nanoemulsões foi obtida ultrassonicando o mesmo com o tensoativo hidrofílico previamente ao aquecimento da fase oleosa. O cloridrato de pilocarpina foi adicionado durante o processo de resfriamento das formulações. A nanoemulsão base e as nanoemulsões com extrato, pilocarpina ou ambos ativos apresentaram tamanho de partícula entre 70 e 80 nm, com baixo índice de polidispersão. Essas quatro emulsões apresentaram pH e temperatura de inversão de fases característicos de sistemas estáveis e condizentes com o método de obtenção utilizado. O potencial zeta dessas nanoemulsões foi superior a 30 mV em módulo, conferindo estabilidade eletrostática às mesmas. As formulações permaneceram inalteradas em até 60 dias de armazenamento, mesmo após os ensaios de estabilidade. Foi observada citotoxicidade dependente das concentrações do extrato e/ou pilocarpina, sendo que nanoemulsões com quantidades totais de ativos inferiores a 500 µg/ mL apresentaram viabilidade celular superior a 80%. As nanoemulsões foram capazes de manter, com certa redução, os potenciais antioxidantes do extrato e do óleo de girassol e um possível sinergismo entre os dois foi observado. As formulações com pilocarpina apresentaram atividade antioxidante decorrente do óleo na composição. As concentrações eficazes foram bastante inferiores às com toxicidade acima do aceitável. As nanoemulsões obtidas foram caracterizadas como potenciais radioprotetores para uso tópico, sendo necessário confirmar essa ação em estudos posteriores.
ii ethanol extract of Melaleuca leucadendron’s leaves and pilocarpine hydrochloride for potential use as a radioprotective topic. 2014. Dissertação (Mestrado). Núcleo de Pesquisas em Ciências Biológicas, Universidade Federal de Ouro Preto.
Radiodermatites are side effects that may compromise dose and adherence to radiotherapy in cancer patients. Non-toxic radioprotectors, to prevent or minimize these damages, are necessary. Melaleuca leucadenron specie and pilocarpine possibly present this ability. The aim of this study was to develop and evaluate nanoemulsions containing crude ethanol extract of Melaleuca leucadendron’s leaves and pilocarpine hydrochloride for potential use as a radioprotective topic. Extract of M. leucadendron was obtained and presented phenolic content of 10.23%. Pilocarpine hydrochloride did not show antioxidant activity. Extract and sunflower oil were highly antioxidant, with IC50 of 17.0 ± 0.59 µg / mL and 6.39 ± 0.27 mg / mL, respectively, by DPPH method.
Stable nanoemulsions were obtained by combining sunflower oil, sorbitan monostearate, and ethoxylated hydrogenated castor oil, by phase inversion method. Good incorporation of the extract in nanoemulsion was obtained by sonication with the hydrophilic surfactant before heating the oil phase. Pilocarpine hydrochloride was added during the cooling process of the formulations. Free nanoemulsion and nanoemulsions with extract, pilocarpine or both, presented particle size in the range of 70 and 80 nm, with low polydispersity. These four emulsions showed pH and phase inversion temperature characteristic of stable systems, consistent with the method of production used. Zeta potential of these nanoemulsions was more than 30 mV in magnitude, giving them electrostatic stability. Formulations have not changes during the period of 60 days, even after stability tests. Depending on the concentrations of the extract and / or pilocarpine cytotoxicity was observed, and nanoemulsions with total quantities of active lower 500 µg / mL showed a 80% cell viability. Nanoemulsions were able to maintain, with just a sligth reduction, the antioxidant potential of the extract and sunflower oil, and possible synergism between the two was observed. Formulations with pilocarpine showed antioxidant activity due to the oil in its composition. Effective concentrations were much lower than concentrations with toxicity above the acceptable. Nanoemulsions obtained were characterized as potential radioprotective for topical use, being necessary to confirm this action in subsequent studies.
iii Figura 1: Pele e anexos cutâneos. Fonte: MEZADRI, 2010... 8 Figura 2: Reação de redução do radical DPPH pelo antioxidante sintético BHT. Fonte: TIVERON, 2010... 12
Figura 3: Redução do radical ABTS por um antioxidante e sua formação por persulfato de potássio. Fonte: HUANG et al., 2005... 13
Figura 4: Árvores da espécie Melaleuca leucadendron, localizadas no campus da Universidade Federal de Ouro Preto (UFOP)... 14
Figura 5: Folhas, frutos e partes do caule da espécie Melaleuca leucadendron... 14 Figura 6: Fórmula estrutural do cloridrato de pilocarpina. Fonte: Farmacopéia Brasileira V, 2010... 16
Figura 7: Aspecto translúcido de uma nanoemulsão em comparação com água purificada. Fonte: ROCHA-FILHO 2014... 18
Figura 8: Estrutura molecular do monooleato de sorbitano. Fonte: www.sigmaaldrich.com/catalog/product/sigma/s6760... 25
Figura 9: Estrutura molecular do monoestearato de sorbitano. Fonte: www.sigmaaldrich.com/catalog/product/aldrich/w302805... 26
Figura 10: Etapas do processo de obtenção do extrato etanólico bruto das folhas de Melaleuca leucadendron. A – Folhas secas pulverizadas. B – Solvente sendo eliminado do extrato em evaporador rotativo... 26
Figura 11: Representação esquemática da determinação da distribuição granulométrica pela técnica de espectroscopia de correlação de fótons (PCS). Fonte: YAJING et al., 2014... 35
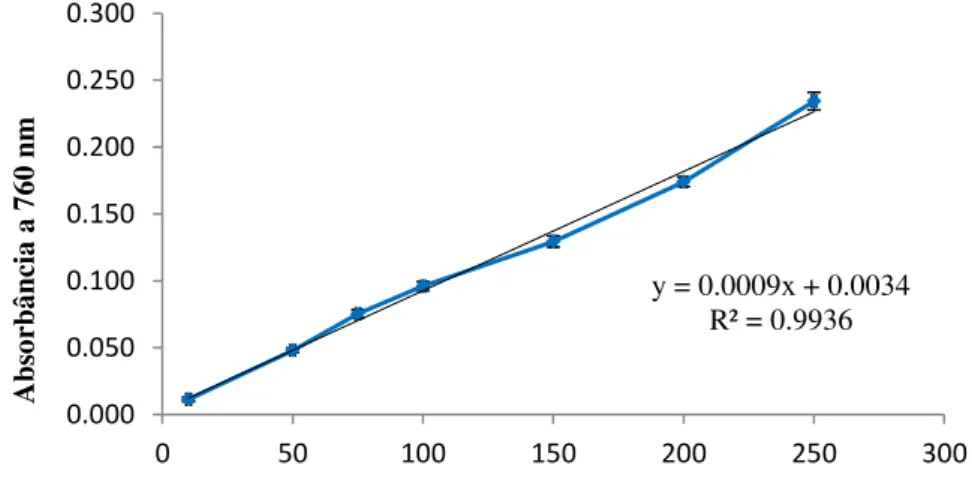
Figura 12: Extrato etanólico bruto das folhas de Melaleuca leucadendron... 45 Figura 13: Curva de calibração e sua respectiva equação linear obtidas para o ácido-gálico pelo método Folin-Ciocalteu para quantificação de compostos fenólicos (média ± desvio padrão, n = 3)... 46
Figura 14: Reação de neutralização de radical livre por estrutura fenólica básica, através da doação de hidrogênio, originando intermediário pouco reativo... 47
iv padrão, n = 3)... 49
Figura 17: Capacidade de inibição do radical DPPH em função da concentração do óleo de girassol após 30 e 60 minutos de reação. (média ± desvio padrão, n = 3) 52
Figura 18: Fotomicrografia de formulações utilizando o sistema tensoativo Span 80/ Croduret 50 Special, 24 horas após o preparo, aumento de 400X. A – emulsão SC5 sob luz branca comum. B – emulsão SC3 sob luz polarizada... 55
Figura 19: Fotomicrografia, sob luz polarizada, de uma das formulações utilizando o sistema tensoativo Crill 3/ Croduret 50 Special num total de 10 % de fase oleosa, emulsão CC5, 24 horas após o preparo, aumento de 400X... 56
Figura 20: Fotomicrografia, sob luz polarizada, da emulsão CC15, utilizando o sistema tensoativo Crill 3/ Croduret 50 Special num total de 20 % de fase oleosa, 24 horas após o preparo, aumento de 400X... 57
Figura 21: Emulsão CC13 durante resfriamento sob agitação, com aspecto transparente azulado... 58
Figura 22: Fotomicrografia sob luz polarizada, das formulações com aspecto macroscópico de nanoemulsões, 24 horas após o preparo, aumento de 1000X. A – emulsão CC13. B – emulsão CC14... 58
Figura 23: Incorporação de 0,5% do EEB previamente ao aquecimento da fase oleosa. A – método I: EEB adicionado à fase oleosa completa. B – método II: EEB adicionado ao Croduret 50 Special e sonicado por 2 horas. C – método III: EEB adicionado ao Croduret 50 Special e sonicado por 4 horas... 62
Figura 24: Formulações contendo 0,1% de EEB. A – nanoemulsão obtida pelo método I. B – nanoemulsão obtida pelo método III... 62
Figura 25: Condutividade elétrica das nanoemulsões em função da temperatura... 68 Figura 26: Viabilidade celular das nanoemulsões com EEB (E1 a E7) e das nanoemulsões com cloridrato de pilocarpina (P1 a P7), avaliada pelo método MTT, frente a macrófagos (média ± desvio padrão, n = 3)... 74
Figura 27: Viabilidade celular das nanoemulsões com EEB e cloridrato de pilocarpina, avaliada pelo método MTT, frente a macrófagos (média ± desvio padrão, n = 3). Nessas formulações, as concentrações em %, de EEB e pilocarpina, respectivamente, são: EP1 = 0,01/0,01; EP2 = 0,02/0,01; EP3 = 0,02/0,02 e EP4 = 0,05/0,05... 74
v Tabela 1: Composições testadas para a obtenção das nanoemulsões... 33 Tabela 2: Composição, denominação e proporção do sistema tensoativo empregado para cada uma das formulações desenvolvidas... 33
Tabela 3: Concentrações dos princípios ativos em cada uma das nanoemulsões avaliadas quanto à citotoxicidade pelo método MTT... 41
Tabela 4: Concentrações dos princípios ativos em cada uma das nanoemulsões avaliadas quanto à capacidade antioxidante pelo método DPPH... 42
Tabela 5: Triagem da presença dos principais metabólitos secundários no EEB das folhas de Melaleuca leucadendron... 45
Tabela 6: Comparação da capacidade redutora de DPPH do EEB das folhas de Melaleuca leucadendron, com alguns antioxidantes sintéticos e extratos vegetais... 49 Tabela 7: Comparação da capacidade redutora de DPPH do óleo de girassol e alguns outros óleos... 52
Tabela 8: Concentração de α-tocoferol com capacidade redutora do radical ABTS equivalente a da solução de óleo de girassol diluído 10 vezes... 53
Tabela 9: Aspecto macroscópico das emulsões desenvolvidas utilizando Span 80/Croduret 50 Special como sistema tensoativo... 54
Tabela 10: Aspecto macroscópico das emulsões desenvolvidas utilizando Crill 3/Croduret 50 Special como sistema tensoativo... 55
Tabela 11: Resultados da distribuição granulométrica após o teste de estresse térmico (média ± desvio padrão, n = 3)... 60
Tabela 12: Resultados da distribuição granulométrica após o teste de centrifugação (média ± desvio padrão, n = 3)... 61
Tabela 13: Composições centesimais das nanoemulsões utilizadas nos ensaios de caracterização... 64
Tabela 14: Distribuição granulométrica obtida para caracterização das nanoemulsões, 24 horas após o preparo (média ±desvio padrão, n = 3) ... 65
Tabela 15: Valores de pH das nanoemulsões após 1, 7 e 30 dias do preparo (média ± desvio padrão, n = 3)... 66
vi após o preparo (média ±desvio padrão, n = 3)... 70
Tabela 18: Distribuição granulométrica das nanoemulsões posteriormente aos testes de estresse térmico realizados 1, 7, 15, 30 e 60 dias após seu preparo (média ±desvio padrão, n = 3)... 71
Tabela 19: Distribuição granulométrica das nanoemulsões posteriormente aos testes de centrifugação realizados 1, 7, 15, 30 e 60 dias após seu preparo (média ±desvio padrão, n = 3)... 72
Tabela 20: Capacidade de inibição do radical DPPH, observada após 30 e 60 minutos, apresentada pelas nanoemulsões com EEB, de E1 a E6... 76
Tabela 21: Capacidade de inibição do radical DPPH, observada após 30 e 60 minutos, apresentada pelas nanoemulsões com cloridrato de pilocarpina, de P1 a P6... 78
vii A/O Água em óleo
ABTS 2,2-azinobis (3-etilbenzotiazolina-acidosulfónico) ANOVA Análise de variância
BHT Butilhridroxitolueno
CC Crill 3 / Croduret 50 Special CCD Cromatografia em camada delgada CE50 Concentração eficaz a 50 %
CT50 Concentração tóxica a 50 %
DEMEM Meio Eagle Modificado por Dulbecco DNA Ácido desoxirribonucléico
DPPH 2,2-difenil-1-picrilhidrazil EAG Equivalentes de ácido gálico EAT Equivalentes de α-tocoferol EEB Extrato etanólico bruto
EHL Equilíbrio hidrofílico-lipofílico ELISA Ensaio imunoenzimático EROs Espécies reativas de oxigênio FDA Food and Drug Administration IDPPH Inibição do radical DPPH
INCA Instituto Nacional de Câncer José Alencar Gomes da Silva IP Índice de polidispersão
Log P Coeficiente de partição óleo-água
MTT 3-(4,5-dimetil-tiazol-2-il)-2,5-difenil-tetrazólio NB Nanoemulsão base
NE Nanoemulsão com EEB
NEP Nanoemulsão com EEB e pilocarpina NP Nanoemulsão com pilocarpina
O/A Óleo em água
OMS Organização Mundial da Saúde P.A Padrão analítico
viii SC Span 80 / Croduret 50 Special
SPSS Statistical Package for Social Sciences TE Equivalentes de Trolox
TIF Temperatura de inversão de fases UV Ultravioleta
2 1. INTRODUÇÃO
O câncer é uma das principais causas de morbidade e mortalidade no mundo. A terapia com radiação tem sido utilizada, por aproximadamente 100 anos, como um modo efetivo de tratamento dessa patologia, sendo necessária em mais da metade dos casos (MAURYA et al., 2006; GUERRA et al., 2012; JEONG et al., 2014; HALVORSEN et al., 2014).
A radioterapia tem como fundamento a aplicação de uma dose determinada de radiação ionizante, num volume tumoral previamente definido, com a finalidade de diminuir ou erradicar o tumor. No entanto, para chegar às células cancerosas, a radiação atravessa os tecidos adjacentes causando danos aos mesmos (REIS, 2008; KHAN e ALHOMIDA, 2011). A base dessa terapia é lesionar direta ou indiretamente o DNA, causando danos irreparáveis. Geralmente a morte das células ocorre na primeira ou em uma das primeiras divisões celulares pós-radiação, acometendo preferencialmente os tecidos com maior proliferação (STONE et al., 2003; MARKOUIZOU et al., 2007; BURDAK-ROTHKAMM e PRISE, 2009).
A pele é uma barreira de defesa biológica e, devido à sua elevada taxa proliferativa, é também um dos principais órgãos afetados pelos danos que essa terapia promove. Muitas vezes apresenta a inflamação específica da radiação, denominada radiodermatite. Essas lesões cutâneas podem ser limitantes da dosagem aplicada na sequência do tratamento, comprometendo sua eficácia ou a qualidade de vida do paciente. E, algumas reações agudas graves, podem requerer a suspensão temporária ou permanente da radioterapia (MARKOUIZOU et al., 2007; MEI et al., 2014).
3 O desenvolvimento de medicamentos, historicamente, é sinônimo do estudo de princípios ativos derivados de fontes naturais, principalmente espécies vegetais. A espécie Melaleuca leucadendron é pertencente à família Myrtaceae, proveniente da Austrália e comum em regiões de clima tropical a temperado. Alguns extratos da espécie e o óleo essencial das folhas tem sido relacionados com potenciais antioxidantes e anti-inflamatórios (FU et al., 2010; PUJIARTI et al., 2011; YUN et al., 2012).
A pilocarpina é um alcalóide presente nas folhas da espécie vegetal Pilocarpus microphyllus, conhecida popularmente como jaborandi. É um agonista muscarínico utilizado nos tratamentos de glaucoma e xerostomia. Em muitos países tem sido utilizada para amenizar efeitos adversos consequentes do tratamento radioterápico, sendo o seu uso aprovado para tratar a baixa salivação decorrente da radioterapia (RODRÍGUEZ-CABALLERO et al. 2012; SAWAYA et al., 2011; ARARUNA et al., 2012; KIM et al., 2014).
As nanoformulações, incluindo nanoemulsões, têm sido constantemente utilizadas como carreadoras de substâncias de origem vegetal, melhorando as propriedades farmacocinéticas dos produtos e protegendo contra toxicidade e degradação (ANSARI et al., 2012; KUMARI et al., 2012). As nanoemulsões apresentam as vantagens de aumentar a solubilidade e a permeabilidade das substâncias ativas. Quando aplicadas topicamente, são capazes de penetrar nas rugosidades até mesmo da pele áspera. Além disso, apresentam caráter estético agradável e causam boa sensação quando aplicadas (TADROS et al., 2004; MORAIS et al. 2006; KUMARI et al., 2012).
5 2. REVISÃO DA LITERATURA
2.1. O câncer
O câncer é uma das principais causas de óbito no mundo. Segundo a Organização Mundial de Saúde (OMS) (2014), causou 8,2 milhões de mortes em 2012. São milhões de casos incidentes anualmente, sendo que, de acordo o Instituto Nacional de Câncer José Alencar Gomes da Silva (INCA) estima-se que só no Brasil, ocorram aproximadamente 576 mil novos casos, no biênio 2014/2015 (BRASIL, 2014).
A doença se caracteriza pelo crescimento rápido e incontrolável de células anormais e pode afetar qualquer parte do organismo. Essas células cancerosas podem romper seus limites habituais, atingir tecidos adjacentes e posteriormente invadir outros órgãos, fenômeno denominado metástase (CASTLE et al., 2014; CHEN et al., 2014).
Muitos tipos de câncer ainda não respondem totalmente às intervenções terapêuticas. Para uma maior eficácia do monitoramento e tratamento, com chances de cura, é necessário um diagnóstico precoce e exato (ILYAS et al., 2014; VULAPALLI, 2014; SU et al., 2015).
O objetivo da terapia é curar a doença ou prolongar consideravelmente a sobrevida do paciente, assim como melhorar a qualidade de vida. O tratamento dessa patologia requer uma seleção cuidadosa de uma ou mais intervenções. As principais alternativas são cirurgia, radioterapia e quimioterapia (BALIGA e RAO, 2010; KHAN e ALHOMIDA, 2011; OMS, 2014).
A quimioterapia citotóxica é a intervenção mais comum. Nesse tratamento, as células cancerosas que se dividem rapidamente são mortas. Algumas células saudáveis, que apresentam maiores taxas proliferativas, também costumam ser eliminadas por dificuldades na especificidade da medicação (VULAPALLI, 2014).
6 2.2. Radioterapia
Desde o final do século XIX, quando houve a descoberta de meios de gerar Raios X por Wilhelm Conrad Roentgen, a terapia com radiação ionizante tem sido desenvolvida como uma parte essencial do diagnóstico e do tratamento de vários tipos de câncer. A intervenção por esse método pode ser realizada como uma modalidade primária ou como adjuvante, em combinação com cirurgia, quimioterapia, terapia hormonal e imunoterapia (VUJOŠEVIĆ e BOKOROV, 2010; KHAN e ALHOMIDA, 2011).
A radioterapia tem como princípio geral causar danos irreparáveis ao DNA das células cancerosas, impedindo que as mesmas cresçam ou se reproduzam. É utilizada com intenção curativa ou paliativa. Pode ser aplicada de formas diferentes, dependendo do tipo de câncer e dos objetivos do tratamento. Pode ser através de feixe externo, denominada teleterapia, através de braquiterapia, que consiste em incidir a radiação diretamente nos tecidos tumorais e ainda, por meio de radiofármacos (RADVANSKY et al., 2013; JEONG et al., 2014; PLITEA et al., 2015).
O tratamento básico com irradiação consiste em administrar uma dose total, dividida em frações. Essas frações são aplicadas com frequência predeterminada, por um período de tempo. Cada fração elimina a mesma quantidade de células tumorais, sendo que a cada dose diária, o tumor estará menor e, com isso, a proporção de destruição será maior. Logo, o intuito do fracionamento é obter um declínio geométrico do número de células sobreviventes a cada aplicação, ocasionando uma regressão do câncer (WITHERS, 1992; MURIEL, 2002; BOURGIER et al., 2013).
De acordo com Connell e Hellman (2009) a administração da dose em frações parece amplificar uma pequena vantagem de sobrevivência que os tecidos normais apresentam sobre as células tumorais, quando irradiados com pequena exposição. Assim, o fracionamento permite minimizar os efeitos adversos e aperfeiçoar o efeito citotóxico sobre os tecidos cancerosos (BOURGIER et al., 2013).
Os efeitos da radioterapia podem ser divididos em quatro etapas:
Física, na qual a radiação é absorvida pelos tecidos, resultando na ionização e excitação dos átomos;
7 Biológica, que representa os processos subsequentes, como danos ao material
genético, lesões na membrana da célula e alteração de processos bioquímicos; Clínica, onde ocorre a manifestação dos sinais e sintomas da exposição à
radiação (JERÔNIMO, 2013).
Os danos causados pela radiação ionizante podem ser letais às células tumorais. Caso ocorra reparação, parcial ou total das mesmas, ainda podem exibir uma variedade de anormalidades cromossômicas capazes de comprometer sua divisão e viabilidade (FALK, 2003).
As fases do ciclo celular mais sensíveis à radiação são a fase pré-mitótica (G2) e
a fase mitótica (M), na qual ocorre a divisão celular. Com isso, células que se dividem rapidamente, como é o caso das tumorais, tendem a ser os alvos dessa terapia (FALK, 2003).
Para atingir os tumores, a radiação atravessa tecidos saudáveis, deixando-os expostos aos danos que pode causar. A natureza e o grau dos efeitos colaterais dependem da dose de radiação ionizante e da sensibilidade dos órgãos irradiados (JEONG et al., 2014). Segundo Gontarz et al. (2014) a radiossensibilidade celular é proporcional à sua atividade proliferativa. Portanto, a radioterapia é um balanço entre a destruição de células tumorais e a minimização dos danos aos tecidos normais.
2.2.1. Radiodermatites
Devido à sua elevada taxa de proliferação, a pele é um dos órgãos mais afetados pelo tratamento radioterápico. Danos cutâneos precoces e tardios são descritos desde os estudos pioneiros da radioatividade. As radiodermatites, como são denominadas, são esperadas em cerca de 95 % dos pacientes que fazem terapia com radiação (KIROVA et al., 2011; CHAN et al., 2014).
8 Figura 1: Pele e anexos cutâneos
Fonte: MEZADRI, 2010
As dermatites são consequência do tratamento por radiação interromper o processo normal de divisão celular e comprometer a regeneração, resultando em danos ou morte celular. A patofisiologia dessas reações envolve uma combinação de lesão direta pela radiação e uma resposta inflamatória subsequente, que afetam as células da epiderme, a derme e a vascularização (RADVANSKY et al., 2013; CHAN et al., 2014).
Segundo os Critérios Comuns de Terminologia para Eventos Adversos v3.0 (do inglês: CTCAE – Common Terminology Criteria for Adverse Events) (2006), definidos pelo Instituto Nacional do Câncer dos Estados Unidos, as radiodermatites podem ser classificadas em 5 graus, de acordo com a gravidade:
Grau 1, ocorre eritema fraco ou descamação seca;
Grau 2, ocorre eritema moderado a vigoroso, descamação úmida desigual, confinada principalmente às dobras e rugosidades cutâneas e edema moderado; Grau 3, ocorre descamação úmida fora das dobras e rugosidades, com
hemorragia induzida por trauma menor ou abrasão;
Grau 4, ocorre necrose da pele ou ulceração de toda a espessura da derme e sangramento espontâneo do local envolvido;
Grau 5, ocorre a morte do paciente.
9 são um fator limitante da dose ou até mesmo um motivo para a interrupção do tratamento (KIROVA et al., 2011; MCQUESTION, 2011).
2.3. Radioprotetores
O diagnóstico precoce e as novas abordagens multidisciplinares têm contribuído para um aumento na expectativa de vida dos pacientes. Com isso, a preocupação com a redução dos efeitos tóxicos da radiação e melhoria da qualidade de vida é cada vez maior (BOURGIER et al., 2012).
Os denominados radioprotetores são agentes que protegem contra a lesão induzida por radiação, se administrados antes, durante, ou depois da irradiação. Um protetor ideal deve evitar os efeitos adversos graves ou tardios em tecidos normais, ser facilmente dispensado, com a mínima toxicidade inerente e não proteger o tumor das radiações ionizantes (WEISS e LANDAUER, 2009; BOURGIER et al., 2012).
Os radioprotetores têm sido classificados de acordo com o período de aplicação. São denominados profiláticos quando administrados anteriormente à radioterapia para prevenir a ocorrência de efeitos agudos ou tardios. Os mitigadores são aqueles aplicados durante ou um pouco depois da terapia, com a finalidade de reduzir as ações da radiação sobre os tecidos normais, antes do surgimento de sintomas. E os que são os utilizados após a irradiação para evitar seus efeitos tardios, quando os sintomas já foram desenvolvidos, são os agentes terapêuticos (BEGG et al., 2011; BOURGIER et al., 2012).
Os agentes protetores da radiação podem exercer sua ação por diversos mecanismos, como suprimir a formação de espécies reativas, detoxificar as espécies reativas formadas, estabilizar o alvo ou, ainda, aumentar os processos de recuperação e reparo (NAIR et al., 2001).
Agentes que tem capacidade de induzir hipóxia local suprimem a formação de espécies reativas. Como no caso dos que realizam reações que resultam no consumo químico ou bioquímico de oxigênio, tornando esse menos disponível para a formação de espécies reativas de oxigênio (EROs) (JERÔNIMO, 2013).
10 glutationa redutase e a superóxido dismutase (NAIR et al., 2001; BALIGA e RAO, 2010; CHATTERJEE, 2013).
A estabilização que os radioprotetores promovem deve-se à capacidade que alguns compostos têm de interagir com alvos celulares, como o DNA, originando complexos que protegem dos danos da radiação (NAIR et al., 2001; JERÔNIMO, 2013).
O aumento dos processos de recuperação ocorre através da ativação de uma ou mais vias de reparo do DNA, que geralmente agem em conjunto para eliminar os danos e restabelecer as funções celulares (YOUSRI et al., 2011; CHATTERJEE, 2013).
Os efeitos de radioproteção são, de maneira geral, consequência das capacidades sequestradora de radicais livres, quelante de metais, antioxidante, anti-inflamatória, antimutagênica ou do aprimoramento dos processos de reparo do DNA (BALIGA e RAO, 2010; BEGG et al., 2011).
Muitos estudos avaliando a eficácia de agentes tópicos e orais, para a prevenção e tratamento de radiodermatites, têm sido desenvolvidos no decorrer dos últimos anos. Nem todos esses agentes tiveram alguma capacidade de reduzir ou eliminar os efeitos tóxicos da radiação à pele comprovada. Apenas a amifostina foi aprovada pela FDA (do inglês: Food and Drug Administration) (HOSSEINIMEHR, 2009; MASFERRER et al., 2010).
A amifostina é um potente radioprotetor, capaz de ligar-se a radicais livres, desintoxicando moléculas potencialmente prejudiciais geradas pela radiação. No entanto, não pode ser utilizada quando a quimioterapia estiver associada ao tratamento radioterápico, o que comumente acontece. Esse fármaco tem seu uso clínico limitado, devido aos efeitos colaterais e à toxicidade que apresenta (HOSSEINIMEHR, 2009; CITRIN et al., 2010; MADERO-VISBAL et al., 2012).
O desenvolvimento de radioprotetores efetivos e não tóxicos é uma necessidade cada vez mais evidente. Muitas espécies vegetais têm sido investigadas com essa finalidade. No entanto, até o momento, nenhum medicamento que apresente todas as características ideais foi relatado (ARORA et al., 2005; YOU et al., 2009).
2.3.1. Atividade antioxidante
11 formadas em elevada quantidade, como no caso de células expostas à radiação, ocorre um desequilíbrio entre EROs e os antioxidantes do organismo, gerando uma condição denominada estresse oxidativo (YOUSRI et al., 2011;BARRERA, 2012).
Os danos celulares causados pela radiação ionizante são predominantemente mediados pela geração excessiva de EROs. A interação da radiação com a água, que é o maior constituinte das células, desencadeia a formação dessas espécies. Os radicais livres originados reagem com as macromoléculas celulares, como DNA, RNA, proteínas e membrana, resultando em disfunção ou mortalidade celular (BAÑO et al., 2006;SRINIVASAN et al., 2006).
A redução desses radicais livres por ação de substâncias com propriedades antioxidantes, especialmente de origem natural, representa uma possível forma de proteção contra as injúrias causadas pela radiação (GREENBERGER e EPPERLY, 2004; SRINIVASAN et al., 2006; BOURGIER et al., 2012).
Os compostos fenólicos, encontrados em uma grande variedade de espécies vegetais, têm recebido atenção especial. Geralmente apresentam efetivo potencial antioxidante, originando um radical fenoxi, cuja estrutura é altamente estabilizada por ressonância e incapaz de propagar reações radicalares em cadeia. Devido a essa elevada capacidade sequestradora de radicais livres, esses compostos têm sido estudados como substâncias potencialmente radioprotetoras (SRINIVASAN et al., 2007; HOSSEINIMEHR, 2009; MACEDO et al., 2013).
A atividade antioxidante pode ser decorrente de mecanismos diversos, como inibição de reações de oxidação de radicais livres; inibição da formação de radicais livres; interrupção da propagação de auto-oxidação em cadeia; supressão de oxigênio singlete; conversão de hidroperóxidos em compostos estáveis; conversão de metais pró-oxidantes em produtos estáveis e, finalmente, inibição de enzimas pró-pró-oxidantes (CAROCHO e FERREIRA, 2013).
12 2.3.1.1. Método de redução do radical DPPH
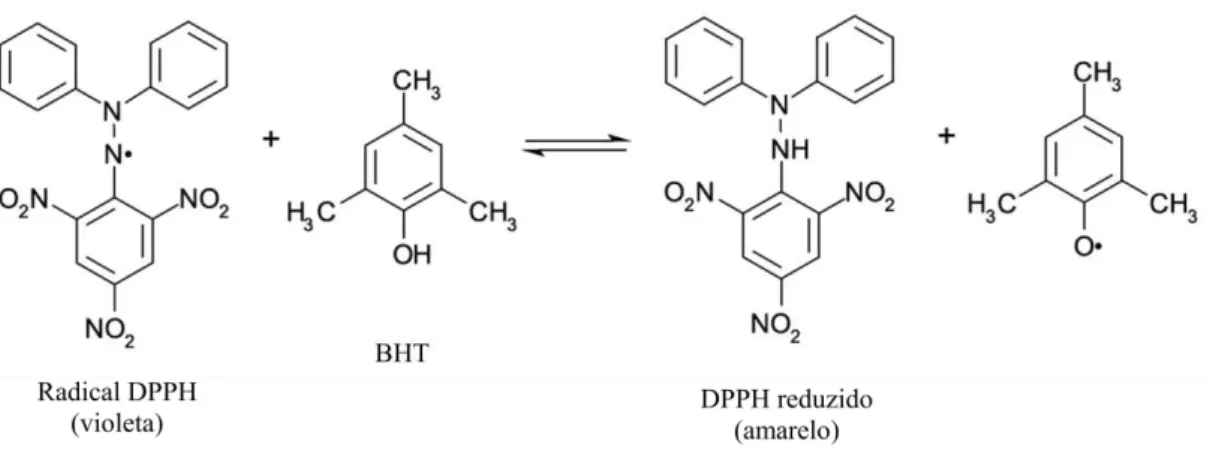
O 2,2-difenil-1-picrilhidrazil (DPPH) em sua forma radicalar apresenta coloração roxa e absorve em 517 nm. Após ser reduzido por um antioxidante a absorção desaparece, como pode ser observado na Figura 2 que ilustra a reação desse radical com o antioxidante sintético BHT. Atualmente esse é um dos métodos mais utilizados para avaliar capacidade antioxidante. (BRAND-WILLIAMS et al., 1995; TIVERON, 2010).
Figura 2: Reação de redução do radical DPPH pelo antioxidante sintético BHT Fonte: TIVERON, 2010
Alguns fenóis, como o α-tocoferol, reagem rapidamente com o radical DPPH. No entanto, devido a várias reações secundárias que ocorrem lentamente causando uma diminuição progressiva de absorbância, pode ser difícil alcançar o estado estacionário mesmo após algumas horas. Normalmente é determinada a concentração de antioxidante necessária para captar 50% dos radicais DPPH (CE50) após 30 minutos de
reação e o tempo para alcançar estabilidade (PEREIRA, 2010).
2.3.1.2. Método de redução do radical ABTS
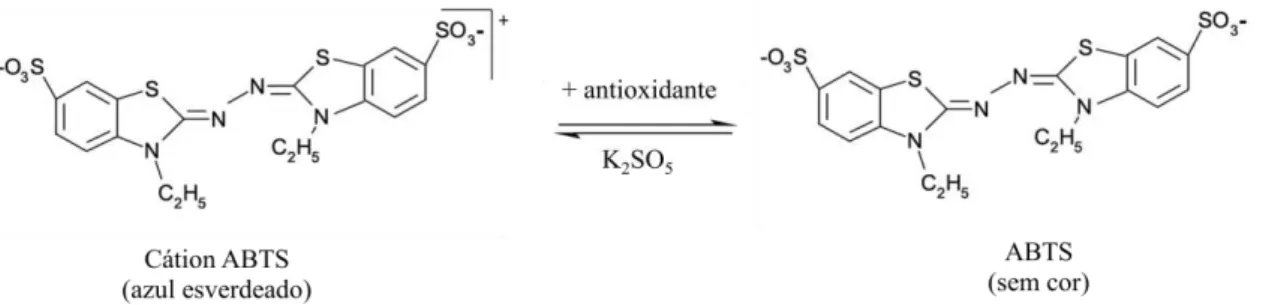
13 O ABTS é mais reativo que o DPPH, completando a reação após 1 minuto. Por ser solúvel tanto em água quanto em solventes orgânicos permite a análise de amostras com diferentes polaridades (ARNAO, 2000; TIVERON et al., 2012).
Figura 3: Redução do radical ABTS por um antioxidante e sua formação por persulfato de potássio.
Fonte: HUANG et al., 2005
2.4. Melaleuca leucadendron
A família Myrtaceae compreende cerca de 130 gêneros e de 3800 a 5800 espécies, sendo composta de arbustos lenhosos a árvores altas. Apresenta elevada ocorrência na Austrália, sudeste da Ásia e nas regiões tropicais e temperadas da América. É considerada uma das mais diversificadas famílias do cerrado brasileiro (STEFANELLO et al., 2011; VILLARROEL et al., 2014).
O gênero Melaleuca é pertencente a essa família, sendo representado por aproximadamente 250 espécies. Dentre essas espécies encontra-se a Melaleuca leucadendron (Figura 4), cuja árvore apresenta caule branco acinzentado e esponjoso com folhas geralmente verde-escuras. As flores são branco-amareladas e pequenas e os frutos são lenhosos, capsulados e globosos (TSURUGA et al., 1991; RINI et al., 2012; AHMED et al., 2013; SHAH et al., 2013).
Conhecida popularmente como melaleuca ou cajuputi, a Melaleuca leucadendron possui elevada capacidade de adaptação e pode crescer bem em solos pobres, ambientes secos ou submersos, sendo resistente a pragas e poluição (AHMED et al., 2013; TIA et al., 2013).
14 antifúngica (YOSHIDA et al., 1996; PUJIARTI et al., 2011;RINI et al., 2012; SURH e YUN, 2012).
Figura 4: Árvores da espécie Melaleuca leucadendron, localizadas no campus da Universidade Federal de Ouro Preto (UFOP)
15 Fu et al. (2010) avaliaram extratos dos frutos de M. leucadenron, em tetrahidrofurano ou em mistura de metanol /ácido acético/ água, encontrando grande potencial antioxidante e elevado conteúdo fenólico. Segundo estudo realizado por Surh e Yun (2012) a fração butanólica do extrato metanólico de M. leucadendron apresenta propriedades que sugerem que essa espécie possa ser utilizada como uma fonte de antioxidantes e anti-inflamatórios naturais.
2.5. Cloridrato de pilocarpina
A espécie vegetal Pilocarpus microphyllus, conhecida popularmente como jaborandi, é um tipo de arbusto originário do Brasil, que ocorre mais intensamente no estado do Maranhão. As folhas dessa espécie são a principal fonte de pilocarpina, um alcalóide que age como agonista colinérgico muscarínico (ARARUNA et al., 2012; CHO et al., 2013; JENSEN et al., 2013).
A pilocarpina possui muitas propriedades farmacêuticas, predominantemente relacionadas às suas ações parassimpatomiméticas. É um princípio ativo que exerce funções semelhantes à acetilcolina e é capaz de estimular a secreção das glândulas sudoríparas, lacrimais e salivares (MACKNELLY e DAY, 2009; SAWAYA et al., 2011; CHO et al., 2013).
Esse fármaco tem sido utilizado a mais de um século para reduzir a pressão intraocular no tratamento do glaucoma. É geralmente empregado na forma de cloridrato de pilocarpina, como solução oftálmica, em concentrações de 1 à 4 % (FRONZA et al., 2004; ABREU et al., 2011; CHANG et al., 2013).
O cloridrato de pilocarpina (Figura 6) apresenta a forma de um pó branco cristalino ou de cristais incolores, caracterizando-se por ser altamente higroscópico. Esse princípio ativo é altamente solúvel em água e etanol, com coeficiente de partição óleo/água hidrofílico (log P = 0,01) (JARVINEN et al., 1991; FARMACOPÉIA BRASILEIRA V, 2010).
16 Figura 6: Fórmula estrutural do cloridrato de pilocarpina
Fonte: Farmacopéia Brasileira V, 2010
Um gel de pilocarpina a 4% foi eficaz para o tratamento de pênfigo vulgar, uma doença caracterizada por lesões na pele. O índice de epitelização observado em lesões tratadas topicamente, com esse gel, foi significativamente maior que o do grupo placebo (IRAJI e YOOSEFI, 2006).
Aragona et al. (2006) relataram uma melhoria no epitélio conjuntival, após tratamento com pilocarpina sistêmica, em pacientes com síndrome de Sjögren, doença autoimune que acomete as glândulas salivares e lacrimais levando ao desenvolvimento de xerostomia e olhos secos. E determinaram que o benefício obtido não foi dependente da secreção glandular.
O uso de pilocarpina diminuiu a perda de peso corporal total, em ratos, ao final de 48 horas pós hepatectomia parcial e reduziu o edema hepático durante sua regeneração (KALIL et al., 1998).
2.6. Óleo de girassol
O girassol (Helianthus annuus L.) é uma das mais importantes oleaginosas comestíveis cultivadas no mundo, junto à soja e ao amendoim. Essa espécie tem sua origem na América Central, sendo conhecida desde o século 26 a.C. (WEISZ et al., 2009; WANG et al., 2012).
17 A vitamina E previne o câncer e doenças cardiovasculares, além de agir como um antioxidante natural. O α-tocoferol, que é a forma mais ativa dessa vitamina, é encontrado em uma considerável concentração no óleo de girassol, na faixa de 500 a 600 mg/ kg de óleo (WARNER e MOUNTS, 1990; BAKRE et al., 2014; THAKORE et al., 2014).
Os compostos fenólicos presentes no óleo de girassol possuem elevada capacidade sequestradora de radicais livres, exercendo ação antioxidante. Muitos estudos têm descrito que antioxidantes fenólicos apresentam diversas atividades biológicas, incluindo anti-inflamatória e preventiva de câncer e aterosclerose (VALAVANIDIS et al., 2004;VALANTINA e NEELAMEGAM, 2012).
O ácido linoléico é o principal componente do óleo de girassol, representando cerca de 48 a 74 % da composição. Esse ácido graxo tem sido descrito com atividades biológicas como anti-inflamatória, desempenhando um papel positivo na cicatrização de feridas (STUYVESANT e JOLLEY, 1967; BONFERONI et al., 2014; THAKORE et al., 2014).
O valor medicinal do óleo de girassol pode ser aumentado pela conjugação com nanopartículas. O emprego desse óleo em formulações tópicas, devido à sua origem vegetal, contribui para o desenvolvimento de produtos seguros e compatíveis com a pele (MORAIS, 2008; THAKORE et al., 2014).
2.7. Nanoemulsões
Emulsões são sistemas metaestáveis que consistem de dois líquidos imiscíveis, em que um encontra-se disperso no outro, na forma de glóbulos. Um exemplo primordial de emulsões é o leite excretado por mamíferos do sexo feminino. No leite, pequenas gotículas de óleo encontram-se dispersas num meio líquido aquoso, servindo como um carreador de substâncias nada ou pouco solúveis em água (WALSTRA, 2005; CHOI et al., 2014; HÖHLER et al., 2014).
18 interfacial, diminuindo a probabilidade de coalescência e melhorando a estabilidade (CUNHA-JÚNIOR et al., 2003; HÖHLER et al., 2014).
Os agentes tensoativos costumam ser classificados de acordo com o equilíbrio hidrofílico-lipofílico (EHL) das regiões de diferentes polaridades. Existe uma escala adimensional para o EHL que varia de 0 a 20. No caso de tensoativos não-iônicos, valores inferiores a 9 referem-se a agentes lipofílicos e valores superiores a 11 são relativos a agentes hidrofílicos. Sendo que, geralmente, são formadas emulsões O/A na faixa de EHL de 8 a 18. No entanto, a solubilidade dos tensoativos varia com a temperatura, ocasionando um deslocamento no equilíbrio e nas características da formulação originada (SCHRAMM et al., 2003).
As nanoemulsões são emulsões com tamanho de partícula reduzido, apresentando diâmetro médio geralmente na faixa de 20 a 200 nm, podendo apresentar granulometria de até 500 nm. São caracterizadas como sistemas cineticamente estáveis, possuem baixa viscosidade e aspecto transparente ou translúcido (Figura 7) (IZQUIERDO et al., 2004; KOMAIKO e MCCLEMENTS, 2014; ROCHA-FILHO 2014).
Figura 7: Aspecto translúcido de uma nanoemulsão em comparação com água purificada
Fonte: ROCHA-FILHO 2014
19 termodinamicamente estáveis e exigem uma elevada quantidade de tensoativos (acima de 20 %) para serem formadas. (IZQUIERDO et al., 2002; MCCLEMENTS, 2012).
2.7.1. Estabilidade das nanoemulsões
Para serem aplicadas às mais diversas áreas, as emulsões precisam apresentar um período pré-determinado de estabilidade físico-química. Os fenômenos de instabilidade mais comuns, que podem comprometer a qualidade dessas formulações, são coalescência, floculação, cremeação, maturação de Ostwald e inversão fases (RAHN-CHIQUE et al., 2012; RAO e MCCLEMENTS, 2012).
Um dos fatores que mais influenciam na estabilidade de nanoemulsões é o tamanho dos glóbulos. Quanto menores são os mesmos, mais estável é o sistema. O tamanho reduzido protege as partículas da sedimentação ou coalescência por reduzir a ação da força gravitacional sobre as mesmas, fazendo com que o movimento Browniano, que essas realizam naturalmente, supere a gravidade (IZQUIERDO et al., 2004; TADROS et al., 2004).
Os tensoativos e a fase oleosa também influenciam na estabilidade, por interferirem no tamanho e na polidispersivdade dos glóbulos, devendo ser adequadamente selecionados. De acordo com a literatura, o uso em conjunto de tensoativos que apresentem liofilia diferente contribui para a obtenção de emulsões mais estáveis. (SCHRAMM et al., 2003; MORAIS, 2008; ALMEIDA et al., 2009).
A estabilização das nanoemulsões, utilizando tensoativos não-iônicos, pode ocorrer através de impedimento estérico, por repulsão eletrostática ou por um mecanismo combinando esses dois métodos. O mecanismo eletrostático produz forças repulsivas na superfície das partículas, impedindo que as mesmas colidam pela ação das forças de van der Waals, que são atrativas (SANTOS et al., 2011; HONARY e ZAHIR, 2013).
20 2.7.2. Emulsificação pelo método da temperatura de inversão de fases
Nanoemulsões podem ser obtidas pelo processo de inversão de fases. Durante esse processo a fase contínua vai sendo acrescentada à fase dispersa sob agitação. Ocorre inversão de um sistema O/A em A/O ou vice-versa. No ponto onde a inversão de fases acontece, a tensão interfacial é mínima, envolvendo gasto energético ínfimo (MORAIS et al., 2006; SAJJADI, 2006).
A inversão espontânea pode ocorrer mantendo-se a temperatura constante e alterando a composição ou mantendo-se a composição constante e alterando a temperatura, que é o método da temperatura de inversão de fases (método TIF) (PATEL et al., 2011; ROCHA-FILHO 2014).
No método TIF os tensoativos não-iônicos etoxilados desidratam durante o aquecimento, alterando a sua afinidade pelas fases aquosa e oleosa. No aquecimento esses tensoativos tornam-se mais lipofílicos, originando emulsões A/O. Quando o sistema é resfriado, os tensoativos alcançam a curvatura espontânea, onde a tensão interfacial é mínima, ocorrendo a inversão de fase para O/A (GUMIERO e ROCHA-FILHO, 2012; CARNEIRO, 2013).
Nesse método ocorre inversão transicional, onde uma igualdade na afinidade por ambas as fases pode ser observado. Também é definido como método da temperatura de equilíbrio hidrofílico-lipofílico (EHL). Essa definição é recebida porque o ponto onde o par de tensoativos atinge o EHL na superfície dos glóbulos é onde ocorre a mínima tensão interfacial que proporciona a inversão (MAALI e MOSAVIAN, 2013; ONTIVEROS et al., 2014).
2.7.3. Vantagens das nanoemulsões
21 Esses sistemas são uma excelente escolha para o encapsulamento e entrega de fármacos, podendo carrear tanto substâncias hidrofílicas quanto lipofílicas. A grande área interfacial entre o óleo e a água pode melhorar a solubilidade dos ativos e, também, modificar adsorção e biodisponibilidade (MCCLEMENTS, 2013; SANTANA et al., 2013).
O pequeno tamanho dos glóbulos, associado às características conferidas pelos componentes e o método de preparo, confere boa resistência à força gravitacional e é capaz de prevenir fenômenos de instabilidade, como floculação e cremeação (TADROS et al., 2004).
Nanoemulsões podem ser aplicadas em várias áreas, como nas indústrias cosméticas, de alimentos e farmacêuticas. Muitos estudos têm avaliado os possíveis usos desse tipo de formulação para a encapsulação de fármacos, assim como para liberação controlada dos mesmos no organismo humano (TADROS, 1994; KOROLEVA e YURTOV, 2012;CARNEIRO, 2013; SANTANA et al., 2013).
23 3. OBJETIVO GERAL
Desenvolver e avaliar nanoemulsões com extrato etanólico bruto das folhas de
Melaleuca leucadendron e cloridrato de pilocarpina para o uso potencial como radioprotetor tópico.
3.1. OBJETIVOS ESPECÍFICOS
Obter extrato etanólico bruto (EEB) das folhas da espécie Melaleuca leucadendron e determinar as principais classes de metabólitos secundários presentes no mesmo.
Quantificar compostos fenólicos presentes no extrato obtido.
Avaliar a capacidade antioxidante in vitro do EEB das folhas de Melaleuca leucadendron, do cloridrato de pilocarpina e do óleo de girassol, por DPPH e ABTS.
Desenvolver nanoemulsões utilizando óleo de girassol e incorporar o extrato de
Melaleuca leucadendron e o cloridrato de pilocarpina nas mesmas. Caracterizar e estudar a estabilidade das nanoemulsões obtidas.
25 4. MATERIAL E MÉTODOS
4.1. Materiais
4.1.1. Material Botânico
As folhas de Melaleuca leucadendron foram coletadas no campus da Universidade Federal de Ouro Preto, situada no município de Ouro Preto, Minas Gerais, no ano de 2012.
Foram retirados fragmentos de caules, de partes infectadas por fungos (manchas pretas e/ou brancas) e de outros materiais considerados como sujidades e em sequência as folhas foram secas em estufa com circulação de ar a 40 ºC, pulverizadas em moinho de facas e pesadas.
4.1.2. Material para o desenvolvimento das nanoemulsões
Para o desenvolvimento das nanoemulsões foram utilizados: Óleo de girassol (Liza) – óleo de grau alimentício;
Span 80® (Croda) – monooleato de sorbitano (Figura 8), tensoativo com EHL de 4,3; denominado pelo CTFA como Sorbitan oleate (C24H44O6);
Figura 8: Estrutura molecular do monooleato de sorbitano Fonte: www.sigmaaldrich.com/catalog/product/sigma/s6760
26 Figura 9: Estrutura molecular do monoestearato de sorbitano
Fonte: www.sigmaaldrich.com/catalog/product/aldrich/w302805
Croduret 50 Special® (Croda) – óleo de rícino hidrogenado e etoxilado, tensoativo com EHL de 14,1; denominado pelo CTFA como PEG-40 Hydrogenated Castor Oil.
Cloridrato de pilocarpina (All Chemistry, lote ALL 50206) – princípio ativo; EEB das folhas de Melaleuca leucadendron– princípio ativo;
Água destilada recém obtida.
4.2. Obtenção do extrato
Em erlenmeyer de 5000 mL, 600 g de folhas de Melaleuca leucadendron secas fragmentadas (Figura 10A) foram maceradas com 3000 mL de álcool etílico padrão analítico (P.A). Essa maceração foi realizada por um período de seis dias.
Figura 10: Etapas do processo de obtenção do extrato etanólico bruto das folhas de Melaleuca leucadendron. A – Folhas secas pulverizadas. B – Solvente sendo eliminado
27 Inicialmente as folhas foram umedecidas com o etanol e esse solvente foi acrescentado até totalizar 1000 mL. Após 48 horas foi realizada filtração do sistema. Esse processo foi repetido por mais duas vezes, totalizando os 3000 mL de etanol utilizados na extração. O filtrado obtido foi concentrado, por eliminação do solvente, utilizando evaporador rotatório, sob pressão reduzida e mantendo-se a temperatura de aquecimento entre 40 e 50 ºC (Figura 10B).
Para uma completa eliminação do solvente, após a concentração em evaporador rotatório, o extrato foi mantido em estufa à 40 ±5 ºC por 5 dias.
4.3. Prospecção Fitoquímica
Para realizar a triagem de metabólitos secundários, o EEB das folhas de
Melaleuca leucadendron foi ressuspendido em metanol/água (9:1) e submetido à partição com clorofórmio. Os solventes das frações obtidas foram eliminados em evaporador rotativo, sob pressão reduzida e aquecimento entre 40 e 50 ºC.
Foi realizada prospecção fitoquímica por cromatografia em camada delgada (CCD). Na fração hidroalcoólica, rica em compostos mais polares, foi investigada a presença de compostos fenólicos, triterpenos, taninos, flavonóides, antranóides, cumarinas, saponinas e alcalóides. Na fração clorofórmica, rica em compostos apolares, foi avaliada a presença de esteróides.
Para realização de CCD foram utilizadas placas cromatográficas contendo uma fina camada de sílica gel 60 GF254 (Vetec®, Brasil). Esse material foi preparado depositando sílica gel/ água (1:2) sobre placas de vidro (10 x 10 cm) e armazenando essas placas em estufa (100 a 150 ºC) por no mínimo uma hora.
Utilizando tubos capilares, foram adicionadas alíquotas das frações a 1 cm da base das placas. Quando utilizados padrões, alíquotas dos mesmos foram adicionadas 3 cm à direita das amostras. Em sequência, foram realizadas eluição e revelação das cromatoplacas.
28 Também foram realizados, com a fração hidroalcoólica, ensaios de coloração ou precipitação, de acordo com o descrito por Matos (1997). Esses testes foram executados como complemento para a triagem de taninos, flavonóides e alcalóides.
4.3.1. Compostos fenólicos
Foi realizada CCD, utilizando acetato de etila/clorofórmio/água (88:6:6) como fase móvel. As placas foram reveladas com cloreto férrico (FeCl3) a 2%, avaliando a
presença de compostos fenólicos através dessa reação. O teste foi considerado positivo quando observadas manchas negro-azuladas (WAGNER e BLADT, 1996).
4.3.2. Triterpenos e esteróides
A reação de Liebermann-Burchard por CCD foi utilizada para investigar a presença dessas classes. A fase móvel foi tolueno/acetato de etila (93:7). Triterpenos foram investigados na fração hidroalcoólica e esteróides na fração clorofórmica. A observação de manchas escuras no visível ou de fluorescência no ultravioleta em 365nm (UV365nm) foi considerada como resultado positivo.
4.3.3. Taninos
Utilizando clorofórmio/ácido acético glacial/água (50:45:5) como fase móvel, foi realizada CCD. Taninos foram considerados presentes quando observadas manchas negro-azuladas ou negro-esverdeadas após revelação com cloreto férrico (FeCl3) a 2%.
Também foi realizado ensaio de precipitação. A uma alíquota da fração hidroalcoólica do extrato foi adicionado NaCl a 2% e gelatina a 1%. O surgimento de precipitado foi considerado indicativo da presença de taninos.
4.3.4. Flavonóides
A CCD foi realizada utilizando clorofórmio/acetato de etila (60:40) como eluente. Para averiguação de flavonóides foi utilizado Reagente de Produtos Naturais
29 cromatoplacas. A ocorrência de fluorescências amarelas e verdes foi caracterizada como indicativo desses metabólitos.
A presença de flavonóides também foi avaliada pela reação de Shinoda. Uma amostra da fração hidroalcoólica foi acidificada e acrescida de um pequeno fragmento de magnésio granulado. Foi considerado positivo o desenvolvimento de coloração avermelhada.
4.3.5. Antranóides e cumarinas
Foi realizada CCD utilizando tolueno/éter (1:1) saturado com ácido acético glacial a 10% como fase móvel para análise de cumarinas. Para avaliar a presença de antranóides a fase móvel utilizada foi acetato de etila/metanol/água (100:13,5:10).
O hidróxido de potássio metanólico foi o reagente de detecção. A reação foi considerada positiva nas seguintes situações: sob a luz visível, antraquinonas desenvolvem coloração vermelha; sob a luz UV365nm, antronas desenvolvem coloração
amarela e cumarinas ficam azuis.
4.3.6. Saponinas
Na determinação de saponinas foi utilizado clorofórmio/metanol/água (70:30:4) como fase móvel e reagente anisaldeído/ácido sulfúrico como revelador das cromatoplacas. A placa foi aspergida e aquecida a 105 ºC por 10 minutos. O surgimento de manchas azuis ou azul-violeta indica a presença dessa classe de metabólitos.
4.3.7. Alcalóides
A fase móvel utilizada na CCD foi acetato de etila/metanol/água (100:13,5:10). Para analisar a presença de alcalóides foi observado o aparecimento de manchas marrons ou alaranjadas em cromatoplaca revelada com reagente de Dragendorff.
4.4. Determinação do teor de fenóis totais
30 fosfomolibídico e fosfotunguístico, no qual o molibdênio e o tungstênio encontram-se num estado de oxidação que em presença de certos agentes redutores, como os compostos fenólicos, originam os chamados molibdênio azul e tungstênio azul, cuja coloração permite a determinação da concentração das substâncias redutoras.
A determinação foi realizada de acordo com o descrito por Michel et al. (2011), utilizando uma solução do extrato em metanol na concentração de 3 mg/mL e uma curva de ácido gálico nas concentrações de 10 a 250 µg/mL. Em tubos de ensaio foram misturados 100 µL de reagente de Folin-Ciocalteu e 20 µL da solução do extrato ou 20 µL das concentrações 10, 50, 75, 100, 150, 200 e 250 µg/mL de ácido gálico ou 20 µL de água destilada, definida como branco. Após 1 minuto de agitação, foram acrescentados a cada tubo 300 µL de solução aquosa de carbonato de sódio a 20%. Um volume final de 2 mL foi completado com água destilada e a mistura foi incubada à temperatura ambiente por 2 horas.
O experimento foi desenvolvido em triplicata e a leitura das absorbâncias foi realizada a 760 nm em Espectrofotômetro ultravioleta-visível (UV-vis) Helios α
Thermo Electron Corporation. Foi elaborada uma curva de calibração com as absorbâncias médias das concentrações do padrão ácido gálico. O teor de fenóis totais foi determinado pela interpolação da média das absorbâncias da amostra através da equação linear originada da curva e foi expresso em mg equivalentes de ácido gálico (EAG) por grama de extrato.
4.5. Avaliação da capacidade antioxidante in vitro
A determinação da capacidade antioxidante do EEB das folhas de Melaleuca leucadendron, do cloridrato de pilocarpina e do óleo de girassol foi realizada por dois métodos de redução de radicais livres.
4.5.1. Método de redução do radical DPPH
31 soluções etanólicas nas concentrações 0,5; 1; 2,5 e 5 mg/mL e para o óleo de girassol soluções em acetona nas concentrações 2,5; 5; 7,5 e 10 mg/ mL.
Em tubos com 2,5 mL das variadas concentrações das amostras ou com 2,5 mL de etanol puro, utilizado como controle negativo, foram acrescentados 1 mL de solução etanólica de DPPH (Sigma-Aldrich) 0,004% m/v. Para o branco, à 2,5 mL das diferentes concentrações, foram acrescentados 1 mL de etanol puro. Após 30 e 60 minutos, de incubação à temperatura ambiente e ao abrigo da luz, foi efetuada a leitura das absorbâncias a 517 nm em Espectrofotômetro UV-vis Helios α Thermo Electron
Corporation.
As absorbâncias das amostras, após descontar o respectivo branco, foram utilizadas para calcular o percentual de inibição do radical livre DPPH (%IDPPH), com base na seguinte fórmula:
% IDPPH = [(CN-AM)/CN] x 100, onde: IDPPH = inibição do DPPH;
CN = absorbância do controle negativo e
AM = absorbância da amostra descontada a absorbância do branco.
O experimento foi realizado em triplicata e com os valores médios foi elaborada uma curva de inibição para o EEB, uma para o cloridrato de pilocarpina e uma para o óleo. Com base nas equações lineares obtidas para cada curva foi calculada a concentração das amostras que provocou 50% de inibição do DPPH (CE50), sendo os
valores expressos como média ± desvio padrão.
4.5.2. Método de redução do radical ABTS liofilizado
O radical catiônico ABTS foi produzido de acordo com o descrito por Re et al. (1999), para isso uma solução aquosa a 7 mM do ABTS (Sigma-Aldrich) com 2,75 mM de persulfato de potássio foi preparada. Essa solução foi deixada em repouso ao abrigo da luz e à temperatura ambiente por 16 horas.