UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE MEDICINA
DEPARTAMENTO DE SAÚDE COMUNITÁRIA
PROGRAMA DE PÓS-GRADUAÇÃO EM SAÚDE COLETIVA
MESTRADO EM SAÚDE PÚBLICA
FRANCISCO ROGERLÂNDIO MARTINS DE MELO
EPIDEMIOLOGIA E DISTRIBUIÇÃO ESPACIAL DA MORTALIDADE
RELACIONADA À DOENÇA DE CHAGAS NO BRASIL, 1999 A 2007
FRANCISCO ROGERLÂNDIO MARTINS DE MELO
EPIDEMIOLOGIA E DISTRIBUIÇÃO ESPACIAL DA MORTALIDADE
RELACIONADA À DOENÇA DE CHAGAS NO BRASIL, 1999 A 2007
Dissertação apresentada ao programa de Pós-Graduação em Saúde Coletiva do Departamento de Saúde Comunitária da Universidade Federal do Ceará, como requisito parcial para obtenção do título de Mestre em Saúde Pública.
Área de concentração: Saúde Coletiva (Epidemiologia das Doenças Transmissíveis e Não Transmissíveis).
Orientador: Prof. Dr. Jorg Heukelbach
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências da Saúde
___________________________________________________________________________
M485e Melo, Francisco Rogerlândio Martins de
Epidemiologia e distribuição espacial da mortalidade relacionada à doença de Chagas no Brasil, 1999 a 2007. – 2011.
259 f.; il. Color.
Dissertação (Mestrado) – Universidade Federal do Ceará, Faculdade de Medicina, Departamento de Saúde Comunitária, Programa de Pós-Graduação em Saúde Coletiva, Fortaleza, 2011.
Área de Concentração: Saúde Coletiva (Epidemiologia das Doenças Transmissíveis e Não Transmissíveis)
Orientador: Prof. Dr. Jorg Heukelbach.
1. Doença de Chagas-mortalidade. 2. Doença de Chagas-epidemiologia. 3. Estudos de séries temporais. 4. Distribuição espacial da população. I. Título
CDD: 616.9363
FRANCISCO ROGERLÂNDIO MARTINS DE MELO
EPIDEMIOLOGIA E DISTRIBUIÇÃO ESPACIAL DA MORTALIDADE
RELACIONADA À DOENÇA DE CHAGAS NO BRASIL, 1999 A 2007
Dissertação submetida ao programa de Pós-Graduação em Saúde Coletiva do Departamento de Saúde Comunitária da Universidade Federal do Ceará, como requisito parcial para obtenção do título de Mestre em Saúde Pública. Área de concentração Saúde Coletiva (Epidemiologia das Doenças Transmissíveis e Não Transmissíveis).
Aprovada em:____/____/______
BANCA EXAMINADORA
_____________________________________________________ Profº. Dr. Jörg Heukelbach (Orientador)
Universidade Federal do Ceará (UFC)
_____________________________________________________ Profº. Dr. Adauto José Gonçalves de Araújo
Escola Nacional de Saúde Pública (FIOCRUZ)
_____________________________________________________ Profº. Dr. Luciano Pamplona de Góes Cavalcanti
Universidade Federal do Ceará (UFC)
_____________________________________________________ Profª. Dra. Terezinha do Menino Jesus S. Leitão
Aos meus pais, Ana e Raimundo (in memoriam), pela contribuição moral e o caráter da formação pessoal.
Aos meus irmãos, Rosiel, Rogério, Renato e Carina.
AGRADECIMENTOS
De maneira especial, ao meu orientador Dr. Jörg Heukelbach, por ter acreditado na minha capacidade e pela confiança em mim depositada. Agradeço por todo apoio durante o mestrado, pela compreensão, incentivo, dedicação e, sobretudo, paciência, por entender minhas dúvidas e inquietudes, pelo exemplo de vida e superação. Obrigado pelo interesse demostrado, pelo apoio científico, disponibilidade para leituras e discussões, além das sugestões e criticas que foram relevantes para a construção desse trabalho.
A meus pais, por me conduzirem pelo caminho da compreensão, do diálogo e do respeito ao próximo. Meu pai Raimundo, in memoriam, hoje estaria compartilhando toda a sua alegria por eu ter cumprido mais uma etapa de minha vida. A minha mãe Ana, palavra obrigado não seria suficiente para traduzir a minha gratidão por todo apoio, carinho e amor. Ela é a razão de tudo isto, pelo incentivo que sempre me proporcionou. Aos meus irmãos Rogério, Rosiel Renato e Carina pelo apoio dispensado e por me fazerem acreditar que a Educação é a melhor maneira para reduzir as desigualdades sociais e o caminho para um futuro melhor para o Brasil. Essa conquista é para vocês!
À Coordenação do Programa de Pós-Graduação em Saúde Coletiva da UFC, pela oportunidade oferecida.
Ao corpo docente do Curso de Pós-Graduação do Mestrado em Saúde Pública da Universidade Federal do Ceará, pelos subsídios teórico-metodológicos e pela colaboração intelectual que me ajudaram nessa caminhada.
À banca de qualificação, composta pelos professores Fernando Schemelzer e Carlos Henrique, pelas valiosas sugestões que contribuíram para o resultado final desta dissertação de mestrado.
Aos membros da banca examinadora da defesa da dissertação, que gentilmente aceitaram o convite de participação e pelas sólidas sugestões e contribuições para o enriquecimento deste trabalho.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico – CNPq e à Fundação Cearense de Apoio a Pesquisa – FUNCAP, que através da bolsa de estudos possibilitou o desenvolvimento desta pesquisa.
A Dominik Fontes, Zenaide Queiroz e Adriana Alencar pela disponibilidade em ajudar sempre que necessário.
A minha companheira Mauricélia, pela compressão e apoio para cursar o Mestrado, por ter permanecido ao meu lado, me incentivando a percorrer este caminho, por compartilhar angústias, dúvidas, momentos de alegria e realização. Obrigado pelo companheirismo que demonstrou não só neste período, mas como em todos os momentos de nossas vidas.
Ao professor Dr. Alberto Novaes Ramos Júnior, por sua importante colaboração intelectual na pesquisa e pelo exemplo de dedicação ao trabalho.
À professora Dra. Jaqueline Caracas pelo apoio disponibilizado durante a disciplina Estágio à docência.
Ao geógrafo Wolfram Lange, pela colaboração na análise espacial dos dados.
Aos meus colegas de turma do mestrado, que contribuíram para que este período não fosse somente de aprendizado acadêmico, mas também de divertidas e agradáveis companhias e apoio nos momentos de dificuldade.
“Um homem que ousa desperdiçar uma hora ainda não descobriu o valor da vida.”
RESUMO
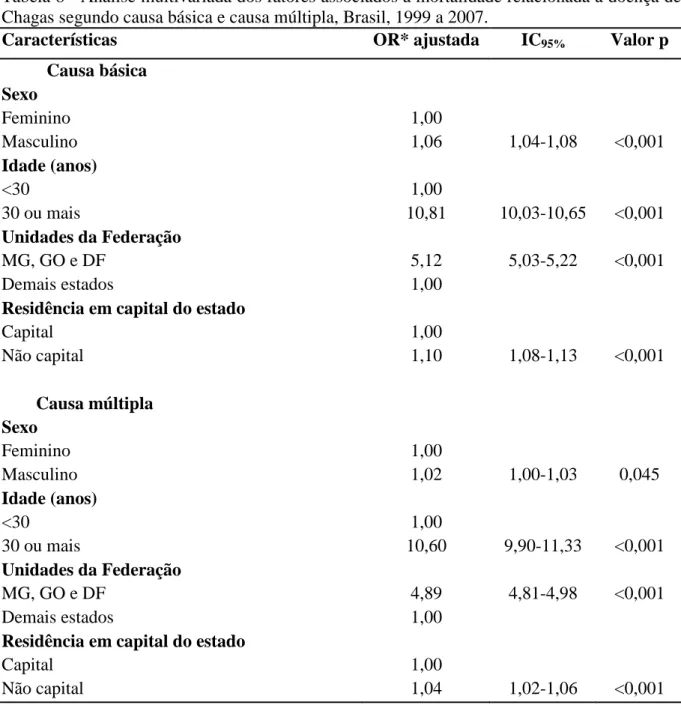
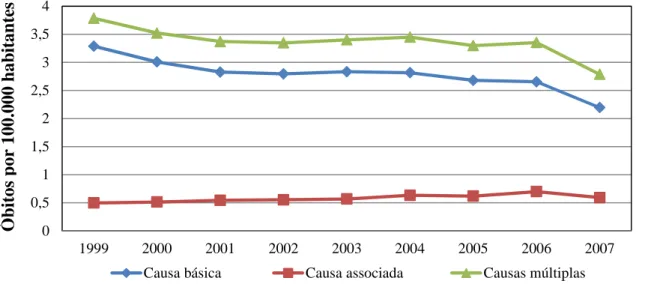
A doença de Chagas continua sendo uma Doença Tropical Negligenciada e um problema de saúde pública, com significativas implicações socioeconômicas na maioria dos países latino-americanos, incluindo o Brasil. Objetivou-se caracterizar a magnitude e os padrões da mortalidade relacionada à doença de Chagas no Brasil. Foi realizado estudo descritivo e analítico com dados de mortalidade obtidos do Sistema de Informação sobre Mortalidade do Ministério da Saúde (SIM/DATASUS/MS), além de análise espacial utilizando os municípios como unidades de observação. Foram analisados todos os óbitos ocorridos no Brasil entre 1999 e 2007, nos quais a doença de Chagas foi mencionada como causa básica ou associada de morte. Foram calculados os coeficientes de mortalidade específicos e a mortalidade proporcional para analisar as tendências temporais por meio de regressão polinomial. Investigaram-se os fatores associados ao óbito pela doença de Chagas, comparando-os com os óbitos gerais. Foram descritas as causas de morte que frequentemente se associaram com a doença de Chagas. Para análise de autocorrelação espacial foram utilizados os métodos: Moran global, Getis-Ord General G, Moran local e estatística Gi*. Entre 1999 e 2007, ocorreram 53.930 óbitos relacionados à doença de Chagas no Brasil (44.543 como causa básica e 9.387 como causa associada), com coeficiente médio de mortalidade de 3,78/100.000 habitantes e mortalidade proporcional de 0,6%. Durante o período de estudo, a mortalidade apresentou tendência de declínio a nível nacional (p=0,011), porém com padrões diferenciados entre as regiões. Observou-se redução da mortalidade nas regiões Centro-Oeste (p=0,001), Sudeste (p=0,007) e Sul (p=0,028), mas a região Nordeste apresentou tendência de crescimento (p=0,047) e a região Norte apresentou tendência de estabilidade (p=0,309). Na análise multivariada foram independentemente associados à mortalidade: idade >30 anos (OR ajustada=10,60; IC 95%: 9,90-11,33; p<0,001); residir nos estados de Minas Gerais, Goiás e Distrito Federal (OR ajustada=4,89; IC 95%: 4,81-4,98; p<0,001); não morar em capital de estado (OR ajustada=1,04; IC 95%: 1,02-1,06; p<0,001) e sexo masculino (OR ajustada=1,02; IC 95%: 1,00-1,03; p=0,045). As principais causas associadas à doença de Chagas como causa básica foram as complicações diretas do envolvimento cardíaco, como os transtornos de condução/arritmias (41,4%) e a insuficiência cardíaca (37,7%). As doenças cerebrovasculares (13,2%), isquêmicas do coração (13,2%) e hipertensivas (9,3%) foram as principais causas básicas nos óbitos em que a doença de Chagas foi causa associada. A análise espacial identificou um extenso agregado espacial (cluster) de alto risco para mortalidade relacionada à doença de Chagas envolvendo oito estados na região central do Brasil e mais quatro clusters menores. Apesar do declínio da mortalidade relacionada à doença de Chagas no Brasil, esta continua sendo uma importante causa de morte em áreas endêmicas e com marcantes diferenças regionais. Com o declínio da transmissão vetorial, as deficiências no sistema público para a prevenção, controle e tratamento da doença de Chagas, principalmente nas regiões Norte e Nordeste, precisam ser superadas. O desafio é garantir acesso adequado aos serviços de saúde e assistência social para o grande número de indivíduos com doença de Chagas na fase crônica que se acumularam durante as últimas décadas.
ABSTRACT
Chagas’ disease is a Neglected Tropical Disease and a public health problem with significant socioeconomic implications in most Latin American countries, including Brazil. This study aimed to characterize the magnitude and patterns of mortality associated with Chagas disease in Brazil. A descriptive and analytical study was performed based on mortality data obtained from the Mortality Information System of the Ministry of Health (SIM/DATASUS/MS), and a spatial analysis with municipalities as the unit of observation. We studied all deaths occurring in Brazil from 1999 to 2007, where Chagas’ disease was mentioned as underlying or associated cause of death. We calculated mortality rates and proportional mortality and described time trends, using polynomial regression. Factors associated with death from Chagas’ disease were identified, as compared to deaths by other causes. We also described causes of death frequently associated with Chagas disease. For spatial analysis we used the following methods: Global Moran, Getis-Ord General G, local Moran and Gi* statistic. Between 1999 and 2007, 53,930 deaths occurred related to Chagas disease in Brazil (44,543 as underlying cause of death, and 9.387 as associated cause), with a mean mortality of 3.78/100,000/year, and a proportional mortality of 0.6%. Mortality showed a declining trend at national level (p=0.011), but with different patterns between regions. There was a reduction of mortality in the Central West (p=0.001), Southeast (p=0.007) and South (p=0.028), whereas the Northeast showed an increasing trend (p=0.047), and the North a tendency of stabilization (p=0.309). In multivariable analysis, factors independently associated with mortality were: age >30 years (adjusted OR = 10.60; 95% CI: 9.90-11.33, p <0.001); residence in the states of Minas Gerais, Goiás and Distrito Federal (adjusted OR = 4.89; 95% CI: 4.81-4.98, p <0.001); not living in a state capital (adjusted OR = 1.04; 95% CI: 1,02-1,06; p<0,001); and male sex (adjusted OR=1.02; 95% CI: 1,00-1,03; p=0,045). The main conditions associated with Chagas disease as underlying cause of death were cardiac complications, such as conduct disorders/arrhythmias (41.4%) and heart failure (37.7%). Cerebrovascular complications (13.2%), ischemic heart disease (13.2%) and hypertensive disorders (9.3%) were the main underlying causes of death in which Chagas’ disease was an associated cause. Spatial analysis identified a major cluster of high risk for mortality related to Chagas’ disease involving eight states in the central region of Brazil, and four smaller clusters of high risk in the surrounding area. Despite the decline in mortality associated with Chagas’ disease in Brazil, the disease remains an important cause of death in endemic areas and with marked regional differences. With decreasing importance of vector-borne transmission, the deficiencies of the public system in prevention, control and treatment of Chagas disease, mainly in North and Northeast regions, remain a challenge. Adequate access to health services and social assistance need to be guaranteed for the large number of individuals with chronic Chagas’ disease that have accumulated during the last decades.
LISTA DE FIGURAS Figura 1. Figura 2 Figura 3 Figura 4 Figura 5 Figura 6 Figura 7 Figura 8 Figura 9 Figura 10 Figura 11 Figura 12 Figura 13 Figura 14 Figura 15 Figura 16 Figura 17 Figura 18 Figura 19 Figura 20 Figura 21
Trypanosoma cruzi na corrente sanguínea visto ao microscópio eletrônico . Carlos Ribeiro Justiniano das Chagas (1878-1934) ... Área de risco de transmissão vetorial da doença de Chagas ... Triatomíneos transmissores da doença de Chagas ... Sinal de Romaña (edema bipalpebral unilateral) ... Cardiopatia Chagásica Crônica ... Megaesôfago ... Megacólon Chagásico ... Distribuição dos países endêmicos para doença de Chagas ... Distribuição dos casos de infecção por T. cruzi, baseados em estimativas oficiais e status da transmissão vetorial, a nível mundial, 2006-2009 ... Rotas de migração da América Latina e estimativa do número total de pessoas infectadas em países não endêmicos ... Área de distribuição de T. infestans no Brasil ... Casos de Doença de Chagas Aguda (DCA) notificadas no Brasil ... Coeficiente de mortalidade anual por doença de Chagas/100.000 habitantes, Brasil, 1980 a 2008 ... Bloco da declaração de óbito para preenchimento das condições e causas do óbito ... Distribuição dos óbitos relacionados à doença de Chagas no banco de dados do SIM, Brasil, 1999 a 2007 ... Número de óbitos relacionados à doença de Chagas segundo faixa etária, causa múltipla, Brasil, 1999 a 2007 ... Distribuição dos óbitos por doença de Chagas como causa básica, segundo forma clínica e região, Brasil, 1999 a 2007 ... Coeficiente padronizado de mortalidade relacionada à doença de Chagas no Brasil, 1999 a 2007 ... Coeficiente padronizado de mortalidade relacionada à doença de Chagas segundo regiões, Brasil, 1999 a 2007 ... Coeficientes médios da mortalidade específica relacionados à doença de Chagas segundo unidades da federação, Brasil, 1999 a 2007 ...
Figura 22 Figura 23 Figura 24 Figura 25 Figura 26 Figura 27 Figura 28 Figura 29 Figura 30 Figura 31 Figura 32 Figura 33 Figura 34 Figura 35 Figura 36
Razão entre o total de menções e frequência da causa básica dos óbitos relacionados à doença de Chagas, Brasil, 1999 a 2007 ... Coeficiente padronizado de mortalidade relacionado à doença de Chagas segundo sexo, Brasil, 1999 a 2007 ... Razão entre homem e mulheres dos coeficientes de mortalidade relacionada à doença de Chagas, Brasil, 1999 a 2007 ... Coeficiente específico de mortalidade relacionada à doença de Chagas segundo grupos etários, Brasil, 1999 a 2007 ... Evolução da média de idade ao morrer em óbitos relacionados à doença de Chagas no Brasil, 1999 a 2007 ... Evolução da média de idade ao morrer em óbitos relacionados à doença de Chagas no Brasil, 1999 a 2007 ... Mortalidade proporcional relacionada à doença de Chagas segundo regiões, Brasil, 1999 a 2007 ... Mortalidade proporcional por doença de Chagas segundo unidades da federação, Brasil, 1999 a 2007 ... Mortalidade proporcional por doença de Chagas em relação aos óbitos por doenças infecciosas e parasitárias (DIP), Brasil, 1999 a 2007 ... Mortalidade proporcional por doença de Chagas em relação aos óbitos por DIP segundo regiões, Brasil, 1999 a 2007 ... Mortalidade proporcional por doença de Chagas em relação à mortalidade por DIP segundo UF de residência, Brasil, 1999 a 2007 ... Municípios com pelo menos um óbito relacionado à doença de Chagas registrados segundo causa básica (A) e múltipla de morte (B), Brasil, 1999 a 2007 ... Distribuição espacial dos coeficientes de mortalidade relacionada à doença de Chagas (por 100 mil habitantes) segundo causa básica de morte por municípios, Brasil, 1999 a 2007... Distribuição espacial dos coeficientes de mortalidade relacionada à doença de Chagas (por 100 mil habitantes) segundo causas múltiplas de morte por municípios, Brasil, 1999 a 2007 ... Moran Map dos coeficientes de mortalidade relacionada à doença de Chagas segundo causa básica por município, Brasil, 1999 a 2007 ...
Figura 37
Figura 38
Figura 39
Figura 40
Moran Map dos coeficientes de mortalidade relacionada à doença de Chagas segundo causa múltipla por município, Brasil, 1999 a 2007 ... Índices Gi* classificados por desvios padrões em relação à média dos coeficientes de mortalidade relacionada à doença de Chagas segundo causa básica por municípios, Brasil, 1999 a 2007 ... Índices Gi* classificados por desvios padrões em relação à média dos coeficientes de mortalidade relacionada à doença de Chagas segundo causa múltipla por municípios, Brasil, 1999 a 2007 ... Relação entre os coeficientes médios de mortalidade relacionada à doença de Chagas (A) e detecção de aglomerados (clusters) de alto risco para mortalidade relacionada doença de Chagas (B e C) no Brasil, entre 1999 e 2007, proporção de soropositivos por município no inquérito sorológico nacional-1975 a 1980 (D), áreas de alto risco para transmissão vetorial e dispersão das principais espécies de triatomíneos, segundo inquérito triatomínico no Brasil, 1975-1983 (E a J) ...
103
105
106
LISTA DE TABELAS Tabela 1 Tabela 2 Tabela 3 Tabela 4 Tabela 5 Tabela 6 Tabela 7 Tabela 8 Tabela 9 Tabela 10 Tabela 11 Tabela 12 Tabela 13
Alterações em parâmetros epidemiológicos selecionados após implementação das medidas de controle na América Latina, 1990 a 2006 Casos de DCA por tipo de transmissão no Brasil, 2005 a 2010 ... Casos de DCA notificados com sua respectiva letalidade, segundo Unidade da Federação (UF), Brasil, 2005 a 2010 ... Descrição das variáveis utilizadas no estudo obtidas a partir das informações disponiveis na declaração e as recodificadas para análise, Brasil, 1999-2007 ... Caracterização epidemiológica dos óbitos relacionados à doença de Chagas segundo causas básicas, associadas e múltiplas de morte, Brasil, 1999 a 2007 ... Caracterização epidemiológica dos óbitos relacionados à doença de Chagas segundo causas básicas, associadas e múltiplas de morte, Brasil, 1999 a 2007 ... Análise bivariada dos fatores associados à mortalidade relacionada à doença de Chagas como causa múltipla, Brasil, 1999 a 2007 ... Análise multivariada dos fatores associados à mortalidade relacionada à doença de Chagas segundo causa básica e causa múltipla, Brasil, 1999 a 2007 ... Análise das tendências dos coeficientes padronizados de mortalidade relacionada à doença de Chagas no Brasil e regiões, 1999 a 2007 ... Análise das tendências dos coeficientes de mortalidade relacionados à doença de Chagas segundo sexo e razão entre sexos, Brasil, 1999-2007. Análise das tendências dos coeficientes de mortalidade relacionada à doença de Chagas segundo faixa etária e idade média ao morrer, Brasil, 1999 a 2007 ... Análise das tendências da mortalidade proporcional relacionada à doença de Chagas no Brasil e regiões, 1999 a 2007 ... Análise das tendências da mortalidade proporcional por doença de Chagas em relação aos óbitos por doenças infecciosas e parasitárias (DIP) no Brasil e regiões, 1999 a 2007 ...
Tabela 14
Tabela 15
Tabela 16
Tabela 17
Tabela 18
Causas associadas de morte nos óbitos de doença de Chagas como causa básica, Brasil, 1999 a 2007 ... Causas básicas de morte em declarações de óbito com doença de Chagas como causa associada, Brasil, 1999 a 2007 ... Distribuição dos municípios com maiores coeficientes de mortalidade* relacionada à doença de Chagas segundo causa básica e causa múltipla de morte, Brasil, 1999 a 2007 ... Índice Global de Moran para os coeficientes médios de mortalidade relacionados à doença de Chagas e seus níveis de significância, segundo causa básica e causa múltipla, Brasil, 1999 a 2007 ... Índice Getis-Ord para os coeficientes médios de mortalidade relacionados à doença de Chagas e seus níveis de significância, segundo causa básica e causa múltipla, Brasil, 1999 a 2007 ...
91
93
99
101
LISTA DE ABREVIATURAS E SIGLAS
AIDS Síndrome da Imunodeficiência Adquirida/Acquired Immune Deficiency Syndrome
AVAI/DALY Anos de Vida Ajustados para Incapacidade/Disability-Adjusted Life Years
CCC Cardiopatia Chagásica Crônica
CID Classificação Internacional de Doenças
DATASUS Departamento de Informática do Sistema Único de Saúde
DC Doença de Chagas
DCA Doença de Chagas Aguda
DF Distrito Federal
DIP Doenças Infecciosas e Parasitárias DO Declaração de Óbito
DSC Departamento de Saúde Comunitária
GNChE Rede Global para Eliminação da Doença de Chagas/Global Network for Chagas Elimination
GO Goiás
HIV Vírus da Imunodeficiência Humana/Human Immunodeficiency Virus IBGE Instituto Brasileiro de Geografia e Estatística
IC Intervalo de Confiança
MG Minas Gerais
MS Ministério da Saúde
OR Razão de Chances/Odds Ratio
OMS/WHO Organização Mundial da Saúde/World Health Organization
OPAS/PAHO Organização Pan-Americana da Saúde/ Pan American Health Organization
RR Risco Relativo
SIG Sistema de Informações Geográficas SIM Sistema de Informação sobre Mortalidade
SINAN Sistema de Informação de Agravos de Notificação SNA Sistema Nervoso Autônomo
SNC Sistema Nervoso Central
SNP Sistema Nervoso Periférico SUS Sistema Único de Saúde
SVS Secretaria de Vigilância em Saúde
UF Unidade da Federação
UFC Universidade Federal do Ceará
SUMÁRIO 1 1.1 1.2 1.3 1.3.1 1.3.2 1.3.3 1.4 1.5 1.6 1.7 1.7.1 1.7.2 1.8 2 3 3.1 3.2 4 4.1 4.2 4.3 4.4 4.5 5 5.1 5.2 5.3 5.3.1 5.3.2 5.3.3 INTRODUÇÃO ...
Aspectos gerais ...
Mecanismos de transmissão da doença de Chagas ...
Doença de Chagas como síndrome clínica ...
Fisiopatologia ... História natural da doença ... Tratamento ... Contexto epidemiológico e distribuição geográfica da doença de Chagas ...
Cenário epidemiológico da doença de Chagas no Brasil ...
Mortalidade causada pela doença de Chagas ...
Utilização de dados de mortalidade em estudos epidemiológicos ...
Declaração de óbito e Sistema de Informação sobre Mortalidade ... Causa básica e causas múltiplas de morte ... Análise de dados espaciais em saúde pública ...
JUSTIFICATIVA ...
OBJETIVOS ...
Geral ...
Específicos ...
MATERIAL E MÉTODOS ...
Tipo e período de estudo ...
População do estudo ...
Fonte de dados ...
Processamento e análise dos dados ...
Aspectos éticos ...
RESULTADOS ...
Perfil dos óbitos relacionados à doença de Chagas ...
Fatores associados à mortalidade relacionada à doença de Chagas ...
Indicadores de mortalidade relacionados à doença de Chagas ...
Coeficientes de mortalidades gerais ... Coeficientes de mortalidade segundo características demográficas ... Mortalidade proporcional relacionada à doença de Chagas ...
5.4
5.5
5.6
5.7
6
6.1
6.2
6.3
6.4
6.5
7
Doenças e agravos associados com a doença de Chagas como causa básica
de morte ...
Causas básicas de morte nos óbitos com a doença de Chagas como causa
associada ...
Distribuição espacial dos óbitos relacionados à doença de Chagas ...
Identificação de aglomerados espaciais de alto risco para mortalidade
relacionada à doença de Chagas ...
DISCUSSÃO ...
Perfil epidemiológico, determinantes e fatores associados à mortalidade
relacionada à doença de Chagas ...
Tendência temporal da mortalidade relacionada à doença de Chagas ...
Causas múltiplas de morte relacionadas à doença de Chagas ...
Padrões espaciais da mortalidade relacionada à doença de Chagas ...
Limitações do estudo ...
CONCLUSÕES ...
REFERÊNCIAS ...
APÊNDICES ...
ANEXOS ... 91
93 94
100 109
1 INTRODUÇÃO
1.1 Aspectos gerais
A doença de Chagas ou tripanossomíase americana é uma parasitose causada por um protozoário flagelado, Trypanosoma cruzi (Figura 1), de natureza endêmica e evolução essencialmente crônica (BRASIL, 2009b). Embora a descrição da doença de Chagas, juntamente com seu agente causador por Carlos Chagas (Figura 2) seja uma descoberta relativamente recente (CHAGAS, 1909), ela já existia nas Américas há milhões de anos como uma infecção silvestre (DIAS; COURA, 1997; COURA, 2007; DIAS, 2009; COURA; BORGES-PEREIRA, 2010; COURA; VIÑAS, 2010). Quando o homem invadiu os ecótopos naturais da infecção, esta começou a ser transmitida na forma de antropozoonose (COURA, 2007; COURA; BORGES-PEREIRA, 2010; COURA; VIÑAS, 2010). Estudos paleoparasitológicos encontraram a infecção por T. cruzi em múmias pré-colombianas no norte do Chile e sul do Peru, com datações de 9.000 anos atrás (AUFDERHEIDE et al., 2004), e no cerrado brasileiro, com 7.000 anos (LIMA et al., 2007), indicando que a doença de Chagas já afligia a população do continente americano há milhares de anos.
Figura 1- Trypanosoma cruzi na corrente sangüínea visto ao microscópio eletrônico. Fonte: Fundação Oswaldo Cruz.
(http://www.ioc.fiocruz.br/pages/informerede/corpo/informeemail/230206/mat_01.htm).
2007; COURA; BORGES-PEREIRA, 2010).
Figura 2- Carlos Ribeiro Justiniano das Chagas (1878-1934). Fonte: Fundação Oswaldo Cruz.
(http://www.fiocruz.br/chagas/cgi/cgilua.exe/sys/start.htm?sid=33).
Podemos considerá-la como um exemplo típico de processo infeccioso resultante das alterações produzidas pelo homem ao ambiente e das distorções econômicas e sociais, oferecendo ao vetor, moradias rurais de péssima qualidade, frutos de perversas relações de produção e de políticas sociais excludentes (DIAS; COURA, 1997).
A doença de Chagas é considerada uma doença negligenciada, afetando principalmente populações pobres e marginalizadas (SCHMUNIS, 2007; DIAS et al., 2008). Está intimamente relacionada à pobreza humana, à instabilidade dos programas de controle, à falta de prioridade política e à ausência de conhecimentos técnicos (SCHMUNIS, 2007; DIAS, 2009), gerando um ciclo vicioso, em que a pobreza é determinante social da doença e a doença gera ainda mais pobreza (GADELHA; ARAÚJO-JORGE, 2009).
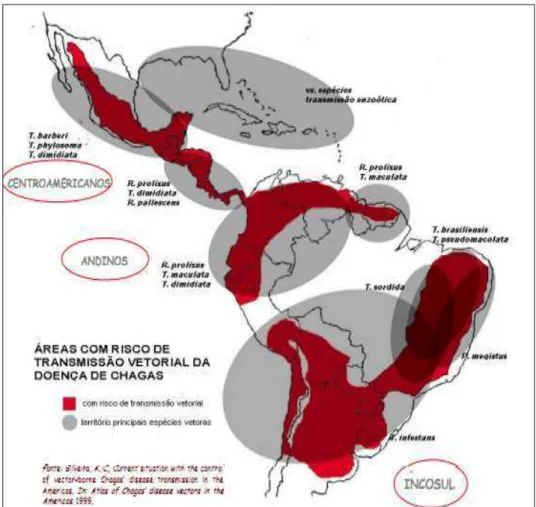
Figura 3- Área de risco de transmissão vetorial da doença de Chagas (SILVEIRA et al., 2002).
2002; DIAS; SILVEIRA; SCHOFIELD, 2002; PIRARD et al., 2005; DIAS, 2009), foram responsáveis pela diminuição da transmissão da doença nas últimas décadas.
Embora originária da América Latina, muitos casos da doença ocorrem em outros continentes devido à migração de indivíduos infectados para países não endêmicos (COURA; DIAS, 2009). O processo de globalização tem afetado tanto o perfil epidemiológico da doença de Chagas, como as perspectivas de controle e manejo (DIAS, 2007; SCHMUNIS, 2007). Mediante crescente mobilidade das populações e intensa migração, a doença se urbanizou em grande velocidade e indivíduos infectados se dispersaram para áreas não endêmicas, levando risco de transmissão por transfusão sanguínea, transplante de órgãos e de forma congênita entre os migrantes (SCHMUNIS, 2007; MONCAYO; SILVEIRA, 2009).
1.2 Mecanismos de transmissão da doença de Chagas
Os mecanismos da transmissão da doença podem ser resumidos, por ordem de maior importância epidemiológica, nas seguintes formas (BRASIL, 2005b; RAMOS Jr. et al., 2007; COURA, 2007; BRASIL, 2009b).
Principais mecanismos:
• Via vetorial (triatomíneos): É a principal via de infecção por T. cruzi, correspondendo de 70% a 90% dos casos da doença de Chagas. A transmissão vetorial acontece pela passagem do protozoário das excretas dos triatomíneos vetores (Figura 4) através da pele lesada ou de mucosas do ser humano, durante ou logo após o repasto sanguíneo (BRASIL, 2010c). Esses, ao picarem os vertebrados, em geral defecam após o repasto, eliminando formas infectantes de tripomastigotas metacíclicos, que penetram pelo orifício da picada ou por solução de continuidade deixada pelo ato de coçar (BRASIL, 2005b; BRASIL, 2009b). Das 140 espécies de triatomíneos conhecidos atualmente, 69 foram identificados no Brasil (BRASIL, 2009b). Uma diversidade destas espécies foram encontradas infectadas. Com a interrupção da transmissão vetorial por Triatoma infestans no País, outras espécies de triatomíneos têm especial importância na transmissão da doença ao homem: Triatoma brasiliensis, Panstrongylus megistus, Triatoma pseudomaculata e Triatoma sordida (BRASIL, 2005b; BRASIL, 2009b; BRASIL, 2010c). A transmissão está relacionada às características próprias dos vetores, às baixas condições sociais e a ação desordenada do homem sobre o ambiente (ARAS, 2003b).
Figura 4 - Triatomíneos transmissores da doença de Chagas.
Fonte: (
http://oqueitacaretem.blogspot.com/2008/10/entre-barbeiros-dengue-escorpies-na.html).
• Via vertical (através da placenta ou canal do parto): corresponde em média a 1%, variando em algumas séries de 0,5 a 18,5%, na dependência de fatores biológicos do parasita, hospedeiro e da área geográfica estudada (DIAS; AMATO NETO, 2011). Destes podemos citar, a associação do baixo peso e prematuridade nos recém-nascidos infectados, relação da infecção congênita com alta carga parasitária das mães e uma resposta imunológica periférica deficiente, além do período de infecção da mãe durante a gestação (MORRETI et al., 2005).
• Via oral (alimentos contaminados): a transmissão da doença de Chagas por via oral é considerada mecanismo primário, principalmente no ciclo silvestre da tripanossomíase americana (DIAS; AMATO NETO, 2011). Existem relatos desde a primeira metade do século XX, de surtos de doença aguda causada por transmissão oral por meio da ingestão de alimentos contaminados, como carne, cana de açúcar, sopas, sucos de fruta, com alta morbidade e mortalidade (PRATA, 2001; PINTO et al., 2009; OPAS, 2009). Surtos de transmissão oral foram detectados, no Pará e em outras áreas amazônicas, na Paraíba, em Santa Catarina, na Bahia e no Ceará (CAVALCANTI et al., 2009; DIAS; AMATO NETO, 2011). Nas últimas décadas, esta forma de transmissão ganhou importância epidemiológica, sendo responsável por grande parte dos casos identificados, principalmente na região Amazônica (BRASIL, 2010c). A maior visibilidade a esta modalidade de transmissão como evento emergente em saúde pública, abre espaço para ações de vigilância sanitária voltadas para o controle de exportação de sucos e outros produtos para outras regiões e para fora do país(OPAS, 2009).
• Mecanismos secundários (ou alternativos) incluem a forma acidental (acidentes de laboratório e manipulação de animais contaminados) e transplante de órgãos (COURA, 2007).
1.3Doença de Chagas como síndrome clínica
1.3.1 Fisiopatologia
envolvidos mecanismos do hospedeiro (constituição genética, reações imunológicas, etc.) e do protozoário (ação lesiva, polimorfismo, tropismo celular, etc.), todos inter-relacionados durante o curso da infecção (DIAS; MACEDO, 2005; SIQUEIRA-BATISTA; MORAES; HANH, 2007).
Os parasitos depositados em feridas na pele ou mucosa estimulam uma reação inflamatória local (chagoma de inoculação ou sinal de Romaña), com uma resposta linforreticular (COURA, 2007). Instalada a infecção, T. cruzi permanece alojado no interior de células do sistema mononuclear fagocitário por alguns dias, até chegar à circulação e se disseminar pelo organismo (SIQUEIRA-BATISTA; MORAES; HANH, 2007). Os tripomastigotas circulantes envoltos pelos macrófagos são levados para fígado, gânglios linfonodos, baço, sistema nervoso central e músculos esqueléticos e cardíacos, para formarem pseudocistos de amastigotas. Com a ruptura dos pseudocistos no miocárdio ou plexos miontéricos, ocorre miocardite aguda mediada por linfócitos T CD4+ e T CD8+ (DIAS; MACEDO, 2005; COURA, 2007).
A interação homem/T. cruzi induz os seguintes processos patológicos básicos (DIAS; MACEDO, 2005; SIQUEIRA-BATISTA; MORAES; HANH, 2007):
• Resposta inflamatória: caracterizada na fase aguda, por fenômenos vasculares, exsudativos e necrótico-degenerativos (com participação celular prioritária de macrófagos e linfócitos) e, na fase crônica, com predomínio de infiltrado linfoplasmocitário;
• Lesão celular: com ampla variação da intensidade, desde mínimas alterações até ocorrência de necrose extensa, provocadas tanto pela ação direta do T. cruzi quanto por respostas do hospedeiro mantidas por linfócitos T CD4+ e T CD8+;
• Fibrose: elemento que se inicia já na fase aguda, mas que se instala tardiamente na evolução da doença, caracterizado pela neoformação colágena, pouco vascularizada e de muito difícil regressão.
Estes processos podem ocorrer em vários órgãos e tecidos humanos, aparecendo com maior frequência e intensidade no coração, tubo digestivo e sistema nervoso (DIAS; MACEDO, 2005), ocasionando miocardiopatia dilatada crônica, morte súbita, arritmias, disfagia, megaesôfago, megacólon e meningoencefalite (COURA, 2007).
1.3.2 História natural da doença
• Fase aguda: predomina a parasitemia em quantidade expressiva. É caracterizada por dois grupos principais, a doença de Chagas aguda (DCA) inaparente, sem manifestações clínicas exuberantes (maioria dos casos), e DCA aparente, com os característicos sinais de porta de entrada, chagoma de inoculação e/ou sinal de Romaña (Figura 5), que são observados apenas nos casos consequentes à transmissão vetorial (GOMES et al, 2007). O quadro da DCA é composto por achados como febre (pouco elevada), mal-estar geral, cefaleia, astenia, hiporexia, linfadenomegalia, edema, hepatoesplenomegalia e as manifestações de miocardite e meningoencefalite em casos graves (BRASIL, 2005b; COURA, 2007; GOMES et al., 2007). Manifestações digestivas (diarreia, vômito e epigastralgia) são comuns em casos de transmissão oral, bem como relatos de icterícia e manifestações digestivas hemorrágicas (BRASIL, 2010c). As manifestações de doença febril podem persistir por até 12 semanas. Nesta fase, os sinais e sintomas podem desaparecer espontaneamente, evoluindo para a fase crônica ou progredir para formas agudas graves, que podem levar ao óbito (BRASIL, 2009b). O prognóstico da DCA depende da idade do paciente e da gravidade e localização das lesões (COURA, 2007). Geralmente tem curso benigno (letalidade entre 1% e 13,5%), com desaparecimento dos sintomas em 30 a 90 dias. Os casos mais graves estão relacionados à ocorrência em crianças menores de dois anos e quase sempre fatal nos pacientes com miocardite intensa e nas formas meningoencefálicas (DIAS; MACEDO, 2005; COURA, 2007; GOMES et al., 2007).
Figura 5 - Sinal de Romaña (edema bipapelbral unilateral) (MELO; GRECO, 2009).
• Forma indeterminada: é caracterizada pelo paciente assintomático e sem sinais de comprometimento cardíaco (clínica, eletrocardiograma e radiografia de tórax normais) e do aparelho digestivo (avaliação clínica e radiológica normal do esôfago e cólon) (BRASIL, 2009b). Apesar de serem assintomáticos, esses pacientes apresentam reações positivas para a infecção por T. cruzi. A forma indeterminada pode variar de 40 a 90% dos casos, dependendo da área geográfica (COURA et al., 1999; COURA, 2007; COURA; BORGES-PEREIRA, 2010c). O quadro assintomático pode perdurar por toda a vida da pessoa infectada ou pode evoluir tardiamente (anos ou décadas) para a forma cardíaca e/ou digestiva (megaesófago ou megacólon) (BRASIL, 2009b). Cerca de 20 a 30% dos indivíduos na forma indeterminada irão desenvolver lesões irreversíveis no sistema nervoso autônomo do coração, esófago e cólon e no sistema nervoso periférico (MONCAYO; SILVEIRA, 2009).
Figura 6 -Cardiopatia Chagasica Crônica. Nota-se importante cardiomegalia e a presença de lesão vorticilar (aneurisma da ponta do ventrículo esquerdo) (MELO; GRECO, 2009).
• Forma digestiva: O comprometimento do trato digestivo ocorre com frequência variável, entre 3,1% e 13% conforme a região endêmica estudada. Esta forma caracteriza-se por alterações ao longo do trato digestivo, ocasionadas por lesões dos plexos nervosos (destruição neuronal simpática), com consequentes alterações da motilidade e de morfologia, ao nível de trato digestivo, sendo o megaesôfago (Figura 7) e o megacólon (Figura 8), as formas mais comuns (BRASIL, 2005b). O megaesôfago é a forma de acometimento mais precoce da doença de Chagas. Ele pode ser diagnosticado a qualquer idade, sendo mais frequente entre 20 a 40 anos e predominante no sexo masculino (GOMES et al., 2007).
Figura 7- Megaesôfago. Fonte: MEDONLINE, 1998
(http://www.medonline.com.br/med_ed/med2/raiox2.html)
DIAS, 2005; GOMES et al., 2007; BRASIL, 2009b).
Figura 8 - Megacólon Chagásico.
Fonte: (http://sites.google.com/site/tripacruzi/manifestacoes).
• Forma neural ou nervosa: caracteriza por alterações significativas no sistema nervoso central (SNC), sistema nervoso periférico (SNP) e sistema nervoso autônomo (SNA), porém seu significado clínico ainda não está completamente esclarecido (DIAS; MACEDO, 2005; GOMES et al., 2007). Tem sido observados quadros graves de meningoencefalite em pacientes imunodeprimidos (portadores de neoplasias hematológicas, usuários de drogas imunossupressoras ou co-infectados pelo HIV) (BRASIL, 2005a; DIAS; MACEDO, 2005).
• Forma congênita: Ocorre em crianças nascidas de mães com exame positivo para T. cruzi. Pode passar despercebida em mais de 60% dos casos. Em sintomáticos, pode ocorrer prematuridade, baixo peso, hepatoesplenomegalia e febre. Menigoencefalite costuma ser fatal (BRASIL, 2010c). Para confirmação de caso, é necessário identificar os parasitos no sangue do recém-nascido ou sorologia positiva após os seis meses de idade (BRASIL, 2005b). Existem diferenças regionais na gravidade e natureza da infecção crônica (MONCAYO; SILVEIRA, 2009). A cardiopatia chagásica crônica (CCC) se apresenta na forma mais tardia na população argentina do que na brasileira (GOMES et al., 2007), enquanto a prevalência da forma digestiva é maior no Brasil do que em outros países latino-americanos, sendo os países da América Central com menores ocorrências de acometimento digestivo (GOMES et al., 2007; MONCAYO; SILVEIRA, 2009).
imunodepressão, como neoplasias hematogênicas e uso de drogas imunossupressoras (BRASIL, 2010c). A frequência dessa reativação não é totalmente conhecida, havendo diferentes descrições na literatura (BRASIL, 2007). Estima-se que ocorra em aproximadamente 20% dos co-infectados (FREITAS, 2009). Os quadros de reativação são de graves, e quase sempre incluem o comprometimento do Sistema Nervoso Central - SNC (meningoencefalite) e do coração (miocardite) (DIAS; MACEDO, 2007; BRASIL, 2007; GOMES et al., 2007), em 79% e 25% dos casos, respectivamente (RIVERA; HILLIS; LEVINE, 2004). A reativação da doença de Chagas tem sido associada à alta mortalidade, e muitos pacientes vão a óbito antes ou durante a terapia (RIVERA; HILLIS; LEVINE, 2004; SARTORI et al., 2007; FREITAS, 2009).
A revisão da definição de caso de Aids no Brasil, realizada em 2004 incluiu a reativação da doença de Chagas, expressa clinicamente por meio de miocardite e/ou meningoencefalite, na lista de doenças definidoras de Aids (RAMOS Jr., 2004; BRASIL, 2007). Para estruturar uma resposta organizada, o Brasil desenvolve desde 2006 um movimento para constituição de uma Rede Nacional de Atenção e Estudos em Co-Infecção T. cruzi/HIV que atualmente envolve cooperação com outros países, como a Argentina e a Espanha (RAMOS Jr. et al., 2010).
1.3.3 Tratamento
Existem apenas dois fármacoss com ação comprovada para o tratamento específico da doença de Chagas: nifurtimox e benzonidazol (BRASIL, 2005b; DIAS; MACEDO, 2005; COURA, 2007; QUINTAS et al., 2007; BRASIL, 2009b). Os dois fármacos se mostram eficazes na fase aguda, na doença congênita e nos casos raros de acidentes laboratoriais. Em crianças, bons resultados são obtidos, mesmo no inicio da fase crônica. Ambos os fármacos curam em torno de 80% dos casos agudos, porém, têm baixa atividade antiparasitária na fase crônica, visto que apenas 20% dos pacientes são curados (DIAS; MACEDO, 2005; COURA, 2007; QUINTAS et al., 2007). Assim, o grande desafio encontra-se na fase crônica plenamente estabelecida. Os fármacos estão combinados a uma série de efeitos adversos e tóxicos, à tolerância medicamentosa, à resistência de cepas de T. cruzi e ao discutível retardo da evolução da doença para condições mais críticas (QUINTAS et al., 2007).
como o cetoconazol (derivado imidazólico), fluconazol e itraconazol (derivado triazólico) e, mais recentemente, o posaconazol têm se mostrado eficaz in vitro contra T. cruzi. No entanto, os resultados experimentais e clínicos são controversos (COURA, 2007, 2009).
Novas propostas para o tratamento da doença de Chagas se baseiam na combinação de fármacos com diferentes mecanismos de ação, como no caso da Aids, tuberculose e hanseníase, que foram apenas controladas depois que foram tratadas com diferentes associações de fármacos. Essa estratégia tem como objetivo, aumentar a ação dos diferentes compostos terapêuticos evitar o desenvolvimento de resistência do parasita aos quimioterápicos (COURA, 2007, 2009).
1.4 Contexto epidemiológico e distribuição geográfica da doença de Chagas
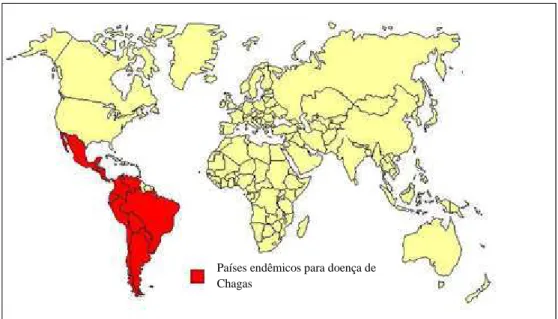
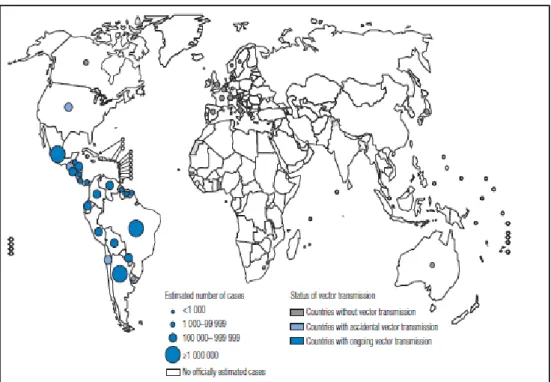
A doença de Chagas é endêmica em 22 países do continente americano (Figuras 9 e 10) (MONCAYO; SILVEIRA, 2009; COURA; VIÑAS, 2010). É a sexta doença tropical mais importante do mundo (HOTEZ et al., 2006; VILELLA et al., 2009), com impacto social elevado em toda a área endêmica (WHO, 2002; SCHMUNIS, 2007; DIAS, 2009). Estima-se que haja cerca de 15 a 18 milhões de pessoas infectadas na América Latina. Aproximadamente 100 milhões de pessoas estão em potencial risco de se tornarem infectadas (WHO, 2002; DIAS, 2007; COURA; DIAS, 2009). Sua incidência anual é estimada em 100 a 200 mil casos novos na região (WHO, 2002). Contudo, essas estimativas podem ser imprecisas e não refletem as realidades dos diferentes países da região.
Figura 9 - Distribuição dos países endêmicos para doença de Chagas (COSTA, 2009).
Figura 10 - Distribuição dos casos de infecção por T. cruzi, baseados em estimativas oficiais e status da transmissão vetorial, a nível mundial, 2006 a 2009 (WHO, 2010).
Nas últimas décadas, houve uma redução drástica do surgimento de novos casos na região endêmica. Esse declínio é o resultado de vários fatores, os mais importantes estão relacionados à redução progressiva da transmissão vetorial e transfusional (MONCAYO; SILVEIRA, 2009). Uma conquista importante neste contexto é ilustrada pelas iniciativas regionais da América Latina para a interrupção da transmissão da doença de Chagas, cujo objetivo consistiu na interrupção da transmissão por meio da eliminação de vetores domésticos e triagem de doadores de sangue (MONCAYO; SILVEIRA, 2009). Em 1991, foi lançada a Iniciativa do Cone Sul, qual incluiu os países: Argentina, Brasil, Bolívia, Chile, Paraguai e Uruguai, cobrindo uma área responsável por aproximadamente 60% da prevalência global de infecção por T. cruzi (MONCAYO; ORTIZ-YANINE, 2006). Seu modelo foi adaptado às iniciativas dos países do Pacto Andino em 1996, para América Central em 1997 e mais recentemente a Iniciativa Amazônica, em 2004 (WHO, 2002; SCHOFIELD; JANNIN; SALVATELLA, 2006; MONCAYO; SILVEIRA, 2009).
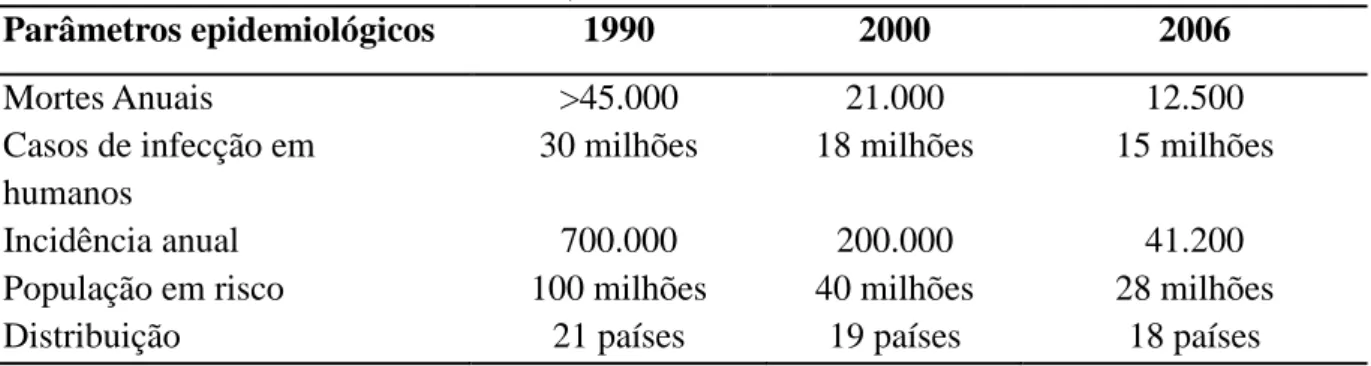
Tabela 1 - Alterações em parâmetros epidemiológicos selecionados após implementação das medidas de controle na América Latina, 1990 a 2006.
Parâmetros epidemiológicos 1990 2000 2006
Mortes Anuais >45.000 21.000 12.500
Casos de infecção em humanos
30 milhões 18 milhões 15 milhões
Incidência anual 700.000 200.000 41.200
População em risco 100 milhões 40 milhões 28 milhões
Distribuição 21 países 19 países 18 países
Fontes: Salvatella, 2007; Dias; Prata; Correia, 2008; Dias, 2009.
A situação atual da América Latina, após implementação das medidas de controle pelas iniciativas regionais podem ser resumidas da seguinte forma: interrupção da transmissão pela principal espécie vetora domiciliar (T. infestans) no Uruguai em 1997, no Chile em 1999 e no Brasil em 2006; interrupção parcial da transmissão vetorial na Argentina, Paraguai e Bolívia; eliminação do vetor Rhodnius prolixus em algumas áreas na Guatemala, Honduras e El Salvador; diferentes níveis de controle do Triatoma dimidiata na América Central; o Programa de Chagas dos Países Andinos, o Sistema de Vigilância da Amazônia e o Programa Nacional de Chagas no México, estão em andamento (SALVATELA, 2007; DIAS; PRATA; CORREIA, 2008).
Dados recentes demonstram que as medidas adotadas até o momento na América Latina, apresentaram um bom impacto no controle da doença, na prevalência da infecção e na mortalidade por doença de Chagas (VINHAES; DIAS, 2000). No período de 1990 a 2001, ocorreu uma redução significativa na carga da doença. O número de anos perdidos ajustados para incapacidade (Disability-Adjusted Life Years - DALYs) por doença de Chagas passou de 2,8 milhões em 1990 para 0,8 milhões em 2001, uma redução de 78% (SCHMUNIS, 2007; MONCAYO; SILVEIRA, 2009).
Considerada tradicionalmente uma doença relacionada à pobreza, endêmica nas Américas, a doença de Chagas passa atualmente por um processo de alteração de seus padrões epidemiológicos clássicos. Casos crônicos e agudos, importados e autóctones têm sido registrados em todo o mundo, inclusive em países não endêmicos, que há pouco não compartilhava deste problema (GADELHA; ARAÚJO-JORGE, 2009).
continentes é remota (SCHMUNIS, 2007). Os principais meios de transmissão nesses países são a partir de transfusão de sangue, transplante de órgão e transmissão congênita (COURA; VIÑAS, 2010).
Estima-se que há cerca de 300 mil pessoas infectadas nos Estados Unidos, 5.500 no Canadá, 80 mil na Europa, 3.000 no Japão e 1.500 na Austrália, sendo ilustrado na Figura 11 (SCHMUNIS, 2007; COURA; VIÑAS, 2010; SCHMUNIS; YADON, 2010). A doença de Chagas pode se tornar um problema de saúde global (SCHMUNIS; YADON, 2010), podendo trazer consequências graves para a saúde humana em longo prazo (COURA; VIÑAS, 2010). Esta complexa transição epidemiológica, da qual emerge a abrangência global da doença de Chagas, sinaliza a necessidade de esforço integrado de diversos países para o seu enfrentamento (GADELHA; ARAÚJO-JORGE, 2009). Buscando combater este problema, a Organização Mundial de Saúde (OMS) lançou recentemente, a Rede Global para Eliminação da Doença de Chagas (GNChE) (MONCAYO; SILVEIRA, 2009).
Figura 11 - Rotas de migração da América Latina e estimativa do número total de pessoas infectadas em países não endêmicos (COURA; VIÑAS, 2010).
1.5 Cenário epidemiológico da doença de Chagas no Brasil
Em 1975, o Brasil possuía a mais extensa área endêmica no continente, perfazendo 36% do território do país, em torno de 3,5 milhões de km² (MONCAYO; SILVEIRA, 2009). Essa área incluía 18 estados (do Maranhão ao Rio Grande do Sul) com mais de 2.450 municípios, nos quais se comprovou a presença de triatomíneos domiciliados e destes, 711 com presença de T. infestans, principal vetor estritamente domiciliar no Brasil. Até então, a Região Amazônica estava excluída dessa área de risco por ausência de vetores domiciliados (BRASIL, 2009b). Em 1980, estimava-se que a prevalência da doença de Chagas no Brasil era de 4,2% (inquérito nacional), correspondendo a 6,5 milhões de indivíduos (CAMARGO et al., 1984; SILVEIRA; SILVA; PRATA, 2011).
Figura 12 - Área de distribuição de T. infestans no Brasil: (A) 1983, (B) 1989 a 1992 e (C) áreas de resíduos de T. infestans-2008 (BRASIL, 2009c).
Com a redução significativa da transmissão vetorial e por transfusão sanguínea, o número de pacientes na forma aguda da doença foi drasticamente reduzido na maioria das áreas endêmicas. Estimativas mais recentes ajustam para cerca de 2 a 3 milhões, o número de pessoas infectadas (DA COSTA PINTO et al., 2001; WHO, 2002; DIAS, 2006), 600 mil com complicações cardíacas ou digestivas que levam a óbito cinco mil pessoas por ano (GADELHA; ARAÚJO-JORGE, 2009).
A prevalência da infeção por T. cruzi no grupo de 7 a 14 anos em 1999 foi de 0,04%, ante 18,5% em 1980, representando uma redução de 99,8% na incidência nesta faixa etária. Em 2011, os resultados de 104.954 testes sorológicos em uma amostra de população no grupo de 0 a 5 anos (inquérito nacional de soroprevalência de avaliação do controle da doença de Chagas no Brasil 2001 a 2008), indicaram que a soroprevalência nesta faixa etária é de 0,03%, o que pode ser interpretado como uma prova da interrupção da transmissão vetorial (T. infestans) no Brasil (OSTERMAYER et al., 2011).
Em 2006, baseado em dados epidemiológicos e entomológicos, o Brasil recebeu da Organização Pan-Americana da Saúde (OPAS) e Organização Mundial da Saúde (OMS), a
A B
Certificação Internacional de Interrupção da Transmissão da Doença de Chagas pelo T. infestans (FERREIRA; SILVA, 2006; MONCAYO; SILVEIRA, 2009).
Estudos para avaliar a relação custo-benefício e custo-efetividade do Programa de Controle da Doença de Chagas no Brasil, mostraram que entre 1975 e 1995 teriam sido prevenidas 2.339.000 novas infecções e 337 mil óbitos por doença de Chagas. Isso se traduziu na prevenção da perda de 11.486.000 DALYs. Esses números indicam ganho na ordem de US$ 17,00 para cada US$ 1,00 aplicado nas atividades de controle. Isso indica que o programa e suas atividades são custo-efetivas e com bom retorno para os investimentos realizados (AKHAVAN, 2000; MONCAYO; SILVEIRA, 2009).
Embora novos casos de doença de Chagas tenham sido reduzidos nos últimos 30 anos, em virtude da sistemática de vigilância e controle em áreas endêmicas no Brasil, surtos da doença de Chagas aguda (DCA) relacionadas à ingestão de alimentos contaminados (caldo de cana, açaí, bacaba, entre outros) e casos isolados por transmissão vetorial extradomiciliar têm sido frequentemente relatados em diversos estados brasileiros (Figura 13) (GAZIN et al., 2004), principalmente em áreas até pouco consideradas não indenes, com maior frequência na região da Amazônia Legal (OPAS, 2009). No período de 1997 a 2008, mais de 600 casos agudos foram notificados na região, a maioria deles provenientes de focos microepidêmicos, relacionados à transmissão oral por ingestão de sucos de frutas da região como, por exemplo, o açaí (DIAS; PRATA; CORREIA, 2008; OPAS, 2009; BARBOSA-FERREIRA et al., 2010).
Figura 13 - Casos de Doença de Chagas Aguda (DCA) notificadas no Brasil, (A) 2005-2008 e (B) 2009* (até 21/09/2009) (BRASIL, 2009c).
No período de 2000 a 2010 (até 02 de outubro de 2010), foram registrados no Brasil 1007 casos de doença de Chagas aguda. Destes, 73% (736/1007) foram por transmissão
oral, 1,8% por transmissão vetorial (18/1007) e em 25% (252/1007) não se definiu a forma de transmissão (Tabelas 2 e 3) (BRASIL, 2010b).
Tabela 2 - Casos de doença de Chagas aguda (DCA) por tipo de transmissão no Brasil, 2005 a 2010*.
Ano Oral Vetorial Ignorada Total
N % N % N %
2005 27 82 0 0 6 18 33
2006 107 91 3 3 8 7 118
2007 119 74 3 2 39 24 161
2008 74 56 4 3 53 40 131
2009 165 64 6 2 85 33 256
2010* 21 75 1 4 6 21 28
Total 513 71 17 2 197 27 727
Fonte: BRASIL, 2010a. *Até 30/05/2010
Tabela 3 - Casos de doença de Chagas aguda (DCA) notificados com sua respectiva letalidade, segundo Unidade da Federação (UF), Brasil, 2005 a 2010*.
UF 2005 2006 2007 2008 2009 2010* Total Óbitos Letalidade (%)
AC - - - - 01 - 01 - -
AM - - 28 - 03 18 49 01 2,0
AP - 05 19 20 15 - 59 - -
CE - 08 - 01 - - 09 - -
BA - 13 - - - - 13 02 15,4
MA 02 02 02 05 01 - 12 01
MT - 01 01 - - - 02 - -
PA 07 85 109 99 236 10 546 11 8,3
PI - 01 01 01 - - 03 - -
SC 24 - - - 24 03 12,5
SP - 03 - - - - 03 01 33,3
TO - - 01 05 - - 06 - -
Total 33 118 161 131 256 28 727 19 2,6
Fonte: BRASIL, 2010a. *Até 30/05/2010
Hoje, o perfil epidemiológico da doença apresenta um novo cenário com a ocorrência de casos e surtos na Amazônia Legal por transmissão oral e vetorial (sem colonização e extradomiciliar). Com isso, evidenciam-se duas áreas geográficas onde os padrões de transmissão são diferenciados:
vigilância epidemiológica, entomológica e ambiental devem ser concentradas, com vistas à manutenção e sustentabilidade da interrupção da transmissão da doença por T. infestans e por outros vetores passíveis de domiciliação;
b) a região da Amazônia Legal, onde a doença de Chagas não era reconhecida
como problema de saúde pública, as ações de vigilância devem ser estruturadas e executadas de forma extensiva e regular na região por meio de: detecção e investigação de surtos de casos febris agudos, apoiada na vigilância da malária; identificação e mapeamento de marcadores ambientais, a partir do reconhecimento dos ecótopos preferenciais das diferentes espécies de vetores mais frequentes e na investigação de situações em que há evidências ou suspeita de domiciliação de alguns vetores (BRASIL, 2010b).
A preocupação com a doença de Chagas nos próximos anos leva em conta os processos políticos e científicos, já que a sustentabilidade dos esforços de controle depende de vontade política (DIAS, 2009; SILVEIRA, 2011b). Nas áreas em que o controle foi eficaz, eventualmente, o sucesso obtido pode levar à negligência ou desativação dos programas, principalmente quando outras prioridades de saúde (como o dengue) aparecem (SALVATELA, 2007; DIAS, 2009). Haverá uma redução progressiva dos níveis de infecção em áreas sobre controle, mas alguns focos permanecerão, provavelmente dentro de bolsões de pobreza, isolados politicamente e com infraestrutura sanitária precária. Novas situações epidemiológicas apareceram de forma aleatória e inesperada, como a transmissão oral e a invasão doméstica de triatomíneos silvestres (SALVATELLA, 2007).
A prevenção de nível secundário está assumindo importância pela grande massa de pessoas com doença de Chagas crônica existente. O desafio nesse caso está em sistematizar procedimentos e estabelecer referências e contrareferências para atenção a esse paciente, principalmente para aqueles que sofrem de cardiopatia crônica (SILVEIRA et al., 2002).
1.6Mortalidade causada pela Doença de Chagas
Estima-se que, na América Latina, aproximadamente 14.000 pessoas morrem em consequência da doença a cada ano (SCHMUNIS, 2007). No período de 1972 a 1983, estimou-se que 8,2% dos 5 milhões de mortes ocorridos no Brasil foram provocados pela doença de Chagas (SILVEIRA, 1986). O maior conhecimento sobre a história natural da doença e a maior possibilidade de intervenção nos planos clínico e cirúrgico levou à redução da mortalidade específica e à ampliação da sobrevida. As pessoas infectadas por T. cruzi morriam precocemente, principalmente a população masculina, em geral em virtude de complicações da forma cardíaca (RAMOS Jr.; CARVALHO, 2009).
Atualmente, a doença de Chagas é a quarta causa de morte no Brasil entre as doenças infecciosas e parasitárias (ARAÚJO; SABROZA; SILVA, 2010). No periodo de 1996 a 2008, a doença de Chagas foi responsável por aproximadamente 66 mil óbitos (DATASUS, 2011). Atualmente, é responsável por 5 mil óbitos anuais, ante 10 mil mortes em 1960, com deslocamento da faixa etária dos óbitos de 30 a 50 anos de idade para 50 a 70 anos, porém, com padrões desiguais da morbimortalidade nas diferentes regiões do país (RAMOS Jr.; CARVALHO, 2009).
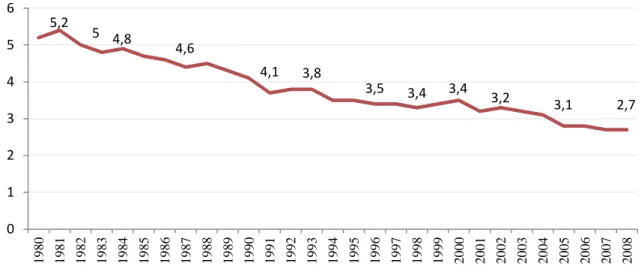
Figura 14 - Coeficiente de mortalidade anual por doença de Chagas/100.000 habitantes, Brasil, 1980 a 2008 (Modificado de DIAS, 1999; SIM/DATASUS/MS).
Como produto natural deste processo, o novo milênio contemplará cada vez mais pacientes idosos, daí derivando um grande desafio para os profissionais de saúde e para o sistema de saúde nas próximas décadas. O manejo da doença de Chagas em situações de idade avançada e de superposição de agravos envolve novos conhecimentos e práticas, em especial com relação as enfermidades crônico-degenerativas prevalentes na terceira idade como hipertensão, diabetes, coronariopatias (DIAS, 1999), ampliando as necessidades de atenção integral desta população (RAMOS Jr.; CARVALHO, 2009).
1.7 Utilização de dados de mortalidade em estudos epidemiológicos
As informações sobre mortalidade desempenham importante papel no planejamento local, regional e nacional, contribuem para a identificação da situação demográfica do país e permitem fazer inferências sobre o futuro. (ISRAEL; ROSEMBERG; CURTIN, 1986; SANTO; PINHEIRO, 1995). As estatísticas de mortalidade são de grande relevância em Saúde Pública, por constituírem importantes indicadores das condições de saúde da população, permitindo a identificação de grupos de maior risco e orientando o planejamento e a implantação de programas de saúde, bem como avaliando seus resultados (ISHITANI; FRANÇA, 2001; SANTO, 2007a). Em epidemiologia representam uma das principais fontes de informação para numerosos tipos de estudos (ISHITANI; FRANÇA, 2001).
5,2
5 4,8
4,6
4,1 3,8
1.7.1 Declaração de óbito e Sistema de Informações sobre Mortalidade (SIM)
As estatísticas de mortalidade no Brasil têm origem nas Declarações de Óbito (DO) (Anexo 1), que são atestados por médicos ou a partir de relatos de testemunhas para registro em cartório de registro civil (BRASIL, 2001). A DO é o documento-padrão do Sistema de Informações sobre Mortalidade do Ministério da Saúde (SIM/MS), para coleta das informações sobre mortalidade que servem de base para o cálculo de estatísticas vitais e epidemiológicas (BRASIL, 2009a). O SIM foi desenvolvido e implantado em 1975, cujo objetivo é captar dados sobre os óbitos a fim de fornecer informações sobre mortalidade para todas as instâncias do sistema de saúde (BRASIL, 2001). Talvez seja o único sistema de vigilância epidemiológica com características de continuidade, padronização e cobertura nacional na área da saúde, permitindo a elaboração de estatísticas de mortalidade consolidadas para todo o país (SANTO; PINHEIRO, 1995; SANTO, 2000).
Figura 15 - Bloco da declaração de óbito para preenchimento das condições e causas do óbito (BRASIL, 2009a).
A causa de morte tem sido usada pelos epidemiologistas para a geração de hipóteses sobre a etiologia das doenças, para o seguimento ao longo do tempo de mudanças nos padrões de doenças e para a descrição da prevalência de doenças em grupos populacionais e áreas geográficas (SANTO, 2007a). O conhecimento preciso de padrões de mortalidade, segundo a causa de morte, permite a pesquisa de eventuais fatores etiológicos e a tomada de decisões com vistas a evitar esses fatores (SANTO; PINHEIRO, 1995).
Estudos de mortalidade, tendo a DO como fonte de dados, constituem um procedimento simples e de baixo custo para gerar informações de morbimortalidade, podendo fornecer subsídios importantes para se avaliar a mortalidade por doença de Chagas na população, tanto como causa básica quanto causa associada de morte.
1.7.2 Causa básica e causas múltiplas de morte
Tradicionalmente, a mortalidade é apresentada por meio de uma única causa, denominada causa básica de morte (SANTO; PINHEIRO, 1999; ISHITANI; FRANÇA, 2001; SANTO, 2007a), definida como:
(a) a doença ou lesão que iniciou a sucessão de eventos mórbidos que levou diretamente à morte, ou
Os dados de mortalidade apresentados segundo a causa básica de morte são considerados unidimensionais, de fácil compreensão e extensamente utilizados em Saúde Pública, Epidemiologia, Demografia e Atuária, atribuindo a razão de óbito a apenas uma doença, lesão ou violência (SANTO; PINHEIRO, 1999; SANTO, 2007a). Este enfoque baseado em uma causa única tem sido empregado por permitir comparabilidade entre diferentes locais, pela sua importância na análise das tendências de mortalidade e por seu uso tradicional de orientar medidas de prevenção da morte (ISHITANI; FRANÇA, 2001).
Embora seja de grande importância, a utilização do conceito de causa básica nas análises de mortalidade, este enfoque apresenta algumas limitações devido a uma perda considerável de informações contidas nas DO, quando se ignoram outras causas ou diagnósticos mencionados no atestado de óbito. Muitas afecções mencionadas frequentemente na DO não aparecem como causas mais comuns de morte nessas estatísticas. Isto ocorre, por exemplo, com a hipertensão arterial e o diabetes, dificultando a avaliação dos programas específicos para o controle dessas doenças (ISHITANI; FRANÇA, 2001). Atualmente, com o aumento da expectativa de vida e importância das doenças crônico-degenerativas como causas de óbito, um maior número de diagnósticos tem sido informado nas declarações de óbito (ISHITANI; FRANÇA, 2001; OLIVEIRA et al., 2009).
Considerando as limitações das estatísticas de mortalidade que levam em conta somente a causa básica, bem como para evitar a perda de informações relativas às afecções que não são selecionadas como causa básica de morte, uma proposta alternativa é a utilização do enfoque de causas múltiplas de morte (ISHITANI; FRANÇA, 2001; GOLDACRE et al., 2004; REDELINGS; SORVILLO; SIMON, 2006; SANTO, 2007b), na qual aproveita todas as causas, básica e associadas, informadas na declaração de óbito (LAURENTI, 1974; LAURENTI; BUCHALLA, 2000; SANTO, 2007b). As causas múltiplas têm caráter multidimensional, pois não apenas a causa básica, mas todas as afecções são levadas em consideração e envolvem interpretação complexa de sua relação com a morte (SANTO; PINHEIRO, 1999).
Ao ocorrer uma morte, o evento será, então, relacionado a diversos diagnósticos, tornando-se difícil a seleção de apenas uma causa para descrever um processo tão complexo (OLIVEIRA et al., 2009). A análise da mortalidade sob o enfoque das causas múltiplas de morte permite a identificação de doenças presentes no momento da morte e que podem ter participado no processo que evoluiu para o óbito (ISHITANI; FRANÇA, 2001). As estatísticas de mortalidade por causas múltiplas podem fornecer informações sobre todo o processo letal que culminou com a morte, oferecendo novos elementos e perspectivas para a sua prevenção (SANTO, 2009).
O conhecimento das várias doenças que contribuem para um óbito permite que seja avaliada a importância das causas que normalmente não estariam privilegiadas nas estatísticas porque são doenças não caracterizadas como causa básica, reconhecendo a frequência de doenças que raramente são consideradas básicas e as estatísticas de mortalidade por causas múltiplas não são afetadas pelas mudanças das regras de seleção da causa de morte (LAURENTI; BUCHALLA, 2000). Ainda existe a possibilidade de descobrir novas associações de doenças e conhecer informações sobre a natureza das lesões em casos de morte por causas externas (acidentes e violências) (LAURENTI; BUCHALLA, 2000).
O estudo das causas múltiplas de morte representa um avanço na análise das estatísticas de mortalidade. Entretanto, não visa substituir o enfoque da causa básica de morte que, apesar de apresentar limitações, possuem objetivos e benefícios bem estabelecidos. A utilização da metodologia das causas múltiplas de morte pode ser um importante instrumento complementar na avaliação e planejamento das ações de saúde, especialmente neste momento em que se verifica um aumento do número de diagnósticos informados por declaração DO (ISHITANI; FRANÇA, 2001).
1.8 Análise de dados espaciais em saúde pública