UNIVERSIDADE FEDERAL DO CEARÁ
CENTRO DE CIÊNCIAS
DEPARTAMENTO DE FÍSICA
ADAILTON AZEVEDO ARAUJO FILHO
Doença de Parkinson e nanotecnologia
FORTALEZA
2 ADAILTON AZEVEDO ARAUJO FILHO
DOENÇA DE PARKINSON E NANOTECNOLOGIA
Monografia apresentada ao Curso de Graduação
em Física do Departamento de Física, da
Universidade Federal do Ceará, como requisito
parcial para obtenção do grau de graduado em
Licenciada de Física.
Orientador: Prof. Dr. Valder Nogueira Freire.
FORTALEZA
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca Universitária
Gerada automaticamente pelo módulo Catalog, mediante os dados fornecidos pelo(a) autor(a)
A687d Araújo Filho, Adailton Azevêdo Araújo Filho.
Doença de Parkinson e nanotecnologia / Adailton Azevêdo Araújo Filho Araújo Filho. – 2016. 63 f. : il. color.
Trabalho de Conclusão de Curso (graduação) – Universidade Federal do Ceará, Centro de Ciências, Curso de Física, Fortaleza, 2016.
Orientação: Prof. Dr. Valder Nogueira Freire.
1. Parkinson e Nanotecnologia. I. Título.
5
6
AGRADECIMENTOS
Agradeço a Deus por ter me dado discernimento no que deveria ser feito.
Agradeço a minha tia Sandra, minha vovó Marly e ao meu vovô Zeca por terem me acolhido quando eu era pequenino.
Agradeço ao meu super papai e a minha super mamãe e ao meu único irmão por terem me dado inspiração e suporte para que chegasse até aqui.
Agradeço ao meu único irmão por ter passado meu estresse jogado Fifa.
Agradeço ao professor Valder por ter aberto as portas do mundo da pesquisa para mim e por ser uma inspiração como profissional.
Agradeço ao Lála por ter ensinado-me a como estudar Inglês.
Agradeço aos companheiros de laboratório Aurélio Moreira, Leonardo Serafim e Mauricélio Bezerra por terem se disponibilizado a ensinar-me.
7 Agradeço a Fernanda por ter sido fonte de inspiração, por ter expandido meu modo de pensar, por ter feito eu encarar os obstáculos com outros olhos e por ter me proporcionado momentos únicos e inesquecíveis.
Agradeço aos professores do curso de idiomas (CLEC), em especial a professora Valerie, por terem servido de motivação e por terem ensinado-me Inglês.
Agradeço ao Piu, meu filho, ao Bilu e a Duba por terem sido carinhosos
Agradeço ao Josenildo por ter tirado xerox
Agradeço a UFC
Agradeço ao departamento de Física
Agradeço ao secretátio Paulo
Agradeço ao Jackson Hermann
Agradeço ao Milton Vanderley Reinheimer
Agradeço a Dn.Naura
8 Agradeço a Eveline
Agradeço ao professor George Marks
9
LISTA DE ABREVIATURAS E SÍMBOLOS
BBB: Barreira-sangue cérebro RES: Sistema reticuloendotelial
PCN: Parâmetros curriculares nacionais
ENEM: Exame Nacional do Ensino Médio
SNC: Sistema nervosa central
MAO: Monoanina Oxidase
DFT: Teoria do funcional da densidade
10
LISTA DE TABELAS
11
LISTA DE FIGURAS
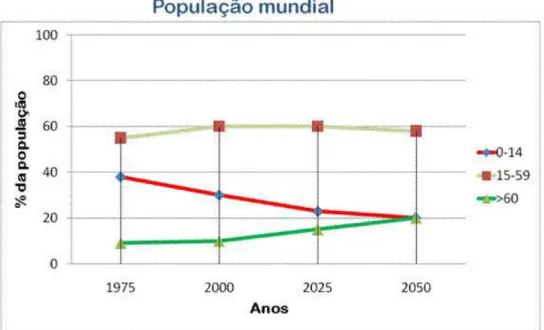
FIGURA 1:GRÁFICO QUE REPRESENTA A PORCENTAGEM DA POPULAÇÃO MUNDIAL COM IDADES DE 0 A 14
(QUADRADO),15 A 59(LOSANGO) E MAIS DE 60 ANOS (TRIÂNGULO) ENTRE O PERÍODO DE 1975-2050. ... 15
FIGURA 2:FOTO ILUSTRATIVA DE JAMES PARKISON E DE SEU CONCEITUADO TRABALHO:“AN ESSAY ON THE SHAKING PALSY”. ... 16
FIGURA 3:REPRESENTAÇÃO DE CAFÉ E DE CIGARROS. ... 17
FIGURA 4:REPRESENTAÇÃO DA ERVA KAVA-KAVA. ... 18
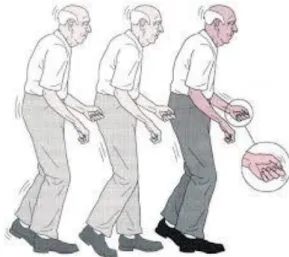
FIGURA 5:POSTURA CURVADA E TREMOR NA DOENÇA DE PARKINSON. ... 19
FIGURA 6:REPRESENTAÇÃO DE TREMORES ASSOCIADOS À DOENÇA DE PARKISON. ... 20
FIGURA 7:PROBLEMAS RELATADOS COM O TEMPO POR PACIENTES PARKINSONIANO. ... 20
FIGURA 8:MÉDICO MOSTRANDO AO PACIENTE COMO FAZER O EXAME DA "BATIDA DE DEDOS". ... 21
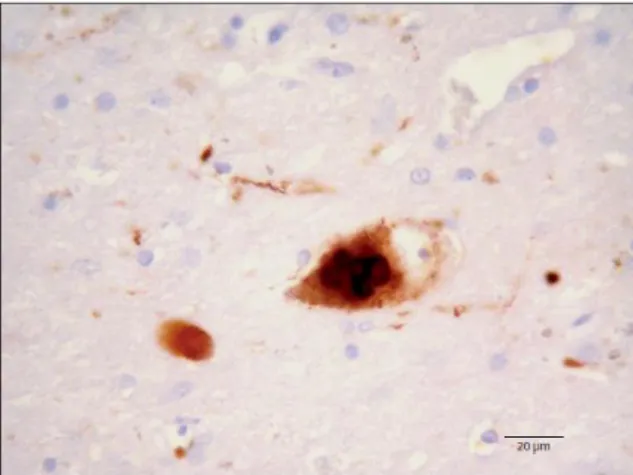
FIGURA 9:AGLOMERADOS PROTEICOS DE Α–SINUCLEÍNA EM UM NEURÔNIO DA SUBSTÂNCIA NEGRA DE UM PACIENTE COM PARKINSON. ... 23
FIGURA 11:PERDA DA SUBSTÂNCIA NEGRA NO CÓRTEX CEREBRAL. ... 23
FIGURA 10:ILUSTAÇÃO DE UM NEURÔNIO COM CORPOS DE LEWY. ... 23
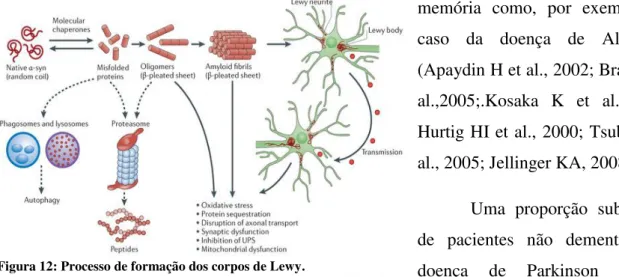
FIGURA 12:PROCESSO DE FORMAÇÃO DOS CORPOS DE LEWY. ... 24
FIGURA 13:DESIGNAÇÃO IUPAC E FÓRMULA QUÍMICA DO MEDICAMENTO L-DOPA. ... 26
FIGURA 14:ILUSTRAÇÃO DA ATUAÇÃO DA L-DOPA NO ORGANISMO. ... 26
FIGURA 15:PROCESSO DE FORMAÇÃO DE ATUAÇÃO DA DOPAMINA. ... 27
FIGURA 16:UM DOS REMÉDIOS MAIS UTILIZADOS NO TRATAMENTO DA DOENÇA DE PARKINSON. ... 28
FIGURA 17:QUATRO CONFIGURAÇÕES DE ALTA ENERGIA DE INTERAÇÃO (A,B,C E D) PARA A ADSORÇÃO DE L-DOPA EM C60 OBTIDAS USANDO CÁLCULOS DFT-LDA.AS DISTÂNCIAS ENTRE OS CENTRÓIDES DAS MOLÉCULAS DE L-DOPA E O CENTRO DO FULERENO SÃO INDICADAS. ... 30
FIGURA 18:REPRESENTAÇÃO DE CÉLULAS TRONCO DIFERENCIADAS EM NEURÔNIOS EM UM PACIENTE COM PARKISON. ... 31
FIGURA 19:MOLÉCULAS SE MOVENDO NO INTERIOR DE UM NANOTUBO DE CARBONO, NUM CENÁRIO POSSÍVEL DE DRUG DELIVERY. ... 32
FIGURA 20:REPRESENTAÇÃO DE UMA MOLÉCULA DE DNA. ... 33
FIGURA 21:DESCRIÇÃO ESQUEMÁTICA DAS CARACTERÍSTICAS DE VASOS CEREBRAIS DA BARREIRA SANGUE -CÉREBRO. ... 34
FIGURA 22:EXEMPLO DE UM SENSOR DE LEVODOPA. ... 35
FIGURA 23:EXEMPLOS DE NANOPARTÍCULAS COM MOLÉCULAS ADSORVIDAS (ACIMA) E ENCAPSULADAS (ABAIXO) ... 36
FIGURA 24:REPRESENTAÇÃO DA DISTRIBUIÇÃO DE UM FÁRMACO EM NANOESFERAS. ... 37
FIGURA 25:NANOTUBOS SERVINDO DE TRANSPORTE PARA ALGUMAS MOLÉCULAS. ... 38
FIGURA 26:REPRESENTAÇÃO DA APLICAÇÃO DE NANOTECNOLOGIA. ... 40
FIGURA 27:ILUSTRAÇÃO DE NANO PARTÍCULAS MAGNÉTICAS... 42
12
RESUMO
Esta monografia é um trabalho de conclusão do Curso de Física Licenciatura que possui um caráter de divulgação científica que é voltado para os diferentes públicos leitores tais como: professores do ensino fundamental e médio, alunos e ao público em geral fazendo com que as informações possam ser repassadas de forma simples para aqueles que desejam saber sobre a doença de Parkinson (sintomas, causas, tratamento, etc) e sobre a nanotecnologia aplicada à saúde dos pacientes que, naturalmente, proporciona-lhes uma melhor qualidade de vida.
13
Sumário
AGRADECIMENTOS ... 6
LISTA DE ABREVIATURAS E SÍMBOLOS ... 9
LISTA DE TABELAS ... 10
LISTA DE FIGURAS ... 11
RESUMO ... 12
INTRODUÇÃO ... 14
PARTE 1: O QUE É MAL DE PARKINSON ? ... 15
1.1 Uma visão geral ... 16
1.2 Falando um pouco sobre a patogenia ... 17
1.3 Sintomas ... 19
1.4 Diagnosticando a doença ... 21
1.5 Uma visão sobre lesões neurológicas ocorrentes ... 23
1.6 Tratamento ... 26
1.7 Olhando para o futuro ... 31
PARTE 2: NANOTECNOLOGIA E PARKINSON ... 32
2.1 Uma visão sobre nanotecnologia ... 33
2.2 Entendendo a barreira sangue cérebro (BBB) que dificulta a passagem de drogas no sistema nervoso central ... 34
2.3 Bioativadores promissores ... 35
2.4. Mecanismos de transporte de drogas através da barreira sangue-cérebro empregando nanotecnologia ... 36
2.5. Nanopartículas poliméricas ... 37
2.6. Os nanotubos de carbono e nanofibras de eletrofiação ... 38
2.7 Nanoentrega de genes para o tratamento da doença de Parkinson ... 40
2.8 Células tronco como terapia utilizando nanorobôs ... 40
2.9 Desenvolvimento de Fulereno (C60) baseado em componentes neuroprotetores ... 43
CONCLUSÕES ... 45
14
INTRODUÇÃO
Levando em conta o currículo do ensino de ciências no território nacional Brasileiro, percebe-se que não há uma abordagem expressiva de física aplicada à saúde. Pensando nisso, este trabalho foi confeccionado, a fito de ajudar a construção sócio-educacional estudantil, para que os jovens estudantes do ensino médio, por exemplo, tenham mais contato com algumas possíveis associações de diferentes áreas do conhecimento como nanotecnologia, farmacologia, biologia e física estando, pois, em concordância com o que é proposto pelo exame nacional do ensino médio (Enem)
“O ENEM, portanto, induz as unidades escolares a uma efetiva e concreta mudança curricular com base na interdisciplinaridade que deve ser a diretriz básica para o Projeto Político Pedagógico da organização escolar. O que se pretende nas escolas é o estabelecimento de uma intercomunicação efetiva entre as disciplinas, por meio de objetivos e conteúdos de forma a romper com a tradicional fragmentação curricular no processo de ensino e aprendizagem, tendo em vista que as disciplinas continuam sendo ministradas desarticuladamente de acordo com os seus princípios epistemológicos.”
e estando em concordância também com os Parâmetros Curriculares Nacionais dos tópicos II (Investigação e compreenão) e III (Contextualização sócio-cultural). Ainda pensando na facilidade/comodidade da leitura, este trabalho foi dividido em diferentes partes (aproximadamente independentes) de modo que o leitor possa ir direto ao tópico desejado.
15
PARTE 1
:
O QUE É MAL DE PARKINSON ?
Nos últimos anos, tanto nos países desenvolvidos quanto nos países subdesenvolvidos, a distribuição etária mundial tem sofrido substanciais alterações que são caracterizadas pela diminuição do número de jovens e pelo aumento do número de pessoas idosas (Figura 1). Com isso, há o aumento da probabilidade de se desenvolver algumas doenças caracterizadas como “doenças da velhice” tais como a doença de Parkinson. Levando em conta este fato, é importante conhecer o máximo sobre esta doença para que se possa, com o máximo de antecedência possível, prever sua possível aparição e encaminhar o paciente para um especialista capacitado dando-lhe a chance de melhorar sua qualidade de vida – uma vez que quanto mais precoce for o diagnóstico, melhor será o tratamento.
16
1.1 Uma visão geral
Em volta de 1817, James Parkinson esperava que sua monografia intitulada. “An Essay on the Shaking Palsy” (Figura 2), na qual ele detalhou seis pacientes com "movimentos involuntários com uma menor força muscular em partes que não estão em ação, mesmo quando se era resistido; uma propensão para dobrar o tronco para frente e passar de um ritmo de caminhada para um ritmo de corrida", convenceria, de forma quase que absoluta, os neurologistas que tinham descrito tal fenômeno como sendo uma “desordem não reconhecida” (Parkison J., 1817; Kempster PA et al. 2007). Em uma descrição clara, para o agradecimento ao boticário de Londres, Jean Martin Charcot, o qual era considerado o pai da neurologia, propôs que a síndrome deveria ser chamada “maladie de Parkinson” (doença de Parkinson).
De forma acentuada, a incidência da doença aumenta com o avanço da idade. Pessoas que tem a idade entre 50 e 59 anos, são acometidas por essa doença com uma frequência em torno de 17,4 em cada 100.000. Já pessoas entre 70 e 79 anos de idade, são acometidas por essa doença com uma frequência em torno de 93,1 em cada 100.000 (Bower JH et al., 1999; de Rijk et al., 1995). A idade média de início da doença é de 60 anos e a sua duração média, desde o diagnóstico até morte, são de aproximadamente 15 anos (Katzenschlager R et al., 2008). No mundo, existem mais de 4 milhões de pessoas diagnosticadas com a doença resultando uma média de 2% da população idosa mundial.
Embora haja evidências de que os homens são cerca de 50% mais propensos que mulheres a desenvolver Parkinson, essa diferença não é absoluta e varia muito de acordo com diferentes estudos, podendo haver uma maior propensão na população com mais de 70 anos de idade(Twelves D et al., 2003). Além do mais, sabe-se que a doença de Parkinson não está relacionada com a raça ou muito menos com crença de cada indivíduo. A causa ainda permanece sem uma justificativa precisa assim como fora descrito por James Parkinson, 1817. No entanto, importantes pistas genéticas e indícios patológicos vem sendo encontrados.
Figura 2: Foto ilustrativa de James Parkison e de seu conceituado trabalho:
17
1.2 Falando um pouco sobre a patogenia
A doença de Parkinson é considerada como sendo uma desordem esporádica e poucas causas ambientais foram identificadas como significativas (Tanner CM., 2003; Taylor KS et al., 2005; Dick FD et al., 2007). Analogamente às outras doenças neurodegenerativas, o envelheciemento é o principal fator para que o indivíduo desenvolva a doença, embora cerca de 10% das pessoas apresentem o quadro com menos de 45 anos de idade. É curioso que pessoas que nunca fumaram, têm duas vezes mais chances de desenvolverem a doença de Parkison (Allam MF et al., 2004; Hernán MA et al., 2001) já que a nicotina aumenta a liberação de dopamina estriatal e a enzima monoamina oxidase1 é inibida no cérebro dos fumantes2 (Fowler JS et al., 1996). Homens depois dos 60 anos e mulheres que já entraram na
menopausa, assim como pessoas que fazem a ingestão de baixas quantidades de cafeína (Figura3), parecem estarem mais propensos (cerca de 25 % a mais) a desenvolver o mal de Parkinson (Ascherio A et al., 2004). Tanto o aumento de cafeína quanto o aumento de nicotina no sangue, aumentam a liberação de dopamina no organismo. A cafeína é um antagonista do receptor A2 de adenosina sendo
de grande interesse já que alguns compostos desta classe tem se mostrado relevantes para os medicamentos antiparkisonianos (Jankovic J., 2008).
1“A monoaminoxidase (MAO) é uma enzima mitocondrial encontrada em tecidos neurais e não neurais, como o
intestinal e o hepático. No neurônio, a MAO funciona como uma "válvula de segurança", reagindo oxidativamente e inativando qualquer excesso de moléculas neurotransmissoras (noradrenalina, dopamina e serotonina) que podem ser produzidos por vesículas sinápticas quando o neurônio está em repouso”.
2“Os inibidores da MAO podem inativar a enzima, reversível ou irreversivelmente, permitindo que as moléculas
neurotransmissoras não sofram degradação e, consequentemente, alcancem a fenda sináptica. Isto causa a
18 Estudos mostram que pode haver, embora que de maneira fraca, correlações entre a doença de Parkinson com: ferimentos na cabeça, vida rural, obesidade de meia-idade, falta da prática de exercícios físicos, ingestão de quantidades insatisfatórias de líquidos, exposição a herbicida e a inseticidas (Elbaz A., 2007; Thacker EL et al., 2008). Podemos ter casos clínicos semelhantes, embora não identicos, quando há exposições a algumas toxinas ambientais, tais como: metil-4-fenil-1,2,3,6-tetra-hidropiridina, cianetos, dissulfureto de carbono, e tolueno (Tanner CM.et al., 2003).
Estudos genéticos têm sido feitos sugerindo que genes podem estar associados à doença (Paísan-Ruíz C et al., 2004). Uma das justificativas para a ativação de alguns genes recessivos autossomicos da doença de Parkison, seria a disfunção da mitocôndria (Schapira AH., 1994). Defeitos na manipulação de proteínas, pelo sistema de ubiquitina-proteassoma, que conduzem a agregação de proteínas citotóxicas, tem também sido associada a muitas mutações em proteínas tais como: α-sinucleína e parkin unbiquitina-ligase. Uma vez que temos acumulações de proteínas indesejadas que excedem a capacidade de eliminação pelos proteossomos, há um extress proteolítico que pode desencadear o Parkinson (Olanow CW et al., 2006). A proteína parkin unbiquitina-ligase é a mediadora da disfunção das mitocondrias por autofagossomos (Narendra D., 2008). A incapacidade de remover mitocôndrias disfuncionais pode ser um relevante fator patogênico.
Além do mais, Remédios de ervas, como kava kava (Figura 4), que é um sedativo proveniente do Pacífico ocidental (Meseguer E et al., 2002) ou raízes indianas da espécie Rauwolfia Serpentina também podem ocasionar o desenvolvimento do Parkinson (Sourkes TL., 1999). A compra crescente de medicamentos à base de plantas por meio da internet e o surgimento de formulações genéricas de pureza duvidosa têm exposto pessoas a produtos tóxicos comercializados de forma irregular que, naturalmente, geram um grande risco à saúde (Cosentino C., 2000).
19
1.3 Sintomas
Em geral, a doença de Parkinson apresenta um quadro de insuficiência de destreza. Há casos menos comuns em que o paciente apresenta o ligeiro arrastamento de um pé. O início da doença se manifesta de forma gradual e os primeiros sintomas podem passar despercebidos ou mal interpretados por um longo tempo. Uma das primeiras queixas dos pacientes são fadiga e
rigidez que, no entanto, não são características específicas. Colegas de trabalho ou membros familiares podem notar um rosto “duro”, uma aparência envergonhada, uma rigidez dos braços ou uma expressão monótona na fala. De forma resumida, há a presença de movimentos mais lentos. Estas alterações são raramente notadas pelos pacientes, bem como pelos familiares. Os primeiros sinais físicos são muitas vezes equivocadamente atribuídos à velhice, à pobreza, à introspecção ou ao reumatismo. É bem comum uma demora de 2 a 3 anos, em média, a partir dos primeiros sintomas até se chegar ao diagnóstico. Quando se tem a confirmação do diagnóstico, pacientes e seus familiares muitas vezes começam a relembrar dos sinais e sintomas relevantes que aconteceram no passado.
Uma avaliação cuidadosa do histórico familiar dos pacientes com a doença de Parkinson pode também ajudar a identificar outros sintomas iniciais. Perda precoce do sentido do olfato (hiposmia3) é ocasionalmente relatada, no entanto, muitos pacientes não o percebem
até que sejam formalmente testados (Doty RL., 1995). Distúrbios no sono, incluindo gritos, agitações com dificuldade nos movimentos de braços e pernas e quedas da cama, podem ser percebidos se o cônjuge do paciente for especificamente questionado.
Há muitas reclamações por parte dos pacientes no decorrer dos primeiros dois anos da doença. Há alguns sintomas que podem ajudar no diagnóstico como a ocorrência de quedas (especialmente para trás), desmaios, incontinência urinária, discurso proeminente, dificuldades na deglutição, aminésia e delírio.
3 Redução da sensibilidade olfativa.
20 Nos estágios mais avançados da doença de Parkinson, a face dos pacientes é rígida, sem expressividade, a fala é monótona e um pouco atrapalhada, a postura fica flexionada para frente (Figura 5) e ocorre um intenso tremor nas mãos (Figura 6). Um outro exemplo não menos importante é o “congelamento de marcha” que pode ocorrer durante vários segundos. É comum, por exemplo, quando o paciente adentra a sala de um consultório médico e depois este começar a se mover de um modo muito rápido. Outras queixas relatadas por pacientes são constipação, dificuldade na deglutição da saliva e incontinência urinária. A cateterização urinária e a gastrostomia percutânea são, por vezes, necessárias na fase terminal. Outro ponto importante que deve ser levado em conta é o risco de demência. Esta existe normalmente naqueles pacientes que apresentam distúrbios “de marcha”, fala proeminentes, depressão e uma fraca resposta à L-dopa (um dos principais medicamentos utilizados em paciente com Parkinson). O maior fator de risco para a demência é, no entanto, a idade (Figura 7) e não a duração da doença em si (Kempster PA et al., 2007; Levy G., 2007). Muitos sintomas podem ser confundidos com os de outras doenças como, por exemplo, o Alzheimer, porém dificuldades visuais, distúrbios de atenção, insônia, delírio e disfunção executiva são mais comuns na doença de Parkinson do que na doença de Alzheimer.
Figura 6: Representação de Tremores associados à doença de Parkison.
21
1.4 Diagnosticando a doença
Um evento bem recorrente na doença de Parkinson é a bradicinesia4, que pode ser
aparente assim que o paciente entra no consultório ou quando o paciente fica despido para ser examinado. Um dos testes mais populares é o da “batida de dedos” (Figura 8). Este consiste no “bater” dos dedos utilizando o indicador e o polegar por cerca de 20 segundos. Além disso, outro teste é o teste do piano (para que possa haver outra verificação do movimento dos dedos dos pacientes). Se houver dúvidas após esses exames, é pedido ao paciente para que faça essa mesma “batida de dedos” com as duas mãos simultaneamente. A bradicinesia na perna é avaliada de acordo com o andar do paciente. Naturalmente, esta é de fato confirmada quando existe uma lentidão generalizada (uma perda de velocidade nas atividades no geral, bem como uma perda de amplitude nos movimentos)
A doença de Parkinson é também caracterizada por tremores nas mãos (em média de 4-6 ciclos por segundo) que, para a detecção, exige que a mão do paciente esteja em repouso. Contudo, os tremores nas mãos apresentados por pacientes, podem ser consequência de outros fatores tais como: uso da mão afetada por algum acidente, situações emocionais e etc. Pacientes com menos de 40 anos de idade frequentemente apresentam tais tremores, de uma forma mais intensa nas pernas, podendo ser mais perceptíveis quando o paciente vai se sentar. De forma diferente, os pacientes com idade acima de 70 anos de idade apresentam tais tremores, de uma forma mais intensa no queixo, na mandíbula, nos lábios e na língua. Existe um debate que ainda não foi encerrado para definir se a existência do tremor aumenta o risco de se desenvolver posteriormente a doença de Parkinson. Todavia, muitos neurologistas vêm estudando pacientes com uma longa história de tremores (tremores posturais e tremores nas mãos) que são algumas vezes associadas a tremores na cabeça que progridem, depois de muitos anos, para uma doença de Parkinson (Grosset D., 2005). Embora
4“Termo médico que define a lentidão anormal dos movimentos”.
22 a presença de tremores “de repouso” seja útil para o diagnóstico da doença de Parkinson, tremores semelhantes podem ocorrer em alguns casos de distonias e tremores atípicos (Cortés X et al., 1998). Alguns pacientes se queixam de impaciência e dificuldade motora encontrando, dessa forma, problemas para achar uma posição confortável para descansar seus membros. Além do mais, o “travamento” da articulação braço-ombro, pode ser também um importante indicativo para o diagnóstico.
Dificuldades posturais no tronco também podem ser identificadas quando se é pedido ao paciente para ele se levante (com os braços cruzados) de uma cadeira por exemplo. Ele tende a caminhar vagarosamente por cerca de aproximadamente dez passos para depois, de maneira rápida, andar por um corredor. Sinais físicos adicionais que podem ser notados na primeira consulta incluem distonia do pé em pacientes jovens, o piscar dos olhos exibindo uma expressão de ansiedade no olhar e uma tendência a arrastar uma perna ao caminhar.
Juntamente com a bradicinesia, a progressão lenta, a apresentação unilateral com sinais assimétricos, o mexer da pupila em repouso e uma boa resposta à L-dopa ajudam a corroborar o diagnóstico da doença (Katzenschlager R et al., 2003; Gibb WR., 1989). De acordo com pesquisas feitas na Queen Square, o aparecimento de alucinações visuais e a hiposmia precoce também são sugestivos da doença de Parkinson (Hawkes C., 2004; Williams DR., 2005). Além do mais, foram feitas a utilização seletiva de testes de “odor” na Universidade da Pensilvânia para uma identificação de possíveis portadores da doença sendo, pois, útil em algumas situações clínicas (Katzenschlager R., 2004).
Alguns pacientes que apresentam dificuldades ao andar, apresentam uma modesta resposta de L-dopa podendo ser, assim, difícil de distinguir daqueles que possuem atrofia múltipla do sistema ou paralisia supranuclear progressiva. Para os portadores dessa doença, também existem os fatores de risco tais como hipertensão e antecedentes de derrames. Poucos pacientes com doença de Parkinson também têm insuficiência autonômica cardiovascular.
23
1.5 Uma visão sobre lesões neurológicas ocorrentes
A perda seletiva específica da região dopaminérgica bem como a perda de neurônios contendo neuromelanina de pares compactos da substancia negra são marcas patológicas do mal de Parkinson (Figura 11). Esta perda de células nervosas é acompanhada por três estruturas intraneuronais bem distintas: os corpos de Lewy (Figura 10), o corpo pálido e a neurite de Lewy. Os corpos de Lewy são subdivididos em corpos do tipo clássico (tronco cerebral) e corticais. A forma do tronco cerebral é uma forma de estrutura esférica de 8-30 m com um núcleo hialina rodeado por uma auréola periférica, e é composta por filamentos com 7-20 nm de largura com material granular denso e com estruturas vesiculares. Os “corpos pálidos” são grandes estruturas eosinofílicas arredondadas que frequentemente deslocam a neuromelanina e são antecessores dos corpos de Lewy (Ince P et al., 2008). O número de
neurônios da substância negra (3-4%) que contêm corpos de Lewy não é proporcional ao tempo de duração da doença. Este achado é consistente com a noção de que, ao contrário dos emaranhados neurofibrilares, os corpos de Lewy são continuamente formados e destruídos na substancia negra durante a doença (Greffard S et al., 1999). Uma agregação anormal de α -sinucleína (Figura 12) é o componente principal
Figura 10: Perda da substância negra no córtex cerebral.
Figura 9: Aglomerados proteicos de α–Sinucleína em um neurônio da substância negra de um paciente com Parkinson.
24 dos corpos de Lewy (Figura 9). Anticorpos de α-sinucleína pontilham os corpos de Lewy e os corpos neurite de Lewy e isso vem se tornando o padrão imune mais sensível para a aplicação de métodos histoquímicos de diagnóstico de rotina (Wakabayashi K et al., 2007).
α-sinucleína-positivo é uma coloração de ubiquitina-negativa citoplasmática (ponteada) que pode também ser visto nos neurônios pigmentados do tronco cerebral sem corpos de Lewy. Isto representa a fase inicial de uma acumulação anormal de α-sinucleína (Figura 12) (Kuusisto E et al., 2003). Corpos de Lewy corticais se ausentam do núcleo interno e são especialmente comuns em neurônios piramidais (de tamanho pequeno e médio) das camadas V e VI do córtex temporal, frontal, parietal, córtices insulares, cíngulo e o córtex entorrinal. Estes corpos estão presentes em quase todos os casos da doença em pequenas quantidades (Halliday G et al., 2007). A patologia neorocortical extensiva dos corpos de Lewy que, em muitos casos, são associados ao Parkinson é comum em pacientes com severa perda de memória como, por exemplo, no caso da doença de Alzheimer (Apaydin H et al., 2002; Braak H et al.,2005;.Kosaka K et al., 1984; Hurtig HI et al., 2000; Tsuboi Y et al., 2005; Jellinger KA, 2008)
Uma proporção substancial de pacientes não dementes com doença de Parkinson também possuem a patologia cortical de corpos de Lewy. Por conseguinte, os corpos de Lewy neocorticais não são necessariamente o correlato patológico da demência na doença de Parkinson (Parkkinen L et al., 2005; Colosimo C et al., 2003). A quantidade de proteínas β-amilóide corticais associadas parece ser o fator chave para o declínio cognitivo com o avanço da doença (Lashley T et al., 2008; Kalaitzakis ME et al., 2008;). A Heterogeneidade patológica com demência é ainda apoiada por um estudo que mostra que um longo curso de parkinsonismo (antes do aparecimento de demência) está associado com uma baixa frequência e contagem cortical de corpos de Lewy, apesar de uma grande perda da atividade de colina acetiltransferase (Ballard C et al., 2008)
Tornou-se evidente que poucos doentes (com α-sinucleína LRRK-2 e com mutações GBA), após a autópsia, apresentavam todas as alterações indistinguíveis daquelas encontradas
26
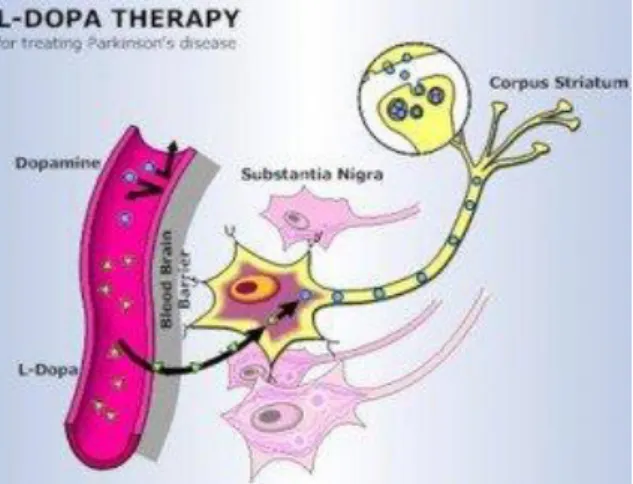
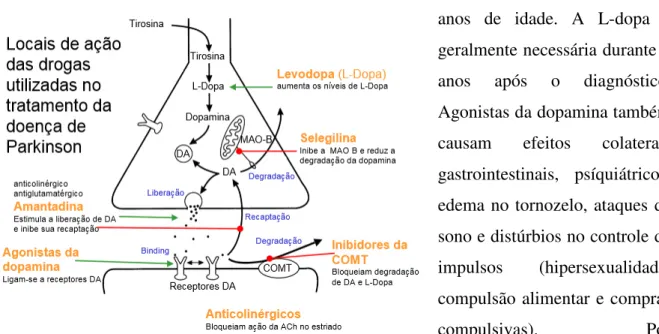
1.6 Tratamento
A doença de Parkinson ainda é uma doença progressiva e incurável. No entanto, o tratamento melhora substancialmente a qualidade de vida e a capacidade funcional do paciente. A L-dopa (Figura 13), em combinação com um inibidor de dopa-descarboxilase periférica (benserazida ou carbidopa), é o medicamento mais eficaz e deve ser sempre a opção de tratamento inicial para qualquer que seja a idade do paciente. Para a maioria das pessoas, o medicamento pode ser mantido ao longo dos primeiros cinco anos da doença em uma dosagem de 300-600 mg/dia. Embora não seja possível a predição exata da dose terapêutica para um determinado indivíduo, há melhorias nos sintomas motores dos pacientes
(de 20-70%) para qualquer dose presente no intervalo de 300-600 mg/dia. Dentro de uma ou duas semanas de tratamento inicial, a fadiga e a bradicinesia diminuem (Fahn S et al., 2004).
O tremor é muitas vezes é difícil de tratar e em alguns pacientes desaparece apenas depois de vários anos de tratamento, podendo indicar, dessa forma, um efeito de atraso farmacológico ou uma evolução da doença.
Fala, deglutição e instabilidade postural podem melhorar no início do tratamento, mas os sintomas axiais são geralmente menos sensíveis (Hely MA et al., 2008). Quando o paciente começa a fazer a ingestão de fármacos, os primeiros efeitos adversos podem incluir náuseas, anorexia e fraqueza. No entanto, a L-dopa é geralmente bem tolerada quando temos a dose medicamentosa aumentada progressivamente (Figura 14). No início, problemas neuropsiquiátricos, às vezes, podem ocorrer incluindo hipomania, depressão e delírio. Os agonistas de dopamina5 não-ergolínicos (pramipexol, ropinirol, rotigotina, e piribedil) são
drogas eficazes que, em contraste com a L-dopa, quando utilizadas como monoterapia, não provocam discinesias. Eles são um tratamento de primeira linha popular que é utilizado em
5 Estes aumentam a neurotransmissão dopaminégica.
Figura 13: Designação IUPAC e fórmula química do medicamento L-Dopa.
27 pacientes com menos de 55 anos de idade. A L-dopa é geralmente necessária durante 3 anos após o diagnóstico. Agonistas da dopamina também causam efeitos colaterais gastrointestinais, psíquiátricos, edema no tornozelo, ataques de sono e distúrbios no controle de impulsos (hipersexualidade, compulsão alimentar e compras
compulsivas). Por
conveniência, dependendo dos efeitos colaterais que o paciente venha a sentir, as vezes é necessário que este se abstenha de determinados medicamentos.
Os inibidores seletivos do tipo B da monoamina oxidase (selegilina e rasagilina) são bem tolerados e podem ser administrados uma vez ao dia, porém, são menos eficazes do que L-dopa ou outros agonistas dopaminérgicos. Esses inibidores seletivos do tipo B parecem retardar a progressão da doença quando seu uso é iniciado precocemente e são propostos como agentes modificadores da doença (Shoulson I., 1998). Dois estudos recentes mostram que o tratamento precoce com 1 mg de rasagilina ao dia, em comparação com tratamento tardio (6 meses mais tarde) leva a alguns resultados positivos (Clarke CE., 2008).
A amantadina é uma outra droga bem tolerada que tem leves efeitos “antiparkisonianos” e pode ser usado como tratamento inicial e, além do mais, apresenta propriedades antagonistas de glutamato que atua efetivamente no combate da discinesia em alguns pacientes (Del Dotto et al., 2001). A eficácia de cada uma destas drogas, bem como seus efeitos adversos precisam ser totalmente explicados ao paciente quando as opções de tratamento estão a ser consideradas (Rascol O et al., 2002; Miyasaki JM., 2006). Respostas associadas com placebo, que são particularmente significativas em pacientes com doença de Parkinson, podem levar a uma melhora inicial de 20% nas habilidades motoras. Esta melhoria pode ser mediada através de caminhos mesolímbicos dopaminérgicos (de la Fuente-Fernandez R et al., 2002; Goetz CG et al., 2008).
28 Ajustes na dose de L-dopa podem aumentar o
benefício terapêutico a longo prazo. A combinação de um inibidor da “catecol-O-metil-transferase” (entacapone) ou um inibidor da “monoamina-oxidase B ” (selegilina, rasagilina) com L-dopa pode ajudar a eliminar efeitos colaterais precoces (wearing-off6).
Além do mais, a substituição parcial por um agonista de dopamina, também poderia reduzir a discinesia decorrente da L-dopa (Rascol O et al., 2002; Miyasaki JM., 2006). Esta também está disponível em combinação com carbidopa e entacapone, apresentando vantagens na liberação padrão imediata de L-Dopa, reduzindo a frequência de flutuações motoras quando usada desde o começo (Figura 16).
Outra classe de fármacos também utilizada para o tratamento da doença são as drogas anticolinérgicas que podem reduzir alguns fenômenos dolorosos de distonias no início da doença (Poewe WH et al., 1988). Se estas abordagens não forem satisfatórias, o tolcapone (inibidor da cathecol-o-methil transferase) poderia ser utilizado como terapia de segunda linha de forma oral. Neste caso, a monitorização da função das enzimas hepáticas é obrigatória por causa da ocorrência de fatalidades (relatadas por insuficiência hepática), ainda que raras.
A aplicação de apomorfina subcutânea é um tratamento altamente eficaz para flutuações motoras refratárias que pode ajudar a restaurar a confiança dos pacientes para poderem sair de casa. No entanto, o sucesso deste procedimento depende do uso precoce da domperidona como uma droga anti-emética que, naturalmente, precisa ser acompanhado/suporte por enfermeiros especialistas. Embora os métodos de drogas aplicadas de forma subcutânea sejam promissores e viáveis em alguns casos, existe uma limitação desta abordagem no caso de quem apresenta um quadro de paniculite eosinofílica no local de injecção (podendo raramente ulcerar ou infeccionar comprometendo à absorção de drogas).
6A expressão wearing off refere-se ao reaparecimento ou piora de algum sintoma da doença de Parkison que
ocorre comumente duas ou mais horas depois da ingestão de Levodopa.
29 A administração entérica de uma formulação solúvel de L-dopa (Duodopa) através da gastro-jejunostomia é uma outra opção médica altamente eficaz para pacientes que não conseguiram ou estão relutantes em tentar a bomba de apomorfina. Algumas questões técnicas, incluindo bloqueio ou acotovelamento do tubo, deslocamento do cateter e infecção do estomago são outras complicações recorrentes deste processo (Frankel JP et al., 1990). Se o dispositivo “jejunostomico” se desligar, pode ocorrer raramente uma perfuração intestinal (Eggert K et al., 2008). Além disso, aminoácidos dietéticos de cadeia longa na barreira sangue-cérebro podem levar a um “switch-off” mesmo quando as concentrações de L-DOPA no plasma no estado estacionário são alcançadas (Frankel et al., 1989).
Tanto a apomorfina parentérica como a L-Dopa entérica produzem um fornecimento constante de droga dopaminérgica para o cérebro e reduzem os períodos refratários fora de imobilidade e discinesias em mais de 50%. No entanto, a evidência ainda é fraca para ambas as abordagens (Katzenschlager et al., 2005). Uma melhoria sustentada no desempenho motor, com uma grande redução dos movimentos involuntários induzidas por drogas, também pode ser conseguida por neurocirurgia funcional com estimulação cerebral profunda bilateral do núcleo subtalâmico ou o com a estimulação do segmento interno do globo pálido (Limousin P., 2008; Deuschl G et al., 2006). Problemas comportamentais incluindo abulia, depressão, redução da fluência verbal, ganho de peso, apraxia da abertura palpebral e dificuldade com ajustamento social foram relatados no quadro pós cirúrgico (Krack P et al., 2003). Já foi relatado que em alguns quadros infecciosos pode haver hemorragia intracerebral e propensão ao suicídio (Voon V et al., 2008).
Para além do declínio cognitivo em doentes idosos, há outra complicação tardia mais desafiadora da doença de Parkinson, que é a instabilidade postural. O que pode levar a medo de quedas com o aumento da imobilização e dependência dos pacientes. Assim sendo, as benzodiazepinas7 devem ser evitadas sempre que possível, porque estas aumentam o risco de
queda. A maioria das quedas ocorrem na direção frontal ou lateral. Isso ocorre por causa das assimetrias posturais e problemas de integração sensório-motora, juntamente com a falha de intensificação compensatória (Bloern BR et al., 2004). Existem maneiras de minimizar tais adversidades, tais como a fisioterapia hábil (que promove uma melhoria no andado), terapia cognitiva (para a locomoção em geral), exercícios (para a melhora no equilíbrio), treinamento para o ganho de força muscular (para que haja um aumento na mobilidade das articulações).
7“As benzodiazepinas são um grupo de fármacos ansiolíticos utilizados como sedativos, hipnóticos e relaxantes
30 Tudo isso é eficaz e muito bem vindo no
tratamento ( Keus SH et al., 2007). Exercícios físicos e mentais, praticados de forma regular, devem ser incentivados em todas as fases da doença e da vida.
Para minimizar a neurotoxicidade do tratamento com a droga isolada, foi sugerida a utilização de L-Dopa adsorvida em buckminsterfulereno (C60). Cálculos teóricos usando a teoria do funcional da densidade (DFT) procuraram confirmar a viabilidade dessa abordagem (ver Figura 17), o que propiciaria uma nova estratégia para o tratamento do Mal de Parkinson (Freire, V. N. et al., 2012).
Tabela 1: Distribuição dos remédios no tratamento do mal de Parkinson.
REMÉDIOS
Distribuídos na rede estadual Distribuídos na rede municipal
Tolcapone (100 mg) Biperideno (2 mg e 4 mg)
Pramipexol (0,125 mg , 0,250 mg e 1 mg)
Levodopa + Beserazida (100/25 mg e 200/50 mg)
Carbegolina (0,5 mg) Amantadina (100 mg)
31
1.7 Olhando para o futuro
Embora a expectativa de vida, o controle da bradicinesia e o controle dos tremores tenham melhorado com novos tratamentos para a doença de Parkinson, o controle da instabilidade postural e do comprometimento cognitivo são necessidades terapêuticas importantes ainda não satisfeitas. Além disso, nenhum tratamento neuroprotetor pode deter o processo da doença subjacente e a terapia dopaminérgica está longe da perfeição no controle da deficiência motora.
Algumas questões precisam ser resolvidas quando se trata da doença de Parkinson. Entre elas, podemos destacar a necessidade de uma classificação subjetiva global da alteração da gravidade da doença (Freed CR
et al., 2001; Paul G et al., 2006). A utilização de células-tronco (Figura 18) no tratamento da doença pode fornecer um suprimento ilimitado de neurônios dopaminérgicos quando estas se diferenciam em neurônios produtores de dopamina; Quando se usam células-tronco retiradas de embriões, no entanto, a melhora comportamental é limitada e existe um risco grande de formação de tumores (Laguna et al., 2008).
32 PARTE 2: NANOTECNOLOGIA E PARKINSON
Como foi visto na parte 1, a doença de Parkison é caracterizada pela degeneração dos neurônios dopaminérgicos nigrostriatais do mesencéfalo, resultando em bradicinesia, rigidez e os chamados tremores de repouso (Singh et al., 2007). Atualmente, a terapia de primeira linha para a doença é a administração oral de agonistas de dopamina como a Levodopa. Porém, à medida que a doença progride, a dosagem medicamentosa vai apresentando uma menor eficácia, fazendo com que as doses terapêuticas tenham que ser aumentadas ou mesmo combinadas com outras drogas, o que intensifica alguns efeitos colaterais indesejados. Para complementar o tratamento farmacológico, a estimulação cerebral profunda e o transplante de neurônios dopaminérgicos também foram explorados (Pollak et al, 2002;. Freed et al, 2001). Em tal contexto, a nanotecnologia (Figura 19) pode proporcionar uma solução possível para vencer muitos dos desafios no tratamento da doença de Parkinson, possibilitando a entrega de drogas específicas e promovendo o aumento de sua biodisponibilidade e de sua eficácia, ou ainda estimulando as células diretamente a nível molecular.
33
2.1 Uma visão sobre nanotecnologia
A nanotecnologia possibilita novas abordagens biotecnológicas e desempenha um papel bastante significativo em diversos contextos. Ela consiste no desenvolvimento de novos materiais, estruturas e
dispositivos funcionais na escala nanométrica (1-100 nm) capazes de interagir, por exemplo, com sistemas biológicos a um nível molecular. Assim, a nanotecnologia pode fornecer novas vias para a estimulação, resposta e interação de células e/ou com tecidos alvo a fim de induzir respostas fisiológicas
desejadas (Figura 20) enquanto minimizam-se os possíveis efeitos colaterais. Logo, a nanotecnologia pode gerar soluções para a superação dos obstáculos encontrados no tratamento de várias doenças, incluindo a doença de Parkinson8 (Morris K., 2004), uma vez
que com esta temos o transporte de algumas substâncias de forma mais específica bem como o aumento da biodisponibilidade e da eficácia de vários medicamentos. Isso ocorre por meio de um controle mais fino das interações com sistemas biológicos complexos, permitindo uma maior seletividade e maior rapidez de ação do que abordagens farmacológicas convencionais.
8Como dito anteriormente, nessa doença há vários sistemas de neurotransmissores envolvidos o que implica no
uso de muitos fármacos diariamente. Em geral, os pacientes não estão satisfeitos com o fato de tomarem 10 ou 12 comprimidos por dia. Um dos principais objetivos a serem alcançados é o desenvolvimento de apenas um comprimido que já tenha todas as quantidades de drogas necessárias a ser tomado uma vez ao dia.
34
2.2 Entendendo a barreira sangue cérebro (BBB) que dificulta a passagem de drogas no sistema nervoso central
Essa barreira é um mecanismo de seleção de moléculas para o parênquima cerebral que permite ao cérebro manter sua homeostase. A BBB é formada por membranas apicais, basais endoteliais polarizadas e por outras interfaces de tecidos em série (Kreuter et al., 2002). A complexidade funcional destas membranas é atribuída principalmente as células cerebrais endoteliais que mantem-se bem justapostas (Pardridge, 2005; Kabanov e Gendelman, 2007). Assim, as drogas precisam atravessar um conjunto de numerosas membranas para ganhar acesso ao cérebro (Figura 21) e, embora várias drogas tenham uma boa eficácia terapêutica nos seres humanos, sua entrega de forma precisa e eficiente ainda permanece um desafio (Pardridge, 2005; Collister e Albensi, 2005; Tyler e Federoff, 2006; Kabanov e Gendelman, 2007).
35
2.3Bioativadores promissores
Sistemas de entrega de fármacos ideais, in vivo, que seriam capazes de determinar a necessidade bem como a dosagem medicamentosa para que, em seguida, possa ser entregue automaticamente (LaVan DA et al., 2003). Estes sistemas baseiam-se em biosensores que dão informações sobre compostos químicos específicos (dizendo se há ou não sua presença, bem como sua quantidade) nos diferentes meios (Ochoteco E et al., 2006). É promissora a combinação adequada de biosensor na entrega de fármacos que, naturalmente, permite o controle em tempo real da dosagem de drogas de acordo com alterações no estado químico e fisiológico do meio. Um passo limitante na criação de sistemas de entrega controlada de fármacos tem sido o desenvolvimento de biosensores estáveis (Tao SL., 2003), uma vez que muito destes são reativos (Kerner W., 2006). No quesito de entrega de fármacos assistida por biosensores, a Diabetes foi a doença mais amplamente estudada. Há sistemas disponíveis que detectam níveis de glicose no sangue e liberam a insulina como resposta (Kerner W., 2006). Em relação à doença de Parkinson, ao contrário da Diabetes, tem sido desenvolvido biosensores para detecção de níveis plasmáticos de levodopa9 (Figura 22) (G.Linazasoro
2008).
Figura 22: Exemplo de um sensor de Levodopa.
9 O biossensor (biosenssor de Dopamina) é composto por uma matriz polimérica condutora, em que o composto
36
2.4. Mecanismos de transporte de drogas através da barreira sangue-cérebro empregando nanotecnologia
Mecanismos de transporte na BBB podem ser manipulados por drogas cerebrais. Estudos sobre a cinética de fluxo revelaram um movimento dependente da concentração dos compostos através da BBB em uma dada direção (Ma et al., 2005). A direção do fluxo é possível tanto do plasma para o cérebro como do cérebro para o plasma. Assim sendo, existe um fluxo líquido que é a diferença entre as duas taxas dos fluxos unidirecionais que é um fator determinante para que drogas atinjam concentrações terapêuticas no sistema nervoso central (Miller., 2002). Pequenas moléculas lipofílicas passam facilmente entre capilares sanguíneos, porém, as moléculas grandes ou hidrofílicas requerem canais de ATP, proteínas e/ou receptores para que possam passar.
Nessa linha de raciocínio, existem duas abordagens para entrega de drogas no sistema nervoso central: a abordagem molecular e a abordagem transportadora polimérica. Considerando a abordagem de drogas moleculares, há um direcionamento de enzimas específicas para as células do cérebro que são ativadas. Porém, esta
abordagem apresenta uma desvantagem que é a limitação da disponibilidade de medicamentos para as vias metabólicas. Pela abordagem do transporte polimérico empregam-se de veículos poliméricos que são administrados por via intravenosa ou por implantes de dispositivos cerebrais que administram, de forma sistemática, os sistemas de entrega de nano drogas10
(Figura 23) que têm a capacidade de controlar e orientar a libertação de vários agentes bioativos utilizados para o tratamento de doenças neuro-degenerativas (Girish et al., 2009). Alguns exemplos de transportadores poliméricos são nanopartículas poliméricas e outras nanoestruturas (Kreuter et al., 2002). Além do mais, vários estudos têm demonstrado que
10Um dos principais desafios é a necessidade de equilibrar a pequena escala dos dispositivos com as
quantidades de medicamentos que são clinicamente necessários.
37 nanopartículas poliméricas podem ser usadas para a entrega de droga no sistema nervoso central e em genes alvo (Calvo et al, 2002; Gupta et ai, 2003; Kreuter, 2004; Cui et al., 2005).
2.5. Nanopartículas poliméricas
Nanopartículas poliméricas se apresentam do tamanho de 10 a 100 nm (Muller e Keck, 2004). Se devidamente projetadas, podem ter alta capacidade de carregamento de drogas bem como de protegê-las contra a degradação (Figura 24) proporcionando, assim, maiores chances desta droga chegar ao cérebro. Elas são estáveis e podem ter como função final a liberação de fármacos no sistema nervoso central, uma vez que apresentam propriedades superfíciais que podem ser manipuladas a fim de evitar o reconhecimento pelos macrófagos do sistema reticuloendotelial (RES) (Behan et al., 2001). Nanopartículas poliméricas vem sendo utilizadas para a entrega de muitos fármacos, tais como doxorrubicina, no sistema nervoso central (Calvo et al, 2001; Alyaudtin et al, 2001;. Kreuter et al, 2003;. Steiniger et al, 2004). No entanto, existem alguns problemas a serem considerados nos sistemas de identificação de drogas à base de nanopartículas que são: o sistemático ataque enzimático na circulação periférica, a remoção das nanopartículas por sistemas de efluxo, a probabilidade de sequestro celular e a taxa de depuração de fármacos no cérebro.
38
2.6. Os nanotubos de carbono e nanofibras de eletrofiação
Os nanotubos de carbono estão sendo explorados para melhorar a estimulação elétrica no sistema nervoso central (Kabanov e Gendelman, 2007). Clinicamente, implantes funcionais de estimulação elétricas estão ganhando força para o tratamento da doença de Parkinson. O desenvolvimento de conjuntos de eletrodos à base de nanofibras de carbono comprimidas (para estimular o SNC) permite a injeção em locais de degeneração fazendo com que os substratos físicos e os sinais moleculares necessários possam estimular e apoiar a cicatrização do tecido no tratamento de doenças neurodegenerativas (Du Toit et al., 2007). O mecanismo envolvido no nanotubo de carbono, durante a estimulação neuronal, pode ser explicado em termos de um modelo de circuito neuronal (in vivo) que é cultivado em um substrato de nanotubo para afetar a estimulação via sináptica (simples e múltiplas) através das camadas de nanotubos de carbono. Estas interações podem também prover um acoplamento elétrico convencional, revelando assim novas abordagens para o entendimento básico da eletrofisiologia do sistema nervoso central.
Apesar dos benefícios descritos acima, os nanotubos de carbono são altamente tóxicos e podem causar a morte celular através de uma via de estresse oxidativo. Portanto, não são aplicados mais amplamente em pesquisas de entrega de drogas (Figura 25). Estudos para melhorar a biocompatibilidade e reduzir a toxicidade de nanotubos de carbono continuam em curso.
Nanofibras de eletrofiação foram confeccionadas inicialmente por Cooley e Morton em 1902 para explicar o efeito do campo elétrico externo em fluidos. Por volta de 1930, aplicou-se um campo elétrico produzido por eletrodos a um polímero de acetato-celulose. Feito isso, a solução foi posta para evaporar, produzindo um resíduo de nanofibras com os resíduos do que restou (Formhals, A., 1934). Nanofibras são mais seguras de sintetizar do que os nanotubos de carbono e representam menos risco de poluição do ar. Nanofibras de
40
2.7 Nanoentrega de genes para o tratamento da doença de Parkinson
In vivo, a transferência de genes utilizando vetores virais é uma estratégia promissora para ultrapassar a limitação da BBB no tratamento da doença de Parkison (Dass e Kordower, 2007). A terapia genética para a doença de Parkison teve inicio com estudos clínicos e agora está em fase de coleta de dados. Após numerosos desafios, os investigadores descobriram que a terapia envolvendo genes para a doença de Parkison pode ser factível (Kabanov e Gendelman, 2007). Além do mais, os anticorpos monoclonais11 terapêuticos já foram
estudados a mais de uma década atrás (Fiandaca et al., 2008). Os pesquisadores estão analisando a viabilidade do uso da nanotecnologia para promover a condensação dos plasmídeos do DNA em nanopartículas e entregá-las ao cérebro como um meio para interromper ou prevenir o processo neurodegenerativo (Suk et al., 2006).
2.8 Células tronco como terapia utilizando nanorobôs
Uma promissora terapia celular para as doenças neurodegenerativas foi demonstrada na implantação de diferentes tipos de células estaminais em modelos animais (Freed et al, 2001;. Kim et al, 2002;. Parati et at, 2003). Transplantes de células estaminais no cérebro de rato demonstraram uma reintegração de neurônios bem como uma recuperação parcial de déficit motor associado com a
deficiência de dopamina (Kim et al., 2002). Resultados semelhantes foram obtidos após o transplante de neurônios dopaminérgicos fetais em ensaios clínicos (Piccini et al., 2000). Assim sendo, é possível utilizar vários tipos de células estaminais para gerar neurônios dopaminérgicos. O processo de
11“Anticorpos monoclonais são anticorpos produzidos por um clone de um único linfócito B parental, que é
clonado e imortalizado, produzindo sempre os mesmos anticorpos, em resposta um agente patogénico”.
41 diferenciação de neurônios dopaminérgicos a partir células estaminais embrionárias, in vitro, apresenta-se como sendo um das formas mais eficazes para a geração de neurônios dopaminérgicos (Isacson, 2003; Barberi et al., 2003). Recentes avanços na clonagem terapêutica humana também permitem essa abordagem de gerar neurônios (Woo, 2004). Tanto diferenciação das células estaminais embrionárias in vitro, quanto o transplante de neurônios dopaminérgicos em modelos com animais, resultaram na integração funcional das células implantadas no cérebro e na recuperação parcial das funções motoras (Kim et al, 2002;. Barberi et al, 2003)
42 Muitos dispositivos médicos, baseados em nanotecnologia, são implantados a cada ano (Girish et al., 2009). No caso da doença de Parkinson,
estimuladores cerebrais profundos são rotineiramente implantados no sistema nervoso central (Rodríguez MC et al., 2000). Além do mais, existe também a possibilidade de entrega simultânea de medicamentos (antagonistas de glutamato, canabinóides e outros) ou de outras moléculas (fatores tróficos, enzimas, etc.) que são capazes de modular a atividade das estruturas de saída dos gânglios da base. Finalmente, biossensores implantados no corpo estriado do cérebro
e outros núcleos para monitorar os níveis de dopamina e outros neurotransmissores podem ser interessantes (Withtman RM., 2006), o que poderia ser obtido por meio de técnicas cirúrgicas assistidas por sensores de nanopartículas magnéticas (Figura 27) (Girish et al., 2009). O sensor biocompatível em conjunto com estas nanopartículas poderiam ser colocados em áreas específicas do cérebro por um campo magnético externo.
43
2.9 Desenvolvimento de Fulereno (C60) baseado em componentes neuroprotetores
Demonstrou-se que o componente principal de um conversor catalítico ou um derivado de fulereno podem conduzir a um eventual tratamento para a doença de Parkinson (Verma, 2000). Lesões mediadas por radicais livres são conhecidas por terem relevancia nos processos fisiológicos e em doenças relacionadas a perturbações isquêmicas, traumáticas e neurodegenerativas (Verma, 2000; Raghupathi et al, 2000; Gagliardi, 2000; Wilson e Gelb, 2002; Blass, 2003). Devido à sua reatividade, eles podem ativar vias bioquímicas indesejadas que resultam em danos celulares. Radicais livres danificam os componentes das membranas celulares, proteínas e materiais genéticos por
sofrerem oxidação (conhecidos como “estresse oxidativo”) (Dugan et al., 2001; Rzigalinski et al., 2006). Acredita-se que o estresse oxidativo desempenha um papel importante na doença de Parkinson. Espécies químicas, tais como superóxido, hidroxila, peroxinitrito (ONOO), e peróxido (H2O2) podem produzir uma série de alterações oxidativas, incluindo a fragmentação do DNA, peroxidação de lípidos das membranas celulares, diminuindo a produção de energia mitocondrial e a inativação de proteínas transportadoras (Mahadik e Mukherjee, 1996;. Dugan et al, 2001; Wilson e Gelb, 2002). Além do mais, algums sintomas
atribuídos à velhice, como a arteriosclerose, também são atribuídas à oxidação induzida por radicais livres. A medicina tem sido limitada no desenvolvimento de abordagens terapêuticas que neutralizam estes radicais livres danosos. Nesta perspectiva, há uma abordagem promissora que tem sido desenvolvida para que possamos ultrapassar este desafio: o desenvolvimento de compostos neuroprotetores de fulereno com base no fulereno (Figura 28) (Dugan et al, 2001; Silva, 2005).
44 Os fulerenos são moléculas em forma de esferas composto por 60 átomos de carbono (C60) nos quais algumas ligações são “distorcidas” devido ao arranjo pentagonal-hexagonal dos átomos. Fulerenos hidroxilados são moléculas de fulereno funcionalizadas com grupos hidroxila e que tem demonstrado possuir caráter antioxidante e, portanto, sendo capazes de captar radicais livres, reduzindo glutamatos e combatendo a excitotoxicidade e a morte celular por apoptose (Jin et al., 2000). O mecanismo de neuroproteção mediada por fulerenos hidroxilados é, em parte, devido à inibição dos canais de glutamato (Jin et al., 2000).
45
CONCLUSÕES
Embora os “shaking palsy” permaneçam um enigma desde quando James Parkinson relatou de forma pioneira suas características clínicas, o conhecimento sobre a doença se torna cada vez mais rico graças a novas descobertas científicas. Danos graves para a maioria das células nervosas contendo catecolaminérgicos no tronco cerebral são uma característica claramente demonstrada da patologia, ainda que os danos não se restrinjam a estas estruturas. Termos como doença de corpos de Lewy ou α-sinucleína podem ser úteis para patologistas moleculares, mas são inadequados à beira do leito. Estudos sobre a função das proteínas, identificação de genes de suscetibilidade, interação do processo da doença com o envelhecimento normal e a natureza de “gatilhos” ambientais, são necessários se quisermos desenvolver biomarcadores confiáveis e uma cura para este distúrbio de movimentos incapacitantes.
47
REFERÊNCIAS
Parkinson J. An Essay on the Shaking Palsy. London: Sherwood, Neely and Jones, 1817. Kempster PA, Hurwitz B, Lees AJ. A new look at James Parkinson’s Essay on the Shaking Palsy. Neurology 2007; 69: 482–85.
Bower JH, Maraganore DM, McDonnell SDK, Rocca WA. Incidence and distribution of parkinsonism in Olmsted County, Minnesota, 1976–1990. Neurology 1999; 52: 1214–20. de Rijk MC, Breteler MM, Graveland GA, et al. Prevalence of Parkinson’s disease in the elderly: the Rotterdam Study. Neurology 1995; 45: 2143–46.
Katzenschlager R, Head J, Schraq A, Ben-Shlomo Y, Evans A, Lees AJ. Fourteen-year fi nal report of the randomized PDRG-UK trial comparing three initial treatments in PD. Neurology 2008; 71: 474–80.
Twelves D, Perkins KS, Counsell C. Systematic review of incidence studies of Parkinson’s disease. Mov Disord 2003; 18: 19–31.
Stern GM. Did Parkinsonism occur before 1817 J Neurol Neurosurg Psychiatry 1989; (suppl): 11–12.
Tanner CM. Is the cause of Parkinson’s disease environmental or hereditary? Evidence from
twin studies. Adv Neurol 2003;91: 133–42
Allam,MF, Campbell MJ, Hofman A, Del Castillo AS, Fernandez-Crehuet Navajas R.
Smoking and Parkinson’s disease: systematic review of prospective studies. Mov Disord
2004; 19: 614–21.
Hernan MA, Zhang SM, Rueda-deCastro AM, Colditz GA, Ascherio A. Cigarette smoking
and the incidence of Parkinson’s disease in two prospective studies. Ann Neurol 2001; 50:
48
Ascherio A, Weisskopf MG, O’Reilly EJ. Coff ee consumption, gender, and Parkinson’s
disease mortality in the cancer prevention study II cohort: the modifying eff ects of estrogen. Am J Epidemiol 2004; 160: 977–84.
Ascherio A, Chen H, Schwarzschild MA, Zhang SM, Colditz GA, Speizer FE. Caff eine, postmenopausal estrogen, and risk of Parkinson‘s disease. Neurology 2003; 60: 790–95.
Fowler JS, Volkow ND, Wang GJ, et al. Brain monoamine oxidase A inhibition in cigarette smokers. Proc Natl Acad Sci USA 1996; 93: 14065–69.
Jankovic J. Are adenosine antagonists, such as istradefylline, caff eine, and chocolate, useful in the treatment of Parkinson’s disease? Ann Neurol 2008; 63: 267–69.
Elbaz A, Tranchant C. Epidemiologic studies of environmental exposures in Parkinson’s disease. J Neurol Sci 2007; 262: 37–44.
Thacker EL, Chen H, Patel AV, et al. Recreational physical activity and risk of Parkinson’s disease. Mov Disord 2008; 23: 69–74.
Tanner CM, Aston DA. Epidemiology of Parkinson’s disease and akinetic syndromes. Curr
Opin Neurol 200; 13: 427–30.
Paisan-Ruiz C, Jain S, Evans EW, et al. Cloning of the gene containing mutations that cause PARK8-linked Parkinson’s disease. Neuron 2004; 44: 595–600.
Healy DG Falchi M, O-Sullivan SS, et al. Phenotype, genotype, and worldwide genetic penetrance of LRRK2-associated Parkinson’s disease: a case-control study. Lancet Neurol 2008; 7: 583–90.
Schapira AH. Evidence for mitochondrial dysfunction in Parkinson’s disease—a critical
49 Olanow CW, McNaught KS. Ubiquitin-proteasome system and Parkinson’s disease. Mov Disord 2006; 21: 1806–23.
Narendra D, Tanaka A, Suen DF, Youle RJ. Parkin is recruited selectively to impaired mitochondria and promotes their autophagy.J Cell Biol 2008; 183: 795–803.
Doty RL, Bromley SM, Stern MB. Olfactory testing as an aid in the diagnosis of Parkinson’s
disease: development of optimal discrimination criteria. Neurodegeneration 1995; 4: 93–97.
Iranzo A, Santamaria J, Rye DB, et al. Characteristics of idiopathic REM sleep behavior disorder and that associated with MSA and PD. Neurology 2005; 65: 247–52.
Meseguer E, Taboara R, Sanchez V, Mena MA, Campos V, Garcia De Yebenes J. Life-threatening Parkinsonism induced by kava kava. Mov Disord 2002; 17: 193–96.
Sourkes TL. “Rational hope” in the early treatment of Parkinson’sdisease. Can J Physiol
Pharmacol 1999; 77: 375–82.
Cosentino C, Torrs L, Scorticati MC, Micheli F. Movement disorders secondary to adulterated medication. Neurology 2000; 55: 598–99.
Kempster PA, Williams DR, Selikhova M, Holton J, Revesz T, Lees AJ. Patterns of levodopa
response in Parkinson’s disease: a clinico-pathological study. Brain 2007; 130: 2123–28.
Levy G. The relationship of Parkinson disease with aging. Arch Neurol 2007; 64: 1242–46.
McKeith IG. Consensus guidelines for the clinical and pathologic diagnosis of dementia with Lewy bodies (DLB): report of the Consortium on DLB International Workshop. J Alzheimers Dis 2006; 9 (3 suppl): 417–23.
Grosset D, Lees AJ. Long duration asymmetric postural tremor in the development of
50 Cortes X, Soriano JB, Sanchez-Ramos JL, Azofra J, Almar E, Ramos J. European study of asthma. Prevalence of atopy in young adults of 5 areas in Spain. Spanish Group of European Asthma Study. Med Clin (Barc) 1998; 111: 573–77.
Katzenschlager R, Cardozo A, Avila Cobo MR, Tolosa E, Lees AJ. Unclassifi able parkinsonism in two European tertiary referral centres for movement disorders. Mov Disord 2003; 18: 1123–31.
Gibb WR, Lees AJ. The signifi cance of the Lewy body in the diagnosis of idiopathic
Parkinson’s disease. Neuropathol Appl Neurobiol 1989; 15: 27–44.
Katzenschlager R, Lees AJ. Olfaction and Parkinson’s syndromes: its role in diff erential
diagnosis. Curr Opin Neurol 2004; 17: 417–23.
Ince P, Clark B, Holton J, Revesz T, Wharton SB. Disorders of movement and systems
degenerations. In: Greenfi eld’s Neuropathology. Love S, Louis DN, Ellison DW, eds.
Arnold: London, 2008: 889–1030.
Greff ard S, Verny M, Bonnet AM, Seilhean D, Hauw JJ, Duyckaerts C. A stable proportion of Lewy body bearing neurons in the substantia nigra suggests a model in which the Lewy body causes neuronal death. Neurobiol Aging 2008; published online May 23. DOI:10.1016/j.neurobiolaging.2008.03.015.
Wakabayashi K, Tanji K, Mori F, Takahashi H. The Lewy body in Parkinson’s disease: molecules implicated in the formation and degradation of alpha-synuclein aggregates. Neuropathology 2007; 27: 494–506.
Kuusisto E, Parkkinen L, Alafuzoff I. Morphogenesis of Lewy bodies: dissimilar incorporation of alpha-synuclein, ubiquitin, and p62. J Neuropathol Exp Neurol 2003; 62: 1241–53.
Halliday G, Hely M, Reid W, Morris J. The progression of pathology in longitudinally
51 Apaydin H, Ahlskog JE, Parisi JE, Boeve BF, Dickson DW. Parkinson disease neuropathology: later-developing dementia and loss of the levodopa response. Arch Neurol 2002; 59: 102–12.
Braak H, Rub U, Jansen Steur ER, Del Tredici K, de Vos RA. Cognitive status correlates with neuropathologic stage in Parkinson disease. Neurology 2005; 64: 1404–10.
Kosaka K, Yoshimura M, Ikeda K, Budka H. Diff use type of Lewy body disease: progressive dementia with abundant cortical Lewy bodies and senile changes of varying degree—a new disease? Clin Neuropathol 1984; 3: 185–92.
Hurtig HI, Trojanowski JQ, Galvin J, et al. Alpha-synuclein cortical Lewy bodies correlate
with dementia in Parkinson’s disease. Neurology 2000; 54: 1916–21.
Tsuboi Y, Dickson DW. Dementia with Lewy bodies and Parkinson’s disease with dementia:
are they diff erent? Parkinsonism Relat Disord 2005; 11 (suppl 1): S47–51.
Jellinger KA, Attems J. Prevalence and impact of vascular and Alzheimer pathologies in Lewy body disease. Acta Neuropathol 2008; 115: 427–36.
Parkkinen L, Kauppinen T, Pirttila T, Autere JM, Alafuzoff I. Alpha-synuclein pathology does not predict extrapyramidal symptoms or dementia. Ann Neurol 2005; 57: 82–91.
Parkkinen L, Pirttila T, Tervahauta M, Alafuzoff I. Widespread and abundant alpha-synuclein pathology in a neurologically unimpaired subject. Neuropathology 2005; 25: 304–14.
Colosimo C, Hughes AJ, Kilford L, Lees AJ. Lewy body cortical involvement may not
always predict dementia in Parkinson’s disease. J Neurol Neurosurg Psychiatry 2003; 74:
52 Lashley T, Holton JL, Gray E, et al. Cortical alpha-synuclein load is associated with
amyloid-beta plaque burden in a subset of Parkinson’s disease patients. Acta Neuropathol 2008; 115:
417–25.
Kalaitzakis ME, Graeber MB, Gentleman SM, Pearce RK. Striatal beta-amyloid deposition in Parkinson disease with dementia. J Neuropathol Exp Neurol 2008; 67: 155–61.
Ballard C, Ziabreva I, Perry R, et al. Diff erences in neuropathologic characteristics across the Lewy body dementia spectrum. Neurology 2006; 67: 193134.
Kordower JH, Chu Y, Hauser RA, Freeman TB, Olanow CW. Lewy body-like pathology in long-term embryonic nigral transplants in
Parkinson’s disease. Nat Med 2008; 14: 504–06.
Li JY, Englund E, Holton JL, et al. Lewy bodies in grafted neurons in subjects with
Parkinson’s disease suggest host-to-graft disease propagation. Nat Med 2008; 14: 501–03.
Fahn S, Oakes D, Shoulson I, et al. Levodopa and the progression of Parkinson’s disease. N Engl J Med 2004; 351: 2498–508.
Hely MA, Reid WG, Adena MA, Haliday GM, Morris JG. The Sydney multicenter study of
Parkinson’s disease: the inevitability of dementia at 20 years. Mov Disord 2008; 23: 837–44.
Parkison Study Group. A controlled trial of rasagiline in early Parkinson disease: the TEMPO Study. Arch Neurol 2002; 59: 1937–43.
Shoulson I. DATATOP: a decade of neuroprotective inquiry. Parkinson Study Group. Deprenyl and tocopherol antioxidative therapy of parkinsonism. Ann Neurol 1998; 44 (3 suppl 1): S160–66.
Clarke CE. Are delayed-start design trials to show neuroprotection in Parkinson’s disease