Universidade de Trás-os-Montes e Alto Douro
Prevalência da dirofilariose (D. immitis) em cães e
gatos do distrito de Braga
Dissertação de Mestrado Integrado em Medicina Veterinária
Raquel Rodrigues Alves Orientadores:
Professora Doutora Maria João Pires, UTAD Professora Doutora Elena Carretón Gomez, ULPGC
ii
Universidade de Trás-os-Montes e Alto Douro
Prevalência da dirofilariose (D. immitis) em cães e
gatos do distrito de Braga
Dissertação de Mestrado Integrado em Medicina Veterinária
Raquel Rodrigues Alves
Orientadores: Professora Doutora Maria João Pires, UTAD Professora Doutora Elena Carretón Gomez, ULPGC
Composição do Júri:
______________________________________________________________________ ______________________________________________________________________ ______________________________________________________________________
iii
Declaração
Declaro que esta dissertação de mestrado é resultado da minha pesquisa e trabalho pessoal e das orientações das minhas orientadora e coorientadora. O conteúdo é original e as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição para obtenção de qualquer grau académico.
Vila- Real, 29 de agosto de 2018
v
Agradecimentos
Agora que esta etapa está prestes a ser concluída, gostaria de agradecer a todos aqueles que de alguma forma, contribuíram para que eu chegasse até aqui.
À minha orientadora, Professora Doutora Maria João Pires, por sempre se ter mostrado disponível para me ajudar em todas as minhas questões, pelo auxílio com todas as questões logísticas do estudo, e por toda a calma, amabilidade e compreensão transmitida em todos os momentos.
À minha coorientadora, a Professora Doutora Elena Carretón Gomez e à equipa de Cardiologia da Universidad de Las Palmas de Gran Canaria, em particular à Doutora Yaíza Falcón, pela forma como me receberam e integraram com toda a amabilidade e por se mostrarem sempre disponíveis para me receber e ajudar quer durante a minha estadia no Hospital Clínico Veterinário, em Gran Canária, como por e-mail.
A toda a equipa de médicos veterinários, enfermeiros e auxiliares do Hospital Veterinário de Braga, pela oportunidade de estágio concedida, pela aprendizagem proporcionada, ambiente de profissionalismo e simpatia ao longo de todos estes anos. Um obrigada muito especial à Dra. Manuela Machado por ser sempre uma profissional incansável e um exemplo a seguir e que tanto me ajudou na colheita das amostras para o estudo.
A todas as clínicas participantes no estudo, à associação CAPA e à Dra. Liliana Carvalho do Centro de recolha oficial do município de Braga como aos proprietários dos animais objeto deste estudo, pela gentileza em colaborar.
Á empresa UranoVet pela amabilidade em fornecer os testes que foram essenciais para a realização deste estudo e ao Dr. Rodrigo Morchón do laboratório da Universidade de Salamanca, que permitiu que a análise das amostras dos gatos fosse possível.
À minha incrível família, em especial ao meu pai, que me acompanhou nas diversas viagens pelo distrito para deixar material e recolher amostras, contribuindo enormemente para o sucesso deste estudo e à minha mãe e irmã, por serem o meu porto seguro e por toda a força e apoio incondicional ao longo destes anos.
vi Ao meu namorado, por suportar as longas ausências, por me ajudar sempre a lidar com as muitas frustrações decorrentes deste curso e deste projeto e por todo o seu amor, carinho e apoio incondicional ao longo dos anos.
Às minhas incansáveis colegas de casa, Joana e Bia e à Sílvia, por terem sido as amigas perfeitas, por terem estado ao meu lado ao longo destes 6 anos maravilhosos, por toda a sua amizade que me ajudou a enfrentar este curso e por nunca me terem deixado desistir, mesmo quando o pânico se instalava.
vii
Resumo
A dirofilariose cardiopulmonar é uma doença parasitária causada pelo nemátode da espécie Dirofilaria immitis, que é transmitido por um vetor e cujos hospedeiros definitivos são principalmente os cães, mas que também tem sido relatada noutros animais, nomeadamente nos gatos domésticos. Esta é uma doença com distribuição mundial, que tem manifestado tendências de expansão para locais previamente livres da doença e Portugal é considerado um país onde a infeção é endémica. Assim, o principal objetivo deste trabalho foi determinar a prevalência e seroprevalência da infeção causada por Dirofilaria immitis em cães e gatos do distrito de Braga.
No presente trabalho foram analisadas amostras de soro de 318 cães e 84 gatos, colhidas em distintas zonas do distrito de Braga. No caso dos cães, 157 eram machos e 161 eram fêmeas, de distintas raças e idades compreendidas entre os 6 meses e os 18 anos. As amostras dos cães foram testadas com recursos a um teste rápido imunocromatográfico. No que diz respeito aos gatos eram 42 machos e 42 fêmeas, também de distintas raças e idades entre os 8 meses e os 20 anos. As suas amostras foram analisadas com recurso a técnicas serológicas que visam a deteção de anticorpos anti-DiSA e anti-WSPr.
Durante o período do estudo, encontrou-se uma prevalência de 0% em cães e uma seroprevalência de cerca de 8,3% (7 animais) no caso dos gatos, o que denota um aumento em relação a um estudo previamente publicado. A média de idades dos gatos positivos é de 7,1 anos, com um desvio padrão de 5,5 anos. Quanto ao género, 71,4% dos gatos positivos eram machos (5 gatos), e os restantes 28,6% eram fêmeas (2 gatos). A prevalência mais elevada, foi registada nos gatos de habitat misto (indoor/outdoor), 57,1% (4 gatos). Já a prevalência mais baixa corresponde aos gatos exclusivamente indoor (1 gato).
Este estudo vem demonstrar a importância de incluir a dirofilariose cardiopulmonar na lista de diagnósticos diferenciais em gatos que habitem esta zona do país e que apresentem sinais clínicos compatíveis com a doença. Além disso, serve para sensibilizar a comunidade médico-veterinária e os tutores para esta doença, que pode ser fatal e cujos sinais clínicos são extremamente inespecíficos, especialmente em gatos.
ix
Abstract
Heartworm disease is a vector-borne parasitic disease caused by the nematode Dirofilaria immitis, whose definitive hosts are mainly dogs, but which has also been reported in other animals, particularly in domestic cats. This is a ubiquitous disease, which has manifested expansion tendencies to sites previously free of the disease and Portugal is considered a country where the infection in endemic. Thus, the main objective of this study was to determine the prevalence and seroprevalence of heartworm disease caused by Dirofilaria immitis in dogs and cats in the district of Braga.
In this study, serum samples from 318 dogs and 84 cats were collected from different parts of the district of Braga. When it comes to dogs, 157 were males and 161 females, of different breeds and ages between 6 months and 18 years. The dog samples were assayed with a rapid immunochromatographic test. For cats, 42 were males and 42 females, also of different breeds and ages between 8 months and 20 years. Their samples were analyzed using serological techniques that aim the detection of DiSA and anti-WSPr antibodies.
During the study period, there was an absence of prevalence in dogs and a prevalence of about 8.3% (7 animals) in cats, which indicates an increase if we compare it to a previously published study. The mean age of positive cats is 7.1 years, with a standard deviation of 5.5 years. As for gender, 71.4% of the positive cats were males (5 cats), and the remaining 28.6% were females (2 cats). The highest prevalence was recorded in mixed habitat cats (indoor / outdoor), 57.1% (4 cats). On the other hand, the lowest prevalence corresponds to exclusively indoor cats (1 cat).
This study demonstrates the importance of including heartworm disease in the list of differential diagnoses in cats that live in this area of the country and that present clinical signs compatible with the disease. In addition, it serves to sensitize the veterinary community and tutors for this disease, which can be fatal and whose symptomatology is extremely non-specific, especially in cats.
x Índice Geral Declaração ... iii Agradecimentos ... v Resumo ... vii Abstract ... ix
Índice de Figuras ... xvii
Índice de tabelas ... xxi
Índice de anexos ... xxiii
Lista de abreviaturas e símbolos ... xxiv
I. Introdução ... 1
II. Dirofilariose cardiopulmonar ... 3
1. Transmissão ... 3
1.1 Fatores favoráveis para a Transmissão... 4
2. Ciclo de vida ... 5
3. Hospedeiros e reservatórios ... 7
4. O papel da Wolbachia na dirofilariose cardiopulmonar ... 7
5. Dirofilariose cardiopulmonar no Cão ... 9
5.1. Prevalência... 9
xi
5.1.2. Prevalência em Portugal ... 10
5.1.2.1. Zona Norte... 10
5.1.2.2. Zona Centro ... 10
5.1.2.3. Zona Sul ... 10
5.1.2.4. Região Autónoma da Madeira e região autónoma dos Açores ... 11
5.2. Fisiopatologia ... 11
5.3. Sinais clínicos ... 14
5.4. Diagnóstico ... 15
5.4.1. Métodos Serológicos ... 15
5.4.1.1. Pesquisa de Antigénios Circulantes ... 15
5.4.1.2. Pesquisa de microfilárias ... 16
5.4.2. Métodos clínicos e imagiológicos ... 17
5.4.2.1. Radiografia Torácica ... 17
5.4.2.2. Ecocardiografia ... 18
5.4.2.3. Outros métodos diagnósticos ... 19
a) Hemograma ... 19
b) Perfil de Coagulação ... 19
c) Perfil Hepático e Perfil Renal ... 20
d) Biomarcadores de lesão cardiopulmonar ... 20
xii
5.6. Tratamento da dirofilariose cardiopulmonar ... 21
5.6.1. Protocolo recomendado pela American Heartworm Society ... 21
6. Dirofilariose cardiopulmonar no Gato ... 24
6.1. Prevalência... 24
6.1.1. Prevalência na Europa ... 24
6.1.2. Prevalência em Portugal ... 24
6.1.3. Prevalência em gatos indoor vs. gatos outdoor ... 26
6.2. Fisiopatologia ... 26
6.3. Diagnóstico ... 28
6.3.1. Métodos Serológicos ... 28
6.3.1.1. Teste de Deteção de Antigénios ... 28
6.3.1.2. Deteção de microfilárias... 29
6.3.1.3. Deteção de Anticorpos ... 29
6.3.2. Métodos imagiológicos ... 30
6.3.2.1. Radiografia Torácica ... 30
6.3.2.2. Ecocardiografia ... 31
6.4. Comparação entre o Síndrome HARD e a dirofilariose crónica ... 31
6.5. Prevenção da dirofilariose cardiopulmonar ... 32
6.6. Tratamento da dirofilariose cardiopulmonar ... 32
xiii
6.6.2. Animais com Alterações Pulmonares ... 33
6.6.3. Animal com Síndrome HARD ... 33
6.6.4. Considerações gerais do tratamento ... 33
III. Estudo da prevalência da infeção por D. immitis em Cães e Gatos no distrito de Braga 35 1. Introdução e Objetivos... 35
2. Materiais e métodos ... 36
2.1. Caracterização da área geográfica em estudo ... 36
2.2. População em estudo ... 37
2.2.1. Amostras de cães ... 37
2.2.2. Amostra de gatos ... 38
2.3. Caracterização da população alvo ... 39
2.3.1. Cães ... 39 2.3.1.1. Critérios de inclusão ... 39 2.3.1.2. Critérios de exclusão ... 39 2.3.2. Gatos ... 39 2.3.2.1. Critérios de inclusão ... 39 2.3.2.2. Critérios de exclusão ... 39
2.4. Realização e análise dos inquéritos ... 40
xiv
2.6. Pesquisa de antigénios de D. immitis em cães (UranoTest Dirofilaria®) ... 41
2.6.1. Interpretação dos resultados do teste ... 42
2.7. Pesquisa de anticorpos de D. immitis em gatos ... 43
2.8. Análise estatística ... 44
3. Resultados ... 45
3.1. Cães ... 45
3.1.1. Prevalência da infeção ... 45
3.1.2. Caracterização da amostra em estudo ... 45
3.1.2.1. Raça dos cães ... 45
3.1.2.2. Idade dos cães ... 46
3.1.2.3. Género dos cães ... 47
3.1.2.4. Habitat dos cães ... 47
3.1.2.5. Estatuto de vacinação dos cães ... 48
3.1.2.6. Desparasitação interna ... 48
3.1.2.7. Desparasitação externa ... 48
3.1.2.8. Saídas para fora do distrito ... 49
3.2. Gatos ... 49
3.2.1. Seroprevalência da infeção ... 49
3.2.2. Caracterização da amostra em estudo ... 49
xv
3.2.2.2. Idade dos gatos ... 50
3.2.2.3. Raça dos gatos ... 51
3.2.2.4. Habitat dos gatos ... 51
3.2.2.5. Estatuto de vacinação dos gatos ... 52
3.2.2.6. Desparasitação externa ... 52
3.2.2.7. Desparasitação interna ... 52
3.2.2.8. Saídas para fora dos limites do distrito ... 52
3.2.3. Caracterização dos gatos que apresentaram resultados positivos ... 53
4. Discussão ... 57
5. Conclusão ... 61
IV. Bibliografia ... 62
xvii
Índice de Figuras
Figura 1 - Fatores responsáveis pela disseminação da infeção por D. immitis.. ... 4 Figura 2- Ciclo de vida de D. Immitis no cão. L1 a L4 – estádios larvares; L5 – adulto imaturo; Mf – Microfilárias. ... 5 Figura 3 - Distribuição da dirofilariose cardiopulmonar (D. immitis) em cães até 2001 e posteriormente até 2012... 9 Figura 4 - Fisiopatologia da dirofilariose cardiopulmonar no cão.. ... 12 Figura 5 - Esquematização do movimento retrógrado dos parasitas e da sua chegada à veia cava. ... 13 Figura 6- Ascite e caquexia cardíaca num cão com dirofilariose cardiopulmonar. Cão sem raça definida, de 8 anos que apresentava Síndrome de veia cava.. ... 14 Figura 7 - Interpretação dos resultados do teste de antigénios (Ag) e de deteção de Microfilárias (Mf).. ... 16 Figura 8 - A: Radiografia em projeção latero-lateral (LL) de um cão sem raça definida, de 7 anos, com dirofilariose cardiopulmonar. De notar a presença de áreas focais de parênquima pulmonar com aumento da densidade (mais radiopacas), principalmente nos
lobos pulmonares caudais. Note-se ainda o aumento da silhueta cardíaca direita. B: Radiografia em projeção dorso-ventral (DV) do mesmo cão da figura 8A, em que se
pode observar o aumento da silhueta cardíaca direita, com aspeto de “D invertido”.. .. 18 Figura 9 - Ecocardiografia em projeção paraesternal direita, eixo curto, em que se observa o trato de saída do ventrículo direito e se observa uma linha hiperecogénica (seta), que representa um parasita adulto na artéria pulmonar principal.. ... 19 Figura 10 - Situação epidemiológica da dirofilariose cardiopulmonar nos gatos de Portugal Continental. ... 25
xix Figura 11- Concelhos onde se procedeu à recolha de amostras de sangue para inclusão no
presente estudo epidemiológico... 37
Figura 12 - Exemplo dos dossiers que foram entregues em cada local que participou no estudo. ... 40
Figura 13- Material necessário para a colheita de uma amostra... 41
Figura 14 - Metodologia de realização do teste. ... 42
Figura 15 - Interpretação dos diferentes resultados que podemos obter no teste. ... 42
Figura 16 - Representação gráfica das raças com mais de três indivíduos na população total (frequência absoluta expressa em número de indivíduos); SRD – sem raça definida. ... 45
Figura 17 - Representação em frequência relativa das faixas etárias da população da amostra em anos. ... 46
Figura 18 - Caracterização da amostra em estudo de acordo com o género (frequência relativa). ... 47
Figura 19 - Caracterização do tipo de habitat da população (frequência relativa). ... 47
Figura 20 - Representação gráfica do estatuto vacinal e de desparasitação interna e externa dos animais da população (frequência absoluta representada em número de indivíduos). ... 48
Figura 21- Prevalência da infeção na população dos gatos (frequência relativa). ... 49
Figura 22 - Representação dos intervalos de idades da população da amostra (frequência relativa). ... 50
Figura 23 - Distribuição dos animais da população segundo a sua raça (frequência relativa); EC - europeu comum. ... 51
xxi Figura 24- Distribuição dos animais da população segundo o seu tipo de habitat (frequência relativa). ... 51 Figura 25- Representação do estatuto de vacinação e desparasitação interna e externa da população (Frequência relativa). ... 53 Figura 26 - Caracterização segundo a raça e o género dos gatos da população que apresentaram resultados positivos no teste de pesquisa de anticorpos, (frequência relativa); EC – Europeu comum. ... 53 Figura 27- Caracterização segundo o género e a idade dos gatos da população que apresentaram resultados positivos no teste de pesquisa de anticorpos (frequência relativa). ... 54 Figura 28 – Caracterização segundo o seu habitat dos gatos que apresentaram resultados positivos no teste de pesquisa de anticorpos (frequência relativa). ... 55 Figura 29 - Caracterização segundo o estatuto de vacinação e desparasitação interna e externa dos gatos da população que apresentaram resultados positivos no teste de pesquisa de anticorpos (frequência relativa). ... 55
Índice de tabelas
Tabela 1 - Etiologia dos sinais clínicos mais frequente num cão com dirofilariose cardiopulmonar ... 14 Tabela 2 - Protocolo de tratamento adulticida recomendado pela American Heartworm Society. ... 22 Tabela 3 - Lista dos sinais clínicos mais frequentes em gatos com dirofilariose cardiopulmonar. ... 28
xxiii Tabela 4 - Critérios de diagnóstico segundo as provas realizadas. ... 30 Tabela 5 - Diferenciação entre Síndrome Hard e dirofilariose crónica. ... 31 Tabela 6 - Distribuição das amostras de cães e de gatos segundo o local e o concelho de onde são provenientes. ... 38
Índice de anexos
Anexo I – Questionário para os tutores……….….xxviii Anexo II – Declaração de consentimento informado………xxix Anexo III- Folha de explicação do processamento das amostras………..xxx
xxiv
Lista de abreviaturas e símbolos
º C - Graus Celsius % - Percentagem µl – Microlitro
A. reconditum - Acanthocheilonema reconditum
Ac - anticorpos Ag - antigénios
AHS – American Heartworm Society cm - Centímetros
BID – duas vezes por dia
BSA – Solução de albumina de soro bovino D. immitis - Dirofilaria immitis
D. repens - Dirofilaria repens DO – Densidade ótica
DiSA – Extrato antigénico somático de D. immitis DV – Dorso-ventral
EC – Europeu Comum
ELISA - Enzyme-Linked Immunosorbent Assay HARD – Heartworm associated respiratory disease
xxv INE - Instituto Nacional de Estatística
IV - Intravenoso IM - Intramuscular Kg – quilograma
L1 – Primeiro estádio larvar L2 – Segundo estádio larvar L3 - Terceiro estádio larvar L4 – Quarto estádio larvar L5 – Adulto imaturo LL – Latero-lateral Mf - Microfilária
mg/Kg - Miligrama por quilograma ml - mililitro
nm – nanómetro
PO - per os
rpm - Rotações por minuto SID – Uma vez por dia SRD – Sem raça definida
1
I. Introdução
A dirofilariose cardiopulmonar é uma doença com distribuição mundial (Dantas-Torres e Otranto, 2013), causada por um nematode, a Dirofilaria Immitis que é transmitida por insetos vetores (Carretón et al., 2014), geralmente do género Culex, Aedes e Anopheles (Carretón et al, 2012).
Afeta geralmente animais de companhia, tais como o cão, o gato e o furão, mas também pode afetar carnívoros selvagens, nomeadamente o coiote, o lobo e a raposa (Carretón, 2012; Carretón et al., 2012; Simón et al., 2012). Tanto os cães domésticos como os carnívoros selvagens são hospedeiros definitivos para a D. immitis, sendo considerados os principais reservatórios da infeção. Embora os gatos e os furões, apresentem uma microfilaremia baixa ou transitória, também podem ser uma fonte de infeção para os mosquitos vetores durante os curtos períodos de tempo em que apresentam microfilárias circulantes (Carretón, 2012; American Heartworm Society, 2014; Meireles, et al, 2014). A dirofilariose cardiopulmonar, tal como o nome indica, causa sinais clínicos a nível pulmonar e cardíaco, que em cães são geralmente a tosse, a dispneia, a taquipneia, a inapetência, a perda de peso e a intolerância ao exercício (Carretón et al., 2012; American Heartworm Society, 2014b). Em gatos, no entanto, esta doença pode passar despercebida, sendo que os sinais clínicos podem ser vagos ou transitórios (Nelson, 2008; American Heartworm Society, 2014a) ou então o animal pode apresentar sinais cardiorrespiratórios tais como os previamente descritos para os cães, aos quais se somam os vómitos intermitentes, os sinais neurológicos e a morte súbita (Nelson, 2008; Lee e Atkins, 2010; Méndez et al, 2012).
Tendo em conta que a dirofilariose é considerada uma doença cosmopolita (Carretón et al., 2012) e com tendências emergentes (Traversa et al, 2010; Simón et al., 2012), é pertinente estudar a sua prevalência em locais cuja prevalência é baixa ou não está estudada, para poder tirar conclusões acerca do surgimento da doença em áreas previamente consideradas não endémicas.
Por este motivo, surgiu a ideia de realizar este estudo, em colaboração com várias clínicas, hospitais, associações e com o Centro de recolha Oficial de Braga, para tentar perceber
2 se o distrito de Braga permanecia ainda uma região não endémica de dirofilariose cardiopulmonar, ou se as alterações ambientais fruto do aquecimento global, as mudanças na dinâmica populacional e sazonal do vetor ou ainda os movimentos nas populações de animais (Traversa et al., 2010) levaram a um aumento da infeção por D. Immitis no distrito de Braga.
3
II. Dirofilariose cardiopulmonar
A dirofilariose cardiopulmonar é uma doença cosmopolita e de distribuição mundial, que geralmente se localiza em zonas com elevada temperatura e humidade durante pelo menos uma parte do ano (Carretón et al., 2012).
Isto ocorre porque o desenvolvimento e a sobrevivência dos insetos vetores são influenciados principalmente pela temperatura, humidade e disponibilidade de água, portanto, um dos fatores mais importantes que favorece a dispersão e disseminação de doenças transmitidas por vetores, é o aquecimento global (Traversa et al., 2010).
1. Transmissão
São várias as espécies de mosquitos que servem como vetores de dirofilariose cardiopulmonar, geralmente depois de adquirirem microfilárias, aquando da ingestão do sangue de um cão. No caso dos gatos, quer indoor como outdoor, também estes são infetados por mosquitos que adquiriram microfilárias provenientes de cães (Calvert e Thomason, 2016).
Está demonstrado que algumas espécies de mosquitos são mais competentes como vetores de dirofilariose cardiopulmonar do que outras. Inclusive dentro da mesma espécie, determinadas estirpes ou indivíduos são mais eficientes a transmitir da doença do que outras (Cancrini e Gabrielli, 2007).
No que diz respeito aos mosquitos, dentro da família culicidae, existe uma enorme diversidade; são mais de 3000 as espécies que se adaptaram e que se estendem desde áreas costeiras a cadeias montanhosas (Simón et al., 2012). No entanto, existem três géneros que estão geralmente associados à transmissão da D. immitis: Culex, Aedes e Anopheles (Cancrini e Gabrielli, 2007; Carretón et al., 2012).
Segundo Ferreira et al. (2015), em Portugal, as espécies mais frequentemente responsáveis pela transmissão de D. immitis são Culex Theileri, com uma prevalência de 63,48%, seguida por Culex pipiens com 21,19% e por Aedes (Ochlerotatus) caspius com 6,56%.
4 1.1 Fatores favoráveis para a Transmissão
A situação epidemiológica da dirofilariose cardiopulmonar está a alterar-se de forma rápida; apesar dos esforços feitos para prevenir e controlar a infeção em cães, a dirofilariose cardiopulmonar canina está a aumentar em áreas endémicas, e a espalhar-se para áreas previamente não endémicas (Genchi et al., 2009; Simón et al., 2009).
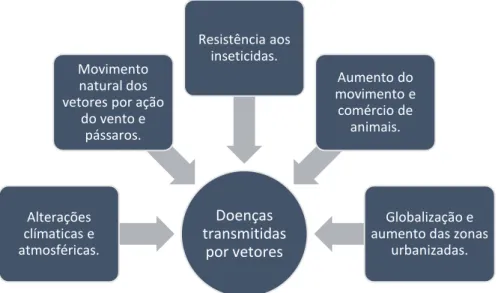
Tal como representado na figura 1, existem vários fatores que neste momento contribuem para a crescente tendência de aparecimento da infeção por D. immitis.
A transmissão de D. Immitis por mosquitos é extremamente dependente de um clima adequado, que permita o desenvolvimento larvar do parasita nos insetos vetores, sendo as temperaturas ambientais os principais fatores que favorecem a disseminação desse parasita (Traversa et al., 2010; American Heartworm Society, 2014b).
O desenvolvimento de larvas L3 infeciosas requer 8 a 10 dias a 28 - 30 °C, 11 a 12 dias a 24 °C e 16 a 20 dias a 22 °C. Abaixo de 18 °C, o desenvolvimento é interrompido, embora possa ser reiniciado quando a temperatura aumenta acima deste limite (Cancrini e Gabrielli, 2007).
Por isso é que no Hemisfério Norte os meses de pico de transmissão de dirofilariose cardiopulmonar são os meses de verão, julho e agosto, uma vez que a duração da estação
Doenças transmitidas por vetores Alterações clímaticas e atmosféricas. Movimento natural dos vetores por ação
do vento e pássaros. Resistência aos inseticidas. Aumento do movimento e comércio de animais. Globalização e aumento das zonas
urbanizadas.
Figura 1 - Fatores responsáveis pela disseminação da infeção por D. immitis. Adaptado de Harrus e Baneth (2005).
5 de transmissão da infeção em zonas temperadas é essencialmente dependente da quantidade de calor necessário para favorecer o desenvolvimento da larva infetante no mosquito (American Heartworm Society, 2014b).
No entanto, foi comprovado que em zonas urbanas, os mosquitos são capazes de manter o seu ciclo todo o ano, reproduzindo-se em pequenos recipientes e águas paradas, graças ao calor que fica retido no asfalto e nos edifícios. Cria-se assim um microambiente favorável para o seu desenvolvimento e que favorece a expansão da doença (Carretón et al., 2012; American Heartworm Society, 2014b).
2. Ciclo de vida
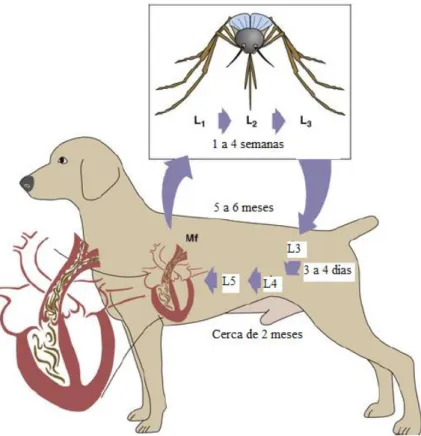
Tal como representado na figura 2, quando um mosquito vetor suscetível realiza uma refeição
num hospedeiro
microfilarémico, o mosquito torna-se infetado (Ware, 2010; American Heartworm Society, 2014b). No inseto vetor, o estádio larvar 1 (L1), ou microfilária, invade os túbulos de Malpighi do mosquito, onde ocorre a muda para o estádio larvar 2 (L2), que finalmente, sofre uma nova metamorfose, para estádio larvar 3 (L3) ou
larva infetante (American Heartworm Society, 2014b). Em seguida, a L3 migra para o aparelho bucal do mosquito, sendo posteriormente, aquando de uma nova refeição (American Heartworm Society, 2014b), depositadas na pele do hospedeiro definitivo, através da solução de continuidade causada pela picada do mosquito (Meireles et al, 2014).
Figura 2- Ciclo de vida de D. Immitis no cão. L1 a L4 – estádios larvares; L5 – adulto imaturo; Mf – Microfilárias. Adaptado deAtkins (2017).
6 O tempo necessário para o desenvolvimento das microfilárias, L1, para L3 ou larva infetante no mosquito é temperatura-dependente (American Heartworm Society, 2014b), sendo que pode demorar entre uma a quatro semanas e o tempo é tanto menor quanto maior for a temperatura ambiente (Calvert e Thomason, 2016).
Por cada picada de mosquito podem ser inoculadas até 10 larvas L3 no hospedeiro definitivo (Calvert e Thomason, 2016). Após a picada do mosquito, as L3 iniciam a migração para o tecido subcutâneo, adiposo e para os músculos e iniciam a muda para L4 cerca de 3 a 4 dias após terem infetado o hospedeiro definitivo e para L5 depois de passados 50 a 70 dias (American Heartworm Society, 2014b; Meireles et al., 2014; Atkins, 2017). Às artérias pulmonares chegam em cerca de 100 dias (Calvert e Thomason, 2016).
Geralmente a elevada pressão do fluxo sanguíneo conduz as L5 para as arteríolas pulmonares, a partir de onde vão crescendo, até se se tornarem parasitas adultos e se alojarem nas grandes artérias pulmonares (American Heartworm Society, 2014b) ou no ventrículo direito se a carga parasitária for muito elevada (Calvert e Thomason, 2016). A localização dos parasitas adultos parece ser dependente, quer do porte do cão, como da carga parasitária que este apresenta (American Heartworm Society, 2014b).
É ainda no estádio de L5 que podem surgir migrações erráticas, mais frequentes no gato, com destaque para localizações no sistema nervoso central ou artérias sistémicas (Meireles et al., 2014; Calvert e Thomason, 2016).
Nos cães, cerca de 5 a 6 meses após a infeção, os parasitas tornam-se adultos e a fêmeas começam a libertar microfilárias para a circulação periférica (Ware, 2010; American Heartworm Society, 2014b; Calvert e Thomason, 2016), sendo que os parasitas adultos podem chegar a viver no cão, cerca de 5 a 7 anos, com microfilarémia durante cerca de 30 meses (Atkins, 2017).
Em gatos, os parasitas tornam-se adultos cerca de 7 a 8 meses após a infeção (American Heartworm Society, 2014b), geralmente não há produção de microfilárias (American Heartworm Society, 2014b; Meireles et al., 2014) e a carga parasitária é baixa (cerca de
7 1 a 3 parasitas) (Calvert e Thomason, 2016). Os parasitas adultos podem viver cerca de 2 a 4 anos (American Heartworm Society, 2014b).
3. Hospedeiros e reservatórios
D. Immitis infeta uma grande variedade de espécies animais, incluindo cães domésticos, lobos, raposas, coiotes, gatos domésticos, furões, leões marinhos, felinos não domésticos, e humanos (Hoch e Strickland, 2008; Carretón et al., 2012).
A prevalência da infeção por D. immitis é determinada principalmente pela distribuição de espécies reservatórias caninas, sejam elas domésticas ou selvagens (Hoch e Strickland, 2008; Bowman e Atkins, 2009; American Heartworm Society, 2014b).
Os gatos são mais resistentes à infeção do que os cães (Bowman e Atkins, 2009; Ware, 2010) e aparentemente conseguem provocar a supressão da capacidade reprodutiva das fêmeas de D. immitis. São também muito eficientes a eliminar as larvas nos estádios imaturos e as microfilárias (com recurso ao sistema imunitário), pelo que geralmente não constituem um reservatório (Hoch e Strickland, 2008).
4. O papel da Wolbachia na dirofilariose cardiopulmonar
Tal como a maioria dos nemátodes filarídeos, também a D. immitis alberga uma bactéria simbionte intracelular denominada Wolbachia (Kramer, 2007; American Heartworm Society, 2014b; Atkins, 2017). No caso da D. immitis, a espécie que se conhece é a Wolbachia pipientis que desempenha um papel essencial na biologia e nas funções reprodutivas dos seus hospedeiros (Kramer, 2007; McHaffie, 2012; Atkins, 2017). Wolbachia pipientis, é uma bactéria gram-negativa pertencentes à ordem Rickettsiales (Carretón et al., 2012), que se encontra predominantemente nas células hipodermais, ou seja, diretamente por baixo da cutícula do parasita. Em fêmeas W. pipientis, também está presente nos ovários, nos oócitos e nos estados embrionários dentro do útero, o que sugere que a bactéria se transmite de forma vertical e que está presente em todas as fases evolutivas do parasita (Kramer, 2007; Carretón et al., 2012; McHaffie, 2012).
8 Apesar de ainda não ser claro o porquê da Wolbachia ser tão importante para o seu hospedeiro (Kramer, 2007), sabe-se que a presença da bactéria é essencial para a sobrevivência de D. immitis e que a eliminação da Wolbachia conduz à esterilidade das fêmeas e posteriormente à morte dos adultos (Kramer, 2007; Carretón et al., 2012; McHaffie, 2012).
Além de ser imprescindível para a sobrevivência do parasita, a Wolbachia também desempenha um importante papel na patogenia e na resposta imune do hospedeiro perante a infeção por D. immitis (Kramer, 2007; Ware, 2010; Carretón et al., 2012). Quando ocorre a morte dos parasitas ou durante as mudas dos estádios larvares, as bactérias são libertadas e esta libertação estimula uma resposta inflamatória no corpo do hospedeiro, que é, em parte, responsável pelo quadro clínico que estes animais apresentam (Carretón et al., 2012). Além disso, esta bactéria possui uma proteína de superfície, a proteína recombinante que recobre a superfície da Wolbachia (WSPr), que induz uma resposta de IgG em hospedeiros infetados por D. immitis podendo esta proteína contribuir para o processo inflamatório pulmonar e renal que ocorre na dirofilariose cardiopulmonar (American Heartworm Society, 2014b) .
Segundo Kramer (2007), nas espécies de parasitas em que a Wolbachia foi identificada, a sua prevalência é sempre de 100%, uma vez que todos os individuos estão infetados. No entanto, um estudo conduzido por Landum et al. (2014), em que se analizou a prevalência de Wolbachia em cães com infeção por D. immitis em Portugal, reportou que apenas cerca de 50% dos cães microfilarémicos, apresentaram resultados positivos ao PCR para deteção desta bactéria.
9
5. Dirofilariose cardiopulmonar no Cão 5.1. Prevalência
5.1.1. Prevalência na Europa
A Europa é um dos continentes onde a infeção por D. immitis no cão foi estudada mais extensivamente, sendo que, historicamente, os países do Sul da Europa, tais como a Espanha, Itália, França, Grécia e Portugal (Carretón et al., 2012) são aqueles onde a infeção é considerada endémica ou hiperendémica (Morchón et al, 2012) (figura 3).
No entanto, tal como se pode observar na figura 3, atualmente, em países como a Croácia, Roménia, e a Sérvia a infeção também já é considerada endémica (Carretón et al., 2012; Otranto et al., 2013). Inclusivamente, tem-se verificado uma tendência de expansão desta doença para países do centro e norte da Europa (Áustria, Alemanha e Holanda) onde têm sido reportados casos esporádicos da infeção. Estes casos estão na maior parte das vezes relacionados com animais que viajaram com os tutores para regiões mediterrânicas, ou que foram adotados dessas mesmas zonas (Genchi et al., 2005; Guerrero et al., 2007; Traversa et al., 2010; Carretón et al., 2012; Simón et al., 2012; Otranto et al., 2013).
Figura 3 - Distribuição da dirofilariose por D. immitis em cães até 2001 e posteriormente até 2012. Adaptado de Otranto et al. (2013).
10 5.1.2. Prevalência em Portugal
Segundo Alho et al. (2014), em Portugal, a transmissão da infeção por D. immitis é marcadamente sazonal, com picos de transmissão no verão, sendo que os seus resultados denotam uma tendência de aumento e expansão desta doença em Portugal, particularmente em cães.
Considera-se que em Portugal a dirofilariose cardiopulmonar em cães é endémica (Alho et al., 2012), variando, no entanto, a sua prevalência consoante a área.
5.1.2.1. Zona Norte
Um estudo conduzido por Cardoso et al. (2012), revelou nesta zona uma prevalência de 2,9% em animais aparentemente saudáveis e de 3,4% em animais clinicamente suspeitos. Vieira et al. (2015), referem que a prevalência por distrito é de 0% em Braga, no Porto, em Bragança, em Vila Real, e em Viseu. Já em Viana do Castelo é de 2,1% e em Aveiro de 6,8%.
5.1.2.2. Zona Centro
Nesta área, Cardoso et al. (2012), descrevem uma prevalência de 0,9% em animais aparentemente saudáveis e de 7,4% em animais clinicamente suspeitos, especificando, porém, que em Lisboa esta é de 2,4% em animais aparentemente saudáveis e de 5,8% em animais suspeitos. Alho et al. (2014), particularizam a prevalência da infeção por D. immitis em cães nos distritos de Santarém, Coimbra e Setúbal que foi respetivamente de 13,2%, 13,8% e 24,8%. No entanto, no que diz respeito a Coimbra, o estudo de Vieira et al. (2015), reportou uma prevalência de apenas 8,8 %.
5.1.2.3. Zona Sul
O primeiro estudo de prevalência desta doença em Portugal foi publicado por Araujo (1996) e mostrou que a infeção em cães era prevalente em várias regiões do sul de Portugal, incluindo o Ribatejo (16,7%), o Alentejo (16,5%) e o Algarve (12%). Cardoso et al. (2012), reportam uma incidência no Alentejo de 4,7 % em animais aparentemente
11 saudáveis e 14 % em animais clinicamente suspeitos e no Algarve, 5,1% em animais aparentemente saudáveis e de 17,1 % em animais clinicamente suspeitos.
5.1.2.4. Região Autónoma da Madeira e região autónoma dos Açores
Já nos anos 90, a Ilha da Madeira mostrou ser um dos locais mais afetados, com uma prevalência de 30%, segundo Araujo (1996). No entanto, mais recentemente Cardoso et al. (2012), verificaram um aumento deste valor para 40%.
No diz respeito aos Açores, não foi detetado qualquer resultado positivo, pelo que a prevalência é de 0% (Cardoso et al., 2012).
5.2. Fisiopatologia
A dirofilariose cardiopulmonar é uma doença que afeta principalmente as artérias pulmonares e o parênquima pulmonar, provocando lesões no lado direito do coração apenas em fases mais avanças da doença (Carretón et al., 2012; Atkins, 2017).
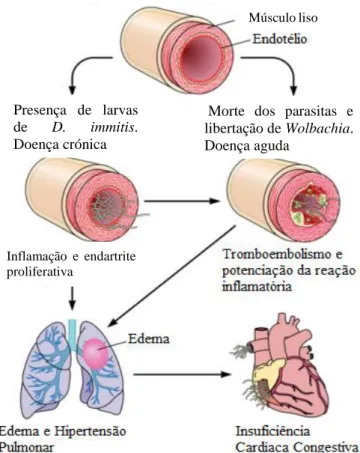
Tal como ilustrado na figura 4, a presença de parasitas adultos em contacto direto com as artérias pulmonares provoca inflamação e espessamento da camada íntima da artéria por migração de células de músculo liso da túnica média para a túnica íntima (Bowman e Atkins, 2009; Carretón et al., 2012; Meireles et al., 2014).
12 Graças a estes processos, as
artérias pulmonares tornam-se espessadas e o lúmen da artéria diminui, causando aquilo que se denomina como endartrite proliferativa (Carretón et al., 2012; Simón et al., 2012; Atkins, 2017) .
Embora o lúmen arterial diminua, o diâmetro das artérias aumenta, estas tornam-se tortuosas e perdem a elasticidade (Carretón et al., 2012; Meireles et al., 2014). A perda de elasticidade faz com que a artéria não consiga dilatar, por exemplo em situações de exercício físico, levando a um
aumento da resistência ao fluxo sanguíneo, e ao aparecimento de hipertensão pulmonar (Ware, 2010; Carretón et al., 2012; Meireles et al., 2014).
A hipertensão pulmonar pode ser agravada pelo facto de algumas arteríolas estarem obstruídas e inflamadas pela presença de parasitas, ocorrendo assim a formação de êmbolos parasitários, principalmente aquando da morte dos nemátodes, provocando aquilo que se denomina como tromboembolismo pulmonar (Bowman e Atkins, 2009; Carretón et al., 2012; Simón et al., 2012).
O aumento do trabalho cardíaco causado pela hipertensão pulmonar, provoca hipertrofia/dilatação do ventrículo direito em apenas cerca de 9 a 10 meses (Ware, 2010; Carretón et al., 2012; Simón et al., 2012).
Figura 4 - Fisiopatologia da dirofilariose cardiopulmonar no cão. Adaptado de Simón et al. (2012).
Músculo liso
Inflamação e endartrite proliferativa
Vaso sanguíneo antes da chegada dos parasitas
Presença de larvas de D. immitis.
Doença crónica
Morte dos parasitas e libertação de Wolbachia. Doença aguda
13 Com a progressão da doença, os parasitas que inicialmente se tinham fixado nos ramos periféricos das artérias pulmonares começam a avançar em direção a segmentos mais proximais, e à medida que os parasitas vão crescendo, chegam à artéria pulmonar principal e tal como representado na figura 5, entram no ventrículo direito e fazendo um movimento retrógrado passam através da válvula tricúspide e atingem assim o átrio direito e posteriormente a veia cava (Carretón et al., 2012; Simón et al., 2012).
A presença de parasitas no átrio e no ventrículo direito interfere com a contração cardíaca e com o trabalho da válvula tricúspide, provocando regurgitação e aumento da pressão em todo o sistema venoso, causando assim congestão passiva crónica e insuficiência cardíaca direita (Carretón et al., 2012; Meireles et al., 2014).
Figura 5 - Esquematização do movimento retrógrado dos parasitas e da sua chegada à veia cava. Adaptado de Strickland (1998).
14 Se não houver uma intervenção médica ou
cirúrgica atempada, todos os fatores acima descritos, culminam numa situação de má perfusão tecidular, hipoxia, aparecimento de azotemia pré-renal, congestão generalizada, hemólise intravascular e geralmente morte por aquilo que se denomina como síndrome de veia cava (figura 6) em cerca de 24 a 72 horas (Strickland, 1998).
5.3. Sinais clínicos
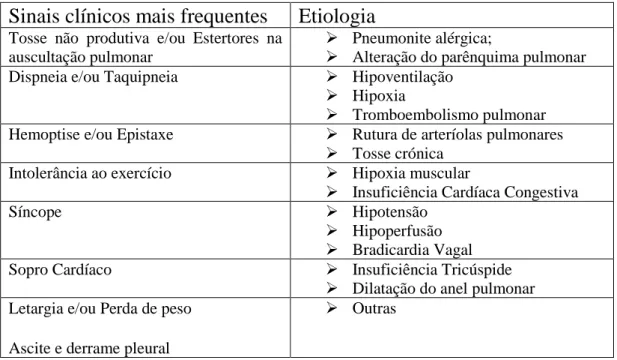
Os sinais clínicos de dirofilariose cardiopulmonar dependem da gravidade e da duração da infeção (Calvert e Thomason, 2016) e, na maioria dos casos, refletem os efeitos dos parasita nas artérias pulmonares, nos pulmões e no coração (Atkins, 2017). Embora os sinais clínicos mais frequentes estejam representados na tabela 1, é importante salientar que, a maioria dos cães com dirofilariose cardiopulmonar podem ser assintomáticos durante vários anos após a infeção (Carretón et al., 2012; Calvert e Thomason, 2016; Atkins, 2017).
Sinais clínicos mais frequentes
Etiologia
Tosse não produtiva e/ou Estertores na auscultação pulmonar
➢ Pneumonite alérgica;
➢ Alteração do parênquima pulmonar Dispneia e/ou Taquipneia ➢ Hipoventilação
➢ Hipoxia
➢ Tromboembolismo pulmonar Hemoptise e/ou Epistaxe ➢ Rutura de arteríolas pulmonares
➢ Tosse crónica Intolerância ao exercício ➢ Hipoxia muscular
➢ Insuficiência Cardíaca Congestiva
Síncope ➢ Hipotensão
➢ Hipoperfusão ➢ Bradicardia Vagal
Sopro Cardíaco ➢ Insuficiência Tricúspide
➢ Dilatação do anel pulmonar Letargia e/ou Perda de peso
Ascite e derrame pleural
➢ Outras
Figura 6- Ascite e caquexia cardíaca num cão com dirofilariose cardiopulmonar. Cão sem raça definida, de 8 anos que apresentava Síndrome de veia cava. Fotografia gentilmente cedida pela Doutora Elena Carretón.
Tabela 1 - Etiologia dos sinais clínicos mais frequente num cão com dirofilariose cardiopulmonar. Adaptado de Carretón et al. (2012).
15
5.4. Diagnóstico
Tendo em conta o tema desta dissertação, os métodos de diagnóstico serológicos serão os mais extensivamente estudados, em detrimento dos restantes métodos clínicos e imagiológicos. (Venco, Manzocchi, Genchi, & Kramer, 2017).
5.4.1. Métodos Serológicos
5.4.1.1. Pesquisa de Antigénios Circulantes
Para o despiste da doença numa população de cães assintomáticos ou para a verificação de uma suspeita de infeção de D. immitis, o teste de deteção de antigénios circulantes é o método de diagnóstico mais sensível (Hoch e Strickland, 2008; American Heartworm Society, 2014b). Esta deteção de antigénios circulantes é feita através de testes serológicos como ELISA (enzyme-linked immunoassay) e imunocromatografia, os quais geralmente detetam antigénios do tecido ovárico das dirofilarias fêmeas adultas (Carretón et al., 2012; American Heartworm Society, 2014b; Meireles et al., 2014). Atualmente já existem testes altamente sensíveis e capazes de detetar antigénios não provenientes do tecido ovárico das fêmeas, pelo que já é possível detetar infeções nas quais existam apenas parasitas machos (Venco et al., 2017).
Estes testes estão atualmente disponíveis na forma de testes rápidos para uso rotineiro em clínicas veterinárias (Meireles et al., 2014), são fáceis de utilizar e altamente específicos, uma vez que não existem reações cruzadas com outros parasitas tais como D. repens ou A. reconditum, sendo assim raros os falso-positivos (Hoch e Strickland, 2008; Carretón et al., 2012).
Embora a sensibilidade destes testes seja muito elevada, podem ocorrer resultados falso-negativos, principalmente nos primeiros 5 a 8 meses de infeção, em animais infetados apenas com parasitas machos, em infeções com poucos parasitas fêmea, ou no caso de falha técnica do teste (Hoch e Strickland, 2008; Carretón et al., 2012; American Heartworm Society, 2014b). Além disso, a antigenemia pode ser suprimida durante cerca de 9 meses pós infeção, se os animais tiverem recebido quimioprofilaxia adequada (lactonas macrocíclicas) (American Heartworm Society, 2014b), o que dará também origem a resultados falso-negativos nesse período.
16 Se o resultado do teste não for o esperado, o teste deve ser repetido e posteriormente, caso o resultado se mantenha este deve ser confirmado com recurso a um laboratório de referência (American Heartworm Society, 2014b).
A intensidade da cor de um resultado positivo do teste de antigénios circulantes não pode ser utilizada para determinar o nível de carga parasitária, uma vez que o nível de antigénios presentes pode aumentar devido à morte recente de parasitas ou diminuir quando as fêmeas existentes são ainda jovens ou quando existem poucas fêmeas adultas (Carretón et al., 2012; American Heartworm Society, 2014b; Meireles et al., 2014; Calvert e Thomason, 2016).
Segundo as recomendações da American Heartworm Society (2014b), o método de eleição para diagnóstico de dirofilariose cardiopulmonar no cão atualmente é a detecção de antigénios, combinada com a pesquisa de microfilárias (figura 7).
5.4.1.2. Pesquisa de microfilárias
Na maioria dos cães microfilarémicos, as microfilárias podem ser detetadas no exame microscópico de uma gota de sangue fresco, através da visualização direta das microfilárias ou pelo deslocamento das células sanguíneas no campo microscópico causada pelos movimentos das microfilárias (American Heartworm Society, 2014b; Meireles et al., 2014).
Este método de diagnóstico é 20% a 25% menos sensível na deteção de microfilárias do que os testes de concentração, por isso, para obter resultados mais precisos podemos usar
NEGATIVO
Teste Ag negativo; Teste Mf negativo; Profilaxia; Repetir teste Ag em 6 meses.DIROFILARIOSE
OCULTA
Teste Ag positivo; Teste Mf negativo; Tratamento adulticida.DIROFILARIOSE
Teste Ag Positivo; Teste Mf Positivo; Tratamento adulticida.RESULTADOS
DISCORDANTES
Teste Ag negativo; Teste Mf Positivo; Repetir testes.Figura 7 - Interpretação dos resultados do teste de Antigénios (Ag) e de deteção de Microfilárias (Mf). Adaptado de Carretón et al. (2012).
17 técnicas de concentração, tais como a técnica de Knott Modificada ou o teste de filtração (American Heartworm Society, 2014b; Calvert e Thomason, 2016).
O teste de Knott modificado provoca a hemólise dos eritrócitos graças à adição de formol e permite a observação de microfilárias em extensão após centrifugação (Meireles et al., 2014). É o método recomendado para observar a morfologia e para a mensuração das dimensões dos parasitas, facilitando assim a diferenciação entre D. immitis e outras espécies de filarias como Acanthocheilonema reconditum, e evitando assim falso-positivos (American Heartworm Society, 2014b; Meireles et al., 2014).
Na pesquisa de microfilárias podem ocorrer resultados falso-negativos por diversas razões, tais como, a infeção ser amicrofilaremica, o número de microfilárias circulantes ser pequeno ou a quantidade de sangue examinada ser insuficiente (Hoch e Strickland, 2008; Meireles et al., 2014).
Os animais podem não apresentar microfilárias por várias razões, incluindo administração prévia de lactonas macrocíclicas, infeções por parasitas de um único género, infeções pré patentes ou ainda por destruição imunomediada das microfilárias (Hoch & Strickland, 2008; Meireles et al., 2014).
5.4.2. Métodos clínicos e imagiológicos
5.4.2.1. Radiografia Torácica
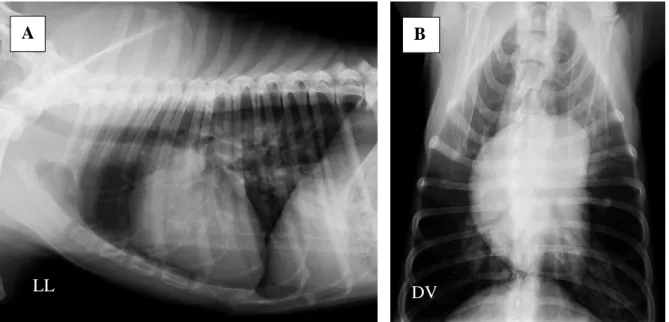
Apesar de não ser um teste de rastreio eficaz para a dirofilariose cardiopulmonar, a radiografia torácica oferece uma excelente ferramenta para determinar a gravidade da doença, para avaliar as alterações do parênquima pulmonar e para descartar outros possíveis diagnósticos diferenciais (Atkins, 2017). São considerados sinais típicos de dirofilariose cardiopulmonar a nível radiográfico, o aumento do tamanho e da tortuosidade de vasos intra e interlobulares, o aumento focal da densidade do parênquima pulmonar, principalmente nos lobos caudais (figura 8A), e a dilatação do ventrículo direito, com aumento da silhueta cardíaca e aspeto de “D invertido” na projeção dorsoventral (figura 8B) (Hoch e Strickland, 2008; Atkins, 2017).
18
5.4.2.2. Ecocardiografia
Este método é pouco sensível como ferramenta diagnóstica, porque os parasitas são raramente visíveis no ventrículo direito, exceto em cães com síndrome de veia cava e/ou alta carga parasitária (Bowman e Atkins, 2009; Calvert e Thomason, 2016).
No entanto, a ecocardiografia pode ser útil para avaliar a função cardíaca, as características do fluxo sanguíneo cardíaco e as dimensões das camaras cardíacas. Um estudo em modo doppler espectral, permite-nos avaliar a velocidade de fluxo transtricúspide e assim tirar conclusões acerca do grau de hipertensão pulmonar (Bowman e Atkins, 2009; Carretón et al., 2012).
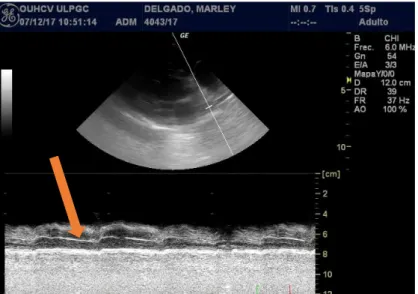
A ecocardiografia pode, às vezes, demonstrar a presença de parasitas na artéria pulmonar (figura 9) uma vez que a parede do corpo dos parasita adultos é altamente ecogénica, produzindo imagens semelhantes a traços paralelos (Bowman e Atkins, 2009; American Heartworm Society, 2014b).
LL DV
A B
Figura 8 - A: Radiografia em projeção latero-lateral (LL) de um cão sem raça definida, de 7 anos, com dirofilariose cardiopulmonar. De notar a presença de áreas focais de parênquima pulmonar com aumento da densidade (mais radiopacas), principalmente nos lobos pulmonares caudais. Note-se ainda o aumento da silhueta cardíaca direita. B: Radiografia em projeção dorso-ventral (DV) do mesmo cão da figura 8A, em que se pode observar o aumento da silhueta cardíaca direita, com aspeto de “D invertido”. Imagens gentilmente cedidas pela Doutora Elena Carretón.
19 Segundo Boon et al. (2014), o
Modo-M permite-nos medir o índice de distensibilidade da artéria pulmonar direita, existindo uma forte correlação entre este índice e a gravidade da hipertensão pulmonar. Este método é simples e facilmente repetível e pode ser usado para
detetar precocemente a
hipertensão pulmonar em cães
com dirofilariose
cardiopulmonar, mesmo na ausência de regurgitação tricúspide.
5.4.2.3. Outros métodos diagnósticos
a) Hemograma
A maioria dos cães apresenta hemograma normal, sendo que 60% dos cães com infestações graves podem apresentar anemia normocítica e normocrómica e nos cães com síndrome de veia cava pode ocorrer hemólise intravascular dos eritrócitos, dando origem a uma anemia hemolítica. No leucograma, a alteração mais frequente é a eosinofilia, que está presente em cerca de 85% dos cães com microfilárias circulantes e em 95% dos cães amicrofilarémicos (Ware, 2010; Carretón et al., 2012).
b) Perfil de Coagulação
Altera-se significativamente em casos de tromboembolismo pulmonar grave, porque há consumo ativo dos fatores de coagulação, plaquetas e fibrinogénio (Carretón et al., 2012).
Figura 9 - Ecocardiografia em projeção paraesternal direita, eixo curto, em que se observa o trato de saída do ventrículo direito e se observa uma linha hiperecogénica (seta), que representa um parasita adulto na artéria pulmonar principal. Imagem gentilmente cedida pela Doutora Elena Carretón.
20 c) Perfil Hepático e Perfil Renal
O perfil hepático geralmente não sofre alterações. Quanto ao perfil renal, podemos observar o aumento da concentração sérica da creatinina e do azoto ureico sanguíneo (BUN), mas os casos de azotemia são raros (Carretón et al., 2012).
d) Biomarcadores de lesão cardiopulmonar
Alguns exemplos destes biomarcadores são a troponina I, a mioglobina, o N-terminal do pró-peptídeo natriurético cerebral (NT – ProBNP) e o dímero D. Estes permitem avaliar a gravidade das lesões provocadas por esta doença, mensurar e avaliar eficácia do efeito do tratamento adulticida e ser utilizados como fator de prognóstico (Carretón et al., 2012; Méndez et al., 2015; Carretón at al, 2017).
No caso concreto do dímero D, é um parâmetro muito útil para confirmar a formação e a gravidade dos fenómenos tromboembólicos, que ocorrem normalmente aquando da morte dos parasitas, por exemplo após o tratamento adulticida (Carretón et al., 2012; Carretón et al., 2013; Calvert e Thomason, 2016).
5.5. Prevenção da dirofilariose cardiopulmonar
Os produtos utilizados para prevenir a dirofilariose em cães são as lactonas macrocíclicas, tais como a ivermectina, moxidectina, selamectina, milbemicina oxima, entre outros. Estes fármacos atuam sobre as microfilárias, larvas em estádios L3 e L4 e em alguns casos de uso contínuo, atuam ou podem atuar contra parasitas pré-adultos, L5. A maior parte das vezes estes produtos devem ser administrados mensalmente, à exceção do Guardian SR® cuja administração é anual, uma vez que esta é uma formulação de libertação lenta de moxidectina (Carretón et al., 2012; Wolstenholme et al., 2015).
A prevenção em cachorros deve ser iniciada tão cedo quanto possível e nunca após os 2 meses de idade. Isto porque, especialmente em áreas endémicas, a possibilidade de o animal ser picado por um mosquito portador da D. immitis existe hipoteticamente desde o dia em que o cachorro nasce (Carretón et al., 2012).
21 As reações adversas a estes fármacos são pouco frequentes com doses preventivas, no entanto, devemos alertar o tutor dos possíveis efeitos indesejáveis, para que uma reação adversa seja reconhecida e prontamente tratada (Bowman e Atkins, 2009). No caso da milbemicina oxima, esta possui um efeito microfilaricida muito potente e rápido, pelo que não deve ser administrada a cães com microfilárias circulantes (Carretón et al., 2012). Tem vindo a ser reportados casos de D. immitis que apresentam resistência às lactonas macrocíclicas, no entanto, o mecanismo desta resistência ainda não está devidamente esclarecido (Wolstenholme et al., 2015) pelo que contínua a ser recomendado o seu uso para prevenção da dirofilariose cardiopulmonar (McCall, 2005; American Heartworm Society, 2014b).
5.6. Tratamento da dirofilariose cardiopulmonar
O objetivo do tratamento da dirofilariose cardiopulmonar é melhorar as condições clínicas do animal e eliminar todos os estádios da D. immitis (microfilárias e os estádios larvares) com o mínimo de complicações possíveis (American Heartworm Society, 2014b). Antes de o tratamento ser iniciado, deve ser avaliado o estado clínico e cardiovascular do animal (Carretón et al., 2012). Em cães que apresentem um quadro clínico grave de dirofilariose cardiopulmonar, o tratamento não deve ser iniciado até que os sinais clínicos sejam estabilizados, por exemplo com recurso a glucocorticóides, diuréticos, vasodilatadores, agentes inotropos positivos e fluidoterapia (American Heartworm Society, 2014b).
5.6.1. Protocolo recomendado pela American Heartworm Society
Independentemente da gravidade da doença, com a exceção da síndrome da veia cava, o protocolo de três doses de fármaco adulticida (tabela 2) é o recomendado pela American Heartworm Society (AHS) devido à sua maior segurança e eficácia (American Heartworm Society, 2014b). O fármaco adulticida que a AHS recomenda é o dicloridrato de melarsomina, numa dose de 2,5 mg/kg, aplicada por via intramuscular profunda na musculatura epaxial entre L3 e L5 (American Heartworm Society, 2014b).
22
Tabela 2 - Protocolo de tratamento adulticida recomendado pela American Heartworm Society, Adaptado de American Heartworm Society (2014b).
Dia Tratamento
Dia 0 • Diagnóstico positivo;
• Iniciar a restrição de exercício;
• Se o cão for sintomático, estabilizar com tratamento adequado e administrar prednisona, 0,5 mg/kg BID, 1ª semana, 0,5 mg/kg SID, 2ª semana, 0,5 mg/kg em dias alternados durante 3ª e/ou 4ª semanas.
Dia 1 • Administrar lactonas macrocíclicas (para eliminar microfilárias circulantes e prevenir a reinfeção);
• Manter o animal sobre observação durante pelo menos 8 horas para monitorizar uma possível reação anafilática.
Dia 1-28 • Doxiciclina 10 mg/kg BID durante 4 semanas.
Dia 30 • Administrar lactonas macrocíclicas (para eliminar microfilárias circulantes e prevenir a reinfeção).
Dia 60 • Administrar lactonas macrocíclicas (para eliminar microfilárias circulantes e prevenir a reinfeção);
• Primeira administração de melarsomina 2,5 mg/Kg, IM;
• Se necessário repetir o protocolo de administração de prednisona; • Restrição absoluta de exercício.
Dia 90 • Administrar lactonas macrocíclicas (para eliminar microfilárias circulantes e prevenir a reinfeção);
• Segunda administração de melarsomina 2,5 mg/Kg, IM. Dia 91 • Terceira administração de melarsomina 2,5 mg/Kg, IM;
• Se necessário repetir o protocolo de administração de prednisona; • Restrição absoluta do exercício durante mais 6-8 semanas após a
administração de melarsomina; Dia 120 • Avaliar a presença de microfilárias;
• Se for positivo, administrar 30 dias de doxiciclina e repetir o teste em 30 dias.
Dia 271 • Teste de antigénios 6 meses depois de terminar o tratamento.
Tal como já foi referido anteriormente, quando se inicia o protocolo para eliminar as dirofilarias, aumenta-se significativamente a probabilidade de ocorrência de fenómenos tromboembólicos, que podem ser graves se a carga parasitaria for alta e a doença pulmonar for grave. Para minimizar a ocorrência e a gravidade do tromboembolismo pulmonar, é de extrema importância garantir que o animal faz uma restrição absoluta do exercício, principalmente durante o período de tratamento (American Heartworm Society, 2014b; Atkins, 2017). Além disso, a AHS também recomenda a utilização de
23 glucocorticóides tais como a prednisona, para minimizar os sinais clínicos de tromboembolismo pulmonar. O protocolo recomendado é administrar 0,5 mg/kg BID, durante a primeira semana, 0,5 mg/kg SID na segunda semana, seguido por 0,5 mg/kg em dias alternados, durante 1 ou 2 semanas. Este protocolo pode ser aplicado e repetido consoante necessário ao longo do tratamento adulticida (Carretón et al., 2012; American Heartworm Society, 2014b).
Tendo em conta a importância da bactéria Wolbachia na inflamação que ocorre na vasculatura pulmonar e renal, principalmente aquando da morte dos parasitas (Calvert e Thomason, 2016), a AHS recomenda que antes da administração da melarsomina, seja administrada doxiciclina a uma dose de 10 mg/kg BID, durante 4 semanas. Isto garante que a bactéria Wolbachia e seus metabolitos estão reduzidos ou ausentes quando os parasitas morrem e se fragmentam (American Heartworm Society, 2014b).
Durante e após a conclusão do tratamento, devemos reforçar junto do tutor, a importância de administrar lactonas macrocíclicas mensalmente, ou segundo as recomendações do fabricante, para prevenir uma reinfeção (Carretón et al., 2012; American Heartworm Society, 2014b).
O tratamento adulticida está contraindicado em animais que apresentem síndrome de veia cava e nestes casos, devemos proceder tão rápido quanto possível à extração cirúrgica dos parasitas (Bowman e Atkins, 2009; American Heartworm Society, 2014b; Atkins, 2017). Embora com a cirurgia se remova uma grande parte dos parasitas presentes na veia cava e lado direito do coração, após a recuperação da cirurgia, recomenda-se realizar tratamento adulticida para eliminar quaisquer parasitas restantes, especialmente se ainda houver carga parasitária visível na ecocardiografia (Bowman e Atkins, 2009; American Heartworm Society, 2014b; Calvert e Thomason, 2016).
24
6. Dirofilariose cardiopulmonar no Gato 6.1. Prevalência
6.1.1. Prevalência na Europa
As taxas de infeção em gatos são geralmente menores do que em cães, embora em algumas regiões estas sejam maiores que o esperado (Calvert e Thomason, 2016). Numa mesma área geográfica estima-se que a infeção por D. Immitis em gatos seja cerca de 5 a 20% do valor de prevalência em cães (Ware, 2010), embora este valor possa estar subestimado devido às dificuldades do diagnóstico em gatos e aos sinais clínicos inespecíficos e transitórios que este parasita provoca nestes animais (Méndez et al., 2012). Embora existam muito menos estudos e dados acerca da prevalência da infeção por D. immitis em gatos do que em cães (Méndez et al., 2012), estima-se que a zona mais endémica do continente Europeu seja, segundo Genchi et al. (2007a), a zona do Vale do Rio Po no norte de Itália onde a prevalência é de cerca de 24%.
No entanto, à medida que se realizam mais estudos, verifica-se que a dirofilariose cardiopulmonar no gato também está a aumentar (Méndez et al., 2012). Um estudo levado a cabo por Montoya-Alonso et al. (2011), mostrou que a seroprevalência da infeção na população de gatos de Gran Canária é inclusive maior que a prevalência em cães, nessa mesma área endémica.
Neste momento, para colmatar a falta de informação, aceita-se que a dirofilariose cardiopulmonar pode afetar gatos em qualquer zona onde existam cães infetados (Méndez et al., 2012).
6.1.2. Prevalência em Portugal
Tal como já foi referido anteriormente, ainda existem poucos estudos acerca da epidemiologia da infeção por D. immitis em gatos, o que faz com que, inclusive em Portugal, o mapa de prevalência desta doença esteja incompleto.
Na figura 10 está ilustrada toda a informação disponível até à data sobre a dirofilariose cardiopulmonar em gatos em Portugal Continental.
25 É importante salientar que Vieira et al. (2015), usaram como ferramenta para estudar a prevalência da infeção testes de deteção de anticorpos contra D.immitis e Wolbachia, enquanto que Almeida (2010), Ramos et al. (2012) e Rosa (2009), utilizaram testes de deteção de antigénio de D. immitis. Isto pode explicar a disparidade de resultados obtidos e o facto de o Centro e Sul apresentarem resultados de prevalência menores do que o Norte do país, o que não seria espectável tendo em conta o que se verifica na prevalência em cães. 14,3% (Vieira et al., 2015) 12,9% (Vieira et al., 2015) 17,6% (Vieira et al., 2015) 13,3% (Vieira et al., 2015) 7,1% (Vieira et al., 2015) 16% (Vieira et al., 2015) 18,7% (Vieira et al., 2015) 1,2% (Almeida, 2010) 5,9 % (Ramos et al., 2012) 1,4% (Rosa, 2009)
26 6.1.3. Prevalência em gatos indoor vs. gatos outdoor
Muitos gatos vivem vidas mais protegidas do que a maioria dos cães e geralmente ficam confinados dentro de casa (American Heartworm Society, 2014a).
No entanto, contrariamente ao que seria de esperar, um estudo retrospetivo, realizado por Atkins et al. (2000) concluiu que aproximadamente 25% dos gatos diagnosticados com dirofilariose cardiopulmonar eram considerados gatos exclusivamente indoor. Esta conclusão suporta a ideia de que o facto de um gato ser exclusivamente indoor, não significa que esteja protegido contra a infeção, porque quer os gatos indoor como os outdoor podem ser infetados através de mosquitos que adquiriram microfilárias de cães infetados (Calvert e Thomason, 2016).
Por isso, o papel dos Médicos Veterinários é desmistificar junto dos tutores, mitos persistentes sobre a infeção - por exemplo, o de que os gatos em ambientes fechados não correm o risco de adquirirem a doença - e encorajar o uso de lactonas macrocíclicas mensalmente em áreas endémicas de dirofilariose cardiopulmonar em cães (Hoch e Strickland, 2008; American Heartworm Society, 2014a).
6.2. Fisiopatologia
A importância clínica da dirofilariose cardiopulmonar é maior em gatos, porque mesmo um pequeno número de parasitas pode vir a ser potencialmente fatal, os sinais clínicos são inespecíficos e o diagnóstico definitivo é um desafio (American Heartworm Society, 2014a).
Alguns gatos nunca chegam a manifestar sinais clínicos, mas quando os sinais são evidentes, estão geralmente associados a dois estádios da doença: presença de parasitas na vasculatura pulmonar e morte de parasitas adultos (Méndez et al., 2012; American Heartworm Society, 2014a).
Embora a maioria dos parasitas imaturos que atingem as artérias pulmonares caudais morram, os gatos expostos a infeção por D. immitis têm o potencial de desenvolver lesões pulmonares significativas, mesmo na ausência de parasitas adultos (Lee e Atkins, 2010; Méndez et al., 2012). Isto ocorre porque, como consequência da chegada e morte dos