BIOMARCADORES SÉRICOS EM RATOS OSTEOPORÓTICOS
JUVENIS PARA A AVALIAÇÃO DO METABOLISMO ÓSSEO
DISSERTAÇÃO DE MESTRADO EM BIOLOGIA CLÍNICA LABORATORIAL
LINTON EMANUEL DA SILVA DINIS
Professor Doutor Bruno Colaço Professor Doutor Pedro Gomes
Universidade de Trás-os-Montes e Alto Douro
BIOMARCADORES SÉRICOS EM RATOS OSTEOPORÓTICOS
JUVENIS PARA A AVALIAÇÃO DO METABOLISMO ÓSSEO
DISSERTAÇÃO DE MESTRADO EM BIOLOGIA CLÍNICA LABORATORIAL
LINTON EMANUEL DA SILVA DINIS
ORIENTADOR CIENTÍFICO: Professor Doutor Bruno Jorge Antunes Colaço Universidade de Trás-os-Montes e Alto Douro
……….
CO-ORIENTADOR CIENTÍFICO: Professor Doutor Pedro Gomes
Faculdade de Medicina Dentária do Porto …….……….………
Composição do Júri:
___________________________________________
___________________________________________
___________________________________________
Vila Real, 2014
Dissertação submetida à
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO Para obtenção do grau de MESTRE
“Anyone who has never made a mistake has never tried anything new.” Albert Einstein
Agradecimentos
Ao terminar este trabalho desejo agradecer a diversas pessoas a quem estou grato por todo o apoio que me foi prestado:
À Universidade de Trás-os-Montes e Alto Douro, na pessoa do seu Magnífico Reitor, Professor Doutor António Fontainhas Fernandes, manifesto o meu reconhecimento por toda a disponibilidade e facilidades concebidas durante a realização desta dissertação de mestrado.
Ao Professor Doutor Bruno Colaço um enorme agradecimento por ter aceitado ser meu orientador de dissertação de mestrado. Agradeço também a disponibilidade e interesse em ouvir todas as minhas questões e problemas no âmbito deste projeto. Em especial pela confiança depositada no meu trabalho e pela revisão cuidada deste relatório.
Ao Professor Doutor Pedro Gomes pela revisão deste trabalho e por todo o apoio prestado.
À Professora Doutora Ana Rita Ferreira por todo apoio concedido durante a dissertação e por toda a ajuda prestada em todos os problemas que surgiram.
À Ana Isabel Padrão por toda a paciência e apoio na minha iniciação as técnicas laboratoriais de zimografia, immunoblotting e por todos os ensinamentos úteis que se refletiram nos bons resultados obtidos.
À Virginia, Rita e Vanessa pelo sorriso bem-disposto e simpatia que nunca faltou e por todo o bom ambiente de trabalho que proporcionaram. Em especial pela companhia e quebra de rotina.
À Filipa, Susana, João e em especial a Ana por todo o apoio e bons momentos passados.
Aos meus pais por acreditarem em mim e pelo suporte financeiro que me disponibilizaram durante estes anos. À família em geral por toda a atenção e apoio prestado, indispensáveis para mim.
Aos meus amigos agradeço o companheirismo ao longo destes últimos 2 anos e a partilha de bons momentos.
Resumo
A osteoporose é uma patologia óssea progressiva, que está associada a uma diminuição significativa da massa e da densidade mineral óssea, com consequente aumento do risco de fratura.
O objetivo deste estudo foi utilizar o modelo do rato ovarietomizado (OVX), em ratos com 8 semanas de idade, para tentar perceber a fiabilidade dos biomarcadores séricos para estimar a densidade mineral óssea.
No presente estudo, foram utilizados 32 ratos fêmea da estirpe Wistar, das quais 16 foram submetidas ao procedimento cirúrgico de ovarietomia, enquanto nas restantes foi efetuada uma cirurgia simulada (SHAM). Decorridos 3 meses após a cirurgia foram sacrificados 8 animais SHAM e 8 animais OVX. Este processo foi repetido para os restantes animais, 6 meses após a cirurgia. No momento do sacrifício foi recolhido sangue para análises séricas dos biomarcadores do metabolismo ósseo, biomarcadores inflamatórios e metaloproteinases. Foram também recolhidas as tíbias, fémures e mandíbulas para se efetuarem análises microtomográficas e biomecânicas.
Neste estudo, observou-se um aumento da taxa de peso corporal nos animais OVX aos 3 meses (43,41%) e 6 meses (48,75%). Verificou-se também uma tendência de aumento dos níveis séricos de osteocalcina (OC), fosfatase alcalina (ALP), interleucina-6 (IL-6), metaloproteinase-2 (MMP-2) e metaloproteinase-9 (MMP-9) nos grupos OVX, tendo sido observadas diferenças estatisticamente significativas (p<0,05) para a OC e MMP-2, aos 3 e 6 meses. As análises microtomográficas revelaram uma diminuição superior a 75% do número de trabéculas e do espaçamento entre trabéculas no grupo OVX, aos 3 meses, que se manteve relativamente estável durante o período experimental. As análises biomecânicas demonstraram uma diminuição da tensão de fratura de 10,2% no fémur e 29,3% na mandíbula dos animais OVX com 6 meses. Globalmente, a MMP-2 aparenta ser o indicador de osteopenia mais robusto, uma vez que apresenta uma forte correlação positiva com a IL-6 (r= 0,949; p<0,05) e negativa com a tensão de fratura do fémur (r= -0,984; p <0,01).
De um modo geral concluiu-se que marcadores como a ALP, IL-6, OC, MMP-2 e MMP-9 são bons indicadores das alterações estruturais confirmadas através das técnicas não laboratoriais e poderão ter uma relevância clínica na monitorização da condição osteoporótica, bem como na avaliação da eficácia de terapêuticas anti-osteoporóticas.
Palavras-chave: Perda óssea, Biomarcadores, Metabolismo ósseo, Osteoporose, Ovarietomia,
Abstract
Osteoporosis is a progressive bone disease, which is associated with a significant decrease of the bone mineral density, with a consequent increase in fracture risk.
The aim of this study was to use a juvenile ovarietomized rat model (OVX) to understand the reliability of some serum biomarkers on bone density determination.
In the present study, we used 32 female Wistar rats, 16 of which were submitted to surgical ovariectomy, while the remaining was performed simulated surgery (SHAM). At 3 months after surgery 8 SHAM and 8 OVX animals were euthanized. This process was repeated for the remaining animals, 6 months after surgery.
At the time of sacrifice blood samples ware taken for analysis of serum biomarkers of bone metabolism, inflammatory biomarkers and metalloproteinases. Tibias, femurs and jaws were also collected to effectuate micro-CT scan and biomechanical analysis.
In this study, we observed an increased rate of body weight of OVX animals at 3 months (43.41%) and 6 months (48.75%). There was also a trend of increase in serum levels of osteocalcin (OC), alkaline fosfatse (ALP), interleukin-6 (IL-6), metalloproteinase-2 (MMP-2) and matrix metalloproteinase-9 (MMP-9) in OVX groups. Differences were found statistically significant (p <0.05) for OC and MMP-2, at 3 and 6 months afer inducement. Micro-CT scam analyses showed a decrease of more than 75% of the trabecular number and trabecular spacing in OVX 3 month’s group, which remained relatively stable in the review period. The biomechanical analysis demonstrated a decrease in stress fracture of the femur in 10.2% and 29.3% in the jaw of OVX animals after 6 months. Overall, MMP-2 appears to be the more robust indicator of osteopenia, as it features a strong positive correlation with IL-6 (r = 0.949, p <0.05) and a negative correlation to the femur fracture force (r = -0.984, p <0.01).
In general it was found that markers such as ALP, IL-6, OC, MMP-2 and MMP-9 are good indicators of structural changes, confirmed by the non laboratory techniques, and may have clinical relevance in osteoporotic condition monitoring, well as assessing the effectiveness of anti-osteoporotic therapies.
Índice Geral
I. Introdução………...1 1. Tecido Ósseo ...1 2. Metabolismo Ósseo ...3 3. Osteoporose ...7 4. Avaliação do metabolismo………11 4.1 Diagnóstico da osteoporose ... 11 4.1.1 Métodos Laboratoriais ... 114.1.1.1 Biomarcadores do metabolismo ósseo ... 11
4.1.2 Métodos não laboratoriais ... 21
II. Objetivos…………..……….26
III. Material e Métodos………..27
1. Considerações prévias ... 27
2. Animais ... 27
3. Bioquímica sérica ... 28
4. Immunoblotting ... 28
5. Zimografia ... 29
6. Análise da densidade óssea ... 30
6.1 Micro-CT ... 30
6.2. Biomecânica óssea ... 31
7. Análise Estatística ... 32
IV. Resultados……….33
1. Peso dos animais, útero e rins... 33
2. Bioquímica sérica: ... 34
2.1. Albumina ... 34
2.3. Triglicéridos... 35 2.4. Fosfatase Alcalina ... 36 2.5. Creatina Cinase ... 37 3. Immunoblotting ... 37 3.1. Osteopontina ... 37 3.2. Osteocalcina... 38 3.3. IL-6 ... 39 3.4. PCR ... 39 4. Metaloproteinases ... 40 5. Avaliação microtomográfica ... 42 6. Biomecânica óssea ... 45
7. Correlação entre marcadores do metabolismo ósseo ... 46
V. Discussão………...48
VI. Conclusões……….63
Índice de figuras
Figura 1: Esquema representativo dos vários tipos de tecidos ósseos presentes no
esqueleto………..………2
Figura 2: Variação da densidade mineral óssea ao longo da idade em humanos……....……..4
Figura 3: Diferentes fases da remodelação óssea…………...……….………..5
Figura 4: Via de regulação do RANKL, RANK e OPG e sua influência na reabsorçã óssea……….……….……….…….6
Figura 5: A- Osso Normal; B- Osso com osteoporose…………..………...….…8
Figura 6: Efeito da diminuição dos estrogénios nos osteoblastos, osteoclastos e outros fatores ósseos.……….…………...…..……….9
Figura 7: Mecanismo fisiopatológico da osteoporose……….…...……….…10
Figura 8: Remodelação óssea induzida por processo inflamatório……….……...…11
Figura 9: Modelos de indução de osteopenia/osteoporose………...……….….……….23
Figura 10: Plano experimental utilizado nesta expêriencia………....…….………28
Figura 11: Técnica de biomecânica de flexão por 3 pontos: A- no fémur; B- na mandíbula………..……31
Figura 12: Análise do parâmetro sérico albumina entre animais SHAM e OVX…..…...34
Figura 13: Análise do parâmetro sérico proteína total entre animais SHAM e OVX……...35
Figura 14: Análise do parâmetro sérico triglicéridos entre animais SHAM e OVX………...36
Figura 15: Análise do parâmetro sérico fosfatase alcalina entre os animais SHAM e OVX..36
Figura 16: Análise do parâmetro sérico creatinina cinase entre os animais SHAM e OVX...37
Figura 17: Análise do marcador de metabolismo ósseo osteopontina por Immunoblotting entre animais SHAM e OVX………....38
Figura 18: Análise do marcador de metabolismo ósseo osteocalcina por Immunoblotting entre animais SHAM e OVX………...…….……38
Figura 19: Análise do marcador de inflamação IL-6 por Immunoblotting entre animais SHAM e OVX………..……….39
Figura 20: Análise do marcador de inflamação PCR por Immunoblotting entre animais SHAM e OVX………..….40
Figura 21: Zimografia representativa dos animais saudáveis 3 e 6 e animais osteoporóticos ao longo de 3 e 6 meses….………..………. 40
Figura 22: Gel de zimografia inibido tampão de desenvolvimento com 3,72 g/L de
EDTA……….…...41
Figura 23: Variação da atividade proteolítica sérica das bandas S1, medida por densidade
ótica nos animais SHAM e OVX………...………...…41
Figura 24: Variação da atividade proteolítica das bandas S1, medida por densidade ótica nos
animais SHAM e OVX………...………..…42
Figura 25: A: imagem tridimensional obtida por reconstrução digital com micro-CT de uma
tíbia de ratos SHAM 3M; B: imagem de corte seccional da tíbia com evidência da tíbia na zona cortical e trabécular de animais SHAM 3M……….………...……...45
Figura 26: A: imagem tridimensional obtida por reconstrução digital com micro-CT de uma
tíbia de ratos OVX 3M; B: imagem de corte seccional da tíbia com evidência na zona cortical e trabécular de animais OVX 3M………...………..………..45
Índice de tabelas
Tabela 1: Marcadores de reabsorção/formação óssea………...…...………...…….12 Tabela 2: Classificação das diversas Metaloproteinases de matriz………..…..…….…15 Tabela 3: Lista de citocinas pró-inflamatórias envolvidas no metabolismo ósseo…...…..….19 Tabela 4: Modelos animais utilizados para estudo de osteopenia/osteoporose...…...…25 Tabela 5: Variação do peso corporal dos animais ao longo do período experimental e peso do
útero no final da experiência…………..……….…..33
Tabela 6: Variação do peso dos rins dos animais ao longo da experiência……….…34 Tabela 7: Avaliação da DMO entre animais SHAM e OVX ao longo do período experimental,
com recurso a microtomografia………...……….…………44
Tabela 8: Avaliação tensão de fratura entre animais SHAM e OVX aos 6 meses de
osteoporose com recurso à técnica de biomecânica………..46
Tabela 9: Correlação entre marcadores séricos e dados de biomecânica para o grupo SHAM
3M………..……...…46
Tabela 10: Correlação entre marcadores séricos e dados de biomecânica para o grupo SHAM
6M………..…...47
Tabela 11: Correlação entre marcadores séricos para o grupo OVX 3M………....…47 Tabela 12: Correlação entre marcadores séricos e dados de biomecânica para o grupo OVX
Lista de abreviaturas e Símbolos
% - Percentagem <- Menor
ADP- Adenosina difosfato Alb- Albumina
ALT- Alanina aminotransferase ALP - Fosfatase alcalina total ANOVA- Análise de variância ATP- Adenosina trifosfato BALP-Fosfatase alcalina óssea
BGLAP- Proteína gama-carboxiglutamato do osso
BMU- Unidades multicelulares básicas de remodelação óssea BV- Volume do osso
Conn.D- Densidade de conecção
CTx- Telopeptido C-Terminal do Colagénio tipo I DEXA- Densitometria de duplo feixe de raios-X DGAV- Direção geral de alimentação e veterinária DMO- Densidade de Massa Óssea
DP- Desvio padrão DPD- Desoxipiridinolina E2- Prostaglandina
EDTA- Ácido etilenodiamino tetra-acético EMA- Agencia Europeia dos Medicamentos FDA- Food and drug administration
g- Grama
GIO- Osteoporose induzida por glucocorticoides Gla- Ácido gamalinolênico
h- Horas
HCl- Ácido clorídrico IL- Interleucina IM- Imobilização INF- Interferão
kDa- Quilodaltons Kg- Quilograma L- Litro
m- Massa
mA- Miliamperes
M-CSF- Fator macrofágico estimulante de colónias MEC- Matriz extra-celular
Micro-CT- Micro Tomografia computorizada ml- Mililitro
mM- Milimolar
MMPs- Metaloproteinases de Matriz N- Newton
n- Número de animais NaCl- Cloreto de zinco
NTx- Telopeptido N-terminal do colagénio tipo I ºC - Graus Celsos OC- Osteocalcina OPG- Osteoprotegerina OPN- Osteopontina ORX- Orquietomia OVX- Ovarietomizado
P1NP- Propéptido N-terminal do procolagénio tipo I PAGE- Electroforese em gel de poliacrilamida PBS- Tampão fosfato salino
PCR- Proteina C reativa pH- Potencial de Hidrogénio PTH- Hormona da paratiróide
RANK- Recetor Activator do Fator Nuclear κB
RANKL- Ligando do recetor activator do fator nuclear κB RAS - Sistema renina angiotensina aldosterona
RE- Recetor de estrogénio rpm- Rotações por minuto
SD- Sprague dawley
SDS- Dodecil sulfato de sódio SHAM- Cirurgia simulada
SIBLING- Small Integrin-binding Ligand, N-linked Glycoprotein Tb.N- Número de trabéculas
Tb.Sp- Espaçamento dos trabéculas Tb.Th- Espessura das trabéculas
TBS-T- Tampão fosfato salino – Tween
TGF- Fator de crescimento e transformação TNF- Fator de necrose tumoral
Tris- tris(hidroximetil)aminometano TV- Volume trabécular v- Volume Zn2+- Zinco ZnCl2- Cloreto de Zinco α- Alfa β- Beta γ- gama μm- Micrómetro
I. Introdução
O sistema esquelético humano é normalmente constituído por cerca de 206 ossos em idade adulta e embora pareça estático está em constante actividade, havendo um equilíbrio entre a reabsorção e a formação dos diversos componentes ósseos. Caso ocorra uma perturbação deste equilíbrio, os ossos ficam susceptíveis a lesões e diversas doenças.
Existe portanto a necessidade de compreender o metabolismo do osso e de desenvolver, ao nível da medicina, técnicas que permitam monitorizar rotineiramente o estado dos ossos do organismo. Será assim possível diagnosticar as doenças inerentes com maior celeridade, possibilitando um maior sucesso no tratamento das mesmas e minimizando desta forma o impacto que estas têm na qualidade de vida dos indivíduos afetados.
1. Tecido Ósseo
O osso é o principal constituinte do esqueleto. Este confere a função de suporte e apoio para os músculos, proteção de órgãos vitais e funciona como reserva de minerais como cálcio e fósforo (Gartner e Hiatt, 2011).
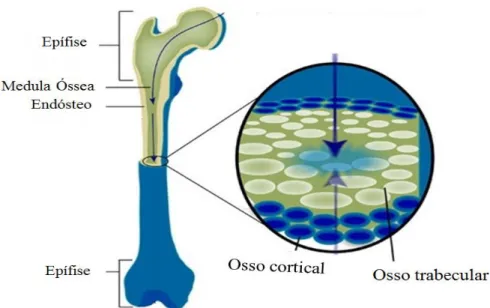
Existem dois tipos de tecido ósseo: o cortical e o trabécular (figura 1). O osso cortical ou compacto é formado por lâminas ósseas paralelas e extremamente próximas entre si, constituindo uma substância dura e compacta que confere resistência ao osso. Em termos gerais, este é responsável pela formação de uma camada exterior de espessura variável, por sua vez revestida por uma membrana resistente denominada periósteo. A sua porosidade é de apenas 5 a 30% e representa 80% do total da massa óssea do esqueleto. O osso trabécular ou esponjoso é muito menos espesso, já que é formado por lâminas ósseas irregularmente dispostas nos vários sentidos, deixando espaços livres, designados de trabéculas, ocupados pela medula óssea. Este possui uma porosidade de cerca de 30 a 90% e constitui à volta de 20% de toda a massa óssea de um individuo normal (Nyman et al., 2010).
O osso cortical encontra-se em grandes quantidades na superfície das epífises do osso e na diáfise dos ossos longos. Por sua vez o osso trabécular encontra-se sobretudo no centro dos ossos curtos e dos ossos longos. Nos ossos chatos encontram-se duas camadas de osso cortical separadas por osso trabécular (Nyman et al., 2010).
No osso, o primeiro tecido a ser formado é do tipo primário. Este tecido é do tipo não lamelar, apresentando fibras colágenosas dispostas sem organização definida. O tecido ósseo primário é gradualmente substituído por tecido ósseo secundário ao longo do tempo. Num adulto a quantidade de osso primário é vestigial, encontrando-se apenas nos alvéolos dentários e nas suturas dos ossos cranianos. Por sua vez o tecido ósseo secundário é constituído por fibras de colagénio dispostas em lamelas de 3 a 7 µm de espessura, que se encontram paralelas umas às outras ou em camadas concêntricas (Carneiro e Junqueira, 2008).
Figura 1: Esquema representativo dos vários tipos de tecidos ósseos presentes no esqueleto
(adaptado de: http://www.betterbones.com/bonefracture/physicalconditions.aspx)
O tecido ósseo é um tipo de tecido conjuntivo especializado, constituído por células e matriz óssea. A matriz óssea é composta por uma parte orgânica (35%) e uma parte inorgânica (65%), que está relacionada com a rigidez e resistência do osso. A matriz orgânica é composta na sua grande maioria por colagénio tipo I e por algumas glicoproteínas e proteoglicanos. A parte inorgânica é constituída por iões de fosfato e cálcio, formando compostos como os cristais de hidroxiapatite, tornando o osso forte e flexível (Carneiro e Junqueira, 2008).
O tecido ósseo é também formado por vários tipos de células como osteócitos, osteoblastos, osteoclastos e células de revestimento ósseo (Gartner e Hiatt, 2011).
Os osteoblastos localizam-se na superfície do osso, formando lâminas de células cuboides e colunares. Estas células são responsáveis pela síntese dos componentes orgânicos da matriz óssea, como o colagéneo I, proteoglicanos e glicoproteínas. São
também responsáveis pela mineralização óssea, devido a acumulação de fosfato de cálcio na matriz óssea (Crowder e Stout, 2011; Rosenberg et al., 2012).
Os osteócitos são células achatadas derivadas dos osteoblastos que se encontram dentro da matriz óssea, estas irradiam prolongamentos, que comunicam através de canalículos com outros osteócitos formando junções comunicantes. Estas permitem a troca de iões, nutrientes e fluido extracelular entre estas células, que são essenciais para a manutenção da matriz óssea (Carneiro e Junqueira, 2008; Schaffler e Kennedy, 2012).
Por sua vez os osteoclastos são células gigantes muito ramificadas e multinucleadas, com função de reabsorver o tecido ósseo. Encontram-se sob a forma de porções dilatadas em lacunas da matriz (lacunas de Howship). Estas segregam para o interior da matriz óssea iões H+, colagenases e hidrolases, dissolvendo os cristais de sais de cálcio o que possibilita a degradação da matriz óssea (Crowder e Stout, 2011).
As células de revestimento do osso cobrem a superfície do osso numa fina camada e são particularmente evidentes no esqueleto adulto. Estas têm núcleos achatados ou levemente ovoides e podem conectar-se entre si por via de junções. Desta forma têm a capacidade de comunicar entre si através de sinalizadores celulares. As células de revestimento podem ser induzidas a proliferar e diferenciar-se em células osteogénicas podendo ser consideradas uma fonte de precursores osteogénicos. Devido a ativação da remodelação óssea que ocorre nas superfícies ósseas estas podem estar envolvidas na propagação do sinal de ativação que inicia a reabsorção do osso e remodelação óssea. Evidências sugerem que estas células são também importantes para a manutenção dos fluxos de iões entre o osso e o fluido intersticial contribuindo para a homeostase mineral (Miller et al., 1989; Eriksen, 2010).
O tecido ósseo embora pareça estático é constantemente renovado, deste modo processos de reabsorção e de formação óssea ocorrem simultaneamente nos organismos vertebrados (Hertrampf et al., 2008). A remodelação óssea é crucial para a manutenção da qualidade do osso.
2. Metabolismo Ósseo
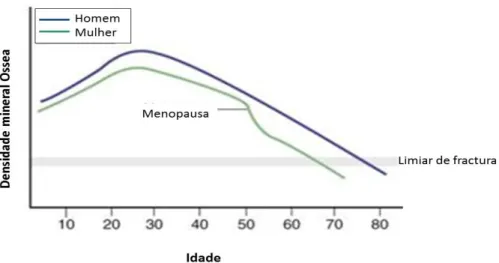
Durante a infância e puberdade a formação óssea ocorre mais rapidamente que a reabsorção, fazendo com que a massa óssea aumente até aos 25-30 anos de idade (figura 2). A partir desse pico a taxa de reabsorção começa a alcançar a taxa de formação, resultando numa diminuição da massa óssea com o aumento da idade (Wu et al., 2011)
Figura 2: Variação da densidade mineral óssea ao longo da idade em humanos (adaptado de:
http://www.cixip.com/index.php/page/content/id/746).
Estima-se que cerca de 10% de todo o esqueleto humano seja renovado a cada ano através deste processo, verificando-se deste modo a importância do metabolismo ósseo nos organismos vertebrados (Lerner, 2006 a).
O processo de remodelação ocorre em pequenos conjuntos de células chamadas de unidades multicelulares básicas de remodelação óssea (BMU), sendo caracterizado pela combinação das funções dos osteoclastos e osteoblastos (Riggs e Parfitt, 2005; Rosenberg et al., 2012).
A primeira etapa do metabolismo ósseo envolve o recrutamento das células precursoras dos osteoclastos para o osso. Esta fase designa-se normalmente de fase de ativação (figura 3). As células percursoras de osteoclastos estão presentes em tecidos hematopoéticos, como a medula óssea e respondem a sinais hormonais. Quando recrutadas, as células agrupam-se e fundem-se em osteoclastos multinucleados, em determinada região da superfície óssea que será reabsorvida. (Lewiecki, 2011).
A diferenciação das células progenitoras em osteoclastos ocorre por meio de um mecanismo que envolve a interação com células osteoblasticas. Após a diferenciação, ocorre a remoção da camada osteoide não-mineralizada, através dos osteoclastos que produzem enzimas proteolíticas, como as metaloproteinases. Este processo facilita o acesso dos osteoclastos ao osso subjacente (Boyle et al., 2003; Proff e Romer, 2009).
A fase seguinte é vulgarmente designada de reabsorção. Nesta ocorre o reconhecimento das proteínas da matriz óssea por meio de recetores de membrana chamadas integrinas (Proff e Romer, 2009).
As integrinas desempenham um papel fundamental na interação celular com as proteínas da matriz óssea. Nas zonas claras são formadas adesões focais, responsáveis pela forte interação célula/substrato e pelo isolamento do espaço externo abaixo da célula (lacuna de reabsorção). Posteriormente ocorre a ativação osteoclástica, provavelmente iniciada pelos fatores libertados pelos osteoblastos e pelo contacto célula a célula. De seguida, os osteoclastos ativados degradam os componentes minerais e orgânicos, libertando-se fragmentos de minerais ósseos e de colágenio. Os osteoclastos são estimulados pelo calcitriol, fator de necrose tumoral (TNF), prostaglandina (E2), interleucina-1 (IL-1) e interleucina-6 (IL-6), e são inibidos por interleucina-4 (IL-4) e interleucina-13 (IL-13) e estrogénios (Lewiecki, 2011). Seguidamente ocorre a fase designada de reversão, que é caracterizada pela apoptose dos osteoclastos, possivelmente induzida pelo fator de crescimento e transformação beta (TGF-β) e ativação dos osteoblastos. Nesta fase ocorre o início da formação óssea que resulta de uma complexa cascata de eventos que envolve a proliferação de células mesenquimais primitivas, diferenciação de pré-osteoblasto, maturação dos osteoblastos, formação de matriz e finalmente mineralização (Hadjidakis e Androulakis, 2006)
Figura 3: Diferentes fases da remodelação óssea (adaptado de: Proff e Romer, 2009).
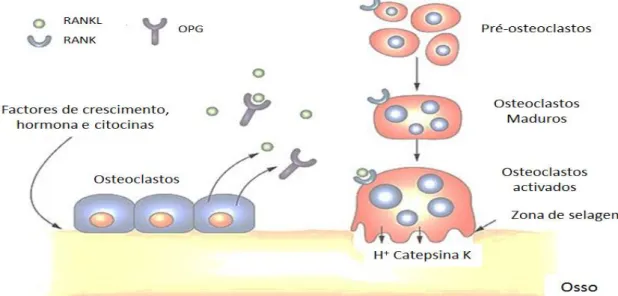
Os ovários são a principal fonte de estrogénios circulantes. Estas são hormonas sexuais femininas com inúmeras funções fisiológicas, nomeadamente na regulação da produção da citocina RANK ligando (RANKL) e osteoprotegerina (OPG) (Palacios et al., 2005; Rosenberg et al., 2012).
A OPG e RANKL são conhecidas como sendo os principais fatores envolvidos na génese de osteoclastos. A RANKL inibe a apoptose dos osteoclastos, estimulando a diferenciação e ativação dos mesmos. A OPG tem uma função antagónica ao RANKL, podendo atuar inibindo o receptor activator do fator nuclear κB (RANK) através da ligação com o receptor ativator do RANKL ou diretamente por meio de outros recetores presentes nos osteoclastos (figura 4) (Lewiecki, 2011).
Figura 4: Via de regulação do RANKL, RANK e OPG e sua influência na reabsorção óssea (adaptado de:
Lewiecki, 2011).
Sabe-se que os estrogénios desempenham um papel crucial na remodelação óssea devido a sua ação sobre os osteoclastos entre outros intervenientes e sinalizadores celulares. Existem dois tipos distintos de recetores de estrogénios (RE). Estes são designados de REα e REβ. O REα encontra-se distribuído por todo o organismo e é expresso nos osteoclastos e osteoblastos. Por outo lado o REβ é expresso essencialmente em tecidos epiteliais e mesenquimais, incluindo osteoblastos (Almeida et al.,2013).
A ativação dos recetores de estrogénios nas células progenitoras de osteoclastos inibe a sua maturação e como consequência ocorre diminuição da sua produção. Quando estes recetores são ativados ao nível de osteoclastos maduros, conduzem a inibição da sua atividade, impedindo a sua ação destrutiva no tecido ósseo (Almeida et al.,2013).
Sabe-se que o estrogénio estimula a expressão de colagénio tipo I e restringe a produção de um forte estimulador de osteoclastos, o fator macrofágico estimulante de colónias (M-CSF). A constatação de que o estrogénio pode diminuir a apoptose dos
osteoblastos, aumentando assim o tempo de vida destas células foi apresentada também como um mecanismo pelo qual o estrogénio pode controlar a formação de osso (Rosenberg et al., 2012).
Alterações nos níveis de estrogénios poderão conduzir a uma perturbação do equilíbrio da remodelação óssea, devido a uma quantidade de osso absorvida superior a quantidade de osso formado, resultando no aparecimento de uma doença designada de osteoporose.
3. Osteoporose
A diminuição da densidade óssea é designada de osteopenia, no entanto quando esta diminuição ocorre de forma drástica, enfraquecendo de tal modo o osso que fica suscetível a fratura designa-se por osteoporose. A osteoporose é uma doença e pode ser classificada em dois tipos, primária e secundária.
A osteoporose primária refere-se a um aparecimento súbito desta condição sem uma causa aparente, normalmente relacionado com o avanço da idade (Orimo et al., 2001).
Por sua vez a osteoporose secundária refere-se ao aparecimento desta condição como consequência de uma outra doença que afeta o ritmo normal do metabolismo ósseo. A artrite reumatóide, hipertiroidismo e doença de Cushing's são exemplos dessas doenças. O tratamento destas doenças deverá fazer aumentar a relação formação/reabsorção óssea permitindo a recuperação do estado de osteoporose (Orimo et al., 2001)
A osteoporose é uma doença metabólica caracterizada pela redução da densidade óssea e alteração da microarquitectura do tecido ósseo, que conduz à fragilização do osso, tornando-o mais suscetível a fraturas (figura 5). A taxa de remodelação do osso trabécular é normalmente muito elevada quando comparada com a do osso cortical. Esta diferença no metabolismo destes dois tecidos ósseos explica porque as doenças ósseas metabólicas, tal como a osteoporose afectam principalmente o osso trabécular (Lerner, 2006 a; Hertrampf et al., 2008).
Esta doença está normalmente relacionada com os níveis de estrogénio no sangue, sendo o seu aparecimento mais frequente em mulheres que homens, uma vez que as mulheres sofrem uma queda brusca na concentração de estrogénios na menopausa (Wu et al., 2011). Os estrogénios ajudam a controlar o equilíbrio entre o
ganho e perda de massa óssea devido a sua ação inibidora sobre os osteoclastos (Hertrampf et al., 2008).
A B
Figura 5: A- Osso Normal; B- Osso com osteoporose (adaptado de:
http://www.drwolgin.com/Pages/osteoporosis.aspx)
A osteoporose é uma doença de progressão lenta e normalmente assintomática, só sendo normalmente detetada quando surgem as primeiras fraturas. Estas fraturas surgem numa fase já bastante avançada da doença uma vez que a densidade óssea se encontra em valores próximos do limiar de fratura. Esta baixa densidade óssea faz com que o osso frature com extrema facilidade face a um choque mecânico ou aplicação de força exagerada sobre o osso. Os pontos mais fracos do esqueleto normalmente são as vértebras, os pulsos, as ancas e o fémur, fazendo com que muitas das fraturas tenham um impacto grande ao nível da locomoção do paciente e da sua qualidade de vida (Lerner, 2006 a).
Quando os níveis de estrogénios caem abaixo de um nível crítico, a sua ação de regulação negativa sobre os osteoclastos é significativamente reduzida. Este facto resulta num aumento exponencial do número dos osteoclastos, diminuição da diferenciação e proliferação de osteoblastos, bem como na alteração dos níveis normais de vários sinalizadores do metabolismo ósseo o que resulta num impacto direto sobre a remodelação (figura 6) (Rosenberg et al., 2012).
Figura 6: Efeito da diminuição dos estrogénios nos osteoblastos, osteoclastos e outros fatores ósseos
(adaptado de: http://www.endotext.org/chapter/glucocorticoid-induced-osteoporosis).
Bcl-2:célula B de linfoma 2; Bax: Bcl-2 associada a proteína X; RANK: recetor activador do fator nuclear κB; RANKL: Ligando do recetor activator do fator nuclear κB; OPG: osteoprotegerina; IL-1,6,11: interleucinas 1,6,11; TGF-β: fator de crescimento e transformação beta; TNF-α: fator de necrose tumoral alfa e M-CSF: factor macrofagico estimulante de colónias
Uma hiperatividade dos osteoclastos, devido a uma descoordenação de proteínas sinalizadoras como a calcitocina e outras citocinas devido a carência de estrogénios conduz a um aumento na taxa de RANKL e OPG e a um aumento da expressão do M-CSF que conduzem à dissolução dos sais de cálcio da matriz óssea, originando lacunas (figura 7). Desta forma as redes de colagénio ficam desmineralizadas permitindo a ação das colagenases, levando ao aparecimento de fissuras no osso que fica menos denso e por isso mais frágil (Proff e Romer, 2009).
Entre as citocinas com propriedades de reabsorção, influenciadas pelo estrógenio, destaca-se a IL-1 e a IL-6. A deficiência estrogénica provoca aumento na secreção dessas citocinas, que vão conduzir ao aumento da atividade de reabsorção do osso através da sua ação direta nas células percursoras de osteoclastos levando a sua maturação ou indiretamente afetando os níveis de expressão dos sinalizadores RANKL e OPG. O facto dos níveis de interleucina aumentarem estimula os monócitos e as células T a produzirem TNF-α que por sua vez estimula os osteoclastos (Elavarasu et al., 2012).
Figura 7: Mecanismo fisiopatológico da osteoporose (adaptado de: Elavarasu et al., 2011).
Várias citocinas e mediadores inflamatórios demonstraram ser capazes de estimular a formação de osteoclastos e a reabsorção óssea (figura 8). Por conseguinte, têm sido implicados na etiopatologia da osteoporose induzida por inflamação, originando a reabsorção óssea (Lewiecki, 2011).
As citocinas como a bradicinina, calidina e trombina têm um efeito estimulante sobre a produção de osteoclastos. Estas estimulam o RANKL, bem como a OPG que vão afetar os osteoblastos e osteoclastos. As quimiocinas são importantes para o recrutamento de células progenitoras de osteoclastos para o foco inflamatório, e também para a fusão das células, originando os osteoclastos multinucleados (Yu et al., 2004).
Existem também estudos que demostram o envolvimento da células T na perda de massa óssea induzida por inflamação devido à possível capacidade destas expressarem o ligando RANK (Yu et al., 2004; Lerner, 2006 b; Cochran, 2008).
Figura 8: Remodelação óssea induzida por processo inflamatório (adaptado de: Cochran, 2008).
4. Avaliação do Metabolismo Ósseo
4.1 Diagnóstico da osteoporose
Atualmente a osteoporose é uma doença crónica sem tratamento definitivo, portanto é importante o diagnóstico rápido da mesma. Vários métodos têm sido utilizados com o intuito de diagnosticar e auxiliar o acompanhamento clínico desta doença para que seja possível retardar e minimizar os seus efeitos, melhorando a qualidade de vida do individuo (Wu et al., 2011).
Estes métodos de diagnóstico dividem-se em dois grandes grupos, os laboratoriais e os não laboratoriais.
4.1.1 Métodos Laboratoriais
4.1.1.1 Biomarcadores do metabolismo ósseo
Este tipo de marcadores bioquímicos pode ser quantificado através de testes laboratoriais, onde se faz a avaliação de parâmetros séricos no sangue e urina que ajudam a determinar alterações da taxa de reabsorção e formação óssea. Assim podem
indicar a presença ou ausência de uma patologia óssea, prevendo o comportamento dessa mesma patologia (Srivastava, 2005).
Os marcadores do metabolismo ósseo ajudam a inferir sobre os principais órgãos e sinalizadores celulares que possam estar envolvidos na etiopatologia da osteoporose (Srivastava, 2005).
Os dois maiores grupos são então os marcadores de reabsorção e formação óssea (tabela 1). No entanto existem outros marcadores do metabolismo ósseo baseados nos mecanismos inflamatórios (Hertrampf et al., 2009).
Marcadores de formação/reabsorção óssea
Dada a complexidade do metabolismo do tecido ósseo é normalmente necessário utilizar marcadores mais específicos para avaliarem a perda de osso e a regeneração do osso, de forma independente.
Tabela 1: Marcadores de reabsorção/ formação óssea
Marcadores de formação óssea Marcadores de reabsorção óssea
Fosfatase alcalina (ALP)
Fosfatase alcalina óssea (BALP) Osteocalcina (OC)
Osteopontina (OPN)
Propéptido N-terminal do procolagénio tipo I (P1NP)
Desoxipiridinolina (DPD)
Fosfatase ácida resistente ao tartarato (TRAP)
Telopeptido C-Terminal do Colagénio tipo I (CTx)
Telopeptido N-terminal do colagénio tipo I (NTx)
Metaloproteinases de matriz (MMPs)
Fosfatase Alcalina
A fosfatase alcalina (ALP) designada pelo código EC 3.1.3.1 pelo comité internacional da bioquímica e biologia molecular é uma enzima hidrolítica responsável pela remoção de grupos fosfato de vários tipos de moléculas, como os nucleótidos, proteínas e alcaloides. O processo de remoção do grupo fosfato é efetuado com recurso a um processo designado fosforilação (Harrison et al., 2008).
Nos mamíferos em geral, a fosfatase alcalina está presente na maioria dos tecidos do organismo, sendo a sua concentração particularmente elevada no fígado, vias biliares, rins e osso. O intervalo normal da fosfatase alcalina é variável consoante a espécie e o tecido em análise. Varia também de acordo com o sexo, idade, concentração de estrogénios. Clinicamente níveis elevados da enzima ALP podem ser indicadores de
que os ductos biliares estão obstruídos, gravidez e perda óssea acelerada (Harrison et al., 2008).
A fosfatase alcalina específica do osso é uma das várias isoenzimas da fosfatase alcalina. Esta é sintetizada pelos osteoblastos, estando envolvida no metabolismo ósseo. Embora o seu papel específico no processo de formação óssea seja ainda desconhecido pensa-se que esteja diretamente envolvida na calcificação da matriz óssea. É portanto considerado um marcador altamente específico do metabolismo ósseo, em especial da formação do osso através dos osteoblastos. Valores muito elevados desta enzima estão normalmente relacionados com o aumento de doençass associadas ao metabolismo ósseo como a osteoporose, doença de Paget e hipertiroidismo (Millán, 2006).
Osteopontina
A osteopontina também conhecida como sialoproteina I, tem um peso molecular que ronda os 66 kDa e é codificada pelo gene OPN. Em seres humanos o gene situa-se no braço longo do cromossoma 13. O gene é composto por sete exões (Kiefer et al., 1989; Young et al., 1990). A OPN é uma proteína da matriz extracelular (MEC) carregada negativamente. É composta por cerca de 300 aminoácidos (297 em rato e 314 em humanos). Esta proteína pode sofrer modificações pós-tradução, que aumentam o seu peso molecular em cerca de 44 kDa (Rangaswami et al., 2006). Esta glicoproteína não colagenosa foi pela primeira vez descrita em 1986, pertencendo atualmente a categoria das proteínas SIBLING (Small Integrin-binding Ligand, N-linked Glycoprotein) (Huang et al., 2005; Banerjee et al. 2009). É caracterizada como uma proteína multifuncional, que embora seja altamente expressa ao nível dos ossos pode ser encontrada em muitos tecidos do organismo, nomeadamente nos macrófagos, células endoteliais, células musculares lisas e placenta. A nível do osso são produzidas por fibroblastos, pré-osteoblastos, osteoblastos, osteócitos, odontoblastos, células de medula óssea e condrócitos hipertróficos (Ashizawa et al., 1996).
Apesar de ainda não se compreenderem detalhadamente as vias de regulação da expressão da OPN, pensa-se que esta esteja envolvida na regulação da mineralização óssea uma vez que é fortemente produzida pelos osteoclastos e osteoblastos. Em particular, os estudos nesta área sugerem que desempenhe um papel na fixação dos osteoclastos à matriz mineral dos ossos (Huang et al., 2005; Banerjee et al., 2009).
Pensa-se que a estimulação da expressão da OPN também ocorra após a exposição das células a citocinas pró-inflamatórias, mediadores clássicos de inflamação aguda (TNF-α, IL-1β, angiotensina II e hormona paratiróide (PTH) (Guo et al., 2001).
O facto de a osteopontina interagir com vários recetores da superfície celular que são expressos ubiquamente torna-a um componente ativo em muitos processos fisiológicos e patológicos, incluindo a cicatrização de feridas, remodelação óssea, tumorogénese, inflamação, isquemia e resposta imunitária. Portanto, a manipulação dos níveis plasmáticos de OPN pode ser útil no tratamento de doenças autoimunes, metástase do cancro e osteoporose (Wang e Denhardt, 2008).
Osteocalcina
A osteocalcina é uma proteína não colagenosa dependente da vitamina K, com um peso molecular de 5 a 6 kDa. É codificada pelo gene BGLAP, sendo produzida no osso pelos osteoblastos maduros e secretada para o espaço extracelular, onde podem entrar na circulação sanguínea ou ligar-se ao osso mineralizado (Puchacz et al., 1989).
Esta contém três resíduos de ácido gamalinolênico (Gla), que são pos-transcricionalmente modificados pela gama-glutamil carboxilase. A carboxilação destes resíduos é essencial para facilitar a sua ligação à hidroxiapatite e posterior deposição na matriz óssea mineralizada. Deste modo a osteocalcina circulante pode estar presente na forma carboxilada como descarboxilada. A vitamina K desempenha portanto um papel especialmente importante por ser um cofator da gama-glutamil carboxilase responsável pela carboxilação da OC, reduzindo deste modo a libertação de OC para a circulação (Yu et al., 2010).
A OC normalmente está implicada na homeostase iónica do cálcio e vários estudos apontam para uma correlação direta entre o aumento dos níveis de soro de osteocalcina e o aumento da densidade mineral óssea. Desde que se descobriu este facto começou a ser utilizada em larga escala como biomarcador do metabolismo ósseo (Huang et al., 2005). Vários autores observaram que existe uma associação entre os níveis desta proteína e o metabolismo energético em modelos animais, devido a relação inversa entre o nível de glicose no plasma/ massa gorda e níveis de OC (Razzaque et al., 2011).
MMPs:
As metaloproteinases de matriz são protéases, endopeptídases dependentes de zinco. Estas constituem uma família de enzimas estruturalmente relacionadas que desempenham um papel fundamental na degradação da matriz extracelular em situações normais ou patogénicas. Estão normalmente implicadas em processos de desenvolvimento embrionário, cicatrização de lesões, angiogénese, imunidade, inflamação, metastização e degradação óssea (Ortega et al., 2003; Yu e Han, 2006).
Foram descritas pela primeira vez por Jerome Gross e Lapière em 1962, que observaram atividade enzimática das mesmas ao nível da matriz extracelular (Krane e Inada, 2008).
Existem mais de 20 metaloproteinases, cada uma codificada por um gene diferente. As MMPs podem ser classificadas em pelo menos cinco grupos principais, de acordo com a sua especificidade, estrutura primária do substrato e localização celular (tabela 2) (Murphy et al., 2002; Visse e Nagasse, 2003). Os principais grupos são: as colagenases, gelatinases, estromelinas, matrilisinas e MMs do tipo membranar (MT-MMPs). Existem outras metaloproteinases que não se enquadram em nenhum deste grupo, tendo portanto uma classificação distinta (Murphy et al., 2002).
Tabela 2: Classificação das diversas Metaloproteinases de matriz (adaptado de: Murphy et al., 2002).
Tipo Gene Substratos principais
Colagenases
MMP-1 MMP-8 MMP-18
Colagénio I,II,III IV e X, gelatina, proteoglicanos, agracano, versicano. Colagénio I,II,III V, VII, VIII e X, gelatina, α-2 antiplasmina.
Colagénio I,II,III e IV, gelatina, plasminogénio, tenascína.
Gelatinases MMP-2
MMP-9
Colagénio I, IV,V,VII, X, XI, gelatina, fibronectina, elastina, agecano. Colagénio IV,V,VII, X, XIV, gelatina, elastina, fibronectina.
Estromelisinas
MMP-3 MMP-10 MMP-11
Colagénio III, IV, IX, X, gelatina, elastina, lamilina, agrecano, perlecano. Colagénio III, IV e V, gelatina, caseína, elastina, fibronectina, agrecano. Inibidor de protéase α-1
Matrilisinas MMP-7
MMP-26
Colagénio IV e X, gelatina, caseína, elastina, transferrina, agrecano Colagénio IV fibronectina, fibrinogénio, gelatina.
MT- MMPs MMP-14 MMP-15 MMP-16 MMP-17 MMP-24 MMP-25
Colagénio I,II e III gelatina, elastina, fibronectina, vitronectina. ProMMP-2, gelatina fibronectina, tenascina, nidogénio, lamelina. ProMMP-2.
ProMMP-2, gelatina.
ProMMP-2, ProMMP-9 e gelatina
Colagénio IV, gelatina, fibronectina e fibrina.
Novas MMPs
MMP-19 MMP-20 MMP-22 MMP-28
Colagénio IV, gelatina, lamelina, nidogénio, tenascina, fibronectina. Amelogenina.
Gelatina e caseína Caseína
As MMPs têm um domínio estrutural semelhante. Na maior parte dos casos são constituídas pelo domínio pro-peptídeo, domínio catalítico e domínio tipo hemopexina C-terminal (Yu e Han, 2006).
As MMPs são produzidas por diversos tipos de células, incluindo linfócitos T e B, fibroblastos, macrófagos, neutrófilos e algumas células epiteliais (Maugeri et al., 2005).
Em condições fisiológicas normais, a atividade das MMPs é regulada através de 3 processos distintos: ativação do percursor zimogénio, regulação dos níveis de transcrição e inibição endógena, através de inibidores de metaloproteinases de matriz. É discutível qual destes processos será mais importante a nível da regulação e qual o impacto que cada um tem na ativação das metaloproteinases. Pensa-se que a regulação transcricional e inibição endógena sejam os processos com maior impacto na regulação das MMPs (Visse e Nagasse, 2003).
São várias as enzimas proteolíticas que degradam a matriz óssea, existindo duas categorias principais de protéases que atuam sobre a matriz óssea: as protéases de cisteína e as metaloproteinases de matriz. O efeito das meteloproteinases está associado ao fornecimento adequado de estrogénios no microambiente ósseo. Caso este fornecimento seja alterado é possível que ocorra a desregulação dos mecanismos de turnover ósseo que vai originar o aparecimento de patologias (Ortega et al., 2003).
As MMPs são essenciais para a iniciação do processo de reabsorção osteoclástica removendo o colagénio da superfície do osso facilitando a sua desmineralização (Ortega et al., 2003).
As colagenases são enzimas que permitem a quebra das ligações peptídicas no colagénio, que se encontra em grandes quantidades na matriz extracelular. As estromelisinas embora exibam uma ampla capacidade para clivar as proteínas de matriz extracelular revelam-se incapazes de clivar os colagénios triplo-helicoidais (Lim e Kim, 2007).
As gelatinases permitem que os organismos possam hidrolisar gelatina em sub-compostos (polipéptidos, péptidos, e aminoácidos) de modo a poderem atravessar a membrana celular e serem utilizados pelo organismo (Hujanen, 2005).
A importância das metaloproteinases de matriz na osteogénese tem sido descrita por vários investigadores, especialmente a MMP-2 e MMP-9. A MMP-2 (72 kDa) e MMP-9 (92 kDa) são designadas respectivamente de gelatinase A e B. Estas têm uma ampla especificidade de substrato, dos quais se destacam a gelatina e vários tipos de
colagénio, entre os quais o colagénio do tipo IV, um dos principais componentes da membrana basal (Murphy et al., 2002). Estes dados levam a acreditar que as MMPs são normalmente necessárias ao desenvolvimento e remodelação do tecido ósseo (Krane e Inada, 2008).
A MMP-2, na sua forma ativa (62 kDa) é uma das MMPs mais importantes na preservação da massa óssea. Esta é altamente expressa no desenvolvimento das células ósseas, em especial nos osteoclastos. Além disso, o potencial da MMP-2 é enfatizado pelas descobertas de que é capaz de clivar colagénios fibrilares nativos que potencializam pro-MMP-9. Este facto aponta para que tenham um papel fundamental na degradação da matriz óssea, contribuindo para o normal metabolismo ósseo (Krane e Inada, 2008). A MMP-2 é a mais amplamente distribuída, estando associada a células do tecido conjuntivo, incluindo fibroblastos e osteoblastos. A sua indução difere fundamentalmente das outras MMPs devido a elementos promotores de genes distintos, que lhe conferem características de expressão constitutiva, indicando provavelmente um papel na dissolução de colagénios danificados ou desnaturados (Mansell et al., 1997).
O papel das mesmas no metabolismo ósseo pode ser observado através do tratamento de cobaias com um inibidor de MMP de largo espectro.Verificou-se que animais MMP-2 knockout apesar de se desenvolverem sem anomalias aparentes, apresentavam ausência de enzimas activas relacionadas a forma autossómica recessiva de osteólise multicêntrica, um distúrbio genético raro que causa a destruição e reabsorção do osso. Mutações no gene MMP2 estão associadas à síndrome de Torg-Winchester, doença autossómica recessiva caracterizada por uma osteólise generalizada, osteoporose grave e artropatia progressiva (Krane e Inada, 2008).
Segundo Nyman et al. (2011) os murganhos MMP-2 knockout registam uma menor DMO do que os ossos dos murganhos do tipo selvagem, mas aparentemente não apresentavavam diferenças no seu comprimento, sugerindo MMP-2 tem uma influência na composição das propriedades biomecânicas do osso.
A MMP-9 é considerada uma das principais protéases responsáveis pela degradação da matriz óssea. Os seus elevados níveis de expressão no tecido ósseo, especialmente nos osteoclastos levam-nos a acreditar no seu papel fundamental para a remodelação e regeneração óssea (Ortega et al., 2003). Os animais sem o gene MMP-9 apresentam manifestações fenotípicas muito pronunciadas, exibindo cartilagem substancialmente hipertrofiada, ossificação deficiente e um atraso na formação da medula óssea. As cobaias MMP-9 knockout revelam também uma diminuição da
formação do osso trabécular e do recrutamento dos osteoclastos (Ortega et al., 2003). Segundo Nyman et al. (2011) os ossos longos de murganhos MMP-9 knockout foram 10% mais pequenos do que os ossos dos ratos do tipo selvagem, sugerindo que esta MMP, tem uma influência estrutural sobre as propriedades biomecânicas dos ossos.
Apesar de ainda ser mal compreendido o papel destas MMPs na formação e reabsorção óssea sabe-se que as gelatinases podem influenciar a arquitectura óssea e as propriedades biomecânicas do osso. Este facto baseia-se nas capacidade da MMP-2 e MMP-9 em processar vários tipo de colagénio, que são críticos para a capacidade do tecido ósseo dissipar energia (Krane e Inada, 2008).
Sabe-se também que a MMP-2 e MMP-9 têm a capacidade de regular a biodisponibilidade e bioatividade do TGF-β através do processamento das proteínas que o tranportam. O seu papel no turnover da matriz óssea e na ativação dos fatores de crescimento, constituem um fator de peso para realçar o papel das gelatinases na microarquitectura óssea (Nyman et al., 2011).
Marcadores Inflamatórios
Nos processos de remodelação óssea induzidos por inflamação, a atividade dos osteoblastos e osteoclastos é influenciada pela sinalização proveniente das células imunitárias mas também de hormonas sistémicas incluindo os estrogénios, pois existem recetores de estrogénios nas células imunitárias (Lerner, 2006 b; Cochran, 2008).
As citocinas são moléculas que influenciam a ativação, crescimento e diferenciação de células. Eles são mediadores que regulam a resposta inflamatória, desempenhando um papel crucial. Sabe-se que várias citocinas bem como outros fatores inflamatórios são capazes de influenciar a reabsorção óssea, induzindo a produção de osteoclastos e a reabsorção óssea (tabela 3) (Cochran, 2008).
Tabela 3: Lista de citocinas pró-inflamatórias envolvidas no metabolismo ósseo.
Citocinas pró-inflamatórias do metabolismo ósseo
Interleucina-1 (IL-1) Interleucina-6 (IL-6) Interleucina-11 (IL-11) Interleucina-17 (IL-17)
Fator de Necrose de Tumor (TNFα) Interferão β (IFNβ)
Proteína C Reativa (PCR)
IL-6
A interleucina-6 atua como citocina pró-inflamatória secundária e anti-inflamatória. Esta é codificada pelo gene IL-6, localizado no braço curto do cromossoma 7. As citocinas do tipo IL-6, também conhecidas por glicoproteína 130 (gp 130), são constituídas por quatro longas α-hélices (Heinrich et al., 2003).
A IL-6 é secretada pelas células T e macrófagos para estimular a resposta imunitária atuando simultaneamente como uma citocina anti-inflamatória e pró- inflamatória, consoante a atividade biológica. Esta citocina é reconhecida como um potente fator da reabsorção óssea, atuando através da estimulação dos osteoclastos no contexto da inflamação crónica e de deficiência em estrogénios. Os estrogénios têm a capacidade de inibir o efeito da IL-6 em células de linhagem osteoclástica, impedindo a perda óssea. Deste modo, verifica-se que está intimamente ligada com as doenças ósseas (Renqing, 2012).
Estudos moleculares indicam que amostras de ossos de fêmeas em menopausicas com osteoporose expressam mais mRNA de IL-6 do que em pós-menopausa com DMO normal. Para além desse facto verifica-se que a produção de IL-6 pelas células sanguíneas aumenta significativamente no tratamento da osteoporose (Renqing, 2012). Estudos experimentais sugerem também que animais com sobreexpressão de IL-6, apresentam um grave comprometimento da microarquitectura óssea cortical e trabécular, consequência da diminuição da osteoblastogénese e aumento
da osteoclastogénese devido a sua ação sobre moléculas sinalizadoras como o RANKL, que, estimula a formação dos osteoclastos (Renqing, 2012).
PCR
A proteína C reativa é uma proteína plasmática de fase aguda produzida no fígado. Foi descoberta por Tillett e Francis em 1930, recebendo a designação de PCR porque foi identificado pela primeira vez no soro de pacientes com inflamação aguda que reagiam com o polissacarídeo C de pneumococos. Inicialmente pensou-se que a PCR podia ser uma secreção patogénica pois os seus níveis encontravam-se elevados em indivíduos com várias doenças, incluindo cancro. Esta hipótese foi mais tarde descartada quando associaram a elevação dos seus níveis a resposta inflamatória (Pepys et al.,2003).
A PCR é codificada pelo gene PCR que está localizado no braço longo do cromossoma 1. É contituída por 224 resíduos de aminoácidos, com uma massa molecular de aproximadamente 25 kDa. Esta proteína é pentamérica com forma de disco e pertence a uma família de proteínas designada de pentraxinas (Murray et al., 2012).
A proteína C reativa possui várias funções associadas à defesa do hospedeiro, nomeadamente: promover a aglutinação, fagocitose de bactérias e fixação de complemento (Pepys e Hirschfield, 2003).
Normalmente a sua concentração é muito baixa em indivíduos saudáveis, porém na presença de estímulos inflamatórios pode ter um aumento significativo. É portanto um indicador extremamente sensível da inflamação (Pablo et al., 2012). O valor da PCR pode subir até 50.000 vezes em caso de inflamação. Obtendo-se um pico máximo por volta das 48 horas após o inicio da resposta. O seu tempo de semivida é constante, portanto, o seu nível é determinado principalmente pela taxa de produção (Pepys Hirschfield, 2003).
Estes aumentos séricos acentuados podem ocorrer não apenas na presença de inflamação mas também infecção, traumatismo e necrose dos tecidos. Como há um grande número de condições diferentes nas quais esta pode aumentar normalmente não é útil no diagnóstico de uma patologia específica. No entanto um elevado nível de PCR pode fornecer um importante suporte para a presença de uma doença inflamatória como artrite reumatóide e até osteoporose. Medir e mapear valores de PCR poderá então ser
também útil para determinar a evolução da doença ou a eficácia dos tratamentos (Murray et al., 2012).
Existem algumas limitações na utilidade clínica da maioria dos marcadores de metabolismo ósseo conhecidos, daí a necessidade da investigação continua no sentido de explorar novas maneiras de melhorar a sua aplicação clínica e até mesmo de encontrar novos marcadores ainda mais fiáveis, que nos permitam estabelecer uma correlação clara entre a sua concentração sérica e o nível de dano ocorrido devido as doenças do metabolismo ósseo.
4.1.2 Métodos não laboratoriais
Dentro dos métodos não laboratoriais destaca-se a medição da densidade mineral óssea (DMO). Este tem sido o método de diagnóstico mais utilizado, visto que diversos trabalhos populacionais demonstram elevada correlação entre a resistência óssea e quantidade de matriz mineralizada (característica medida por esta técnica) (Pablo et al., 2012).
Dentro das técnicas que detetam a osteopenia por avaliação da densidade de massa óssea podemos destacar a radiografia, a densitometria de duplo feixe de raios-X (DEXA), microtomografia computorizada (micro-CT) e a biomecânica.
A radiografia simples é uma técnica muito útil no diagnóstico de osteopenia, detetando o decréscimo da densidade mineral dos ossos. No entanto esta necessita de ser pelo menos 20-40% inferior para que estas alterações sejam visíveis na radiografia (Harrison et al.,2008).
A técnica DEXA usa feixes de raios-X para estimar a densidade mineral óssea. Este método tem sido amplamente utilizado na deteção da osteoporose, entre outras doenças que afetam o metabolismo ósseo, devido a sua sensibilidade na deteção de alterações na DMO e capacidade de prever os riscos de fratura com grande fiabilidade (Gafni e Baron, 2004).
A microtomografia computadorizada é uma técnica não invasiva que gera uma imagem tridimensional do tecido em estudo através de raios-X. O termo micro indica que os tamanhos dos pixéis das seções transversais fotografadas estão na gama dos micrómetros, tratando-se portanto de uma técnica de elevada resolução (Harrison et al., 2008; Mizutani e Suzuki, 2012).
A técnica de biomecânica é uma técnica que avalia a qualidade do osso quando submetido a um stresse de compressão que é normalmente medido em N/cm2 ou Pascal.
No momento da fratura é verificado se a tensão de quebra corresponde a um valor normal ou anormal para as características do osso em estudo. Esta técnica apresenta como desvantagem o facto de ser extremamente invasiva, não podendo ser utilizada em condições clínicas, ou sequer em modelos experimentais com animais vivos (Nyman et al., 2010).
No entanto sabe-se que a DMO é uma medida estática e que por isso não reflecte as alterações dinâmicas que estão a ocorrer no tecido. Um modo de superar esta limitação, melhorando a sensibilidade e a especificidade da avaliação do risco de fratura é desenvolver marcadores bioquímicos de remodelação óssea.
5. Modelos de indução da osteoporose
Nos dias de hoje não existe um modelo animal que represente de forma fidedigna todos os estágios da osteoporose em seres humanos. No entanto existem modelos que se aproximam bastante, permitindo fazer várias comparações Estes modelos de indução de osteopenia/osteoporose podem ser utilizados em vários animais como são exemplos: os murganhos, os ratos, os cobaios, os coelhos, as ovelhas, os cães e alguns primatas (Vermeirsch et al., 2007; Wuttke et al., 2008; Bellido et al., 2010; Hertrampf et al., 2009; Melville et al., 2013)
O porte dos animais a serem utilizados varia de acordo com o parâmetro da doença em estudo, uma vez que os diferentes tipos de animais a utilizar em cada modelo possui diferentes suscetibilidades à progressão da osteopenia. Estes diferentes ritmos de progressão da doença serão refletidos ao nível dos ossos mais suscetíveis em cada animal (Turner, 2011).
A utilização de espécies de maior dimensão deve-se sobretudo à opinião generalizada de que o osso de rato não apresenta remodelação Harversiana característica dos animais de maior (Lelovas et al., 2008; Oheim et al., 2012).
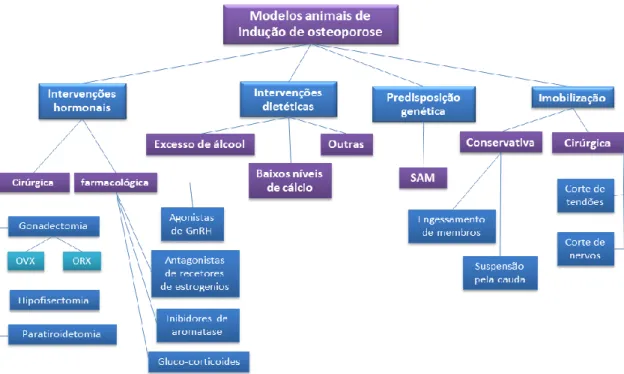
De acordo com a figura 9, podemos constatar que existem vários modelos de indução de osteopenia/osteoporose nos animais. Muitos destes modelos adquiriram uma grande projeção sendo largamente utilizados para estudos de metabolismo ósseo (Lelovas et al., 2008). Os modelos existentes são baseados em intervenções hormonais, dietéticas ou pela imobilização. As intervenções a nível hormonal podem ser cirúrgicas ou através de fármacos. Dentro das técnicas cirúrgicas pode-se referir a gonadectomia, hipofisectomia e paratiroidectomia. No que diz respeito aos procedimentos alimentares
estes podem ser baseados em dietas pobres em cálcio, abusivas em álcool, entre outros fatores. No caso da técnica de imobilização esta pode ser conseguida através de técnicas conservativas ou cirurgicamente (Dion et al, 2011). Existem também modelos animais de senescência acelerada (SAM), geneticamente induzida que retratam com relativa fiabilidade os efeitos do envelhecimento na densidade de massa óssea, simulando os acontecimentos que ocorrem na osteoporose primária. Este modelo oferece também a possibilidade de estudar os genes implicados na senescência que conduz este processo (Jilka et al., 1996; Lü et al., 2009).
Os modelos mais utilizados nesta área são a ovarietomia (OVX), orquietomia (ORX), imobilização (IM) e a osteoporose induzida por glucocorticoides (GIO) (tabela 4) (Jee e Yao, 2001; Oheim et al., 2012).
Figura 9: Modelos de indução de osteopenia/osteoporose (adaptado de: Lelovas et al., 2008).
A ovarietomia também designada por ooforectomia é o modelo animal mais utilizado, sendo particularmente utilizado na investigação em osteoporose pós-menopausa uma vez que o único modelo aprovado para testes pré-clínicos segundo as directrizes regulatórias da FDA (Food and Drug Adinistration) e AEM (Agência Europeia de Medicamentos), com a finalidade de se obter a posterior aprovação da entrada desses mesmos fármacos no mercado (Matthai et al., 2001; Turner, 2008).
Este modelo pretende retratar a deficiência de estrogénios que ocorre na mulher após a menopausa, para se avaliar o decaimento da densidade de massa óssea e os fatores que intervém na perda da mesma. Neste modelo a carência de estrogénios é recriada através da remoção cirúrgica dos ovários às fêmeas em idade reprodutiva para cessar a produção da hormona sexual feminina, conduzindo a osteopenia e numa fase mais avançada a osteoporose. Este modelo é utilizado sobretudo com animais de pequeno porte como o rato e o murganho uma vez que a remoção cirúrgica dos ovários é mais simples e económica que noutras espécies de maior porte (Turner, 2011; Oheim et al., 2012).
O modelo ORX é utilizado em animais do sexo masculino, nos quais a osteoporose é causada pela cessação da produção da hormona testosterona após o precedimento de orquietomia. Embora a manutenção da qualidade do esqueleto no sexo masculino seja considerada multifatorial, sabe-se que a testosterona desempenha um papel crucial no metabolismo do osso. Pensa-se que seja um dos principais sinalizadores responsáveis pelo recrutamento dos osteoblastos e inibição da atividade dos osteoclastos (Juma et al., 2012; Razzaque et al., 2012).
O modelo de imobilização provoca osteopenia/osteoporose em ratos devido a um mecanismo diferente. Este modelo baseia-se no princípio de que a robustez e qualidade do osso estão diretamente ligados a atividade física, deste modo uma imobilização que pode ser conseguida através do corte cirúrgico de um nervo ou tendão que irá conduzir à imobilização de determinada zona do animal de um membro tendo como consequência a diminuição da formação do osso (Tian et al., 2011). Caso se pretenda avaliar uma resposta sistémica em vez de local poderá efetuar-se um corte cirúrgico dos nervos da coluna vertebral do animal, conduzindo à sua total imobilização. Como alternativa cirúrgica, existe também a técnica de imobilização conservativa que consiste num processo de imobilização reversível através da colocação de ligaduras ou engessamento da área em questão (Sibilia et al., 2013). O modelo de imobilização é um dos modelos que pretende mimetizar a perda de densidade óssea após a menopausa, sendo especialmente utilizado em animais de pequeno porte uma vez que são mais fáceis de imobilizar tanto cirurgicamente como conservativamente (Turner, 2011).
O modelo de indução da osteoporose através de glucocorticoides, baseia-se na associação entre o excesso de glicocorticóides e a osteoporose. Embora esta associação tenha ocorrido há vários anos atrás, a sua importância na prática clínica só foi reconhecida recentemente. O excesso de glucocorticoides é uma das causas mais