UNIVERSIDADE FEDERAL DA PARAÍBA
CENTRO DE CIÊNCIAS DA SAÚDE
PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS NATURAIS E
SINTÉTICOS BIOATIVOS
MARIA DO SOCORRO DE FRANÇA SILVA
AVALIAÇÃO DOS EFEITOS DO 2-NITRATO-1,3-DIBUTOXIPROPANO
(NDBP) SOBRE O SISTEMA CARDIOVASCULAR
JOÃO PESSOA
–
PB
MARIA DO SOCORRO DE FRANÇA SILVA
AVALIAÇÃO DOS EFEITOS DO 2-NITRATO-1,3-DIBUTOXIPROPANO
(NDBP) SOBRE O SISTEMA CARDIOVASCULAR
Tese apresentada ao Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos do Centro de Ciências da Saúde da UFPB, como parte dos requisitos para a obtenção do título de Doutor em Produtos Naturais e Sintéticos
Bioativos. Área de concentração:
Farmacologia.
Orientador: Prof. Dr. Valdir de Andrade Braga
Co-orientador: Prof. Dr. Isac Almeida de Medeiros
JOÃO PESSOA
–
PB
S586a Silva, Maria do Socorro de França. Avaliação dos efeitos do
2-nitrato-1,3-dibutoxipropano (NDBP) sobre o sistema
cardiovascular / Maria do Socorro de França Silva.-- João Pessoa, 2012.
150f. : il.
Orientador: Valdir de Andrade Braga Co-orientador: Isac Almeida de Medeiros Tese (Doutorado) – UFPB/CCS
1. Produtos Naturais. 2. Óxido nítrico –
tolerância. 3. Controle autonômico. 4. Hipotensão. 5. Bradicardia.
MARIA DO SOCORRO DE FRANÇA SILVA
AVALIAÇÃO DOS EFEITOS DO 2-NITRATO-1,3-DIBUTOXIPROPANO
(NDBP) SOBRE O SISTEMA CARDIOVASCULAR
Aprovado em 03 de agosto de 2012.
BANCA EXAMINADORA
______________________________________________
Prof. Dr. Valdir de Andrade Braga
Universidade Federal da Paraíba
Orientador
______________________________________________
Prof. Dr. Demetrius Antônio Machado de Araújo
Universidade Federal da Paraíba
Examinador interno
______________________________________________
Profa. Dra. Sandra Rodrigues Mascarenhas
Universidade Federal da Paraíba
Examinador interno
______________________________________________
Prof. Dr. Luís Carlos Reis
Universidade Federal Rural do Rio de Janeiro
Examinador externo
______________________________________________
Prof. Dr. Deoclecio Alves Chianca Júnior
A Deus pelo dom da vida! Pelo amor que me inspira a todo instante e pela presença insubstituível de todas as pessoas com as quais Ele me presenteou.
Ao meu orientador, Prof. Valdir de Andrade Braga, pela disposição em ensinar com paciência e competência, sempre me apoiando e incentivando. Não poderia ter tido melhor exemplo de professor e pesquisador!
Ao professor Isac Almeida de Medeiros, quem primeiro me recebeu em seu laboratório, possibilitando-me ingressar no mundo da pesquisa.
Ao professor Demétrius Antônio Machado de Araújo, por me abrir as portas do seu laboratório com prontidão e solicitude.
Aos professores da banca de qualificação e defesa, pois contribuíram significativamente para melhorar este trabalho.
Aos demais professores do Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos por fazerem parte da minha formação profissional.
Ao professor Petrônio Filgueiras de Athayde Filho e seu aluno Alexsandro Fernandes dos Santos, pela substância cedida e cooperação ao longo deste trabalho.
A coordenação do PPGPNSB, na pessoa da profa. Dra. Fátima Agra, pelo incentivo constante à realização de um trabalho com qualidade. Aos funcionários do Programa, meus agradecimentos.
A José Crispim pela amizade, força e disposição em ajudar, sempre quando necessário. A Luís Cordeiro da Silva e Adriano Cordeiro pelo trabalho realizado no biotério, dando-nos suporte para trabalhar. A Universidade Federal da Paraíba (UFPB) por possibilitar a realização desta pesquisa. À Coordenação de Aperfeiçoamento de Pessoal de Ensino Superior (CAPES) pelo suporte técnico e financeiro.
A todas as pessoas que fazem o Laboratório de Fisiologia Cardiovascular e Controle Neural da Pressão Arterial, em especial a Matheus Monteiro, Leônidas Júnior e Thyago Queiroz pelo envolvimento neste trabalho.
A minha mãe e meus irmãos pelo auxílio e incentivo em todos os momentos, das mais variadas formas. Divido essa conquista com vocês!
Ao meu namorado, Daniel Falcão, por estar sempre comigo, me aconselhando e auxiliando nos momentos mais necessários. Você tem sido muito importante para essa conquista!
“
A mente que se abre a uma nova ideia
jamais voltará ao seu tamanho original
”.
Avaliação dos efeitos do 2-nitrato-1,3-dibutoxipropano (NDBP) sobre o sistema cardiovascular. FRANÇA-SILVA, MS. Tese de Doutorado apresentada ao Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos, UFPB (2012).
RESUMO
Relatos prévios demonstraram que o 2-nitrato-1,3-dibutoxipropano (NDBP), um nitrato orgânico sintetizado a partir da glicerina, induziu vasodilatação em anéis de artéria mesentérica cranial isolada de rato mediante a ativação da via NO-GMPc-PKG, bem como dos canais para K+ e, adicionalmente, causou hipotensão e bradicardia em ratos normotensos não-anestesiados. O estudo atual teve como objetivo investigar os efeitos do NDBP sobre o sistema cardiovascular em ratos, avaliando a liberação de NO eliciada pelo NDBP em células musculares lisas vasculares, a capacidade do NDBP induzir tolerância ao vasorrelaxamento e o efeito da administração aguda do composto sobre o controle autonômico de animais normotensos e hipertensos, por meio de abordagens in vitro e in vivo. Nos experimentos bioquímicos foi utilizada a cultura de células musculares lisas de aorta de rato (CMLAR) e, nos experimentos farmacológicos foram utilizados ratos Wistar ou ratos espontaneamente hipertensos (SHR) e normotensos Wistar Kyoto (WKY). Foi observado que o NDBP causou um aumento concentração-dependente nos níveis de NO em CMLAR. Além disso, não houve alteração no efeito vasodilatador do NDBP quando os anéis de artéria mesentérica foram previamente expostos ao NDBP, nas concentrações de 10 µM ou 100 µM, sugerindo que o nitrato orgânico em estudo não induziu tolerância. Nos experimentos in vivo, foi constatado que a pressão média basal dos animais espontaneamente hipertensos foi significantemente maior que a do grupo normotenso. A administração aguda do NDBP (1, 5, 10, 15 e 20 mg/kg, i.v.) induziu uma resposta bifásica: hipotensão e bradicardia seguidas de hipertensão e taquicardia, em ratos SHR e WKY. O bloqueio dos receptores muscarínicos pela atropina (2 mg/kg) atenuou a bradicardia induzida pelo NDBP (15 mg/kg), reduzindo também a hipotensão em WKY e SHR. Entretanto, a resposta pressora ao composto foi potencializada. A secção bilateral do nervo vago praticamente aboliu a bradicardia em WKY e SHR. Adicionalmente o hexametônio (30 mg/kg), um bloqueador nicotínico ganglionar, reduziu tanto a bradicardia quanto a resposta pressora em ambos os grupos. A administração do azul de metileno (4 mg/kg), um bloqueador da ciclase de guanilil solúvel (CGs), atenuou as repostas hipotensora e bradicárdica induzida pelo NDBP (15 mg/kg) em ratos WKY. Evento similar aconteceu nos animais SHR. Esses resultados sugerem que o NDBP libera NO em CMLAR, sendo incapaz de induzir tolerância ao seu efeito vasorrelaxante, entretanto, os efeitos cardiovasculares do NDBP são mediados, principalmente, pela ação central do composto, resultando em alterações na função autonômica de ratos normotensos e espontaneamente hipertensos.
Evaluation of effects of the 2-nitrate-1,3-dibuthoxypropan (NDBP) on cardiovascular system. FRANÇA-SILVA, MS. Tese de Doutorado apresentada ao Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos, UFPB (2012).
ABSTRACT
Previous studies have shown that the 2-nitrate-1,3-dibuthoxypropan (NDBP), an organic nitrate synthesized from glycerin, induced vasorelaxation in mesenteric artery of rats through activation of the NO-cGMP-PKG pathway and K+ channels, in
addition, caused hypotension and bradycardia in normotensive conscious rats. The current research aimed to investigate the effects of the NDBP on cardiovascular system in rats, evaluating the NO release in rat smooth muscle cell culture, the ability of NDBP to induce tolerance to vasodilatation and the effect of the acute administration of the compound on autonomic control of blood pressure and heart rate of normotensive and hypertensive rats, using in vitro and in vivo approaches. For biochemical determination aortic rat smooth muscle cell culture (ARSMC) was used and the pharmacological experiments were developed using Wistar rats or spontaneously hypertensive (SHR) and normotensive Wistar Kyoto (WKY) rats. The NDBP caused concentration-dependent increases in NO levels in ARSMC. In addition, NDBP produced no change in the vasorelaxation induced by the NDBP when the rings were pre-incubated with the NDBP (10 µM or 100 µM), suggesting that the NDBP did not induce tolerance. In vivo experiments, SHR rats were significantly hypertensive compared with WKY rats. The acute administration of the NDBP (1, 5, 10, 15 and 20 mg/kg, i.v.) caused a biphasic response: hypotension and bradycardia followed by hypertension and tachycardia in WKY and SHR rats. The blockade of muscarinic receptors with atropine (2 mg/kg) blunted the bradycardia induced by NDBP (15 mg/kg) and reduced the hypotension in WKY and SHR. However, the pressor response to the compound was potentiated. Furthermore, vagotomy almost abolished the bradycardia in WKY and SHR. Moreover, hexamethonium (30 mg/kg), a nicotinic ganglionic blocker, reduced both bradycardia and pressor response in WKY and SHR. The administration of methylene blue (4 mg/kg), a soluble guanylyl cyclase (sGC) blocker, attenuated the hypotension and bradycardia induced by the NDBP (15 mg/kg) in WKY. Similar event occurred in SHR animals. In conclusion, the NDBP releases NO in ARSMC, and was unable to induce tolerance to its vasorelaxant effect, however, the cardiovascular effects of NDBP are mainly mediated by the central action of the compound, resulting in changes on autonomic function of spontaneously hypertensive and normotensive rats.
LISTA DE FIGURAS
Figura 1: Representação esquemática da ação do óxido nítrico na célula
muscular lisa vascular... 27
Figura 2: Representação esquemática da ação do NO como neuromodulador... 28
Figura 3: Estrutura química de alguns doadores de NO... 33
Figura 4: Estrutura química dos principais nitratos orgânicos... 34
Figura 5: Estrutura química do 2-nitrato-1,3-dibutoxipropano (NDBP)... 37
Figura 6: Representação esquemática do protocolo experimental para a avaliação da habilidade do NDBP induzir tolerância em anéis de artéria mesentérica de rato... 46
Figura 7: Representação esquemática do protocolo experimental para a avaliação do efeito da administração aguda do NDBP sobre a PA e a FC... 48
Figura 8: Representação esquemática do protocolo experimental para a administração do NDBP (15 mg/kg) em ratos SHR e WKY não-anestesiados antes e após diferentes bloqueios... 50
Figura 9: Efeito do NDBP (10-6 M, 3x10-5 M, 10-4 M) ou NPS (10-7 M) sobre os níveis de NO expressos como fluorescência relativa em CMLAR, usando o DAF-2DA... 52
Figura 10: Fluorescência basal emitida por DAF e pela adição do nitroprussiato de sódio em CMLAR (A). Fluorescência basal emitida pela adição do NPS ou NDBP, 10-6 M (B); NPS ou NDBP, 3X10-5 M (C); NPS ou NDBP 10-4 M em CMLAR... 53
Figura 11: Efeito do NDBP e NTG nas concentrações de 10-6 M ou 10-4 M sobre o nível de NO expresso como fluorescência relativa em CMLAR, usando o DAF-2DA... 54
Figura 12: Fluorescência basal emitida por DAF e fluorescência emitida pela adição de diferentes concentrações de nitroglicerina (NTG) em CMLAR... 55
Figura 14: Efeito vasorrelaxante do NDBP (10-8 – 10-4 M) em anéis de artéria mesentérica cranial isolada de rato submetidos à incubação prévia com o NDBP (10 µM) comparado ao grupo que não sofreu incubação prévia e ao controle (veículo)... 57
Figura 15: Traçado representativo do efeito induzido pelo NDBP (10-8 –
10-4 M) em anéis de artéria mesentérica cranial isolada de rato pré-contraídos com FEN (10 M), sem exposição prévia ao NDBP (A), após a incubação prévia com o NDBP (100M) (B), e grupo controle (C)... 58
Figura 16: Efeito vasorrelaxante do NDBP (10-8 – 10-4 M) em anéis de artéria mesentérica cranial isolada de rato submetidos à incubação prévia com o NDBP (100 µM) comparado ao grupo que não sofreu incubação prévia e ao controle (veículo)... 59
Figura 17: Traçado representativo ilustrando a pressão arterial pulsátil (PAP), pressão arterial média (PAM) e frequência cardíaca (FC) em ratos espontaneamente hipertensos (SHR) e normotensos Wistar Kyoto (WKY)... 60
Figura 18: Valores basais de pressão arterial média e frequência cardíaca em ratos normotensos Wistar Kyoto (WKY) e espontaneamente hipertensos (SHR)... 61
Figura 19: Traçado representativo ilustrando as mudanças na PAP, PAM e FC após a administração aguda do NDBP (1, 5, 10, 15 e 20 mg/kg, i.v.) em ratos normotensos Wistar Kyoto (WKY) não-anestesiados... 62
Figura 20: Efeito da administração aguda do NDBP (1, 5, 10, 15 e 20 mg/kg, i.v.) sobre a PAM e FC em ratos normotensos Wistar Kyoto (WKY) não-anestesiados... 63
Figura 21: Traçado representativo ilustrando as mudanças na PAP, PAM e FC após a administração aguda do NDBP (1, 5, 10, 15 e 20 mg/kg, i.v.) em ratos espontaneamente hipertensos (SHR) não-anestesiados... 64
Figura 22: Efeito da administração aguda do NDBP (1, 5, 10, 15 e 20 mg/kg, i.v.) sobre a PAM e FC em ratos espontaneamente hipertensos (SHR) não-anestesiados... 65
Figura 24: Traçado representativo ilustrando as mudanças na PAP, PAM e FC em ratos SHR induzidas pelo NDBP (15 mg/kg, i.v.) antes e após a atropina (2 mg/kg)... 67
Figura 25: Efeito da administração aguda do NDBP (15 mg/kg, i.v.) em ratos normotensos Wistar Kyoto (WKY) antes e após a atropina (2 mg/kg)... 68
Figura 26: Efeito da administração aguda do NDBP (15 mg/kg, i.v.) em ratos espontaneamente hipertensos (SHR) antes e após a atropina (2 mg/kg)... 69
Figura 27: Traçado representativo ilustrando as mudanças na PAP, PAM e FC em ratos WKY induzidas pelo NDBP (15 mg/kg, i.v.) antes e após vagotomia... 70
Figura 28: Traçado representativo ilustrando as mudanças na PAP, PAM e FC em ratos SHR induzidas pelo NDBP (15 mg/kg, i.v.) antes e após vagotomia... 71
Figura 29: Efeito da administração aguda do NDBP (15 mg/kg, i.v.) em ratos normotensos Wistar Kyoto (WKY) antes e após vagotomia... 72
Figura 30: Efeito da administração aguda do NDBP (15 mg/kg, i.v.) em ratos espontaneamente hipertensos (SHR) antes e após vagotomia... 73
Figura 31: Traçado representativo ilustrando as mudanças na PAP, PAM e FC em ratos WKY induzidas pelo NDBP (15 mg/kg, i.v.) antes e após o hexametônio (30 mg/kg)... 74
Figura 32: Efeito da administração aguda do NDBP (15 mg/kg, i.v.) em ratos normotensos Wistar Kyoto (WKY) antes e após o hexametônio (30 mg/kg)... 75
Figura 33: Traçado representativo ilustrando as mudanças na PAP, PAM e FC em ratos SHR induzidas pelo NDBP (15 mg/kg, i.v.) antes e após o hexametônio (30 mg/kg)... 76
Figura 34: Efeito da administração aguda do NDBP (15 mg/kg, i.v.) em ratos espontaneamente hipertensos (SHR) antes e após o hexametônio (30 mg/kg)... 77
Figura 36: Efeito da administração aguda do NDBP (15 mg/kg, i.v.) em ratos normotensos Wistar Kyoto (WKY) antes e após o azul de metileno (4 mg/kg)... 79
Figura 37: Traçado representativo ilustrando as mudanças na PAP, PAM e FC em ratos SHR induzidas pelo NDBP (15 mg/kg, i.v.) antes e após o azul de metileno (4 mg/kg)... 80
LISTA DE QUADROS
Quadro 1: Composição da solução nutritiva de Tyrode... 42
LISTA DE ABREVIATURAS
ACh Acetilcolina
ALDHm Aldeído desidrogenase mitocondrial
AMB Núcleo ambíguos
ATP Trifosfato de adenosina
bpm Batimentos por minuto
CaV Canal de cálcio operado por voltagem
CGs Ciclase de guanilil solúvel
CE50 Concentração molar de um agonista que produz 50% do efeito
máximo do referido agonista
CMLAR Células musculares lisas de aorta de rato
DAF Diaminofluoresceína
DAF-2DA Diacetato de 4,5-diaminofluoresceína
DAF-2T Triazolo-diaminofluoresceína
DC Débito cardíaco
DMEM Meio de cultura de Eagle modificado por Dubelcco
DMV Núcleo dorsal motor do vago
ECA Enzima conversora de angiotensina
Emáx Efeito máximo
eNOS Sintase do óxido nítrico endotelial
EROs Espécies reativas de oxigênio
FACS Separador de células ativado por fluorescência
FC Frequência cardíaca
FEN Cloridrato de L (-) fenilefrina
GABA Ácido gama-aminobutírico
GMPc Monofosfato de guanosina cíclico
GSNO S-nitroso-glutationa
GTP Trifosfato de guanosina
iNOS Sintase do óxido nítrico induzível
ISDN Dinitrato de isossorbida
ISMN Mononitrato de isossorbida
MLKC Cinase da cadeia leve da miosina
NADPH Fosfato de dinucleotídeo de nicotinamida e adenina
NDBP 2-nitrato-1,3-dibutoxipropano
nNOS Sintase do óxido nítrico neuronal
NO Óxido nítrico
NOS Sintase do óxido nítrico
NPS Nitroprussiato de sódio
NTG Nitroglicerina
NTS Núcleo do trato solitário
OMS Organização Mundial da Saúde
PA Pressão arterial
PAD Pressão arterial diastólica
PAM Pressão arterial média
PAP Pressão arterial pulsátil
PAS Pressão arterial sistólica
PBS Tampão fosfato salina
pD2 Logaritmo negativo na base 10 da CE50 de um agonista (- Log CE50) PETN Tetranitrato de pentaeritritol
PKG Proteína cinase dependente de guanina
PMCA Cá2+-ATPase da membrana plasmática PVN Núcleo paraventricular do hipotálamo
RVLM Núcleo rostral ventrolateral do bulbo
RVPT Resistência vascular periférica total
SBC Sociedade Brasileira de Cardiologia
SERCA Cá2+-ATPase do retículo endosarcoplasmático
SFB Soro fetal bovino
SFO Órgão subfornicial
SHR Ratos espontaneamente hipertensos
SNA Sistema Nervoso Autonômico
SNC Sistema Nervoso Central
SRAA Sistema renina-angiotensina-aldosterona
WKY Ratos normotensos Wistar Kyoto
SUMÁRIO
1 INTRODUÇÃO... 23
1.1 Considerações gerais sobre pressão arterial... 23
1.2 Controle a curto prazo da PA – Papel do Sistema Nervoso Autonômico... 24
1.3 Óxido nítrico (NO)... 26
1.4 Hipertensão... 30
1.5 Doadores de NO... 32
1.6 Nitratos orgânicos... 34
1.7 Considerações sobre o 2-nitrato-1,3-dibutoxipropano (NDBP)... 36
2 OBJETIVOS... 39
2.1 Objetivo geral... 39
2.2 Objetivos específicos... 39
3 MATERIAIS E MÉTODOS... 41
3.1 Animais... 41
3.2 Substâncias-teste... 41
3.3 Drogas utilizadas... 41
3.4 Soluções nutritivas... 42
3.5 Cateteres vasculares... 43
3.6 Ensaios bioquímicos in vitro... 43
Medida da produção intracelular de NO em células musculares lisas de aorta de rato (CMLAR)... 43
Cultura primária de CMLAR... 43
Incubação do DAF-2DA e protocolos experimentais... 44
3.7 Ensaios farmacológicos in vitro... 45
Avaliação da habilidade do NDBP em induzir tolerância ao vasorrelaxamento... 45
Verificação da presença do endotélio funcional... 45
Avaliação da atividade vasorrelaxante do NDBP sobre tecido vascular previamente exposto ao composto... 46
3.8 Ensaios farmacológicos in vivo... 47 Efeitos do NDBP sobre o controle autonômico de ratos espontaneamente hipertensos (SHR) e seus controles normotensos Wistar Kyoto (WKY)... 47
Implantação dos cateteres vasculares...... 47
Registro da PA e FC... 47
Avaliação do efeito da administração aguda do NDBP sobre a PA e a FC em ratos espontaneamente hipertensos (SHR) e normotensos Wistar Kyoto (WKY) não-anestesiados... 48
Avaliação da influência do bloqueio parassimpático na resposta induzida pelo NDBP... 49
Avaliação da influência da vagotomia na resposta induzida pelo NDBP... 49
Avaliação da influência do bloqueio ganglionar na resposta induzida pelo NDBP... 49
Avaliação da influência do bloqueio da ciclase de guanilil solúvel nos efeitos cardiovasculares induzidos pelo NDBP... 49 3.9 Análise estatística... 50
4 RESULTADOS... 52 4.1 Produção de óxido nítrico intracelular em cultura de células
musculares lisas de rato... 52 4.2 Avaliação da tolerância elucidada pelo NDBP in vitro... 56
4.3 Efeitos do NDBP sobre o controle autonômico de ratos espontaneamente hipertensos (SHR) e seus controles normotensos (WKY)... 60
Efeitos do NDBP após bloqueio parassimpático... 66
Efeitos do NDBP após vagotomia... 70
Efeitos do NDBP após bloqueio ganglionar... 74
Efeito do NDBP sobre a PA e a FC após bloqueio da ciclase de guanilil solúvel (CGs)... 78
5 DISCUSSÃO... 83
6 CONCLUSÕES... 91
7 PERSPECTIVAS... 93
REFERÊNCIAS... 95
APÊNDICE A –Artigos sobre o NDBP... 113
1 INTRODUÇÃO
1.1 Considerações gerais sobre a pressão arterial
A pressão arterial (PA) corresponde ao produto do débito cardíaco (DC) pela resistência vascular periférica total (RVPT). O DC é influenciado pelo volume diastólico final, pela contratilidade miocárdica e pela frequência cardíaca. O volume diastólico final é o volume que chega à câmara ventricular antes da contração, sendo determinado pelo volume sanguíneo e tônus muscular venoso que determinam a pressão venosa. A RVPT, por sua vez, é o resultado de modificações tensionais no músculo liso vascular (GUYENET, 2006).
A pressão arterial é classificada em pressão arterial sistólica (PAS) e pressão arterial diastólica (PAD). A pressão sistólica é o maior valor de pressão mensurado durante um ciclo cardíaco, sendo a pressão na artéria após o sangue ter sido ejetado do ventrículo esquerdo durante a sístole. Já a pressão diastólica é a menor pressão arterial medida durante o ciclo cardíaco, sendo a pressão na artéria durante o relaxamento ventricular quando nenhum sangue é ejetado. A diferença entre pressão arterial sistólica e pressão diastólica consiste na pressão de pulso, que reflete o volume de sangue ejetado em cada batimento cardíaco, ou seja, o volume sistólico (CONSTANZO, 2006).
A partir desses valores de pressão, obtém-se a pressão arterial média (PAM), pressão em um ciclo cardíaco completo, que é calculada pela soma da pressão diastólica a um terço da pressão pulsátil. Desse modo, a PAM sofre maior influência da pressão diastólica que diminui ao longo da árvore arterial, direcionando o fluxo sanguíneo. O processo aterosclerótico, a redução da complacência arterial ou o aumento do volume sanguíneo elevam a pressão arterial sistólica, pulsátil e média, contribuindo para a instalação da hipertensão (CONSTANZO, 2006). Essas alterações no sistema cardiovascular resultam do desequilíbrio entre os diversos mecanismos que regulam a pressão arterial.
O controle da PA a curto prazo é modulado por mecanismos neurais de controle caracterizados por promoverem ajustes rápidos de pressão arterial e de frequência cardíaca. Dentre os mecanismos neurais mais importantes para o controle da pressão arterial destacam-se o reflexo cardiopulmonar, o quimiorreflexo e o barorreflexo. O controle da pressão arterial a longo prazo é determinado pelo sistema renina-angiotensina-aldosterona (SRAA) (COLEMAN, 1980; DAMPNEY et al, 2002). E, paralelamente, o endotélio vascular também influencia a pressão arterial por meio da produção de substâncias vasoativas, sejam elas contracturantes, como prostaglandinas, tromboxanos e endotelina, ou vasodilatadoras como as prostaciclinas e o óxido nítrico (NO) (BATLOUNI, 2001). A desregulação nesses mecanismos de controle da pressão arterial está relacionada com o desenvolvimento da hipertensão.
1.2 Controle a curto prazo da PA – Papel do Sistema Nervoso Autonômico
Os mecanismos neurais de controle da PA resultam em alterações apropriadas do débito cardíaco, da resistência periférica e do retorno venoso por meio de mecanismos reflexos. Esta ação reflexa dá-se via sistema nervoso autonômico (SNA) por meio de suas divisões simpática e parassimpática, e envolve receptores, aferências, centros de integração, eferências e efetores, além da liberação de diferentes hormônios. Receptores ao longo do sistema cardiovascular captam as perturbações na PA e emitem sinais elétricos que são conduzidos pelas fibras aferentes até o sistema nervoso central (SNC), a partir deste, a resposta é gerada e transmitida pelas vias eferentes até os órgãos efetores (COLEMAN, 1980; DAMPNEY, 1994).
No SNC, os neurônios formam redes integradas em regiões distintas envolvidas com a regulação da pressão arterial. As áreas envolvidas com a modulação simpática da PA incluem o órgão subfornicial (SFO), o núcleo paraventricular do hipotálamo (PVN) e o bulbo ventrolateral rostral (RVLM). Por outro lado, as principais regiões envolvidas com a regulação parassimpática da PA são o núcleo dorsal motor do vago (DMV) e o núcleo ambíguo (AMB) (FENG et al, 2002).
ganglionares de complexidade diversa como a rede cardíaca, localizadas fora do SNC. Os gânglios periféricos contêm os neurônios motores, denominados neurônios ganglionares, que controlam o músculo liso e outros órgãos viscerais. Os neurônios ganglionares simpáticos que controlam os alvos cardiovasculares são principalmente noradrenérgicos (BLESSING, 1997; LOEWY; SPYER, 1990).
Nesse sentido, o controle autonômico da pressão arterial opera através de neurônios pré-ganglionares simpáticos e parassimpáticos que liberam acetilcolina, responsável por atuar sobre os receptores nicotínicos pós-ganglionares; neurônios pós-ganglionares parassimpáticos que liberam acetilcolina para atuar em receptores muscarínicos no coração; e neurônios pós-ganglionares simpáticos, os quais liberam principalmente noradrenalina e inervam o coração, vasos sanguíneos, rins e glândula adrenal. O nervo vago é responsável pela inervação parassimpática de praticamente todos os órgãos abaixo do pescoço, incluindo o coração. Já a inervação simpática envolve diversos nervos, como o nervo simpático renal, lombar, dentre outros (HANG, 2005; GUYENET, 2006).
Antagonistas dos receptores nicotínicos da acetilcolina atuam como bloqueadores ganglionares, impedindo a transmissão parassimpática e simpática à periferia. Em 1950 essas drogas foram introduzidas no tratamento da hipertensão, por sua ação simpatolítica, sendo a mecamilamina a primeira a ser utilizada, seguida do hexametônio, mas que tiveram o uso proibido devido a sérios efeitos colaterais (SHYTLE et al, 2002). Atualmente o único bloqueador ganglionar utilizado como anti-hipertensivo é o trimetafan, e o hexametônio tem uso restrito em animais como ferramenta farmacológica, sobretudo na avaliação do SNA (MURPHY, 1995).
Outras ferramentas farmacológicas utilizadas no estudo da atividade autonômica incluem a atropina, antagonista competitivo dos receptores muscarínicos da acetilcolina; o propranolol, antagonista dos receptores β-adrenérgicos; o prazosin, antagonista dos receptores α-adrenérgicos, dentre outras drogas (LEE et al, 2008; PATTERSON; O’HAGAN, 2002; KWAN et al, 2003; MURPHY, 1995; YAMADA et al, 2011). Alguns procedimentos como a secção de nervos parassimpáticos e simpáticos também fornecem importantes informações sobre o funcionamento do sistema nervoso autonômico.
neuropeptídeo Y e o óxido nítrico, desempenham papel importante nas mudanças autonômicas via ativação de áreas neurais regulatórias da função cardiovascular como o núcleo paraventricular do hipotálamo (PVN), o núcleo do trato solitário (NTS) e o RVLM, em resposta a ativação de reflexos cardiovasculares (BRAGA et al, 2006; CRUZ et al, 2008; FRANCHINI; KRIEGER, 1993; MAUAD; MACHADO, 1998; PATON et al, 2008; REDDY et al., 2007).
1.3 Óxido nítrico (NO)
O NO, primeiramente descrito como o fator relaxante derivado do endotélio, é uma molécula gasosa, inorgânica e incolor que constitui um dos mais importantes mediadores de processos intra e extracelular. Ele é produzido pela ação da enzima sintase do NO, da qual há três isoformas: a sintase do NO endotelial (eNOS), sintase do NO neuronal (nNOS), ambas constitutivas; e a sintase do NO induzível (iNOS), envolvida em processos inflamatórios (BONAVENTURA et al, 2006; DUSSE et al, 2003; MAEDA et al, 2004).
O NO é o primeiro mensageiro na via de sinalização NO/GMPc/PKG, iniciando a cascata de reações de fosforilação em que cada passo é enzimaticamente amplificado, processo crítico para geração de efeitos fisiológicos. A L-arginina é oxidada gerando L-citrulina e NO pela ação da NOS, que por sua vez transfere elétrons do fosfato de dinucleotídeo de nicotinamida e adenina (NADPH), via flavinas (flavina-adenina-dinucleotídeo e flavina-mononucleotídeo) do seu domínio carboxiterminal redutase, para o grupo heme no domínio oxigenase aminoterminal. Essa reação requer o cofator tetrahidrobiopterina (BH4) e diversos
mecanismos de ativação (FORSTERMANN; SESSA, 2012; FRANCIS et al, 2010). Nas células endoteliais, o NO é formado pela isoforma endotelial da sintase do NO, a eNOS, também denominada NOS III, ativada principalmente pelo complexo Ca+2/Calmodulina ou outras proteínas como a Akt (FÖRSTERMANN et al, 1995; GATH; RADI; AUGUSTO, 1996).
cinases dependentes de GMPc (PKG), e proteínas cinases ativadas por mitógenos (MAPKs) (ARCHER et al, 1994; CORNWELL et al, 1991).
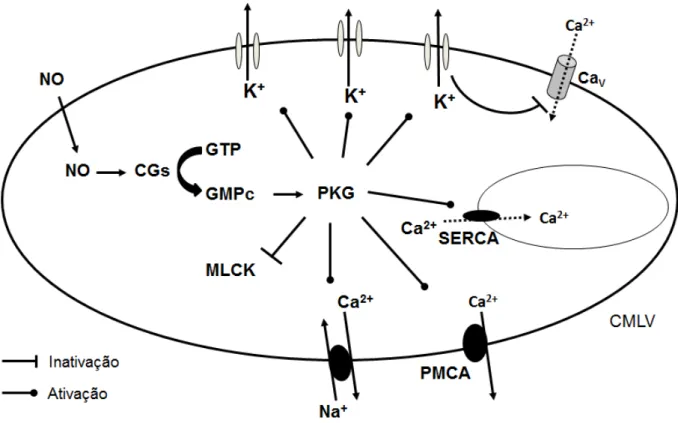
A PKG promove a fosforilação da cinase da cadeia leve da miosina (MLCK), ocasionando sua inativação (CORNWELL et al, 1991); da bomba de Ca2+ do retículo endosarcoplasmático (SERCA), ativando-a e acelerando a recaptação de Ca2+ para os estoques intracelulares (CORNWELL et al, 1991); da bomba de cálcio da membrana plasmática (PMCA), favorecendo o efluxo desse íon; do trocador Na+/Ca2+, promovendo sua ativação; e dos canais para K+ da membrana plasmática, promovendo sua abertura, o que gera hiperpolarização nas células musculares lisas com fechamento dos canais para Ca2+ sensíveis à voltagem. Esses eventos resultam na diminuição da [Ca+2]i e posterior vasorrelaxamento com redução da
resistência vascular periférica, conforme ilustrado na Figura 1 (FURCHGOTT, 1983; HILGERS; WEBB, 2005; IRVINE; FAVALORO; KEMP-HARPER, 2003; VANHOUTTE; BOULANGER, 1995).
Figura 1: Representação esquemática da ação do óxido nítrico na célula muscular lisa vascular. Cav:
Além disso, vários autores apresentaram evidências de que o relaxamento vascular induzido pelo NO pode ocorrer por mecanismo independente do GMPc, mediante a ativação direta dos canais para K+ (BOLOTINA et al, 1994; MISTRY; GARLAND, 1998; PLANE et al, 1996). Tem sido descrito como outra ação do NO a sua interação com grupos tióis para formar compostos S-nitrosilados que modulam a atividade desses canais (BROILLET, 1999).
Desse modo, o NO reduz a resistência vascular periférica, desempenhando grande papel no controle do tônus vascular e da pressão arterial. Entretanto, o óxido nítrico também atua pela via GMPC-PKG como um neuromodulador do SNC. Assim
as ações cardiovasculares desta molécula não são restritas a efeitos diretos nos vasos sanguíneos, mas compreendem efeitos em todo o substrato neural que contribui para a geração da atividade nervosa autonômica (BREDT et al, 1990; GARTHWAITE et al, 1988). O NO modula a liberação de neurotransmissores como mostrado na Figura 2, influenciando a transmissão da atividade autonômica para órgãos alvo via medula espinhal, junções ganglionares e neuromusculares, interferindo na descarga simpática e parassimpática à periferia (SCHMITT e DIRSCH, 2009; ZANZINGER, 1999).
Figura 2: Representação esquemática da ação do NO como neuromodulador. Adaptado de Barreto; Correia; Muscará (2005). CGs: ciclase de guanilil solúvel. GMPc: monofosfato de guanosina cíclico. GTP: trifosfato de guanosina. GLUT: glutamato. NO: óxido nítrico. NOS: sintase do óxido nítrico. NT: neurotransmissores. PKG: proteína cinase dependente de guanina. RNMDA: receptor de glutamato tipo
Abordagens experimentais revelaram que a interação do glutamato com o óxido nítrico no NTS influencia os reflexos cardiovasculares, o que foi embasado pela evidência da co-localização das isoformas eNOS e nNOS com o glutamato nesse núcleo (DUN et al., 1994; KROWICKI et al., 1997; LIN et al., 1998, 2007). A modulação glutamatérgica também é realizada pelo NO na região caudal ventrolateral do bulbo (CVLM) (ZANZINGER et al, 1997). Atuando em sítios neurais, específicos, o NO revela efeitos cardiovasculares muitas vezes opostos.
Estudos demonstraram que a produção de NO pela eNOS no NTS induz hipotensão e bradicardia em ratos não-anestesiados (SAKAI et al., 2000; HIROOKA et al., 2001, 2003). Por outro lado, autores afirmam que o NO derivado da eNOS exerce efeitos estimulatórios no NTS (LIN, 2009).
Kishi et al (2001) constataram que a superexpressão da eNOS no RVLM reduz a pressão arterial e a atividade nervosa simpática direcionada à periferia. Por outro lado, a superexpressão da iNOS nesse núcleo causa hipertensão e simpatoexcitação devido ao aumento do estresse oxidativo (KIMURA et al, 2005). As respostas cardiovasculares diferentes podem ser atribuídas a diferentes quantidades de NO produzido, o que também foi relatado por Chan et al (2001) e Morimoto et al (2000).
Horn et al (1994) relataram a ação do NO sobre a liberação de neurotransmissores, tanto inibitórios quanto excitatórios, no PVN, como o aspartato, o glutamato e o ácido gama-aminobutírico (GABA) em ratos, o que ratifica o papel dual do óxido nítrico no sistema nervoso autonômico e a necessidade de maiores investigações.
Além de efeitos vasculares e neurais, o NO atua diretamente no coração. Relatos da literatura apontam a produção de NO pelas três isoformas da NOS nas células endoteliais, varicosidades simpáticas, fibras pós-ganglionares parassimpáticas e nos próprios cardiomiócitos, regulando a função cardíaca. O NO apresenta efeito inotrópico positivo quando em baixa quantidade e inotrópico negativo quando se encontra em alta quantidade. Adicionalmente, apresenta cronotropismo negativo e atenua a sinalização β-adrenérgica em vários modelos animais (HERRING; PATTERSON, 2001; BALLIGAND et al, 1995).
na síntese e metabolismo desta molécula podem ter consequências diretas na pressão arterial, acarretando doenças cardiovasculares, dentre elas a hipertensão, sendo o NO, um potencial alvo terapêutico para o tratamento dessa enfermidade (RAJAPAKSE; MATTSON, 2009; ZANZINGER, 1999).
1.4 Hipertensão
A hipertensão é um estado alterado da saúde no qual a pressão arterial do sangue está acima dos valores considerados normais. Um indivíduo é considerado hipertenso se apresentar valores de PA sistólica ≥ 140 mmHg e∕ou de PA diastólica ≥ 90 mmHg em medidas de consultório. O diagnóstico deverá ser sempre validado por medidas repetidas, em condições ideais, em, pelo menos, três ocasiões (FIGUEIREDO et al, 2009; MANCIA et al, 2007).
Dados de mais de 194 países revelaram que um em cada três adultos no mundo inteiro tem pressão arterial elevada, uma condição que provoca cerca de metade de todas as mortes por derrame cerebral e doenças cardíacas. Tal característica se faz mais evidente em países de baixa e média renda. Em alguns países africanos, metade da população adulta tem pressão arterial elevada, onde a maioria permanece sem diagnóstico, apesar de que, muitos casos poderiam ser tratados com medicamentos de baixo custo, o que reduziria significativamente o risco de morte e invalidez por doença cardíaca e/ou derrames. Em países de renda alta, o diagnóstico, muitas vezes precoce, e tratamento generalizado de baixo custo com medicamentos surtiram efeito, reduzindo significativamente a pressão arterial média nessa população, contribuindo assim para uma redução nas mortes por doenças relacionadas ao sistema cardiovascular (CAIN; KHALIL, 2002; WHO, 2012). No Brasil, a hipertensão arterial atinge cerca de 30 % da população, chegando a mais de 50 % nos indivíduos com idade entre 60 e 69 anos e mais de 75 % naqueles acima dos 70 anos, sendo um dos principais fatores de risco associado à mortalidade no país (SOCIEDADE BRASILEIRA DE CARDIOLOGIA, 2010).
aumento da quantidade da massa cardíaca e muscular lisa, diminuição da complacência venosa e aumento da vasoconstrição com redução da vasodilatação, tanto dependente como independente do endotélio vascular (FOLKOW, 1982; SAFAR et al, 1981).
Alterações endoteliais com elevação na síntese de substâncias contraturantes e espécies reativas de oxigênio, bem como a formação ou atividade reduzida de substâncias vasodilatadoras como o óxido nítrico (NO) estão envolvidas na patogênese da hipertensão (MARÍN; RODRIGUES-MARTINEZ, 1997; SMITH et al, 2004).
Além disso, estudos relacionam a participação do aumento da atividade simpática e a redução da atividade parassimpática à patogênese da hipertensão (FLORAS et al, 1992; IRIGOYEN et al, 2005; WYSS, 1993). Esses fenômenos estão bastante relacionados com a disfunção dos reflexos cardiovasculares que modulam a atividade autonômica sobre a pressão arterial e frequência cardíaca (DALL'AGO et al, 1999).
Estudos apontam para uma significativa atenuação na sensibilidade do barorreflexo, tanto em animais quanto em pacientes com hipertensão e o grau de atenuação tem correlação importante com a severidade da hipertensão (ECKBERG, 1979; GRASSI; MANCIA, 1994). Evidências experimentais em ratos espontaneamente hipertensos (SHR) indicam que entre nove e quatorze semanas de idade, o ganho do barorreflexo diminui progressivamente devido às alterações correspondentes ao intervalo de FC, confirmando a associação entre hipertensão, hiperatividade simpática e disfunção barorreflexa (DALL'AGO et al, 1999; FLORAS et al, 1988).
1.5 Doadores de NO
Os doadores de NO são compostos capazes de liberar NO quando aplicados em sistemas biológicos, reproduzindo a resposta do NO endógeno ou o substituindo em situações de deficiência (FEELISCH, 1998). Esses compostos geralmente apresentam um grupo nitroso funcional em sua molécula fornecendo o NO em condições in vivo e in vitro (BATES et al, 1991).
O modo de liberação de NO difere significativamente entre as classes de doadores, bem como a sua reatividade química. Alguns doadores liberam NO de forma espontânea ou não-enzimática, enquanto outros requerem catálise enzimática para liberá-lo, outros ainda requerem a interação com tióis, ácidos ou metais, reações de oxidação ou redução para liberarem esta molécula (ACHIKE et al., 2003).
Um doador de NO atualmente utilizado na clínica é o nitroprussiato de sódio (NPS) (Figura 3), um complexo inorgânico com grupo ferroso, administrado para reduzir rapidamente a pressão arterial em pacientes com crises hipertensivas, sendo também o fármaco de escolha em estudos pré-clínicos e clínicos, reconhecido como padrão na vasodilatação independente do endotélio. O mecanismo de liberação de NO a partir do NPS em tecidos biológicos não ocorre de forma espontânea e necessita de moléculas teciduais específicas, tais como a cisteína e a glutationa, que contêm grupos sulfidril em sua estrutura, além de requerer a irradiação pela luz ou redução de elétrons (BUTLER; MEGSON, 2002; FEELISCH, 1998; GROSSI; D’ANGELO, 2005). A principal limitação do uso do NPS é a liberação de cianeto (CN-), que causa toxicidade celular pronunciada (ARNOLD; LONGNECKER; EPSTEIN, 1984; WANG et al, 2002).
Os S-nitrosotióis (RSNO) são compostos que contém um grupo nitroso ligado ao enxofre de um grupo tiol. Muitos deles são sintetizados, mas outros podem ocorrer naturalmente, como a S-nitroso-glutationa (GSNO, Figura 3). Esses compostos são derivados de aminoácidos, peptídeos e proteínas e funcionam como
estoques de NO, que pode ser liberado quando requeridos (STAMLER et al., 1992).
Vários fatores liberam NO dos S-nitrosotióis, incluindo luz, calor, metais de transição,
superóxidos, tióis adjacentes e enzimas, tais como xantina oxidase, superóxido
dismutase e diversas desidrogenases (AL-SA’DONI; FERRO, 2000; BUTLER et al.,
1998; LIU L et al., 2001).
Figura 3: Estrutura química de alguns doadores de NO (MILLER; MEGSON, 2007).
1.6 Nitratos orgânicos
Os nitratos orgânicos são ésteres de ácido nítrico de álcoois mono- ou poli-hídricos (CSONT; FERDINANDY, 2005). Descobertos há mais de um século, esses compostos são os doadores de NO mais conhecidos e comumente utilizados na prevenção e tratamento de doenças cardiovasculares, sendo capazes de reduzir a pré-carga e pós-carga. Os principais constituintes dessa classe incluem o trinitrato de gliceril, também conhecido por nitroglicerina (NTG); o mononitrato de isossorbida (ISMN); dinitrato de isossorbida (ISDN) e o tetranitrato de pentaeritritol (PETN), apresentados na Figura 4 (KOJDA et al, 1995; MILLER ; MEGSON, 2007).
Figura 4: Estrutura química dos principais nitratos orgânicos (MILLER; MEGSON, 2007).
A nitroglicerina é o protótipo desse grupo e, a aldeído desidrogenase mitocondrial (ALDHm) foi identificada como a principal enzima envolvida na biotransformação desse nitrato orgânico a 1,2-gliceril-dinitrato e NO2. A atividade da
ALDHm exerce papel central no vasorelaxamento induzido por NTG in vitro e hipotensão in vivo e, a presença de inibidores dessa enzima cessa o vasorelaxamento, da mesma forma que a produção de 1,2-gliceril-dinitrato (CHEN et al., 2002; SYDOW et al., 2004; ZHANG et al., 2004).
efeitos hemodinâmicos, a NTG e outros nitratos orgânicos como o dinitrato de isossorbida (ISDN) e o mononitrato de isossorbida (ISMN) melhoraram consideravelmente a função ventricular esquerda em pacientes com insuficiência cardíaca congestiva e, a hipertensão pulmonar. Apresentam efeitos favoráveis sobre o remodelamento do ventrículo esquerdo após o infarto do miocárdio, bem como sobre a incidência de isquemia silenciosa (MÜNZEL et al, 2011; SKVARIL, 2000).
Estudos mostram que a administração de nitratos orgânicos é capaz de amenizar a elevação da pressão arterial e melhorar alterações morfológicas e funcionais do sistema cardiovascular em diversos modelos de hipertensão como a hipertensão deficiente de NO, genética ou dependente de sal (BARROS et al, 2002; TÖRÖK, 2008). Os nitratos orgânicos também são sugeridos como terapia adjuvante aos inibidores da ECA no tratamento da hipertensão (ELKAYAM, 1996; FUNG, 1993; BODE-BÖGER, 2005)
Oliver et al (2010) demonstraram que a administração oral do ISMN reduziu significativamente a pressão arterial em pacientes com hipertensão resistente e a combinação desse nitrato com o inibidor de fosfodiesterases, sildenafil, promoveu uma redução adicional da pressão arterial.
Estudos em animais mostram que o PETN é associado a efeitos benéficos contra aterosclerose em coelhos hiperlipidêmicos e à melhora da disfunção endotelial no diabetes pela redução do estresse oxidativo (SCHUHMACHER et al, 2011).
Todos os benefícios contra doenças cardiovasculares desempenhados pelos nitratos orgânicos resultam, principalmente, do relaxamento das células musculares lisas vasculares mediante a liberação de NO. Entretanto, a terapia a longo prazo com essas drogas resulta no rápido desenvolvimento de tolerância, limitando sua eficácia (GOYAL et al, 2006; KLEMENSKA; BERESEWICZ, 2009; YURTSEVEN et al, 2003).
inativam enzimas envolvidas na liberação de NO (KLEMENSKA; BERESEWICZ, 2009; THADANI, 1997).
A partir da década de 80, abordagens experimentais revelaram que os nitratos NTG, ISDN, ISMN e PETN induzem tolerância, sendo este último em menor proporção (FINK; BASSENGE, 1997; JURT et al, 2001). A redução da atividade da enzima ALDHm e a elevação das EROs são as principais causas de tolerância induzida por essas drogas (DAIBER et al, 2004). Além disso, o processo de tolerância está associada ao surgimento de modificações deletérias como a disfunção endotelial e o aumento ativação simpática (KLEMENSKA; BERESEWICZ, 2009; THADANI, 1997; FUNG, 2004; FUNG, 1992).
Diante dessa problemática, a descoberta e a síntese de novos nitratos orgânicos incapazes de induzir tolerância tornam-se bastante relevante para o tratamento de desordens cardiovasculares, incluindo a hipertensão.
Recentemente, o nosso grupo de pesquisa apresentou os efeitos de um novo nitrato orgânico, o 2-nitrato-1,3-dibutoxipropano (NDBP) (Figura 5), obtido a partir da glicerina, um subproduto da rota de produção do biodiesel (SANTOS, 2009).
1.7 Considerações sobre o 2-nitrato-1,3-dibutoxipropano (NDBP)
Atualmente o mundo está vivendo o que se chama "Era dos Biocombustíveis", devido à preocupação com o meio ambiente e o potencial econômico dessas fontes energéticas (SANTOS, 2009). Entre os biocombustíveis, destaca-se o biodiesel como uma interessante alternativa e, sua produção tem aumentado nos últimos anos, no entanto, uma preocupação importante é como lidar com a grande quantidade de subprodutos gerados durante a sua rota de produção.
Nesse contexto, a partir da glicerina foi sintetizado o 2-nitrato-1,3-dibutoxipropano (NDBP). Este produto apresenta peso molecular de 249,304; fórmula molecular C11H23NO5; e fórmula estrutural mostrada a seguir:
Figura 5: Estrutura química do 2-nitrato-1,3-dibutoxipropano (NDBP).
Estudos in vivo demonstraram que o NDBP apresentou efeito hipotensor e bradicárdico de maneira dose-dependente em ratos normotensos não-anestesiados. Abordagens in vitro revelaram que o NDBP exerceu atividade vasorrelaxante em anéis de artéria mesentérica cranial isolada de rato e esse efeito possivelmente envolveu a liberação de NO em meio fisiológico com posterior ativação da via NO-GMPc-PKG, bem como canais para K+ (FRANÇA-SILVA, 2010), demonstrando
atividades promissoras do NDBP sobre o sistema cardiovascular. Entretanto, estudos relacionados à tolerância medicamentosa induzida pelo NDBP não foram realizados. Esses estudos são extremamente necessários para a obtenção de um nitrato orgânico mais eficaz que os já existentes.
2 OBJETIVOS
2.1 Objetivo geral
Avaliar os efeitos do 2-nitrato-1,3-dibutoxipropano (NDBP) sobre o sistema cardiovascular de ratos normotensos e hipertensos por meio de abordagens in vitro e in vivo.
2.2 Objetivos específicos
Abordagens in vitro
Avaliar a produção de óxido nítrico pelo NDBP em cultura de células musculares lisas de aorta de rato (CMLAR);
Verificar se o NDBP induz tolerância em preparações de artéria mesentérica cranial isolada de rato;
Abordagens in vivo
Caracterizar os efeitos da administração aguda do NDBP sobre a pressão arterial e frequência cardíaca em ratos normotensos Wistar Kyoto (WKY) e espontaneamente hipertensos (SHR) não-anestesiados;
3 MATERIAL E MÉTODOS
3.1 Animais
Foram utilizados ratos Wistar nos experimentos in vitro e, ratos espontaneamente hipertensos (SHR) e seus controles normotensos Wistar Kyoto (WKY) nos experimentos in vivo. Todos os animais foram provenientes do Biotério Prof. Thomas George, do Centro de Biotecnologia da UFPB.
Esses animais pesaram entre 250 e 300 g e tinham idade entre 12 e 14 semanas. Eles foram mantidos sob condições controladas de temperatura (21 ± 1 ºC) e ciclo claro-escuro de 12 horas (das 6 às 18 horas), com livre acesso à água e ração (Labina®, Purina). Todos os experimentos desenvolvidos neste estudo foram aprovados pelo Comitê de Ética em Pesquisa Animal do CBIOTEC/UFPB, sob parecer nº 0209/10 (Anexo).
3.2 Substância-teste
O NDBP foi obtido por síntese orgânica a partir da glicerina (SANTOS et al, 2009), e cedido ao projeto pelo laboratório do Prof. Dr. Petrônio Filgueiras de Athayde Filho, do Departamento de Química da UFPB.
Para a realização dos protocolos experimentais in vitro, imediatamente antes dos experimentos, o NDBP foi solubilizado em cremofor na proporção de 1:1 e diluído em água destilada para a concentração de 10-1 M; ou em solução salina (0,9%) para a concentração de 20 mg/ml, nos experimentos in vivo. Em seguida foram diluídos novamente para a concentração ou dose desejada, de acordo com a necessidade de cada protocolo experimental.
3.3 Drogas utilizadas
Dodge; e sal sódico de heparina, obtido da Roche. As drogas utilizadas nos experimentos in vitro foram dissolvidas em água destilada e as utilizadas nos protocolos in vivo foram dissolvidas em salina.
3.4 Soluções nutritivas
Nos protocolos in vitro foram utilizadas soluções nutritivas (pH = 7,4) aeradas com mistura carbogênia (95% de O2 e 5% de CO2) e mantidas a 37º C.
Na preparação das soluções foram utilizados os seguintes sais: cloreto de sódio (NaCl), cloreto de potássio (KCl), cloreto de cálcio (CaCl2), cloreto de
magnésio (MgCl2), fosfato de sódio (NaH2PO4), bicarbonato de sódio (NaHCO3) e
glicose (C6H12O6) (SIGMA), cuja composição em milimolar (mM) é descrita no
Quadro 1.
Substância Concentração (mM)
NaCl 158,3
KCl 4,0
CaCl2 2,0
MgCl2 1,05
NaH2PO4 0,42
NaHCO3 10,0
Glicose 5,6
Quadro 1: Composição da solução nutritiva de Tyrode (TANAKA et al, 1999).
Em outra série de experimentos foi utilizada a solução de tampão fosfato salina, conhecida como PBS, composta de cloreto de sódio (NaCl), cloreto de potássio (KCl), fosfato de potássio (KH2PO4) e fosfato dissódico (Na2HPO4), cuja
composição em milimolar (mM) é descrita no Quadro a seguir.
Substância Concentração (mM)
NaCl 137,0
KCl 2,7
KH2PO4 4,17
Na2HPO4 4,3
3.5 Cateteres vasculares
Na confecção dos cateteres para os protocolos in vivo, foram utilizados tubos de polietileno PE-10 (diâmetro interno e externo de 0,28 - 0,61 mm, respectivamente) de 3 cm de comprimento para o cateter arterial e 2,5 cm para o cateter venoso, soldados por aquecimento a tubos de polietileno PE-50 (diâmetro interno e externo de 0,58 - 0,96 mm, respectivamente) de 22 cm. Antes da canulação, os cateteres foram preenchidos com solução salina (0,9%) + 500 UI de heparina e a extremidade PE-50 de cada cateter foi obstruída com pino de metal.
3.6 Ensaios bioquímicos in vitro
Medida da produção intracelular de NO em células musculares lisas de aorta de rato (CMLAR)
O estudo bioquímico utilizando técnicas de citometria de fluxo/ Separador de Células Ativado por Fluorescência (Citômetro FACS Calibur®, Becton Dickinson, San Jose, CA, EUA) foi desenvolvido em colaboração com a Profª. Drª. Lia Sumie Nakao, no Setor de Ciências Biológicas, Centro Politécnico, UFPR, Curitiba-PR.
Cultura primária de CMLAR
Após a remoção da aorta torácica de ratos, esta foi transferida para PBS estéril onde os tecidos conjuntivo e adiposo foram removidos. Em seguida, o PBS foi trocado e a aorta seccionada em pequenos fragmentos de aproximadamente 5 mm.
2000 rpm). O sobrenadante foi desprezado e adicionou-se DMEM suplementado com SFB (10%) mais antibióticos ao “pellet”, o qual foi transferido para novas placas de cultura celular.
Incubação do DAF-2DA e protocolos experimentais
As CMLAR em confluência foram lavadas com PBS e mantidas em DMEM sem SFB para os experimentos. DAF-DA (10 μM) foi adicionado e incubado por 5 minutos 37ºC. Em seguida, adicionaram-se as substâncias-teste, que foram incubadas por 30 minutos a 37 ºC. As células foram lavadas com PBS e tratadas com tripsina (0,2% em DMEM) por 2 minutos para que fossem desprendidas do assoalho da placa de 24 poços (P-24).
Logo após a confirmação do desprendimento das células por microscopia óptica (Microscópio invertido Olympus, aumento de 400x), adicionou-se DMEM suplementado com SFB a 5% para reduzir a ação da tripsina frente às células. A seguinte sequência foi repetida por duas vezes: centrifugação (2000 rpm por 5 minutos), remoção do sobrenadante e lavagem com PBS. As suspensões de CMLAR (~106 células/mL) em PBS foram imediatamente levadas ao Citômetro para
quantificar a fluorescência (excitação: 490 nm e emissão: 530 nm) do interior das células (XIAO et al., 2006), sendo analisadas 10.000 células.
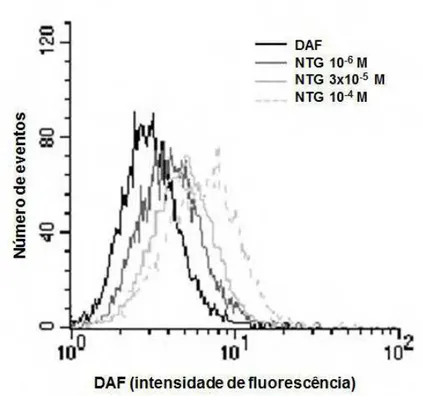
A biodisponibilidade de NO nas CMLAR foi quantificada por exposição das amostras biológicas ao NDBP (10-6 M, 3x10-5 M, 10-4 M), ou ainda ao nitroprussiato de sódio (NPS, 10-7 M) ou nitroglicerina (NTG, 10-6 M ou 10-4 M), os controles positivos, após pré-incubação com o DAF-2DA. A fluorescência nessas células foi produzida pela oxidação do DAF-DA em sua forma fluorescente verde, DAF-2T, e os sinais foram obtidos em histogramas de frequência.
Desse modo, foi possível detectar a concentração de NO sem estimulação (fluorescência basal), ou seja, na presença do DAF sozinho e, as mudanças na concentração intracelular de óxido nítrico após o tratamento com o NDBP, NTG ou NPS foram expressas como a razão entre a fluorescência após os tratamentos (F) e a fluorescência basal (F0): F/F0. Todos os tratamentos foram realizados em
3.7 Ensaios farmacológicos in vitro
Avaliação da habilidade do NDBP em induzir tolerância ao vasorrelaxamento
Preparações de anéis de artéria mesentérica cranial isolada de rato normotenso
Os ratos foram eutanasiados e, por meio de uma incisão no abdome do animal, a artéria mesentérica cranial foi identificada, removida e imediatamente transferida para a solução de Tyrode, onde o vaso foi dissecado e seccionado em anéis (1 - 2 mm de comprimento). Os anéis tiveram o endotélio removido por atrito mecânico entre as paredes internas do vaso e uma haste de metal. Cada anel foi imerso em cubas contendo solução de Tyrode, a 37º C, gaseificada com uma mistura de 95% de O2 e 5% de CO2 (carbogênio), para manter o pH relativamente
constante entre 7,2 e 7,4. Em seguida, os anéis foram suspensos verticalmente por linhas de algodão fixadas a um transdutor de força (DATAQ®, 2008, Insight, Brasil) e
submetidos à tensão basal de aproximadamente 0,75 g, durante 60 minutos para estabilização. Durante este período a solução do banho foi trocada a cada 15 minutos, para prevenir a interferência de metabólitos e a linha de base ajustada quando necessário (ALTURA; ALTURA, 1970). Mudanças na tensão isométrica foram captadas pelo sistema de aquisição (WinDaq/XL, DI 148-U, Insight, Brasil).
Verificação da presença do endotélio funcional
Avaliação da atividade vasorrelaxante do NDBP sobre tecido vascular previamente exposto ao composto
O protocolo de avaliação da tolerância induzida pelo NDBP foi realizado de acordo com Daiber et al (2004). Após um período de estabilização de 60 minutos e posterior verificação do endotélio funcional, o NDBP (10 µM ou 100 µM) foi adicionado ao banho e incubado por 30 minutos. Após este período os anéis foram lavados e submetidos a um segundo período de estabilização, semelhante ao anterior. Em seguida, induziu-se uma contração com FEN (10 M) e concentrações crescentes do NDBP (10-8, 3 x 10-8, 10-7, 3 x 10-7, 10-6, 3 x 10-6, 10-5, 3 x 10-5 e 10-4 M), foram aplicadas de maneira cumulativa para a obtenção de uma curva concentração-resposta (Figura 7). O relaxamento foi expresso como percentagem reversa da contração induzida pela FEN. Após a obtenção das curvas concentração-resposta, foram calculados os valores de pD2 (-log da CE50) e Emáx (efeito máximo)
das curvas individuais. O relaxamento induzido pelo NDBP em anéis pré-incubados com o composto foi comparado com o relaxamento dos anéis que não sofreram exposição prévia ao NDBP. Em outro grupo, os anéis foram incubados apenas com o cremofor (10 µM ou 100 µM) e o mesmo veículo foi administrado cumulativamente nas mesmas doses utilizadas do NDBP (10-8 a 10-4 M) após a contração com FEN
(Grupo controle).
3.8 Ensaios farmacológicos in vivo
Efeitos do NDBP sobre o controle autonômico de ratos espontaneamente hipertensos (SHR) e normotensos Wistar Kyoto (WKY)
Implantação dos cateteres vasculares
Um dia antes dos experimentos foi realizada a implantação dos cateteres vasculares (canulação). Os animais foram anestesiados com cetamina (75 mg/kg, i.p.) e xilazina (10 mg/kg, i.p.). Em seguida, foram colocados em decúbito dorsal em uma prancha cirúrgica. Uma pequena incisão na região inguinal foi realizada, separando a musculatura para localização do feixe vasculonervoso femoral. A seguir, artéria e veia femorais foram dissecadas e expostas. A extremidade PE-10 do cateter arterial foi introduzida em direção à aorta abdominal, via artéria femoral, para registro dos parâmetros cardiovasculares e em direção à veia cava caudal, por meio da veia femoral, para administração das drogas. Uma vez implantadas, as cânulas foram exteriorizadas na região escapular dorsal do rato e fixadas com linha de sutura.
Após a cirurgia, os animais foram acondicionados em gaiolas individuais mantidas sob condições de temperatura, luminosidade e níveis de ruído controlados e receberam água e ração ad libitum, durante 24 horas para recuperação.
Registro da pressão arterial (PA) e frequência cardíaca (FC)
Avaliação do efeito da administração aguda do NDBP sobre a PA e a FC em ratos espontaneamente hipertensos (SHR) e normotensos Wistar Kyoto (WKY) não-anestesiados
Após 24 horas da implantação dos cateteres vasculares, os animais foram mantidos em aclimatação por um período de 30 minutos para estabilização dos parâmetros cardiovasculares, em seguida, doses do NDBP (1, 5, 10, 15 e 20 mg/kg) foram administradas aleatoriamente por via intravenosa e as alterações na pressão arterial e na frequência cardíaca foram avaliadas, conforme o protocolo esquematizado na Figura 7.
Figura 7: Representação esquemática do protocolo experimental para a avaliação do efeito da administração aguda do NDBP sobre a PA e a FC.
Os valores de pressão arterial média (PAM) e frequência cardíaca (FC) foram computados antes (valores da linha de base) e imediatamente após a administração de NDBP e suas variações calculadas por meio da seguinte fórmula:
ΔPAM = PAMposterior– PAManterior
Onde:
PAM = Variação dos valores de pressão arterial média (PAM) PAMposterior = PAM após a administração do NDBP
PAManterior = PAM antes da administração do NDBP
O mesmo cálculo foi realizado para os valores de FC.
Avaliação da influência do bloqueio parassimpático na resposta induzida pelo NDBP
A fim de investigar a contribuição da atividade parassimpática nas respostas induzidas pelo NDBP, a atropina (2 mg/kg), um antagonista dos receptores muscarínicos (LEE et al, 2008), foi administrado por via intravenosa em ratos SHR e WKY, e o efeito do NDBP foi avaliado antes e após o bloqueio.
Avaliação da influência da vagotomia na resposta induzida pelo NDBP
Em outra série de experimentos, após anestesia com cetamina (75 mg/kg, i.p.) e xilazina (10 mg/kg, i.p.), os ratos SHR e WKY foram submetidos à secção bilateral do nervo vago, procedimento também denominado vagotomia e, as respostas ao NDBP foram avaliadas antes e após este procedimento cirúrgico.
Avaliação da influência do bloqueio ganglionar na resposta induzida pelo NDBP
No intuito de avaliar o efeito do NDBP sobre a atividade simpática dos animais SHR e WKY, foi administrado o hexametônio (30 mg/kg, i.v.), um bloqueador nicotínico ganglionar (SHYTLE et al, 2002). O NDBP foi administrado antes e após a utilização dessa ferramenta farmacológica e as respostas cardiovasculares foram comparadas.
Avaliação da influência do bloqueio da ciclase de guanilil solúvel (CGs) nos efeitos cardiovasculares induzidos pelo NDBP
Todos os protocolos experimentais in vivo com os diferentes bloqueios estão representados na Figura 8.
Figura 8: Representação esquemática do protocolo experimental para a administração do NDBP (15 mg/kg) em ratos SHR e WKY não-anestesiados antes e após diferentes bloqueios.
3.9 Análise estatística
Os dados foram expressos como média ± e.p.m. e foram consideradas diferenças significativas quando p<0,05. Nos experimentos farmacológicos in vitro, o valor de efeito máximo EMáx foi considerado como a resposta vasorrelaxante máxima
do NDBP à fenilefrina (FEN). As curvas foram obtidas por regressão não-linear, por meio da qual obteve-se também o pD2.
4 RESULTADOS
4.1 Produção de óxido nítrico intracelular em cultura de células musculares lisas de rato
Em células musculares lisas de aorta de rato (CMLAR), o NDBP (10-6 M, 3x10-5 M e 10-4 M) foi capaz de aumentar a fluorescência relativa após a incubação com o DAF-2DA (% fluorescência = 22.0 ± 1.2; 37.9 ± 4.0; 75.8 ± 9.5, respectivamente, n = 4, p<0,05), da mesma forma que o nitroprussiato de sódio, 10-7 M (% fluorescência = 24.3 ± 1.8), o controle positivo, demonstrando a produção intracelular de óxido nítrico (Figura 9). O tratamento com o cremofor (veículo) não alterou a fluorescência basal emitida pelo DAF (dados não mostrados).
Figura 9: Efeito do NDBP (10-6 M, 3x10-5 M, 10-4 M) ou NPS (10-7 M) sobre os níveis de NO expressos como fluorescência relativa em CMLAR ( 106/ml) usando o DAF-2DA. Dados representativos de quatro experimentos em triplicata. A produção basal foi zerada e a diferença foi colocada como percentagem da fluorescência nos diferentes tratamentos. Valores expressos como média ± e.p.m. *p<0,05 versus fluorescência basal.
A Figura 10 apresenta um traçado representativo ilustrando o aumento da fluorescência emitida por DAF causado pelo NDBP em comparação com o nitroprussiato de sódio (NPS) em CMLAR.
0 20 40 60 80 100 NDBP 10
-6 M
NDBP 3 x
10 -5 M
NDBP 10
-4 M
NPS 10
Figura 10: Fluorescência basal emitida por DAF, e pela adição do NPS em CMLAR (A). Fluorescência basal emitida pela adição do NPS ou NDBP, 10-6 M (B); NPS ou NDBP, 3 x 10-5 M (C); NPS ou NDBP, 10-4 M (D) em CMLAR.
A B