Universidade de Brasília Instituto de Ciências Biológicas
Departamento de Botânica
Programa de Pós-Graduação em Botânica
Propagação
in vitro
e Caracterização Anatômica de Gemas
Adventícias e Embriões Somáticos de Murici (
Byrsonima basiloba
Juss., Malpighiaceae)
Zanderluce Gomes Luis
Universidade de Brasília Instituto de Ciências Biológicas
Departamento de Botânica
Propagação
in vitro
e Caracterização Anatômica de Gemas
Adventícias e Embriões Somáticos de Murici (
Byrsonima basiloba
Juss., Malpighiaceae)
Zanderluce Gomes Luis
Orientador: Luiz Alfredo Rodrigues Pereira
Co-orientadora: Conceição Eneida dos Santos Silveira
Dissertação apresentada ao Departamento de Botânica do Instituto de Ciências Biológicas da Universidade de Brasília, como parte dos requisitos necessários à obtenção do título de Mestre em Botânica.
____________________________________ Dr. Luiz Alfredo Rodrigues Pereira
Departamento de Botânica, UnB (Orientador)
___________________________________ Dra. Conceição Eneida dos Santos Silveira
Departamento de Botânica, UnB (Co-Orientadora)
____________________________________ Dr. João Batista Teixeira
CENARGEN/EMBRAPA (Membro externo)
___________________________________ Dra. Sueli Maria Gomes
Departamento de Botânica, UnB (Membro interno)
____________________________________ Dra. Lourdes Isabel do Velho Amaral
À meus pais e aos meus irmãos,
que colaboraram com compreensão,
amor e carinho nesta jornada
!!!
DEDICO
À minha mãe, pelo carinho de todos os dias, palavras de conforto e amizade. À meu pai, pela confiança e por acreditar sempre. Aos meus irmãos, pelo carinho e companheirismo.
À meus avós Orlando e Ironda, por todo incentivo e amparo.
Ao Maricélio, por toda atenção, dedicação, companheirismo, ajuda em todas as coletas e tudo que fosse necessário. À sua família, por me receber quando mais precisei, pelo carinho e atenção. Em especial à Marinalva por me acolher como filha e cuidar como se assim fosse.
Ao meu orientador, Professor Luiz Alfredo, pela compreensão, paciência e ajuda, sempre que necessário e principalmente por ter acreditado no meu potencial.
À co-orientadora, Professora Eneida, por toda paciência e auxílio durante todas as etapas deste trabalho e, principalmente, pela amizade e conselhos que foram de grande importância para minha formação pessoal e profissional.
Aos professores membros da banca: João Batista Teixeira por toda atenção e contribuição ao meu trabalho; Loudes Amaral, por toda atenção, carinho e incentivo, que foram essenciais quando achei que tudo estava perdido; Sueli Maria Gomes pela atenção.
Ao professor José Elias de Paula, por identificar a espécie no campo e toda a atenção prestada.
À minha querida amiga Giselle Pina, pela amizade sincera, companheirismo, incentivo e ajuda em todos os momentos. Obrigada Gi!!!
Ao amigo Davi!!! Sempre sincero e muito divertido! Obrigada por toda ajuda, amizade e confiança!!!
ii
Aos amigos do Programa de Pós-Graduação em Botânica, Kadja, Aucilene, Juliene, Thais, Angélica, Gustavo, Mônica, Maria, Sabrina, Plauto, Gabriela, Cinara e Silvia, pela amizade.
Aos funcionários do Departamento de Botânica, Elias Luiz B. Cavalcante, por toda orientação e amizade; Eli Noronha, pela paciência e ensinamentos; Daiane e Guilherme pela amizade!
A todos os amigos do Laboratório de Anatomia Vegetal e Fisiologia Vegetal por tornarem meus dias mais felizes!
A todos que, de uma forma ou de outra, colaboraram para o encerramento desta etapa importante da minha vida e que, embora não citados aqui, não deixam de ter meu profundo agradecimento.
À Capes pela bolsa de mestrado!
INTRODUÇÃO GERAL --- 1
1. REVISÃO BIBLIOGRÁFICA --- 5
1.1 Alguns aspectos sobre Byrsonima Rich. ex. H.B.K. --- 6
1.2 Byrsonima basiloba--- 7
1.3 Cultura de tecido vegetais---10
1.4 Micropropagação ---11
1.5 Multibrotação ---12
1.6 Regeneração in vitro de plantas ---13
1.7 Contaminação in vitro---14
1.8 Meios de Cultura ---16
1.9 Reguladores de crescimento ---17
2. REFERÊNCIASBIBLIOGRÁFICAS ---20
CAPÍTULO I---27
MICROPROPAGAÇÃO DE Byrsonima basiloba Juss ---27
RESUMO ---28
1. INTRODUÇÃO ---30
2. MATERIALEMÉTODOS ---32
2.1 Coleta e preparo do material vegetal ---32
2.2 Cultura de Tecidos ---32
2.2.1 Desinfestação com hipoclorito de sódio e germinação ---33
2.2.2 Desinfestação com fungicida Carbendazim e germinação ---33
2.2.3 Multiplicação ---34
2.2.3.1 Multiplicação e alongamento de brotos nos subcultivos---34
2.2.3.2 Efeito das concentrações de sais, hormônios e carvão ativado na multiplicação e alongamento---35
2.2.4. Alongamento ---36
2.2.5 Enraizamento e aclimatação---36
2.3. Análise estatística ---37
iv
3.2. Influência do tempo de imersão em fungicida Carbendazim na desinfestação e
germinação de sementes ---39
3.3 Germinação e desenvolvimento das plântulas ---40
3.4 Multiplicação ---42
3.4.1 Efeito do número de subcultivos---42
3.4.2 Efeito da concentração de sais do meio MS, hormônios e carvão ativado na multiplicação e alongamento de brotos---45
3.5 Alongamento ---49
3.6 Enraizamento e aclimatação ---49
4. DISCUSSÃO ---52
4.1 Desinfestação e germinação de Byrsonima basiloba---52
4.2 Desenvolvimento das plântulas---54
4.3 Multiplicação e alongamento ---55
4.4 Enraizamento e aclimatação ---58
5. CONCLUSÕES ---60
6. REFERÊNCIASBIBLIOGRÁFICAS ---61
CAPITULO II ---66
RESUMO ---67
1. INTRODUÇÃO ---69
2. MATERIALEMÉTODOS---71
2.1. Material vegetal ---71
2.2. Meio de cultura para indução de formação de gemas adventícias e embriões somáticos ---71
2.3. Concentrações de BAP e ANA na indução de embriogênese somática e organogênese---72
2.4 Testes para maximização dos processos de organogênese e embriogênese. ---72
2.4.1 Efeito do TDZ, BAP e ANA ---72
2.4.2 Efeito de um pré-tratamento, tratamento e meio de regeneração na indução de gemas adventícias e embriões somáticos---74
2.5 Análise morfo-anatômica ---74
2.5.1 Obtenção do material e fixação ---74
3.1 Reação dos explantes ao tratamento com BAP e ANA. ---76
3.2 Testes para maximização dos processos de organogênese e embriogênese.---77
3.2.1 Efeito do TDZ, BAP e ANA ---77
3.2.2 Efeito da variação das concentrações de BAP e ANA ---78
3.3 Análise morfo-anatômica ---82
4 DISCUSSÃO ---86
5 CONCLUSÕES ---91
6
REVISÃO BIBLIOGRÁFICA
Figura 1. Aspectos gerais de Byrsonima basiloba--- 9
CAPÍTULO I Figura 1. Germinação e desinfestação de sementes de Byrsonima basiloba em função do tempo de imersão em hipoclorito de sódio---38
Figura 2. Germinação e desinfestação de sementes de Byrsonima basiloba em função dos diferentes tempos de imersão em fungicida ---39
Figura 3. Desenvolvimento das plântulas de Byrsonima basiloba in vitro em água e ágar --41
Figura 4. Aspecto dos brotos de Byrsonima basiloba no primeiroe segundosubcultivos com 30 dias de cultivo.---44
Figura 5. Aspecto dos brotos de Byrsonima basiloba após 30 dias de cultivo---44
Figura 6. Aspecto dos brotos de Byrsonima basiloba após 30 dias de cultivo---48
Figura 7. Brotos de Byrsonima basiloba em meio de alongamento---49
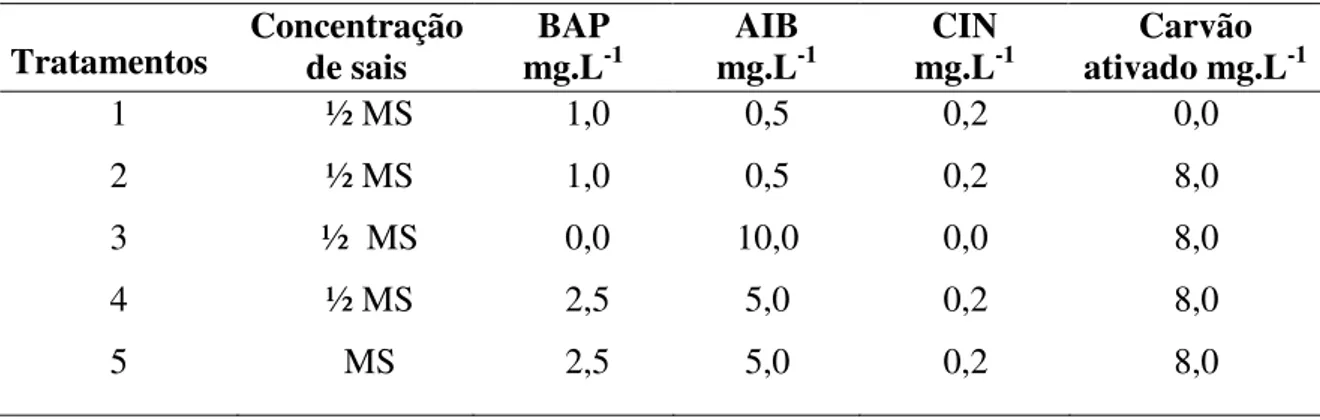
Figura 8. Enraizamento e aclimatação de brotos micropropagados de Byrsonima basiloba-51 Tabelas Tabela 1. Concentrações de sais do meio MS, de hormônios e presença ou não de carvão ativado nos tratamentos do segundo experimento de multiplicação de brotos de Byrsonima basiloba---35
Tabela 2. Média de brotos produzidos por clone nas cinco subculturas em meio MS suplementado com 1,0 mg.L-1 AIB + 0,5 mg.L-1 de BAP + 0,2 mg.L-1 de CIN ---42
Figura 1. Explantes inoculados em meio suplementado com 0,45 mg.L-1 de BAP e 0,09
mg.L-1 ANA ---77
Figura 2. Explantes inoculados inicialmente em meio BA suplementado com TDZ (0.66 mg.L-1) e ANA (0.01 mg.L-1) ---78
Figura 3. Porcentagem de explantes oxidados, com calo friável e explantes necrosados em tratamentos contendo diferentes concentrações de BAP e ANA---80
Figura 4. Calos em explantes cotiledonares de Byrsonima basiloba---81
Figura 5. Aspecto das células nos calos, em divisão e sua organogênese ---83
8
AIB AIA ANA BAP CIN MS ½ MS TDZ 2,4-D PVC
Ácido indolbutírico Ácido 3-indoliacético Ácido naftaleno-acético 6-benzilaminopurina
6-furfurilaminopurina (cinetina)
Meio de cultura formulado por (Murashige & Skoog, 1962) Concentrações de sais do meio MS diluídas pela metade Thidiazuron
INTRODUÇÃO GERAL
O Cerrado é um tipo de vegetação própria do Brasil, com algumas extensões alcançando a Bolívia e o Paraguai, abrigando uma importante diversidade biológica, com um número significativo de espécies endêmicas (Ratter et al., 1997). É considerado uma das 25 áreas mundiais prioritárias para conservação da biodiversidade, graças ao número de espécies endêmicas e o grau de ameaça em virtude das ações antrópicas.
O Cerrado abriga uma grande biodiversidade com cerca de 10 mil espécies de plantas dos quais 4400 seriam endêmicas, correspondendo 1,5 % da flora mundial (Myers et al., 2000). Esse bioma possui inúmeras espécies de interesse econômico como plantas medicinais e frutíferas que geralmente são utilizadas pela população como fonte de alimento, no tratamento de muitas doenças infecciosas como malária, infecções bacterianas e fúngicas (Alves et al., 2000).
É um bioma que se encontra bastante ameaçado, com espécies importantes comercial e ecologicamente e que estão desaparecendo em função da desordenada expansão urbana e agropecuária, bem como pela exploração irracional. O ritmo acelerado desta ação antrópica nas últimas décadas tem ocasionado a perda de material genético vegetal nativo e praticamente desconhecido cientificamente (Vieira & Martins, 2000). A preocupante taxa de extinção destas espécies vegetais torna urgente o estabelecimento de políticas e ações de conservação. Uma solução para a manutenção desse patrimônio genético é viabilizar o uso econômico e sustentável das espécies nativas do Cerrado que podem ser exploradas como recurso genético, alimento, medicamentos, fonte de energia, emprego em paisagismo e outras utilidades (Zaidan & Figueiredo-Ribeiro, 1995; Felfili et al., 2002).
Brasil, as quais são conhecidas popularmente como murici (Mamede et al., 1998). Seus frutos são ricos em vitamina C (Filgueiras & Silveira, 1990; Almeida et al., 1998) e comumente utilizados na fabricação de doces, sucos, licores, sorvetes e consumo in natura. Sua comercialização se dá em grande parte em feiras livres e mercados públicos da região de ocorrência das espécies (Gusmão et al., 2006).
Além de ser uma excelente fonte de alimento, a casca dos frutos pode ser utilizada como antidiarréico, na forma de chá ou como antifebrífuga, quando usada separadamente em decocção (Ferreira, 1973, Almeida et al., 1998). As espécies arbóreas de Byrsonima podem ser utilizadas na construção civil, como ornamentais e também na recuperação de áreas degradadas (Silva & Tassara, 1996).
Apesar de sua grande utilidade, estudos visando o uso racional dessas espécies são raros. Além disso, muitas plantas do Cerrado, inclusive o gênero Byrsonima possuem baixa taxa de germinação e emergência lenta das plântulas (Lorenzi, 2002), dificultando a propagação pela via sexuada. É importante que se trabalhe no sentido de se obter formas eficientes de propagação das espécies deste gênero, o que dará suporte para a multiplicação e conservação in vitro de genótipos, contribuindo dessa maneira para o seu manejo sustentável.
O uso de técnicas de cultura de tecidos consiste numa alternativa viável de propagação de plantas com dificuldades de reprodução semelhante às encontradas em espécies de Byrsonima. É uma ferramenta promissora para a preservação de fontes vegetais, pois facilita a distribuição de material das plantas ameaçadas e permite a formação de banco de genes. Através da micropropagação o cultivo das espécies pode ser viabilizado em menos tempo, tanto para a recuperação do ambiente, como para o cultivo comercial das espécies com potencial econômico (Fay, 1992; Kane et al., 2000; Pletsch, 2003).
1 REVISÃO BIBLIOGRÁFICA
1.1 Alguns aspectos sobre Byrsonima Rich. ex. H.B.K.
A família Malpighiaceae inclui cerca de 1.100 espécies, representadas por árvores, arbustos e lianas (Mabberley, 1993). Composta por cerca de 60 gêneros, essa família tem um amplo centro de distribuição na América Tropical, onde estão aproximadamente 85% de suas espécies (Davis et al., 2002). Nos diferentes biomas do Brasil, a família apresenta 32 gêneros, com cerca de 300 espécies (Barroso, 1991). Dentre os gêneros pertencentes à Malpighiaceae, Byrsonima é composto por cerca de 150 espécies (Mamede, 1981), sendo um gênero essencialmente americano e encontrado nas regiões tropicais e subtropicais da América do Sul (Felício et al., 1995).
No Brasil, são encontradas cerca de 60 espécies de Byrsonima distribuídas em vários estados, desde a Amazônia até o Paraná. O Cerrado brasileiro apresenta 38 espécies deste gênero, que medram em diferentes fisionomias, como cerradão, cerrado, cerrado sujo, cerrado ralo, campo rupestre e mata de galeria (Mendonça, 1998). No Distrito Federal há registro de 10 espécies (Giulietti, 1971). Popularmente são conhecidas como murici, morici, mureci ou moreci (Corrêa, 1984).
A frutificação das espécies Byrsonima pode ocorrer ao longo do ano todo (Ferreira, 1973). Os frutos são drupas de coloração amarela maturidade, com exocarpo fino, mesocarpo carnoso, endocarpo pétreo, contendo um único pirênio, com três lóculos e uma semente em cada lóculo (Giulietti, 1971; Ferreira, 1973; Barroso, 1991), sendo B. gautherioides Griseb. a única espécie cujo fruto é unilocular monospérmico (Giulietti, 1971).
Apesar da importância econômica do gênero, poucos trabalhos foram dedicados ao seu estudo, principalmente no que diz respeito à propagação de suas espécies para o uso racional e sustentável.
1.2 Byrsonima basiloba
Byrsonima basiloba possui vários nomes populares como murici-do-campo ou murici de folhas brancas (Ferreira, 1973), e de acordo com dados constantes no herbário da Universidade de Brasília (UB), também é conhecida como murici-de-ema. B. basiloba é uma planta arbustiva, bastante ramificada, com cerca de 2 metros de altura (Ferreira 1973). De acordo com Giuliette (1971), Byrsonima basiloba pode ser coletada em diferentes localidades do Distrito Federal, tais como, nas margens do Lago Paranoá, na Chapada da Contagem, no córrego Convança, além de outras áreas. Pereira (2002) também encontrou espécimes de B. basiloba no final da L2 Norte, próximo ao parque Olhos D’água e na via L3 próximo ao IBAMA.
Figura 1. Aspectos gerais da espécie Byrsonima basiloba. A) Indivíduo no campo, com frutos verdes. B) Ramo com gema apical; folhas com filotaxia oposta cruzada. C-D) Frutos verdes e em estágio de maturação. Matriz fotografada no Centro Olímpico da Universidade de Brasília.
No comércio, já é possível encontrar a polpa de murici (Silva & Borges, 1979), que é vendida como uma mistura de polpas de várias espécies do gênero. Isso ocorre em função da dificuldade de colher frutos de uma mesma espécie, uma vez que esses são extraídos em áreas de vegetação nativa, onde a densidade por espécie é baixa e irregular (Azanha, comunicação pessoal). Além disso, devido à constante redução das áreas de Cerrado, B. basiloba pode sofrer uma erosão genética, agravando bastante a situação dessa espécie na natureza. Estudo de propagação in vitro a partir de ramos e plântulas germinadas in vitro demonstra que é possível o uso de técnicas de cultura de tecidos para a propagação dessa espécie. Foi estabelecido um protocolo de propagação a partir sementes germinadas in vitro, contudo as fases de enraizamento e aclimatação não foram completadas (Pereira, 2002).
1.3 Cultura de tecidos vegetais
A cultura de tecidos vegetais consiste em inocular explantes, que podem ser pedaços de caule ou de folha, gemas, embriões, cotilédones e grãos de pólen, em condições assépticas em meio de cultura visando promover a regeneração e multiplicação somática desses explantes para obtenção de uma planta completa, com todas as características e funções orgânicas da planta original (Melo et al., 1998). Em geral, os meios de cultura contêm sais minerais, podendo ter ou não um agente gelificante, suplementado com fitorreguladores, em ambiente asséptico e condições de luz e temperatura controladas (Feveiro et al., 2001).
(Moreira et al., 1999), barbatimão, Stryphnodendron adstringens (Mart.)Coville (Pasqual & Barros, 1992; França et al., 1995), e Anemopaegma arvense (vell) Stellf. ex de Souza (Pereira et al., 2003). Os resultados obtidos de tais estudos são promissores o suficiente para se acreditar que a continuidade das pesquisas nesta área trará benefícios significativos para o plantio de espécies selecionadas (Melo et al., 1998).
1.4 Micropropagação
A micropropagação é uma das principais aplicações da cultura de tecidos vegetais (Barbosa et al., 1993) e tem como objetivo reproduzir plantas idênticas à planta-matriz de onde foram retirados os explantes. A técnica está baseada no totipotencial de uma única célula vegetal, ou seja, na sua capacidade de, por si só, originar uma nova planta, com as mesmas características genéticas da planta original (Pinto, 2001).
Através das técnicas de micropropagação pode-se induzir a proliferação de gemas apicais e axilares (multibrotação), formação de gemas adventícias por organogênese e de embriões por embriogênese somática, permitindo a obtenção de um grande número de plantas em pouco tempo (Grattapaglia & Machado, 1998; Torres et al., 1998; Carvalho, 1999).
compostos pouco interessantes em compostos muito interessantes sob o aspecto econômico
(Amaral & Silva, 2003).
Vários fatores influenciam na obtenção de um protocolo de sucesso para micropropagação. Dentre eles podemos destacar: estado fisiológico e fitossanitário da planta matriz e do explante no momento da coleta, a época de coleta, o tipo de explante, o protocolo de desinfestação, o isolamento e o tamanho dos explantes, as condições de cultivo, a manipulação dos explantes nas subculturas, entre outros (Youmbi, 1991; Silveira, 1994; Grattaplaglia & Machado, 1998).
1.5 Multibrotação
A técnica de multibrotação consiste na multiplicação por meio de brotos contendo meristemas apicais e/ou axilares ou através de primórdios foliares. Pode ser realizada em meio de cultura com ou sem reguladores de crescimento, resultando em brotos semelhantes a plântulas, com forte dominância apical. Os meristemas podem estar quiescentes ou ativos, dependendo do estado fisiológico da planta (Melo, 1998).
Para se estabelecer uma cultura de ápices/gemas axilares é necessário que as partes da planta-mãe (explante), sejam retiradas livre de microorganismos, e colocadas em meio de cultura. Quanto menor o explante, maior a probabilidade de se obter uma planta livre de patógenos (Simão, 1998; Feveiro et al., 2001), porém torna-se mais difícil sua sobrevivência. Apesar dos explantes maiores que 0,25 mm aumentarem o risco de contaminação virótica, eles têm uma taxa de sobrevivência mais elevada (Simão, 1998).
Essa técnica tem sido usada com sucesso na multiplicação de diversas espécies (Fidelis, 1998), possibilitando obter mudas sadias, livres de vírus e outros patógenos, produzindo assim, material de alta qualidade genética e sanitária, sem a introdução de variabilidade genética (Grattapaglia & Machado, 1998).
1.6 Regeneração in vitro de plantas
A regeneração in vitro pode ser realizada por organogênese ou embriogênese somática a partir de uma otimização dos componentes do meio de cultura. A organogênese ocorre pela diferenciação de gemas adventícias diretamente no explante (organogênese direta) ou do calo (organogênese indireta) (Grattaplagia & Machado, 1998). Nesta via de regeneração, a gema é uma estrutura monopolar e há conexão vascular ao tecido de origem (Tisserat, 1991).
A regeneração indireta tem a vantagem de possibilitar a obtenção de uma grande quantidade de plantas a partir de um único explante, sendo um dos métodos mais eficientes na produção de plantas in vitro. Essa técnica apresenta o risco de provocar alterações genéticas tais como aneuploidias e poliploidias, que levam à perda da identidade genética do material propagado sendo, portanto evitada na propagação de culturas economicamente importantes, entretanto, é possível distinguir os regenerantes aberrantes na primeira etapa do processo, podendo-se assim eliminar as plantas indesejáveis (Pereira & Melo, 2004).
espécies de plantas, entretanto o seu sucesso em plantas lenhosas ainda é limitado (Guerra et al., 1999).
O sucesso para qualquer via de regeneração in vitro depende de vários fatores, onde os fitorreguladores se destacam como os principais controladores da morfogênese in vitro. De acordo com França (2001), a presença de reguladores de crescimento no meio de cultura propiciou amplo avanço das técnicas que constituem a biotecnologia atual.
1.7 Contaminação in vitro
Na micropropagação todas as etapas são importantes, porém a desinfestação do explante é essencial, na qual podem ser utilizadas diversas substâncias de ação germicida. A desinfestação deve permitir a eliminação dos microorganismos com o menor dano possível para os explantes. Na desinfestação, deve-se levar em conta o tipo de explante e a espécie vegetal para o uso das soluções desinfetantes (Mroginki & Roca, 1991).
necessário a adequação de acordo com a espécie e a sensibilidade do tecido a ser desinfestado (Mroginki & Roca, 1991).
A contaminação por microorganismos é conhecida como um dos problemas mais sérios na micropropagação. Na maioria das vezes, essa contaminação é proveniente de bactérias, sendo consideradas os contaminantes mais comuns em cultura de tecidos e os que ocasionam os maiores danos. Em seguida encontram-se os vírus, porque podem ser sistêmicos e sua detecção é mais difícil (Montarroyos, 2000). Para o controle das contaminações bacterianas, normalmente são utilizadas substâncias antibióticas que são incorporadas ao meio de cultura ou usadas diretamente sobre os explantes contaminados (Grattapaglia & Machado, 1998; Montarroyos, 2000).
As contaminações fúngicas podem ser facilmente visualizadas devido à intensa proliferação dos fungos (Pasqual et al., 1997). O benomyl, primeiro fungicida sistêmico desenvolvido, possui atividades preventivas, curativas e sistêmicas contra numerosos grupos de fungos, sendo utilizado em diversos trabalhos no controle de contaminações fúngicas, através de pulverizações na planta matriz em várias concentrações, 200 mg.L-1 (Sato et al., 2001), 1,0 g.L-1 (Dantas et al., 2002; Rodrigues et al., 2003), 2,0 g.L-1 (Mantovani et al., 1999). A desinfestação de explantes, através da imersão completa do explante no fungicida tem sido relatada em diversos trabalhos como o realizado com embriões de pau-rosa, Aniba rosaeodora Ducke (Handa et al., 2005) e em brotos de Pfaffia tuberosa (Spreng.) Hicken
1.8 Meios de Cultura
Os meios utilizados para a cultura de células, tecidos e órgãos de plantas fornecem as substâncias essenciais para o crescimento dos tecidos e controlam, em grande parte, o padrão de desenvolvimento in vitro (Caldas et al., 1998).
O meio de cultura é constituído de componentes essenciais e opcionais. Os essenciais são água, sais inorgânicos, fonte de carbono e energia, vitaminas e reguladores de crescimento. Outros componentes orgânicos, tais como aminoácidos, amidas, ácidos orgânicos e substâncias naturais complexas podem ser adicionados ao meio para otimizar determinada resposta no padrão de crescimento (Torres et al., 2001).
Os macronutrientes nitrogênio, fósforo, potássio, cálcio, magnésio, e enxofre são requeridos em todos os tipos de culturas, mas a concentração requerida pela planta de cada um pode variar de acordo com a espécie. Os micronutrientes são requeridos pela planta em quantidades menores, sendo os mais utilizados em cultura de tecidos o ferro, manganês, zinco, boro, cobre, cloro, molibdênio, e o níquel, no entanto o cobalto, iodo, e o sódio são incluídos em alguns meios de cultura, embora sua exigência e papel na fisiologia não estejam bem definidos (Rout et al., 2000).
A exigência de carboidratos é suprida com a incorporação da sacarose 2-3%, ou glicose, sendo está última com menos freqüência. Outros carboidratos como a lactose, a maltose, a galactose são usados raramente. Além do seu papel como uma fonte de carbono, os carboidratos ajudam a manter o potencial osmótico no meio de cultura.
capazes de sintetizar todos seus aminoácidos exigidos, a adição de glutamina, cisteína, prolina, e tirosina ou uma mistura do aminoácido como a caseína hidrolisada ao meio pode aumentar o crescimento celular.
O ágar é o agente solidificante mais usado para preparar meios de cultura sólidos ou semi-sólidos, porém outros agentes gelificantes como gelatina, amido e o gelrite também são utilizados (Rout et al., 2000).
O meio MS (Murashige & Skoog, 1962) e o B5 (Gamborg et al., 1968) são os mais utilizados na cultura de tecidos da grande maioria das espécies, porém para espécies lenhosas o mais indicado é o WPM (Lloyd & Mccown, 1980; Caldas et al., 1998). Entretanto, algumas espécies lenhosas são propagadas em meio MS, como a aroeira, Myracrodruon urundeuva Fr. All (Andrade et al., 2000) e Kielmeiera coriacea Mart. (Arello & Pinto, 1993). Além disso, modificações e diluições feitas no meio MS têm apresentado bons resultados para diversas espécies lenhosas. Em espinheira-santa, com a redução em 50% da concentração dos sais do meio MS, minimizou-se a oxidação fenólica (Flores et al., 1998), enquanto que, para mogno ,Swietenia macrophylla King, e espécies de Prunus, o meio MS diluído a ¾ foi eficiente no crescimento dos explantes, e na taxa de multiplicação (Rodrigues et al., 2003; Rocha & Quorin, 2004). Na micropropagação de Lychnophora pinaster Mart, o meio MS diluído quatro vezes resultou em maior sobrevivência e multiplicação dos explantes (Souza, et al., 2003). Já para aroeira, o meio MS com a metade dos seus sais foi eficiente na multiplicação da espécie (Andrade et al., 2000).
1.9 Reguladores de crescimento
estado fisiológico dos explantes, que está relacionado com a época do ano e estado geral da planta-matriz (Castro et al., 2002).
As citocininas e as auxinas são as classes de reguladores mais usadas em cultura de tecidos e o balanço hormonal destes dois reguladores determina a formação de raízes, parte aérea e calo (Frank & Chumulling, 1999).
As citocininas desempenham papel importante na regulação da divisão celular, expansão foliar, quebra de dominância apical, formação de gemas adventícias, induzem o desenvolvimento prematuro de brotos axilares, que produzem grande número de brotações que podem ser cultivadas e utilizadas na produção de mudas, e interagem com as auxinas no controle de muitos aspectos do crescimento e do desenvolvimento das plantas (Frank & Schmulling, 1999; Pozo et al., 2005). Dentre as citocininas mais usadas em cultura de tecidos estão: BAP (6-benzilaminopurina), cinetina (CIN), zeatina, 2IP (isopenteniladenina) e TDZ (thidiazuron) (Torres, 2001).
O BAP tem sido muito eficaz para promover a multiplicação em diversas espécies e parece ser a citocinina mais adequada para a formação de grande número de brotos e alta taxa de multiplicação nas culturas. Por outro lado, a CIN permite apenas o crescimento normal sem brotações múltiplas (Hu & Wang, 1983 apud Torres, 1998; Grattapaglia & Machado, 1998). O TDZ é um herbicida, que tem sido utilizado como regulador de crescimento e apresenta efeitos semelhantes às citocininas, estimulando a produção de calos, tendo ação superior a estas, sendo muito eficiente na micropropagação em várias espécies, principalmente arbóreas ou florestais (Huetteman & Preece, 1993).
Pozo et al., 2005). As auxinas mais usadas são AIA (ácido indolacético), AIB (ácido 3-indolbutírico), ANA (ácido ∝-naftalenoacético) e 2,4-D (ácido 2,4-diclorofenoxiacético). O
AIA é uma auxina instável que se degrada facilmente na presença de luz, pH baixo (Torres, 2001), fatores que a tornam muito fraca, quando comparada com o 2,4-D e o ANA, que são mais estáveis. O 2,4-D promove uma maior formação de calos e pode ser importante em sistemas de embriogênese somática, enquanto o AIA é ineficaz. Já o AIB é geralmente a melhor auxina na indução de raízes in vitro (Torres, 1998).
2 REFERÊNCIAS BIBLIOGRÁFICAS
Almeida, S.P.; Proença, C.E.B.; Sano, S.M.; Ribeiro, J.F. Cerrado: espécies vegetais úteis. EMBRAPA- CPAC. Planaltina, DF. 85-88 p. 1998.
Alves, T. M. De A.; Silva, A. F.; Brandão, M.; Grandi, T. S. M.; Smânia, E. De F.; Smânia Júnior, A.; Zani, C. L. Biological screening of Brazilian medicinal plants. Memórias do Instituto Oswaldo Cruz. 95(3): 367-373 p. 2000.
Alves, E. C. S. C., A. Xavier & W. C. Otoni. Organogênese in vitro a partir de explante
caulinar na regeneração de clones de Eucalyptus grandis W. Hill ex Maiden X E.
urophylla S. T. Blake. Revista Árvore. 28(5): 643-653p. 2004.
Amaral, C.L.F.; Silva, A.B. da. Melhoramento biotecnológico de plantas medicinais. Biotecnologia Ciência e Desenvolvimento, 30: 55-59p. 2003.
Andrade, M.W. De; Luz, J.M.Q.; Lacerda, As.; Melo, P.R.A.de. Micropropagação da aroeira (Myracrodruon urundeuva Fr. All). Ciência e Agrotecnologia, 24 (1):174-180p. 2000. Barbosa, M.H.P.; Pasqual, M.; Pinto, J.E.B.P.; Arello, E.F.; Barros, I. Efeitos da
benzilaminopurina e ácido indole-3-acético sobre a propagação in vitro de Gerbera jamesonii Bolus ex Hook cv. Applebloesem. Pesquisa Agropecuária Brasileira. Brasília. 28(1): 15-19p. 1993.
Barroso, G.M. Sistemática de Angiospermas do Brasil. Universidade Federal de Viçosa, MG. 1991.
Caldas, L.S.; Haridasan, P.; Ferreira, M.E. Meios nutritivos. In: Torres, A.C.; Caldas, L.S.; Buso, J.A. (Ed). Cultura de tecidos e transformação genética de plantas. Brasília: EMBRAPA-CNPH, 87-132p. 1998.
Carvalho, J.M.F.C. Técnicas de Micropropagação. EMPRAPA- Centro Nacional de Pesquisas de Algodão. Campina Grande, PB. ISS 0101-0205, 38p. 1999.
Corrêa, M.P. Dicionário das Plantas Úteis do Brasil. Ministério da Agricultura Instituto Brasileiro de Desenvolvimento Florestal. 5: 264-269p. 1984.
Dantas, A.C.De M.; Nesi, A.N.; Machado, L.B.; Haerter, J.; Fortes, G.R.de L. Estabelecimento e multiplicação in vitro de cultivares de Pyrus spp. Revista Brasileira de Agrociência, 8(1):19-23p. 2002.
Davis, C.C.; Anderson, W.R.; Donoghue, M.J. Phylogeny of Malpighiaceae: Evidence from chloroplast ndhF and trnl-F nucleotide sequences. American Journal Botany. 88: 1830–1846p. 2002.
Diniz, J.D.N.; Almeida, J.L.; Teixeira, A.L.A.De.; Gomes, E.S.; Hernandez, F.F.F. Ácido giberélico (GA3) e 6-benzilaminopurina (BAP) no crescimento in vitro de Macela (Egletes viscosa (L.) Less.). Ciência Agrotécnica. 27(4): 934-938p. 2003.
Felicio, J. D.; Gonçalez, E.; Lins, A. L.; Braggio, M. M.; David, J. M. Triterpenos isolados das folhas de três espécies de Byrsonima. Arquivos do Instituto de Biologia. São Paulo. 62: 91-92p. 1995.
Ferreira, M.B. Frutos Comestíveis Nativos do Distrito Federal-IV. Fundação Zoobotânica do DF, Brasília- DF. 15-21 p. 1973.
Fevereiro, Manuel P.; Caetano, Helena V.; Santos, Maria G. Cadernos didáticos de Ciências. Lisboa: Ministério da Educação, DES, EEC. 1. 2001.
Fidelis, I. Micropropagação de Brosimun guadichaudii Tréc. (Mama-cadela): uma espécie considerada medicinal. Dissertação de Mestrado. Universidade Federal de Lavras. Lavras. 102 p. 1998.
Figueiredo, S.F.L.; Albarello, N.; Viana, V.R.C. Micropropagation of Rollinia mucosa (jacq.) Baill. In Vitro Cellular & Developmental Biology –Plant. 37: 471-475p. 2001.
França, S. C. Abordagens biotecnológicas para a obtenção de substâncias ativas. In: Simões, C. M. O. (Org.). Farmacognosia: da planta ao medicamento. 3a edição. Porto Alegre. 105-124p. 2001.
Frank, M.; Schumulling, T. Cytokinin cicles cells. Trendes in Plant Sciences. 4(7): 243-244p. 1999.
Gamborg, O.L.; Miller, R.A.; Ojima, K. Nutrient requirements of suspension cultures of soybean root cells. Experimental Cell Research. 50:151-158p. 1968.
Guerra, P.G.; Torres, A.C.; Teixeira, J.B. Embriogênese somática e sementes sintéticas. In: Torres, A.C.; Caldas, L.S.; Buso, I.A. (Eds.). Cultura de tecidos e transformação genética de plantas. EMBRAPA: Brasilia. 2:533-568p. 1999.
Giulietti, A. M. Byrsonima do Distrito Federal. In: III Simpósio sobre o cerrado. Cood. Mário Guimarães Ferri. EDUSP & Editora Edgar Bluches Ltda. 133-149 p. 1971.
Gusmão, E.; Vieira, F.A.; Fonseca Junior, E.M. Biometria de frutos e endocarpos de murici (Byrsonima verbascifolia Rich. ex A. Juss.). Nota Técnica/Technical Note: 12 (1): 84-91p. 2006.
Grattapaglia, D. & Machado, M. A. Micropropagação. In: Cultura de tecidos e transformação genética de plantas. EMBRAPA. Produção de Informação/ Centro Brasileiro Argentino de Biotecnologia. Brasília – DF. 2: 183-260p. 1998.
Grigoletto, E. R.; Silveira, C. E.; Caldas, L.S. Micropropagation de mangaba (Harconia speciosa Gomez). Anais do XLVII Nacional de Botânica, Nova Friburgo, RJ. 441p. 1996.
Grigoletto, E. R. Micropropagação de Harconia speciosa Gómez (mangabeira). Tese de mestrado.Universidade de Brasília. 68p. 1997.
Huettman, C.A.; Preece, J.E. Thidiazuron: a potent cytokinin for woody plant tissue culture. Plant Cell Tissue and Organ Culture. 33(2): 105-119. 1993.
Joly, A. B. Botânica - Introdução à Taxonomia Vegetal. Cia Editora Nacional. 4a ed. São Paulo. 413 p. 1977.
Lorenzi, H. Árvores brasileiras: Manual de identificação e cultivo de plantas arbóreas nativas do Brasil. Nova Odessa. 1: 386p. 2002.
Lloyd, G.; Mccown, B. Use of microculture for production and improvement of Rhododendron spp. HortScience, 15: 416p. 1980.
Mamede, M.C.H. O gênero Byrsonima Rich. ex A.L. Juss. (Malpighiaceae). Na Serra do Cipó, Minas Gerais, Brasil. Tese de Mestrado. Universidade de São Paulo, São Paulo. 1981.
Mabberley, D. J. The Plant-Book. A portable dictionary of the higher plants. Cambridge University Press. 4o ed. New York. 1993.
Martins-Corder1 & Borges Junior. Desinfestação e quebra de dormência de sementes de Acacia mearnsii de Wild. Ciência Florestal. Santa Maria, 9(2): 1-7 p. 1999.
Melo, J.T.; Silvia, J.A.; Torres, R.A.A.; Silveira, C.E.; Caldas, L.S. Coleta, Propagação e Desenvolvimento Inicial de Espécies do Cerrado, p. 195-243. In: Cerrado: Ambiente e Flora. EMBRAPA. Planaltina- DF. 556 p. 1998.
Mendonça, R.C.; Felfilli, J. M.; Walter, B. M. T.; Silva, M. C.; Rezende, A.R.; Filgueiras, T.S.; Nogueira, P.E. Flora vascular do Cerrado. In: Cerrado ambiente e flora. Brasília: EMBRAPA. Planaltina- DF. 286-556 p. 1998.
Montarroyos, A.V.V. Contaminação in vitro. ABCTP Notícias, 36 e 37:5-10p. 2000.
Mroginsky, L.A; Roca, W.M. Estabelecimento de cultivos de tejidos vegetales in vitro. Roca, W.M.; Mroginsky, L. A. Cultivo de tejidos en la agricultura. in: Fundamentos y aplicaciones. Cali: Centro Internacional de Agricultura Tropical.20- 40p. 1991.
Murashige, T. & Skoog, F.A. Revised medium for rapid growth and bioassay with tobacco tissue cultures. Physiologia Plantarum 15: 473-479. 1962.
Myers, N.; Mittermeier, C.; Mittermeier, G.; Fonseca, G.A.B; Kent, J. 2000. Biodiversity hotspots for conservation priorities. Nature. 403: 853-858.
Pasqual, M.; Hoffmann, A.; Ramos, J.D. Cultura de tecidos vegetais: tecnologia e aplicações; introdução; fundamentos básicos. UFLA/FAEPE. Lavras. 159p.1998. Pasqual, M. & Barros, I. Efeitos do ácido naftalenoacético e 6-benzioaminopurina sobre a
proliferação de brotos in vitro em barbatimão (Stryphnodendron adstringens (Mart.) Coville). Pesquisa agropecuária Brasileira. Brasília. 27(7): 1017-1019p. 1992.
Pereira, K.B.D. Micropropagação e Estudo Morfo-Anatômico do Endocarpo, Semente e Plântula de Byrsonima basiloba Juss. Tese de Mestrado. Universidade de Brasília, UnB. Brasília, DF. 2002.
Pereira, C. D.; Melo, B. Cultura de tecidos vegetais. Uberlândia- UFU/ICIAG. In: Floriano, E. P. 2004. Produção de mudas florestais via assexuada. Caderno Didático. n° 3. 1a edição. 37p. 2004.
Pinto, J. E. B. P. & Bertolucci, S. K. V. Textos acadêmicos: cultivo e processamento de plantas medicinais. Lavras: FAEPE/UFLA. 169 p. 2001.
Proença, C.; Oliveira, R. S. & Silva, A. P. Flores e frutos do cerrado. Ed. UnB, Brasília.
2000.
Pozo, J.C.D.; Lopez-Matas, M.A.; Ramirez-Parra, E.; Gutierrez, C. Hormonal control of the plant cell cycle. Biologia Plantarum, 123:173-183p. 2005.
Ratter, J.A.; Ribeiro, J.F.; Bridgewater, S. 1997. The Brazilian cerrado vegetation and threats to its biodiversity. Annals of Botany. 80: 223-230.
Rodrigues, A.C.; Silveira, C.A.P.; Forets, G.R.L.De.; Fachinello, J.C.; Silva, J.B.da. Estabelecimento e multiplicação in vitro de Prunus sp., em diferentes meios de cultivo. Revista Brasileira de Fruticultura, 25 (1): 131-133p. 2003.
Rout, G.R.; Samantaray, S.; Das, P. In vitro manipulation and propagatino of medicinal plants. Biotechnology Advances, 18: 91-120p. 2000.
Santana, J. G. Caracterização de ambientes de cerrado com alta densidade de pequizeiros (Caryocar brasiliense Camb.) na região sudeste do Estado de Goiás. Tese de Mestrado. Universidade Federal de Goiás, Goiânia, 100p. 2002.
Santos, B.R.; Paiva, R.; Nogueira, R.C.; Lenaldo, M.O.; Silva, D.P.C.; Martinotto.; Soares, F.P.; Paiva, P.D.O. Micropropagação de pequizeiro (Caryocar brasiliense Camb.). Revista Brasileira de Fruticultura- Jaboticabal. 28(2): 293-296. 2006.
Sato, A.Y., Dias, H.C.T., Andrade, L.A. De; Souza, V.C. Micropropagação de Celtis sp: Controle da contaminação e oxidação. CERNE. 7 (2): 117-123p. 2001.
Schenkel, E.P.; Gosmann, G.; Athayde, M.L. Saponinas. In: Simões, C.M.O.; Schenkel, E.P.; Gosmann, G.; Mello, J.C.P.De; Petrovick, P.R. Farmacognosia: da planta ao medicamento. Florianópolis: Ed. Universidade/UFRGS. 597-622p. 2000.
Silva, S. & Tassara, H. frutas no Brasil. Empresa das Artes. São Paulo. 204-206p. 1996. Silveira, C.E. Bouturage et microbouturage du Fraxinus excelsior L.: aspects
morphogenetiques et cytophysiologiques. Tese de doutorado em morfo-anatomia e fisiologia vegetal na Universidade Pierre et Marie Curie, Curie. Paris VI. Paris. 301p. 1994.
Silveira, C.E. & Cottignies, A. Period of harvest, sprouting ability of cutting, and in vitro plant regeneration in Fraxinus excelsior. Canadian Journal of Botany. 72: 261-267p. 1994.
Simão, S. Tratado de fruticultura. Piracicaba: FESALQ. 760 p. 1998.
Souza, A.V.; Pinto, J.E.B.P.; Bertolucci, S.K.V.; Corrêa, R.M.; Castro, E.M de. 2003. Germinação de embriões e multiplicação In vitro de Lychnophora pinaster Mart. Ciênc. Agrotec. Lavras. Edição Especial. 1532-1538p.
Tisserat, B. Embryogenesis, organogenesis and plant regeneration. In: DIXON, R. A.(ed.) Plant Cell Culture. Oxford. 79-106p. 1991.
Torres, A.C.; Barbosa, N.V. Dos R.; Willadino, L.; Guerra, M.P.; Ferreira, C.F.; Paiva, S.A.V. de. Meio e condições de incubação para a cultura de tecidos de plantas. Brasília. Circular Técnica. 24: 20p. 2001.
Torres, A.C.; Caldas, L.S.; Buso, J.A. Cultura de tecidos e transformação genética de plantas. EMBRAPA Produção de Informação/ Centro Brasileiro Argentino de Biotecnologia. Brasília. 2: 183-260 p. 1998.
Thorpe, T.A. In vitro embryogenesis in plants. Dordrecht: Kluwer Academic Publishers. Current Plant Science and Biotechnology in Agriculture. 558p. 1995.
Van Winkle, S., Johnson, S.; Pullman, G.S. The impact of gelrite and activated carbon on the elemental composition of plant tissue culture media. Plant Cell Reports. New York. 21: 1175-1182p. 2003.
Vieira, R. F.; Martins, V. M. Recursos genéticos de plantas medicinais do cerrado: uma compilação de dados. Revista Brasileira de Plantas Medicinais. 3(1): 13-36. 2000. Zaidan, L.B.P.; Figueiredo-Ribeiro, R.C.L. 1995. Aproveitamento econômico de espécies
CAPÍTULO I
RESUMO
O murici (B. basiloba) é um arbusto do Cerrado, cujos frutos são bastante apreciados, sendo consumidos in natura ou processados artesanalmente. Esta planta apresenta dificuldades de propagação sexuada. O objetivo do presente trabalho foi otimizar um protocolo de micropropagação para esta espécie, através de gemas apicais e adventícias obtidas de plântulas germinadas in vitro. Sementes de B. basiloba foram esterilizadas e germinadas em água e ágar. Gemas apicais e axilares adjacentes foram utilizadas na multiplicação em cinco subculturas. Para multiplicação foi utilizado meio MS e ½ MS, suplementado com BAP (6-benzilaminopurina) ou combinado com AIB (ácido indol-3-butírico) e cinetina, acrescido de 20 g.L-1 de sacarose, 0,1 g.L-1 de inositol e 7 g.L-1 de ágar. Testou-se também a influência de carvão ativado. Não houve diferença entre o meio MS pleno e o diluído. A combinação BAP, AIB e CIN produziu maior quantidades de brotos, nas concentrações 0,5, 1,0 e 0,2 mg.L-1 respectivamente. Para aumentar a eficiência na produção de brotos utilizando carvão ativado adicionado ao meio, é necessário aumentar as concentrações hormonais, caso contrário o meio promove apenas o alongamento dos brotos. O uso do carvão ativado foi essencial antes da etapa de enraizamento. Utilizou-se a mistura de talco neutro e AIB na base dos brotos, para o enraizamento ex vitro, que resultou em 47% dos brotos enraizados e aclimatados.
Palavras chaves:
Murici, Cerrado, micropropagação, multiplicação, enraizamento. Abreviações:
ABSTRACT
The murici (B. basiloba) is a shrubby plant of the Cerrado biome, and its fruits are consumed fresh or as homemade sweeties. This species is difficult to be propagated by sexual reproduction. Therefore, the purpose of this work is to optimize a micropropagation protocol for this plant species using as explants the apical and adventitious buds taken from in vitro germinated seeds. Seeds of B. basiloba were sterilized and germinated in agar water medium. The apical and the adjacent buds were micropropagated in five subsequent multiplication subcultures. The multiplication medium was either MS or ½ MS, supplemented with 6-benzylaminopurine (BAP) alone or in combination with indole-3-butyric acid (IBA) or kinetin (KIN) plus 20 g.L-1 of sucrose, 0.1 g.L-1 myo-inositol, 7.0 g.L-1 of agar. Furthermore, the influence of activated charcoal was tested during explant multiplication and elongation. There were no significant differences between the two media tested (MS and ½ MS) in the explant multiplication rate. The combination of 0.5 mg.L-1 BAP, 1.0 mg.L-1 IBA, and 0.2 mg.L-1 KIN was the most effective in inducing sprouting. The activated charcoal was essential to elongate the explants before rooting. Nonetheless, to keep a high rate of multiplication after the addition of activated charcoal in the medium it was necessary to increase the concentration of the hormones. Rooting was induced ex vitro with a mixture of talcum powder and IBA at the basal region of the sprout, and 47% of the explants were rooted and acclimatized.
Key words:
Murici, Cerrado, micropropagation, multiplication, rooting. Abbreviations:
1. INTRODUÇÃO
O gênero Byrsonima é composto por cerca de 150 espécies (Mamede, 1981), sendo 60 nativas do Brasil. No Cerrado ocorrem 38 espécies e especificamente no Distrito Federal há registro de 10 espécies (Giulietti, 1971; Mendonça, 1998). Popularmente são conhecidas como murici, morici, mureci ou moreci, em suas regiões de ocorrência (Corrêa, 1984).
Os frutos das espécies de Byrsonima possuem diversas características semelhantes como forma, diâmetro e coloração. De acordo com Ferreira (1973), dentre as espécies desse gênero encontradas no Cerrado do Distrito Federal, apenas três despertam interesse econômico em função do tamanho de seus frutos: B. basiloba Juss, B. crassa Niedenzu e B. verbascifolia (L.) Rich. ex Juss., cujos frutos têm diâmetros entre 1 e 2 cm. Entretanto, segundo Pereira (2002) os frutos de B. basiloba são de dimensões maiores, o que aumenta o interesse por esta espécie.
Os frutos são bastante apreciados, sendo consumidos in natura ou processado artesanalmente na forma de refresco, sorvetes, licores, pudins e geléias (Barbosa et al. 1979; Almeida et al. 1998). No comércio, também já é possível encontrar a polpa de murici (Silva & Borges, 1979), que na verdade é uma mistura de polpas de várias espécies do gênero. Isso ocorre em função da dificuldade de colher frutos de uma mesma espécie, uma vez que esses são coletados em áreas de vegetação nativa, onde a densidade das espécies é baixa e irregular (Azanha, comunicação pessoal 2008).
germinabilidade desta espécie em condições naturais é baixa e isso se deve provavelmente à redução da fauna que se alimenta dos frutos que propicia a escarificação do endocarpo extremamente rígido, constituído de esclerênquima (Pereira, 2002). Estes fatos evidenciam a importância de estabelecer meios de propagação eficientes para está espécie.
2. MATERIAL E MÉTODOS
2.1 Coleta e preparo do material vegetal
Frutos maduros foram coletados de matrizes previamente selecionadas nos meses de setembro e outubro dos anos de 2006 e 2007, de acordo com o período de maturação e disponibilidade dos mesmos. As coletas foram realizadas em áreas de Cerrado localizadas no Centro Olímpico da Universidade de Brasília (UnB), Parque Olhos D’água e no final da via L3 Norte, todos situados na cidade de Brasília, Distrito Federal. Exemplares da espécie utilizada neste estudo foram depositados no Herbário na Universidade de Brasília (UB) com registro 76712.
Após a coleta, todos os frutos foram transportados para o Laboratório de Anatomia Vegetal, localizado no Departamento de Botânica da Universidade de Brasília, onde foram lavados em água corrente e detergente comercial, com auxílio de uma esponja. Posteriormente, foram retirados e descartados o exocarpo e mesocarpo carnoso. Os pirênios foram lavados em água corrente, com uma escova de cerdas duras e detergente líquido com ação fungicida. Subseqüentemente, os pirênios foram quebrados com auxílio de um torno de bancada e as sementes liberadas com auxílio de uma pinça de ponta fina.
A partir desta etapa, todas as manipulações foram realizadas no Laboratório de Fisiologia Vegetal, em condições assépticas em câmara de fluxo laminar horizontal.
2.2 Cultura de Tecidos.
Em todas as etapas as manipulações foram realizadas em condições assépticas em câmara de fluxo laminar. Todos os instrumentos utilizados (pinças, cabos de bisturis, placas de petri) foram previamente esterilizados em forno Pasteur a 150 ºC, durante 24 horas.
2.2.1 Desinfestação com hipoclorito de sódio e germinação
Para a desinfestação, as sementes foram imersas em álcool etílico 70% durante 1 minuto e imersas em solução de hipoclorito de sódio (2% de cloro ativo) por 15, 20, 30 e 40 minutos. Após aplicação dos tratamentos, as sementes foram lavadas três vezes por um minuto cada em água destilada e autoclavada e foram inoculadas em tubos de ensaio 150 x 25 mm contendo meio de germinação composto de água e ágar 7%.
Os tubos contendo o meio de germinação foram inoculados com sementes de cada um dos tratamentos de desinfestação e fechados com tampas plásticas, vedados com filme de PVC (película de polivinilcloreto) e mantidos em sala de crescimento com lâmpadas fluorescentes (luz do dia) com irradiância de 41 µmoles. m-2. s-1, fotoperíodo de 16 horas, temperatura de 25 ± 2 ºC e umidade relativa de 80%, até o desenvolvimento das plântulas. Estas condições de cultivo foram utilizadas em todas as etapas. Para cada tratamento, foram realizadas três repetições, cada qual constituída por 10 sementes, totalizando 30 sementes por tratamento. A avaliação do número de sementes descontaminadas e germinadas foi realizada no 30º dia de cultivo.
2.2.2 Desinfestação com fungicida Carbendazim e germinação
vezes por um minuto cada em água destilada e autoclavada. As sementes foram inoculadas, cultivadas e avaliadas como descrito anteriormente.
2.2.3 Multiplicação
2.2.3.1 Multiplicação e alongamento de brotos nos subcultivos
Das plântulas com aproximadamente 30 mm de comprimento de parte aérea, obtidas na fase anterior foram utilizadas para a retirada dos explantes para multiplicação. Os explantes constituíram da parte aérea que compreendia o nó cotiledonar, gema apical, gemas axilares subjacentes e a parte basal das folhas cotiledonares. Para a multiplicação, testou-se meio de cultura MS (Murashige & Skoog ,1962), e MS com as concentrações de sais diluídas a metade (½ MS), como descrito para a espécie Byrsonima basiloba, por Pereira (2002). Acrescentou-se 20 g.L-1 de sacarose ao meio, gelificado com ágar a 7 g.L-1 e pH 5,7. O meio foi suplementado com reguladores de crescimento nas seguintes concentrações: 0,5 mg.L-1 de BAP (6-benzilaminopurina), 1,0 mg.L-1 AIB (Ácido indol-3-butírico), e 0,2 mg.L-1 de CIN (6-furfurilaminopurina).
A avaliação do material foi realizada 30 dias após cada repicagem, considerando em cada subcultura os seguintes parâmetros:
a) Efeito sobre o número de brotos por explante e subcultivo; b) Efeito sobre o comprimento médio dos brotos;
2.2.3.2 Efeito das concentrações de sais, hormônios e carvão ativado na multiplicação e alongamento
Para avaliar o efeito das concentrações de reguladores de crescimento, sais do meio MS e presença de carvão ativado realizou-se este experimento com brotos obtidos da segunda subcultura. Os brotos foram submetidos a quatro tratamentos para avaliar a multiplicação e o alongamento. Os tratamentos com diferentes concentrações hormonais, sais do meio MS e carvão ativado estão especificados na tabela 2. O tratamento inicial utilizado na multiplicação foi mantido para efeito de comparação com os novos e para verificar sua efetividade nas novas condições de cultivo.
A avaliação do material foi realizada no 30º dia após a inoculação nestes tratamentos. Foram considerados em todos os tratamentos os seguintes parâmetros: número de brotações por explante, comprimento e aspecto morfológico dos brotos.
Tabela 1. Concentrações de sais do meio MS, de hormônios e presença de carvão ativado nos tratamentos do segundo experimento de multiplicação de brotos de Byrsonima basiloba Juss.
Tratamentos Concentração de sais mg.LBAP -1 mg.LAIB -1 mg.LCIN -1 ativado mg.LCarvão -1
2.2.4 Alongamento
O alongamento foi feito após o 5o subcultivo. Os brotos foram transferidos para meio ½ MS suplementado com 1,0 mg.L-1 de BAP, 0,5 mg.L-1 de AIB e 0,2 mg.L-1 de CIN e 8 mg.L-1 carvão ativado.
Os brotos ficaram neste meio até que alcançassem aproximadamente 3,0 cm de altura para serem transferidos para a fase de enraizamento.
2.2.5 Enraizamento e aclimatação
Para o enraizamento, os brotos foram colocados em copos plásticos de 300 mL perfurados, contendo vermiculita autoclavada e umedecida com água bidestilada e autoclavada. Antes do plantio, a base dos brotos com aproximadamente 2 mm foi tratada com uma mistura de AIB 1000 ppm e talco neutro com fungicida. Essa mistura foi preparada com 0,1 g de AIB, 0,1 g de Benlate® (Benomyl) e 100 g de talco neutro. Para homogeneizar a mistura, foi adicionado álcool comercial, de maneira a formar uma pasta. A pasta foi deixada à temperatura ambiente até total evaporação do álcool e da água, voltando ao estado de pó. O controle foi realizado tratando a outra metade dos brotos com a mesma mistura sem a adição de AIB.
Após o plantio, os copos plásticos foram cobertos com pequenos sacos plásticos transparentes individuais e fixados com uma liga de elástico, a fim de evitar a desidratação dos brotos.
contendo substrato composto de terra vegetal e vermiculita em partes iguais e umidecidos com água corrente de torneira.
A avaliação do material foi realizada no 30º dia, considerando número de plantas com raízes adventícias e aclimatizadas.
2.3. Análise estatística
3. RESULTADOS
3.1. Influência do tempo de imersão em hipoclorito de sódio sobre a desinfestação e germinação
Com relação à variável desinfestação, os tempos que proporcionaram maiores porcentagens de sementes desinfestadas (80% e 87%) foram respectivamente 30 e 40 minutos de imersão em hipoclorito de sódio (Figura 1). Os tempos que apresentaram maiores porcentagens de desinfestação, também resultaram em menor taxa de germinação. A análise estatística apontou diferença significativa apenas entre o tempo de 15 minutos de desinfestação em relação ao de 30 e 40 minutos com p 0,02 e p 0,01, respectivamente.
Figura 1. Germinação e desinfestação de sementes de Byrsonima basiloba em função do tempo de imersão em hipoclorito de sódio. As médias são expressas em porcentagens. Médias seguidas pela mesma letra não diferem significativamente pelo teste Tukey (p 0,05).
resultado, com uma média de sementes germinadas superior a 60% (Figura 1). Tempos maiores que 20 minutos de imersão resultaram em decréscimo da taxa de germinação.
3.2. Influência do tempo de imersão em fungicida Carbendazim na desinfestação e germinação de sementes
Como a contaminação por fungo foi o principal problema no processo de desinfestação, testou-se a efetividade da adição de um fungicida. A presença de fungicida melhorou a eficiência da desinfestação/germinação. No tratamento de 20 minutos de imersão na solução desinfestante foi alcançado em torno de 80% de desinfestação e germinação (Figura 2). Nos tratamentos com tempos superiores a 20 minutos, foi alcançada maior eficiência na desinfestação, contudo a viabilidade das sementes foi sensivelmente comprometida (Figura 2).
3.3. Germinação e desenvolvimento das plântulas
A germinação das sementes de Byrsonima basiloba inicia após o 4º dia de inoculação, e no 20º dia o número de sementes germinadas é elevado. O desenvolvimento das plântulas (Figura 3 A-D) foi considerado lento, com as primeiras folhas (eofilos) surgindo cerca de 60 dias após a inoculação (Figura 3A). Em todas as sementes germinadas, somente depois dos cotilédones terem se expandido e se tornado verdes é que as primeiras raízes surgiram.
Algumas plântulas com os cotilédones totalmente desenvolvidos após 60º dia de cultivo produziram calos na face adaxial das folhas cotiledonares. Esses calos surgiram como manchas brancas na superfície adaxial (Figura 3 B) e se multiplicavam (Figura 3 C).
3.4. Multiplicação
3.4.1 Efeito do número de subcultivos
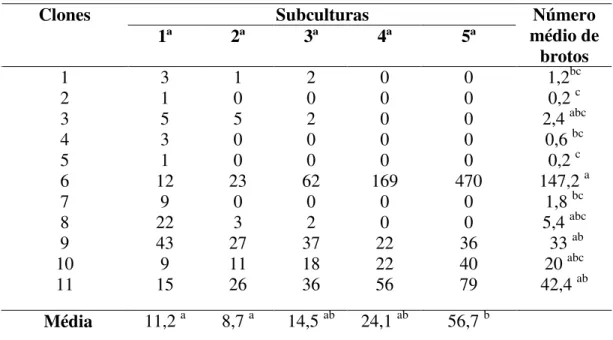
A tabela 3 mostra o número de brotos produzidos pelos diferentes clones testados ao final das subculturas. Embora não tenha sido observada diferença significativa entre o número de brotos dos clones na 1a e 2a subculturas, verificou-se uma tendência de diminuição dos brotos produzidos na 2a subcultura na maioria dos clones testados com exceção dos clones 6 e 11. Esta diminuição ocorreu pela morte dos brotos dos clones 2, 4, 5 e 7 durante a segunda subcultura. Já na 3ª subcultura observou-se o aumento do número de brotos produzidos nos clones, exceto o clone 3. Na 5ª subcultura, do total de 11 clones iniciais, restaram apenas quatro produzindo brotos. Embora o número de brotos na 5a subcultura tenha sido superior às demais, a análise estatística apontou diferenças significativas apenas desta em relação às duas primeiras subculturas realizadas neste experimento. Foi possível observar também que, com as sucessivas subculturas a média de brotos produzidos do clone 6 foi significativamente superior aos clones 2, 4, 5 e 7, pode-se notar uma diferença numérica expressiva.
Tabela 2. Número médio de brotos produzidos por clone em cinco subculturas realizadas sob efeito do tratamento ½ MS + 1,0 mg.L-1 AIB + 0,5 mg.L-1 de BAP + 0,2 mg.L-1 de CIN.
Subculturas Clones
1ª 2ª 3ª 4ª 5ª médio de Número
brotos 1 2 3 4 5 6 7 8 9 10 11 3 1 5 3 1 12 9 22 43 9 15 1 0 5 0 0 23 0 3 27 11 26 2 0 2 0 0 62 0 2 37 18 36 0 0 0 0 0 169 0 0 22 22 56 0 0 0 0 0 470 0 0 36 40 79 1,2bc 0,2 c 2,4 abc
0,6 bc 0,2 c 147,2 a
1,8 bc 5,4 abc
33 ab 20 abc 42,4 ab Média 11,2 a 8,7 a 14,5 ab 24,1 ab 56,7 b
A Figura 4 ilustra o aspecto morfológico dos brotos nas duas primeiras subculturas. Em parte dos brotos produzidos nas duas primeiras subculturas, as folhas adquiriram coloração amarelada e posteriormente os brotos necrosaram. Notou-se que alguns brotos que apresentavam folhas com coloração amarelada após serem transferidos para a terceira subcultura foram capazes de recuperar e adquirir aspecto saudável demonstrado pela coloração verde escuro das folhas (Figura 5A).
Figura 4. Aspecto dos brotos de Byrsonima basiloba no primeiroe segundosubcultivos com 30 dias de cultivo. A) Explante com brotações desenvolvendo normalmente. B) Explante sem desenvolvimento aparente e com folhas amarelas. C) Explante com folhas amarelas. Barras = 1,0 cm.
A tabela 3 agrupa os resultados observados no comprimento (altura) médio dos brotos nas cinco subculturas realizadas. Mesmo não existindo diferença significativa entre as cinco subculturas, observou-se que, o comprimento médio dos brotos na 2a, 3a e 4a se manteve por volta de 0.32 a 0.39 cm. Já a 5a subcultura foi a que apresentou melhores resultados, tanto em relação ao comprimento médio dos brotos, quanto ao número de brotos produzidos como já citado.
Tabela 3. Efeito do subcultivo sobre comprimento médio de brotos produzidos em meio ½MS suplementado com 1,0 mg.L-1 de AIB, 0,5 mg.L-1 de BAP e 0,2 mg.L-1 de CIN.
Subcultura Número de brotos Comprimento médio dos brotos
1a 2a 3a 4a 5a 123 96 159 269 625
0,17 a 0,32a 0,39a 0,37a 0,60a
Médias seguidas pela mesma letra não diferem entre si pelo teste Tukey (p< 0,05).
3.4.2 Efeito da concentração de sais do meio MS, hormônios e carvão ativado na multiplicação e alongamento de brotos.
A tabela 4 permite observar que, o maior número de brotos produzidos ocorreu no tratamento 1, o qual foi estatisticamente diferente dos outros tratamentos. Ressalta-se ainda que o tratamento 1 foi o mesmo utilizado no experimento anterior de multiplicação, o que confirma a eficiência do mesmo no desenvolvimento das gemas axilares. Já o tratamento 2 contendo menores concentrações de reguladores de crescimento, apesar de não apresentar diferença estatística em relação aos demais tratamentos, foi o que permitiu maior alongamento dos brotos. Embora o tratamento 3 tenha sido eficiente com relação ao alongamento dos brotos, este continha grande quantidade de BAP (10 mg.L-1), aumentando o custo da produção de plantas em larga escala e ainda, mesmo que o carvão ativado esteja agindo como um quelante, a grande quantidade de BAP poderia interferir no processo de enraizamento.
Além disso, as combinações hormonais neste experimento resultaram numa visível melhora do aspecto morfológico dos brotos provenientes da segunda subcultura (Figura 6). A presença de carvão ativado nos tratamentos não resultou necessariamente em maior quantidade de brotos, porém, notou-se maior alongamento (Tabela 4) e vigor dos brotos demonstrado pela coloração das folhas (Figura 6 B-D).
Tabela 4. Número e comprimento médio de brotos de Byrsonima basiloba, em função de diferentes concentrações hormonais, sais do meio MS e presença de carvão ativado.
Hormônios mg.L-1 Tratamentos Concentração
de sais
AIB BAP CIN
Carvão ativado mg.L-1 Número médio de brotos Comprimento médio dos
3.5 Alongamento
O alongamento foi realizado em meio contendo ½ MS, 1,0 mg.L-1 AIB, 0,2 mg.L-1 CIN e 8,0 mg.L-1 de carvão ativado. Observou-se que ao colocar vários brotos no mesmo frasco para alongar, geralmente um alongava mais, como pode ser notado na figura 7A. Quando se isolavam os brotos e os colocavam no meio de alongamento, formavam um calo cicatricial na inserção dos brotos adjacentes que foram retirados. Esse calo formado pode ter exercido influência na etapa de enraizamento.
Figura 7. Brotos de Byrsonima basiloba em meio de alongamento. A) Brotos apresentando um mais desenvolvido. B) Brotos após 30 dias em meio de alongamento.
O enraizamento foi obtido 45 dias após a transferência para condição ex vitro e tratamento com talco e AIB. A Figura 8 A-D, ilustra desde a base do broto tratada com talco mais AIB até o broto com 2 raízes adventícias. Aos 20 dias nesta condição, observou-se que somente os brotos contendo calo na base, formado pela retirada dos brotos adjacentes conseguiram diferenciar raízes adventícias. Aqueles transferidos sem vestígio de calo não foram capazes de enraizar necrosando após 25 dias. A maior porcentagem de plantas que enraizaram e sobreviveram foram aquelas retiradas da condição in vitro com mais de 2 centímetros de altura. Estas sobreviveram, mesmo sem raízes, até 30 dias em condição ex vitro.
4. DISCUSSÃO
4.1 Desinfestação e germinação de Byrsonima basiloba.
A micropropagação é uma alternativa viável de propagação de muitas espécies do Cerrado que se encontram em risco de extinção (Santana 2002). É uma ferramenta promissora para a preservação, pois facilita a propagação das espécies ameaçadas (Pletsch, 2003; Kane et al., 2000). Na micropropagação, é de extrema importância o estabelecimento de um protocolo de desinfestação eficiente, que reduza significativamente a porcentagem de contaminação das sementes in vitro para dar continuidade ao processo de propagação. Para isso, várias substâncias com ação germicida têm sido utilizadas, sendo as mais comuns, o etanol e os compostos a base de cloro, como o hipoclorito de sódio (Grattapaglia & Machado, 1998; Hartmann et al., 1990).
A combinação de etanol e hipoclorito de sódio ou cálcio normalmente permite o controle adequado das bactérias e dos fungos saprofíticos que infestam a superfície dos órgão vegetais (Bucher 2002). O tempo de tratamento e a concentração da substância desinfestante são fatores essenciais nesta etapa (Melo, 1998). Melo et al. (1998) citam que as sementes são geralmente explantes menos contaminados do que ramos coletados no campo, e ao mesmo tempo resistem melhor ao tratamento de desinfestação. No presente trabalho a combinação de etanol, hipoclorito de sódio e fungicida foram testadas em diferentes tempos de imersão para se obter sementes de Byrsonima basiloba desinfestadas. O melhor resultado foi obtido com a utilização de fungicida.