Agradecimentos
Em primeiro lugar, quero agradecer às minhas orientadoras, Professora Doutora Amarilis de Varennes e Professora Doutora Maribela Pestana Correia, pela orientação, disponibilidade, apoio e incentivo que me deram no decorrer desta tese.
À Teresa Saavedra, por todo tempo, conselhos e paciência, em particular durante a fase experimental do meu trabalho.
À Paula Gonçalves, pelo apoio e tempo dispensado para realizar as análises laboratoriais necessárias para completar o meu trabalho.
À minha mãe, por fazer todos os possíveis pelo meu sucesso pessoal e académico e por todos os trabalhos vistos e revistos ao longo da minha carreira universitária, em especial este.
Ao meu pai, por sempre ter incentivado e apoiado todas as minhas escolhas, especialmente a de seguir agronomia.
À Avó Ni que esteve sempre disponível com uma palavra otimista e permitiu que a minha experiência de estudar em Lisboa tenha sido ainda melhor.
Às minhas irmãs, por todas as vezes que me ajudaram e ouviram e onde me posso sempre apoiar.
A toda a minha família e amigos, em especial à Maria, à Matilde, à Matilde, à Inês, à Joana, à Carminho e à Carocha, que estão sempre disponíveis e me permitem ser quem sou hoje. A todos aqueles que aqui não foram mencionados, mas que de alguma forma contribuíram para a minha formação e realização pessoal, académica e profissional, muito obrigada!
Índice
Lista de quadros, figuras e abreviaturas ...5
Resumo ...8 Abstract ...8 1. Introdução ...10 2. Morangueiro ...11 2.1. Caraterísticas e biologia ...11 2.2. Sistemas de produção ...13
2.3. Interesse da cultura em Portugal ...14
3. O Fe na planta ...17
3.1. Absorção e transporte ...18
3.2. Toxicidade - Efeitos fisiológicos e morfológicos ...19
3.3. Armazenamento de Fe ...21 3.4. Funções na planta ...22 4. Material e Métodos ...24 4.1. Delineamento experimental ...24 4.2. Meio de cultura ...24 4.3. Instalação da experiência ...25
4.4. Monitorização da solução nutritiva ...27
4.5. Parâmetros de biomassa...27 4.6. SPAD...28 4.7. Atividade da QF-R ...28 4.8. Quantificação de micronutrientes ...29 4.9. Análise estatística ...30 5. Resultados e discussão ...31
5.1. Monitorização da solução nutritiva ...31
5.2. Fase 1 ...32 5.2.1 Parâmetros de biomassa ...32 5.2.2. SPAD ...35 5.2.3. Atividade da QF-R ...37 5.3. Fase 2 ...39 5.3.1. Parâmetros de biomassa ...39 5.3.2 SPAD ...42
5.3.3 Atividade da QF-R ...44
5.4. Quantificação de micronutrientes ...46
6. Conclusões e perspetivas futuras ...53
Anexo 1 ...54
Anexo 2 ...55
Lista de quadros, figuras e abreviaturas
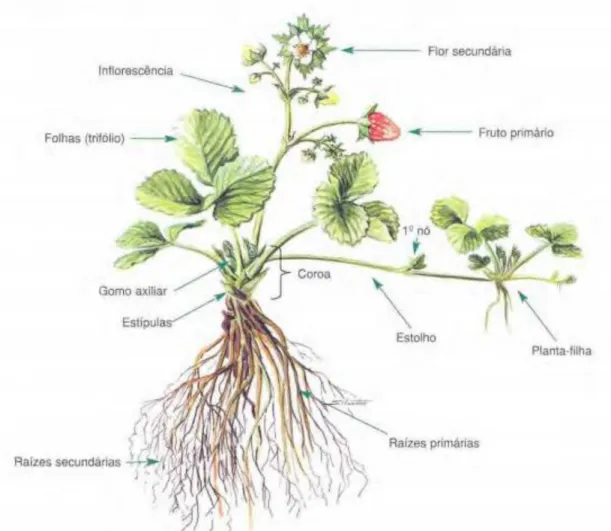
Figura 1 Representação esquemática de uma planta adulta de morangueiro (Palha et al.,
2005). ...12
Figura 2 Modelo da estratégia I para absorção de ferro, utilizada pelas plantas não pertencentes à família Poacea. R= quelato de ferro redutase; Tr=transportador do Fe(II). (Modified from Marschner et al., 1986; Romheld,1987 em Marschner & Römheld, 1994) ...18
Figura 3 Sintomas de excesso de Fe em arroz. (IRRI) ...19
Figura 4 Representação esquemática tridimensional da ferritina, a proteína responsável pelo armazenamento de ferro (Casiday & Frey, 2000) ...22
Figura 5 Calendarização do desenvolvimento metodológico ...24
Figura 6 Representação esquemática da disposição das caixas na estufa, cada cor representa uma concentração diferente de Fe adicionada ao meio de cultura. ...26
Figura 7 SPAD-502, aparelho de medição de SPAD ...28
Figura 8 Preparação das amostras para a quantificação de nutrientes ...29
Figura 9 Início do ensaio - 24 de janeiro de 2017 ...31
Figura 10 Comparação do ensaio entre os dias 1 e 11 de fevereiro de 2017 ...32
Figura 11 Amostras de plantas de cada tratamento da fase 1, em laboratório, antes da destruição das amostras para medição dos parâmetros de biomassa. ...35
Figura 12 Na fase 2, de cada tratamento 3 plantas foram introduzidas numa solução com 400 μM de Fe. à esquerda, as que antes estavam em Fe0, Fe10 e Fe50 e, à direita, as que na fase 1, estavam em Fe100, Fe150 e Fe200. ...39
Figura 13 Planta do tratamento Fe0 ...55
Figura 14 Planta do tratamento Fe10 ...55
Figura 16 Planta do tratamento Fe50 ...55
Figura 15 Planta do tratamento Fe100 ...55
Figura 17 Planta do tratamento Fe150 ...55
Figura 18 Planta do tratamento Fe200 ...55
Gráfico 1 Representação gráfica dos 10 países com maior produção de morangos no mundo. ...14
Gráfico 2 Produção de morango em Portugal desde 1994 até 2015...15
Gráfico 3 Produtividade da cultura de morangueiro no Mundo, na Europa e em Portugal. ...15
Gráfico 4 Evolução dos valores de CE, pH e T ao longo do período experimental ...32
Gráfico 5 Evolução da concentração de clorofila nas folhas novas em cada tratamento, ao longo da fase 1 do período experimental ...36
Gráfico 6 Evolução da concentração de clorofila nas folhas velhas em cada tratamento, ao longo da fase 1 do período experimental ...36
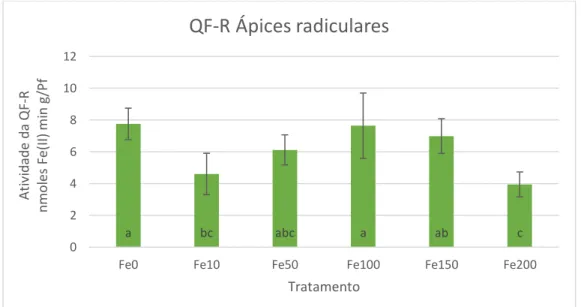
Gráfico 7 Atividade da enzima QF-R medida nos ápices radiculares...37
Gráfico 8 Atividade da enzima QF-R medida nas folhas novas ...37
Gráfico 9 Atividade da enzima QF-R medida nas folhas velhas ...38
Gráfico 10 Evolução da concentração de clorofila nas folhas novas em cada tratamento, ao longo da fase 2 do período experimental ... Erro! Marcador não definido. Gráfico 11 Evolução da concentração de clorofila nas folhas velhas em cada tratamento, ao longo da fase 2 do período experimental ...43
Gráfico 12 Atividade da enzima QF-R medida nos ápices radiculares ...44
Gráfico 13 Atividade da enzima QF-R medida nas folhas novas ...45
Gráfico 14 Atividade da enzima QF-R medida nas folhas velhas...45
Gráfico 15 Relação encontrada entre o tratamento e a razão entre a concentração de Cu nas raízes e o peso seco das raízes (PS1 – na fase 1; PS2 – na fase 2)...48
Gráfico 16 Relação encontrada entre o tratamento e a razão entre a concentração de Zn nas raízes e o peso seco das raízes (PS1 – na fase 1; PS2 – na fase 2)...48 Gráfico 17 Relação encontrada entre o tratamento e a razão entre a concentração de Mn nas raízes e o peso seco das raízes (PS1 – na fase 1; PS2 – na fase 2)...49 Gráfico 18 Relação encontrada entre o tratamento e a razão entre a concentração de Fe nas raízes e o peso seco das raízes (PS1 – na fase 1; PS2 – na fase 2)...49 Gráfico 19 Relação entre o tratamento e a razão entre a concentração de Fe nas folhas novas e o peso seco das folhas novas (PS1 – na fase 1; PS2 – na fase 2). ...50 Gráfico 20 Relação entre o tratamento e a razão entre a concentração de Zn nas folhas novas e o peso seco das folhas novas (PS1 – na fase 1; PS2 – na fase 2). ...51 Gráfico 21 Relação entre o tratamento e a razão entre a concentração de Mn nas folhas novas e o peso seco das folhas novas (PS1 – na fase 1; PS2 – na fase 2). ...51 Gráfico 22 Relação entre o tratamento e a razão entre a concentração de Fe nas folhas novas e o peso seco das folhas novas (PS1 – na fase 1; PS2 – na fase 2). ...52 Gráfico 23 Resultados do teste à CE e pH para as diferentes concentrações de Fe que viriam a ser adicionadas ao meio de cultura ...54
Tabela 1 Distribuição da produção de pequenos frutos ao longo do ano, em Portugal (GPP, 2016). ...16 Tabela 2 Produção e oferta de morango nas principais regiões produtoras em Portugal (GPP, 2014). ...16 Tabela 3. Macro e micronutrientes presentes na solução nutritiva de Hoagland, utilizada como meio de cultura. Foram preparadas soluções stock, que eram misturadas em caixas de 20 L para preparar o meio de cultura ...25 Tabela 4 Parâmetros de biomassa medidos no dia da instalação da cultura - T00. ...31 Tabela 5 Média, desvio padrão da média e significância relativo aos parâmetros de biomassa avaliados em relação à raiz: volume radicular, peso seco (PS) e peso fresco (PF) ...33 Tabela 6 Média, desvio padrão da média e significância relativo aos parâmetros de biomassa avaliados em relação à coroa: diâmetro da coroa, peso seco (PS) e peso fresco (PF). ...33 Tabela 7 Média, desvio padrão da média e significância relativo aos parâmetros de biomassa avaliados em relação às folhas novas e às folhas velhas: peso seco (PS) e peso fresco (PF) .34 Tabela 8 Valores médios de biomassa parcial (parte radicular e parte aérea) e total (peso total) dos morangueiros submetidos aos diferentes tratamentos e das razões médias obtidas entre estas biomassas. RPSA – razão do peso seco da parte aérea; RPSR – razão do peso seco da parte radicular; RPSRPA – razão entre a parte radicular e a parte aérea. ...35 Tabela 9 Média, desvio padrão da média e significância relativo aos parâmetros de biomassa avaliados em relação às raízes: volume radicular, peso seco (PS) e peso fresco (PF) ...40 Tabela 10 Média, desvio padrão da média e significância relativo aos parâmetros de biomassa avaliados em relação à coroa: diâmetro, peso seco (PS) e peso fresco (PF) ...40 Tabela 11 Média, desvio padrão da média e significância relativo aos parâmetros de biomassa avaliados em relação às folhas novas (FN) e às folhas velhas (FV): peso seco (PS) e peso fresco (PV) ...41 Tabela 12 Valores médios de biomassa parcial (parte radicular e parte aérea) e total (peso total) dos morangueiros submetidos aos diferentes tratamentos e das razões médias obtidas entre estas biomassas. RPSA – razão do peso seco da parte aérea; RPSR – razão do peso seco da parte radicular; RPSRPA – razão entre a parte radicular e a parte aérea. ...41 Tabela 13 Níveis de significância relativos à concentração de clorofila nas folhas novas e folhas velhas, no início e fim da fase 2. (p>0,05 – Teste de Duncan) ...43
Tabela 14 Concentração média, desvio padrão e nível de significância (p<0,05, teste de Duncan) para o Cu, Zn, Mn e Fe quantificados nas raízes em 3 amostras das plantas de cada tratamento ...46 Tabela 15 Concentração média, desvio padrão e nível de significância (p<0,05, teste de Duncan) para o Cu, Zn, Mn e Fe quantificados nas folhas novas em 3 amostras das plantas de cada tratamento ...47
Resumo
O ferro é um fator limitante no crescimento e desenvolvimento do morangueiro. Este micronutriente quando está disponível e é absorvido em excesso sujeita as plantas a situações de toxicidade, sendo o principal sintoma o bronzeamento das folhas. A produção de morangueiro tem vindo a aumentar, bem como as exigências do mercado em relação ao seu pseudofruto, o morango. Assim, é importante ter o melhor entendimento possível sobre os fatores limitantes da produção. Durante a realização deste trabalho, as plantas de morangueiro foram submetidas numa primeira fase a seis tratamentos com diferentes concentrações (μM) de Fe, nomeadamente, Fe0, Fe10, Fe50, Fe100, Fe150 e Fe200. Numa segunda fase, foram selecionadas plantas de cada tratamento que foram submetidas a um tratamento de 400 μM de Fe. Em ambas as fases, foram realizadas medições de biomassa, leituras de SPAD, atividade da enzima quelato de Fe redutase (QF-R) e quantificado o teor de Fe, Zn, Mn e Cu nas folhas novas e nas raízes. O ensaio teve a duração de 33 dias, incindindo sobre as fases iniciais do desenvolvimento vegetativo do morangueiro.
A ausência de Fe na solução nutritiva provoca sintomas de clorose férrica e diminuição dos parâmetros de biomassa. Nas mesmas plantas, a atividade da enzima QF-R é induzida, de modo a aumentar a disponibilidade de Fe na solução nutritiva. No entanto, estes parâmetros podem ser revertidos pela aplicação de Fe à solução. Segundo os resultados obtidos, a concentração aconselhada para o desenvolvimento e crescimento da cultura são 50 μM de Fe. Para concentrações superiores a 100 μM de Fe verifica-se uma diminuição da biomassa. Para além disso, existe uma diminuição na atividade da enzima QF-R, como mecanismo de defesa contra a fitotoxicidade. Podemos então concluir que apesar da planta conseguir controlar a entrada excessiva de Fe, continuam a existir consequências morfológicas quando o Fe está em excesso.
Palavras-chave: Ferro, clorofila, QF-R, micronutrientes
Abstract
Iron is a limiting factor for strawberry plants growth and development. This micronutrient, when available and absorbed in excess, is potentially toxic, the main symptom being the bronzing of leafs. Strawberry production is increasing, as well as market demands in relation to its pseudo fruit, the strawberry itself. Therefore, it is important to have the best possible understanding of its production and limiting factors. During the realization of this project, strawberry plants were first submitted to six different treatments, with different Fe concentration (μM), particularly, Fe0, Fe10, Fe50, Fe100, Fe150 and Fe200. In a second stage, a number of plants from each treatment were selected and submitted to a 400 μM treatment. In both stages measurements of biomass, SPAD values, QF-R activity and analyses of the roots and leaves, to determine Fe, Zn, Mn and Cu, were taken. The experiment lasted for 33 days, considering the first development stages of strawberry plants.
The absence of Fe in the nutritive solution leads to ferric chlorosis and decreased biomass. On the same plants the QF-R enzyme activity is induced to raise the Fe available in the nutritive
solution. Nevertheless, these results can be reverted by applying Fe to the solution. According to the results, the desired concentration for plant development and growth is 50 μM Fe. For concentrations above 100 μM Fe there is a decrease in biomass. In addition, there is a decrease of the QF-R enzyme activity as a defence mechanism against toxicity. It can be concluded that although the plant is able to control the excessive intake of Fe, morphologic consequences still occur when Fe is in excess.
1. Introdução
O morangueiro é uma planta herbácea com interesse económico, cuja aceitação pelo mercado se deve ao aroma, sabor e características nutricionais do seu pseudofruto, o morango (Hancock et al. 2008).
Sendo uma planta de interesse mundial, é na Ásia que se concentra a maior produção, para o que contribui decisivamente a produção da China, o maior produtor mundial. Também na América e Europa se produz morango, sendo, no entanto a produção dos EUA, o segundo maior produtor mundial, cerca de metade da produção chinesa.
A produção de morango evoluiu consideravelmente ao longo das últimas décadas. No Algarve, os sistemas de produção atualmente praticados, que pretendem responder a elevados níveis de exigência dos mercados, são por sua vez altamente exigentes em termos de condições de produção, procurando a otimização simultânea do uso dos fatores de produção que condicionam o desenvolvimento harmonioso da cultura.
O presente trabalho tem como principal objetivo estudar a dinâmica do ferro (Fe) na cultura do morango. Este micronutriente é essencial para as plantas, ou seja, é um nutriente necessário em concentrações reduzidas; no entanto, limita a produção quando em situação de deficiência, sendo potencialmente fitotóxico quando está disponível e é absorvido em excesso. Em ambos os casos irá criar limitações ao desenvolvimento, crescimento e produção das plantas, pelo que é de todo o interesse perceber as consequências fisiológicas e morfológicas envolvidas.
O trabalho está organizado em seis capítulos. No capítulo 2 descrevem-se as principais características e biologia da planta de morangueiro, os sistemas de produção e o interesse da cultura em Portugal. No capítulo 3 revêem-se as principais questões relacionadas com o Fe na planta: a absorção e transporte, os efeitos fisiológicos e morfológicos da toxicidade, o armazenamento de Fe e as funções deste micronutriente na planta. No capítulo 4 apresenta-se o material e métodos usados neste estudo. No capítulo 5 apresentam-se e discutem-se os resultados obtidos nas duas fases do estudo, relativamente aos parâmetros de biomassa, SPAD, atividade da enzima QF-R e análise foliar. Finalmente, no capítulo 6, tiram-se as conclusões mais relevantes deste trabalho e apontam-se algumas perspetivas futuras.
2. Morangueiro
O morangueiro é uma planta herbácea da família das rosáceas com interesse económico devido ao seu pseudofruto, o morango. Todos os morangueiros, selvagens ou cultivados, pertencem ao género Fragaria. O morangueiro comum, utilizado comercialmente, Fragaria x
ananassa Dutch é uma planta híbrida de origem recente resultante do cruzamento natural da Fragaria chiloensis e Fragaria virgiana. A aceitação do morango pelo mercado está relacionada
com o seu aroma e sabor e com as suas características nutricionais (Hancock et al. 2008). Tal como a maioria das cultivares, a cultivar ‘Diamante’ foi desenvolvida através do trabalho de investigação do programa de melhoramento da Universidade da Califórnia (UC Davis), em 1994. Os programas de melhoramento desta espécie centram-se, principalmente, na obtenção de variedades com maior produtividade e mais precoces, com frutos de maiores dimensões e boa cor vermelha, firmes e com elevado poder de conservação.
Segundo o “office of research” da UC Davis, esta é uma cultivar muito produtiva, de dia neutro, que se distingue pela qualidade dos frutos e pela sua grande dimensão. A cor dos frutos, mais clara que de outras cultivares (não adequada para a industrialização), e a firmeza justificam a sua utilização para comercialização em fresco. A planta é muito compacta e ereta, propícia para cultivo com elevadas densidades. Os morangueiros cv. ‘Diamante’ necessitam de horas de frio para quebrar a dormência, antes da plantação. A frutificação acontece duas a três semanas após a plantação, em condições ótimas.
2.1. Caraterísticas e biologia
O morangueiro é uma planta perene herbácea com um sistema radicular fasciculado constituído por raízes primárias, que penetram no solo, e raízes secundárias, que absorvem nutrientes e água e acumulam reservas sob a forma de amido. As raízes são superficiais, podendo ser encontradas na camada superficial de 25 cm do solo (Almeida, 2006; Palha et al., 2005).
O caule é um rizoma estolhoso do qual emergem as folhas em roseta, formando a coroa. A planta é constituída por uma ou mais coroas que funcionam como unidades independentes, onde crescem as folhas, inflorescências, estolhos, coroas ramificadas e raízes adventícias (Almeida, 2006).
O crescimento do morangueiro está dependente do desenvolvimento dos gomos axilares e terminal. A transformação de um gomo depende do estado em que se encontra o meristema; na fase vegetativa o meristema produz folhas, coroas ou estolhos e na fase reprodutiva o meristema produz inflorescências. O gomo pode ainda encontrar-se dormente. O morangueiro desenvolve-se, principalmente, de acordo com a ação do fotoperíodo e da temperatura, apresentando um ciclo fisiológico anual onde os meristemas se encontram, sucessivamente, em fase de dormência, de crescimento vegetativo e reprodutiva (Almeida, 2006).
As folhas são constituídas por três folíolos com um pecíolo longo e estípulas de proteção na base, onde se encontram os gomos, podendo estes evoluir em estolhos ou em novas coroas. Os estolhos são caules especializados rastejantes que enraízam nos nós e asseguram a propagação vegetativa da planta. Quando as condições climáticas são desfavoráveis há diferenciação de estolhos e os gomos desenvolvem-se em novas coroas (Almeida, 2006; Palha
et al., 2005).
A Figura 1 representa esquematicamente uma planta de morangueiro.
A inflorescência é terminal emergindo das estípulas da folha, abaixo desta. A inflorescência termina numa flor primária com brácteas que irão suster outro eixo com uma flor de ordem inferior e assim sucessivamente. Tipicamente, encontra-se uma flor primária, duas flores secundárias, quatro terciárias e oito quaternárias. As flores são hermafroditas, os estames (20 a 30) estão dispostos à volta dos pistilos (60 a 600); quando se dá a deiscência das anteras, o pólen cai diretamente sobre os estigmas (Palha et al., 2005).
A iniciação floral do morangueiro ocorre quando o meristema passa à fase reprodutiva e varia de acordo com a cultivar e a sua relação com o fotoperíodo e a temperatura. Podemos Figura 1 Representação esquemática de uma planta adulta de morangueiro (Palha et al., 2005).
distinguir cultivares de dias longos, de dias curtos e indiferentes ao fotoperíodo. A cultivar ‘Diamante’ é indiferente ao fotoperíodo, o que quer dizer que a iniciação floral é independente do fotoperíodo, florindo a qualquer altura do ano, exceto se se verificarem temperaturas acima de 30°C. No entanto, temperaturas muito altas ou muito baixas podem levar a quebras de produção, derivadas do abrandamento da floração. As flores primárias da inflorescência são as primeiras a frutificarem, produzindo os frutos de maiores dimensões. O fruto é o conjunto constituído por um recetáculo carnudo sobre o qual estão os aquénios, formando um fruto múltiplo de aquénios, o morango (Almeida, 2006; Palha et al., 2005).
As diferentes cultivares de morangueiro adaptam-se a uma grande variedade de condições edafoclimáticas. No entanto, as principais regiões de produção no mundo estão situadas em climas temperados e mediterrâneos. No estado vegetativo são resistentes à geada, mas as flores são sensíveis, sendo destruídas a temperaturas negativas (Almeida, 2006).
O morangueiro adapta-se a quase todos os tipos de solo, desde que bem drenados, com humidade e ricos em matéria orgânica. A cultura é muito sensível à salinidade e ao encharcamento. O morangueiro adapta-se bem a solos com pH entre 5,5 e 7, sendo o intervalo ótimo encontrado entre 6,0 e 6,5 (Palha et al., 2005).
2.2. Sistemas de produção
Existem quatro tecnologias de produção principais: i) o sistema tradicional, de cultura plurianual; ii) a cultura anual ao ar livre com plantação outonal (plantas frescas); iii) a cultura anual protegida com plantação estival (plantas frigo-conservadas, comumente designadas frigo) e iv) os sistemas de cultura sem solo (Almeida, 2006).
As épocas de produção e, consequentemente, de plantação são adaptadas aos objetivos de comercialização. Na produção ao ar livre com plantação outonal utilizam-se variedades de dias curtos selecionadas para produções elevadas. São utilizadas plantas frescas de raiz nua ou produzida em “mottes” ou tabuleiros de alvéolos, as quais podem ser multiplicadas em viveiros de altitude, tendo as necessidades de frio já parcialmente satisfeitas, iniciando assim mais cedo a atividade vegetativa. No sistema de produção em cultura protegida com plantação estival utilizam-se plantas frigo; fisiologicamente estas plantas têm as necessidades de frio completamente satisfeitas, pois permaneceram em câmaras frigoríficas entre -1°C e -2,2°C durante cerca de 6 meses, a partir do momento em que são arrancadas dos viveiros, em pleno repouso vegetativo (dezembro-janeiro), até serem plantadas no Verão seguinte (Almeida, 2006; Palha et al., 2007).
Os sistemas de cultura sem solo começam a ser utilizados, principalmente para contornar duas questões: a fadiga do solo em termos químicos e biológicos devido à contínua utilização por monoculturas, nomeadamente do morangueiro, e as crescentes limitações ao uso de fumigantes de largo espetro, ambos associados a decréscimos quantitativos e qualitativos da produção. Para além de evitar a redução da produtividade, o cultivo sem solo assegura um
controlo rigoroso da utilização de água e nutrientes no meio radicular o que permite produtividades elevadas, soluciona problemas relacionados com escassez hídrica e possibilita um adequado acompanhamento da nutrição das plantas. Associa-se ao cultivo sem solo a possibilidade de reduzir os consumos de água em relação a sistemas tradicionais, sobretudo devido ao fornecimento de água ser realizado em moldes simples e eficazes, em que a água é dotada de forma automatizada e uniforme, de acordo com as necessidades da cultura. Para além disso, este sistema de cultura torna possível a eliminação de encargos associados a práticas culturais do solo, nomeadamente, a eliminação de lavouras e de operações de esterilização do solo, menor necessidade no controlo das infestantes e doenças do solo. Outra razão para considerar produzir morango em sistemas de cultura sem solo é a hipótese de produzir fora de época, procurando uma posição vantajosa no mercado e a possibilidade de oferecer melhores condições de trabalho. No entanto, o cultivo sem solo também apresenta desvantagens, sendo as principais o elevado custo do investimento inicial, a necessidade de pessoal técnico especializado que domine esta tecnologia de produção e a fisiologia da planta, a exigência de água de qualidade elevada e a necessidade de operações de manutenção do sistema de aplicação de solução nutritiva (Rosa et al., 2008).
2.3. Interesse da cultura em Portugal
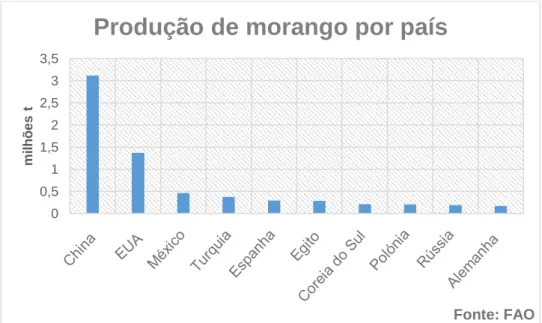
De acordo com os dados da “Food and Agriculture Organization” (FAO), a produção mundial de morangueiro excedeu os 8 milhões de toneladas no ano de 2014. No mesmo ano, a Ásia foi o maior produtor mundial com 48,9% da produção, seguido da América e da Europa, com 25,4% e 19,7%, respetivamente. A China é a principal responsável por estes resultados, produzindo 3,1 milhões de toneladas neste ano, sendo seguida pelos EUA, com menos de metade da produção, tendo atingido as 1,4 milhões de toneladas. Os restantes países no top 10 dos produtores mundiais são apresentados no gráfico 1.
Gráfico 1 Representação gráfica dos 10 países com maior produção de morangos no mundo. 0 0,5 1 1,5 2 2,5 3 3,5 mi lh õ es t
Produção de morango por país
Em Portugal, a produção foi, no ano de 2014 de 14811 t (Gráfico 2), tendo este valor diminuído no ano de 2015 para 9659 t, correspondentes a uma redução na superfície de 575 ha para 321 ha. O Algarve é a principal região produtora de morangueiro, seguida pelo Ribatejo e Oeste e Alentejo (OMAIAA, n.d.).
Gráfico 2 Produção de morango em Portugal desde 1994 até 2015.
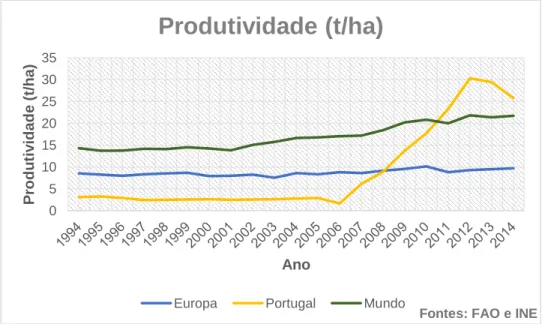
Apesar de não se encontrar no conjunto dos maiores produtores, a produtividade aumentou significativamente desde 2006 encontrando-se, atualmente, acima da média europeia e mundial (Gráfico 3). A cultura em estufa e protegida, em substrato, tem grande expressão no país, justificando as elevadas produtividades em relação a outros países, onde predomina a cultura em solo.
Gráfico 3 Produtividade da cultura de morangueiro no Mundo, na Europa e em Portugal. 0 2000 4000 6000 8000 10000 12000 14000 16000 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 2015 Pr o d u ção (t)
Fontes: FAO e INE
Produção de morangos em Portugal
0 5 10 15 20 25 30 35 P ro d u tiv id a d e ( t/h a ) Ano
Produtividade (t/ha)
Europa Portugal Mundo
O período de colheita do morango corresponde, tradicionalmente, aos meses de abril, maio e junho. No entanto, com a evolução das técnicas produtivas e de propagação e da introdução de novas cultivares, verifica-se o alargamento do período de produção, sendo possível selecioná-lo de acordo com a procura nacional e internacional, produzindo morango durante todo o ano (Tabela 1).
Tabela 1 Distribuição da produção de pequenos frutos ao longo do ano, em Portugal (GPP, 2016).
As tecnologias de produção selecionadas pelo produtor são função, principalmente, do mercado destino, das variedades e das condições edafoclimáticas. Nas diferentes regiões de produção do país, os períodos de produção são distintos, permitindo que haja oferta nacional durante todo o ano (Tabela 2).
A área de cultura sem solo tem vindo a aumentar, tendo especial desenvolvimento no Algarve. No entanto, em 2010, no panorama nacional predominava a cultura em solo, semelhante aos restantes países “mediterrâneos” produtores de morango (EUA – Califórnia, Espanha, Marrocos, Turquia e Itália) (Brás de Oliveira & Fonseca, 2010).
A evolução da produção é uma necessidade face às alterações nas dinâmicas do mercado, particularmente o aumento da importância das grandes superfícies e, consequentemente, a maior importância dos parâmetros de qualidade dos produtos e a inclusão dos pequenos frutos (morango, framboesa, mirtilo, amora e groselha) nos hábitos alimentares dos consumidores durante todo o ano. Já em 1999 se referia que a cultura no solo intensiva praticada no Algarve não permitia dar resposta ao novo panorama do mercado: se por um lado apresentava vantagens por tirar partido da precocidade da produção, o uso dos solos levava a desequilíbrios químicos e biológicos que se refletiam em termos de fertilizações, pragas e doenças, com impactos negativos na produção, tanto em termos quantitativos como qualitativos. A solução encontrada para contornar as novas condições do mercado e da região foi a introdução da cultura sem solo, tendo adquirido grande importância devido às vantagens
Produto Jan Fev Mar Abr Mai Jun Jul Ago Set Out Nov Dez
Frutos Pequenos de Baga
Framboesa
Mirtilo
Morango
associadas a este tipo de cultura - a elevada produtividade como resultado do controlo rigorosos do meio de cultura, particularmente em termos de água e nutrientes, a eliminação das reduções de produtividade como consequência do uso intensivo dos solos, a redução dos consumos de água e a redução da necessidade de controlo de doenças do solo e infestantes (Rosa, 1999).
3. O Fe na planta
O ferro (Fe) é um elemento essencial ao crescimento das plantas. O Fe é um metal pesado sendo, por isso, caraterizado como poluente e tóxico, mesmo em concentrações baixas. No entanto, é um micronutriente essencial para as plantas, ou seja, é um nutriente necessário em concentrações reduzidas podendo limitar a produção quando em situação de deficiência, mas que quando está disponível e é absorvido em excesso é potencialmente fitotóxico. Em ambos os casos irá criar limitações ao desenvolvimento e crescimento das plantas. Os sintomas de excesso de Fe ocorrem quando existem quantidades elevadas de Fe(II) na solução de solo, que são absorvidas pelas raízes e transportadas para os órgãos aéreos da planta (Becker & Asch, 2005).
Apesar de ser o quarto elemento mais abundante na crosta terreste, o Fe está pouco disponível para as plantas por se apresentar em formas pouco solúveis, as quais as raízes não têm capacidade de absorver, o que torna necessário a ativação de mecanismos que aumentem a disponibilidade de Fe no solo. Este aumento de disponibilidade e a absorção de Fe acontece nas plantas de duas formas distintas conforme a estratégia utilizada pelas mesmas. A estratégia I é utilizada por todas as espécies com exceção das pertencentes à família Poacea, o que inclui o morangueiro, e a estratégia II inclui as plantas pertencentes à família Poacea. A estratégia I, também chamada estratégia redutora inclui três mecanismos principais: acidificação da rizosfera, redução do Fe(III) em Fe(II) e transporte do Fe através da membrana plasmática (Pestana et al., 2013).
Quando em situação de excesso de Fe, o principal sintoma vai ser o bronzeamento das folhas, que leva a uma diminuição da produtividade. O Fe pode ainda ser parte da reação de Fenton, que leva a acumulação de radicais prejudiciais às plantas. A principal defesa da planta contra a ocorrência destas reações é o armazenamento de Fe, pela fitoferritina, que controla a libertação deste nutriente.
A tendência para o Fe formar complexos e a capacidade de mudar o estado de oxidação permitem que este nutriente participe em diversas atividades metabólicas e fisiológicas. As duas principais funções são ser cofator de diversas enzimas redox e a formação de complexos proteicos.
3.1. Absorção e transporte
A estratégia 1 inicia-se pela redução do Fe(III) em Fe(II) na membrana plasmática, passando o nutriente a estar disponível para absorção pelas raízes. A reação de redução do Fe é mediada pela quelato de Fe-redutase (QF-R) e, na membrana plasmática das células radiculares podem existir dois sistemas de enzimas redox onde a QF-R atua para converter Fe férrico em Fe ferroso, os sistemas “turbo” e “standard”, dependendo da disponibilidade deste elemento no meio (Figura 2).
Figura 2 Modelo da estratégia I para absorção de ferro, utilizada pelas plantas não pertencentes à família Poacea. R= quelato de ferro redutase; Tr=transportador do Fe(II). (Modified from Marschner et al., 1986; Romheld,1987 em Marschner & Römheld, 1994)
O sistema “standard” está presente em todas as plantas e a sua atividade, ao contrário do sistema “turbo”, não é regulada pela necessidade de Fe. Quando a planta tem a suas necessidades em Fe satisfeitas o sistema “standard” é o utilizado, no entanto, em situações de deficiência de Fe o sistema “turbo” é induzido. A transferência de eletrões neste sistema acontece entre ferrocianidinas, como aceitador de eletrões, e nicotinamida-dinucleótido (NADH) ou nicotinamida-dinucleótido-fosfato (NADPH), como dadores de eletrões (Marschner & Römheld, 1994).
O sistema “turbo” é apenas expresso em plantas que utilizam a estratégia I, incidindo não só sobre ferrocianidinas mas também sobre quelatos de Fe(III). A atividade do sistema “turbo” é induzida pela deficiência de Fe, aumentando a sua atividade como resposta à redução da quantidade de Fe disponível, melhorando a eficiência do mecanismo redutor. Neste, apenas o NADPH é dador de eletrões, no entanto, não só as ferrocianidinas mas também quelatos de ferro são aceitadores de eletrões. O potencial redutor da turbo-redutase ainda não é completamente claro, mas parece certa a existência destes dois mecanismos distintos para redução de ferrocianidinas e quelatos de ferro (Bienfait, 1985; Curie & Briat, 2003; Pestana et
al., 2013; Schmidt, 1999). Citoplasma Apoplasma (Rizoderme) Rizoplano (Rizosfera) Quelante Quelantes Redutores solo
Independentemente do sistema utilizado, na absorção deste nutriente a QF-R tem como objetivo a redução de Fe(III) em quelatos de Fe específicos, dos quais se vai libertar o ião Fe(II), sendo este absorvido pelas raízes. Na forma ferrosa, o Fe está disponível para ser transportado por um transportador de metais divalente pertencente à família ZIP
(“Zinc-regulated transporters, Iron-(“Zinc-regulated transporter-like Protein”), o “iron (“Zinc-regulated transporter 1”
(IRT1) é responsável pela entrada da maioria do Fe(II) nas raízes. Semelhante ao IRT1, o IRT2 também participa no transporte de Fe, no entanto, a ausência deste não é letal o que evidencia a diferença entre a importância que cada um tem no transporte. O sistema de transporte carateriza-se pela baixa afinidade, induzindo um mecanismo comum em que vários metais competem pela absorção, os metais transportados variam de espécie para espécie, na
Arabidopsis thaliana, o AtIRT1 também transporta Zn, Mn, Cd, Co e Ni; no caso do tomate, os
ortólogos, LeIRT1 e LeIRT2 transportam Zn, Mn e Cu, para além do Fe. Contudo, estes transportadores têm em comum o facto de transportarem metais potencialmente tóxicos que, no caso de deficiência de Fe, são encontrados em quantidades elevadas nas plantas (Schmidt, 2003; Vert et al., 2002).
O Fe pode ser translocado das raízes para os órgãos aéreos e entre órgãos aéreos, tanto via xilema como via floema. No simplasto do sistema radicular, o Fe(II) é oxidado e complexado pelo ácido cítrico, originando o Fe(III)-citrato, sendo nesta forma translocado via xilémica. O Fe pode também complexar com a nicotianamina (NA), um aminoácido produzido na maioria dos tecidos, com grande afinidade para formar quelatos com iões metálicos, como o Fe, formando Fe-NA. Sendo transportado no floema, o Fe torna-se disponível para tecidos jovens, como os ápices caulinares. Para o transporte do Fe do xilema (onde se encontra na forma Fe(III)-citrato) para o floema (onde pode complexar com o NA) é necessária a redução do Fe, que ocorre no sistema vascular, nas interfaces simplasto/apoplasto, entrando no citoplasma o Fe(II) que será complexado pela NA (Briat et al., 2007; Pestana et al., 2003).
3.2. Toxicidade - Efeitos fisiológicos e morfológicos
O principal sintoma associado à toxicidade de Fe é obronzeamento das folhas e, consequentemente, diminuição da produtividade. Os sintomas de bronzeamento iniciam-se em folhas totalmente expandidas pelo aparecimento de pequenos pontos castanhos que se espalham desde as pontas até à base da folha; os sintomas desenvolvem-se até que toda a folha se apresente cor de bronze (Figura 3). Em casos extremos pode ainda passar a castanho arroxeado. Os sintomas de fitotoxicidade podem ser
associados com perdas de produtividade; esta relação varia entre espécies e mesmo entre cultivares: no arroz, por exemplo, a produtividade pode diminuir 12% a 35%, em média e as Figura 3 Sintomas de excesso de Fe em arroz. (IRRI)
perdas podem ser totais, se os sintomas se revelarem nos estados vegetativos iniciais (Becker, 2005).
As características principais que levam à toxicidade por Fe são: quantidades elevadas de Fe(II) na solução de solo, pH baixo e baixa capacidade de troca catiónica e K de troca.
O radical hidróxilo (HO·) é uma das espécies mais reativas da família ROS (“reactive oxigen
species”) que tem grande afinidade para aminoácidos e proteínas, polissacáridos ou ácidos
nucleicos, podendo oxidar estas moléculas e danificar as células. Este radical é formado a partir da reação do peróxido de oxigénio (H2O2) com o Fe(II) na reação de Fenton (1). A
quantidade de Fe(II) poderia ser limitante nesta reação, no entanto, este pode ser regenerado
pela sua oxidação pelo superóxido (2). O trabalho de Fenton descreve o potencial oxidativo do peróxido de hidrogénio com sais ferrosos. Alguns anos mais tarde, Haber e Weiss identificaram o radical hidroxilo como o elemento oxidativo desta reação (3). Assim, podemos concluir que, na presença de Fe, o peróxido de hidrogénio e o radical superóxido, podem formar o radical hidroxilo prejudicial à planta (Arora et al., 2002; Becker & Asch, 2005; Chen & Schopfer, 1999).
Quando produzido próximo do ADN, o HO· pode adicionar ou remover átomos de hidrogénio às bases ou à cadeia, levando à modificação do mesmo. No caso da ação sobre proteínas, os aminoácidos mais afetados são a histidina, arginina, lisina, prolina, metionina e cisteína, sendo que o HO· tem capacidades oxidativas que provocam a degradação destes.
Outra ação oxidante prejudicial à planta, desencadeada pela presença de Fe, é a peroxidação lipídica. Nesta, o Fe catalisa a decomposição dos hidroperóxidos lipídicos a radicais alcoxilo
(LO·) (4) e peroxilo (LOO·) (5). Esta reação incide sobre os lípidos insaturados das membranas celulares, provocando a destruição da sua estrutura e levando, em última instância, à morte celular. A destruição da estrutura membranar desencadeia uma sequência de alterações que afeta a permeabilidade e, consequentemente, resulta numa perda da seletividade na troca de nutrientes e substâncias tóxicas para a célula (Becana et al., 1998; Lima & Abdalla, 2001). Finalmente, podemos concluir que as propriedades químicas do Fe fazem com que a acumulação deste elemento essencial tenha de ser limitada nas células vegetais.
LOOH+ Fe2+ → Fe3+ + OH- + LO· Fe3+ + LOOH→ Fe2++ LOO· + H+ (4) (5) H2O2 + Fe2+ ↔󠇄 Fe3+ + OH- + HO· O2 + Fe2+↔󠇄 Fe3++ · O2 ·O2-+ H2O2↔󠇄 O2 + OH- + HO· (1) (2) (3)
3.3. Armazenamento de Fe
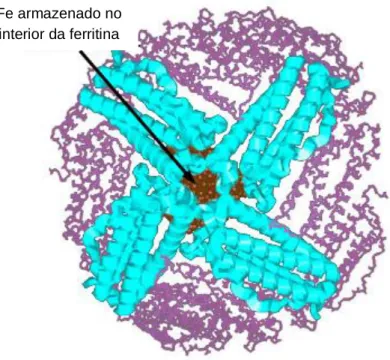
O Fe é um micronutriente essencial para as plantas: no entanto, por ser potencialmente tóxico, as células têm de ter a capacidade de controlar a concentração de Fe não solúvel e solúvel disponível para participar nas reações de Fenton. As ferritinas são proteínas especializadas no armazenamento e libertação de Fe nas células, compostas por 24 subunidades que formam uma esfera oca que pode armazenar até 4500 átomos de Fe, numa forma não tóxica, mas disponível para as plantas (figura 4). A ferritina absorve Fe através da oxidação de Fe(II) e precipitação do Fe(III) no interior da proteína como hidroxifosfato férrico. Esta proteína está localizada nos plastídeos, principalmente nos não-verdes, como etioplastos e amiloplastos, e a sua síntese é regulada, entre outros fatores, pelo excesso de Fe e pelo stress oxidativo. A ferritina é a principal responsável pela homeostase do Fe.
A quantidade de Fe e ferritina nos órgãos vegetais varia, não só de acordo com o órgão mas também com o seu estado de desenvolvimento, podendo o Fe ser armazenado em caso de poder ser tóxico e libertado ou remobilizado em caso de deficiência. Nas sementes, as ferritinas são essenciais para a contrução de um sistema fotossintético funcional; durante a germinação as ferritinas são degradadas e o Fe é libertado e utilizado pela planta. Nas folhas, a principal hipótese formulada, é que atuem como fonte de Fe nos estágios iniciais de desenvolvimento, atuando na síntese de proteínas que contêm Fe e que estão envolvidas na fotossíntese. As ferritinas encontram-se em maior concentração em folhas jovens e senescentes, onde a atividade fotossintética é menor, isto é, onde são necessárias menores quantidades de Fe. Em menores quantidades, estas proteínas também estão presentes nas raízes, onde atuam como “buffer” e controlam o fluxo de Fe após a absorção. Pode então concluir-se que os efeitos benéficos deste micronutriente estão condicionados pela presença de ferritina (Bauer & Hell, 2006; Bienfait, 1989; Briat et al., 2006).
Figura 4 Representação esquemática tridimensional da ferritina, a proteína responsável pelo armazenamento de ferro (Casiday & Frey, 2000)
O controlo da homeostase de Fe na planta é essencial para evitar tanto situações de toxicidade como de deficiência do nutriente. Este controlo pode ser observado em vários níveis, nomeadamente, na absorção e transporte de Fe na planta.
3.4. Funções na planta
Entre os micronutrientes, o Fe é geralmente utilizado pelas plantas em maiores quantidades. A tendência para o Fe formar complexos e a capacidade de mudar o estado de oxidação entre Fe(III) e Fe(II) são as duas principais caraterísticas que lhe permitem participar em diversas atividades metabólicas e fisiológicas. Destaca-se o seu papel na síntese de clorofila, no desenvolvimento dos cloroplastos, no processo fotossintético, na fixação de azoto, na respiração e na síntese de ADN, através da ação da ribonucleótido redutase (Azcón-Bieto & Talón, 2003; Nagajyoti, Lee, & Sreekanth, 2010).
Cerca de 80% do Fe na planta pode ser encontrado nas células fotossintéticas onde é essencial como constituinte de diversas proteínas com grupo heme, como os citocromos, cuja principal função é o transporte de eletrões nos cloroplastos e nas mitocôndrias, e catalases e peroxidases, enzimas que participam nas reações de desintoxicação das plantas em condições de “stress” no processo de “explosão oxidativa”. A distribuição de Fe na planta demonstra a sua importância na atividade fotossintética e, consequentemente, a sua influência no crescimento e desenvolvimento das plantas. O Fe tem um papel essencial na síntese de clorofila, sendo essa caraterística apontada como razão para o aparecimento de cloroses nas folhas quando existe deficiência deste nutriente (Hochmuth, 2014).
Fe armazenado no interior da ferritina
O Fe forma diversos complexos proteicos, sendo os principais as sulfuproteínas (Fe-S) e sendo também importante referir a ferredoxina, nitrito redutase, sulfito redutase e nitrogenase. Estas proteínas são essenciais na fotossíntese, na fixação de azoto e na respiração.
O Fe faz ainda parte de várias proteínas sem grupo heme, como as ferroxinas, proteínas de transporte de eletrões em reações metabólicas. Estas proteínas são componentes importantes dos cloroplastos e da mitocôndria, tendo assim influência na fotossíntese, no metabolismo energético, na regulação das reações redox e morte celular. Assim, para além de estar presente no metabolismo dos pigmentos fotossintéticos, o Fe é fundamental para a estabilidade estrutural e funcionamento dos cloroplastos (Azcón-Bieto & Talón, 2003).
As mitocôndrias atuam como centro energético das células, contendo grandes quantidades de metaloproteínas que necessitam de Fe para conseguirem realizar as suas funções. Para além disso, estas são o local de formação dos complexos Fe-S.
O Fe, como cofator de diversas enzimas, exerce um papel no balanço hormonal das plantas: é necessário na síntese, entre outras, de etileno, lipoxigenase e ácido abíssico, hormonas que são ativadas nas plantas como resposta a condições de “stress” ambiental. Podemos assim concluir que o Fe tem uma dupla influência no sistema oxidativo da planta - se por um lado é responsável pelo “stress” oxidativo como resultado da produção de ROS, por outro, quantidades elevadas de Fe influenciam a atividade antioxidante das células, como co-fator de enzimas antioxidantes (Arora et al., 2002).
4. Material e Métodos
4.1. Delineamento experimental
Os ensaios decorreram numa estufa localizada no “Horto” do “Campus” de Gambelas da Universidade do Algarve, durante os meses de janeiro e fevereiro de 2017, com a finalidade de estudar a dinâmica do Fe em plantas de morangueiro da cultivar ‘Diamante’. As plantas foram instaladas em sistema hidropónico em caixas de 20 L contendo solução nutritiva de Hoagland, sendo apenas variável a concentração de Fe nos diferentes tratamentos utilizados. Para a monitorização da solução nutritiva foram medidos o pH, temperatura e condutividade elétrica (CE).
Os efeitos sobre a cultura foram aferidos através da medição de parâmetros de biomassa e valores SPAD, pela determinação da atividade da enzima QF-R e pela quantificação de nutrientes (Fe, Cu, Mn e Zn).
A experiência decorreu em duas fases distintas, numa primeira fase (Fase 1) as plantas foram instaladas num meio de cultura onde se adicionaram diferentes concentrações de Fe, numa tentativa de determinar os níveis de deficiência e fitotoxicidade. Numa segunda fase (Fase 2), das plantas submetidas às diferentes concentrações de Fe na fase 1 foram retiradas amostras que foram introduzidas num meio de cultura com uma concentração mais elevada de Fe (400 µM) (Figura 5).
Janeiro Fevereiro Agosto
23 24 27 4 6 8 10 13 15 16 20 21 22 23 24 1 2 3 4
Fase 1 FASE 1
Fase 2 FASE 2 Preparação das caixas Instalação do ensaio Emissão das 1ª folhas
Medições pH CE T SPAD Atividade da QF-R Biomassa Quantificação de nutrientes
Figura 5 Calendarização do desenvolvimento metodológico. Na fase 1 (29 dias) realizaram-se 6 tratamentos com concentrações variáveis de Fe, 0, 10, 50, 100, 150 e 200 μM. Na fase 2 (3 dias), uma parte das amostras dda fase anterior foi transferida para um tratamento de 400 μM de Fe. As medições de pH, CE e T foram realizadas para monitorizar a solução nutrtiva. As restantes medições realizaram-se para aferir o efeito dos tratamentos na cultura.
4.2. Meio de cultura
A solução de Hoagland é constituída por diversos macro e micronutrientes essenciais ao crescimento das plantas, nas seguintes concentrações: 2,5 mM Ca(NO3)2.4H2O, 2,5 mM KNO3,
0,5 mM KH2PO4, 1,0 mM MgSO4.7H2O, 23 μM H3BO3, 0,4 μM ZnSO4.7H2O, 0,2 μM
CuSO4.5H2O, 4,5 μM MnCl2.4H2O, 1,0 μM MoO3 e, neste caso específico, concentrações
variáveis de Fe. Para a realização da mesma, foi necessário preparar uma solução “stock” para cada um dos macronutrientes, uma solução “stock” para todos os micronutrientes, excluindo o Fe, e uma solução de Fe. As soluções “stock” foram preparadas com as concentrações indicadas na Tabela 3 e armazenadas no escuro e frio.
Tabela 3. Macro e micronutrientes presentes na solução nutritiva de Hoagland, utilizada como meio de cultura. Foram preparadas soluções stock, que eram misturadas em caixas de 20 L para preparar o meio de cultura
Para a preparação das soluções “stock” de macronutrientes pesou-se a quantidade indicada na Tabela 3 por cada litro de solução que se dissolveu em água destilada utilizando um agitador magnético. No caso dos micronutrientes, estes foram pesados e dissolvidos no mesmo recipiente, sendo transferidos para um frasco onde foi adicionada água destilada até se atingir o volume final. Todos os frascos foram devidamente identificados e armazenados até as soluções serem utilizadas.
A solução-stock de Fe foi preparada dissolvendo 9,3 g de BasaFer, um adubo comercial com 6% de Fe-EDDHMA (“Ethylene diamine di- [o-hydroxy-methylphenyl] acetic acid”), por cada litro de água destilada.
4.3. Instalação da experiência
As plantas de morangueiro foram compradas a um viveiro do Norte do país que as forneceu de raiz nua, no estado inicial de desenvolvimento, apenas com uma folha.
Os morangueiros foram transplantados no dia 24 de janeiro de 2017 (início da fase 1). As plantas de morangueiro foram instaladas em caixas de plástico opacas de 20 L, previamente
Reagentes Solução-Stock (g/L) Solução Nutritiva (ml/L) Caixa (ml/20L) Macronutrientes Ca(NO3)2.4H2O 236,2 5 100 KNO3 101,1 5 100 KH2PO4 136,1 1 20 MgSO4.7H2O 246,5 2 40 Micronutrientes H3BO3 2,86 1 20 MnCl2.4H2O 1,81 ZnSO4.7H2O 0,22 CuSO4.5H2O 0,08 MoO3 0,016
lavadas e desinfetadas: foram lavadas com água e desinfetadas por imersão numa calda com fosetil de alumínio a 74,6%, tendo sido utilizadas 2 g/L de água para a desinfeção das raízes, durante 24 horas.
Para cada tratamento fizeram-se três repetições (caixas), cada uma com 4 plantas, exceto no tratamento Fe0 em que foram colocadas 10 plantas por caixa, tomou-se a decisão de neste tratamento utilizar um número superior para estas plantas serem utilizadas numa eventual fase de recuperação.
A posição das caixas na estufa foi determinada aleatoriamente (Figura 6). Em cada caixa foram adicionados água desmineralizada, macronutrientes e micronutrientes de modo a completar 20 L de solução nutritiva, nas quantidades indicadas na Tabela 3. O Fe foi adicionado em cada caixa, de forma a corresponder ao tratamento determinado:
• Fe0 0 μM de Fe – 0 ml Fe/caixa • Fe10 10 μM – 20 ml Fe/caixa • Fe50 50 μM – 100 ml Fe/caixa • Fe100 100 μM – 200 ml Fe/caixa • Fe150 150 μM – 300 ml Fe/caixa • Fe200 200 μM – 400 ml Fe/caixa
Fe0 Fe10 Fe50 Fe100 Fe150 Fe200
Caixa 1 Caixa 2 Caixa 3 Caixa 4 Caixa 5 Caixa 6
Caixa 13 Caixa 14 Caixa 15 Caixa 16 Caixa 17 Caixa 18 Caixa 12 Caixa 11 Caixa 10 Caixa 9 Caixa 8 Caixa 7
Figura 6 Representação esquemática da disposição das caixas na estufa, cada cor representa uma concentração diferente de Fe adicionada ao meio de cultura.
De modo a assegurar a oxigenação do sistema radicular foi instalado um sistema de arejamento, tendo em cada caixa sido colocado um difusor ligado a um sistema de tubagens, regulado por torneiras. Na estufa, não houve nenhum controlo adicional.
Para a realização da experiência foram utilizadas 90 plantas de morangueiro da cv. ‘Diamante’ distribuídas pelos 6 tratamentos já referidos, durante 29 dias.
A fase 2, coma duração de 3 dias, foi iniciada após o aparecimento de sintomas de deficiência nas plantas do tratamento Fe0, tendo sido retiradas de cada tratamento três plantas, as quais foram submetidas a um novo tratamento com uma concentração de 400 μM de Fe na solução nutritiva. Foram ainda mantidas três amostras em cada nível de Fe que serviram como controlo, nas concentrações até então utilizadas. As restantes plantas foram destruídas para avaliação dos parâmetros de biomassa.
4.4. Monitorização da solução nutritiva
A fim de monitorizar a solução nutritiva foram medidos valores de pH e condutividade elétrica (CE). Estes parâmetros foram medidos durante a instalação da cultura e, quando necessário, corrigidos. A partir do momento em que se encontraram valores esperados (pH de 6.0±0.2; CE de 2.0±0.1 dS/m) foram monitorizados regularmente. Para além disso, foi ainda monitorizada a temperatura (T) da solução nutritiva. Os valores de pH e T foram medidos em simultâneo com um potenciómetro HI 9024C, Hanna Instruments. Os valores de CE foram medidos com um condutivímetro LF95/SET, WTW.
4.5. Parâmetros de biomassa
Os parâmetros de biomassa foram medidos no início da experiência (T00), no final da fase 1 (T1) e no final da fase 2 (T2).
No início da experiência, dia 24 de janeiro, uma amostra foi extraída do mesmo lote de onde foram retiradas as plantas utilizadas e foram medidos volume da raiz, diâmetro da coroa, peso radicular (fresco e seco) e peso da parte aérea (fresco e seco).
O volume radicular foi medido através da introdução da raiz num volume conhecido de água e foi calculado através da diferença entre o volume final e o volume inicial (depois e antes da introdução das raízes, respetivamente).
As raízes foram separadas da parte aérea e, depois da pesagem (peso fresco) de cada uma das partes, foram acondicionadas em sacos de papel identificados e colocados na estufa a 60 °C durante 48 h, ou peso constante (peso seco).
No final da fase 1 e início da fase 2, as plantas não utilizadas como controlo ou submetidas ao tratamento Fe400 foram destruídas tendo sido contabilizados volume da raiz, diâmetro da coroa, peso radicular, da coroa, das folhas velhas, das folhas novas e das flores e valores de SPAD das folhas velhas e das folhas novas. Este procedimento foi repetido nas restantes plantas no dia 24 de fevereiro, final da fase 2.
4.6. SPAD
As medições de SPAD tiveram início com a emissão das primeiras folhas. O SPAD-502 (Figura 7) foi utilizado como método não destrutivo para a obtenção de valores de SPAD através da medição da absorvância da folha na região do vermelho e NIR, sendo os valores obtidos proporcionais à concentração de clorofila da folha. Os valores de SPAD medidos foram convertidos em concentração foliar de clorofila (y) através da utilização de curvas de calibração, que diferem entre espécies e entre cultivares. Para o caso específico do morangueiro cv. ‘Diamante’, a função ajustada utilizada é (Gama
et al., 2016):
𝑦 = 0,38 × 𝑆𝑃𝐴𝐷2+ 6,63 × 𝑆𝑃𝐴𝐷 + 71,55 r2=0,97, n=38,
P<0,001)
As medições de SPAD foram realizadas 3 vezes por semana. A partir do momento em que existiam duas folhas foi realizada uma medição na folha velha e uma na folha nova de cada planta. A cada medição corresponde uma média dos valores lidos nos três folíolos da folha.
4.7. Atividade da QF-R
A atividade da enzima QF-R foi determinada em ápices radiculares e em discos foliares de folhas novas e de folhas velhas. O método utilizado baseia-se na formação do complexo Fe(II)-BPDS de coloração rosa, quantificado pela colorimetria da solução.
Para cada tratamento foram realizadas 7 repetições no caso dos ápices radiculares e 5 repetições no caso dos discos foliares. Foram utilizados ápices radiculares com 2 cm de comprimento e discos foliares, das folhas novas e das folhas velhas, com diâmetro de 0,4 cm. Os ápices radiculares e os discos foliares foram inseridos, individualmente, em “eppendorfs” contendo uma solução composta pela solução nutritiva de Hoagland a meia concentração, 5 mM de solução tampão MES (2-(N-morfolino)etanosulfónico), 30 μM de BPDS (ácido bisulfónico de batofenantrolina) e 500 μM Fe-EDTA. Foram ainda realizados 3 ensaios em branco (sem raízes ou discos foliares) com o objetivo de eliminar as reduções de Fe não relacionadas com a reação em estudo. Após uma hora de reação no escuro, a cor foi quantificada num espectrofotómetro, sendo a absorvância lida a 535 nm.
Figura 7 SPAD-502,
aparelho de medição de SPAD
A absorvância foi convertida em moles de Fe(II) tendo em conta o tempo da reação no escuro e o peso final do material vegetativo utilizado; ao valor da absorvância foi subtraído o valor médio dos ensaios em branco, e multiplicado pelo volume do “eppendorf”, assim:
𝑚𝑜𝑙𝑒𝑠 𝐹𝑒(𝐼𝐼)/𝑚𝑖𝑛/𝑔 =(𝐴𝑏𝑠𝑜𝑟𝑣â𝑛𝑐𝑖𝑎 − 𝐴𝑏𝑠𝑜𝑟𝑣â𝑛𝑐𝑖𝑎 𝑏𝑟𝑎𝑛𝑐𝑜) × 𝑉𝑒𝑝𝑝𝑒𝑛𝑑𝑜𝑟𝑓 22,14 × 𝑡 × 𝑃𝐹
V- Volume; t- tempo; PF – Peso fresco
Este procedimento, tal como as medições de parâmetros de biomassa, foi repetido nas plantas não utilizadas como controlo, no final da fase 1, e nas submetidas ao tratamento Fe400 no final da fase 2
4.8. Quantificação de micronutrientes
A quantificação de nutrientes foi efetuada para o Fe, Zn, Mn e Cu por espectrofotometria de absorção atómica (EAA). Esta quantificação foi efetuada para amostras de raízes e de folhas novas, das fases 1 e 2 (Figura 8). O processo iniciou-se pela moagem das amostras que foram depois pesadas e colocadas na estufa a 100 ºC durante 24h. Depois de serem novamente pesadas foram colocadas na mufla a 450 ºC durante 24 h. Após uma última pesagem adicionaram-se 10 ml de HCl 3 M e as amostras foram colocadas numa placa aquecida, processo que foi repetido três vezes. Na terceira vez, a placa foi desligada e as amostras tapadas com vidros de relógio. O último passo no processo da preparação da amostra foi a filtragem do conteúdo das amostras para um balão volumétrico de 100 ml com água quente, completando este volume com água destilada.
A solução obtida com este procedimento contém os nutrientes existentes nas amostras radiculares ou foliares e permite a sua quantificação por EAA. Para esta quantificação foi, em primeiro lugar, necessário estabelecer uma curva padrão, pela utilização de soluções com concentrações rigorosamente conhecidas, utilizando o comprimento de onda específico para cada nutriente. A curva padrão relaciona a concentração de nutriente na solução com a absorvância da respetiva solução num comprimento de onda específico para cada nutriente. Após a obtenção da curva padrão, cada amostra foi lida e a concentração de metal no extrato obtida (mg/L). No caso do Fe, algumas das amostras tinham concentrações muito elevadas neste nutriente, não estando dentro dos limites da curva padrão. Nestes casos foi efetuada uma diluição as 10%, e o processo de leitura foi repetido, obtendo-se valores dentro da curva padrão, e o fator de diluição foi considerado nos cálculos finais.
A concentração de Cu, Zn, Mn e Fe (mg/kg na MS) foi obtida a partir do peso da amostra, diluição da solução (100% ou 10%, nestes casos) e pela leitura do espetrofotómetro.
𝑐𝑜𝑛𝑐𝑒𝑛𝑡𝑟𝑎çã𝑜 = 𝑙𝑒𝑖𝑡𝑢𝑟𝑎 × 100
𝑝𝑒𝑠𝑜 𝑑𝑎 𝑎𝑚𝑜𝑠𝑡𝑟𝑎 𝑟𝑒𝑓𝑒𝑟𝑒𝑛𝑡𝑒 à 𝑀𝑆× 100 𝑑𝑖𝑙𝑢𝑖çã𝑜
4.9. Análise estatística
A análise estatística foi efetuada no programa SPSS 24. A comparação das médias foi efetuada pela análise de variância simples (ANOVA) e teste de comparação múltiplo de variáveis de Duncan, para um nível de significância de 0,95.
5. Resultados e discussão
As plantas instaladas apresentavam uma grande variação em biomassa, podendo esta ser observada na análise dos resultados dos parâmetros de biomassa em T00 (Tabela 4).
Tabela 4 Parâmetros de biomassa medidos no dia da instalação da cultura - T00.
A emissão das primeiras folhas e o início das medições dos valores SPAD decorreu no dia 06 de fevereiro de 2017 (Figura 9).
Figura 9 Início do ensaio - 24 de janeiro de 2017
5.1. Monitorização da solução nutritiva
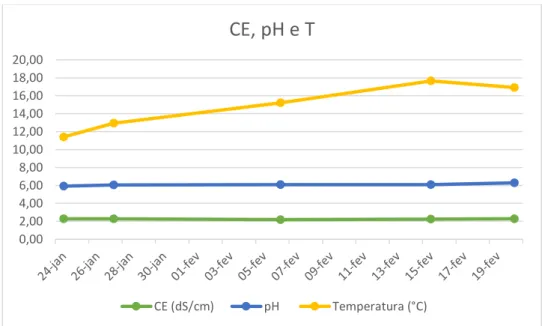
A CE foi controlada durante a introdução da água nas caixas e após a introdução dos nutrientes, tendo-se mantido sempre em 0 durante a introdução da água e dentro dos valores considerados normais após a introdução dos nutrientes. O pH foi também medido após ter sido feita a solução nutritiva, tendo-se obtidos valores na ordem de 5,3. Visto que o pH ótimo para o desenvolvimento do morangueiro é entre 6 e 6,5, este foi corrigido através da adição de 3 ml de NaOH 1M.
Após a instalação da cultura, foram medidos, novamente, o pH e a CE da solução. Tendo sido encontrado valores de pH entre 5,82 e 5,96; este foi, mais uma vez, corrigido, através da adição de 2 ml de NaOH 1M. Após três dias, estes valores foram novamente medidos
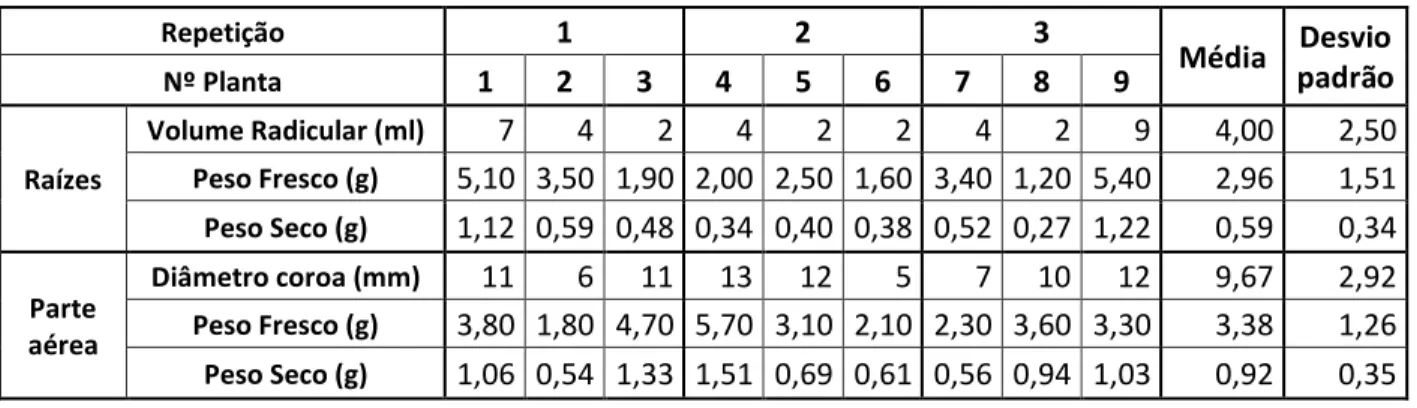
Repetição 1 2 3 Média Desvio padrão Nº Planta 1 2 3 4 5 6 7 8 9 Raízes Volume Radicular (ml) 7 4 2 4 2 2 4 2 9 4,00 2,50 Peso Fresco (g) 5,10 3,50 1,90 2,00 2,50 1,60 3,40 1,20 5,40 2,96 1,51 Peso Seco (g) 1,12 0,59 0,48 0,34 0,40 0,38 0,52 0,27 1,22 0,59 0,34 Parte aérea Diâmetro coroa (mm) 11 6 11 13 12 5 7 10 12 9,67 2,92 Peso Fresco (g) 3,80 1,80 4,70 5,70 3,10 2,10 2,30 3,60 3,30 3,38 1,26 Peso Seco (g) 1,06 0,54 1,33 1,51 0,69 0,61 0,56 0,94 1,03 0,92 0,35
encontrando-se valores de pH entre 6.01 e 6.11, valores dentro da gama ótima para o desenvolvimento do morangueiro. A partir deste momento estes parâmetros foram monitorizados regularmente e não foram encontrados valores foram do intervalo necessário ao bom desenvolvimento da cultura (Gráfico 4).
Gráfico 4 Evolução dos valores de CE, pH e T ao longo do período experimental
Os valores pH e CE mantiveram-se constantes e dentro dos valores recomendados ao longo de todo o período experimental (33 dias), por isso, a solução nutritiva não foi substituída.
5.2. Fase 1
Figura 10 Comparação do ensaio entre os dias 1 e 11 de fevereiro de 2017
5.2.1 Parâmetros de biomassa
Nesta fase, o volume radicular foi significativamente menor nas plantas sem Fe e significativamente maior para as plantas do tratamento Fe50. A partir dos resultados podemos ordenar os tratamentos de acordo com o nível de significância calculado:
Fe0 < Fe200 < Fe150 < Fe10 < Fe100 < Fe50
Em relação ao peso das raízes, as plantas correspondentes ao tratamento Fe50 apresentam resultados significativamente superiores aos outros tratamentos, tanto em peso fresco (PF)
0,00 2,00 4,00 6,00 8,00 10,00 12,00 14,00 16,00 18,00 20,00
CE, pH e T
CE (dS/cm) pH Temperatura (°C)como em peso seco (PS). Em relação ao PF, os tratamentos Fe0 e Fe200 tiveram resultados significativamente menores que os restantes tratamentos. No entanto, em PS, apenas o tratamento Fe0 tem resultados significativamente menores que os restantes, embora seja seguido pelo tratamento Fe200 (Tabela 5).
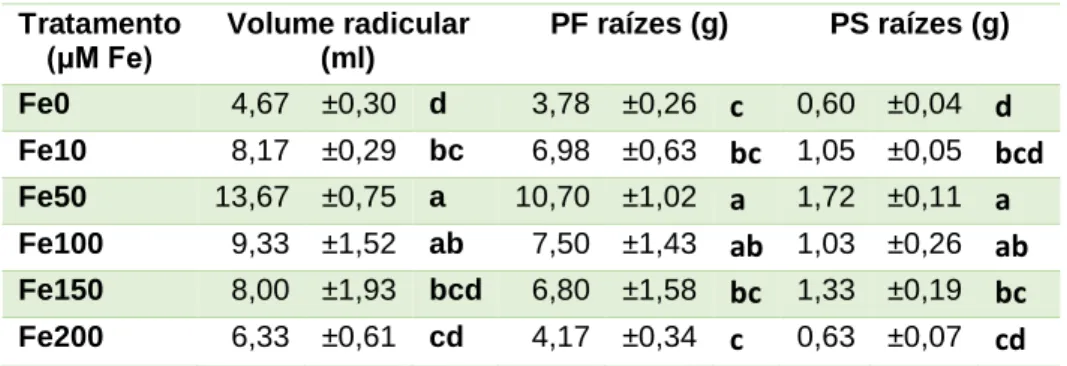
Tabela 5 Média, desvio padrão da média e significância relativo aos parâmetros de biomassa avaliados em relação à raiz: volume radicular, peso seco (PS) e peso fresco (PF)
Tratamento
(μM Fe) Volume radicular (ml)
PF raízes (g) PS raízes (g) Fe0 4,67 ±0,30 d 3,78 ±0,26 c 0,60 ±0,04 d Fe10 8,17 ±0,29 bc 6,98 ±0,63 bc 1,05 ±0,05 bcd Fe50 13,67 ±0,75 a 10,70 ±1,02 a 1,72 ±0,11 a Fe100 9,33 ±1,52 ab 7,50 ±1,43 ab 1,03 ±0,26 ab Fe150 8,00 ±1,93 bcd 6,80 ±1,58 bc 1,33 ±0,19 bc Fe200 6,33 ±0,61 cd 4,17 ±0,34 c 0,63 ±0,07 cd
Quanto ao diâmetro da coroa, observam-se valores significativamente menores no caso dos tratamentos Fe0 e Fe200, enquanto os tratamentos Fe10 e Fe50 apresentam resultados significativamente maiores que os restantes. Em relação ao PF, os resultados do tratamento Fe50 são significativamente maiores que todos os outros. Em PS este resultado mantém-se para o tratamento Fe50, sendo também de salientar que para os tratamentos Fe0 e Fe200 os valores medidos são significativamente menores que os dos tratamentos Fe10, Fe100 e Fe150 (Tabela 6).
Tabela 6 Média, desvio padrão da média e significância relativo aos parâmetros de biomassa avaliados em relação à coroa: diâmetro da coroa, peso seco (PS) e peso fresco (PF).
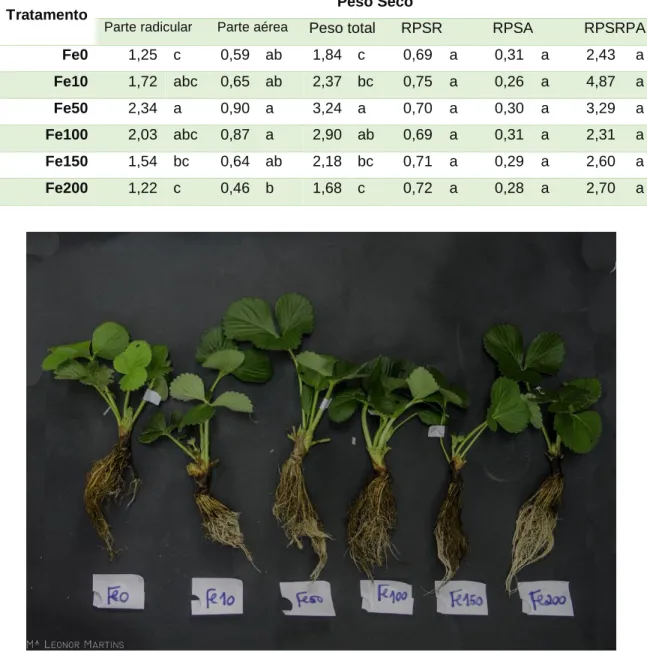
No que diz respeito às folhas, verifica-se que nas folhas novas (FN) do tratamento Fe50 o PF é significativamente maior que os restantes tratamentos e no tratamento Fe100 foram obtidas pesagens de valores significativamente menores do que todos os outros tratamentos. No entanto, em PS nenhuma diferença foi encontrada entre tratamentos (Tabela 7).
Nas folhas velhas (FV), quando pesadas em fresco, foram encontrados valores significativamente maiores nos tratamentos Fe50 e Fe100 e significativamente menores no tratamento Fe200. Em PS, o tratamento Fe100 continuou a ser significativamente maior que os restantes incluindo o Fe50, e o Fe200 manteve-se significativamente menor (Tabela 7).
Tratamento
(μM Fe) Diâmetro da coroa
PF coroa PS coroa Fe0 8,99 ±0,31 b 2,79 ±0,17 b 0,69 ±0,05 b Fe10 11,67 ±0,71 a 4,83 ±0,91 b 1,12 ±0,21 ab Fe50 11,20 ±1,18 a 7,38 ±1,40 a 1,35 ±0,39 a Fe100 10,42 ±0,42 ab 4,18 ±0,52 b 1,00 ±0,12 ab Fe150 9,92 ±0,76 ab 4,37 ±0,93 b 1,12 ±0,18 ab Fe200 9,08 ±0,42 b 2,85 ±0,37 b 0,67 ±0,12 b