CENTRO DE CIÊNCIAS DA SAÚDE
LABORATÓRIO DE TECNOLOGIA FARMACÊUTICA
“PROF. DELBY FERNANDES DE MEDEIROS”
PROGRAMA DE PÓS-GRADUAÇÃO EM PRODUTOS NATURAIS
E SINTÉTICOS BIOATIVOS
ANA SILVIA SUASSUNA CARNEIRO LÚCIO
ALCALÓIDES AZAFENANTRENOS ISOLADOS DE
Anaxagorea dolichocarpa
SPRAGUE & SANDWITH
(ANNONACEAE)
ALCALÓIDES AZAFENANTRENOS ISOLADOS DE
Anaxagorea dolichocarpa
SPRAGUE & SANDWITH
(ANNONACEAE)
Dissertação apresentada ao Programa de Pós-Graduação em Produtos Naturais e Sintéticos Bioativos do Laboratório de Tecnologia Farmacêutica “Prof. Delby Fernandes de Medeiros” do Centro de Ciências da Saúde da Universidade Federal da Paraíba, em cumprimento às exigências para obtenção do título de Mestre em Farmacoquímica de Produtos Naturais e Sintéticos Bioativos.
ORIENTADOR: Prof. Dr. Josean Fechine Tavares CO-ORIENTADOR: Prof. Dr. José Maria Barbosa Filho
L938a Lúcio, Ana Sílvia Suassuna Carneiro.
Alcalóides azafenantrenos isolados de Anaxagorea dolichocarpa Sprague & Sandwith (Annonaceae) / Ana Sílvia Suassuna Carneiro Lúcio.- João Pesoa, 2011.
121f. : il.
Orientador: Josean Fechine Tavares Co-orientador: José Maria Barbosa Filho Dissertação (Mestrado) – UFPB/CCS/LTF
1. Produtos Naturais. 2. Annonaceae. 3. Anaxagorea –
estudo fitoquímico. 4. Alcalóides. 5. Farmacoquímica.
UFPB/BC CDU: 547.9(043)
ANA SILVIA SUASSUNA CARNEIRO LÚCIO
ALCALÓIDES AZAFENANTRENOS ISOLADOS DE
Anaxagorea dolichocarpa
SPRAGUE & SANDWITH
(ANNONACEAE)
COMISSÃO EXAMINADORA
____________________________________________
Prof. Dr. Josean Fechine Tavares
Doutor em Farmacoquímica de Produtos Naturais e Sintéticos Bioativos Universidade Federal da Paraíba – Campus I
(Orientador)
____________________________________________
Prof. Dr. Jackson Roberto Guedes da Silva Almeida
Doutor em Farmacoquímica de Produtos Naturais e Sintéticos Bioativos Universidade Federal do Vale do São Francisco (UNIVASF)
(Examinador Externo)
____________________________________________
Profa. Dra. Celidarque da Silva Dias
Doutora em Farmacoquímica de Produtos Naturais e Sintéticos Bioativos Universidade Federal da Paraíba – Campus I
Aos meus pais, George e Lúcia, exemplo de força, coragem e superação, que fizeram de mim quem sou e acreditaram em meus sonhos.
À minha querida irmã Priscilla, pelo constante estímulo, incentivo, carinho e força dedicados nos momentos em que mais precisei.
À minha tia Dadá, minha segunda mãe, que sempre me apoiou e esteve presente em todos os momentos desta caminhada.
De tudo ficam três coisas:
A certeza de estarmos sempre começando
A certeza de que é preciso continuar
E a certeza de que podemos ser
Interrompidos antes de terminarmos.
Portanto:
Fazer da interrupção um caminho novo,
Da queda um passo de dança,
Do medo uma escada,
Do sonho uma ponte,
Da procura um encontro.
Saber agradecer é certamente a parte mais importante de cada projeto concretizado. Apenas sendo gratos é que aprendemos a reconhecer o valor do trabalho, da ajuda do outro e o valor do nosso próprio trabalho. Diversas pessoas colaboraram direta ou indiretamente para a realização desse trabalho, com sugestões, ideias, críticas e opiniões. Outros contribuíram com amizade, carinho e afeto, provavelmente os ingredientes mais importantes de um bom trabalho. Dessa forma, preciso agradecer a todas as pessoas que se fizeram presentes, que se preocuparam, que foram solidários, que torceram por mim, sempre na certeza de que sozinhos nada faríamos, nada seríamos.
Agradecimento primordial não poderia deixar de ser Àquele, que me permitiu sonhar de uma forma que alargasse meus horizontes. Agradeço Àquele, que me permitiu tudo isso, ao longo de toda a minha vida. É a Ele que dirijo minha maior gratidão. Deus, mais do que me criar, deu propósito à minha vida. Vem Dele tudo o que sou, o que tenho e o que espero. Mais importante do que o lugar que ocupas em mim, é a intensidade de tua presença em tudo que faço.
Aos meus amados pais, George e Lúcia, meus melhores amigos, por acreditarem em mim sempre, por me apoiarem em tudo que fiz nessa vida, por me perdoar pelos erros cometidos, por me repreender e aconselhar quando preciso, por ter me dado condições de estudar desde sempre, por me amar incondicionalmente.
À minha irmã, minha outra metade, Priscilla, minha companheira fiel, amiga de todas as horas, agradeço pelo amor e carinho, pelo apoio, pela ajuda sempre, pelas conversas, pelos conselhos e ensinamentos tão preciosos.
À minha segunda mãe, Dadá, por ter ajudado meus pais na minha criação, pelo amor, pela disponibilidade em ajudar sempre, pelo carinho, pelos conselhos e os valiosos ensinamentos de vida.
e apoio em todos os momentos de minha vida.
Aos meus orientadores: Josean Fechine Tavares, pela orientação, pelos ensinamentos, pela paciência e pela amizade e José Maria Barbosa Filho, por acreditar em mim desde a iniciação científica, pelo apoio sempre que precisei, pelos valiosos ensinamentos, contribuindo para meu crescimento profissional, pela ótima convivência e pela confiança depositada no meu trabalho.
Ao amigo, Jackson Roberto Guedes da Silva Almeida (ou simplesmente Jackson), por me apresentar ao mundo da fitoquímica. Pelo constante incentivo para seguir o caminho da pesquisa. Pela amizade declarada e constante, por acreditar sempre que sou capaz, pelas inúmeras ajudas sempre que precisei, pela confiança no meu trabalho, pelo exemplo de profissional e pessoa.
À amiga, Xirley Pereira Nunes, pela amizade, pelos valiosos ensinamentos, pelas orientações na bancada e para a vida.
Aos meus amigos de graduação e pós-graduação: Daysianne, pela amizade, pela companhia constante na iniciação científica e na graduação, dividindo comigo momentos de alegria e momentos difíceis. Fábio, pela amizade, por se disponibilizar a ajudar sempre, pela sinceridade quando necessário, por dividir seus conhecimentos, pela companhia, pelas conversas e pelos valiosos conselhos.
Às amigas, Camila, Vivianne, Hellane, Helóisa e Karine, pela amizade que encontrei em vocês, pelo incentivo, pelos momentos de apoio incondicional, pelos momentos de diversão, pela companhia, pelas conversas e pela ajuda.
À minha amiga e fiel companheira, Jacqueline, pela amizade, pelo companheirismo, por estar sempre junto comigo durante essa caminhada, tantos nos momentos felizes, como nos momentos de dificuldade. Por me defender quando preciso e me repreender quando necessário.
Ao amigo Raimundo Nonato, pela ajuda sempre necessária no laboratório, pelas conversas de todas as manhãs, pelo carinho, pela companhia, pela amizade, pelos conselhos, por dividir os problemas e comemorar as alegrias.
Ao amigo Vicente Carlos, pela obtenção dos espectros de RMN, pela amizade e pelo apoio.
Aos meus amigos da graduação, Ana Paula, Mayrielle, Hariad, Fernanda, Ritta, George, Igor, Max, Vitor e Bruna, por me apoiarem nesse sonho da pós-graduação desde a iniciação científica e pós-graduação, pela amizade, pelo carinho e apoio sempre.
A todos os colegas da turma de mestrado, em especial, a Thyago Queiroz,
Camila Montenegro, Aline Xavier, Fabíola Lélis e Gedson Rodrigues, obrigada pelo agradável convívio e troca de conhecimentos.
Aos meus companheiros de mestrado da farmacoquímica, em especial, Paula Ferreira, Ingrid Melo e Lázaro Brito, por dividirem comigo todas as dificuldades, e comemorar todas as alegrias, pelo agradável convívio e pela troca de conhecimentos.
Às amigas Gabriela, Analúcia, Thaísa e Danielle pela amizade, pelo incentivo constante, pelas conversas, pelos conselhos e pelo carinho.
Aos alunos de iniciação científica, Laiane, Roseana, Marianna, Yuri, e
Thamires, pela amizade e por todo o apoio que sempre me deram.
A todos os colegas do laboratório, em especial, Fabiana, Sandro, Cínthia,
Ania, Sócrates, Narlize, Alexsandro, Steno, Madalena e Ricardo, pela ótima convivência, pela ajuda e apoio, e pela troca constante de conhecimentos.
Aos professores da Pós-Graduação, em especial, a Marcelo Sobral,
Bagnólia Araújo, Celidarque Dias, Fátima Vanderlei e Marianna Vieira Sobral,
A todos os funcionários do LTF e da Pós-Graduação em Produtos Naturais e Sintéticos Bioativos, em especial a Tânia Alves e Caroline Mangueira e a todos os seguranças e funcionários da limpeza e da manutenção.
À Universidade Federal da Paraíba e ao Conselho Nacional de desenvolvimento Científico e Tecnológico (CNPq) pelo apoio financeiro concedido.
A todos
Muito obrigada!
LÚCIO, Ana Silvia Suassuna Carneiro. Alcalóides azafenantrenos isolados de
Anaxagorea dolichocarpa Sprague & Sandwith (ANNONACEAE) 121 p.
Dissertação (Mestrado em Produtos Naturais e Sintéticos Bioativos) –Laboratório de Tecnologia Farmacêutica “Prof. Delby Fernandes de Medeiros”, Universidade Federal da Paraíba, João Pessoa, 2011.
A família Annonaceae é constituída por aproximadamente 135 gêneros e 2500 espécies distribuídas principalmente pelas regiões tropicais e subtropicais do globo terrestre. No Brasil, a família Annonaceae compreende 26 gêneros, dentre esses, encontramos o gênero Anaxagorea, possuindo cerca de 26 espécies distribuídas na América Central e América do Sul. Entre as espécies, Anaxagorea dolichocarpa Sprague & Sandwith é a espécie neotropical de Annonaceae mais comum e bem distribuída. O presente trabalho descreve os resultados do estudo fitoquímico de Anaxagorea dolichocarpa Sprague & Sandwith. O material botânico foi submetido a processos de extração, partição e cromatografia para isolamento dos constituintes químicos. A estrutura química dos mesmos foi determinada por métodos espectroscópicos de Infravermelho e Ressonância Magnética Nuclear de 1H e 13C uni e bidimensionais, espectrometria de massas e comparações com modelos da literatura. Da fase hexânica foram isolados dois alcalóides azafenantrenos: eupolauramina, descrito pela primeira vez na família Annonaceae e imbilina 1, descrito pela primeira vez no gênero Anaxagorea. Da fase clorofórmica foi isolado o alcalóide azafenantreno sampangina, descrito pela primeira vez no gênero Anaxagorea. Os resultados obtidos nesse trabalho contribuíram para o estudo fitoquímico de Anaxagorea dolichocarpa Sprague & Sandwith e para o conhecimento quimiotaxonômico do gênero Anaxagorea e da família Annonaceae.
LÚCIO, Ana Silvia Suassuna Carneiro. Azaphenanthrenes alkaloids isolated from
Anaxagorea dolichocarpa Sprague & Sandwith (ANNONACEAE) 121 p.
Dissertação (Mestrado em Produtos Naturais e Sintéticos Bioativos) –Laboratório de Tecnologia Farmacêutica “Prof. Delby Fernandes de Medeiros”, Universidade Federal da Paraíba, João Pessoa, 2011.
The Annonaceae family consists of approximately 135 genus and 2500 species distributed by tropical and subtropical regions of the world. In Brazil, the Annonaceae family comprises 26 genus, among these we find the genus Anaxagorea, with about 26 species distributed in Central America and South America. Among this species, Anaxagorea dolichocarpa Sprague & Sandwith is the Neotropical Annonaceae most common and well distributed. This work describes the results of phytochemical study of Anaxagorea dolichocarpa Sprague & Sandwith. The plant material was subjected to extraction processes, and partition chromatography for isolation of chemical constituents. The chemical structures was determined by spectroscopic methods, such as: Infrared, 1H and 13C Nuclear Magnetic Resonance, mass spectrometry and comparisons with literature. Of the hexane extract were isolated two alkaloids azaphenanthrenes: eupolauramine, described for the first time in the Annonaceae family and imbiline 1, described for the first time in the genus Anaxagorea. From the chloroform extract was isolated the alkaloid azaphenanthrene sampangine, described for the first time in the genus Anaxagorea. The results of this work contributed to the phytochemical study of Anaxagorea dolichocarpa Sprague & Sandwith to known chemotaxonomy of the genus Anaxagorea and the Annonaceae family.
Figura 1. Mapa de distribuição geográfica da família Annonaceae ... 28
Figura 2. Frutos de espécies da família Annonaceae: (a) Duguetia lanceolata (Pindaíba), (b) Annona muricata (Graviola) e (c) Rollinia mucosa (Biribá)... 29
Figura 3. Algumas substâncias isoladas de espécies da família Annonaceae.. 31
Figura 4. Mapa de distribuição geográfica do gênero Anaxagorea... 32
Figura 5. Estrutura química de algumas substâncias isolados de espécies do gênero Anaxagorea... 34
Figura 6. Mapa de distribuição geográfica da espécie Anaxagorea dolichocarpa... 35
Figura 7. Mapa de distribuição geográfica da espécie Anaxagorea dolichocarpa na Paraíba... 35
Figura 8. Anaxagorea dolichocarpa. A) Ramo com flor e botões florais. B) Estames, vista ventral. B’) Estames vista laretal. C) Carpelo, vista ventral. C’) Carpelo, vista lateral. D) Fruto... 36
Figura 9. Anaxagorea dolichocarpa Sprague & Sandwith. (11a) Folhas e frutos, (11b) Frutos, (11c) Caule e Frutos e (11d) Flor... 37
Figura 10. Tipos de alcalóides isoquinolínicos encontrados em espécies da família Annonaceae... 38
Figura 11. Esquema sucinto da biossíntese de alcalóides aporfínicos... 41
Figura 12. Esquema da biossíntese de alcalóides azafenantrenos... 42
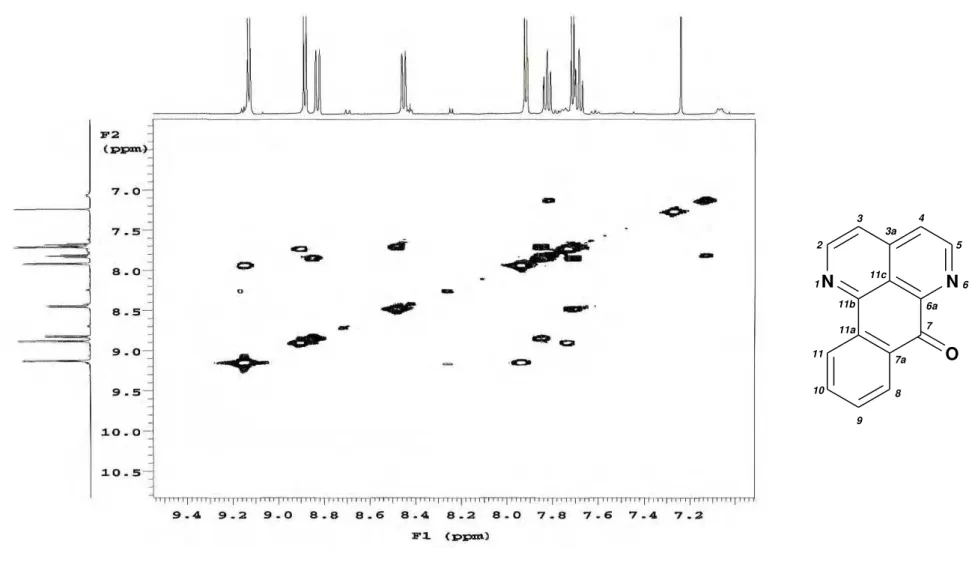
Figura 13. Espectro de Massas de Ad-1... 61
Figura 14. Espectro na região do Infravermelho de Ad-1 (Pastilha de KBr)... 62
Figura 15. Espectro de RMN de 13C - APT de Ad-1 (CDCl 3, 125 MHz)... 63
Figura 16. Expansão do espectro de RMN de 13C de Ad-1 (CDCl 3, 125 MHz)... 64
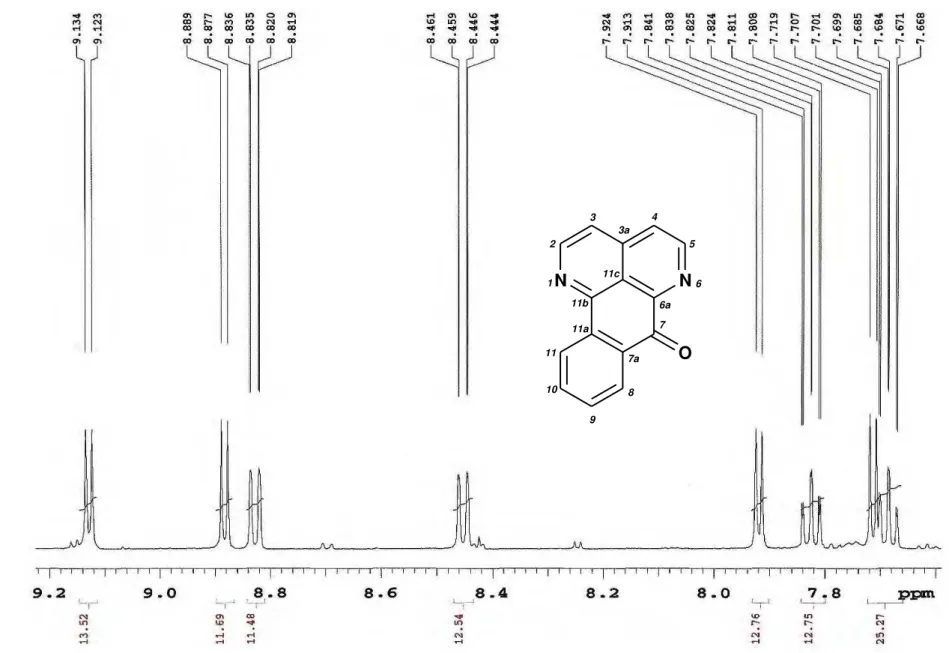
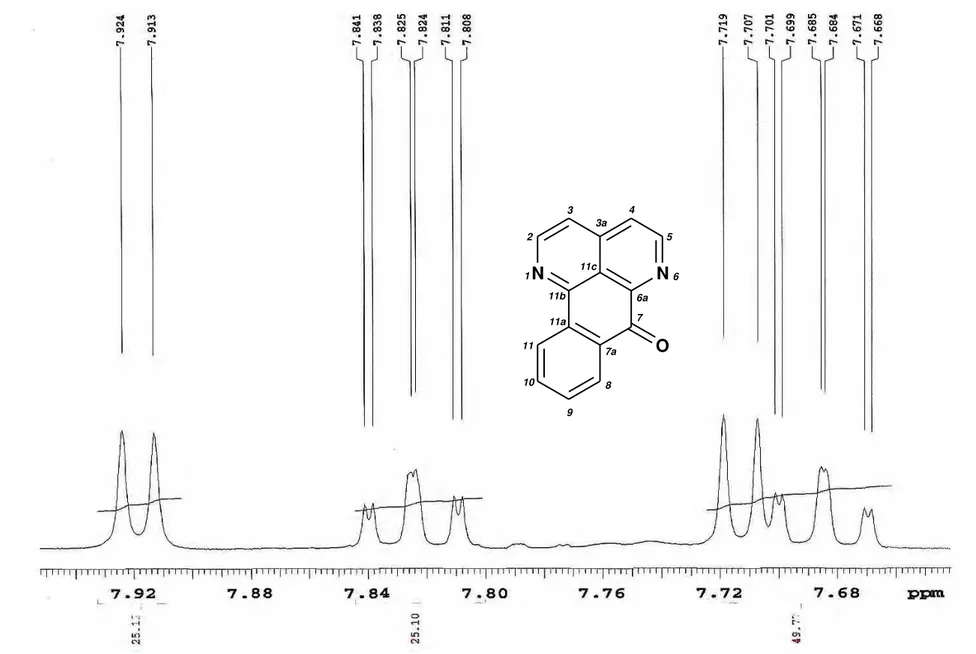
Figura 17. Espectro de RMN de 1H de Ad-1 (CDCl 3, 500 MHz)... 65
Figura 20. Expansão do espectro de RMN de 1H de Ad-1 na região de 9,2 a 8,3 ppm
(CDCl3, 500 MHz)... 68
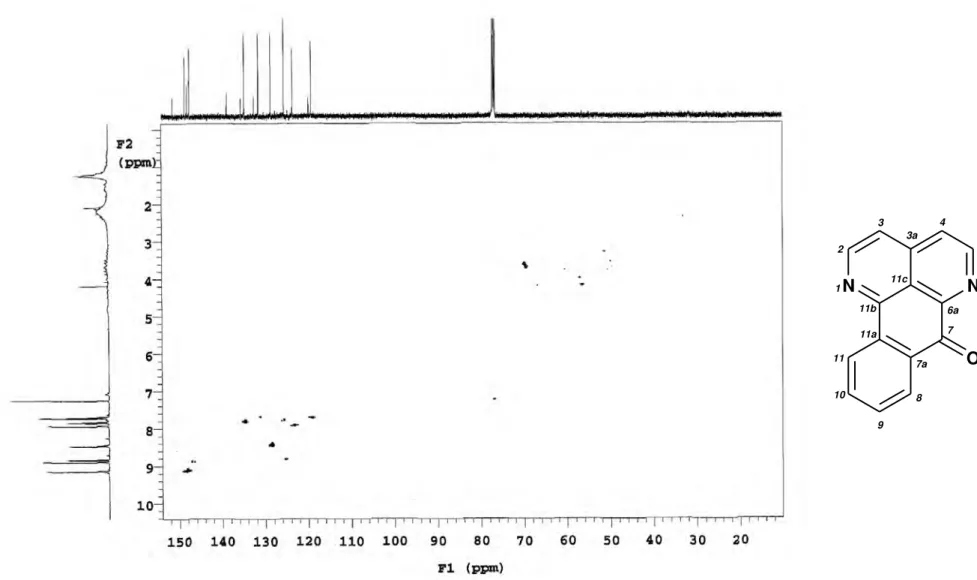
Figura 21. Espectro de correlações 1H x 13C -
JCH - HMQC de Ad-1 (CDCl3, 500 e
125 MHz)... 69
Figura 22. Expansão do espectro de correlações 1H x 13C -
JCH - HMQC de Ad-1 na
região de 150 a 122 ppm (CDCl3, 500 e 125 MHz)... 70
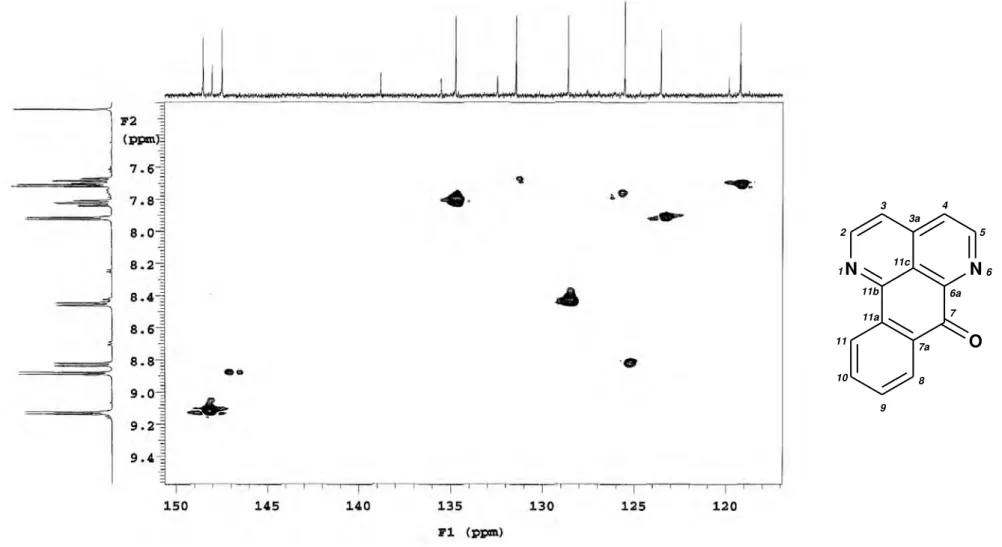
Figura 23. Espectro de correlações 1H x 13C-n
JCH (n=2 e 3) - HMBC de Ad-1 (CDCl3,
500 e 125 MHz)... 71
Figura 24. Expansão do espectro de correlações 1H x 13C-n
JCH (n=2 e 3) - HMBC de
Ad-1 na região de 152 a 121ppm (CDCl3, 500 e 125 MHz)... 72
Figura 25. Expansão do espectro de correlações 1H x 13C-n
JCH (n=2 e 3) - HMBC de
Ad-1 na região de 149 a 121ppm (CDCl3, 500 e 125 MHz)... 73
Figura 26. Espectro de correlação homonuclear COSY de Ad-1 (CDCl3, 500 MHz)... 74
Figura 27. Expansão do espectro de correlação homonuclear COSY de Ad-1 na região de 9,5 a 7,1 ppm (CDCl3, 500 MHz)... 75
Figura 28. Espectro de Massas de Ad-2... 80
Figura 29. Espectro na região do Infravermelho de Ad-2 (Pastilha de KBr)... 81
Figura 30. Espectro de RMN de 1H de Ad-2 (CDCl
3, 500 MHz)... 82
Figura 31. Expansão do espectro de RMN de 1H de Ad-2 na região de 9,2 a 7,6 ppm
(CDCl3, 500 MHz)... 83
Figura 32. Espectro de RMN de 13C - APT de Ad-2 (CDCl
3, 125 MHz)... 84
Figura 33. Expansão do espectro de RMN de 13C de Ad-2 (CDCl
3, 125 MHz)... 85
Figura 34. Espectro de correlações 1H x 13C -
JCH - HMQC de Ad-2 (CDCl3, 500 e
125 MHz)... 86
Figura 35. Expansão do espectro de correlações 1H x 13C -
JCH - HMQC de Ad-2 na
região de 152 a 124 ppm (CDCl3, 500 e 125 MHz)... 87
Figura 36. Espectro de correlações 1H x 13C-n
JCH (n=2 e 3) - HMBC de Ad-2 (CDCl3,
500 e 125 MHz)... 88
Figura 37. Expansão do espectro de correlações 1H x 13C-n
JCH (n=2 e 3) - HMBC de
região de 9,3 a 7,0 ppm (CDCl3, 500 MHz)... 91
Figura 40. Espectro na região do Infravermelho de Ad-3 (Pastilha de KBr)... 95
Figura 41. Espectro de RMN de 1H de Ad-3 (CDCl
3, 500 MHz)... 96
Figura 42. Expansão do espectro de RMN de 1H de Ad-3 na região de 9,2 a 7,6 ppm
(CDCl3, 500 MHz)... 97
Figura 43. Espectro de RMN de 13C - APT de Ad-3 (CDCl
3, 125 MHz)... 98
Figura 44. Expansão do espectro de RMN de 13C de Ad-3 (CDCl
3, 125 MHz)... 99
Figura 45. Expansão do espectro de RMN de 13C de Ad-3 (CDCl
3, 125 MHz)... 100
Figura 46. Espectro de correlações 1H x 13C -
JCH - HMQC de Ad-3 (CDCl3, 500 e
125 MHz)... 101
Figura 47. Expansão do espectro de correlações 1H x 13C -
JCH - HMQC de Ad-3 na
região de 134 a 116 ppm (CDCl3, 500 e 125 MHz)... 102
Figura 48. Expansão do espectro de correlações 1H x 13C -
JCH - HMQC de Ad-3 na
região de 67 a 34 ppm (CDCl3, 500 e 125 MHz)... 103
Figura 49. Espectro de correlações 1H x 13C-n
JCH (n=2 e 3) - HMBC de Ad-3 (CDCl3,
500 e 125 MHz)... 104
Figura 50. Expansão do espectro de correlações 1H x 13C-n
JCH (n=2 e 3) - HMBC de
Ad-3 na região de 152 a 117ppm (CDCl3, 500 e 125 MHz)... 105
Figura 51. Expansão do espectro de correlações 1H x 13C-n
JCH (n=2 e 3) - HMBC de
Ad-3 na região de 131 a 118 ppm (CDCl3, 500 e 125 MHz)... 106
Figura 52. Espectro de correlação homonuclear COSY de Ad-3 (CDCl3, 500 MHz)... 107
Tabela 1. Deslocamentos químicos, tipos de sinal e correlações para Ad-1, verificados nos espectros de RMN 1H e 13C (500 e 125 MHz, respectivamente) uni e bidimensionais em CDCl3 e comparação
com os dados de RMN de 13C da literatura (ORABI et al., 1999)... 60
Tabela 2. Deslocamentos químicos, tipos de sinal e correlações para Ad-2, verificados nos espectros de RMN 1H e 13C (500 e 125 MHz, respectivamente) uni e bidimensionais em CDCl3 e comparação
com os dados de RMN de 13C da literatura (KITAHARA et
al.,2003)... 79
Tabela 3. Deslocamentos químicos, tipos de sinal e correlações para Ad-3, verificados nos espectros de RMN 1H e 13C (500 e 125 MHz, respectivamente) uni e bidimensionais em CDCl3 e comparação
com os dados de RMN de 13C da literatura (CARROLL; TAYLOR,
Quadro 1. Constituintes químicos de espécies do gênero Anaxagorea... 33
Quadro 2. Sistemas de eluições utilizados no fracionamento cromatográfico da fase hexânica do extrato etanólico bruto de Anaxagorea dolichocarpa Sprague & Sandwith... 50
Esquema 1. Obtenção e particionamento do extrato etanólico bruto de Anaxagorea dolichocarpa Sprague & Sandwith... 48
Esquema 2. Fracionamento cromatográfico da fase hexânica do extrato etanólico bruto de Anaxagorea dolichocarpa Sprague & Sandwith... 51
AcOEt Acetato de Etila
APT Attached Proton Test
CC Cromatografia em coluna
CCDA Cromatografia em Camada Delgada Analítica
CCDP Cromatografia em Camada Delgada Preparativa
CDCl3 Clorofórmio deuterado
CHCl3 Clorofórmio
cm Centímetro
compr. Comprimento
COSY Correlation Spectroscopy
d Dupleto
dd Duplo dupleto
ddd Duplo duplo dupleto
EEB Extrato Etanólico Bruto
EM Espectrometria de massas
EtOH Etanol
H2O Água
HMBC Heteronuclear Multiple Bond Correlation
HMQC Heteronuclear Multiple Quantum Correlation
Hz Hertz
IV Infravermelho
J Constante de acoplamento
KBr Brometo de potássio
kg quilograma
LTF Laboratório de Tecnologia Farmacêutica
LMCA Laboratório Multiusuário de Caracterização e Análise
MeOH Metanol
m Multipleto
mg Miligrama
MHz Megahertz
mm Milímetro
NOESY Nuclear Overhauser Enhancement Spectroscopy
pág. Página
ppm Partes por milhão
Rf Fator de Retenção
RMN 13C Ressonância Magnética Nuclear de Carbono 13
RMN 1H Ressonância Magnética Nuclear de Hidrogênio
s Simpleto
UFPB Universidade Federal da Paraíba
UV Ultravioleta
δ Deslocamento químico em ppm
μg micrograma
1. INTRODUÇÃO... 22
1.1. Plantas medicinais: alternativa terapêutica e desenvolvimento de novos fármacos... 22
2. OBJETIVOS ... 26
2.1. Objetivo geral ... 26
2.2. Objetivos específicos ... 26
3. FUNDAMENTAÇÃO TEÓRICA ... 28
3.1.Annonaceae Jussieu: aspectos farmacobotânicos, químicos e farmacológicos... 28
3.2. Considerações sobre o gênero Anaxagorea A.St-Hil... 32
3.3. Considerações sobre Anaxagorea dolichocarpa Sprague & Sandwith ... 35
3.4. Alcalóides de Annonaceae... 38
3.4.1. Alcalóides Aporfínicos ... 39
3.4.1.1. Biossíntese dos alcalóides aporfínicos... 40
4. PARTE EXPERIMENTAL... 44
4.1. Estudo fitoquímico... 44
4.1.1. Coleta e identificação do material botânico... 44
4.1.2. Métodos de análise... 44
4.1.2.1. Métodos cromatográficos... 44
4.1.2.2. Métodos espectrométricos... 45
4.1.2.2.1. Espectroscopia no infravermelho... 45
4.1.2.2.2. Espectroscopia de Ressonância Magnética Nuclear... 45
4.1.2.2.3. Espectrometria de massas... 46
4.1.2.2.4. Ponto de fusão... 46
4.1.3. Processamento das cascas do caule de Anaxagorea dolichocarpa... 47
4.1.4. Obtenção do extrato etanólico bruto (EEB)... 47
4.1.5. Particionamento do extrato etanólico bruto... 47
4.1.6. Fracionamento cromatográfico da fase hexânica... 49
4.1.7. Fracionamento cromatográfico da fase clorofórmica... 52
5. RESULTADOS E DISCUSSÃO ... 56
5.1. Determinação estrutural de Ad-1... 57
5.2. Determinação estrutural de Ad-2... 76
5.3. Determinação estrutural de Ad-3... 92
5.4. Constantes físicas e dados espectroscópicos dos constituintes químicos isolados... 109
6. CONSIDERAÇÕES FINAIS E PERSPECTIVAS... 113
1. INTRODUÇÃO
1.1 Plantas medicinais: alternativa terapêutica e desenvolvimento de novos fármacos
O processo evolutivo proporcionou ao longo do tempo diversos avanços. Dentre estes está a seleção das plantas não só com fins alimentícios, mas como também para o alívio de inúmeros males e doenças. Frente a isso muitos povos passaram a dominar o conhecimento do uso de plantas, perpetuando-se até os dias atuais por meio da utilização consciente de medicamentos à base de ervas medicinais (FERREIRA ; PINTO, 2010).
A utilização de plantas medicinais está em contínua expansão em nível mundial. A crescente busca por agentes terapêuticos derivados de espécies vegetais justifica-se pelo surgimento de doenças ainda sem tratamento apropriado, e pelo crescimento do conhecimento científico a respeito dos fitoterápicos, como importantes alternativas terapêuticas (GUARRERA, 2005).
Assim o uso de plantas medicinais tem ressurgido como uma opção medicamentosa bem aceita e acessível aos povos, e no caso do Brasil é adequada para as necessidades locais de centenas de municípios brasileiros no atendimento primário à saúde. A expansão da fitoterapia pode ser atribuída a diversos fatores tais como: aos efeitos adversos de fármacos sintéticos, a preferência dos consumidores por tratamentos “naturais”, a validação científica das propriedades farmacológicas de espécies vegetais, o desenvolvimento de novos métodos analíticos colocados à disposição do controle de qualidade, o desenvolvimento de novas formas de preparações e administrações de produtos fitoterápicos, um melhor conhecimento químico, farmacológico e clínico das drogas vegetais e seus derivados, além, também, do menor custo se comparado com os fármacos sintéticos (BRAZ FILHO, 2010).
todos os testes clínicos, ela servirá de modelo para a síntese de novos candidatos a fármaco (VEIGA-JUNIOR et al., 2005).
Para aumentar as chances de sucesso na descoberta de novas moléculas com propriedades farmacológicas tem-se levado em conta uma aproximação etnofarmacológica com a diversidade apresentada pelas áreas tropicais, relacionando assim, as propriedades terapêuticas das plantas relatadas pela população com os estudos científicos, visto que a convivência e o aprendizado com os mais diferentes grupos étnicos trouxeram valiosas contribuições para o desenvolvimento da pesquisa em produtos naturais (STEPP, 2004)
Embora existam, nos dias atuais, diversas estratégias e metodologias disponíveis para que se possa sintetizar e descobrir novos fármacos, a Química de Produtos Naturais representa uma destas alternativas de sucesso, historicamente privilegiada. Muitos metabólitos secundários ou especiais se notabilizaram como matérias-primas valiosas para a produção de inúmeros medicamentos contem-porâneos (BARREIRO; BOLZANI, 2009).
Apesar dos muitos desafios enfrentados nas últimas décadas, a Química de Produtos Naturais tem tido avanços importantes com a intersecção com outras áreas afins como Bioquímica, Biologia Molecular, Etnofarmacologia, Imunologia, e de tecnologias inovadoras de análise e elucidação estrutural como a ressonância magnética nuclear e espectroscopia de massas (FERREIRA ; PINTO, 2010).
No processo de embasamento científico de uma medicina alternativa, a química de produtos naturais se destaca ao permitir o conhecimento estrutural dos metabólitos secundários responsáveis pelos efeitos farmacológicos das plantas medicinais. Em suas inúmeras atribuições, engloba o isolamento e a identificação dos constituintes químicos bioativos, atuando como fonte de novos fármacos, e realiza pesquisas para validação de medicamentos de origem vegetal, sendo assim, a base essencial para o direcionamento de estudos farmacológicos (SOUZA; SILVA, 2006).
Assim, o isolamento e a determinação estrutural de substâncias orgânicas produzidas pelo metabolismo secundário de organismos vivos representam importância fundamental para a fitoterapia e o desenvolvimento científico da própria química de produtos naturais, contribuindo para o avanço de outras atividades científicas e tecnológicas no país (LEMOS et al., 2007).
A busca de novos agentes farmacologicamente ativos através da triagem de fontes naturais levou à descoberta de muitos fármacos úteis clinicamente e que desempenham um importante papel no tratamento de várias doenças (CRAGG et al., 2005).
2. OBJETIVOS
2.1. Objetivo geral
Contribuir para o estudo quimiotaxonômico do gênero Anaxagorea, através do estudo químico da espécie Anaxagorea dolichocarpa Sprague & Sandwith.
2.2. Objetivos específicos
Analisar fitoquimicamente as cascas do caule de Anaxagorea dolichocarpa Sprague & Sandwith, através de métodos de extração, isolamento e purificação dos constituintes químicos;
Identificar e/ou elucidar a estrutura dos constituintes químicos isolados através de técnicas de espectroscopia de infravermelho, espectrometria de massas e ressonância magnética nuclear de 1H e 13C (uni e bidimensionais);
3. FUNDAMENTAÇÃO TEÓRICA
3.1. Annonaceae Jussieu: aspectos farmacobotânicos, químicos e farmacológicos
A família Annonaceae, descrita por Antoine Laurent de Jussieu, apresenta uma combinação de caracteres marcantes, é uma das mais uniformes tanto do ponto de vista anatômico como estrutural. É constituída por aproximadamente 135 gêneros e 2500 espécies distribuídas principalmente pelas regiões tropicais e subtropicais do globo terrestre (Figura 01), ocorrendo como árvores aromáticas, arvoretas ou lianas (CHATROU et al., 2004).
Sobre a distribuição da família Annonaceae no mundo, 50 gêneros são encontrados na Ásia e Austrália e 34 gêneros ocorrem na África e América do Sul (BARROSO, 1978). No Brasil, a família Annonaceae compreende 26 gêneros e aproximadamente 260 espécies, desempenhando um importante papel na composição da vegetação (MAAS et al., 2001).
Figura 1. Mapa de distribuição geográfica da família Annonaceae, representado em verde. (Adaptado de: http://www.tropicos.org/Name/42000007?tab=maps, Acesso em: 14 de Janeiro de 2011).
e dísticas, com pecíolo reduzido e sem estípulas, a venação é pinada e podem ocorrer glândulas translúcidas na lâmina foliar (JUDD et al. 1999, SOUZA & LORENZI 2005). As inflorescências são determinadas, algumas vezes reduzidas a uma única flor, terminal ou axilar (JUDD et al. 1999, PONTES et al. 2004, SOUZA & LORENZI, 2005). De acordo com Ribeiro et al. (1999), as Annonaceae podem ser reconhecidas pelo odor forte exalado quando se cortam tronco ou ramos, pela presença de fibras longas e resistentes na casca e pela filotaxia dística.
As espécies desta família destacam-se por apresentar importância econômica considerável e por serem empregadas na medicina tradicional. Muitas espécies, principalmente dos gêneros Annona, Rollinia e Duguetia, são cultivadas em função de possuírem frutos comestíveis e saborosos (Figura 2) tais como: graviola (Annona muricata), pinha, fruta-do-conde ou ata (Annona squamosa), biribá (Rollinia mucosa), pindaíba (Duguetia lanceolata) e cherimólia (Annona cherimólia) (HUTCHINSON, 1964; LEBOEUF et al., 1982; PAULINO NETO; OLIVEIRA, 2006).
Figura 2. Frutos de espécies da família Annonaceae: (a) Duguetia lanceolata (Pindaíba), (b) Annona
muricata (Graviola) e (c) Rollinia mucosa (Biribá).
Outras espécies são utilizadas como plantas ornamentais (Xylopia brasiliensis e Cananga odorata) e na obtenção de perfumes, óleos comestíveis, sabões, álcool e papel (HOEHNE et al., 1941; HUTCHINSON, 1964; LEBOEUF et al., 1982). Algumas espécies, como Bocageopsis spp, Fusaea longifolia, Guatteria megalophylla, Guatteria stipitata e Oxandra polyantha, são de grande importância na indústria (MURILO; RESTREPO, 2000; SÁNCHEZ, 1997).
A família Annonaceae é quimicamente uma das famílias de plantas tropicais menos estudadas. Entretanto, investigações fitoquímicas e, em menor extensão, farmacológicas sobre membros desta família vêm se intensificando nos últimos http://www6.ufrgs.br/fitoecologia/florars/open_sp.php?img=2256 http://www.authenticmaya.com/images/arboles/annona-muricata.jpg http://picasaweb.google.com/lh/photo/3bKfiFu8Tu4NIfmLLhVlhA
anos. Vários estudos têm demonstrado grande quantidade de compostos de natureza química diversificada nas mais variadas partes da planta. Os principais grupos de compostos químicos presentes em extratos preparados de cascas (CHEN et al., 2000), folhas e frutos (CHANG et al., 1998) são os alcalóides, as acetogeninas e os diterpenos (CHEN et al., 2004; OLIVEIRA et al., 2002). A figura 3 (pág.31) mostra algumas substâncias isoladas de espécies de Annonaceae.
Inicialmente os constituintes químicos de Annonaceae foram divididos em dois grupos: substâncias alcaloídicas e não alcaloídicas, o que demonstra a importância dada inicialmente à presença de alcalóides. De fato, até 1982, das 371 substâncias isoladas da família, 225 eram alcalóides, mas o perfil químico de Annonaceae sugere um grande número de constituintes não alcaloídicos (LEBOEUF et al., 1982).
Os metabólitos secundários isolados de espécies de Annonaceae apresentam diversas atividades biológicas comprovadas por estudos científicos, entre essas podemos destacar os flavonóides com propriedades antimicrobiana e antitumoral; diterpenos, com atividades antitumoral, antibacteriana e antifúngica; acetogeninas com atividades antitumoral, antibacteriana, antiparasitária e inseticida e os alcalóides com propriedades antiparasitária, antitumoral, inseticida e antibacteriana (ALALI et al., 1999; LEBOEUF et al., 1982). Isso justifica o grande uso das espécies dessa família pela população na busca da cura e tratamento de diversos males.
Figura 3. Algumas substâncias isoladas de espécies da família Annonaceae MeO O O H H OMe OMe O HO OH OH OH O O O HO OH OH CH3
Quercetina 3-α-raminosídeo
(Flavonóide glicosilado) (SILVA et al., 2009)
Ácido ent-caur-16-en-19 óico
(Diterpeno) (ANDRADE, 2004)
Xymarginatin
(Acetogenina)
(COLMAN-SAIZARBITORIA et al., 2009)
Discretamina
(Alcalóide) (ALMEIDA et al., 2007)
(+)- epimembrina
(Lignóide)
(ESTRADA-REYES et al., 2007)
132 (S)-hidroxi-173-etoxifeoforbídeo
(Feoforbídeo) (SILVA et al., 2009)
(CH2)12
O
(CH2)5
O O COOH N NH N HN O O H H3C
CH3
CH3
CH3
H3C
O C HO
OCH3
O H3C
3.2. Considerações sobre o gênero Anaxagorea A.St.-Hil.
O gênero Anaxagorea possui cerca de 26 espécies distribuídas na América Central e América do Sul (Figura 4). No Brasil são encontradas poucas espécies deste gênero e sua grande maioria está localizada na Floresta Amazônica (MAAS ;WESTRA,1985).
Em relação aos aspectos botânicos, as espécies deste gênero se apresentam como árvores, arvoretas ou arbustos. Tricomas simples ou estrelados, microscópicos. Flor ou em inflorescência, axilar ou raramente terminal, monoclina; sépalas três, raramente , livres ou conatas na base, valvares ou imbricadas; pétalas seis, raramente , livres, valvares, as internas menores; estames numerosos; anteras não septadas transversalmente, estaminódios presentes; conectivo dilatado, plano; carpelos poucos a numerosos, óvulos dois, sub-basais. Fruto apocárpico, carpídios claviformes, explosivamente deiscentes; sementes duas, sem arilo, lustrosas (LOBÃO et al., 2005).
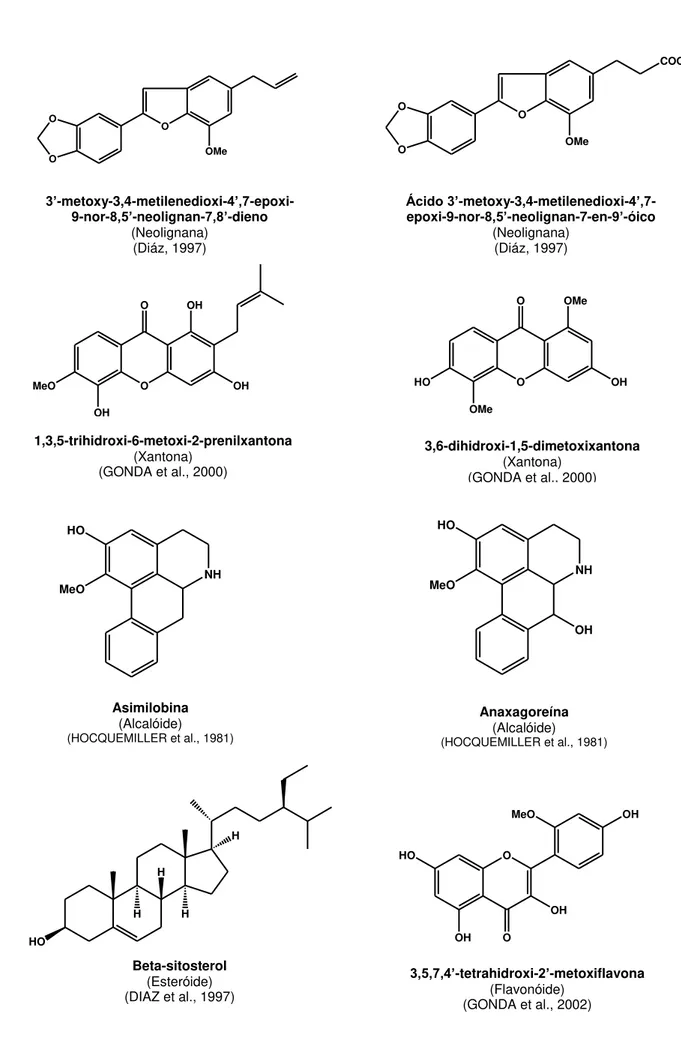
Das 26 espécies deste gênero, somente 5 foram investigadas fitoquimicamente, de onde foram isolados lignóides, flavonóides, xantonas, esteróides e alcalóides aporfínicos. Todos os compostos químicos isolados de espécies deste gênero estão sumarizados no Quadro 1 (Pág. 33). A Figura 5 (pág.34) mostra as estruturas de alguns compostos isolados de espécies deste gênero.
Figura 4. Mapa de distribuição geográfica do gênero Anaxagorea, representado em verde. (Adaptado
Quadro 1: Constituintes químicos de espécies do gênero Anaxagorea Classe do
composto Substância isolada Espécie vegetal Referência
Alcalóide
Asimilobina A.dolichocarpa HOCQUEMILLER et al., 1981
A.prinoides HOCQUEMILLER et al., 1981
Anaxagoreína A.dolichocarpa HOCQUEMILLER et al., 1981
A.prinoides HOCQUEMILLER et al., 1981
Poliprenóide Anaxagorea poliprenol 70 A.brevipes SASAK & CHOJNACKI, 1973
Lignóides
3’-metoxi-3,4-metilenedioxi-4’,7
-epoxi-9-nor-8,5’- neolignan-7,8’-dieno
A.clavata DIAZ, 1997
Ácido 3’-metoxy-3,4-metilenedioxi-4’,7
-epoxi-9-nor-8,5’-neolignan-7-en-9’-óico A.clavata DIAZ, 1997
Xantona
Gentiseina A.luzonensis GONDA et al., 2000
1-3-5-6-tetrahidroxixantona A.luzonensis GONDA et al., 2001
1-3-5-trihidroxi-2-prenilxantona A.luzonensis GONDA et al., 2000
1-3-5-trihidroxi-4-(3-hidroxi-3-methil-butilxantona A.luzonensis GONDA et al., 2000
1-3-5-trihidroxi-4-prenilxantona A.luzonensis GONDA et al., 2000
1-3-5-trihidroxi-6-metoxi-2-prenilxantona A.luzonensis
GONDA et al., 2000
1-3-5-trihidroxixantona A.luzonensis GONDA et al., 2000
1-3-6-7-tetrahidroxixantona A.luzonensis
GONDA et al., 2001
1-3-6-trihidroxi-4-prenilxantona A.luzonensis GONDA et al., 2000
1-3-6-trihidroxi-5-metoxi-4-prenilxantona A.luzonensis
GONDA et al., 2000
1-3-6-trihidroxi-5-metoxixantona A.luzonensis
GONDA et al., 2000
3-5-6-trihidroxi-1-metoxixantona A.luzonensis
GONDA et al., 2001
3-5-dihidroxi-1-metoxixantona A.luzonensis
GONDA et al., 2000
3-6-dihidroxi-1-5-dimetoxixantona A.luzonensis GONDA et al., 2000
3-7-dihidroxi-1-metoxixantona: 6-O-
-D-glucosídeo A.luzonensis GONDA et al., 2002
5-6-dihidroxi-1-methoxixantona:3-O- -D-glucosídeo
A.luzonensis
GONDA et al., 2002
Esteróide β-sitosterol A.clavata DIAZ et al., 1997
Flavonóide
Astragalina A.luzonensis GONDA et al., 2000
Biochanina A A.luzonensis GONDA et al., 2000
Crisina A.luzonensis GONDA et al., 2000
Kaempferol A.luzonensis GONDA et al., 2002
Orobol A.luzonensis GONDA et al., 2000
Taxifolina A.luzonensis GONDA et al., 2000
Quercetina A.luzonensis GONDA et al., 2000
Quercimeritina A.luzonensis GONDA et al., 2002
Gancaonina P A.luzonensis GONDA et al., 2001
3-4’-5-7-tetrahidroxi-2’-metoxi-flavona A.luzonensis GONDA et al., 2002
Kaempferol-3-7-di-O--D-glicosídeo A.luzonensis GONDA et al., 2002
Naringenina-8-iso-pentenil A.luzonensis KITAOKA et al., 1998
Orobol-3’-metil A.luzonensis GONDA et al., 2000
Figura 5. Estrutura química de algumas substâncias isoladas de espécies do gênero Anaxagorea. HO H H H H NH HO MeO OH O HO OMe OH O OMe NH HO MeO O O O COOH OMe O MeO OH OH O OH O O OH HO MeO OH OH O O O OMe
3’-metoxy-3,4-metilenedioxi-4’,7 -epoxi-9-nor-8,5’-neolignan-7,8’-dieno
(Neolignana) (Diáz, 1997)
Ácido 3’-metoxy-3,4-metilenedioxi-4’,7 -epoxi-9-nor-8,5’-neolignan-7-en-9’-óico
(Neolignana) (Diáz, 1997)
1,3,5-trihidroxi-6-metoxi-2-prenilxantona
(Xantona) (GONDA et al., 2000)
3,6-dihidroxi-1,5-dimetoxixantona
(Xantona) (GONDA et al., 2000)
Asimilobina
(Alcalóide) (HOCQUEMILLER et al., 1981)
Anaxagoreína
(Alcalóide) (HOCQUEMILLER et al., 1981)
Beta-sitosterol
(Esteróide) (DIAZ et al., 1997)
3,5,7,4’-tetrahidroxi-2’-metoxiflavona
3.3. Considerações sobre Anaxagorea dolichocarpa Sprague & Sandwith
Anaxagorea dolichocarpa é a espécie neotropical de Annonaceae mais comum e bem distribuída (Figura 6). Pode ser encontrada da Costa Rica até a Bolívia e, no Brasil, nos estados do Amapá, Amazonas, Acre, Rondônia, Goiás, Maranhão, Paraíba, Pernambuco, Bahia e Rio de Janeiro, habitando florestas úmidas, ocorrendo isoladamente ou em grupo de até seis indivíduos. Na Paraíba pode ser encontrada em remanescentes de mata atlântica, principalmente nos municípios de Santa Rita, Mamanguape e Sapé (Figura 7) (MAAS; WESTRA ,1985; PONTES et al. 2004; LOBÃO et al., 2005).
Figura 6. Mapa de distribuição geográfica da espécie Anaxagorea dolichocarpa, representado em
verde. (Adaptado de: http://www.tropicos.org/MapsCountry.aspx?maptype=4&lookupid=1601465, Acesso em: 26 de Janeiro de 2011)
Figura 7. Mapa de distribuição geográfica da espécie Anaxagorea dolichocarpa (●) na Paraíba.
(Adaptada de PONTES et al., 2004).
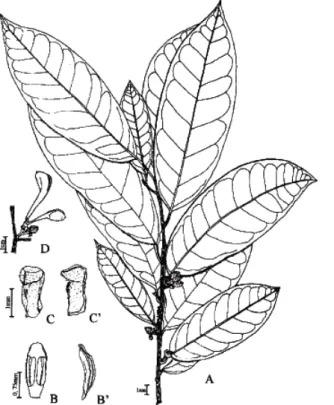
Pontes et al., (2004) descreve botanicamente os indivíduos da espécie como sendo(Figura 8):
Árvores. Ramos acinzentados, tricomas submicroscópicos, estrelados, ferrugíneos, na extremidade dos ramos jovens, glabrescentes quando maduros. Folhas com pecíolo sulcado, retorcido, 1,5-2,5 cm, tricomas esparsos, submicroscópicos, estrelados, ferrugíneo quando jovem, glabrescente quando maduro; lâmina oblongo-lanceolada ou oblonga, 20-23×6,5-10 cm, cartácea, base aguda a obtusa, ápice acuminado, 11-13 pares de nervuras secundárias, glabra na face ventral, tricomas esparsos, estrelados, ferrugíneos, na face dorsal, principalmente na base e na nervura principal. Flores solitárias, axilares, ou inflorescências com 2-4 flores. Flor ca. de 2×1,5 cm; pedicelo 0,5-1 cm compr., indumento denso, tricomas simples, curtos, hialinos. Sépalas livres, oblongas a ovadas, ca. de 1×0,5 cm, indumento esparso no ápice e nas margens da face interna, tricomas simples, indumento denso na face externa, principalmente na base, tricomas estrelados, ferrugíneos. Pétalas 6, livres, carnosas; pétalas externas
oblongas, ca. 1,5×1 cm, tricomas densos, estrelados, em ambas as faces, principalmente na região mediana da face externa; pétalas internas lanceoladas, côncavas da região mediana a região basal da pétala, ca. 1,5×0,5 cm, tricomas estrelados, ferrugíneos, na região mediana, no ápice e nas margens. Estames laminares, ca. 0,5 cm compr., glabros; estaminódios presentes entre os carpelos e os estames, ca. 0,5 cm compr. Carpelos numerosos, angulosos, ca. 0,3 cm compr., pubescentes, 2 óvulos basais, estigma papiloso. Fruto apocárpico; carpídios com deiscência explosiva, ca. 5 cm compr., clavados, estipitados, com tricomas estrelados, esparsos; estipe 2-3 cm compr., espessado. Sementes 2 por carpídio, ca. 2×1 cm, sem arilo, pretas, nítidas, glabras. (Pontes et al., 2004).
Figura 8.Anaxagorea dolichocarpa. A) Ramo com flor e botões florais. B) Estames, vista ventral.
Anaxagorea dolichocarpa é conhecida popularmente pelos nomes: “envira -de-jacú”, maraúba-grande, senzala ou mium-açu (Figuras 9) (ANDRADE et al., 2007). As cascas do seu caule são utilizadas na Colômbia e Equador como ingrediente para curare, na Guiana é utilizada para a limpeza dos dentes e no Suriname utilizada para a fabricação de cestos. Na medicina popular, suas folhas e cascas do caule são utilizadas para tratamento de cefaleias (MAAS; WESTRA, 1985).
Figura 9.Anaxagorea dolichocarpa Sprague & Sandwith. (9a) Folhas e frutos, (9b) Frutos, (9c) Caule
e Frutos e (9d) Flor.
Do ponto de vista químico, os únicos trabalhos envolvendo está espécie reportam o isolamento de dois alcalóides aporfínicos (Anaxagoreína e Asimilobina) das cascas do caule (HOCQUEMILLER et al., 1981) e a caracterização do óleo essencial dos frutos (ANDRADE et al., 2007). Um único estudo farmacológico foi realizado até agora e reporta a atividade antimicrobiana contra Staphylococus aureus (CHIAPPETA; MELLO, 1984).
9a 9b
9c 9d
3.4. Alcalóides de Annonaceae
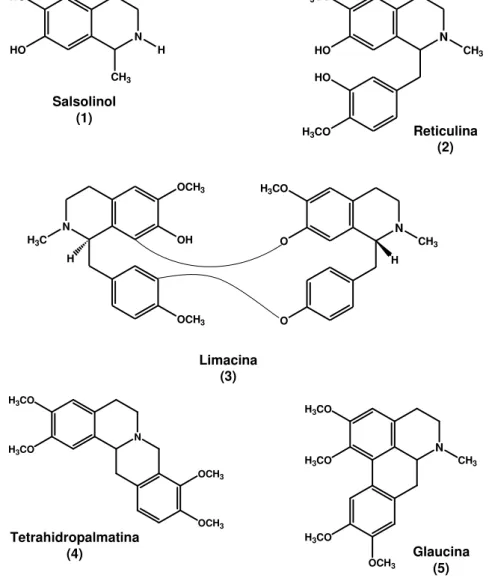
Segundo Leboeuf et al. (1982), os alcalóides, compostos nitrogenados em sua maioria farmacologicamente ativos, são os principais constituintes químicos das espécies pertencentes à família Annonaceae. Essa classe de metabólitos detém grande importância dentro da família Annonaceae, pois substâncias possuindo diversos tipos de esqueletos já foram isoladas. Os alcalóides mais comumente encontrados nesta família são do tipo isoquinolínico, tais como os isoquinolínicos simples (1), benziltetrahidroquinolínicos (2), bisbenzilisoquinolínicos (3), tetrahidroprotoberberínicos (4) e aporfinóides (5) (Figura 10). Dentre esses, os aporfinóides são os mais encontrados em espécies desta família (CAVÉ et al., 1987).
Figura 10. Tipos de alcalóides isoquinolínicos encontrados em espécies da família Annonaceae.
Salsolinol (1) N H CH3 HO HO Reticulina (2) N CH3 HO H3CO
H3CO
HO
N H3C
OCH3 OH OCH3 N CH3 O H3CO
O H H Limacina (3) N CH3 H3CO H3CO
H3CO
OCH3 Glaucina (5)
N
OCH3
H3CO H3CO
OCH3
3.4.1. Alcalóides Aporfínicos
Os alcalóides aporfinóides incluem os aporfínicos propriamente ditos e os alcalóides biogeneticamente relacionados, como os proaporfínicos, oxoaporfínicos e também os fenantrenos (STÉVIGNY et al., 2005). Quimicamente falando, os aporfínicos são bases tetracíclicas formadas por ligação direta dos anéis aromáticos A e D dos núcleos benzilisoquinolínicos típicos (1). O átomo de nitrogênio na posição 6 é normalmente terciário na forma básica mas, pode também ser quaternário, menos frequentemente acetilado ou formilado. Compostos N-óxidos também foram descritos. O alcalóide é chamado noraporfínico quando o nitrogênio é secundário. Nos aporfínicos naturais, as posições 1 e 2 são normalmente substituídas por grupos hidroxila, metoxila ou metilenodioxílico. Para os alcalóides azafenantrenos (2) a posição 1 é ocupada por outro átomo de nitrogênio. O núcleo tetracíclico pode ser substituído em diferentes locais, nas posições 9, 10 e 11 e menos frequentemente nas posições 3 e 8, e em uns poucos casos, a posição 7 (ou 4) é oxigenada. No caso dos alcalóides azafenantrenos, quando a posição 7 é ocupada por uma carbonila, esses são chamados de azaoxoaporfínicos (3). Os aporfínicos são opticamente ativos, possuindo tanto a configuração absoluta R-(-) ou S-(+), dependendo da estereoquímica do carbono 6a (STÉVIGNY et al., 2005).
NR A B C 1 2 3 4 5 7 8 9 10 11 D (2)
N A B NR
C 2 3 4 5 7 8 9 10 11 D
N A B NR
C 2 3 4 5 8 9 10 11 D O
3.4.1.1. Biossíntese dos alcalóides aporfínicos
Os alcalóides aporfínicos se originam principalmente a partir da rota biossintética que tem como precursor o aminoácido L-tirosina (DEWICK, 2002). Os alcalóides pertencentes a este grupo têm estruturas onde é possível identificar uma subunidade proveniente do aminoácido tirosina e, em muitos casos outras subunidades provenientes da degradação parcial deste mesmo aminoácido.
A biossíntese envolve a descarboxilação da L-tirosina formando-se a tiramina. Esta amina sofre hidroxilação, originando a dopamina. Posterior transaminação da L-tirosina dá origem ao Ácido 4-hidroxifenil pirúvico, que por sua vez sofre uma descarboxilação, transformando-se no 4-hidroxifenil acetaldeído. A condensação do resultado dessas duas etapas pela reação tipo Mannich, dá origem aos alcalóides benzilisoquinolínicos.
O produto da reação do tipo Mannich é então o alcalóide triidroxilado norcoclaurina, formado estereoespecificamente como o enantiômero – (S). O passo da O-metilação da (S)-norcoclaurina fornece a (S)-coclaurina que, posteriormente por N-metilação, fornece a (S)-N-metilcoclaurina. Após estas etapas, o anel benzílico é hidroxilado formando o modelo de substituição tetraidroxílico (DEWICK, 2002).
A (S)-reticulina também é citada como precursora da maioria dos alcalóides isoquinolínicos. Esse processo se dá pelo acoplamento oxidativo intramolecular direto da (S)-reticulina, orto ao grupo fenólico no tetraidroisoquinolínico e para ao fenol do substituinte benzílico ou através de acoplamento oxidativo intramolecular
Figura 11. Esquema sucinto da biossíntese de alcalóides aporfínicos (DEWICK, 2002).
OH NH2
HO
O
L - tirosina
NH2 HO NH2 HO HO HO
O CO2H
CHO HO 4-hidroxifenil acetaldeído Ácido 4-hidroxifenil pirúvico Dopamina Tiramina Reação tipo Mannich NH HO HO HO H
(S) - norcoclaurina
(S) - coclaurina (S) –N- metilcoclaurina
(S) – Hidroxi- N- metilcoclaurina
Metilação O2
ascorbato
- CO2
PLP
O
- CO2
Metilação
NH
HO HO H3CO
H NCH3
HO HO H3CO
H NCH3 HO HO H3CO H HO NCH3 H3CO HO H3CO
H HO
(S) – reticulina
NH
Alcalóides Aporfínicos
Acoplamento oxidativo
O NCH3
H3CO
H3CO
N OCH3 N O O CH3
A biossíntese dos alcalóides aporfínicos azafenantrenos, esquematizada abaixo (Figura 12), tem origem a partir do precursor dihidroxioxoaporfina, com a clivagem oxidativa do anel A e formação do ácido keto e posteriormente o ácido azaantraquinona. A formação do anel piridona e posterior desoxigenação leva à formação do azaoxoaporfínico sampangina, intermediário dos alcalóides eupolauramina e imbilina 1 (TAYLOR, 1984).
Figura 12. Esquema da biossíntese de alcalóides azafenantrenos (TAYLOR, 1984).
N O
O HO2CCOH2C
N O HN O N O N N O N O O OCH3 N N O CH3 N O HO HO N O O HO
CO2H
N O
O HO2CH2C
N NH
O HO2CH2C
N
O N
O
Imbilina 1 Eupolauramina
Sampangina
Dihidroxioxoaporfina Ácido Keto
Ácido Azaantraquinona
A B
C
4. PARTE EXPERIMENTAL
4.1. Estudo fitoquímico
4.1.1. Coleta e identificação do material botânico
As cascas do caule da espécie vegetal Anaxagorea dolichocarpa foram coletadas no mês de fevereiro de 2006, no município de Santa Rita, estado da Paraíba. A identificação botânica do material vegetal foi realizada pela Profª.Dra. Maria de Fátima Agra, do Laboratório de Tecnologia Farmacêutica da Universidade Federal da Paraíba (LTF/UFPB). Uma exsicata desta espécie encontra-se depositada no Herbário Prof. Lauro Pires Xavier (JPB), do Centro de Ciências Exatas e da Natureza (CCEN / UFPB) sob o código AGRA & GÓES 5543.
4.1.2. Métodos de análise
4.1.2.1. Métodos cromatográficos
Para a cromatografia de adsorção em coluna (CC) foi utilizada sílica gel 60, ART 7734 da MERCK, com granulometria entre 0,063 – 0,200 mm e 0,04 – 0,063 mm, tendo como suporte, colunas de vidro cilíndricas, cujo comprimento e as dimensões variam de acordo com a quantidade de amostra a ser cromatografada.
Para análise e purificação das frações obtidas por CC, foram empregadas cromatografia em camada delgada analítica (CCDA) e preparativa (CCDP), que foram feitas utilizando-se sílica gel 60 PF254 ART 7749 da MERCK, nas espessuras
de 0,25 e 1,0 mm, respectivamente, suspensa em água destilada (1:2), distribuídas sobre placas de vidro com ajuda de um espalhador mecânico tipo quick fit, seguindo técnica descrita por Matos (1997). As cromatoplacas obtidas foram secas ao ar livre e ativadas em estufa a 110°C, durante duas horas.
Como eluentes foram utilizados hexano, clorofórmio, metanol e acetonitrila, puros ou em misturas binárias, seguindo uma ordem de polaridade crescente. Os solventes empregados foram destilados no LTF/UFPB.
de onda (254 e 366 nm) por meio de aparelho MINERALIGHT, modelo UVGL-58, pela pulverização com o reagente Dragendorff (Tetraiodobismutato de potássio), ou ainda, pela saturação em câmara de iodo.
Através da observação de CCDA as frações semelhantes foram reunidas de acordo com os fatores de retenção (Rf). O grau de pureza foi determinado quando observada uma única mancha após revelação, em pelo menos três tipos de sistemas de eluição diferentes, e análise dos espectros de RMN 1H e 13C das substâncias isoladas.
A recuperação das amostras separadas por CCDP foi feita por extração com clorofórmio:metanol (7:3 v/v), seguida de filtração sob pressão reduzida e concentração em rotaevaporador.
4.1.2.2. Métodos espectrométricos
4.1.2.2.1. Espectroscopia de infravermelho
Os espectros na região do infravermelho (4000 a 400 cm-1), foram registrados
em espectrofotômetro de marca BOMEM FT-IR (modelo MB 100), do Laboratório de Tecnologia Farmacêutica, com frequência medida em cm-1, obtidos em pastilha de
KBr, utilizando-se 1 a 3 mg da amostra.
4.1.2.2.2 Espectroscopia de Ressonância Magnética Nuclear
Os espectros de Ressonância Magnética Nuclear de 1H e 13C, uni e bidimensionais, foram obtidos em espectrômetro da marca VARIAN-NMR-SYSTEM 500 MHz , do Laboratório Multiusuário de Caracterização e Análise –LMCA, Central Analítica da UFPB. As amostras para análise foram preparadas dissolvendo-se as mesmas em solventes deuterados da marca Cambridge Isotope Laboratories: Clorofórmio deuterado (CDCl3).
Para os espectros de RMN de 13C, os deslocamentos químicos foram
referenciados pelos sinais dos carbonos do solvente deuterado: CDCl3 (77,0 ppm).
As multiplicidades no espectro de RMN 1H foram indicadas segundo as convenções: s (simpleto), d (dupleto), dd (duplo dupleto), ddd (duplo duplo dupleto) e m (multipleto).
Os espectros de RMN foram otimizados para as técnicas bidimensionais: HMQC, espectro de correlação heteronuclear, que permite fazer uma correlação entre hidrogênios e seus respectivos carbonos; HMBC que permite fazer uma correlação entre hidrogênios e carbonos a duas (2J) e três (3J) ligações; COSY, estabelece as correlacões entre hidrogênios que são responsáveis, entre si, pelo desdobramento do sinal, e assim discernir a multiplicidade dos sinais observados no espectro de RMN 1H; e NOESY, técnica homonuclear que mostra correlações espaciais dos hidrogênios da molécula (KAISER, 2000).
4.1.2.2.3. Espectrometria de Massas
Os espectros de massas das substâncias foram obtidos em modo de íons positivos pela técnica de Ionização por Eletrospray (+) utilizando um espectrômetro de massas de alta resolução (Bruker, Microtof II) acoplado a Cromatógrafo Líquido (Shimadzu Série 20AD (SPD-M20A; controladora: CBM-20; Bomba: LC-20AD (2); Degasificador: DGU-14A), doLaboratório Multiusuário de Caracterização e Análise –
LMCA,UFPB.
4.1.2.2.4. Ponto de Fusão
4.1.3. Processamento das cascas do caule de Anaxagorea dolichocarpa Sprague & Sandwith
As cascas do caule de Anaxagorea dolichocarpa foram secas em estufa com ar circulante à temperatura média de 45 °C durante quatro dias. Após a secagem, o material vegetal foi submetido a um processo de pulverização em moinho mecânico, obtendo-se 2000 g de pó seco.
4.1.4. Obtenção do extrato etanólico bruto (EEB) das cascas do caule de
Anaxagorea dolichocarpa Sprague & Sandwith
O material vegetal seco e pulverizado (2000 g) foi submetida à maceração exaustiva com etanol (EtOH) a 95% em um recipiente de aço inoxidável, durante 72 horas. Este processo foi repetido por três vezes, obtendo-se o extrato etanólico bruto contendo os constituintes químicos da planta.
A solução extrativa resultante da maceração foi concentrada em rotaevaporador sob pressão reduzida, a uma temperatura média de 45 ° C, sendo obtido 64,0 g de extrato etanólico bruto (EEB), 3,2% em relação ao peso seco da planta.
4.1.5. Particionamento do extrato etanólico bruto (EEB) de Anaxagorea
dolichocarpa Sprague & Sandwith
Uma parte do extrato etanólico bruto (60,0 g) foi suspenso em uma solução de Metanol/Água (7:3 v/v) e homogeneizado sob agitação mecânica durante aproximadamente 60 minutos. Desse processo resultou uma solução hidroalcoólica que foi submetida a uma partição líquido/líquido, em uma ampola de separação, sob agitação manual utilizando consecutivamente solventes de polaridades crescentes, obtendo-se as fases: hexânica, clorofórmica e acetato de etila. As soluções obtidas no processo de partição foram tratadas com Na2SO4 anidro ,para retirada do
Esquema 1. Obtenção e particionamento do extrato etanólico bruto de Anaxagorea dolichocarpa
Sprague & Sandwith
* Descartada
** Reservada para estudos posteriores
Material botânico seco e pulverizado (2000 kg)
Fase Hexânica (11,0 g)
Fase Clorofórmica (14,0 g)
Fase Acetato de Etila (20,0 g)**
- Maceração com etanol a 95 % (três vezes); - Concentração em evaporador rotativo.
Extrato Etanólico Bruto (60,0 g)
Solução Hidroalcoólica
- Dissolução em MeOH:H2O (7:3 v/v);
- Agitação mecânica por 60 minutos.
- Partição em ampola de separação com hexano (três vezes de 500 mL).
Solução Hidroalcoólica I
- Partição em ampola de
separação com CHCl3 (três
vezes de 500 mL).
- Secagem com sulfato de sódio anidro; - Filtração sob pressão reduzida; - Concentração em evaporador rotativo.
- Secagem com sulfato de sódio anidro; - Filtração sob pressão reduzida; - Concentração em evaporador rotativo.
Solução Hidroalcoólica II
- Secagem com sulfato de sódio anidro; - Filtração sob pressão reduzida; - Concentração em evaporador rotativo.
- Partição em ampola de separação com AcOEt (três vezes de 500 mL).
4.1.6. Fracionamento cromatográfico da fase hexânica do EEB das cascas do caule de Anaxagorea dolichocarpa Sprague & Sandwith
A fase hexânica (5,0 g) foi submetida a uma coluna cromatográfica (CC), utilizando-se como fase estacionária sílica gel 60 (Artigo 7734 MERCK - 0,063 – 0,200 mm), e como eluentes hexano, clorofórmio e metanol, puros ou em misturas binárias, obedecendo um grau crescente de polaridade. Foram coletadas 277 frações de 125 mL, que foram concentradas individualmente em rotaevaporador. (Quadro 2, pág. 50; Esquema 2, pág. 51).
As frações foram analisadas através de cromatografia em camada delgada analítica (CCDA), utilizando diferentes sistemas de eluição e reunidas, quando semelhantes e de acordo com seus fatores de retenção (Rfs), após visualização na
Quadro 2. Sistemas de eluições utilizados no fracionamento cromatográfico da fase hexânica do extrato etanólico bruto de Anaxagorea dolichocarpa Sprague & Sandwith.
Sistema de eluição Frações coletadas Frações reunidas
Hex (100 %) 1 a 11 1-33
34-40 41-47
Hex : CHCl3 (80:20) 12 a 31
Hex : CHCl3 (70:30) 32 a 47
Hex : CHCl3 (50:50) 48 a 62
48-59 60-73 74-80 81-89 90-103 104-120
Hex : CHCl3 (30:70) 63 a 107
Hex : CHCl3 (20:80) 108 a 123
CHCl3 (100 %) 124 a 190
121-134
135-148
149-160 161-170 171-190
CHCl3 : MeOH (99,5:0,5) 191 a 203
191-197
198-205
CHCl3 : MeOH (99:1) 204 a 220
206-215 216-220
CHCl3 : MeOH (97:3) 221 a 251
221-226 227-236 237-251
CHCl3 : MeOH (95:5) 252 a 269
252-277
A fração 135-148 foi submetida à cromatografia em camada delgada preparativa (CCDP), utilizando clorofórmio(100%) para eluição, resultando em duas subfrações. A subfração 135-148.1 apresentou-se como cristais amarelos, que após análise por CCDA, recebeu o código Ad-2 e foi encaminhada para análise espectral. (Esquema 2).
Esquema 2. Fracionamento cromatográfico da fase hexânica do extrato etanólico bruto de
Anaxagorea dolichocarpa Sprague & Sandwith.
A fração 198-205 também foi submetida à cromatografia em camada delgada preparativa (CCDP), utilizando clorofórmio e metanol (99:1) como eluentes, obtendo-se três subfrações. A subfração 198-205.1, apreobtendo-sentou-obtendo-se na forma de cristais vermelhos, que após análise em CCDA, foi codificada como Ad-3 e encaminhada para análise espectral (Esquema 2).
- CC (sílica gel 60);
- Hex / Hex: CHCl3 / CHCl3:MeOH
(em gradiente crescente de polaridade)
Fase Hexânica (5,0 g)
277 Frações
- CCDP; - CHCl3 (100 %)
- CCDA
22 Grupos
- CCDA
198-205
- CCDA
135-148
- CCDP;
- CHCl3 : MeOH (99:1)
- CCDA
4.1.7. Fracionamento cromatográfico da fase clorofórmica do EEB das cascas do caule de Anaxagorea dolichocarpa Sprague & Sandwith
Para o fracionamento cromatográfico da fase clorofórmica, 10 g desta fase foi submetida à cromatografia em coluna, utilizando-se como fase estacionária sílica gel 60 (Artigo 7734 MERCK - 0,063 – 0,200 mm), e como eluentes hexano, clorofórmio e metanol, puros ou em misturas binárias, em gradiente crescente de polaridade. Foram obtidas 183 frações de 125 mL, que foram concentradas em rotaevaporador e reunidas por CCDA, de acordo com seus fatores de retenção (Rfs) em 23 grupos (Quadro 3, pág. 53).
A fração 12-24 foi submetida à cromatografia líquida de média pressão (CLMP), utilizando Aparelho de Sistema binário de separação flash da Bushi, equipado com dois módulos de bombas (C-601 e C-605), módulo controlador (C- 615) e coluna (45 x 3,5 cm) empacotada com sílica gel 60 (Artigo 7734 MERCK - 0,04 – 0,063 mm), com um fluxo de 10 mL/min. Foram coletadas 45 frações, que foram concentradas em rotaevaporador e reunidas por CCDA, de acordo com seus Rfs em 12 grupos.
Quadro 3. Sistemas de eluições utilizados no fracionamento cromatográfico da fase clorofórmica do extrato etanólico bruto de Anaxagorea dolichocarpa Sprague & Sandwith
Sistema de eluição Frações coletadas Frações reunidas
Hex (100 %) 1 a 5 1
2-6
Hex : CHCl3 (50:50) 6 a 12
7-9 10-11
CHCl3 (100 %) 13 a 48
12-24
25-39 40-51
CHCl3 : MeOH (99,5:0,5) 49 a 55 52-55
CHCl3 : MeOH (99:1) 56 a 65
56-59 60-68 69-70 71-72 73-74 75-91 92-109
CHCl3 : MeOH (97:3) 66 a 109
CHCl3 : MeOH (96:4) 110 a 132
110-116 117-120
CHCl3 : MeOH (95:5) 133 a 145
121-130 131-145
CHCl3 : MeOH (93:7) 146 a 159 146-161
CHCl3 : MeOH (91:9) 160 a 183
Esquema 3. Fracionamento cromatográfico da fase clorofórmica do extrato etanólico bruto de
Anaxagorea dolichocarpa Sprague & Sandwith.
- CC (sílica gel 60);
- Hex / Hex: CHCl3 / CHCl3:MeOH
(em gradiente crescente de polaridade)
183 Frações
23 Grupos
- CCDA
- CCDA
Fase Clorofórmica (14,0 g)
12-24
45 Frações
Ad-1 (32,7 mg)
- CCDA
- CLMP (sílica gel 60);
- Hex / Hex:CHCl3 / CHCl3 / CHCl3:MeOH
(em gradiente crescente de polaridade)
12-24/16
- CCDA
12 Grupos
- CCDP
- CH2Cl2:MeCN (97:3)